ARTÍCULO DE REVISIÓN
NOVAES, Michele Franciene Baú [1]
NOVAES, Michele Franciene Baú. Evaluación de las normas reglamentarias sobre etiquetado y envasado de productos farmacéuticos. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 06, Vol. 01, págs. 44-64. Junio de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/normas-reguladoras
RESUMEN
La Agencia Nacional de Vigilancia Sanitaria (ANVISA) tiene como objetivo promover la salud de la población a través de la regulación de la producción y comercialización de productos y servicios sujetos a vigilancia sanitaria, incluidos los productos farmacéuticos. Las normas reglamentarias guían los parámetros de calidad que deben seguirse en la cadena de producción en la industria farmacéutica. Esta investigación buscó recopilar datos bibliográficos para aclarar y hacer que la información pública a los profesionales de la salud, el sector farmacéutico, las autoridades representativas vinculadas al Ministerio de Salud, ANVISA y la población brasileña, en general, sobre la importancia de discutir y actualizar la legislación brasileña sobre etiquetado y envasado de productos farmacéuticos, identificando y demostrando datos que indiquen posibles equivalencias entre ellos que puedan dar lugar a errores de medicación , lo que puede ocurrir a cambio. También se pretende verificar con las normas sanitarias vigentes cuáles son la información obligatoria que se debe insertar en las etiquetas, relevante para la seguridad del usuario, y discutir sobre posibles reacciones adversas relacionadas con el excipiente de lactosa, ampliamente utilizado por la industria farmacéutica. Para seleccionar el marco teórico, utilizamos las bases de datos de los sitios Scielo.br, VHL (Biblioteca Virtual de Salud), búsquedas en sitios web, revistas científicas y artículos en revistas de salud, donde usamos las palabras de búsqueda por sí solas: etiquetado, embalaje, legislación, lactosa, y búsqueda combinada de dos o tres palabras: etiquetas de medicamentos-errores, errores de medicamentos de farmacovigilancia, etiquetado-envase-legislación, etiquetas-envase-lactosa. Las obras que no combinaron ninguna de las tres palabras fueron excluidas, así como las que no encajaron en los años preseleccionados de 2000 a 2019. El criterio de exclusión también se aplica a los artículos que, tras la lectura, no se referían al objetivo principal de la investigación. Había una falta de normas específicas para asegurar la diferenciación de envases similares para evitar errores de medicación, como también se observó la falta de normas para discriminar la presencia de lactosa en las etiquetas de los medicamentos. La publicación de legislación para promover la diferenciación de envases y la normalización de la información específica en las etiquetas es fundamental para promover el uso racional de los medicamentos.
Palabras clave: Etiquetado de medicamentos, empaque, errores de medicación. Legislación, lactosa.
1. INTRODUCCIÓN
La Agencia Nacional de Vigilancia Sanitaria (ANVISA) tiene como objetivo promover la salud de la población mediante el seguimiento de la producción y comercialización de productos y servicios sometidos a vigilancia sanitaria, incluidos los productos farmacéuticos, mediante la inspección, estandarización de los procedimientos y procesos a seguir para garantizar la calidad y seguridad en el uso de estos productos (BRASIL, 1999).
La cadena de producción industrial de productos farmacéuticos abarca una serie de procedimientos secuenciales destinados a garantizar la calidad, desde estudios de pre-formulación hasta el desarrollo de etiquetado y material de embalaje adecuado.
La calidad de un producto farmacéutico debe observarse desde los procesos de producción de los activos hasta la etiqueta y el embalaje, que deben cumplir todos los requisitos legales.
ANVISA RESOLUTION RDC No 71/2009 establece las especificaciones, aspectos y contenidos de que las etiquetas y el embalaje de los medicamentos deben desarrollarse en el Brasil, a fin de facilitar el acceso a la información necesaria sobre estos productos y garantizar el uso racional de los medicamentos (BRASIL, 2009).
El propósito del embalaje es empaquetar, empaquetar, empaquetar, proteger y mantener la seguridad, y proporcionar la correcta conservación del producto farmacéutico, constituyendo un elemento importante en la eficacia y seguridad, además de transmitir la información esencial sobre la administración. En las etiquetas debe incluir el nombre comercial del producto, si hay nombre del ingrediente activo, la forma farmacéutica, la vía de administración, dosificación y cantidad empaquetada en el material de embalaje (BRASIL, 2009).
La Constitución Federal en uno de sus artículos establece que la salud está garantizada a todos y es deber del Estado proporcionarla, a través de políticas socioeconómicas que tienden a reducir la probabilidad de que los ciudadanos desarrollen enfermedades u otras lesiones, y el acceso a acciones y servicios para la promoción y protección de la salud de todos los ciudadanos brasileños (BRASIL, 1988).
El Código de Protección del Consumidor establece que es el derecho del consumidor a garantizar la protección de la vida y una información adecuada y clara sobre los productos y servicios. Los productos desarrollados pueden no conllevar riesgos para la salud o la seguridad de los consumidores, y en el caso específico de los productos producidos en el entorno industrial, el fabricante debe proporcionar toda la información necesaria y ésos deben ir acompañados del producto, especialmente la información relativa a la seguridad de uso (BRASIL, 1990).
En 1998, la Organización Mundial de la Salud publicó el documento “The Role of the Pharmacist in Self-Care and Self-Medication”, un informe del 4o Grupo Asesor de la OMS sobre la función del farmacéutico, documento que también informa de la importancia del acceso a información imparcial y de calidad para orientar el autócía y la automedicación (OMS, 1998).
Los errores en la dispensación y administración de medicamentos se derivan de consecuencias multifactoriales, que tienen diversos orígenes y causas, de errores causados por la dispensación y/o administración incorrecta a los derivados de la automedicación inconsciente de productos que contienen sustancias que pueden generar problemas o problemas de salud de los pacientes (OMS, 1998).
Los datos científicos indican que las etiquetas y envases similares de productos farmacéuticos pueden ser una de las razones responsables de causar errores en la dispensación y administración de medicamentos en hospitales y centros de salud (ANACLETO et al., 2005).
Otras investigaciones muestran que el uso de algunos excipientes en preparaciones farmacéuticas, ampliamente utilizados por las industrias en la fabricación de medicamentos, como la lactosa, puede causar el desarrollo de molestias gastrointestinales en personas con intolerancia a este tipo de carbohidratos, tanto en la población infantil como en adultos al administrar medicamentos que contienen este excipiente en preparación (SENA, 2012; SILVA, 2008).
Situaciones como estas pueden conducir a la hospitalización o aumentar la duración de la estancia de los pacientes hospitalizados, lo que conlleva consecuencias para la salud de las personas y el aumento de los costos gastados para los sistemas de salud públicos y privados.
Podemos considerar los sucesos como los mencionados anteriormente como un problema de salud pública que debe analizarse, y debemos discutir las leyes involucradas en el proceso de etiquetado y envasado de productos farmacéuticos, con el fin de garantizar el derecho a la plena salud y la información accesible y clara para el usuario.
Sobre la base de estos sucesos, esta investigación tiene la intención de evaluar las normas reglamentarias vigentes en Brasil sobre el etiquetado y envasado de productos farmacéuticos, analizar datos epidemiológicos sobre errores de medicación derivados de envases similares, informar de la ocurrencia de reacciones adversas derivadas del uso de medicamentos que contienen el excipiente de lactosa, con el fin de verificar la necesidad de discusión y actualización de la legislación brasileña sobre el tema , para facilitar y garantizar el acceso de la población a la información esencial sobre los medicamentos.
2. ATRIBUCIONES DE ANVISA Y NORMAS REGULATORIAS BRASILEÑAS SOBRE ETIQUETADO Y ENVASADO DE MEDICAMENTOS
La Agencia Nacional de Vigilancia de la Salud, organismo vinculado al Ministerio de Salud y caracterizado por la independencia administrativa, tiene como una de sus atribuciones generales la responsabilidad de la estandarización, control y supervisión de productos, sustancias y servicios relacionados con la salud, actúa en promoción de la salud y desarrolla trabajo en situaciones especiales que ponen en riesgo la salud de la población brasileña (BRASIL, 1999).
Como atribuciones específicas de esta entidad, podemos mencionar el establecimiento de normas para regular el sector de las drogas, tales como la estandarización de los parámetros de calidad para la fabricación; autorizar y cancelar registros de insumos y productos farmacéuticos; desarrollar debates y consultas públicas sobre cuestiones relacionadas con la salud para cambiar o crear nuevas normas como base para las actividades en los ámbitos de la producción y comercialización de medicamentos; y analizar las solicitudes de las industrias farmacéuticas para cambios en etiquetas y envases (BRASIL, 1999).
El desarrollo de la civilización en un mundo globalizado, la aparición de nuevas patologías a investigar por la medicina, y con las mejoras logradas en las últimas décadas en relación con la facilidad de acceso a los medicamentos por parte de la población brasileña, en comparación con décadas anteriores, hubo un aumento en el uso de medicamentos y la búsqueda de mejores terapias para atender nuevas enfermedades de la modernidad.
Como resultado de la demanda de nuevas alternativas terapéuticas más eficaces y modernas, se percibió la necesidad de desarrollar nuevos insumos farmacéuticos, el diseño de fórmulas farmacéuticas y sistemas de administración de medicamentos. Como resultado, ha habido un aumento de las inversiones de las industrias en la investigación y el desarrollo de nuevas moléculas, y como resultado de esto y los intereses económicos del sector, ha habido un aumento considerable en la disponibilidad de drogas.
Las etiquetas y los envases de medicamentos se han convertido no sólo en una parte integral del envasado del producto terminado, sino en la comercialización farmacéutica, una importante oportunidad para el estudio y desarrollo de envases comercialmente atractivos que ayudarían a promover el producto y aumentar las ventas. Luego viene la necesidad de establecer normas sanitarias para el etiquetado de estos productos.
Considerando los criterios para las Buenas Prácticas de Manufactura, que se aplican a todas las etapas de investigación, producción y logística de un producto, y la Política Nacional de Drogas instituida por el Ministerio de Salud en 1998, que tiene como uno de sus principios el incentivo a la producción de medicamentos y su regulación sanitaria, el Organismo Nacional de Vigilancia sanitaria publicó la Resolución RDC No 333/2003 (BRASIL, 2003; BRASIL, 2019).
La Resolución de la Junta Colegiada de ANVISA RDC No 333/2003 fue la primera legislación desarrollada en relación con el etiquetado de medicamentos, estableciendo que todos los envases de medicamentos desarrollados a partir del año siguiente a su publicación deben adaptarse a las normas establecidas por esa resolución (BRASIL, 2003). Posteriormente, esta norma fue derogada por la publicación de la Resolución RDC No 71/2009.
La Resolución RDC No 71/2009 es la norma vigente en el Brasil que regula las características que deben observarse para el desarrollo del etiquetado de medicamentos en el Brasil, a fin de facilitar el acceso a la información y normalizar la información obligatoria que debe ingresarse (BRASIL, 2009).
Las empresas deben notificar la adecuación del etiquetado, cumpliendo con los requisitos establecidos en la resolución, y poner a disposición nuevas etiquetas en el embalaje de los medicamentos producidos o importados para su venta en el mercado en un plazo de 540 días a partir de la fecha de publicación (BRASIL, 2009).
Algunas definiciones se presentan en esta norma para los tipos de etiquetado y su destino de uso, y pueden tener etiquetado diferenciado y con características que permitan ser identificadas como una etiqueta de desarrollo para su uso en productos dispensados en instituciones públicas vinculadas al Ministerio de Salud; comercial, con etiquetado desarrollado para productos con ventas en farmacias y farmacias; y hospital, con material destinado a empaquetar productos de uso restringido para clínicas y hospitales. Los conceptos de etiquetado y diferenciación de tipos de envases también se caracterizan (BRASIL, 2009).
La etiqueta es todo tipo de identificación impresa o grabada en el material de etiquetado que tiene como objetivo identificar información importante en contenedores, contenedores, envoltorios, envoltorios o en el producto en el que se desea identificar (BRASIL, 2009).
El embalaje es todo tipo de forma para el embalaje, con el objetivo principal de la agregación de unidades de un producto, con el objetivo de crear mejores condiciones para mantener la calidad y distribución logística del mismo (BRASIL, 2009).
Cuando se trata de medicamentos, todavía tenemos los conceptos de envase primario y secundario. Según el RDC No 71/2009, el embalaje primario es el que mantiene contacto directo con el producto farmacéutico, mientras que el embalaje secundario es el embalaje externo del producto, que está en contacto con el embalaje primario y puede contener uno o más envases primarios (BRASIL, 2009).
De acuerdo con la legislación mencionada anteriormente, hay información cuya inserción se convierte en obligatoria en el proceso de etiquetado para aclarar las características de la droga.
En las etiquetas secundarias de envases, contendrán: el nombre comercial del medicamento y su nombre genérico de cada ingrediente activo contenido en la formulación, con la concentración de cada uno de ellos; la vía de administración, la forma farmacéutica, con indicación de restricción de uso por grupo de edad, indicando si el producto está destinado a uso adulto o pediátrico; la cantidad total embalada en el material de embalaje, con la indicación de las condiciones de temperatura y almacenamiento; e información sobre los datos de registro del fabricante y del producto (BRASIL, 2009).
También se deben insertar frases de advertencia al usuario en relación con contraindicaciones, precaución y advertencia para el uso de ingredientes activos, clase terapéutica y excipientes, cuando proceda, en envases secundarios. Sin embargo, el RDC No 71/2009 no indica específicamente qué frases de advertencia relativas a los ingredientes activos y excipientes deben incluirse en las etiquetas y envases (BRASIL, 2009).
Con respecto a las etiquetas de embalaje primario, se constató que la misma información obligatoria para los envases secundarios debe insertarse en el embalaje primario y cuando no es posible contener toda esta información en el material de embalaje primario, las industrias deben informar las razones mediante petición electrónica (BRASIL, 2009).
El etiquetado de los medicamentos es el vehículo para comunicar la información del producto al usuario. En este sentido, el organismo regulador brasileño tiene una importante función para analizar y establecer criterios a través de la publicación de nuevos actos normativos para el desarrollo de etiquetas y embalajes adecuados a las necesidades de la población y más eficientes desde el punto de vista de la información.
3. ETIQUETAS Y ENVASES DE MEDICAMENTOS SIMILARES Y ERRORES DE MEDICACIÓN
Los problemas relacionados con la seguridad del paciente implican acciones para prevenir y eliminar los errores involucrados en los procesos de salud. Según el Consejo Nacional de Coordinación de los Estados Unidos para la Notificación y Prevención de Errores de Medicamentos (NCCMERP), el error de medicación se puede definir como:
cualquier evento prevenible que pueda causar o conducir al uso indebido de medicamentos o daño al paciente mientras el medicamento está bajo el control del profesional de la salud, paciente o consumidor. Tales eventos pueden estar relacionados con la práctica profesional, productos de atención médica, procedimientos y sistemas, incluyendo prescripción, comunicación, etiqueta del producto, embalaje, nomenclatura, composición, dispensación, distribución, administración, educación, monitoreo y uso (NCCMERP, 2015).
Según la Organización Mundial de la Salud, los errores de medicación son una de las principales razones de lesiones y daños prevenibles en los sistemas de salud, y pueden ocurrir en diferentes etapas del proceso de uso de medicamentos. En todo el mundo, el costo de los errores relacionados con las drogas se estima en 42.000 millones de dólares EE.UU. al año (OMS, 2017).
La publicación de la Ley No 13.236/2015 culminó con la modificación e inclusión de algunos artículos de la Ley No 6360/1976, para reforzar la necesidad de distinguir las etiquetas y el embalaje de los medicamentos a fin de minimizar la aparición de errores de medicación, incluidos los errores derivados de la dispensación, la administración de medicamentos o el intercambio erróneo para presentar envases similares (BRASIL, 2015).
Las etiquetas y envases de los medicamentos, además de comunicar las características para el reconocimiento y el uso de los mismos, tienen por objeto ser un medio importante para evitar errores. Sin embargo, los datos apuntan a errores de medicación en los que las etiquetas y el embalaje de medicamentos pueden ser la causa de confusión por parte de los profesionales de la salud en los procedimientos realizados en el entorno de trabajo y, en consecuencia, perjudican la salud de los pacientes (ANACLETO et al., 2005).
Los errores de medicación son un problema importante de salud pública y son responsables de la ocurrencia de morbilidad, hospitalizaciones, mortalidad y aumento de los gastos de salud. Según una publicación en 2018 del Instituto de Prácticas Seguras para el Uso de Medicamentos, entre los errores relacionados con los medicamentos, el 33% son causados por etiquetas y envases, y el 31% de ellos han evolucionado a muertes relacionadas (ISMP, 2018).
En 2010 se llevó a cabo un estudio epidemiológico del tipo observacional y transversal en diferentes sectores de la farmacia hospitalaria de un hospital universitario de Fortaleza, Ceará, con el fin de verificar etiquetas y envases de medicamentos, identificando similitudes en los mismos que podrían desencadenar errores de medicación que pudieran producirse en los procesos de almacenamiento, dispensación y administración (LOPES et al., 2012).
Examinamos 300 presentaciones farmacéuticas fotografiadas (150 pares) y presentadas a observadores en días diferentes, y los observadores que participaron en el estudio fueron dos enfermeras y un farmacéutico (LOPES et al., 2012).
Las presentaciones farmacéuticas de la muestra de estudio incluyeron medicamentos de referencia, genéricos, medicamentos similares y medicamentos con envases del Ministerio de Salud. Se analizaron formas y presentaciones farmacéuticas, tipos de envases, nombre, color, diseño, clase farmacológica, proveedores y potencial de riesgo; medicamentos potencialmente peligrosos y medicamentos controlados (LOPES et al., 2012).
Para la selección de muestras, se consideraron medicamentos de referencia, genéricos, medicamentos similares y medicamentos con envases del Ministerio de Salud. En caso de similitudes, los datos se introdujeron en una base de datos y se caracterizaron a partir de referencias internacionales como el Consejo Nacional de Coordinación para la Notificación y Prevención de Errores de Medicamentos (NCCMERP, 2017).
Después de presentar las fotos a los observadores, recoger las respuestas obtenidas por ellos y analizar los datos utilizando métodos estadísticos, los investigadores encontraron los siguientes resultados: con respecto al tipo de medicamento, el 43% de los envases similares eran de medicamentos similares, el 21,33% de los medicamentos de referencia y el 18% de los medicamentos genéricos; y, entre las 24 clases farmacológicas, el 28% eran antimicrobianos, un 10,67% de anestésicos y un 6,67% antihipertensivos (LOPES et al., 2012).
También se encontraron similitudes con respecto a los datos impresos, el diseñador, el color de las etiquetas, el embalaje con el mismo color. Los investigadores lo identificaron; entre la muestra analizada, el 50% de los envases primarios y el 44% de los envases secundarios tenían el mismo color (LOPES et al., 2012).
La investigación de las presentaciones farmacéuticas estudiadas en esta investigación también mostró que, en el total de medicamentos posiblemente similares, el 51,33% eran soluciones parenterales de pequeño volumen, incluyendo ampollas, viales y bolsas de sistema cerrado, lo que demuestra la influencia que el tema del etiquetado y envasado de medicamentos tiene en la capacidad de habilitar errores de medicación (LOPES et al., 2012).
Como una representación del problema de observación presentado en esta investigación, tratamos de identificar, por ejemplo, algunas etiquetas y envases similares de medicamentos. Algunas imágenes fueron encontradas de búsqueda en sitios web.
El Ministerio de Salud en 2016 actualizó el Manual de Identidad Visual del Embalaje de Drogas, que estableció los criterios para el desarrollo e identificación del etiquetado de los medicamentos distribuidos por el Sistema Unificado de Salud.
La Figura 1 muestra los medicamentos inyectables producidos y distribuidos por el Ministerio de Salud para su uso en el SISTEMA DE SALUD UNIFICADO (SUS) y representa la similitud en el etiquetado de dos tipos diferentes de insulinas, cuyo posible intercambio puede poner al paciente en riesgo si hay una administración errónea de insulina humana regular (envases presentados en el lado izquierdo de la imagen) en lugar de insulina humana NPH (presentada en el lado derecho de la imagen).
La Figura 2 presenta envases similares de medicamentos con sustancias controladas que se clasifican como anticonvulsivos, comúnmente utilizados para prevenir la desmoción de convulsiones en pacientes con epilepsia. El nombre del fabricante grabado en la parte inferior del paquete estaba cubierto a propósito con negro marcado para no exponer la marca y evitar posibles preguntas con respecto a los intereses de esta investigación.
Figura 1. Envases de insulina similares y la posibilidad de error de medicación.

Figura 2. Paquetes similares de anticonvulsivos fabricados en Brasil.

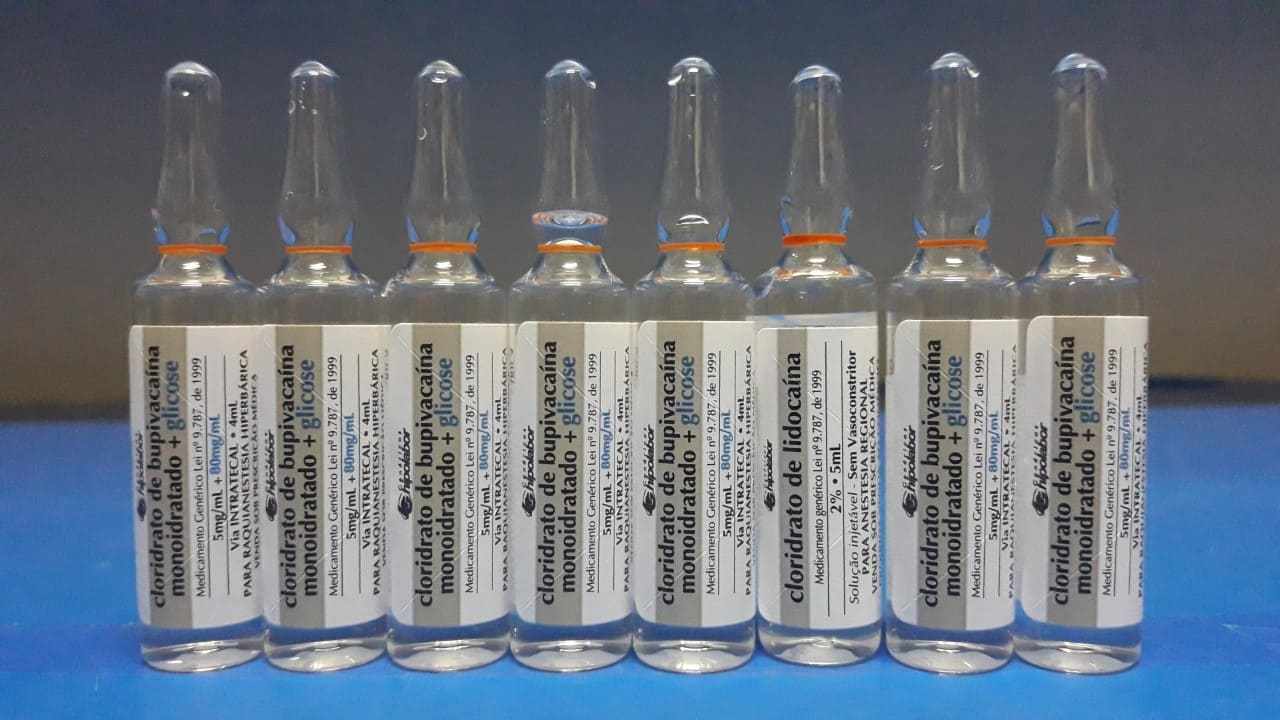
Otra similitud en el etiquetado de los medicamentos fue identificada por el autor de esta investigación mientras se encargaba de proporcionar asistencia farmacéutica en un hospital de la ciudad de Votorantim, en el estado de Sao Paulo, Brasil, desde la observación del stock de farmacia del quirófano, en las cajas (llamada “psicobox”) destinadas a ser aprovechadas por anestesiólogos en los quirófanos, donde el equipo informó de la ocurrencia de error de administración entre la lidocaína y la bupivaína.
Se analizaron las ampollas de fármacos inyectables de lidocaína y bupivacaína encontrados en las cajas y se presentó un potencial de similitud para inducir un error de medicación, tanto para la dispensación como para la administración en pacientes en procedimientos quirúrgicos.
Cabe destacar que las ampollas de estas dos sustancias tienen la misma empresa que el fabricante y con el fin de observar la similitud se colocaron, empíricamente, varias de estas ampollas lado a lado con la introducción de una ampolla de diferente sustancia entre otras para el análisis del potencial de similitud. Las figuras 3 y 4 a continuación presentan la situación descrita.
Figura 3. Medicamentos inyectables utilizados en procedimientos quirúrgicos y aspectos del etiquetado.

Figura 4. Foto ampliada. Medicamentos inyectables utilizados en procedimientos quirúrgicos y aspectos del etiquetado.
Otra investigación publicada en la revista del Instituto Israelí de Enseñanza e Investigación Albert Einstein, trató de demostrar que los colores ayudan en el proceso de identificación visual de las gotas para los ojos, reduciendo la administración incorrecta de gotas para los ojos. Se eliminaron las etiquetas del embalaje de los productos probados y los pacientes fomentaron la identificación de las gotas para los ojos del color característico de cada presentación. Los investigadores concluyeron que la tinción de la sustancia farmacéutica puede ayudar en el proceso de visualización e identificación de medicamentos (COSTA et al., 2019).
A partir de esta investigación y de los datos presentados anteriormente, empíricamente, podemos entender que los colores interfieren en la identificación de los medicamentos, tanto en la sustancia activa presente, como podría influir positivamente en el proceso de etiquetado y envasado de los productos farmacéuticos.
Diferentes colores utilizados en los procesos de desarrollo de material de embalaje para mejorar la distinción de etiquetado, tales como ampollas, viales, bolsas de soluciones parenterales, cristalería, blísters, entre otros, disminuyeron la posibilidad de errores por intercambio.
4. EL USO DE LA LACTOSA COMO EXCIPIENTE FARMACÉUTICO
En los estudios para el diseño de nuevas fórmulas farmacéuticas, se analizan las características biofarmacéuticas y fisicoquímicas de los ingredientes activos y excipientes. Las formas farmacéuticas requieren adyuvantes para ayudar en procesos tales como solubilidad, compresión, conservar, dar volumen, forma a la droga y dar sabor agradable a la formulación para mejorar la aceptación del consumidor (AULTON, 2016).
La lactosa es un carbohidrato disacárido, siendo uno de los tipos de excipiente comúnmente utilizados por la industria, y que se presenta como diluyente y edulcorante, especialmente en formas farmacéuticas sólidas, y también puede interferir en las características farmacocinéticas. Una contraindicación del uso de este excipiente en preparaciones farmacéuticas sería el hecho de que algunas personas tienen intolerancia a la lactosa (AULTON, 2016; 1475).
La intolerancia a la lactosa es una condición del organismo donde existe la incapacidad de digestión de este carbohidrato debido a la deficiencia de la enzima digestiva lactasa, que transforma la lactosa en glucosa y galactosa, siendo una condición que causa problemas de vida de las personas en todo el mundo (PEREIRA; FERREIRA; MARQUES, 2019).
Las personas que están presentes con esta condición, sufren de molestias gastrointestinales, como el desarrollo de diarrea severa prolongada, flatulencia, calambres, hinchazón abdominal y deshidratación, que les lleva a no consumir leche y otros productos lácteos (PERREIRA; FERREIRA; MASQUES, 2019).
Los pacientes con intolerancia a la lactosa están sujetos a reacciones adversas resultantes del uso de medicamentos que contienen este excipiente, y pueden desarrollar síntomas similares a los que se producen al consumir alimentos que contienen este azúcar, ya que la ingesta de la cantidad igual o inferior a 3 gramos ya puede provocar los síntomas descritos (SENA et al., 2014).
Un estudio descrito realizado en el Centro de Farmacovigilancia de Ceará tenía como objetivo identificar la existencia de posibles excipientes que inducen reacciones adversas contenidas en 12 productos (35 presentaciones farmacéuticas) con la venta más alta en Brasil, y la muestra se recogió de agosto a septiembre de 2004 (SILVA et al., 2008).
La lactosa estuvo presente entre los adyuvantes farmacéuticos encontrados en los productos estudiados, como en la formulación que contiene bromazepam (sustancia controlada cuya adquisición requiere receta médica específica) y dipyrone asociada con butilschopolamina (SILVA et al., 2008).
Otro estudio descriptivo con una encuesta bibliográfica de la composición de los medicamentos, a través del prospecto y la información técnica registrada en ANVISA, evaluó el riesgo de posibles excipientes que causan reacciones adversas en medicamentos anticonceptivos. La muestra se caracterizó por 6 presentaciones anticonceptivas, 3 de las cuales fueron medicamentos de referencia y 3 fueron similares, y en todas ellas se encontró la presencia de lactosa en la composición (DE CASTRO et al., 2010).
Las investigaciones realizadas con medicamentos a menudo prescritos a pacientes pediátricos también analizaron la presencia de lactosa en 181 presentaciones diferentes de 42 medicamentos. Los grupos farmacológicos encontrados fueron: analgésicos/antipiréticos, antiinflamatorios no esteroideos, antibióticos, antihistamínicos, antieméticos, corticoesteroides orales, corticosteroides inhalados, broncodilatadores de acción prolongada, corticoesteroides inhalados asociados con broncodilatadores, anticeutores y estabilizadores de membrana celular de mástil. En cuanto a la presencia de lactosa, el 28% de las presentaciones contenían este excipiente (GERMANA, et al. 2009).
Los estudios verificados muestran datos que identifican la presencia de lactosa en un porcentaje considerable entre los productos analizados. Actualmente en Brasil no existe legislación que regule a los fabricantes de medicamentos para añadir en el exterior del paquete la información que la droga presenta la lactosa excipiente.
Los envases secundarios de medicamentos están en contacto directo con el producto y son comúnmente identificados por la población laico en la legislación farmacéutica como el externo y el primer visual identificado: “la caja de medicamentos”. Teniendo en cuenta que ya se ha insertado otra información de advertencia sobre los tintes en el etiquetado de medicamentos a través de la legislación, como la tartazina, sería interesante considerar la posibilidad de insertar la alerta también sobre la lactosa en el exterior, facilitando la identificación.
El etiquetado podría ayudar a las personas con intolerancia a la lactosa a tomar mejores decisiones sobre la elección y la compra de sus medicamentos. Un proyecto de ley presentado a la Cámara de Representantes en 2009, preveía exigir a los laboratorios farmacéuticos que insertaran en las etiquetas de medicamentos una advertencia sobre la existencia de lactosa en la composición de sus productos. Aunque el tema del proyecto de ley es relevante para el uso seguro y racional de los medicamentos, la propuesta se analizó y presentó en 2013.
5. EL DERECHO AL ACCESO A LA INFORMACIÓN SANITARIA Y AL ETIQUETADO DE LOS MEDICAMENTOS
La salud es el derecho de todos y el deber del Estado, garantizado a través de políticas sociales y económicas destinadas a reducir el riesgo de enfermedades y otras lesiones, y acceso universal e igualitario a las acciones y servicios para su promoción, protección y recuperación (BRASIL, 1988).
El derecho a la salud se inserta en el ámbito de los derechos sociales garantizados constitucionalmente (BRASIL, 1988). Sobre la base de la Constitución Federal como principio para resaltar el derecho a la salud y la información derivada de este derecho, depende del organismo regulador brasileño como parte integral y representativa del Ministerio de Salud, la responsabilidad de tomar iniciativas que se desarrollen y garanticen el acceso a la población en los temas de salud que son relevantes para ellos.
La Ley Orgánica de Salud No. 8080/1990, que crea el Sistema Unificado de Salud, reanuda esta declaración contenida en la Constitución Federal de Brasil, reafirmando que la salud es un derecho fundamental del ser humano y el deber del Estado de proporcionar las circunstancias fundamentales para su pleno ejercicio, y el Estado también debe garantizar la salud estableciendo condiciones que garanticen el acceso, pero deja claro que el deber del Estado no exime la responsabilidad de las personas, la familia, las empresas y la sociedad en asuntos relacionados con la salud. (BRASIL, 1990).
En un entorno hospitalario, los medicamentos se almacenan comúnmente en la farmacia y la dispensación es realizada por profesionales que trabajan en el sector, siendo el farmacéutico el miembro del equipo responsable de todas las actividades desarrolladas dentro de la farmacia hospitalaria. El etiquetado visualmente distinto de otros productos permite la correcta identificación del medicamento en el momento de la dispensación y evita errores en la administración de medicamentos por parte de los profesionales sanitarios.
En farmacias y farmacias, los medicamentos pueden ser comprados por el propio usuario u otra persona solicitada por el usuario, y se pueden comprar medicamentos puestos a disposición en el autoservicio y conocidos como MIPs (Medicamentos sin receta), medicamentos que necesitan ser prescritos por un profesional de la salud calificado para este fin, incluyendo medicamentos controlados, cuyo medicamento se conservará en el establecimiento que dispensa el producto.
En el caso de reacciones adversas causadas por pacientes con intolerancia a la lactosa, por ejemplo, el derecho a acceder a la información sanitaria se vuelve esencial. Teniendo en cuenta que muchos medicamentos contienen lactosa como excipiente, incluyendo medicamentos controlados, si el usuario viene a desarrollar una reacción adversa al medicamento porque contiene lactosa, este producto probablemente será inutilizable y el paciente tendrá que pedir al prescriptor otra receta para hacer una nueva compra. Estos casos podrían evitarse con frases de advertencia en el envase, ya que la información sobre los excipientes se inserta sólo en el bullium.
Los medicamentos están disponibles en diferentes ambientes, pero se utilizan con el mismo propósito de prevenir, curar, aliviar los síntomas o ayudar en el diagnóstico de enfermedades. Entendiendo estas premisas, podemos darnos cuenta de que la información sobre estos productos debe llegar a los usuarios de manera eficiente, con el fin de proporcionar un uso seguro y sin riesgos adicionales, además de los conocidos y ya manifestados en el prospecto.
La información sobre los productos, especialmente los relacionados con la salud, debe ser adecuada y clara a fin de presentar con precisión todas las pruebas que garanticen la seguridad en relación con el uso, según lo dispuesto en el artículo 6 del Código de Protección del Consumidor (BRASIL, 1990).
Las reglamentaciones sanitarias son la forma de establecer y garantizar este derecho a los consumidores de productos farmacéuticos. Además, la industria farmacéutica tendría mucho que obtener con el suministro de información más eficiente sobre el etiquetado, además de las exigidas por la legislación vigente, ya que los productos que añaden valor a la seguridad de los consumidores y a la seguridad de las prescripciones por parte de los profesionales de la salud que prescriben medicamentos tendrían una mayor posibilidad de prescripción y venta.
El desarrollo industrial del material de embalaje y el derecho a la información sanitaria deben estar interrelacionados. Teniendo en cuenta que los profesionales de la salud a menudo trabajan largas horas de trabajo al día, envases similares representan un riesgo para una administración errónea y no colaboran para cumplir con los criterios de seguridad en el uso de medicamentos.
Los cambios en el etiquetado y el envasado de medicamentos podrían minimizar la aparición de errores de medicación, alertar a las personas con problemas relacionados con la lactosa sobre las reacciones adversas y promover el uso racional de los medicamentos, garantizando la información directa sobre salud y salud.
6. CONSIDERACIONES FINALES
Tras analizar las normas sanitarias sobre el etiquetado y el envasado de productos farmacéuticos, fue posible encontrar conceptos y recomendaciones genéricos para el desarrollo del etiquetado y se observó que la falta de normas específicas inhibyó posibles errores de medicación derivados de etiquetas y envases similares.
Al mismo tiempo, ninguna norma sanitaria encontró la determinación por parte del organismo regulador brasileño de la obligación de las industrias farmacéuticas de insertar la información: “CONTAINS LACTOSE”, en el embalaje y las etiquetas de los medicamentos, especificando a los profesionales de la salud y a los pacientes sobre la composición de la fórmula farmacéutica directamente en el envase secundario: “fuera de la caja”.
Los costos derivados de los sistemas de salud en todo el mundo generados por errores de medicación y reacciones adversas son elevados, y las consecuencias de la similitud y la falta de información sobre los excipientes en las etiquetas y los envases contribuyen a aumentar el gasto y aumentan la posibilidad de riesgo para la salud de todos.
Los errores de medicación y los acontecimientos adversos derivados del etiquetado y envasado de productos farmacéuticos deben ser investigados por las autoridades de salud pública y ANVISA, un organismo vinculado al Ministerio de Salud, con el fin de buscar soluciones a la cuestión destacada en esta investigación, y tratar de encontrar formas de favorecer el uso racional de medicamentos alineados con el desarrollo por parte de las industrias farmacéuticas de etiquetas y envases más informativos que comerciales.
Al parecer, la ocurrencia de esta situación no ha movido a las industrias farmacéuticas a desarrollar proyectos con el fin de crear nuevas soluciones, proporcionando la estandarización de envases y etiquetas de medicamentos, olvidando que los parámetros de calidad para cumplir con las buenas prácticas de fabricación deben observarse desde los estudios de desarrollo y producción de formas farmacéuticas hasta el control de la calidad y la seguridad en el uso posterior a la comercialización.
Las acciones simples de la industria farmacéutica podrían mejorar la vida de los pacientes y los profesionales de la salud en el manejo de medicamentos. El uso de diferentes colores para diferenciar el etiquetado de medicamentos, especialmente aquellos con potencial de interacción de drogas moderado a severo, y la inserción de una frase de advertencia específica para los productos de lactosa directamente en el exterior en el envase de drogas, podría evitar errores y facilitar el acceso a la información pertinente.
Esta investigación espera contribuir a que se desarrollen nuevos estudios y se adopten medidas al respecto, tanto por parte de las instituciones públicas como del sector industrial farmacéutico, con el fin de garantizar que se produzcan debates y se puedan encontrar soluciones.
Es en primer lugar a la Agencia Nacional de Vigilancia de la Salud, como entidad responsable del desarrollo de la promoción de la salud, el papel de reanalizar la legislación vigente sobre etiquetado y envasado de medicamentos y la publicación de nuevos actos normativos que resuelvan los problemas presentados en esta investigación.
Las etiquetas y el embalaje han sido la causa de errores de medicación y reacciones adversas relacionadas. La regulación de la salud es la manera de proporcionar la prevención y la minimización de los problemas relacionados con las drogas.
7. REFERENCIAS
ANACLETO, Tânia Azevedo et al. Erros de medicação e sistemas de dispensação de medicamentos em farmácia hospitalar. Clinics. São Paulo, v. 60, n. 4, p. 325-332, ago. 2005. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1807-59322005000400011&lng=pt&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S1807-59322005000400011.
ANVISA, 2019. Registro de medicamentos cresce 100%. Disponível em: <http://portal.anvisa.gov.br/noticias/-/asset_publisher/FXrpx9qY7FbU/content/registro-de-medicamentos-cresce-100-em-2019/219201?p_p_auth=fJVL8wqt&inheritRedirect=false>. Acesso em: 06 jan. 2020.
ARAUJO, Ana Carolina; BORIN, Maria de Fátima. Influência de excipientes farmacêuticos em reações adversas a medicamentos. Brasília Med. 2012;49(4):267-278. Disponível em: <https://pdfs.semanticscholar.org/e5a3/9e36b11ae4dc9336d3bd033fe80cd45f2df1.pdf>. Acesso em: 15 jan. 2020.
AULTON, Michael E. Aulton delineamento de formas farmacêuticas. Michael E. Aulton, Kevin M. G. Taylor; [tradução Francisco Sandro Menezes]. Versão digital – 4 ed. – Rio de Janeiro: Elsevier, 2016.
BRASIL, 1988. Constituição da República Federativa do Brasil. Disponível em: <http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm>. Acesso em: 20 nov. 2019
BRASIL, 1990. Lei nº 8.078, de 11 de setembro de 1990. Dispõe sobre o Código de Defesa do Consumidor. Disponível em: <http://www.planalto.gov.br/ccivil_03/leis/l8078.htm>. Acesso em 17 dez. 2019.
BRASIL, 1999. Lei nº 9.782, de 26 de janeiro de 1999. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2006/prt0354_11_08_2006.html>. Acesso em: 15 de jan. de 2020.
BRASIL, 2016. Manual de Identidade Visual de Medicamentos do Ministério da Saúde. Disponível em: < https://www.saude.gov.br/artigos/672-assuntos/assistencia-farmaceutica/42827-arquivos-do-manual-de-identidade-visual-de-medicamentos>. Acesso em: 22 jan 2020.
BRASIL, 2003. Resolução RDC nº 333, de 19 de novembro de 2003. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2003/rdc0333_19_11_2003.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 71, de 22 de dezembro de 2009. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2009/res0071_22_12_2009.html>. Acesso em: 23 nov. 2019.
BRASIL, 2015. Lei nº 13.236, de 29 de dezembro de 2015. Disponível em: <https://www2.camara.leg.br/legin/fed/lei/2015/lei-13236-29-dezembro-2015-782195-publicacaooriginal-149108-pl.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 301, de 21 de agosto de 2019. Disponível em: <http://www.in.gov.br/web/dou/-/resolucao-rdc-n-301-de-21-de-agosto-de-2019-211914064>. Acesso em 14 dez. 2020.
COSTA, Ana Luiza Fontes de Azevedo et al. Quando a cor ajuda. Einstein (São Paulo), São Paulo, v. 17, n. 1, eAO4410, 2019. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1679-45082019000100200&lng=en&nrm=iso>. Acesso em 29 nov. 2019. Epub Dez 17, 2018. http://dx.doi.org/10.31744/einstein_journal/2019ao4410.
DE CASTRO, Ana Luiza Ferreira Meinen; AHLERT, Elias Ricardo; COLET, Christiane de Fátima. Avaliação do risco de reações adversas causadas por excipientes em formulações de anticoncepcionais. Revista Contexto & Saúde, v. 10, n. 19, p. 146-149, 14 jun. 2013. Disponível em: <https://www.revistas.unijui.edu.br/index.php/contextoesaude/article/view/1496>. Acesso em: 15 nov. 2019.
GERMANA, Stefani P. et al. Presença de corantes e lactose em medicamentos: avaliação e 181 produtos. Rev. bras. alergia imunopatol; v. 32, v.1, p. 18-26, jan.-fev. 2009. Disponível em: < http://www.sbai.org.br/revistas/Vol321/ART%201-09%20-%20Presen%C3%A7a%20de%20corantes%20e%20lactose.pdf>. Acesso em: 15 jan. 2020.
ISMP, 2018. Estratégias de segurança do paciente no Brasil – O que já foi feito e o que ainda está por vir?. Disponível em: <https://www.ismp-brasil.org/site/wp-content/uploads/2019/05/A—-es-da-Anvisa-com-foco-seguran–a.pdf>. Acesso em: 22 jan. 2020.
LOPES, Diana Maria de Almeida et al. Análise da rotulagem de medicamentos semelhantes: potenciais erros de medicação. Rev. Assoc. Med. Bras., São Paulo, v. 58, n. 1, p. 95-103, fev. 2012. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42302012000100021&lng=en&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S0104-42302012000100021.
National Coordinating Council for Medication Error Reporting and Prevention. What is a medication error? Nova York: National Coordinating Council for Medication Error Reporting and Prevention; 2015. Disponível em <http://www.nccmerp.org/aboutmedication-errors>. Acesso em 20 de jan. 2020.
PEREIRA, Leandra Gonçalves; FERREIRA, Michelle Silva; MARQUES, Fabíola Pedrosa Peixoto, 2019. Intolerância à lactose e os aspectos legais da rotulagem. Disponível em: <http://anais.unievangelica.edu.br/index.php/latosensu/article/view/4526>. Acesso em 15 jan. 2020
PESSANHA, Ana Flávia de Vasconcelos et al. Influência dos excipientes multifuncionais no desempenho dos fármacos em formas farmacêuticas. Rev. Bras. Farm. 93(2): 136-145, 2012. Disponível em: <http://www.rbfarma.org.br/files/rbf-2012-93-2-2.pdf>. Acesso em: 15 jan. 2020
SENA, Cristina Santana et al. Excipientes farmacêuticos e seus riscos à saúde: uma revisão da literatura. Rev. Bras. Farm. 93(2): 136-145, 2014. Disponível em: <http://www.sbrafh.org.br/v1/public/artigos/2014050405000621BR.pdf>. Acesso em: 15 jan. 2020
SILVA, Antonio Vinicios Alves da et al. Presença de excipientes com potencial para indução de reações adversas em medicamentos comercializados no Brasil. Rev. Bras. Cienc. Farm., São Paulo, v. 44, n. 3, p. 397-405, set. 2008. Available from <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-93322008000300009&lng=en&nrm=iso>. Acesso em: 29 nov. 2019
WHO, 1998. Portal de informações sobre medicamentos essenciais e produtos de saúde. Relatório do 4º Grupo Consultivo da OMS sobre o papel do farmacêutico. Disponível em: <https://apps.who.int/medicinedocs/en/d/Jwhozip32e/>. Acesso em: 15 jan. 2020.
WHO, 2017. O terceiro desafio global da segurança do paciente da OMS: medicação sem danos. Disponível em: <https://www.who.int/patientsafety/medication-safety/campaign/en/>. Acesso em 06 jan. 2020.
[1] Postgrado en Gestión Industrial Farmacéutica por la Universidad Estácio de Sá, Graduado en Farmacia-Bioquímica por la Universidade Paulista – UNIP.
Enviado: Marzo de 2020.
Aprobado: Junio de 2020.