REVIEW ARTICLE
NOVAES, Michele Franciene Baú [1]
NOVAES, Michele Franciene Baú. Bewertung der regulatorischen Standards für die Etikettierung und Verpackung von Arzneimitteln. Revista Científica Multidisciplinar Núcleo do Conhecimento. Jahrgang 05, Ed. 06, Band 01, S. 44-64. Juni 2020. ISSN: 2448-0959, Zugriffslink: https://www.nucleodoconhecimento.com.br/gesundheit/regulierungsstandards
ZUSAMMENFASSUNG
Die National Health Surveillance Agency (ANVISA) zielt darauf ab, die Gesundheit der Bevölkerung durch die Regulierung der Produktion und Vermarktung von Produkten und Dienstleistungen, die einer sanitären Überwachung unterliegen, einschließlich pharmazeutischer Produkte, zu fördern. Die regulatorischen Standards leiten die Qualitätsparameter, die in der Produktionskette in der pharmazeutischen Arzneimittelindustrie eingehalten werden müssen. Diese Forschung zielte darauf ab, bibliographische Daten zu sammeln, um Gesundheitsfachleute, die pharmazeutische Industrie, die mit dem Gesundheitsministerium, ANVISA und der brasilianischen Bevölkerung in Verbindung stehende Behörden zu klären und zu veröffentlichen, über die Bedeutung der Erörterung und Aktualisierung der brasilianischen Rechtsvorschriften über die Kennzeichnung und Verpackung von Arzneimitteln, die Identifizierung und Demonstration von Daten, die auf mögliche Äquivalenzen zwischen ihnen hinweisen, die zu Medikationsfehlern führen können, , was im Gegenzug geschehen kann. Außerdem soll mit den geltenden Hygienestandards überprüft werden, welche obligatorischen Angaben in die für die Benutzersicherheit relevanten Angaben aufgenommen werden müssen, und mögliche Nebenwirkungen im Zusammenhang mit dem in der pharmazeutischen Industrie weit verbreiteten Lactose-Hilfsstoff erörtert werden. Um den theoretischen Rahmen auszuwählen, verwendeten wir die Datenbanken der Websites Scielo.br, VHL (Virtual Health Library), Durchsuchungen auf Websites, wissenschaftlichen Zeitschriften und Artikeln in Gesundheitszeitschriften, wo wir die Suchbegriffe allein verwendeten: Etikettierung, Verpackung, Gesetzgebung, Laktose und kombinierte Suche nach zwei oder drei Wörtern: Arzneimitteletiketten-Medikamentenfehler, Pharmakovigilanz-Medikationsfehler, Etikettierungs-Verpackungs-Gesetzgebung, Etiketten-Verpackung-Lactose. Die Werke, die keines der drei Wörter kombinierten, wurden ebenso ausgeschlossen wie solche, die in den vorgewählten Jahren von 2000 bis 2019 nicht passten. Das Ausschlusskriterium gilt auch für Artikel, die sich nach der Lektüre nicht auf das Hauptziel der Forschung bezogen. Es fehlten spezifische Standards, um die Differenzierung ähnlicher Verpackungen zu gewährleisten, um Medikationsfehler zu vermeiden, wie auch das Fehlen von Regeln zur Diskriminierung des Vorhandenseins von Laktose auf Arzneimitteletiketten festgestellt wurde. Die Veröffentlichung von Rechtsvorschriften zur Förderung der Differenzierung von Verpackungen und die Vereinheitlichung spezifischer Informationen auf Etiketten ist von grundlegender Bedeutung für die Förderung der rationellen Verwendung von Arzneimitteln.
Schlagworte: Arzneimittelkennzeichnung, Verpackung, Medikationsfehler. Rechtsvorschriften, Laktose.
1. EINFÜHRUNG
Die Nationale Gesundheitsüberwachungsbehörde (ANVISA) zielt darauf ab, die Gesundheit der Bevölkerung zu fördern, indem sie die Produktion und Vermarktung von Produkten und Dienstleistungen überwacht, die der sanitären Überwachung, einschließlich pharmazeutischer Produkte, durch Inspektion, Standardisierung der Verfahren und Verfahren, die befolgt werden müssen, um Qualität und Sicherheit bei der Verwendung dieser Produkte zu gewährleisten ,,BRASIL, 1999).
Die industrielle Produktionskette für pharmazeutische Produkte umfasst eine Reihe sequenzieller Verfahren zur Qualitätssicherung, von Vorformulierungsstudien bis hin zur Entwicklung von Etikettierung und geeignetem Verpackungsmaterial.
Die Qualität eines pharmazeutischen Arzneimittels ist von den Herstellungsprozessen der Anlagen bis hin zum Etikett und der Verpackung zu beachten, die alle gesetzlichen Anforderungen erfüllen müssen.
ANVISA RESOLUTION RDC Nr. 71/2009 legt die Spezifikationen, den Aspekt und den Inhalt fest, die die Entwicklung von Etiketten und Verpackungen von Arzneimitteln in Brasilien gewährleisten sollten, um den Zugang zu den erforderlichen Informationen über diese Produkte zu erleichtern und die rationelle Verwendung von Arzneimitteln zu gewährleisten (BRASIL, 2009).
Der Zweck der Verpackung ist es, verpackung, Verpackung, Verpackung, Schutz und Aufrechterhaltung der Sicherheit, und die ordnungsgemäße Konservierung des pharmazeutischen Produkts, ein wichtiges Element für die Wirksamkeit und Sicherheit, zusätzlich zur Vermittlung der wesentlichen Informationen über die Verwaltung. Auf den Etiketten muss der Handelsname des Produkts angegeben sein, wenn der Name des Wirkstoffs, die pharmazeutische Form, der Verabreichungsweg, die Dosierung und die Menge im Verpackungsmaterial verpackt sind (BRASIL, 2009).
Die Bundesverfassung sieht in einem ihrer Artikel vor, dass die Gesundheit für alle gewährleistet ist, und es ist die Pflicht des Staates, sie durch sozioökonomische Maßnahmen bereitzustellen, die dazu neigen, die Wahrscheinlichkeit zu verringern, dass Bürger Krankheiten oder andere Verletzungen erkranken, und den Zugang zu Maßnahmen und Dienstleistungen zur Förderung und zum Schutz der Gesundheit aller brasilianischen Bürger zu erhalten (BRASIL, 1988).
Der Verbraucherschutzkodex sieht vor, dass es das Recht des Verbrauchers ist, den Schutz des Lebens zu gewährleisten und angemessene und klare Informationen über Produkte und Dienstleistungen zu erhalten. Die entwickelten Produkte dürfen keine Risiken für die Gesundheit oder Sicherheit der Verbraucher mit sich bringen, und im speziellen Fall von Produkten, die in der industriellen Umgebung hergestellt werden, muss der Hersteller alle erforderlichen Informationen bereitstellen, und diese müssen mit dem Produkt versehen sein, insbesondere MitInformationen über die Sicherheit der Verwendung (BRASIL, 1990).
1998 veröffentlichte die Weltgesundheitsorganisation das Dokument “The Role of the Pharmacist in Self-Care and Self-Medication”, einen Bericht der 4. WHO-Beratungsgruppe über die Rolle des Apothekers, ein Dokument, das auch die Bedeutung des Zugangs zu unparteiischen und qualitativ hochwertigen Informationen als Richtschnur für Selbstversorgung und Selbstmedikation (WHO, 1998) dokumentiert.
Fehler bei der Abgabe und Verabreichung von Medikamenten ergeben sich aus multifaktoriellen Folgen, die unterschiedliche Ursachen und Ursachen haben, von Fehlern, die durch Abgabe und/oder falsche Verabreichung verursacht werden, bis hin zu Fehlern, die aus unbewusster Selbstmedikation von Produkten stammen, die Substanzen enthalten, die Probleme oder Gesundheitsprobleme von Patienten verursachen können (WHO, 1998).
Wissenschaftliche Daten deuten darauf hin, dass Etiketten und ähnliche Verpackungen von Arzneimitteln einer der Gründe für Fehler bei der Abgabe und Verabreichung von Arzneimitteln in Krankenhäusern und Gesundheitseinrichtungen sein können (ANACLETO et al., 2005).
Andere Untersuchungen zeigen, dass die Verwendung einiger Hilfsstoffe in pharmazeutischen Präparaten, die von Industrien zur Herstellung von Arzneimitteln weit verbreitet sind, wie Laktose, die Entwicklung von Magen-Darm-Beschwerden bei Menschen mit Intoleranz gegenüber dieser Art von Kohlenhydraten verursachen kann, sowohl in der Säuglingspopulation als auch bei Erwachsenen bei der Verabreichung von Medikamenten, die diesen Hilfsstoff in Vorbereitung enthalten (SENA, 2012; SILVA, 2008).
Situationen wie diese können zu krankenhausärztlichen Behandlungen führen oder die Dauer des Krankenhausaufenthalts von Stationären patienten verlängern, was Folgen für die Gesundheit der Menschen und die Erhöhung der Kosten für öffentliche und private Gesundheitssysteme haben kann.
Wir können Ereignisse wie die oben genannten als ein Problem der öffentlichen Gesundheit betrachten, das analysiert werden muss, und wir sollten die Gesetze diskutieren, die mit dem Prozess der Kennzeichnung und Verpackung von Arzneimitteln verbunden sind, um das Recht auf volle Gesundheit und Informationen zu gewährleisten, die für den Benutzer zugänglich und klar sind.
Auf der Grundlage dieser Vorkommnisse beabsichtigt diese Forschung, die in Brasilien geltenden geltenden Regulatorischen Standards für die Kennzeichnung und Verpackung von Arzneimitteln zu bewerten, epidemiologische Daten über Medikationsfehler aus ähnlichen Verpackungen zu analysieren, das Auftreten von Nebenwirkungen zu melden, die aus der Verwendung von Arzneimitteln mit dem Laktose-Hilfsstoff stammen, um die Notwendigkeit einer Diskussion und Aktualisierung der brasilianischen Rechtsvorschriften zu diesem Thema zu überprüfen. , um den Zugang der Bevölkerung zu wesentlichen Informationen über Arzneimittel zu erleichtern und zu gewährleisten.
2. ANVISA’S ATTRIBUTIONS AND BRAZILIAN REGULATORY STANDARDS ON DRUG LABELING AND PACKAGING
Die National Health Surveillance Agency, eine Agentur, die mit dem Gesundheitsministerium verbunden ist und sich durch administrative Unabhängigkeit auszeichnet, hat als eine ihrer allgemeinen Zuschreibungen die Verantwortung für die Standardisierung, Kontrolle und Überwachung von Produkten, Stoffen und Dienstleistungen im Zusammenhang mit der Gesundheit, handeln in der Gesundheitsförderung und entwickeln Arbeit in besonderen Situationen, die die Gesundheit der brasilianischen Bevölkerung gefährden (BRASIL, 1999).
Als spezifische Zuschreibungen dieser Einheit können wir die Festlegung von Standards zur Regulierung des Arzneimittelsektors erwähnen, wie die Standardisierung der Qualitätsparameter für die Herstellung; Registrierungen von Vorleistungen und pharmazeutischen Produkten zu genehmigen und zu stornieren; Debatten und öffentliche Konsultationen zu gesundheitsrelevanten Fragen zu entwickeln, um neue Vorschriften als Grundlage für Tätigkeiten in den Bereichen Herstellung und Vermarktung von Arzneimitteln zu ändern oder zu schaffen; und analysieren die Anforderungen der pharmazeutischen Industrie nach Änderungen bei Etiketten und Verpackungen (BRASIL, 1999).
Die Entwicklung der Zivilisation in einer globalisierten Welt, das Aufkommen neuer Pathologien, die von der Medizin untersucht werden sollen, und mit den Verbesserungen, die in den letzten Jahrzehnten in Bezug auf den einfachen Zugang der brasilianischen Bevölkerung zu Arzneimitteln erreicht wurden, im Vergleich zu früheren Jahrzehnten, gab es eine Zunahme des Einsatzes von Medikamenten und die Suche nach besseren Therapien, um neue Krankheiten der Moderne zu versorgen.
Als Folge der Nachfrage nach neuen, effektiveren und moderneren therapeutischen Alternativen wurde die Notwendigkeit wahrgenommen, neue pharmazeutische Inputs, designierte pharmazeutische Formeln und Arzneimittelabgabesysteme zu entwickeln. Infolgedessen sind die Investitionen der Industrien in die Forschung und Entwicklung neuer Moleküle gestiegen, und infolge dessen und der wirtschaftlichen Interessen des Sektors ist die Verfügbarkeit von Arzneimitteln erheblich gestiegen.
Arzneimitteletiketten und Verpackungen sind nicht nur ein integraler Bestandteil der Verpackung des fertigen Produkts geworden, sondern für das pharmazeutisch vermarktete Produkt eine wichtige Chance für das Studium und die Entwicklung kommerziell attraktiver Verpackungen, die dazu beitragen würden, das Produkt zu fördern und den Umsatz zu steigern. Dann kommt die Notwendigkeit, Hygienestandards für die Etikettierung dieser Produkte festzulegen.
Unter Berücksichtigung der Kriterien für gute Herstellungspraktiken, die für alle Phasen der Forschung, Produktion und Logistik eines Produkts gelten, und der 1998 vom Gesundheitsministerium eingeführten Nationalen Drogenpolitik, die als eines ihrer Grundsätze den Anreiz zur Herstellung von Arzneimitteln und deren Hygienevorschriften hat, veröffentlichte die National Health Surveillance Agency resolution RDC No. 333/2003 (BRASIL, 2003; BRASILIEN, 2019).
Die Entschließung des Kollegiums des AnVISA RDC Nr. 333/2003 war die erste Rechtsvorschrift zur Kennzeichnung von Arzneimitteln, die festlegte, dass alle Arzneimittelpackungen, die ab dem Jahr nach der Veröffentlichung entwickelt wurden, an die in dieser Resolution festgelegten Standards angepasst werden sollten (BRASIL, 2003). In der Folge wurde diese Regel durch die Veröffentlichung der Resolution RDC Nr. 71/2009 aufgehoben.
Die Resolution RDC Nr. 71/2009 ist die aktuelle Norm in Brasilien, die die Merkmale regelt, die bei der Entwicklung der Arzneimittelkennzeichnung in Brasilien zu beachten sind, um den Zugang zu Informationen zu erleichtern und die zu zugebenden obligatorischen Informationen zu standardisieren (BRASIL, 2009).
Die Unternehmen sollten die Angemessenheit der Etikettierung, die Einhaltung der in der Entschließung festgelegten Anforderungen mitteilen und innerhalb von 540 Tagen nach veröffentlichungsdatum neue Etiketten auf der Verpackung von Arzneimitteln, die hergestellt oder zum Verkauf auf den Markt eingeführt werden, zur Verfügung stellen (BRASIL, 2009).
Einige Definitionen sind in dieser Norm für die Arten der Etikettierung und deren Verwendungsort enthalten und können eine differenzierte Kennzeichnung aufweisen und Merkmale aufweisen, die es ermöglichen, als Entwicklungskennzeichnung für die Verwendung in Produkten identifiziert zu werden, die in öffentlichen Einrichtungen im Zusammenhang mit dem Gesundheitsministerium abgegeben werden; kommerziell, mit Etikettierung für Produkte mit Verkauf in Apotheken und Drogerien entwickelt; und Krankenhaus, mit Material, das dazu bestimmt ist, Produkte mit eingeschränkter Verwendung für Kliniken und Krankenhäuser zu verpacken. Die Konzepte zur Kennzeichnung und Differenzierung von Verpackungsarten sind ebenfalls charakterisiert (BRASIL, 2009).
Etikett ist jede Art von Kennzeichnung gedruckt oder graviert auf dem Etikettierungsmaterial, die darauf abzielt, wichtige Informationen in Behältern, Behältern, Wrappern, Wrappern oder auf dem Produkt, in dem es identifiziert werden soll (BRASIL, 2009) zu identifizieren.
Verpackung ist alle Arten von Form für Verpackungen, mit dem Hauptzweck der Aggregation von Einheiten eines Produkts, mit dem Ziel, bessere Bedingungen zu schaffen, um die Qualität und Logistik Verteilung der gleichen zu halten (BRASIL, 2009).
Wenn es um Arzneimittel geht, haben wir immer noch die Konzepte der Primär- und Sekundärverpackung. Nach RDC Nr. 71/2009 ist die Primärverpackung diejenige, die den direkten Kontakt mit dem pharmazeutischen Produkt aufrechterhält, während die Sekundärverpackung die externe Verpackung des Produkts ist, die mit der Primärverpackung in Berührung kommt und eine oder mehrere Primärverpackungen enthalten kann (BRASIL, 2009).
Nach den oben genannten Rechtsvorschriften gibt es Informationen, deren Einfügung in das Etikettierungsverfahren zur Klärung der Merkmale des Arzneimittels obligatorisch wird.
Auf sekundären Verpackungsetiketten enthalten sie: den Handelsnamen des Arzneimittels und seine Gattungsbezeichnung für jeden in der Formulierung enthaltenen Wirkstoff mit der Konzentration jedes einzelnen von ihnen; den Verabreichungsweg, die pharmazeutische Form mit Angabe der Einschränkung der Verwendung nach Altersgruppen, die angeben, ob das Produkt für Erwachsene oder pädiatrische Zwecke bestimmt ist; die im Verpackungsmaterial verpackte Gesamtmenge unter Angabe der Temperatur und der Lagerbedingungen; und Informationen über die Hersteller- und Produktregistrierungsdaten (BRASIL, 2009).
Warnhinweise sollten dem Benutzer auch in Bezug auf Kontraindikationen, Vorsorge und Warnhinweise für die Verwendung von Wirkstoffen, therapeutischen Klassen und Hilfsstoffen, falls zutreffend, in Sekundärverpackungen eingefügt werden. RdC Nr. 71/2009 gibt jedoch nicht ausdrücklich an, welche Warnhinweise in Bezug auf aktive und hilfsstoffliche Inhaltsstoffe auf Etiketten und Verpackungen enthalten sein sollten (BRASIL, 2009).
Hinsichtlich der Primärverpackungsetiketten wurde festgestellt, dass die gleichen obligatorischen Informationen für Sekundärverpackungen in die Primärverpackung eingefügt werden sollten, und wenn es nicht möglich ist, alle diese Informationen im Primärverpackungsmaterial zu enthalten, müssen die Industrien die Gründe über elektronische Petitionen mitteilen (BRASIL, 2009).
Die Kennzeichnung von Arzneimitteln ist das Vehikel für die Übermittlung von Produktinformationen an den Anwender. In diesem Sinne kommt der brasilianischen Regulierungsbehörde eine wichtige Rolle zu, kriterien zu analysieren und festzulegen, indem neue normative Rechtsakte für die Entwicklung von Etiketten und Verpackungen veröffentlicht werden, die den Bedürfnissen der Bevölkerung entsprechen und unter dem Gesichtspunkt der Information effizienter sind.
3. ETIKETTEN UND VERPACKUNGEN ÄHNLICHER ARZNEIMITTEL UND ARZNEIMITTELFEHLER
Zu den Problemen im Zusammenhang mit der Patientensicherheit gehören Maßnahmen zur Vermeidung und Beseitigung von Fehlern, die in Gesundheitsprozessen auftreten. Nach angaben des National Coordinating Council for Medication Error Reporting and Prevention (NCCMERP) der Vereinigten Staaten kann ein Medikationsfehler wie folgt definiert werden:
vermeidbare Ereignisse, die zu einer unsachgemäßen Verwendung von Medikamenten oder zu einer Schädigung des Patienten führen können, während das Medikament unter der Kontrolle des Arztes, des Patienten oder des Verbrauchers steht. Solche Ereignisse können mit der Berufspraxis, Gesundheitsprodukten, Verfahren und Systemen zusammenhängen, einschließlich Verschreibung, Kommunikation, Produktetikett, Verpackung, Nomenklatur, Zusammensetzung, Dispensation, Vertrieb, Verwaltung, Bildung, Überwachung und Verwendung (NCCMERP, 2015).
Nach Angaben der Weltgesundheitsorganisation sind Medikationsfehler einer der Hauptgründe für Verletzungen und vermeidbare Schäden in den Gesundheitssystemen und können in verschiedenen Stadien des Medikationsprozesses passieren. Weltweit werden die Kosten drogenbedingter Fehler auf 42 Milliarden US-Dollar pro Jahr geschätzt (WHO, 2017).
Die Veröffentlichung des Gesetzes Nr. 13,236/2015 gipfelte in der Änderung und Aufnahme einiger Artikel des Gesetzes Nr. 6360/1976, um die Notwendigkeit zu unterstreichen, Etiketten und Verpackungen von Arzneimitteln zu unterscheiden, um das Auftreten von Medikationsfehlern, einschließlich Fehlern bei der Abgabe, Verabreichung von Arzneimitteln oder dem falschen Austausch für die Vorlage ähnlicher Verpackungen, zu minimieren (BRASIL, 2015).
Die Etiketten und Verpackungen von Arzneimitteln haben nicht nur die Art und Weise, wie diese erkannt und verwendet werden, sondern auch ein wichtiges Mittel zur Fehlervermeidung. Die Daten deuten jedoch auf Medikationsfehler hin, bei denen Etiketten und Medikamentenverpackungen bei den in der Arbeitsumgebung durchgeführten Verfahren verwirrung verursachen können und damit die Gesundheit der Patienten schädigen können (ANACLETO et al., 2005).
Medikationsfehler sind ein großes Problem der öffentlichen Gesundheit und sind für das Auftreten von Morbidität, Krankenhausaufenthalten, Sterblichkeit und erhöhten Gesundheitsausgaben verantwortlich. Laut einer Veröffentlichung des Instituts für sichere Praktiken für die Verwendung von Arzneimitteln aus dem Jahr 2018 werden 33 % durch Etiketten und Verpackungen verursacht, und 31 % davon sind auf verwandte Todesfälle zurückgegangen (ISMP, 2018).
Im Jahr 2010 wurde in verschiedenen Bereichen der Krankenhausapotheke eines Universitätskrankenhauses in Fortaleza, Cearé, eine epidemiologische Studie über den Beobachtungs- und Querschnittstyp durchgeführt, um Etiketten und Verpackungen von Arzneimitteln zu überprüfen und Ähnlichkeiten in ihnen zu identifizieren, die Beifallinfehler auslösen könnten, die bei lagerungs-, Dosier- und Verabreichungsprozessen auftreten könnten (LOPES et al., 2012).
Wir untersuchten 300 pharmazeutische Präsentationen fotografiert (150 Paare) und präsentierten Beobachtern an verschiedenen Tagen, und die Beobachter, die an der Studie teilnahmen, waren zwei Krankenschwestern und ein Apotheker (LOPES et al., 2012).
Die pharmazeutischen Präsentationen der Studienprobe umfassten Referenzmedikamente, Generika, ähnliche Medikamente und Arzneimittel mit Verpackungen des Gesundheitsministeriums. Pharmazeutische Formen und Präsentationen, Verpackungsarten, Name, Farbe, Design, pharmakologische Klasse, Lieferanten und Risikopotenzial wurden analysiert; potenziell gefährliche Arzneimittel und kontrollierte Arzneimittel (LOPES et al., 2012).
Für die Auswahl von Proben wurden Referenzmedikamente, Generika, ähnliche Medikamente und Arzneimittel mit Verpackungen des Gesundheitsministeriums berücksichtigt. Bei Auftreten von Ähnlichkeiten wurden die Daten in eine Datenbank eingegeben und aus internationalen Referenzen wie dem National Coordinating Council for Medication Error Reporting and Prevention (NCCMERP, 2017) charakterisiert.
Nach der Präsentation der Fotos an die Beobachter, der Sammlung der von ihnen erhaltenen Antworten und der Analyse der Daten mit statistischen Methoden fanden die Forscher folgende Ergebnisse: In Bezug auf die Art der Medikamente waren 43 % der ähnlichen Packungen von ähnlichen Medikamenten, 21,33 % der Referenzmedikamente und 18 % der Generika; und unter den 24 pharmakologischen Klassen waren 28% antimikrobielle Mittel, 10,67% Anästhetika und 6,67% antihypertensiv (LOPES et al., 2012).
Ähnlichkeiten wurden auch in Bezug auf die gedruckten Daten, der Designer, Farbe der Etiketten, Verpackung mit der gleichen Farbe gefunden. Die Forscher identifizierten dies; in der analysierten Stichprobe hatten 50 % der Primärpakete und 44 % der Sekundärverpackungen die gleiche Farbe (LOPES et al., 2012).
Die Untersuchung der in dieser Forschung untersuchten pharmazeutischen Präsentationen zeigte auch, dass bei der Gesamtzahl der möglicherweise ähnlichen Medikamente 51,33 % kleinvolumige parenterale Lösungen wie Ampullen, Fläschchen und geschlossene Beutel waren, was den Einfluss des Themas etikettieren und verpacken von Medikamenten auf die Fähigkeit, Medikationsfehler zu ermöglichen, zeigt (LOPES et al., 2012).
Als Darstellung des Beobachtungsproblems, das in dieser Forschung vorgestellt wurde, haben wir versucht, beispielsweise einige Etiketten und ähnliche Verpackungen von Arzneimitteln zu identifizieren. Einige Bilder wurden bei der Suche auf Websites gefunden.
Das Gesundheitsministerium aktualisierte 2016 das Handbuch zur visuellen Identität von Arzneimittelverpackungen, in dem die Kriterien für die Entwicklung und Identifizierung der vom Unified Health System vertriebenen Kennzeichnung von Arzneimitteln festgelegt wurden.
Abbildung 1 zeigt injizierbare Medikamente, die vom Gesundheitsministerium zur Verwendung im UNIFIED HEALTH SYSTEM (SUS) hergestellt und vertrieben werden, und stellt die Ähnlichkeit bei der Kennzeichnung von zwei verschiedenen Arten von Insulinen dar, deren möglicher Austausch den Patienten gefährden kann, wenn es eine fehlerhafte Verabreichung von normalem Humaninsulin (Verpackung auf der linken Seite des Bildes) anstelle von Humaninsulin NPH (auf der rechten Seite des Bildes) gibt.
Abbildung 2 zeigt ähnliche Packungen von Medikamenten mit kontrollierten Substanzen, die als Antikonvulsiva klassifiziert sind, die häufig verwendet werden, um die Auslösung von Anfällen bei Patienten mit Epilepsie zu verhindern. Der auf der Unterseite der Verpackung eingravierte Herstellername war absichtlich mit schwarz gekennzeichnetem Zeichen überzogen, um die Marke nicht zu entlarven und mögliche Fragen hinsichtlich der Interessen dieser Forschung zu vermeiden.
Abbildung 1. Ähnliche Insulinverpackung und das Potenzial für Medikationsfehler.

Abbildung 2. Ähnliche Pakete von Antikonvulsiva in Brasilien hergestellt.

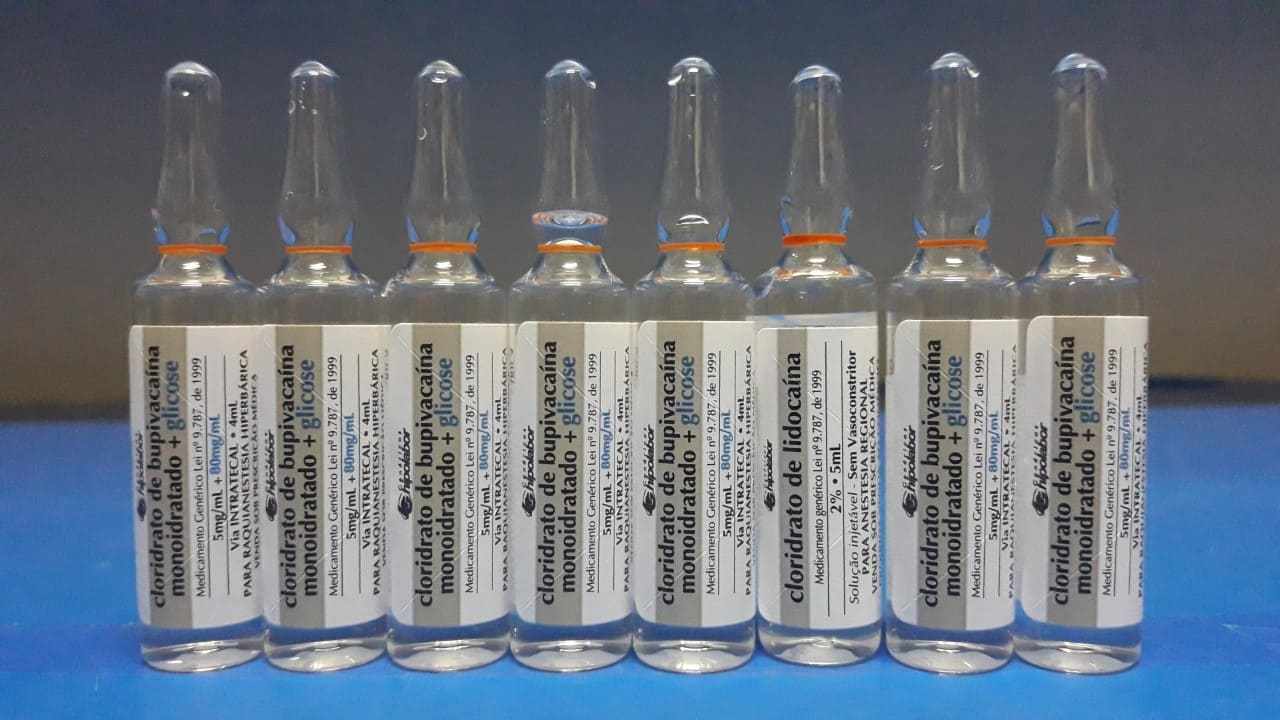
Eine weitere Ähnlichkeit bei der Kennzeichnung von Arzneimitteln wurde vom Autor dieser Forschung identifiziert, während er für die pharmazeutische Hilfe in einem Krankenhaus in der Stadt Votorantim, im Bundesstaat Sao Paulo, Brasilien, aus der Beobachtung des Apothekenbestands des Operationssaals, in den Boxen (genannt “Psychobox”) verantwortlich war, die für die Verwendung durch Anästhesisten in den Operationssälen bestimmt waren, wo das Team das Auftreten von Verwaltungsfehlern zwischen Lidocain und Bupivaberichtete meldete.
Die Injizierungen von injizierbaren Medikamenten von Lidocain und Bupivacain in den Boxen wurden analysiert und präsentierten Ähnlichkeitspotenzial, um Medikationsfehler zu induzieren, sowohl für die Abgabe als auch für die Verabreichung bei Patienten in chirurgischen Eingriffen.
Bemerkenswert ist, dass die Ampullen dieser beiden Stoffe das gleiche Unternehmen wie der Hersteller haben und zur Beobachtung der Ähnlichkeit empirisch mehrere dieser Ampullen neben die Einführung einer Ampulle unterschiedlicher Substanz gestellt wurden, unter anderem zur Analyse des Potentials für Ähnlichkeit. Die nachstehenden Abbildungen 3 und 4 zeigen die beschriebene Situation.
Abbildung 3. Injizierbare Medikamente, die in chirurgischen Verfahren und Aspekten der Etikettierung verwendet werden.

Abbildung 4. Vergrößertes Foto. Injizierbare Medikamente, die in chirurgischen Verfahren und Aspekten der Etikettierung verwendet werden.
Eine weitere Studie, die in der Zeitschrift des Israelischen Instituts für Lehre und Forschung Albert Einstein veröffentlicht wurde, versuchte zu zeigen, dass Farben bei der visuellen Identifizierung von Augentropfen helfen, die falsche Verabreichung von Augentropfen zu reduzieren. Die Etiketten der Verpackung der getesteten Produkte wurden entfernt und die Identifizierung von Augentropfen wurde von den Patienten aus der charakteristischen Farbe jeder Präsentation gefördert. Die Forscher kamen zu dem Schluss, dass die Färbung der Wirkstoffsubstanz bei der Visualisierung und Identifizierung von Medikamenten helfen kann (COSTA et al., 2019).
Aus dieser Forschung und den zuvor vorgestellten Daten können wir empirisch verstehen, dass Farben sowohl im vorhandenen Wirkstoff als auch den Etikettierungs- und Verpackungsprozess pharmazeutischer Produkte beeinflussen könnten.
Verschiedene Farben, die in den Prozessen der Entwicklung von Verpackungsmaterial verwendet werden, um die Unterscheidung der Etikettierung zu verbessern, wie Ampullen, Fläschchen, Beutel parenteraler Lösungen, Glaswaren, Blasen, unter anderem, verringerten die Möglichkeit Fehler pro Austausch.
4. DIE VERWENDUNG VON LACTOSE AS A PHARMACEUTICAL EXCIPIENT
In den Studien zur Entwicklung neuer pharmazeutischer Formeln werden die biopharmazeutischen und physikalisch-chemischen Eigenschaften der aktiven und hilfssamen Inhaltsstoffe analysiert. Pharmazeutische Formen erfordern Hilfsstoffe, um in Prozessen wie Löslichkeit, Kompression zu unterstützen, zu konservieren, Volumen, Form, um das Medikament und geben angenehmen Geschmack der Formulierung, um die Verbraucherakzeptanz zu verbessern (AULTON, 2016).
Lactose ist ein Disaccharid-Kohlenhydrat, das zu den Arten von Hilfsstoffen gehört, die häufig von der Industrie verwendet werden und sich als Verdünnungsmittel und Süßungsmittel, insbesondere in festen pharmazeutischen Formen, darstellen und auch in pharmakokinetische Eigenschaften eingreifen können. Eine Kontraindikation für die Verwendung dieses Hilfsstoffes in pharmazeutischen Präparaten wäre die Tatsache, dass einige Menschen eine Laktoseintoleranz haben (AULTON, 2016; 1475).
Laktose-Intoleranz ist ein Zustand des Organismus, wo es die Unfähigkeit der Verdauung dieses Kohlenhydrates aufgrund eines Mangels des Verdauungsenzyms Laktase, die Lactose in Glukose und Galaktose verwandelt, als ein Zustand, der Lebensprobleme der Menschen weltweit verursacht (PEREIRA; FERREIRA; MARQUES, 2019).
Menschen, die mit dieser Erkrankung anwesend sind, leiden an Magen-Darm-Beschwerden, wie die Entwicklung von längeren schweren Durchfall, Blähungen, Krämpfe, Bauchschwellung und Dehydrierung, die sie nicht milch und andere Milchprodukte zu konsumieren (PERREIRA; FERREIRA; MASQUES, 2019).
Patienten mit Laktose-Intoleranz sind Nebenwirkungen ausgesetzt, die sich aus der Verwendung von Medikamenten ergeben, die diesen Hilfsstoff enthalten, und können ähnliche Symptome entwickeln wie beim Verzehr von Lebensmitteln, die diesen Zucker enthalten, da die Aufnahme der Menge von etwa 3 Gramm bereits die beschriebenen Symptome hervorrufen kann (SENA et al., 2014).
Eine am Pharmakovigilanz-Zentrum von Cearé beschriebene Studie zielte darauf ab, die Existenz möglicher Hilfsstoffe zu identifizieren, die Nebenwirkungen in 12 Produkten (35 pharmazeutische Präsentationen) mit dem höchsten Verkauf in Brasilien hervorrufen, und die Probe wurde von August bis September 2004 gesammelt (SILVA et al., 2008).
Lactose war unter den pharmazeutischen Hilfsstoffen in den untersuchten Produkten enthalten, wie in der Formulierung, die Bromazepam (kontrollierte Substanz, deren Erwerb erfordert spezifische Verschreibung) und Dipyron im Zusammenhang mit Butylschopolamin (SILVA et al., 2008).
Eine weitere beschreibende Studie mit einer bibliographischen Untersuchung der Zusammensetzung von Arzneimitteln durch die Packungsbeilage und die in ANVISA aufgezeichneten technischen Informationen bewertete das Risiko möglicher Hilfsstoffe, die Nebenwirkungen in kontrazeptiven Medikamenten verursachen. Die Probe war durch 6 kontrazeptive Präsentationen gekennzeichnet, von denen 3 Referenzmedikamente waren und 3 ähnlich waren, und in allen von ihnen wurde das Vorhandensein von Lactose in der Zusammensetzung gefunden (DE CASTRO et al., 2010).
Forschung mit Medikamenten oft pädiatrischen Patienten verschrieben analysiert auch das Vorhandensein von Laktose in 181 verschiedenen Präsentationen von 42 Medikamenten. Die gefundenen pharmakologischen Gruppen waren: Analgetika/Antipyretika, nichtsteroidale entzündungshemmende Medikamente, Antibiotika, Antihistaminika, Antiemetika, orale Kortikosteroide, inhalierte Kortikosteroide, lang wirkende Bronchodilatatoren, inhalierte Kortikosteroide im Zusammenhang mit Bronchodilatatoren, Antileurienkotes und Mastzellmembranstabilisatoren. In Bezug auf das Vorhandensein von Laktose enthielten 28% der Präsentationen diesen Hilfsstoff (GERMANA, et al. 2009).
Die verifizierten Studien zeigen Daten, die das Vorhandensein von Laktose in einem beträchtlichen Prozentsatz unter den analysierten Produkten identifizieren. Derzeit gibt es in Brasilien keine Gesetzgebung, die Arzneimittelhersteller reguliert, um auf der Außenseite der Verpackung die Informationen hinzuzufügen, dass das Medikament den Hilfsstoff Lactose präsentiert.
Sekundäre Arzneimittelverpackungen stehen in direktem Kontakt mit dem Produkt und werden von der Laienpopulation in der pharmazeutischen Gesetzgebung häufig als die externe und erste visuell identifiziert: “die Arzneimittelbox”. Angesichts der Tatsache, dass in der Etikettierung von Arzneimitteln durch Rechtsvorschriften bereits andere Warnhinweise über Farbstoffe eingefügt wurden, wie z. B. Tartazin, wäre es interessant, die Warnung auch auf Deraußen zu verwenden, was die Identifizierung erleichtert.
Die Etikettierung könnte Menschen mit Laktoseintoleranz helfen, bessere Entscheidungen über die Wahl und den Kauf ihrer Medikamente zu treffen. Ein Gesetzentwurf, der dem Repräsentantenhaus im Jahr 2009 vorgelegt wurde, sah vor, dass pharmazeutische Laboratorien arzneimittelabhängig auf Arzneimitteletiketten einzufügen müssen, die vor der Zusammensetzung ihrer Produkte von Lactose warnen. Obwohl das Thema des Gesetzes für die sichere und rationelle Verwendung von Arzneimitteln relevant ist, wurde der Vorschlag analysiert und im Jahr 2013 eingereicht.
5. DAS RECHT AUF ZUGANG ZU GESUNDHEITSINFORMATIONEN UND DIE ETIKETTIERUNG VON ARZNEIMITTELN
Gesundheit ist das Recht aller und die Pflicht des Staates, die durch eine sozial- und wirtschaftspolitische Politik gewährleistet wird, die darauf abzielt, das Risiko von Krankheiten und anderen Verletzungen zu verringern, sowie einen universellen und gleichberechtigten Zugang zu Maßnahmen und Dienstleistungen für seine Förderung, seinen Schutz und seine Wiederherstellung (BRASIL, 1988).
Das Recht auf Gesundheit wird in den Anwendungsbereich verfassungsrechtlich garantierter sozialer Rechte aufgenommen (BRASIL, 1988). Basierend auf der Bundesverfassung als Grundsatz, das Recht auf Gesundheit und Information aus diesem Recht hervorzuheben, ist es Aufgabe der brasilianischen Regulierungsbehörde als integraler und repräsentativer Bestandteil des Gesundheitsministeriums, Initiativen zu ergreifen, die den Zugang zur Bevölkerung zu den für sie relevanten Gesundheitsfragen entwickeln und sicherstellen.
Das Gesetz nr. 8080/1990, das das Einheitliche Gesundheitssystem schafft, setzt diese in der brasilianischen Bundesverfassung enthaltene Erklärung wieder auf und bekräftigt, dass Gesundheit ein Grundrecht des Menschen und die Pflicht des Staates ist, die grundlegenden Umstände für seine volle Ausübung zu schaffen, und der Staat muss auch die Gesundheit garantieren, indem er Bedingungen festlegt, die den Zugang gewährleisten, aber es macht deutlich, dass die Pflicht des Staates nicht die Verantwortung der Menschen, der Familie, der Unternehmen und der Gesellschaft in Gesundheitsfragen ausschließt. (BRASILIEN, 1990).
In einem Krankenhausumfeld werden Medikamente häufig in der Apotheke gelagert und die Abgabe wird von Fachleuten durchgeführt, die in der Branche arbeiten, wobei der Apotheker das Teammitglied ist, das für alle Aktivitäten verantwortlich ist, die innerhalb der Krankenhausapotheke entwickelt wurden. Die optisch deutliche Kennzeichnung anderer Produkte ermöglicht die korrekte Identifizierung des Arzneimittels zum Zeitpunkt der Abgabe und verhindert Fehler bei der Verabreichung von Arzneimitteln durch medizinisches Fachpersonal.
In Apotheken und Drogerien können Arzneimittel vom Benutzer selbst oder einer anderen vom Benutzer angeforderten Person gekauft werden und Arzneimittel gekauft werden, die im Selbstbedienungsbereich zur Verfügung gestellt werden und als MIPs (Non-Prescription Drugs) bekannt sind, Medikamente, die von einem dafür qualifizierten Arzt verschrieben werden müssen, einschließlich kontrollierter Medikamente, deren Verschreibung in der Einrichtung, die das Produkt ausgibt, beibehalten wird.
Bei Nebenwirkungen, die beispielsweise von Patienten mit Laktose-Intoleranz verursacht werden, ist das Recht auf Zugang zu Gesundheitsinformationen unerlässlich. In Anbetracht, dass viele Medikamente Lactose als Hilfsstoff enthalten, einschließlich kontrollierter Medikamente, wenn der Benutzer kommt, um eine unerwünschte Reaktion auf das Medikament zu entwickeln, weil es Lactose enthält, wird dieses Produkt wahrscheinlich unbrauchbar sein und der Patient muss den Verschreibenden für ein anderes Rezept fragen, um einen neuen Kauf zu tätigen. Solche Fälle könnten mit Warnhinweisen auf der Verpackung vermieden werden, da die Informationen über Hilfsstoffe nur in Bullium eingefügt werden.
Medikamente sind in verschiedenen Umgebungen erhältlich, werden aber zum gleichen Zweck der Prävention, Heilung, Linderung von Symptomen oder zur Unterstützung bei der Diagnose von Krankheiten verwendet. Wenn wir diese Prämissen verstehen, können wir erkennen, dass die Informationen über diese Produkte die Benutzer effizient erreichen müssen, um eine sichere Verwendung und ohne zusätzliche Risiken zu gewährleisten, zusätzlich zu den bekannten und bereits in der Packungsbeilage manifestierten.
Informationen über Produkte, insbesondere im Zusammenhang mit der Gesundheit, sollten angemessen und klar sein, um alle Beweise, die die Sicherheit in Bezug auf die Verwendung gewährleisten, genau darzustellen, wie in Artikel 6 des Verbraucherschutzgesetzes (BRASIL, 1990) vorgesehen.
Gesundheitsvorschriften sind der Weg, um dieses Recht für die Verbraucher von Arzneimitteln zu etablieren und zu garantieren. Darüber hinaus hätte die pharmazeutische Industrie von der Bereitstellung effizienterer Informationen über die Etikettierung zusätzlich zu den in den geltenden Rechtsvorschriften geforderten Informationen viel zu gewinnen, da Produkte, die einen Mehrwert für die Verbrauchersicherheit und die Verschreibungssicherheit durch Gesundheitsberufe, die Arzneimittel verschreiben, erhöhen, eine größere Möglichkeit der Verschreibung und des Verkaufs hätten.
Die industrielle Entwicklung von Verpackungsmaterial und das Recht auf Gesundheitsinformationen sollten miteinander verknüpft werden. Wenn man bedenkt, dass Angehörige des Gesundheitswesens oft lange Arbeitszeiten am Tag arbeiten, stellen ähnliche Verpackungen ein Risiko für eine fehlerhafte Verabreichung dar und arbeiten nicht zusammen, um die Sicherheitskriterien bei der Verwendung von Medikamenten zu erfüllen.
Änderungen bei der Etikettierung und Verpackung von Medikamenten könnten das Auftreten von Medikamentenfehlern minimieren, Menschen mit Laktose-Problemen auf Nebenwirkungen aufmerksam machen und die rationelle Verwendung von Medikamenten fördern, um direkte Gesundheits- und Gesundheitsinformationen zu gewährleisten.
6. ABSCHLIEßENDE ÜBERLEGUNGEN
Nach der Analyse der Hygienestandards für die Etikettierung und Verpackung von Arzneimitteln konnten allgemeine Konzepte und Empfehlungen für die Entwicklung der Etikettierung gefunden werden, und es wurde festgestellt, dass es keine spezifischen Vorschriften gab, um mögliche Medikationsfehler aus Etiketten und ähnlichen Verpackungen zu verhindern.
Gleichzeitig fand kein Hygienestandard die Bestimmung der brasilianischen Regulierungsbehörde über die Verpflichtung der Pharmaindustrie, die Informationen “CONTAINS LACTOSE” in die Verpackung und die Etiketten von Arzneimitteln einzufügen, in denen Gesundheitsfachleute und Patienten über die Zusammensetzung der pharmazeutischen Formel direkt in der Sekundärverpackung angegeben wurden: “außerhalb der Schachtel”.
Die Kosten für Gesundheitssysteme weltweit, die durch Medikationsfehler und Nebenwirkungen entstehen, sind hoch, und die Folgen der Ähnlichkeit und des Mangels an Informationen über Hilfsstoffe in Etiketten und Verpackungen tragen zu höheren Ausgaben bei und erhöhen die Möglichkeit, die Gesundheit aller zu gefährden.
Medikationsfehler und unerwünschte Ereignisse, die sich aus der Kennzeichnung und Verpackung von Arzneimitteln ergeben, müssen von den Gesundheitsbehörden und ANVISA, einer mit dem Gesundheitsministerium verbundenen Agentur, untersucht werden, um Lösungen für das in dieser Forschung hervorgehobene Problem zu finden und zu versuchen, Wege zu finden, um die rationelle Verwendung von Arzneimitteln zu fördern, die mit der Entwicklung von Etiketten und Verpackungen durch die pharmazeutische Industrie besser als kommerziell in Einklang stehen.
Das Auftreten dieser Situation hat die pharmazeutische Industrie offenbar nicht dazu bewegt, Projekte zu entwickeln, um neue Lösungen zu entwickeln, die die Standardisierung von Verpackungen und Etiketten von Arzneimitteln ermöglichen, wobei zu vergessen ist, dass die Qualitätsparameter zur Erfüllung guter Herstellungspraktiken von den Studien über die Entwicklung und Herstellung pharmazeutischer Formen bis hin zur Kontrolle von Qualität und Sicherheit bei der Verwendung nach dem Inverkehrbringen eingehalten werden sollten.
Einfache Maßnahmen der Arzneimittelindustrie könnten das Leben von Patienten und Angehörigen der Gesundheitsberufe im Arzneimittelmanagement verbessern. Die Verwendung unterschiedlicher Farben zur Unterscheidung der Arzneimittelkennzeichnung, insbesondere von Arzneimitteln mit mittelschwerem bis schwerem Wechselwirkungspotenzial, und die Verwendung einer spezifischen Warnphrase für Lactose-Produkte direkt nach außen in Arzneimittelverpackungen könnten Fehler vermeiden und den Zugang zu relevanten Informationen erleichtern.
Diese Forschung soll dazu beitragen, dass weitere Studien entwickelt werden, und es werden Maßnahmen zu diesem Thema sowohl von öffentlichen Einrichtungen als auch von der pharmazeutischen Industrie ergriffen, um Debatten zu ermöglichen und Lösungen zu finden.
Zunächst liegt es an der National Health Surveillance Agency als der für die Entwicklung der Gesundheitsförderung zuständigen Stelle, der Rolle der Neuanalyse der geltenden Rechtsvorschriften über die Kennzeichnung und Verpackung von Arzneimitteln und der Veröffentlichung neuer normativer Rechtsakte, die die in dieser Forschung vorgestellten Probleme lösen.
Etiketten und Verpackungen waren die Ursache für Medikationsfehler und damit verbundene Nebenwirkungen. Die Gesundheitsregulierung ist der Weg zur Prävention und Minimierung drogenbedingter Probleme.
7. REFERENZEN
ANACLETO, Tânia Azevedo et al. Erros de medicação e sistemas de dispensação de medicamentos em farmácia hospitalar. Clinics. São Paulo, v. 60, n. 4, p. 325-332, ago. 2005. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1807-59322005000400011&lng=pt&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S1807-59322005000400011.
ANVISA, 2019. Registro de medicamentos cresce 100%. Disponível em: <http://portal.anvisa.gov.br/noticias/-/asset_publisher/FXrpx9qY7FbU/content/registro-de-medicamentos-cresce-100-em-2019/219201?p_p_auth=fJVL8wqt&inheritRedirect=false>. Acesso em: 06 jan. 2020.
ARAUJO, Ana Carolina; BORIN, Maria de Fátima. Influência de excipientes farmacêuticos em reações adversas a medicamentos. Brasília Med. 2012;49(4):267-278. Disponível em: <https://pdfs.semanticscholar.org/e5a3/9e36b11ae4dc9336d3bd033fe80cd45f2df1.pdf>. Acesso em: 15 jan. 2020.
AULTON, Michael E. Aulton delineamento de formas farmacêuticas. Michael E. Aulton, Kevin M. G. Taylor; [tradução Francisco Sandro Menezes]. Versão digital – 4 ed. – Rio de Janeiro: Elsevier, 2016.
BRASIL, 1988. Constituição da República Federativa do Brasil. Disponível em: <http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm>. Acesso em: 20 nov. 2019
BRASIL, 1990. Lei nº 8.078, de 11 de setembro de 1990. Dispõe sobre o Código de Defesa do Consumidor. Disponível em: <http://www.planalto.gov.br/ccivil_03/leis/l8078.htm>. Acesso em 17 dez. 2019.
BRASIL, 1999. Lei nº 9.782, de 26 de janeiro de 1999. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2006/prt0354_11_08_2006.html>. Acesso em: 15 de jan. de 2020.
BRASIL, 2016. Manual de Identidade Visual de Medicamentos do Ministério da Saúde. Disponível em: < https://www.saude.gov.br/artigos/672-assuntos/assistencia-farmaceutica/42827-arquivos-do-manual-de-identidade-visual-de-medicamentos>. Acesso em: 22 jan 2020.
BRASIL, 2003. Resolução RDC nº 333, de 19 de novembro de 2003. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2003/rdc0333_19_11_2003.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 71, de 22 de dezembro de 2009. Disponível em: <http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2009/res0071_22_12_2009.html>. Acesso em: 23 nov. 2019.
BRASIL, 2015. Lei nº 13.236, de 29 de dezembro de 2015. Disponível em: <https://www2.camara.leg.br/legin/fed/lei/2015/lei-13236-29-dezembro-2015-782195-publicacaooriginal-149108-pl.html>. Acesso em: 27 out. 2019.
BRASIL, 2019. Resolução RDC nº 301, de 21 de agosto de 2019. Disponível em: <http://www.in.gov.br/web/dou/-/resolucao-rdc-n-301-de-21-de-agosto-de-2019-211914064>. Acesso em 14 dez. 2020.
COSTA, Ana Luiza Fontes de Azevedo et al. Quando a cor ajuda. Einstein (São Paulo), São Paulo, v. 17, n. 1, eAO4410, 2019. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1679-45082019000100200&lng=en&nrm=iso>. Acesso em 29 nov. 2019. Epub Dez 17, 2018. http://dx.doi.org/10.31744/einstein_journal/2019ao4410.
DE CASTRO, Ana Luiza Ferreira Meinen; AHLERT, Elias Ricardo; COLET, Christiane de Fátima. Avaliação do risco de reações adversas causadas por excipientes em formulações de anticoncepcionais. Revista Contexto & Saúde, v. 10, n. 19, p. 146-149, 14 jun. 2013. Disponível em: <https://www.revistas.unijui.edu.br/index.php/contextoesaude/article/view/1496>. Acesso em: 15 nov. 2019.
GERMANA, Stefani P. et al. Presença de corantes e lactose em medicamentos: avaliação e 181 produtos. Rev. bras. alergia imunopatol; v. 32, v.1, p. 18-26, jan.-fev. 2009. Disponível em: < http://www.sbai.org.br/revistas/Vol321/ART%201-09%20-%20Presen%C3%A7a%20de%20corantes%20e%20lactose.pdf>. Acesso em: 15 jan. 2020.
ISMP, 2018. Estratégias de segurança do paciente no Brasil – O que já foi feito e o que ainda está por vir?. Disponível em: <https://www.ismp-brasil.org/site/wp-content/uploads/2019/05/A—-es-da-Anvisa-com-foco-seguran–a.pdf>. Acesso em: 22 jan. 2020.
LOPES, Diana Maria de Almeida et al. Análise da rotulagem de medicamentos semelhantes: potenciais erros de medicação. Rev. Assoc. Med. Bras., São Paulo, v. 58, n. 1, p. 95-103, fev. 2012. Disponível em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42302012000100021&lng=en&nrm=iso>. Acesso em: 29 nov. 2019. http://dx.doi.org/10.1590/S0104-42302012000100021.
National Coordinating Council for Medication Error Reporting and Prevention. What is a medication error? Nova York: National Coordinating Council for Medication Error Reporting and Prevention; 2015. Disponível em <http://www.nccmerp.org/aboutmedication-errors>. Acesso em 20 de jan. 2020.
PEREIRA, Leandra Gonçalves; FERREIRA, Michelle Silva; MARQUES, Fabíola Pedrosa Peixoto, 2019. Intolerância à lactose e os aspectos legais da rotulagem. Disponível em: <http://anais.unievangelica.edu.br/index.php/latosensu/article/view/4526>. Acesso em 15 jan. 2020
PESSANHA, Ana Flávia de Vasconcelos et al. Influência dos excipientes multifuncionais no desempenho dos fármacos em formas farmacêuticas. Rev. Bras. Farm. 93(2): 136-145, 2012. Disponível em: <http://www.rbfarma.org.br/files/rbf-2012-93-2-2.pdf>. Acesso em: 15 jan. 2020
SENA, Cristina Santana et al. Excipientes farmacêuticos e seus riscos à saúde: uma revisão da literatura. Rev. Bras. Farm. 93(2): 136-145, 2014. Disponível em: <http://www.sbrafh.org.br/v1/public/artigos/2014050405000621BR.pdf>. Acesso em: 15 jan. 2020
SILVA, Antonio Vinicios Alves da et al. Presença de excipientes com potencial para indução de reações adversas em medicamentos comercializados no Brasil. Rev. Bras. Cienc. Farm., São Paulo, v. 44, n. 3, p. 397-405, set. 2008. Available from <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-93322008000300009&lng=en&nrm=iso>. Acesso em: 29 nov. 2019
WHO, 1998. Portal de informações sobre medicamentos essenciais e produtos de saúde. Relatório do 4º Grupo Consultivo da OMS sobre o papel do farmacêutico. Disponível em: <https://apps.who.int/medicinedocs/en/d/Jwhozip32e/>. Acesso em: 15 jan. 2020.
WHO, 2017. O terceiro desafio global da segurança do paciente da OMS: medicação sem danos. Disponível em: <https://www.who.int/patientsafety/medication-safety/campaign/en/>. Acesso em 06 jan. 2020.
[1] Postgraduierter in Pharmazeutischem Industriemanagement von der Universität Estécio de Sé, Abschluss in Pharmazie-Biochemie an der Universidade Paulista – UNIP.
Eingesandt: März 2020.
Genehmigt: Juni 2020.


