ARTIGO DE REVISÃO
REIS, Ariadna Jihani Damasceno Vidal de Santana [1], ANJOS, Maria Clara Mota Nobre dos [2], CAVALCANTI, Bruna Luiza de Mendonça [3], SANTOS, Ketully Stefane Chaves dos [4], DINIZ, Maria Celeste Campello [5]
REIS, Ariadna Jihani Damasceno Vidal de Santana. Et al. Trastorno de estrés postraumático como desencadenante de cambios epigenéticos en el cuerpo. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 08, Vol. 04, págs. 96-114. Agosto de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/cambios-epipgeneticos
RESUMEN
El trastorno de estrés postraumático (TEPT) tiene como definición diagnóstica la aparición de estrés traumático grave como factor desencadenante etiológico, y después de la exposición a este evento traumático comienza una serie variable de síntomas característicos y trastornos psicológicos, sociales y biológicos. Este artículo evalúa sistemáticamente cómo el TEPT puede influir en el eje hipotálamo-hipófisis-adrenal mediante modificaciones epigenéticas que suprimen o estimulan la expresión genética de un gen dado a través de biomarcadores. Investigación de enfoque cualitativo, con la naturaleza del tipo de revisión bibliográfica sistemática del carácter analítico. Se investigaron estudios que buscaban correlacionar el TEPT con alteraciones epigenéticas en las generaciones posteriores. La investigación fue construida a través de consultas a bases de datos NCBI: PubMed, BVS y Scielo. La información fue recopilada de 14 artículos científicos publicados entre 2009 y 2018, y los idiomas fueron delimitados al portugués y al inglés. Se observó que el TEPT es responsable de un cambio considerable en el cortisol, serotonina y sensibilidad a los receptores de glucocorticida. La revisión permitió la construcción de una síntesis de conocimiento científico sobre la asociación entre los cambios epigenéticos motivados por el TEPT en pacientes con material genético y tales modificaciones de estos genes serán transferidas a las generaciones futuras.
Palabras clave: metilación del ADN, epigenética, biomarcadores, trastornos de estrés postraumático.
1. INTRODUCCIÓN
El trastorno de estrés postraumático (TEPT) se define como un conjunto de signos y síntomas psíquicos, físicos y emocionales que causan un trastorno de ansiedad. El TEPT es responsable de un cambio considerable en el cortisol, la serotonina y la sensibilidad a los receptores de glucocorticoides (RGS). Por lo tanto, se desarrolla en el individuo que fue una víctima o testigo de una situación traumática que presentaba una amenaza a su integridad o a la de las personas que lo rodeaban. Este trastorno provoca cambios hormonales relacionados con el eje hipotalámico-hipófisis-adrenal (HPA) y en la expresión de cierto gen (VUKOJEVIC et al., 2014). Mientras tanto, la relación entre el estrés, el TEPT y la epigenética se hace evidente, porque incluso si no implica el cambio en sí mismo en la secuencia del código genético, hay alteraciones que pueden afectar la estimulación o inhibición de la expresión génica de cierta información. Tales cambios son la metilación del ácido desoxirribonucleico (ADN) y los cambios en las histonas que presentan el papel del desarrollo normal y son cruciales para el desempeño de la programación correcta de la expresión génica.
En este artículo, discutiremos principalmente el proceso de metilación del ADN de los principales genes de RGS, mineralocorticoides (MR) y serotonina (HTR3A) que promueve una adaptación al cuerpo y la influencia en la susceptibilidad a enfermedades que en consecuencia también se propagarían las próximas generaciones.
Los genes HTR3A, NR3C1, NR3C2 y FKBP5 se centrarán en este artículo. En primer lugar, la hipermetilación del gen NR3C1 da como resultado su baja expresión y disminución de los niveles de cortisol. NR3C2 es responsable de la caída en los niveles de RM Y, en consecuencia, de la disminución en la cantidad de corticotropina. Este proceso se produce a través de la metilación del gen que expresa NR3C2 (PERROUD, 2014). HTR3A puede estar asociado con la modificación en las estructuras cerebrales centrales para el procesamiento de las emociones, especialmente cuando estas estructuras están expuestas al estrés. También es notable la influencia potencial del sistema serotonérgico en la fisiopatología de trastornos afectivos, como el teptográfico. Por último, FKBP5, que actúa como co-chaperona, modulando la actividad de RG en rFRGFespuesta a los estresores durante el embarazo y también está relacionada con la exposición al trauma genera la posibilidad de que el niño ya nazca con un mecanismo más adaptado y propenso a desarrollar depresión y TEPT (PAQUETTE et al., 2014); (SCHECHTER et al., 2016).
1.1 EPIGENÉTICA
El término epigenética significa “además de la información genética codificada en el ADN” y se utiliza genéricamente para definir los cambios que se producen en la expresión génica sin, sin embargo, ninguna alteración en la secuencia del código genético (COSTA et al., 2013).
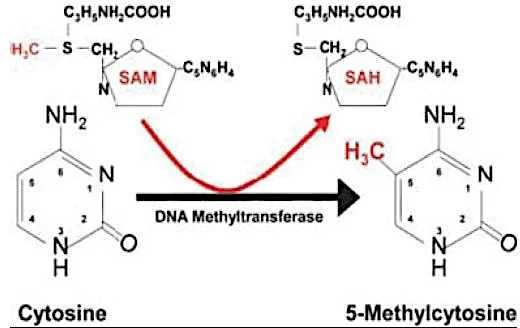
Algunos mecanismos epigenéticos incluyen metilación del ADN, impresión, cambios en la conformación de la cromatina y silenciamiento mediado por el ARN. La metilación del ADN es la modificación epigenética más utilizada por la mayoría de los seres vivos como agente de regulación de la expresión génica, y puede caracterizarse como un factor de silenciamiento del gen. Consiste en la adición de un radical metilo (CH3) al carbono 5 de la citosina, generalmente seguido de guanina (dinucleótido CpG), catalizada por enzimas metiltransferasas de ADN (DNMTs) (COSTA et al., 2013); (AMLI et al., 2016).
Figura 01. Metilación de citoquinas.
1.2 AJUSTE DEL EJE DE HPA
La actividad del eje HPA se rige por la secreción de HLC – hormona corticotrófica y liberadora de vasopresina (AVP) – por el hipotálamo, que a su vez activa la secreción de la hormona adrenocorticotrófica (ACTH) por la glándula pituitaria, que en última instancia estimula la secreción de glucocorticoides a través de la corteza suprarrenal. En este punto de vista, los glucocorticoides interactúan con sus receptores en múltiples tejidos diana, incluyendo el propio eje HPA, donde son responsables de inhibir la retroalimentación negativa de la secreción de ACTH por la hipófisis y HLC del hipotálamo (JURUENA et al., 2004).
Aunque los glucocorticoides ajustan las funciones de casi todos los tejidos del cuerpo, el efecto fisiológico más conocido de estas hormonas es la regulación del metabolismo energético. En este contexto, varios factores controlan la actividad del eje hpa. Además, hay evidencia de catecolaminargic directa, inervación serotoninérgica y dopaminérgica en las neuronas productoras de HLC en el hipotálamo y estos y otros neurotransmisores parecen influir en la liberación de HLC. Por ejemplo, la serotonina ejerce una influencia estimulante sobre hlC a través de subtipos de receptor 5-HT1A, 5-HT1B, 5-HT1C y 5-HT2. La noradrenalina tiene un efecto más variable, siendo estimulador en dosis bajas (a través de receptores alfa 1) e inhibición en dosis altas (a través de receptores beta) (JURUENA et al., 2004).
Este artículo tenía como objetivo descubrir la relación epigenética de la expresión génica en el TEPT a través de los biomarcadores antes mencionados. A partir del estudio de estos, se investigó su interacción con la regulación y el rendimiento en el eje hipotálamo-hipófisis-adrenal. Finalmente, tratamos de entender cómo actuarán esos cambios en la transferencia de estos genes a las generaciones futuras.
2. METODOLOGÍA
La investigación fue desarrollada con un enfoque cualitativo, que se justifica al permitir el despreostez del mundo investigado con la profundización de los datos científicos, lo que permite una mejor comprensión y análisis del objeto de investigación. La naturaleza del estudio consistió en una revisión sistemática de la literatura de carácter analítico. Justificarse por ayudar en la construcción de un amplio análisis de la literatura, contribuyendo como reflejo a la realización de futuros estudios. El sesgo estaba delimitado con los descriptores de estrés y epigenética. Un total de 77.937 artículos fueron utilizados para su consulta en la Biblioteca Virtual, tales como Lilacs, biblioteca virtual de salud (VHL), Scielo y MEDLINE a través de Pubmed, un total de 77.937 artículos que se sometieron a una nueva revisión realizada mediante la lectura de los títulos que también permitían un criterio de inclusión que sería el artículo relativo al PTSD; esta revisión preliminar excluyó 76.359 artículos.
Leyendo el título bajo el criterio de estar relacionado con el TEPT. Estos filtros redujeron el número de artículos de unos 80.000 a 1.578 artículos. Esta sistematización de cómo se realizó la investigación se define en la figura 02.
La nueva etapa de la especificación temática incluyó la inclusión de nuevos criterios de inclusión y exclusión, tales como: raza humana, mujeres, publicaciones de hasta 5 años de edad, exclusión de artículos de revisión, de entre 19 y 44 años. Los 89 artículos resultantes de este filtrado, pasaron por un análisis en el que se eliminaba los artículos duplicados relacionados con los criterios de exclusión e inclusión, disminuyendo el número de artículos a 14 artículos que se sometieron a otro análisis que implicaba la lectura de estos artículos para que el grupo pudiera seleccionar lo que sería más relevante para un examen.
Se centró en los artículos sobre las víctimas de desastres, genocidios o eventos traumáticos a gran escala que, por lo tanto, culminaron en la exclusión de artículos que abordaban el tema, pero no correspondían a nuestros objetivos para la redacción de este artículo de revisión, sólo ocho artículos útiles para la sección temática elegida por el grupo. Los artículos elegidos se organizaron y representaron en el Cuadro 01.
Figura 02. Diagrama de flujo que demuestra la forma en que se llevó a cabo la línea de exclusión de la revisión sistemática
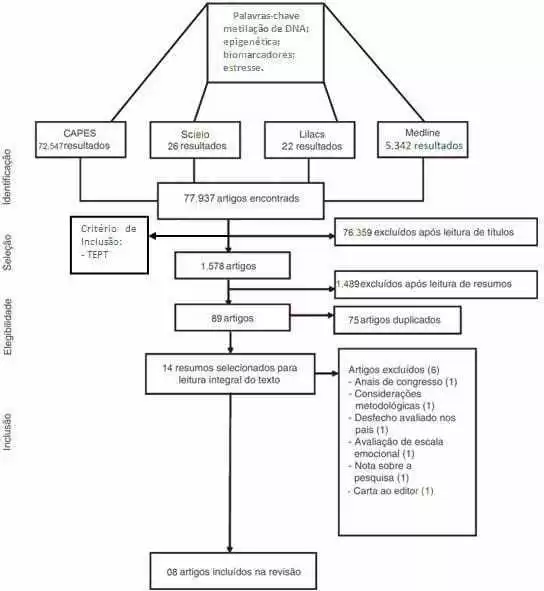
Tabla 01 Lista de autores y sus respectivos artículos y presentación de los resultados encontrados.
| Autor | Artículos | Estudio | Metas | Resultados |
| McNerney, MW et al (2018) 8 | La integración neuronal y epigenética aporta a los síntomas del trastorno de estrés postraumático : El papel del volumen del hipocampo y la metilación del gen glucocorticoides. | Artículo de investigación | El artículo busca determinar si la combinación de imágenes cerebrales y epigenéticas es un mejor predictor de la sintomatología del TEPT que cualquier factor solo.Medición del volumen del hipocampo y metilación de la citosina. | Los datos revelaron una interacción significativa entre la metilación NR3C1 y el tamaño del hipocampo. Los hallazgos fortalecen la idea de que la epigenética y la anatomía neuronal pueden utilizarse como un indicador eficaz para el TEPT |
| Schechter D.S et al (2016) | Asociación del receptor de serotonina 3A metilación con exposición a la violencia materna, actividad neuronal y agresión infantil. | Informe de investigación | El estudio en cuestión examinó si la metilación HTR3A puede estar asociada con la exposición de la madre a la violencia interpersonal (IPV), la psicopatología relacionada con el IPV, el trastorno de apego infantil y la actividad neuronal materna. |
La frecuencia de exposición al IPV materno se asoció con el TEPT materno; y el TRASTORNO materno-PTSD, a su vez, se asoció con la SOD infantil. |
| Perroud N et al (2014) | El genocidio tutsi y la transmisión transgeneracional del esfuerzo materno: epigenética y biología del eje HPA. | Artículo de investigación | El estudio de la transmisión del trastorno de estrés postraumático parental (TEPT) a la descendencia que puede explicarse por la transmisión de procesos epigenéticos, como el estado de metilación del gen NR3C1 y el receptor glucocorticoides (GR) | Hubo una correlación significativa entre la gravedad del TEPT y la depresión en las madres y la gravedad del TEPT y la depresión en sus hijos, respectivamente. |
| Paquette A.G et al (2014) | Trastorno de estrés postraumático en pacientes con trastorno bipolar: una revisión de la prevalencia, correreports y estrategias de tratamiento. | Estudio de cohortes | El estudio tiene como objetivo probar la hipótesis de que la metilación de la placenta FKBP5 y la variación genética contribuyen al control de la expresión génica, y están asociados con los resultados del neurodesarrollo infantil. | Los datos muestran que los bebés con los niveles más altos de metilación experimentarían una reducción en la expresión de FKBP5, lo que resultaría en una mayor activación del cortisol en los receptores glucocorticoides dentro de la placenta, lo que puede influir en la activación de la vía de respuesta glucocorticoides en el bebé en desarrollo. |
| Lynn M. et al (2016) | Una variante de riesgo para el teptón en todo el genoma es un locus de la característica cuantitativa de metilación y confiere disminución de la activación cortical y caras temerosas | Estudio de cohortes | Este estudio tiene como objetivo comprender el riesgo genético del TEPT. Se observó una muestra con un diseño de fenotipo extremo y casos de control con exposiciones similares. | El BSBPCohort tenía una media general de puntuaciones de síntomas de TEPT. Sin embargo, como la cohorte se desarrolló con fenotipos extremos, la gravedad de los síntomas fue mucho mayor en los casos de TEPT. |
| Vukojevic et al (2014) | La modificación epigenética del gen receptor de glucocorticoides está relacionada con la memoria traumática y el riesgo de estrés postraumático en sobrevivientes de genocidio. | Comportamiento/Cognitivo | Su objetivo es analizar los eventos traumáticos que inducen la metilación del ADN, y que proporciona cambios en los diferentes promotores de RG y modificaciones transcripcionales, además de un análisis de la regulación de la actividad cortisol. Asociando así estos factores con el eje del hipotálamo-hipófisis-hipofísica-hipofísis-adrenal en individuos con TEPT. | El análisis también reveló un efecto principal del tiempo de muestreo de cortisol. Las pruebas parciales indicaron que los niveles de cortisol fueron significativamente más bajos en el grupo de TEPT en comparación con el grupo de control para el intervalo de tiempo entre 30 y 45 minutos después del despertar (y entre 45 y 60 minutos después del despertar, los receptores de glucocorticoides fueron significativamente más bajos en TEPT en comparación con el otro grupo de comparación.) |
| Kaminsky Z et al ( 2015) | Variación epigenética y genética en el predicado de comportamiento suicida del ska2 y el trastorno de estrés postraumático. | Artículo original | El objetivo era investigar la interacción del SKA2 y la exposición al trauma en la función del eje hpa, el intento de suicidio y el TEPT | Se observó que el biomarcador epigenético y genético, SKA2, predijo casos de TEPT en civiles cuando se incorporó el abuso infantil |
| MULLIGAN C.J. et al (2012) | Metilación en NR3C1 en recién nacidos asociados con la exposición al estrés prenatal materno y al peso neonatal | Artículo integrado | El estudio tiene como objetivo poner a prueba la idea de que los factores de estrés psicosociales maternos extremos observados en la República Democrática del Congo pueden modificar las marcas epigenéticas de locus específico en el recién nacido, lo que resulta en resultados de salud alterados. | Concluyó que el aumento de la metilación puede restringir la maleabilidad de la expresión génica y restringir el rango de posibles respuestas de adaptación al estrés en los individuos afectados, aumentando así el riesgo de enfermedades con TEPT en la edad adulta. |
Fuente: Autores de la investigación (2019).
3. RESULTADOS Y DISCUSIÓN
3.1 HIPERMETILACIÓN, HIPOMETILACIÓN Y TEPT
El proceso de metilación desempeña un papel clave en el desarrollo embrionario, la inactivación del cromosoma X, la regulación genética, la impresión genómica y las modificaciones de la cromatina. Sin embargo, existen dos mecanismos para regular la expresión génica dentro del proceso de metilación: hipermetilación e hipometilación. La hipometilación del adn suele causar un aumento en la expresión génica, pero la hipermetilación disminuye la expresión de genes determinados (VUKOJEVIC, 2014).
Naturalmente, los patrones de metilación del genoma cambian con la llegada de la senescencia. La mayoría de las veces, la hipometilación ocurre de forma concomitante con la hipermetilación de algunas islas CPG distribuidas en secuencias recurrentes, así como genes transcripcionalmente importantes. Los cambios epigenéticos están directamente relacionados con el avance de la edad, contribuyendo a diversos trastornos o enfermedades adquiridas (FRAGA et al., 2005).
La exposición repetida al estrés durante la infancia predispone una reacción neurobiológica que se mantiene a lo largo de la vida del individuo, y puede afectar negativamente la salud psíquica. Estudios anteriores han demostrado efectivamente que los factores estresantes ambientales, no sólo al principio de la vida, sino también durante el embarazo, aumentan el estado de metilación del exón 1F del gen NR3C1. En el cerebro, el hipocampo es un área abundante en RGS, que también expresa el promotor NR3C1-1F. Además, hay registros de que el hipocampo es sensible al estrés a nivel bioquímico y estructural. Por lo tanto, la metilación del ADN se ha asociado con cambios en la densidad RG en el hipocampo después de la exposición al estrés ambiental. Por lo tanto, los estudios indican que, ya sea debido a la exposición al estrés y la posible pérdida del volumen del hipocampo o por el estado de hipometilación ininate combinado con un volumen inferior del hipocampo, son capaces de predisponer a un individuo al TEPT (MCNERNEY et al., 2018).
No se puede afirmar que el TEPT está asociado con el volumen del hipocampo. Aunque esta controversia puede justificarse por la razón de que no todas las variables importantes involucradas en los volúmenes del hipocampo y el TEPT fueron consideradas completamente como el mecanismo de metilación del ADN (PERROUD et al., 2014).
El rendimiento de la hipermetilación es capaz de perturbar eficazmente el equilibrio del eje HPA, lo que explica cómo los niveles de cortisol (YEHUDA et al., 2009) alterados se encuentran en los niños de sobrevivientes de desastres diagnosticados con TEPT. Por lo tanto, la epigenética puede proporcionar información importante sobre la fisiopatología del TEPT, lo que permite comprender cómo se produce la transmisión transgeneracional de este trastorno (PERROUD et al., 2014); (JURUENA et al., 2004).
Alteración epigenética en portador de ptsd y propagación para su descendencia.
Esta alteración epigenética está directamente relacionada con el eje HPA, que es básicamente responsable de la regulación neuroendocrina de los procesos fisiológicos. Sin embargo, para una persona con TEPT, el funcionamiento de este eje cambia como una forma de adaptación que puede estar relacionada con niveles bajos de cortisol. Por lo tanto, varios estudios sugieren que este proceso está relacionado con el comienzo del desarrollo de enfermedades psíquicas, y probablemente tiene su aparición desde el útero, como consecuencia del reflejo de la programación glucocorticoides a través de la epigenética (BRAND et al., 2006).
Estos estudios indican que el aumento de la metilación del gen NR3C1, responsable de la codificación RG, causa el desequilibrio mr – codificado por el gen NR3C2 – que resulta esencialmente en la reducción de la disponibilidad de RG proporcionando una mayor susceptibilidad de este individuo a las enfermedades psiquiátricas relacionadas con el estrés, tales como la depresión y el TEPT (BRAND et al., 2006; MULLIGAN et al., 2012)
Añadido a este factor de alteración de la estructura en el ADN de las personas que sufren interferencia de factores de estrés externos, varios estudios sugieren que el TEPT es un fuerte correlacionado para el desarrollo de esta misma patología en las generaciones futuras (ROBERTS et al., 2012). La propagación transgeneracional se asocia con la transmisión de cambios biológicos adaptativos en el eje HPA. El TEPT provoca el cambio en el equilibrio neuroendocrino del eje HPA, especialmente cuando se trata de la secreción de niveles bajos de cortisol y esta baja secreción también se incrementa por fármacos antiinflamatorios que forman parte del grupo de corticosteroides que infunden la producción de cortisol por el cuerpo, mejorando también su baja secreción, lo que aumenta la probabilidad de que la descendencia de los padres con TEPT adquiera la enfermedad en el futuro (BRAND et al. , 2006), (LABONTÉ et al., 2014). El bajo nivel de cortisol en relación con el TEPT parental parece estar presente en el desarrollo temprano del bebé -probablemente desde el útero- ya que causan la reprogramación de RGS a través de alteraciones epigenéticas que promueven la aparición de trastornos en la expresión genética (RADTKE et al., 2011). La respuesta fetal al nivel de cortisol indica que la exposición al estrés gestacional materno tiene impactos duraderos en el desarrollo de este niño a través del aumento de la metilación del gen que promueve la RG que persiste más allá de la infancia (RADTKE et al., 2011), (LABONTÉ et al., 2014). Esto representa la programación adaptativa fetal del eje HPA, que puede ser responsable de problemas psicológicos posteriores como depresión o TEPT. Desde esta perspectiva, el feto expuesto a niveles alterados de cortisol en la circulación materna se asocia con problemas neurológicos y de desarrollo de la próxima generación (BRAND et al., 2006).
La placenta, el órgano central del desarrollo fetal, regula la exposición y la retroalimentación a la señalización materna, alterando el entorno de desarrollo fetal. Los mecanismos epigenéticos, como la metilación del ADN, cuando se producen en regiones reguladoras, alteran la función placentaria, modifican la transcripción de genes o el potencial de transcripción (PAQUETTE et al., 2014). FKBP5 (Proteína de unión FK506) disminuye la sensibilidad de RG y evita la translocación nuclear, lo que reduce en consecuencia la capacidad de respuesta de la liberación de cortisol (KAMINSKY et al., 2015). La metilación de FKBP5 dentro de la región reguladora en el intrón 7 está asociada con cambios neurológicos. Se observó que intron 7 se une al sitio de inicio de la transcripción FKBP5 y la metilación altera la inducción de FKBP5. En una línea celular del hipocampo humano, el cortisol induce la desmetilación de esta región reguladora dentro del intrón 7 durante los períodos críticos de diferenciación celular y proliferación. El polimorfismo FKBP5 también está relacionado con la alteración de la inducción del mrna, que determina los cambios en el tamaño del hipocampo, así como las enfermedades relacionadas con los cambios en el eje de la HPA como el TEPT (SCHECHTER et al., 2016); (KAMINSKY et al., 2015).
Los estudios muestran que el feto con el gen ubicado en el intrón hipermetilado 7 experimentaría una reducción en la expresión FKBP5, lo que resultaría en una mayor sensibilidad de los RG al cortisol de la circulación materna dentro de la placenta, influyendo así en el desarrollo fetal. Estudios previos al biomarcador FKBP5 han observado asociaciones con TEPT que se caracterizan por un comportamiento hipervigilante e hiperexcitado. Por lo tanto, los cambios en FKBP5 disminuyen el comportamiento de la respuesta al cortisol promoviendo una respuesta hipervigilante. Individuos con aumento de la metilación de FKBP5 en el útero tienen una vía de respuesta de cortisol poco activa al nacer, quedando predispuesto a desarrollar trastornos relacionados con la hiperresponsabilidad del eje hpa, como el TEPT o la ansiedad (KAMINSKY et al., 2015). A continuación, se analizó que este biomarcador tiene su relevancia funcional para un control epigenético aún desconocido y puede alterar el desarrollo fetal, especialmente en el desarrollo neuroconductual. Por lo tanto, los estudios demuestran efectivamente que los factores de estrés externos, que afectan activamente durante el embarazo, causan hipermetilación del etil 1F del gen NR3C1 y de la región del promotor RG, con el fin de interferir significativamente en la edad adulta (RADTKE et al., 2011).
Este fenómeno es relevante para modificar durante mucho tiempo el equilibrio del eje de hpA y alterar los niveles de cortisol encontrados en los hijos de víctimas de desastres naturales o antropogénicos que han sido diagnosticados con TEPT. Por lo tanto, la epigenética puede proporcionar información sobre el comportamiento de los biomarcadores y manifestaciones macroestructurales con el fin de aclarar la transmisión transgeneracional de este trastorno.
Figura 03. Metilación de ADN- Los pares base forman EL ADN. Estos pares se entrelazan en proteínas llamadas histonas. Esta estructura es similar a un “collar de perlas” que forma cromatina. La metilación es el principal mecanismo epigenético.
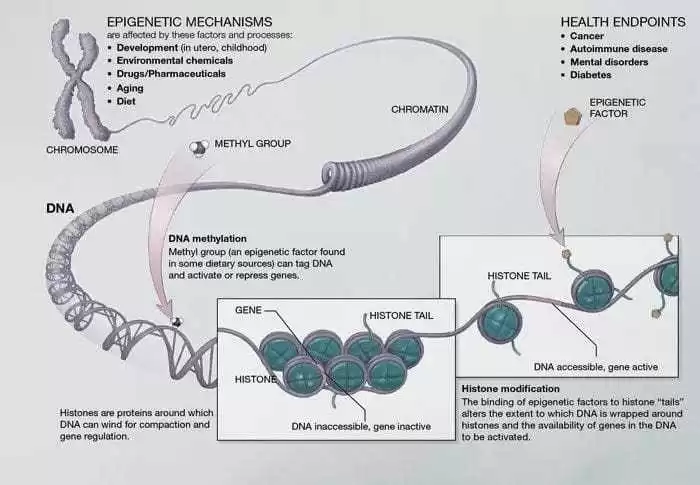
3.2 EL PAPEL DEL CAMBIO EPIGENÉTICO EN EL VOLUMEN DEL HIPOCAMPO Y EL RECEPTOR DE GLUCOCORTICOIDES
Actualmente, la metilación del gen NR3C1 está correlacionada con el volumen del hipocampo y la depresión. El hipocampo es sensible al estrés y altamente sensible a la metilación de este biomarcador. En relación con estos factores con los mecanismos de neuroimagen y epigenética, se utilizaron para proporcionar la base para una orientación interesante en la investigación relacionada con el TEPT y los cambios genotipos. En general, el TEPT reveló una respuesta negativa entre el NR3C1 y el tamaño del hipocampo. Además, una fuerte relación entre este biomarcador, hipocampo, RGs y respuesta ptsd. Específicamente, el hipocampo regula la actividad del eje hpa y, en consecuencia, la acción de los glucocorticoides, como el cortisol. Por lo tanto, aumentando significativamente los signos de estrés en el cuerpo (PERROUD et al., 2014), (AMLI et al., 2016).
Esto nos llevaría a esperar que los valores más bajos de metilación estén asociados con un hipocampo de menor tamaño, que los veteranos de guerra que probablemente no tienen TEPT deberían tener. Sin embargo, el TEPT se asocia con la hipometilación en general y se verifica que esta relación se pierde porque también pueden ocurrir valores de metilación más bajos, independientemente del tamaño del hipocampo. Se deben realizar investigaciones futuras para determinar si esta tendencia sigue siendo la misma en individuos sanos, otros veteranos o grupos civiles con TEPT, y en pacientes con otros trastornos psiquiátricos (AMLI et al., 2016).
La relación entre el volumen del hipocampo y el TEPT es actualmente controvertida en la literatura. Los estudios por imágenes indican que los veteranos del TEPT después del combate tienen un volumen de hipocampo más pequeño en comparación con los veteranos sin TEPT. Sin embargo, otros estudios no han podido replicar esta relación. La razón probable de esta incoherencia en los resultados se debe al hecho de que el TEPT es un trastorno multifactorial (AMLI et al., 2016), (LABONTÉ et al., 2014). Por lo tanto, la comprensión de la base biológica de este trastorno requiere algo más que neuroimagen para analizar la relación del TEPT con el volumen y el funcionamiento del hipocampo. Por lo tanto, es imperativo integrar el conocimiento de la imagen, la bioquímica y la epigenética con el fin de profundizar en el conocimiento actual sobre este trastorno.
4. CONSIDERACIONES FINALES
En este artículo, después de estudiar los biomarcadores citados que se expresan o no por los cambios epigenéticos, podemos señalar algunos de los resultados más actuales en la investigación sobre el TEPT y seguir cómo estos artículos proporcionan perspectivas interesantes y variadas para el descubrimiento prematuro de la predisposición a ciertos trastornos psicológicos. Aunque los artículos no son concluyentes, los resultados de sus estudios indican que los eventos traumáticos en el TEPT en la macroestructura corporal se justifican a través de alteraciones de metilación del ADN que modifican la expresión génica y, en consecuencia, la actividad del eje HPA. Por lo tanto, el TEPT no sólo produce cambios en el eje de control neuroendocrino del cuerpo, sino que también las modificaciones se pueden propagar a las generaciones futuras que alteran el mecanismo de la descendencia para actuar y de manera similar con el mecanismo de su padre.
Aunque la gama de información sobre el tema abordado era amplia, algunos artículos estudiados revelaron la necesidad de seguir investigando para obtener un estudio más profundo sobre el tema. Así, sería posible consolidar la información obtenida en los estudios antes mencionados.
REFERENCIAS
AMLI, Lynn M. et al. A Genome-Wide Identified Risk Variant for PTSD is a Methylation Quantitative Trait Locus and Confers Decreased Cortical Activation to Fearful Faces. Am J Med Genet B Neuropsychiatr Genet. Georgia, p. 327-336. 18 maio 2018. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4844461/>. Acesso em: 22/11/ 2019.
BRAND, Sarah R. et al. The effect of maternal PTSD following in utero trauma exposure on behavior and temperament in the 9-month-old infant. Annals of the New York Academy of Science. Nova Iorque, p. 454-458. abr. 2006. Disponível em: <https://nyaspubs.onlinelibrary.wiley.com/doi/full/10.1196/annals.1364.041>. Acesso em: 30/10/2019.
COSTA, Everton de Brito Oliveira; PACHECO, Cristiane. Epigenetics: gene expression regulation at transcriptional level and its implications. Semina. Londrina, p. 125-136. dez. 2013. Disponível em: <http://www.uel.br/revistas/uel/index.php/seminabio/article/viewFile/5142/13877>. Acesso em: 01 fev. 2019
FRAGA, Mario F. et al. Epigenetic differences arise during the lifetime of monozygotic twins. Epigenetics Differences Arise During The Lifetime Of Monozygotic Twins. Proceedings Of The Proceedings Of The National Academy Of Sciences Of The United States Of America. Seattle, p. 106-117. 17 jan. 2005. Disponível em: <https://www.pnas.org/content/102/30/10604.long>. Acesso em: 27/10/2019.
HARRIS, Angela P. et al. Mineralocorticoid and glucocorticoid receptor balance in control of HPA axis and behaviour. Psychoneuroendocrinology. Edimburgo, p. 648-658. maio 2013. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0306453012002983?via%3Dihub>. Acesso em: 11/09/2019
https://www.tandfonline.com/doi/abs/10.3109/15622975.2013.866693?journalCode=iwbp20. Acesso em: 7 ago. 2019.
JURUENA, Mario F; CLEARE, Anthony J; PARIANTE, Carmine M. The Hypothalamic Pituitary Adrenal axis, Glucocorticoid receptor function and relevance to depression. Rev. Bras. Psiquiatr. São Paulo, v. 26, n. 3, p. 189-201, Setembro 2004. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-44462004000300009&lng=en&nrm=iso>. Acesso em: 22/11/2019.
KAMINSKY, Z et al. Epigenetic and genetic variation at SKA2 predict suicidal behavior and post-traumatic stress disorder. Translational Psychiatry. Baltimore, p. 627-639. 25 ago. 2015. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4564560/>. Acesso em: 20/11/2019.
LABONTÉ, Benoit et al. Epigenetic modulation of glucocorticoid receptors in posttraumatic stress disorder. Translational Psychiatry. Montreal, p. 368-381. abr. 2014. Disponível em: <https://www.nature.com/articles/tp20143>. Acesso em: 31/10/2019.
MCNERNEY, M. Windy et al. Integration of neural and epigenetic contributions to posttraumatic stress symptoms: The role of hippocampal volume and glucocorticoid receptor gene methylation. Plos One. California, p. 421-434. 07 fev. 2018. Disponível em: <https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0192222>. Acesso em: 10 dez. 2019.
MULLIGAN, Connie et al. Methylation changes at NR3C1 in newborns associate with maternal prenatal stress exposure and newborn birth weight. Epigenetics. Florida, p. 853-857. jul. 2012. Disponível em: <https://www.tandfonline.com/doi/abs/10.4161/epi.21180>. Acesso em: 08 /12/2019.
NEUGEBAUER, Richard et al. Post-traumatic stress reactions among Rwandan children and adolescents in the early aftermath of genocide. International Journal Of Epidemiology. Nova Iorque, p. 1033-1045. ago. 2009. Disponível em: <https://academic.oup.com/ije/article/38/4/1033/849053>. Acesso em: 20 /12/ 2019.
PAQUETTE, Alison G. et al. Placental FKBP5 genetic and epigenetic variation is associated with infant neurobehavioral outcomes in the RICHS cohort. Plos One. New Hampshire, 12 ago. 2014. p. 133-143. Disponível em: <https://www.ncbi.nlm.nih.gov/pubmed/25115650>. Acesso em: 20 out. 2019.
PERROUD, Nader et al. The Tutsi genocide and transgenerational transmission of maternal stress: epigenetics and biology of the HPA axis. The World Journal Of Biological Psychiatry. Genebra, 01 abr. 2014. p. 334-345. Disponível em:
RADTKE, Karl M. et al. Transgenerational impact of intimate partner violence on methylation in the promoter of the glucocorticoid receptor. Translational Psychiatry. Konstanz, p. 456-470. jul. 2011. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309516/>. Acesso em: 20/10/2018
ROBERTS, Andrea L et al. Posttraumatic stress disorder across two generations: concordance and mechanisms in a population-based sample. Biol Psychiatry. Massachussetts, p. 505-511. abr. 2012. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3412195/>. Acesso em: 21/09/2019.
SCHECHTER, Daniel S. et al. The association of serotonin receptor 3A methylation with maternal violence exposure, neural activity, and child aggression. Behavioural Brain Research. Genebra, p. 268-277. 15 maio 2017. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0166432816307720?via%3Dihub>. Acesso em: 20 out. 2019.
VUKOJEVIC, Vanja et al. Epigenetic Modification of the Glucocorticoid Receptor Gene Is Linked to Traumatic Memory and Post-Traumatic Stress Disorder Risk in Genocide Survivors. The Journal Of Neuroscience. Suiça, p. 10274-10284. 30 de julho 2014. Disponível em: http://www.jneurosci.org/content/34/31/10274.long. Acesso em: 02 nov. 2019.
YEHUDA, Rachel; BIERER, Linda M. Transgenerational transmission of cortisol and PTSD risk. Progress In Brain Research. Nova Iorque, p. 121-135. nov. 2007. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0079612307670095?via%3Dihub>. Acesso em: 19/11/2019.
[1] Académico del Curso Médico del Centro Universitario Tiradentes (UNIT-AL).
[2] Académico del Curso Médico del Centro Universitario Tiradentes (UNIT-AL).
[3] Académico del Curso Médico del Centro Universitario Tiradentes (UNIT-AL).
[4] Académico del Curso Médico del Centro Universitario Maurício de Nassau (UNINASSAU).
[5] Profesor, Máster, Profesor Asistente del Curso Médico del Centro Universitario Tiradentes (UNIT-AL).
Enviado: Enero de 2020.
Aprobado: Agosto, 2020.