ARTIGO DE REVISÃO
REIS, Ariadna Jihani Damasceno Vidal de Santana [1], ANJOS, Maria Clara Mota Nobre dos [2], CAVALCANTI, Bruna Luiza de Mendonça [3], SANTOS, Ketully Stefane Chaves dos [4], DINIZ, Maria Celeste Campello [5]
REIS, Ariadna Jihani Damasceno Vidal de Santana. Et. Disturbo da stress post-traumatico come trigger di cambiamenti epigenetici nel corpo. Revista Científica Multidisciplinar Núcleo do Conhecimento. Anno 05, Ed. 08, Vol. 04, pp. 96-114. nell’agosto 2020. ISSN: 2448-0959, collegamento di accesso: https://www.nucleodoconhecimento.com.br/salute/cambiamenti-epipgenetici
RIEPILOGO
Il disturbo da stress post-traumatico (DSPT) ha come definizione diagnostica l’insorgenza di grave stress traumatico come fattore di innesco eziologico, e dopo l’esposizione a questo evento traumatico inizia una serie variabile di sintomi caratteristici e disturbi psicologici, sociali e biologici. Questo articolo valuta sistematicamente come la DSPT può influenzare l’asse ipotalamo-pituitario-surenale mediante modifiche epigenetiche che sopprimono o stimolano l’espressione genetica di un determinato gene attraverso biomarcatori. Ricerca di approccio qualitativo, con natura del tipo sistematico rassegna bibliografica del carattere analitico. Sono stati studi condotti che hanno cercato di correlare la DSPT con alterazioni epigenetiche nelle generazioni successive. La ricerca è stata costruita attraverso query su database NCBI: PubMed, VHL e Scielo. Le informazioni sono state raccolte da 14 articoli scientifici pubblicati tra il 2009 e il 2018, e le lingue sono state delimitate al portoghese e all’inglese. È stato osservato che la DSPT è responsabile di un notevole cambiamento nel cortisolo, serotonina e sensibilità ai recettori glucocorticoide. La revisione ha permesso la costruzione di una sintesi di conoscenze scientifiche sull’associazione tra i cambiamenti epigenetici motivati dalla DSPT nei pazienti in materiale genetico e tali modifiche di questi geni saranno trasferite alle generazioni future.
Parole chiave: metilazione del DNA, epigenetica, biomarcatori, disturbi da stress post-traumatico.
1. INTRODUZIONE
Disturbo da stress post-traumatico (DSPT) è definito come un insieme di segni e sintomi psichici, fisici ed emotivi che causano un disturbo d’ansia. DSPT è responsabile di un notevole cambiamento nel cortisolo, serotonina e sensibilità ai recettori glucocorticoidi (RG). Così, si sviluppa nell’individuo che è stato vittima o testimone di una situazione traumatica che ha presentato una minaccia per la sua integrità o quella delle persone intorno a lui. Questo disturbo provoca cambiamenti ormonali legati all’asse ipotaala-pituitario-surenale (IPS) e nell’espressione di alcuni geni (VUKOJEVIC et al., 2014). Nel frattempo, la relazione tra stress, DSPT ed epigenetica diventa chiara, perché anche se non comporta il cambiamento stesso nella sequenza del codice genetico, ci sono alterazioni che possono causare la stimolazione o l’inibizione dell’espressione genica di determinate informazioni. Tali cambiamenti sono la metilazione dell’acido deossiribonucleico (DNA) e i cambiamenti nelle histonas che presentano il ruolo del normale sviluppo e sono cruciali per l’esecuzione della corretta programmazione dell’espressione genica.
In questo articolo, discuteremo principalmente il processo di metilazione del DNA dei principali geni di RG, mineralocorticoidi (MR) e serotonina (HTR3A) che promuove un adattamento al corpo e l’influenza sulla suscettibilità alle malattie che di conseguenza sarebbero propagate anche alle prossime generazioni.
I geni HTR3A, NR3C1, NR3C2 e FKBP5 si concentreranno su questo articolo. In primo luogo, l’ipermetilazione del gene NR3C1 si traduce nella sua bassa espressione e nella diminuzione dei livelli di cortisolo. NR3C2 è responsabile del calo dei livelli di MR e, di conseguenza, della diminuzione della quantità di corticotropina. Questo processo si verifica attraverso la metilazione del gene che esprime NR3C2 (PERROUD, 2014). HTR3A può essere associato con la modifica nelle strutture cerebrali centrali per l’elaborazione delle emozioni, soprattutto quando queste strutture sono esposte allo stress. È anche degno di nota la potenziale influenza del sistema sierotonergico sulla fisiopatologia dei disturbi affettivi, come la DSPT. Infine, FKBP5, che agisce come co-chaperone, modulando l’attività di RG in risposta ai fattori di stress durante la gravidanza ed è anche legato all’esposizione ai traumi genera la possibilità che il bambino sia già nato con un meccanismo più adatto e incline a sviluppare depressione e DSPT (PAQUETTE et al., 2014); (SCHECHTER et al., 2016).
1.1 EPIGENETICA
Il termine epigenetica significa “oltre alle informazioni genetiche codificate nel DNA” ed è genericamente usato per definire i cambiamenti che si verificano nell’espressione genica senza, tuttavia, alcuna alterazione nella sequenza del codice genetico (COSTA et al., 2013).
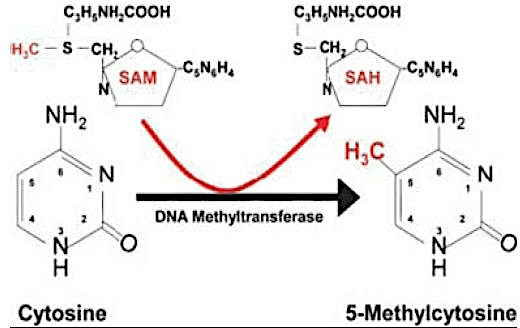
Alcuni meccanismi epigenetici includono la metilazione del DNA, l’imprinting, i cambiamenti nella conformazione della cromatina e il silenziamento mediato dall’RNA. La metilazione del DNA è la modifica epigenetica più comunemente utilizzata dalla maggior parte degli esseri viventi come agente di regolazione dell’espressione genica e può essere caratterizzata come un fattore di silenziamento genico. Consiste nell’aggiunta di un radicale metile (CH3) al carbonio 5 della citosina, di solito seguita da Guanina (dinucleotide CpG), catalizzato da enzimi DNA metiletransferases (DNTT) (COSTA et al., 2013); (AMLI et al., 2016).
Figura 01. Metilazione citochina.
REGOLAZIONE DELL’ALBERO 1.2 HPA
L’attività dell’asse Hpa è regolata dalla secrezione di HLC – ormone corticotrofica e vasopressina-rilascio (AVP) – dall’ipotalamo, che a sua volta attiva la secrezione dell’ormone adrenocorticotrofico (ACTH) da parte della ghiandola pituitaria, che alla fine stimola la secrezione di glucocorticoidi attraverso la corteccia adrenale. In questa visione, i glucocorticoidi interagiscono con i loro recettori in più tessuti bersaglio, tra cui l’asse HPA stesso, dove sono responsabili dell’inibizione del feedback negativo della secrezione ACTH da parte dell’ipofisi e dell’HLC dall’ipotalamo (JURUENA et al., 2004).
Anche se i glucocorticoidi regolano le funzioni di quasi tutti i tessuti del corpo, l’effetto fisiologico più noto di questi ormoni è la regolazione del metabolismo energetico. In questo contesto, diversi fattori controllano l’attività dell’asse hpa. Inoltre, C’è evidenza di direttamente catecholaminergic, innervazione serotoninergica e dopaminergica nei neuroni che producono HLC nell’ipotalamo e questi e altri neurotrasmettitori sembrano influenzare il rilascio di HLC. Ad esempio, la serotonina esercita un’influenza stimolante sull’HLC attraverso i sottotipi di recettore 5-HT1A, 5-HT1B, 5-HT1C e 5-HT2. La noradrenalina ha un effetto più variabile, essendo stimolatore a basse dosi (tramite recettori alfa 1) e inibizione in dosi elevate (tramite recettori beta) (JURUENA et al., 2004).
Questo articolo mirava a scoprire la relazione epigenetica dell’espressione genica nella DSPT attraverso i suddetti biomarcatori. Dallo studio di questi, è stata studiata la loro interazione con la regolazione e le prestazioni nell’asse ipotalamo-pituitario-surrenale. Infine, abbiamo cercato di capire come tali cambiamenti agiranno nel trasferimento di questi geni alle generazioni future.
2. METODOLOGIA
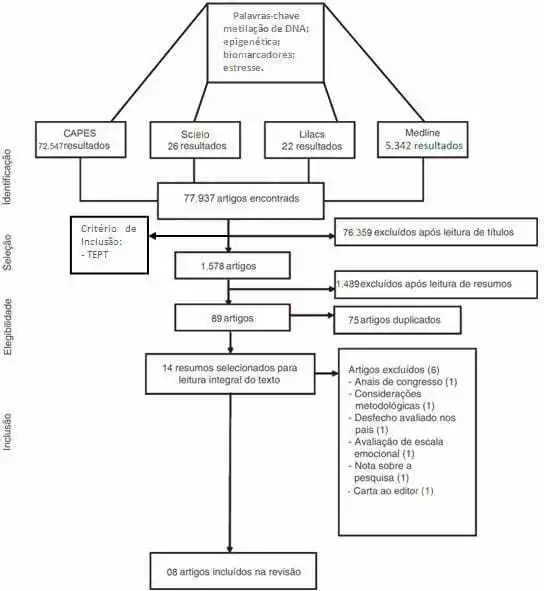
La ricerca è stata sviluppata con un approccio qualitativo, giustificato consentendo lo sblocco del mondo ricercato con l’approfondimento dei dati scientifici, che consente una migliore comprensione e analisi dell’oggetto di ricerca. La natura dello studio consisteva in una revisione sistematica della letteratura di natura analitica. Giustificandosi per l’assistenza nella costruzione di un’ampia analisi della letteratura, contribuendo come riflessione alla realizzazione di studi futuri. Il pregiudizio era delimitato dai descrittori stress ed epigenetica. Un totale di 77.937 articoli sono stati utilizzati per la consultazione nella Biblioteca Virtuale, come Lilacci, biblioteca di salute virtuale (VHL), Scielo e MEDLINE via Pubmed, un totale di 77.937 articoli che sono stati sottoposti a una nuova revisione condotta leggendo i titoli che hanno anche permesso un criterio di inclusione che sarebbe l’articolo che si occupa di DSPT; questo screening preliminare ha escluso 76.359 articoli.
Leggendo il titolo secondo il criterio di essere correlato alla DSPT. Questi filtri hanno ridotto il numero di articoli da circa 80.000 a 1.578 articoli. Questa sistemaizzazione delle modalità di esecuzione della ricerca è definita nella figura 02.
La nuova fase della specifica tematica comprendeva l’inclusione di nuovi criteri di inclusione ed esclusione, come: razza umana, donne, pubblicazioni fino a 5 anni, esclusione della revisione degli articoli, di età compresa tra 19 e 44 anni. Gli 89 articoli risultanti da questo filtro, sono stati sottoposti a un’analisi in cui vi è stata la rimozione di articoli duplicati alleati ai criteri di esclusione e inclusione, riducendo il numero di articoli a 14 articoli che sono stati sottoposti a un’altra analisi che ha comportato la lettura di questi articoli in modo che il gruppo potesse selezionare ciò che sarebbe più rilevante per una revisione.
C’è stato un focus sugli articoli sulle vittime di disastri, genocidi o eventi traumatici su larga scala che, quindi, culminavano nell’esclusione di articoli che affrontavano il tema, ma non corrispondevano ai nostri obiettivi per la scrittura di questo articolo di revisione, solo otto articoli utili per la sezione tematica scelta dal gruppo. Gli articoli scelti sono stati organizzati e rappresentati nella tabella 01.
Figura 02. Diagramma di flusso che illustra come è stata eseguita la linea di esclusione della revisione sistemati
Fonte: Autori della ricerca (2019).
Tabella 01 Elenco degli autori e dei rispettivi articoli e presentazione dei risultati trovati.
| Autore | Articoli | Studiare | Obiettivi | Risultati |
| McNerney, MW et al (2018) 8 | Integrazione neurale ed epigenetica aiuta i sintomi del disturbo da stress post traumatico : Il ruolo del volume dell’ippocampo e della metilazione del gene glucocorticoides. | Articolo di ricerca | L’articolo cerca di determinare se la combinazione di immagini cerebrali ed epigenetiche è un predittore migliore della sintotologia DSPT rispetto a qualsiasi fattore da solo.Misurazione del volume dell’ippocampo e della metilazione della citosina. | I dati hanno rivelato un’interazione significativa tra la metilazione NR3C1 e le dimensioni dell’ippocampo. I risultati rafforzano l’idea che l’epigenetica e l’anatomia neurale possano essere utilizzate come indicatore efficace per la DSPT |
| Schechter D.S et al (2016) | Associazione del recettore della serotonina 3A metilazione con esposizione alla violenza materna, attività neurale e aggressione infantile. | Relazione di ricerca | Lo studio in questione ha esaminato se la metilazione HTR3A può essere associata all’esposizione della madre alla violenza interpersonale (IPV), alla psicopatologia correlata all’IPV, al disturbo dell’attaccamento infantile e all’attività neurale materna. | La frequenza di esposizione all’IPV materno è stata associata alla DSPT materna; e la DSPT-DSPT materna, a sua volta, era associata al SOD infantile. |
| Perroud N et al(2014) | Il genocidio Tutsi e la trasmissione transgenerazionale dello sforzo materno: epigenetica e biologia dell’asse HPA. | Articolo di ricerca | Lo studio della trasmissione del disturbo da stress post-traumatico dei genitori (DSPT) alla prole che può essere spiegato dalla trasmissione di processi epigenetici, come lo stato di metilazione del gene NR3C1 e il recettore glucocorticoide (GR) | C’era una correlazione significativa tra la gravità della DSPT e la depressione nelle madri e la gravità della DSPTe della depressione nei loro figli, rispettivamente. |
| Paquette A.G et al (2014) | Disturbo da stress post-traumatico in pazienti con disturbo bipolare: una revisione della prevalenza, correports e strategie di trattamento. | Studio di coorte | Lo studio mira a testare l’ipotesi che la metilazione del FKBP5 placenteale e la variazione genetica contribuiscano al controllo dell’espressione genica e siano associate ai risultati del neurosviluppo infantile. | I dati mostrano che i neonati con i più alti livelli di metilazione sperimenterebbe una riduzione dell’espressione FKBP5, con conseguente aumento dell’attivazione del cortisolo nei recettori glucocorticoidi all’interno della placenta, che può influenzare l’attivazione del percorso di risposta glucocorticoide nel bambino in via di sviluppo. |
| Lynn M. et al (2016) | Una variante di rischio a livello di genoma per la DSPT è un luogo di caratteristica di metilazione quantitativa e conferisce una diminuzione dell’attivazione corticale e dei volti spaventosi | Studio di coorte | Questo studio mira a comprendere il rischio genetico per la DSPT. È stato osservato un campione con un progetto di fenotipo estremo e casi di controllo con esposizioni simili. | Il BSBPCohort aveva una media generale di punteggi dei sintomi di DSPT. Tuttavia, poiché la coorte è stata sviluppata con fenotipi estremi, la gravità dei sintomi era molto più alta nei casi di DSPT. |
| Vukojevic et al (2014) | La modifica epigenetica del gene del recettore glucocorticoide è legata alla memoria traumatica e al rischio di stress post-traumatico nei sopravvissuti al genocidio. | Comportamentale/Cognitivo | Ha lo scopo di analizzare gli eventi traumatici che inducono la metilazione del DNA, e che fornisce cambiamenti in diversi promotori di RG e modifiche trascrizioni, oltre ad un’analisi della regolazione dell’attività del cortisolo. Così associando questi fattori con l’asse ipotalamo-ipofisi-ipofisi-ipofisi-surenale in individui con DSPT. | L’analisi ha anche rivelato un effetto principale del tempo di campionamento del cortisolo. Test parziali hanno indicato che i livelli di cortisolo erano significativamente più bassi nel gruppo DSPT rispetto al gruppo di controllo per l’intervallo di tempo tra 30 e 45 minuti dopo il risveglio (e tra 45 e 60 minuti dopo il risveglio, i recettori glucocorticoidi erano significativamente più bassi nella DSPT rispetto all’altro gruppo di confronto). |
| Kaminsky Z et al ( 2015) | Variazione epigenetica e genetica nel predicato del comportamento suicidario di ska2 e disturbo da stress post-traumatico. | Articolo originale | L’obiettivo era quello di studiare l’interazione di SKA2 e l’esposizione a traumi nella funzione dell’asse hpa, tentativo di suicidio e DSPT | È stato osservato che il biomarcatore epigenetico e genetico, SKA2, prevedeva casi di DSPT nei civili quando è stato incorporato l’abuso di minori |
| MULLIGAN C.J. et al (2012) | Metilazione in NR3C1 nei neonati associati all’esposizione allo stress prenatale materno e al peso neonatale | Articolo integrato | Lo studio mira a testare l’idea che gli stress psicosociali materni estremi osservati nella Repubblica Democratica del Congo possono modificare i segni epigenetici di locus specifico nel neonato, con conseguente alterazione degli esiti di salute. | Ha concluso che una maggiore metilazione può limitare la malleabilità dell’espressione genica e limitare la gamma di possibili risposte di adattamento allo stress negli individui colpiti, aumentando così il rischio di malattie con DSPT all’età adulta. |
Fonte: Autori della ricerca (2019).
3. RISULTATI E DISCUSSIONE
3.1 IPERMETILAZIONE, IPOMETRIA E DSPT
Il processo di metilazione svolge un ruolo chiave nello sviluppo embrionale, nell’inattivazione dei cromosomi X, nella regolazione genica, nell’imprinting genomico e nelle modifiche della cromatina. Tuttavia, esistono due meccanismi per regolare l’espressione genica all’interno del processo di metilazione: ipermetilazione e ipometilazione. L’ipometilazione del Dna provoca comunemente un aumento dell’espressione genica, ma l’ipermetilazione diminuisce l’espressione dei geni determinati (VUKOJEVIC, 2014).
Naturalmente, i modelli di metilazione del genoma cambiano con l’arrivo della senescenza. La maggior parte del tempo, l’ipometilazione si verifica in concomitanza con l’ipermetilazione di alcune isole CPG distribuite in sequenze ricorrenti, così come geni di importanza trascrizionale. I cambiamenti epigenetici sono direttamente correlati all’avanzare dell’età, contribuendo a vari disturbi o malattie acquisite (FRAGA et al., 2005).
L’esposizione ripetuta allo stress durante l’infanzia predispone una reazione neurobiologica che viene mantenuta per tutta la vita dell’individuo e può influenzare negativamente la salute psichica. Studi precedenti hanno effettivamente dimostrato che gli stressanti ambientali, non solo nelle prime fasi della vita, ma anche durante la gravidanza, aumentano lo stato di metilazione dell’esone 1F del gene NR3C1. Nel cervello, l’ippocampo è un’area abbondante in RGS, che esprime anche il promotore NR3C1-1F. Inoltre, ci sono registrazioni che l’ippocampo è sensibile allo stress a livello biochimico e strutturale. Pertanto, la metilazione del DNA è stata associata a cambiamenti nella densità RG nell’ippocampo dopo l’esposizione allo stress ambientale. Pertanto, gli studi indicano che, sia a causa dell’esposizione allo stress e della possibile perdita del volume dell’ippocampo o dello stato di ipotetilazione ininato combinato con un volume di ippocampo inferiore, sono in grado di predisporre un individuo alla DSPT (MCNERNEY et al., 2018).
Non si può affermare che il DSPT sia associato al volume dell’ippocampo. Anche se questa controversia può essere giustificata dal fatto che non tutte le variabili importanti coinvolte nei volumi di ippocampo e DSPT sono state completamente considerate come il meccanismo di metilazione del DNA (PERROUD et al., 2014).
Le prestazioni dell’ipermetilazione sono in grado di disturbare efficacemente l’equilibrio dell’asse HPA, il che spiega come i livelli di cortisolo (YEHUDA et al., 2009) alterati si trovano nei figli dei sopravvissuti al disastro diagnosticati con DSPT. Così, l’epigenetica può fornire informazioni importanti sulla fisiofisiologia della DSPT , rendendo possibile capire come avviene la trasmissione transgenerazionale di questo disturbo (PERROUD et al., 2014); (JURUENA et al., 2004).
Alterazione epigenetica nel vettore DSPT e propagazione per la loro prole.
Questa alterazione epigenetica è direttamente correlata all’asse HPA, che è fondamentalmente responsabile della regolazione neuroendocrina dei processi fisiologici. Tuttavia, per una persona con DSPT, il funzionamento di questo asse cambia come una forma di adattamento che può essere correlata a bassi livelli di cortisolo. Pertanto, diversi studi suggeriscono che questo processo è legato all’inizio dello sviluppo di malattie psichiche, e probabilmente ha il suo aspetto dall’utero, come conseguenza della riflessione della programmazione glucocorticoide attraverso l’epigenetica (BRAND et al., 2006).
Questi studi indicano che l’aumento della metilazione del gene NR3C1, responsabile della codifica rg, causa lo squilibrio mr – codificato dal gene NR3C2 – essenzialmente con conseguente riduzione della disponibilità di RG fornendo una maggiore suscettibilità di questo individuo alle malattie psichiatriche legate allo stress, come la depressione e la DSPT (BRAND et al., 2006; MULLIGAN et al., 2012)
Aggiunto a questo fattore di alterazione della struttura nel DNA di persone che soffrono di interferenze da fattori di stress esterni, diversi studi suggeriscono che la DSPT è una forte correlazione per lo sviluppo di questa stessa patologia nelle generazioni future (ROBERTS et al., 2012). La propagazione transgenerazionale è associata alla trasmissione di cambiamenti biologici adattivi sull’asse HPA. DSPT provoca il cambiamento nell’equilibrio neuroendocrino dell’asse HPA, soprattutto quando si tratta di secrezione di bassi livelli di cortisolo e questa bassa secrezione è anche aumentata da farmaci antinfiammatori che fanno parte del gruppo di corticosteroidi che instillano la produzione di cortisolo da parte dell’organismo, migliorando anche la sua bassa secrezione, che di conseguenza aumenta la probabilità della prole di genitori con DSPT acquisendo la malattia in futuro (BRAND et al. , 2006), (LABONTÉ et al., 2014). Il basso livello di cortisolo in relazione alla DSPT parentale sembra essere presente nello sviluppo precoce del bambino – probabilmente dall’utero – poiché causano la riprogrammazione dei RG attraverso alterazioni epigenetiche che promuovono la comparsa di disturbi nell’espressione genetica (RADTKE et al., 2011). La risposta fetale al livello di cortisolo indica che l’esposizione allo stress gestazionale materno ha un impatto duraturo sullo sviluppo di questo bambino attraverso una maggiore metilazione del gene che promuove la RG che persiste oltre l’infanzia (RADTKE et al., 2011), (LABONTÉ et al., 2014). Questo rappresenta la programmazione adattiva fetale dell’asse HPA, che può essere responsabile di problemi psicologici successivi come depressione o DSPT. Da questo punto di vista, il feto esposto a livelli alterati di cortisolo nella circolazione materna è associato a problemi neurologici e di sviluppo della prossima generazione (BRAND et al., 2006).
La placenta, l’organo centrale dello sviluppo fetale, regola l’esposizione e il feedback alla segnalazione materna, alterando l’ambiente di sviluppo fetale. I meccanismi epigenetici, come la metilazione del DNA, quando si verificano nelle regioni regolatorie, alterano la funzione placental, modificano la trascrizione genica o il potenziale di trascrizione (PAQUETTE et al., 2014). FKBP5 (Binding Protein FK506) riduce la sensibilità RG e previene la traslocazione nucleare, riducendo di conseguenza la reattività al rilascio di cortisolo (KAMINSKY et al., 2015). La metilazione di FKBP5 all’interno della regione di regolamentazione a intron 7 è associata a cambiamenti neurologici. È stato osservato che intron 7 si lega al sito di inizio della trascrizione FKBP5 e la metilazione altera l’induzione di FKBP5. In una linea cellulare dell’ippocampo umano, il cortisolo induce la demetilazione di questa regione normativa all’interno dell’intron 7 durante i periodi critici di differenziazione cellulare e proliferazione. Il polimorfismo FKBP5 è anche legato all’induzione alterata di mrna, che determina i cambiamenti nelle dimensioni dell’ippocampo, così come le malattie legate ai cambiamenti nell’asse HPA come DSPT (SCHECHTER et al., 2016); (KAMINSKY et al., 2015).
Gli studi dimostrano che il feto con il gene situato nell’intron ipermetilato 7 sperimenterebbe una riduzione dell’espressione FKBP5, con conseguente maggiore sensibilità delle RSI al cortisolo dalla circolazione materna all’interno della placenta, influenzando così lo sviluppo fetale. Studi precedenti al biomarcatore FKBP5 hanno osservato associazioni con DSPT caratterizzate da comportamenti ipervigilanti e ipererciti. Pertanto, i cambiamenti in FKBP5 riducono il comportamento di influenza della risposta al cortisolo promuovendo una risposta iperviglante. Gli individui con una maggiore metilazione di FKBP5 in utero hanno un percorso di risposta al cortisolo poco attivo alla nascita, diventando predisposti a sviluppare disturbi legati all’iperresponsive dell’asse hpa, come la DSPT o l’ansia (KAMINSKY et al., 2015). Successivamente, è stato analizzato che questo biomarcatore ha la sua rilevanza funzionale per un controllo epigenetico ancora sconosciuto e può alterare lo sviluppo fetale, soprattutto nello sviluppo neurocomportamentale. Pertanto, gli studi dimostrano efficacemente che i fattori di stress esterni, che influenzano attivamente durante la gravidanza, causano ipermetilazione dell’etilo 1F del gene NR3C1 e della regione del promotore RG al fine di interferire in modo significativo nell’età adulta (RADTKE et al., 2011).
Questo fenomeno è rilevante per modificare prolungato l’equilibrio dell’asse HPA e alterare i livelli di cortisolo trovati nei figli delle vittime di disastri naturali o antropogenici che sono stati diagnosticati con DSPT. Così, l’epigenetica può fornire informazioni sul comportamento dei biomarcatori e delle manifestazioni macrostruttori al fine di chiarire la trasmissione transgenerazionale di questo disturbo.
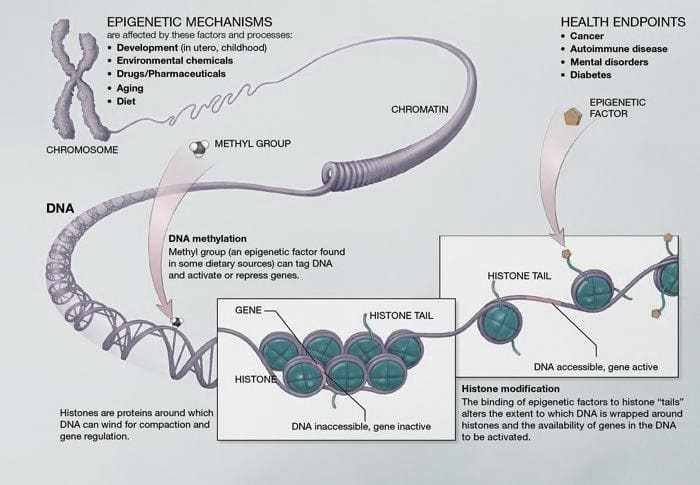
come illustrato nella figura 03. MEtilazione del DNA- Le coppie di basi formano il DNA. Queste coppie si intrecciano in proteine chiamate istoni. Questa struttura è simile a una “collana di perle” che forma la cromatina. La metilazione è il principale meccanismo epigenetico.
3.2 IL RUOLO DEL CAMBIAMENTO EPIGENETICO NEL VOLUME DELL’IPPOCAMPO E NEL RECETTORE DEL GLUCOCORTICOIDE
Attualmente, la metilazione del gene NR3C1 è correlata al volume dell’ippocampo e alla depressione. L’ippocampo è sensibile allo stress e altamente sensibile alla metilazione di questo biomarcatore. Riferendosi a questi fattori ai meccanismi di neuroimaging ed epigenetica, sono stati utilizzati per fornire la base per un interessante orientamento nella ricerca relativa ai cambiamenti di DSPT e genotipo. In generale, DSPT ha rivelato una risposta negativa tra la dimensione di NR3C1 e dell’ippocampo. Inoltre, una forte relazione tra questo biomarcatore, ippocampo, RGs e risposta DSPT. In particolare, l’ippocampo regola l’attività dell’asse hpa e di conseguenza l’azione dei glucocorticoidi, come il cortisolo. Così, aumentando significativamente i segni di stress nel corpo (PERROUD et al., 2014), (AMLI et al., 2016).
Questo ci porterebbe ad aspettarci che valori di metilazione più bassi siano associati a un ippocampo di dimensioni più piccole, che i veterani di guerra che probabilmente non hanno la DSPT dovrebbero avere. Tuttavia, la DSPT è associata all’ipometilazione in generale e viene verificato che questa relazione viene persa perché possono verificarsi anche valori di metilazione più bassi, indipendentemente dalle dimensioni dell’ippocampo. La ricerca futura dovrebbe essere condotta per determinare se questa tendenza rimane la stessa in individui sani, altri veterani o gruppi civili con DSPT , e in pazienti con altri disturbi psichiatrici (AMLI et al., 2016).
Il rapporto tra il volume dell’ippocampo e il DSPT è attualmente controverso nella letteratura. Studi di imaging indicano che i veterani DSPT post-combattimento hanno un volume di ippocampo più piccolo rispetto ai veterani senza DSPT. Tuttavia, altri studi non sono riusciti a replicare questa relazione. La probabile ragione di questa incoerenza nei risultati è dovuta al fatto che la DSPT è un disturbo multifattoriale (AMLI et al., 2016), (LABONTÉ et al., 2014). Pertanto, comprendere la base biologica di questo disturbo richiede più di un semplice neuroimaging per analizzare la relazione della DSPT con il volume e il funzionamento dell’ippocampo. Pertanto, è imperativo integrare la conoscenza dell’imaging, della biochimica e dell’epigenetica al fine di approfondire le conoscenze attuali su questo disturbo.
4. CONSIDERAZIONI FINALI
In questo articolo, dopo aver studiato i biomarcatori citati che sono espressi o meno da cambiamenti epigenetici, possiamo sottolineare alcuni dei risultati più recenti nella ricerca sulla DSPT e seguire come questi articoli forniscono prospettive interessanti e varie per la scoperta prematura della predisposizione a determinati disturbi psicologici. Anche se gli articoli non sono conclusivi, i risultati dei loro studi indicano che gli eventi traumatici nella DSPT nella macrostruttura del corpo sono giustificati attraverso alterazioni della metilazione del DNA che modificano l’espressione genica e, di conseguenza, l’attività dell’asse HPA. Pertanto, la DSPT non solo produce cambiamenti nell’asse di controllo neuroendocrino del corpo, ma può anche essere propagata alle generazioni future che alterano il meccanismo della prole per agire e allo stesso modo con il meccanismo del suo genitore.
Anche se la gamma di informazioni sull’argomento affrontato era ampia, alcuni articoli studiati hanno rivelato la necessità di ulteriori ricerche per ottenere uno studio più approfondito sull’argomento. Pertanto, sarebbe possibile consolidare le informazioni ottenute negli studi di cui sopra.
RIFERIMENTI
AMLI, Lynn M. et al. A Genome-Wide Identified Risk Variant for PTSD is a Methylation Quantitative Trait Locus and Confers Decreased Cortical Activation to Fearful Faces. Am J Med Genet B Neuropsychiatr Genet. Georgia, p. 327-336. 18 maio 2018. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4844461/>. Acesso em: 22/11/ 2019.
BRAND, Sarah R. et al. The effect of maternal PTSD following in utero trauma exposure on behavior and temperament in the 9-month-old infant. Annals of the New York Academy of Science. Nova Iorque, p. 454-458. abr. 2006. Disponível em: <https://nyaspubs.onlinelibrary.wiley.com/doi/full/10.1196/annals.1364.041>. Acesso em: 30/10/2019.
COSTA, Everton de Brito Oliveira; PACHECO, Cristiane. Epigenetics: gene expression regulation at transcriptional level and its implications. Semina. Londrina, p. 125-136. dez. 2013. Disponível em: <http://www.uel.br/revistas/uel/index.php/seminabio/article/viewFile/5142/13877>. Acesso em: 01 fev. 2019
FRAGA, Mario F. et al. Epigenetic differences arise during the lifetime of monozygotic twins. Epigenetics Differences Arise During The Lifetime Of Monozygotic Twins. Proceedings Of The Proceedings Of The National Academy Of Sciences Of The United States Of America. Seattle, p. 106-117. 17 jan. 2005. Disponível em: <https://www.pnas.org/content/102/30/10604.long>. Acesso em: 27/10/2019.
HARRIS, Angela P. et al. Mineralocorticoid and glucocorticoid receptor balance in control of HPA axis and behaviour. Psychoneuroendocrinology. Edimburgo, p. 648-658. maio 2013. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0306453012002983?via%3Dihub>. Acesso em: 11/09/2019
https://www.tandfonline.com/doi/abs/10.3109/15622975.2013.866693?journalCode=iwbp20. Acesso em: 7 ago. 2019.
JURUENA, Mario F; CLEARE, Anthony J; PARIANTE, Carmine M. The Hypothalamic Pituitary Adrenal axis, Glucocorticoid receptor function and relevance to depression. Rev. Bras. Psiquiatr. São Paulo, v. 26, n. 3, p. 189-201, Setembro 2004. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-44462004000300009&lng=en&nrm=iso>. Acesso em: 22/11/2019.
KAMINSKY, Z et al. Epigenetic and genetic variation at SKA2 predict suicidal behavior and post-traumatic stress disorder. Translational Psychiatry. Baltimore, p. 627-639. 25 ago. 2015. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4564560/>. Acesso em: 20/11/2019.
LABONTÉ, Benoit et al. Epigenetic modulation of glucocorticoid receptors in posttraumatic stress disorder. Translational Psychiatry. Montreal, p. 368-381. abr. 2014. Disponível em: <https://www.nature.com/articles/tp20143>. Acesso em: 31/10/2019.
MCNERNEY, M. Windy et al. Integration of neural and epigenetic contributions to posttraumatic stress symptoms: The role of hippocampal volume and glucocorticoid receptor gene methylation. Plos One. California, p. 421-434. 07 fev. 2018. Disponível em: <https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0192222>. Acesso em: 10 dez. 2019.
MULLIGAN, Connie et al. Methylation changes at NR3C1 in newborns associate with maternal prenatal stress exposure and newborn birth weight. Epigenetics. Florida, p. 853-857. jul. 2012. Disponível em: <https://www.tandfonline.com/doi/abs/10.4161/epi.21180>. Acesso em: 08 /12/2019.
NEUGEBAUER, Richard et al. Post-traumatic stress reactions among Rwandan children and adolescents in the early aftermath of genocide. International Journal Of Epidemiology. Nova Iorque, p. 1033-1045. ago. 2009. Disponível em: <https://academic.oup.com/ije/article/38/4/1033/849053>. Acesso em: 20 /12/ 2019.
PAQUETTE, Alison G. et al. Placental FKBP5 genetic and epigenetic variation is associated with infant neurobehavioral outcomes in the RICHS cohort. Plos One. New Hampshire, 12 ago. 2014. p. 133-143. Disponível em: <https://www.ncbi.nlm.nih.gov/pubmed/25115650>. Acesso em: 20 out. 2019.
PERROUD, Nader et al. The Tutsi genocide and transgenerational transmission of maternal stress: epigenetics and biology of the HPA axis. The World Journal Of Biological Psychiatry. Genebra, 01 abr. 2014. p. 334-345. Disponível em:
RADTKE, Karl M. et al. Transgenerational impact of intimate partner violence on methylation in the promoter of the glucocorticoid receptor. Translational Psychiatry. Konstanz, p. 456-470. jul. 2011. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309516/>. Acesso em: 20/10/2018
ROBERTS, Andrea L et al. Posttraumatic stress disorder across two generations: concordance and mechanisms in a population-based sample. Biol Psychiatry. Massachussetts, p. 505-511. abr. 2012. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3412195/>. Acesso em: 21/09/2019.
SCHECHTER, Daniel S. et al. The association of serotonin receptor 3A methylation with maternal violence exposure, neural activity, and child aggression. Behavioural Brain Research. Genebra, p. 268-277. 15 maio 2017. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0166432816307720?via%3Dihub>. Acesso em: 20 out. 2019.
VUKOJEVIC, Vanja et al. Epigenetic Modification of the Glucocorticoid Receptor Gene Is Linked to Traumatic Memory and Post-Traumatic Stress Disorder Risk in Genocide Survivors. The Journal Of Neuroscience. Suiça, p. 10274-10284. 30 de julho 2014. Disponível em: http://www.jneurosci.org/content/34/31/10274.long. Acesso em: 02 nov. 2019.
YEHUDA, Rachel; BIERER, Linda M. Transgenerational transmission of cortisol and PTSD risk. Progress In Brain Research. Nova Iorque, p. 121-135. nov. 2007. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0079612307670095?via%3Dihub>. Acesso em: 19/11/2019.
[1] Accademico del Corso Medico del Centro Universitario Tiradentes (UNIT-AL).
[2] Accademico del Corso Medico del Centro Universitario Tiradentes (UNIT-AL).
[3] Accademico del Corso Medico del Centro Universitario Tiradentes (UNIT-AL).
[4] Accademico del Corso Dio del Centro Universitario Mauràcio de Nassau (UNINASSAU).
[5] Professore, Master, Assistente Professore del Corso Di Medico del Centro Universitario Tiradentes (UNIT-AL).
Inviato: gennaio 2020.
Approvato: agosto 2020.