ARTIGO DE REVISÃO
REIS, Ariadna Jihani Damasceno Vidal de Santana [1], ANJOS, Maria Clara Mota Nobre dos [2], CAVALCANTI, Bruna Luiza de Mendonça [3], SANTOS, Ketully Stefane Chaves dos [4], DINIZ, Maria Celeste Campello [5]
REIS, Ariadna Jihani Damasceno Vidal de Santana. Эт аль. Посттравматическое стрессовое расстройство как триггер эпигенетических изменений в организме. Revista Científica Multidisciplinar Núcleo do Conhecimento. 05-й год, Эд. 08, Vol. 04, стр. 96-114. Август 2020 года. ISSN: 2448-0959, Ссылка доступа: https://www.nucleodoconhecimento.com.br/здравоохранение/эпипгенетические-изменения
РЕЗЮМЕ
Посттравматическое стрессовое расстройство (ПТСР) имеет в качестве диагностического определения возникновение тяжелого травматического стресса в качестве этиологического триггерного фактора, и после воздействия этого травматического события начинается переменная серия характерных симптомов и психологических, социальных и биологических расстройств. В этой статье систематически оценивается, как ПТСР может влиять на гипоталамус-гипофиза надпочечников оси эпигенетических модификаций, которые подавляют или стимулируют генетическую экспрессию данного гена с помощью биомаркеров. Исследование качественного подхода, с характером типа систематического библиографического обзора аналитического характера. Были исследованы исследования, которые стремились соотнести ПТСР с эпигенетическими изменениями в последующих поколениях. Исследование было построено на основе запросов в базы данных NCBI: PubMed, VHL и Scielo. Информация была собрана из 14 научных статей, опубликованных в период с 2009 по 2018 год, и языки были делимитированы на португальский и английский языки. Было отмечено, что ПТСР несет ответственность за значительное изменение кортизола, серотонина и чувствительности к глюкокортикоидных рецепторов. Проверка позволила вынести на рассмотрение синтез научных знаний о связи между эпигенетическими изменениями, мотивированными ПТСР у пациентов генетическим материалом, и такие модификации этих генов будут переданы будущим поколениям.
Ключевые слова: метилирование ДНК, эпигенетика, биомаркеры, посттравматические стрессовые расстройства.
1. ВВЕДЕНИЕ
Посттравматическое стрессовое расстройство (ПТСР) определяется как набор психических, физических и эмоциональных признаков и симптомов, которые вызывают тревожное расстройство. ПТСР является причиной значительных изменений в кортизола, серотонина и чувствительности к глюкокортикоидных рецепторов (ГР). Таким образом, она развивается у человека, который был жертвой или свидетелем травматической ситуации, которая представляла угрозу его целостности или жизни окружающих его людей. Это расстройство вызывает гормональные изменения, связанные с гипоталамико-гипофиза надпочечников (HPA) оси и в экспрессии определенного гена (VUKOJEVIC et al. 2014). В то же время, связь между стрессом, ПТСР, и эпигенетика становится ясно, потому что даже если она не предполагает изменения себя в последовательности генетического кода, Есть изменения, которые могут привести к стимуляции или ингибирования экспрессии генов определенной информации. Такие изменения являются метилирование дезоксирибонуклеиновой кислоты (ДНК) и изменения в гистоны, которые представляют роль нормального развития и имеют решающее значение для выполнения правильного программирования экспрессии генов.
В этой статье мы обсудим в основном процесс метилирования ДНК основных генов РГС, минералокортикоидов (МР) и серотонина (HTR3A), который способствует адаптации к организму и влияет на восприимчивость к заболеваниям, которые, следовательно, также будут распространяться в следующих поколениях.
Гены HTR3A, NR3C1, NR3C2 и FKBP5 будут сосредоточены на этой статье. Во-первых, гиперметилирование гена NR3C1 приводит к его низкой экспрессии и снижению уровня кортизола. NR3C2 несет ответственность за снижение уровня MR и, следовательно, за уменьшение количества кортикотропина. Этот процесс происходит через метилирование гена, который выражает NR3C2 (PERROUD, 2014). HTR3A может быть связано с изменением структур мозга центральное место в обработке эмоций, особенно когда эти структуры подвергаются стрессу. Примечательно также потенциальное влияние серотонергической системы на патофизиологию аффективных расстройств, таких как ПТСР. Наконец, FKBP5, который выступает в качестве со-сопровождающего, модулируя активность RG в ответ на стрессоры во время беременности, а также связано с воздействием травмы генерирует возможность ребенка уже рождается с механизмом более адаптированы и склонны к развитию депрессии и ПТСР (PAQUETTE et al., 2014); (SCHECHTER et al., 2016).
1.1 ЭПИГЕНЕТИКА
Термин эпигенетика означает “в дополнение к генетической информации, закодированной в ДНК” и в целом используется для определения изменений, которые происходят в экспрессии генов без, однако, каких-либо изменений в последовательности генетического кода (COSTA et al., 2013).
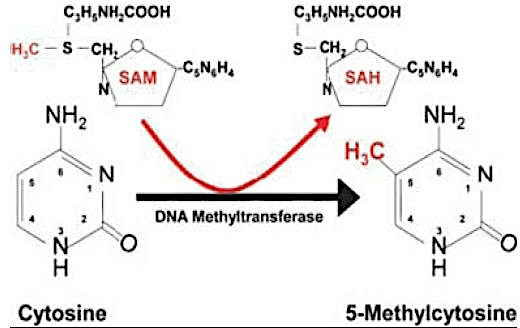
Некоторые эпигенетические механизмы включают метилирование ДНК, отпечаток, изменения в конформации хроматина, и РНК-опосредованное замалчивание. Метилирование ДНК является эпигенетической модификацией, наиболее часто используемой большинством живых существ в качестве агента регуляции экспрессии генов, и может быть охарактеризовано как фактор замалчивания генов. Он состоит из добавления метил-радикала (CH3) к углероду 5 цитозина, за которым обычно следуют гуанин (динуклеотид CpG), катализированный ферментами ДНК метилтрансферазы (ДНКMI) (COSTA et al., 2013); (AMLI et al., 2016).
Рисунок 01. Метилирование цитокина.
РЕГУЛИРОВКА ВАЛА 1.2 HPA
Активность оси HPA регулируется секреции HLC – кортикотрофного и вазопрессин-выпускающего гормона (AVP) – гипоталамуса, который, в свою очередь, активирует секрецию адренокортикотрофического гормона (АКТГ) гипофизом, который в конечном итоге стимулирует секрецию глюкокортикоидов через кору надпочечников. В этой точке зрения, глюкокортикоиды взаимодействуют со своими рецепторами в нескольких тканях-мишенях, включая ось HPA, где они отвечают за ингибирование отрицательной обратной связи секреции ACTH гипофиза и HLC из гипоталамуса (JURUENA et al., 2004).
Хотя глюкокортикоиды корректировать функции почти всех тканей в организме, наиболее известным физиологическим эффектом этих гормонов является регулирование энергетического метаболизма. В этом контексте несколько факторов контролируют активность оси HPA. Кроме того, есть доказательства прямой катехоламинергической, серотонинергической и дофаминергической иннервации в HLC-производящих нейронов в гипоталамусе, и эти и другие нейротрансмиттеры, кажется, влияют на выпуск HLC. Например, серотонин оказывает стимулирующее воздействие на HLC через подтипы рецепторов 5-HT1A, 5-HT1B, 5-HT1C и 5-HT2. Норадреналин имеет более переменный эффект, будучи стимулятором в низких дозах (через альфа-1 рецепторы) и ингибирование в высоких дозах (через бета-рецепторы) (JURUENA et al., 2004).
Эта статья была направлена на открытие эпигенетической взаимосвязи экспрессии генов в ПТСР через вышеупомянутые биомаркеры. Из изучения этих, их взаимодействие с регулированием и производительности в гипоталамус-гипофиза надпочечников оси было исследовано. Наконец, мы попытались понять, как такие изменения будут действовать при передаче этих генов будущим поколениям.
2. МЕТОДОЛОГИЯ
Исследование было разработано с помощью качественного подхода, который оправдан тем, что позволил распечатать исследованный мир с углублением научных данных, что позволяет лучше понять и провести анализ исследовательского объекта. Характер исследования состоял из систематического обзора литературы аналитического характера. Обоснование себя за содействие в строительстве широкого анализа литературы, способствуя как отражение реализации будущих исследований. Предубеждение было делимитировано со стрессом дескрипторов и эпигенетикой. Для консультаций в Виртуальной библиотеке было использовано в общей сложности 77 937 статей, таких, как “Сирень”, виртуальная библиотека здоровья (VHL), Scielo и MEDLINE через Pubmed, в общей сложности 77 937 статей, которые были представлены на новый обзор, проведенный путем прочтения названий, которые также позволили включить критерий, который будет статьи, касающиеся ПТСР; этот предварительный показ исключил 76 359 статей.
Читая название по критерию связи с ПТСР. Эти фильтры сократили количество статей примерно с 80 000 до 1578 статей. Эта систематизация того, как проводилось исследование, определяется на рисунке 02.
Новый этап тематической спецификации включал включение новых критериев включения и исключения, таких, как: человеческая раса, женщины, публикации в возрасте до 5 лет, исключение из обзора статей в возрасте от 19 до 44 лет. 89 статей, полученных в результате этой фильтрации, прошли анализ, в ходе которого были исключены дублирующие статьи, связанные с критериями исключения и включения, что привело к сокращению числа статей до 14 статей, которые были представлены на другой анализ, который касался чтения этих статей, с тем чтобы группа могла выбрать то, что было бы более актуальным для обзора.
Основное внимание было сосредоточено на статьях о жертвах стихийных бедствий, геноцидов или крупномасштабных травмирующих событий, которые, таким образом, привели к исключению статей, посвященных этой теме, но не соответствовали нашим целям по написанию настоящей обзорной статьи, и лишь восемь статей были полезны для тематического раздела, выбранного группой. Выбранные статьи были организованы и представлены в таблице 01.
Рисунок 02. Flowchart демонстрирует способ зрения линии исключения систематического обзора
Источ
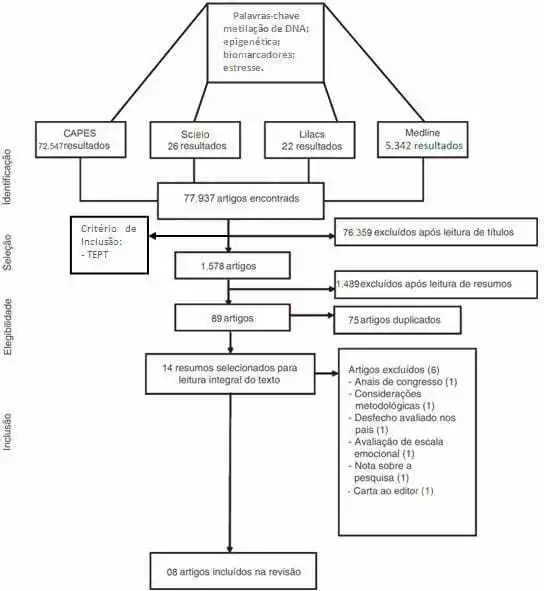
Таблица 01 Список авторов и их соответствующих статей и представление найденных результатов.
| Автор | Статьи | Исследование | Целей | Результаты |
| McNerney, MW et al (2018) 8 | Нейронная и эпигенетическая интеграция вклад в симптомы посттравматического стрессового расстройства : Роль объема гиппокампа и метилирования гена глюкокортикоидов. | Исследовательская статья | Статья направлена на определение того, сочетание мозга и эпигенетических изображений является лучшим предиктором симптоматологии ПТСР, чем любой фактор в одиночку.Измерение объема гиппокампа и метилирования цитозина. | Данные показали значительное взаимодействие между метилированием NR3C1 и размером гиппокампа. Полученные результаты укрепляют идею о том, что эпигенетика и нейронная анатомия могут быть использованы в качестве эффективного индикатора ПТСР |
| Schechter D.S et al (2016) | Ассоциация рецепторов серотонина 3A метилирования с воздействием материнского насилия, нервной активности и детской агрессии. | Отчет об исследованиях | В исследовании, о котором идет речь, изучался вопрос о том, может ли метилирование HTR3A быть связано с воздействием межличностного насилия (ИПВ), психопатологией, связанной с ИПВ, расстройством привязанности детей и материнской нервной активностью. | Частота воздействия материнского ИПВ была связана с материнским ПТСР; и материнский ПТСР-ПТСР, в свою очередь, был связан с детским SOD. |
| Perroud N et al(2014) | Геноцид тутси и трансгенеративная передача материнских усилий: эпигенетика и биология оси HPA. | Исследовательская статья | Изучение передачи родительского посттравматического стрессового расстройства (ПТСР) потомству, которое может быть объяснено передачей эпигенетических процессов, таких как метилирование статуса гена NR3C1 и глюкокортикоидного рецептора (GR) | Существует значительная корреляция между тяжестью ПТСР и депрессии у матерей и тяжестью ПТСР и депрессии у их детей, соответственно. |
| Paquette A.G et al (2014) | Посттравматическое стрессовое расстройство у пациентов с биполярным расстройством: обзор распространенности, коррепорты и стратегии лечения. | Когортное исследование | Исследование направлено на проверку гипотезы о том, что метилирование плацентарный FKBP5 и генетические изменения способствуют контролю экспрессии генов, и связаны с результатами развития детского нейроразвития. | Данные показывают, что младенцы с самым высоким уровнем метилирования будет испытывать снижение экспрессии FKBP5, в результате чего увеличение активации кортизола в глюкокортикоидных рецепторов в плаценте, которые могут повлиять на активацию глюкокортикоида ответ путь у развивающегося ребенка. |
| Lynn M. et al (2016) | Вариант риска для ПТСР в ширину генома является локусом количественного метилирования и дает снижение корковой активации и страшные лица | Когортное исследование | Это исследование направлено на понимание генетического риска ПТСР. Был замечен образец с экстремальным фенотипом проектирования и контроля случаев с аналогичными воздействиями. | BSBPCohort было общее среднее ПТСР симптомы оценки. Однако, как когорта была разработана с экстремальными фенотипами, тяжесть симптомов была гораздо выше в случаях ПТСР. |
| Vukojevic et al (2014) | Эпигенетическая модификация гена глюкокортикоидных рецепторов связана с травматической памятью и риском посттравматического стресса у переживших геноцид. | Поведенческие/когнитивные | Она направлена на анализ травматических событий, которые вызывают метилирование ДНК, и которая обеспечивает изменения в различных промоутеров RG и транскрипционных модификаций, в дополнение к анализу регулирования активности кортизола. Таким образом связывая эти факторы с гипоталамус-гипофиза-гипофиза-гипофиза надпочечников оси у людей с ПТСР. | Анализ также выявил основной эффект времени отбора проб кортизола. Частичные тесты показали, что уровень кортизола были значительно ниже в группе ПТСР по сравнению с контрольной группой для интервала времени между 30 и 45 минут после пробуждения (и между 45 и 60 минут после пробуждения, глюкокортикоидные рецепторы были значительно ниже в ПТСР по сравнению с другой группой сравнения.) |
| Kaminsky Z et al ( 2015) | Эпигенетическая и генетическая вариация в предикате суицидального поведения ska2 и посттравматическом стрессовом расстройстве. | Оригинал статьи | Цель состояла в том, чтобы исследовать взаимодействие SKA2 и воздействие травмы в функции оси hpa, попытка самоубийства и ПТСР | Было отмечено, что эпигенетический и генетический биомаркер, SKA2, предсказал случаи ПТСР у гражданских лиц, когда жестокое обращение с детьми было включено |
| MULLIGAN C.J. et al (2012) | Метилирование в NR3C1 у новорожденных, связанных с воздействием материнского пренатального стресса и веса новорожденных | Интегрированная статья | Целью исследования является проверка идеи о том, что экстремальные материнские психосоциальные стрессоры, наблюдаемые в Демократической Республике Конго, могут изменять эпигенетические следы специфического локуса у новорожденных, что приводит к изменению результатов для здоровья. | Она пришла к выводу, что увеличение метилирования может ограничить податливость экспрессии генов и ограничить диапазон возможных ответных мер по адаптации к стрессу у пострадавших лиц, тем самым увеличивая риск заболеваний ПТСР в зрелом возрасте. |
Источник: Авторы исследования (2019).
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1 ГИПЕРМЕТИЛИРОВАНИЕ, ГИПОМЕТИЛИРОВАНИЕ И ПТСР
Процесс метилирования играет ключевую роль в эмбриональном развитии, инактивации Х-хромосомы, регуляции генов, модификациях геномного отпечатка и хроматина. Однако в процессе метилирования существуют два механизма регулирования экспрессии генов: гиперметилирование и гипометилирование. Гипометилирование ДНК обычно вызывает увеличение экспрессии генов, но гиперметилирование уменьшает экспрессию определенных генов (VUKOJEVIC, 2014).
Естественно, метилирование моделей генома изменения с приходом сенесценции. Большую часть времени гипометилирование происходит одновременно с гиперметилированием некоторых островов CPG, распределенных в периодических последовательностях, а также транскрипционно важных генов. Эпигенетические изменения непосредственно связаны с возрастом, способствуя различным приобретенным расстройствам или заболеваниям (FRAGA et al., 2005).
Повторное воздействие стресса в детстве предрасполагает нейробиологической реакции, которая поддерживается на протяжении всей жизни человека, и может негативно повлиять на психическое здоровье. Предыдущие исследования эффективно показали, что экологические стрессоры, не только в раннем возрасте, но и во время беременности, увеличить состояние метилирования 1F экзон гена NR3C1. В головном мозге гиппокамп является обильной областью в ПP, которая также выражает промоутер NR3C1-1F. Кроме того, есть записи, что гиппокамп чувствителен к стрессу на биохимическом и структурном уровне. Таким образом, метилирование ДНК было связано с изменениями плотности ПP в гиппокампе после воздействия экологического стресса. Таким образом, исследования показывают, что либо из-за воздействия стресса и возможной потери объема гиппокампа или состояние гипометилирования инината в сочетании с более низким объемом гиппокампа, они способны предрасполагать человека к ПТСР (MCNERNEY et al., 2018).
Нельзя утверждать, что ПТСР связан с объемом гиппокампа. Хотя это противоречие может быть оправдано тем, что не все важные переменные, участвующие в объемах гиппокампа и ПТСР были полностью рассмотрены в качестве механизма метилирования ДНК (PERROUD et al., 2014).
Производительность гиперметилирования способна эффективно нарушить баланс оси HPA, что объясняет, как уровни кортизола (YEHUDA et al., 2009) изменены находятся у детей выживших в катастрофе с диагнозом ПТСР. Таким образом, эпигенетика может предоставить важную информацию о патофизиологии ПТСР, что позволяет понять, как происходит трансгенерация этого расстройства (PERROUD et al., 2014); (JURUENA et al., 2004).
Эпигенетические изменения в птср перевозчика и распространения для их потомства.
Это эпигенетическое изменение напрямую связано с оси HPA, которая в основном отвечает за нейроэндокринную регуляции физиологических процессов. Однако, для человека с ПТСР, функционирование этой оси изменения в качестве одной из форм адаптации, которые могут быть связаны с низким уровнем кортизола. Таким образом, некоторые исследования показывают, что этот процесс связан с началом развития психических заболеваний, и, вероятно, имеет свой внешний вид из матки, как следствие отражения глюкокортикоида программирования через эпигенетику (BRAND et al., 2006).
Эти исследования показывают, что увеличение метилирования гена NR3C1, ответственного за ПP кодирования, вызывает г-н дисбаланс – кодируется геном NR3C2 – по существу приводит к снижению доступности RG обеспечивая большую восприимчивость этого человека к стресс-связанных психических заболеваний, таких как депрессия и ПТСР (BRAND et al., 2006; MULLIGAN et al., 2012)
В добавлении к этому фактору изменения структуры в ДНК людей, которые страдают от вмешательства внешних стрессоров, несколько исследований показывают, что ПТСР является сильным коррелирует для развития этой же патологии в будущих поколениях (ROBERTS et al., 2012). Распространение трансгенерации связано с передачей адаптивных биологических изменений на оси HPA. ПТСР вызывает изменение нейроэндокринного баланса оси HPA, особенно когда дело доходит до секреции низкого уровня кортизола, и эта низкая секреция также увеличивается с помощью противовоспалительных препаратов, которые являются частью группы кортикостероидов, которые прививают производство кортизола организмом, а также повышение его низкой секреции, что, следовательно, увеличивает вероятность развития потомства родителей с ПТСР приобретения в будущем . , 2006), (LABONTÉ et al., 2014). Низкий уровень кортизола по отношению к родительскому ПТСР, как представляется, присутствует в раннем развитии ребенка – вероятно, из матки, так как они вызывают перепрограммирование ПP через эпигенетические изменения, которые способствуют появлению расстройств в генетической экспрессии (RADTKE et al., 2011). Фетальная реакция на уровень кортизола указывает на то, что воздействие материнского гестационного стресса оказывает длительное воздействие на развитие этого ребенка за счет увеличения метилирования гена, продвигаемого RG, который сохраняется вне детства (RADTKE et al., 2011), (LABONTÉ et al., 2014). Это представляет собой адаптивное программирование плода оси HPA, которое может быть ответственным за более поздние психологические проблемы, такие как депрессия или ПТСР. С этой точки зрения, плод подвергается изменению уровня кортизола в материнской циркуляции связано с неврологическими и проблемами развития следующего поколения (BRAND et al., 2006).
Плацента, центральный орган развития плода, регулирует воздействие и обратную связь с материнской сигнализацией, изменяя среду развития плода. Эпигенетические механизмы, такие как метилирование ДНК, когда они происходят в регионах регулирования, изменяют плацентарную функцию, изменяя транскрипцию генов или потенциал транскрипции (PAQUETTE et al., 2014). FKBP5 (Связывающий белок FK506) снижает чувствительность RG и предотвращает ядерную транслокацию, что, следовательно, снижает отзывчивость высвобождения кортизола (KAMINSKY et al., 2015). Метилирование FKBP5 в пределах регулятивной области на интрон 7 связано с неврологическими изменениями. Было отмечено, что интрон 7 связывается с местом начала транскрипции FKBP5 и метилирование изменяет индукцию FKBP5. В линии клеток гиппокампа человека кортизол вызывает деметилирование этой регулятивной области в пределах интрона 7 в критические периоды клеточной дифференциации и пролиферации. Полиморфизм FKBP5 также связан с измененной индукцией mrna, которая определяет изменения в размере гиппокампа, а также заболевания, связанные с изменениями оси HPA, такие как ПТСР (SCHECHTER et al., 2016); (KAMINSKY et al., 2015).
Исследования показывают, что плод с геном, расположенным в гиперметилированном интроне 7, будет испытывать снижение экспрессии FKBP5, что приводит к большей чувствительности ПP к кортизолу из материнской циркуляции в плаценте, тем самым влияя на развитие плода. Исследования до биомаркера FKBP5 наблюдали ассоциации с ПТСР, которые характеризуются гипербдигантным и гиперволноватым поведением. Таким образом, изменения в FKBP5 уменьшить кортизола влияние поведение, способствуя гипербдигантной реакции. Лица с повышенным метилированием FKBP5 в утробе матери имеют мало-активный путь реакции кортизола при рождении, становится предрасположенным к развитию расстройств, связанных с гиперответственностью оси hpa, таких как ПТСР или тревога (KAMINSKY et al., 2015). Затем было проанализировано, что этот биомаркер имеет свою функциональную актуальность для эпигенетического контроля, который до сих пор неизвестен и может изменить развитие плода, особенно при нейровиотеральной разработке. Таким образом, исследования эффективно показывают, что внешние стрессоры, активно влияющие во время беременности, вызывают гиперметилирование 1F этилового спирта гена NR3C1 и области промоутера RG, чтобы значительно вмешаться во взрослую жизнь (RADTKE et al., 2011).
Это явление имеет отношение к длительному изменению баланса оси HPA и изменению уровня кортизола, обнаруженного у детей жертв стихийных или антропогенных катастроф, у которых был диагностирован ПТСР. Таким образом, эпигенетика может предоставить информацию о поведении биомаркеров и макроструктурных проявлений для того, чтобы прояснить трансгенерационную передачу этого расстройства.
Рисунок 03. Метилирование ДНК- Базовые пары образуют ДНК. Эти пары переплетаются в белках, называемых гистонами. Эта структура похожа на “жемчужное ожерелье”, которое образует хроматин. Метилирование является основным эпигенетическим механизмом.
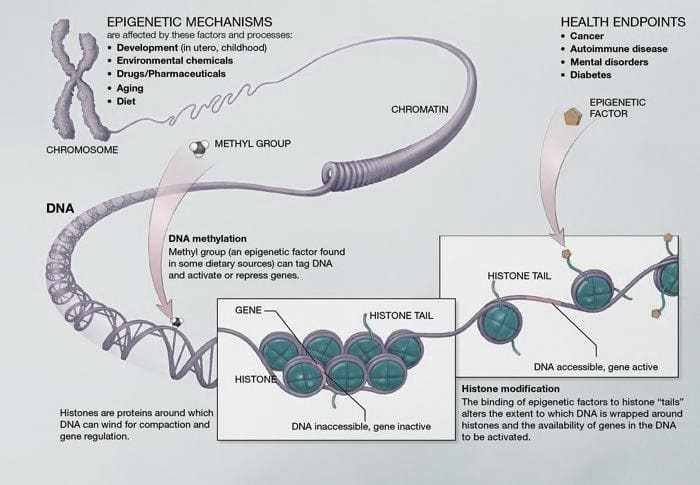
3.2 РОЛЬ ЭПИГЕНЕТИЧЕСКИХ ИЗМЕНЕНИЙ В ОБЪЕМЕ ГИППОКАМПА И ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ
В настоящее время метилирование гена NR3C1 коррелирует с объемом гиппокампа и депрессией. Гиппокамп чувствителен к стрессу и очень реагирует на метилирование этого биомаркера. Соотнося эти факторы с нейровизуацией и эпигенетическими механизмами, они использовались для создания основы для интересной ориентации в исследованиях, связанных с ПТСР и изменениями генотипов. В целом, ПТСР выявил отрицательный ответ между размером NR3C1 и гиппокампа. Кроме того, сильная связь между этим биомаркером, гиппокампом, РГС и птср-реакцией. В частности, гиппокамп регулирует активность оси HPA и, следовательно, действие глюкокортикоидов, таких как кортизол. Таким образом, значительно увеличивая признаки стресса в организме (PERROUD et al.,2014), (AMLI et al., 2016).
Это привело бы нас к ожидать, что более низкие значения метилирования связаны с меньшего размера гиппокампа, который ветераны войны, которые, вероятно, не имеют ПТСР должны иметь. Тем не менее, ПТСР связан с гипометилированием в целом, и это проверено, что эта связь теряется, потому что более низкие значения метилирования также может произойти, независимо от размера гиппокампа. Будущие исследования должны быть проведены, чтобы определить, является ли эта тенденция остается той же у здоровых людей, других ветеранов или гражданских групп с ПТСР, а также у пациентов с другими психическими расстройствами (AMLI et al., 2016).
Взаимосвязь между объемом гиппокампа и ПТСР в настоящее время является спорным в литературе. Изображения исследования показывают, что после боя ПТСР ветераны имеют меньший объем гиппокампа по сравнению с ветеранами без ПТСР. Тем не менее, другие исследования не смогли повторить эту связь. Вероятная причина такого несоответствия в результатах связана с тем, что ПТСР является многофакторным расстройством (AMLI et al., 2016), (LABONTÉ et al., 2014). Таким образом, понимание биологической основы этого расстройства требует больше, чем просто нейровизуализ для анализа взаимосвязи ПТСР с объемом и функционированием гиппокампа. Поэтому крайне важно интегрировать знания в области визуализации, биохимии и эпигенетики, с тем чтобы углубить современные знания об этом расстройстве.
4. ЗАКЛЮЧИТЕЛЬНЫЕ СООБРАЖЕНИЯ
В этой статье, после изучения биомаркеров цитируется, которые выражаются или нет эпигенетических изменений, мы можем указать на некоторые из наиболее актуальных результатов в исследованиях по ПТСР и следить за тем, как эти статьи обеспечивают интересные и разнообразные перспективы для преждевременного открытия предрасположенности к определенным психологическим расстройствам. Хотя статьи не являются окончательными, результаты их исследований показывают, что травматические события в ПТСР в макроструктуре тела оправданы путем изменения метилирования ДНК, которые изменяют экспрессию генов и, следовательно, активность оси HPA. Таким образом, ПТСР не только производит изменения в оси нейроэндокринного контроля тела, но и изменения могут быть распространены на будущие поколения, которые изменяют механизм потомства действовать и аналогичным образом с механизмом его родителей.
Хотя диапазон информации по этому вопросу является широким, некоторые изученные статьи выявили необходимость дальнейших исследований для получения более глубокого исследования по этому вопросу. Таким образом, можно было бы консолидировать информацию, полученную в вышеупомянутых исследованиях.
ССЫЛКИ
AMLI, Lynn M. et al. A Genome-Wide Identified Risk Variant for PTSD is a Methylation Quantitative Trait Locus and Confers Decreased Cortical Activation to Fearful Faces. Am J Med Genet B Neuropsychiatr Genet. Georgia, p. 327-336. 18 maio 2018. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4844461/>. Acesso em: 22/11/ 2019.
BRAND, Sarah R. et al. The effect of maternal PTSD following in utero trauma exposure on behavior and temperament in the 9-month-old infant. Annals of the New York Academy of Science. Nova Iorque, p. 454-458. abr. 2006. Disponível em: <https://nyaspubs.onlinelibrary.wiley.com/doi/full/10.1196/annals.1364.041>. Acesso em: 30/10/2019.
COSTA, Everton de Brito Oliveira; PACHECO, Cristiane. Epigenetics: gene expression regulation at transcriptional level and its implications. Semina. Londrina, p. 125-136. dez. 2013. Disponível em: <http://www.uel.br/revistas/uel/index.php/seminabio/article/viewFile/5142/13877>. Acesso em: 01 fev. 2019
FRAGA, Mario F. et al. Epigenetic differences arise during the lifetime of monozygotic twins. Epigenetics Differences Arise During The Lifetime Of Monozygotic Twins. Proceedings Of The Proceedings Of The National Academy Of Sciences Of The United States Of America. Seattle, p. 106-117. 17 jan. 2005. Disponível em: <https://www.pnas.org/content/102/30/10604.long>. Acesso em: 27/10/2019.
HARRIS, Angela P. et al. Mineralocorticoid and glucocorticoid receptor balance in control of HPA axis and behaviour. Psychoneuroendocrinology. Edimburgo, p. 648-658. maio 2013. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0306453012002983?via%3Dihub>. Acesso em: 11/09/2019
https://www.tandfonline.com/doi/abs/10.3109/15622975.2013.866693?journalCode=iwbp20. Acesso em: 7 ago. 2019.
JURUENA, Mario F; CLEARE, Anthony J; PARIANTE, Carmine M. The Hypothalamic Pituitary Adrenal axis, Glucocorticoid receptor function and relevance to depression. Rev. Bras. Psiquiatr. São Paulo, v. 26, n. 3, p. 189-201, Setembro 2004. Disponível em: <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-44462004000300009&lng=en&nrm=iso>. Acesso em: 22/11/2019.
KAMINSKY, Z et al. Epigenetic and genetic variation at SKA2 predict suicidal behavior and post-traumatic stress disorder. Translational Psychiatry. Baltimore, p. 627-639. 25 ago. 2015. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4564560/>. Acesso em: 20/11/2019.
LABONTÉ, Benoit et al. Epigenetic modulation of glucocorticoid receptors in posttraumatic stress disorder. Translational Psychiatry. Montreal, p. 368-381. abr. 2014. Disponível em: <https://www.nature.com/articles/tp20143>. Acesso em: 31/10/2019.
MCNERNEY, M. Windy et al. Integration of neural and epigenetic contributions to posttraumatic stress symptoms: The role of hippocampal volume and glucocorticoid receptor gene methylation. Plos One. California, p. 421-434. 07 fev. 2018. Disponível em: <https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0192222>. Acesso em: 10 dez. 2019.
MULLIGAN, Connie et al. Methylation changes at NR3C1 in newborns associate with maternal prenatal stress exposure and newborn birth weight. Epigenetics. Florida, p. 853-857. jul. 2012. Disponível em: <https://www.tandfonline.com/doi/abs/10.4161/epi.21180>. Acesso em: 08 /12/2019.
NEUGEBAUER, Richard et al. Post-traumatic stress reactions among Rwandan children and adolescents in the early aftermath of genocide. International Journal Of Epidemiology. Nova Iorque, p. 1033-1045. ago. 2009. Disponível em: <https://academic.oup.com/ije/article/38/4/1033/849053>. Acesso em: 20 /12/ 2019.
PAQUETTE, Alison G. et al. Placental FKBP5 genetic and epigenetic variation is associated with infant neurobehavioral outcomes in the RICHS cohort. Plos One. New Hampshire, 12 ago. 2014. p. 133-143. Disponível em: <https://www.ncbi.nlm.nih.gov/pubmed/25115650>. Acesso em: 20 out. 2019.
PERROUD, Nader et al. The Tutsi genocide and transgenerational transmission of maternal stress: epigenetics and biology of the HPA axis. The World Journal Of Biological Psychiatry. Genebra, 01 abr. 2014. p. 334-345. Disponível em:
RADTKE, Karl M. et al. Transgenerational impact of intimate partner violence on methylation in the promoter of the glucocorticoid receptor. Translational Psychiatry. Konstanz, p. 456-470. jul. 2011. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3309516/>. Acesso em: 20/10/2018
ROBERTS, Andrea L et al. Posttraumatic stress disorder across two generations: concordance and mechanisms in a population-based sample. Biol Psychiatry. Massachussetts, p. 505-511. abr. 2012. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3412195/>. Acesso em: 21/09/2019.
SCHECHTER, Daniel S. et al. The association of serotonin receptor 3A methylation with maternal violence exposure, neural activity, and child aggression. Behavioural Brain Research. Genebra, p. 268-277. 15 maio 2017. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0166432816307720?via%3Dihub>. Acesso em: 20 out. 2019.
VUKOJEVIC, Vanja et al. Epigenetic Modification of the Glucocorticoid Receptor Gene Is Linked to Traumatic Memory and Post-Traumatic Stress Disorder Risk in Genocide Survivors. The Journal Of Neuroscience. Suiça, p. 10274-10284. 30 de julho 2014. Disponível em: http://www.jneurosci.org/content/34/31/10274.long. Acesso em: 02 nov. 2019.
YEHUDA, Rachel; BIERER, Linda M. Transgenerational transmission of cortisol and PTSD risk. Progress In Brain Research. Nova Iorque, p. 121-135. nov. 2007. Disponível em: <https://www.sciencedirect.com/science/article/pii/S0079612307670095?via%3Dihub>. Acesso em: 19/11/2019.
[1] Академик Медицинского курса Центра Университета Тирадентеса (UNIT-AL).
[2] Академик Медицинского курса Центра Университета Тирадентеса (UNIT-AL).
[3] Академик Медицинского курса Центра Университета Тирадентеса (UNIT-AL).
[4] Академический медицинский курс Университетского центра Маурисио де Нассау (UNINASSAU).
[5] Профессор, магистр, доцент медицинского курса Центра Университета Тирадентеса (UNIT-AL).
Отправлено: январь 2020 года.
Утверждено: август 2020 года.