ARTÍCULO ORIGINAL
FERREIRA, Fernanda Amorim [1], PARAÍBA, Isabella Maria Rios [2], ELIAS, Laíse de Souza [3]
FERREIRA, Fernanda Amorim. PARAÍBA, Isabella Maria Rios. ELIAS, Laíse de Souza. Efecto de la melatonina en la morfofisiología cardíaca de ratas inducida hiperlipidemia. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 10, Vol. 13, págs. 130-143. Octubre de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/nutricion/efecto-de-la-melatonina
RESUMEN
Las hiperlipidemias se clasifican como alteraciones metabólicas y están relacionadas con enfermedades cardiovasculares, que destacan la enfermedad aterotótica coronaria. Las enfermedades cardiovasculares tienen una notable participación en las tasas de mortalidad en todo el mundo y, como resultado, ha sido el blanco de la investigación que busca la innovación terapéutica. La melatonina es una hormona producida en una fase ambiental de la oscuridad por la glándula pineal que juega antioxidante, reducción de lípidos, función antiinflamatoria, entre otros, demostrando así ser una molécula potente en el tratamiento de enfermedades cardiovasculares. Por lo tanto, el objetivo de este trabajo es evaluar el efecto de la melatonina en el estrés oxidativo y parámetros bioquímicos en ratas inducidas por hiperlipidemia. Para ello, se utilizaron 15 ratas albinas machos (Rattus norvegicus albinus), con 150 días de edad, procedentes del bioterio del departamento de Morfología y Fisiología Animal de la Universidad Rural Federal de Pernambuco. Estos animales se mantuvieron en jaulas, con alimentación y agua ad libitum, temperatura de 22oC e iluminación artificial que establecerá un fotoperiodo de 12 horas de luz y 12 horas de oscuridad (ciclo invertido). En conclusión, estudios han demostrado que la melatonina tiene efectos en la reducción de la peroxidación lipídica, niveles de creatina quinasa (CK), así como reducir la reducción de glutatión. Como un fármaco barato y bien tolerado, melatonina puede ser una nueva opción terapéutica para enfermedades cardiovasculares y personas con hiperlipidemia.
Palabras clave: Aterosclerosis, melatonina, corazón, hiperlipidemia, estrés oxidativo.
INTRODUCCIÓN
Las hiperlipidemias son alteraciones metabólicas que se producen cuando los niveles de lípidos circulantes exceden los límites de normalidad en el torrente sanguíneo (BEVILACQUA et al., 2007). Esta producción no regulada puede causar problemas graves, incluyendo enfermedades cardiovasculares (ECV), como hipertensión, aterosclerosis, además de daños a diferentes órganos y tejidos, caracterizando así un grave problema de salud pública (EMET et al., 2016).
Las ECV tienen una notable participación en las tasas de mortalidad en todo el mundo y, como resultado, ha sido el blanco de investigaciones que buscan innovaciones terapéuticas. (SIMKO et al., 2016). Así, en las últimas décadas, la búsqueda de nuevos fármacos para el tratamiento de la hiperlipidemia ha valorado el papel de las sustancias que actúan en el control del aumento del perfil lipídico y la inflamación, además de proteger el endotelio vascular contra el estrés oxidativo (JOCKERS et al., 2016). Entre estas sustancias, la melatonina ha recibido mucha repercusión para el tratamiento de lesiones en varios órganos, incluyendo el corazón (YANG et al., 2014).
La melatonina (N-acetil-5-metoxitripptalina) (MEL) es una hormona neuroendocrina producida por la glándula pineal (HARDELAND et al., 2006). Su secreción está regulada por el ciclo de luz/oscuridad ambiental a través del núcleo supraquiasmático (SKENE et al., 2006). Desde que comenzó su biosíntesis por la noche, a partir de fotorreceptores de la retina que envían señal a la glándula pineal, estimulando la producción y liberación de melatonina (GOOLEY et al., 2003). El mecanismo de acción de MEL depende de los receptores de membrana llamados MT1, MT2 y MT3, que se expresan tanto individualmente como juntos en diversos tejidos y órganos, los dos primeros se expresan tanto en el corazón como en la arteria de la rata (CAHILL; GRACE; BESHARSE, 1991) (LI; ZHANG; TANG, 2013).
Mediante la presentación de receptores ampliamente distribuidos por el cuerpo, MEL puede ser responsable de una serie de eventos fisiológicos (FARÍAS; ZEPEDA; CALAF, 2012). Inicialmente su función se limitó a la regulación del ciclo de sueño/vigilia (SUN; HUANG; QU, 2015) sin embargo, a lo largo de los años también se han divulgado otras funciones, tales como su papel antioxidante y antiinflamatorio, en la regulación del metabolismo de los lípidos y la glucosa, (AGIL et al., 2011) (ESPINO; PARIENTE; RODRIGUEZ, 2011) así como su efecto cardioprotector, que tiene un papel importante en las enfermedades del corazón (TAN et al., 1998), como lesión por isquemia-reperfusión miocárdica, aterosclerosis, hipertensión e insuficiencia cardíaca. (FAVERO et al., 2012) (BENOVA et al., 2013) (DOMINGUEZ; ABREU-GONZALEZ; REITER, 2014).
Los estudios en ratas encontraron que MEL produjo un efecto cardioprotector contra la cardiotoxicidad inducida por agentes quimioterápicos y recientemente la amplitud del efecto protector cardíaco ejercido por MEL (SUN; GUSDON; QU, 2016). Además, se encontró que la melatonina era eficiente en la reducción de los efectos de la isquemia inducida en los corazones de las ratas (YU et al., 2014), reduciendo la frecuencia cardíaca, reduciendo los niveles de proteína creatina quinasa, (FAVERO et al., 2016), preservación de la microestructura cardiomiocitos (LIN et al., 2018), reducción de las arritmias cardíacas y la oxidación de lípidos resultantes de procesos isquémicos cardíacos (TARE et al., 2014), además de mejorar la función cardíaca y el flujo sanguíneo (ZHANG et al., 2017).
En vista del aumento de la hiperlipidemia (KANG; KOH; LEE, 2011) y consecuentemente enfermedades cardiovasculares (HARDELAND, 2015) y que la melatonina desempeña la función antioxidante, (PANDI-PERUMAL et al., 2013) (COMMENTZ; HELMKE, 1995), (REITER et al., 2013) antiinflamatorio y reducción de lípidos (ALLEGRA et al., 2003), es necesario estudiar la eficacia del efecto de la melatonina en la morfofisiología cardíaca en ratas inducidas por hiperlipidemia. Así, esta investigación puede contribuir al desarrollo de métodos terapéuticos complementarios en el tratamiento de la hiperlipidemia, así como enfermedades cardiovasculares. El presente estudio tuvo como objetivo evaluar el efecto de la melatonina en la morfofisiología cardíaca de ratas inducidas a la hiperlipidemia.
1. MATERIALES Y MÉTODOS
1.1 GRUPOS EXPERIMENTALES
Utilizamos 15 ratas albina macho (Rattus norvegicus albinus), de 150 días de edad, del bioterium del Departamento de Morfología y Fisiología Animal de la Universidad Rural Federal de Pernambuco. Estos animales se mantuvieron en jaulas, con alimentación y agua ad libitum, temperatura de 22oC e iluminación artificial que estableció un fotoperiodo de 12 horas de luz y 12 horas de oscuridad (ciclo invertido). Los animales fueron pesados y divididos aleatoriamente en tres grupos experimentales: GC: ratas sin inducción de hiperlipidemia; GI: ratas inducidas a la hiperlipidemia y tratadas con placebo; GM: ratas inducidas a la hiperlipidemia y tratadas con melatonina.
1.2 INDUCCIÓN DE HIPERLIPIDEMIA
Para inducir hiperlipidemia, Triton WR 1339 se administró por vía intraperitoneal durante treinta días, también conocido como tyloxapol, un detergente no aniónico de estructura polimérica, a una dosis de 400mg/kg de peso corporal, disuelto en NaCl al 0,9%. Esta sustancia se ha utilizado en estudios experimentales porque es capaz de causar hiperlipidemia en animales. Los análisis bioquímicos se utilizaron para realizar un seguimiento de la hiperlipidemia después del tercer día de inducción, según labtest® kits, siguiendo los catálogos especificados: LDL, HDL, triglicéridos y colesterol total. Los animales no inducidos a la hiperlipidemia (GC) recibieron dosis equivalentes de solución salina de la misma manera.
1.3 ADMINISTRACIÓN DE MELATONINA
La melatonina se administró por vía oral (VO), por lo que 10mg/kg de melatonina se disolvió en 200 microlitros de alcohol. Entonces, a las 7:00 a.m., esta solución se diluyó en el agua potable de los animales, vale la pena señalar que las botellas fueron recubiertas con papel de aluminio para proteger el contenido de luminosidad.
1.4 ANÁLISIS BIOQUÍMICO
Se recogieron muestras de sangre en los períodos previos a la inducción y después del tratamiento. Para el análisis antes del período de inducción, las ratas fueron movilizadas por contención mecánica y la sangre recogida por punción caudal lateral con el uso de catéter (24G). Para el análisis después de la inducción y su tratamiento respectivo, la sangre se recogió por punción cardíaca. El material fue centrifugado, el sobrenadante embalado en Eppendorf y mantenido en un congelador a -20oC hasta el momento de las dosis. Para ello, se utilizó el kit Labtest®, siguiendo el catálogo específico: proteína CK (133-1/500).
1.5 ANÁLISIS DE ESTRÉS OXIDATIVO: PEROXIDACIÓN LIPÍDICA Y GLUTATIÓN REDUCIDO
La peroxidación lipídica se estimó midiendo los niveles de sustancias reactivas del ácido tiobarbitúrico (TBARS), mientras que la reducción de glutatión (GSH) se determinó midiendo los grupos de sulfhidrión no proteico. Para ello, se maceraron fragmentos del corazón en KCl, 1,15% en una proporción de 10 ml/1g hasta la homogeneización completa del material recogido. El homogeneato se transfirió a un tubo de ensayo, al que se añadieron 2 ml de regente (0,375% ácido tiobarbitúrico y 75% ácido tricloroacético) a cada ml de la mezcla. Los tubos duplicados se sellaron y calentaron en un baño de agua (100 oC) durante 15 minutos. El overnum se separó y la absorbancia se midió a 535 nm.
1.6 PROCEDIMIENTOS ÉTICOS
El experimento fue desarrollado de acuerdo con los Principios éticos en la Experimentación Animal, de acuerdo con la Ley No 11.794 de 8 de octubre de 2008, y el proyecto fue aprobado por la Comisión de ética sobre el uso de animales (CEUA) de la Universidad Rural Federal de Pernambuco (UFRPE – número de proceso 23082.015842/2014) (ANEXO A).
1.7 ANÁLISIS ESTADÍSTICO
Los análisis estadísticos se realizaron utilizando el método no paramétrico Kruskal-Wallis, donde los medios fueron comparados por la prueba Wilcoxon-Mann Whitney, el 95% de importancia.
2. RESULTADOS Y DISCUSIÓN
El daño oxidativo inducido en células y tejidos se ha relacionado con procesos fisiológicos y con la etiología de diversas enfermedades, como el envejecimiento, y enfermedades crónicas como la diabetes, el cáncer y la aterosclerosis, donde a menudo se observa el aumento del contenido de las especies reactivas de oxígeno (EROs) más importantes en el contexto biológico (ROSEN et al., 2001) (HIGASSHI et al., 2014).
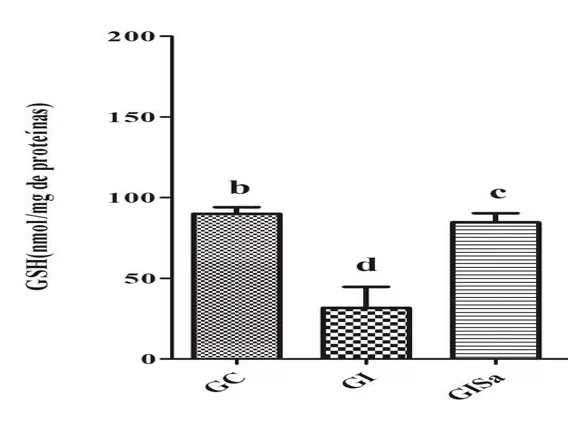
Los análisis de los niveles de TBARS en el tejido cardíaco después de la inducción a la hiperlipidemia revelaron valores altos en comparación con el grupo de control. Sin embargo, el tratamiento con melatonina atenió los niveles de TBARs, presentando valores similares a GC (Figura 1). El análisis tisular de los niveles de GSH en el grupo inducido y tratado con melatonina fue superior a los animales del grupo GI, demostrando también valores similares a los del grupo de control (Figura 2). Con esto, nos dimos cuenta de que la melatonina era capaz de reducir el daño oxidativo.
Esta hormona tiene la capacidad de secuestrar especies de oxígeno reactivo (EROs) y nitrógeno (ERN), actuando para prevenir el daño oxidativo (ALVES et al., 2014) además de estimular la expresión de enzimas antioxidantes (PANDI-PERUMAL et al., 2013) a través del crecimiento de la expresión del Keap1-Nrf2 (MANCHESTER et al., 2015).
ONK (2016) encontró que el uso de 20mg/kg de melatonina dio lugar a disminución de los niveles de TBARS. Del mismo modo, Debosree Ghosh (2015) demostró que la dosis mínima de 10 mg/kg de melatonina era necesaria para proteger contra el aumento de la peroxidación lipídica en los glóbulos rojos de las ratas.
Numerosos estudios se han divulgado demostrando el efecto aislado de la melatonina en la promoción de los niveles de GSH, por ejemplo, aumento de los niveles de GSH se han demostrado en animales con daño hepático inducido por tioacetamida (TAA) y tratados con melatonina (10 mg/kg) Czechowska (2015) y Goc (2017), observaron altos niveles de GSH en el tejido hepático de animales tratados con 10 mg/kg de MEL solos o en combinación con nitroprusido sódico (SNP), un fármaco antihipertensivo con efectos tóxicos, en comparación con la administración aislada del SNP.
En nuestro estudio, el grupo inducido a la hiperlipidemia y tratado con melatonina, demostró una reducción en los niveles de proteína Ck en comparación con el grupo hiperlipidémico (GI), sin embargo, en relación con el grupo de control, no se observó ninguna alteración significativa (Tabla 1).
La creatina quinasa (CK) es una enzima que desempeña un papel importante en la generación de energía para el metabolismo muscular. Está presente predominantemente en el tejido muscular, pero también se encuentra en el tejido cerebral (BRANCACCIO et al., 2008). Entre las moléculas utilizadas como marcador de daño cardíaco, la creatina quinasa (CK) se describe a menudo como el mejor marcador indirecto de daño al tejido muscular (FOSCHINI et al., 2017). Esta reducción en los niveles de CK se puede atribuir a los efectos de estabilización de membrana dados por MEL. Los estudios in vitro muestran que MEL es capaz de inhibir la internalización de la fosfatidilserina, la expresión de bax y la xantina oxidasa, causando así la estabilización de la bica proa lipídica (KOCIC et al., 2017).
Ghaeli (2015), informa que en pacientes con infarto de miocardio con sobrenivelación del segmento ST sometido a intervención coronaria percutánea primaria, administración de melatonina más tratamiento estándar disminuyó considerablemente el nivel de creatina quinasa-MB. Además, MEL todavía tiene efectos antiinflamatorios y anti-apoptóticos, pudiendo así actuar en el control de enfermedades cardiovasculares (CHEN et al., 2016).
3. CONCLUSIÓN
En conclusión, estudios han demostrado que la melatonina tiene efectos en la reducción de la peroxidación lipídica, niveles de creatina quinasa (CK), así como aumentar la reducción de glutatión en ratas inducidas por hiperlipidemia.
REFERENCIAS
AGIL, A, Navarro-Alarcon M, Ruiz R, et al. Beneficial effects of melatonin on obesity and lipid profile in young Zucker diabetic fatty rats. J Pineal Res 2011; 50:207–212.
ALLEGRA, M.; REITER, R. J.; TAN, D. X.; et al. The chemistry of melatonin’s interaction with species. J. Pineal Res., v.34, n.1, p. 1–10, 2003.
ALVES, R.S.C. et al. A melatonina e o sono em crianças. Pediatria. v. 1, p. 587-594,2004.
BRANCACCIO, P.; Maffulli, N.; Buonauro, R. Serum enzyme monitoring in sports medicine. Clin Sports Med 2008. 27:1-1.
BENOVA, T, Viczenczova C, Radosinska J, et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol 2013; 91:633–639.
BEVILACQUA, MR, GIMENO SGA, BEVILACQUA MR, Matsumura LK, et al. Hiperlipidemias e Fatores Dietéticos: Estudo Transversal Entre Nipo-Brasileiros. Arq Bras Endocrinol Metab. 2007 mar/out; 51/4: 547-558.
CAHILL, GM, Grace MS, Besharse JC. Rhythmic regulation of retinal melatonin: metabolic pathways, neurochemical mechanisms, and the ocular circadian clock. Cell Mol Neurobiol 1991; 11:529–560.
CHEN, S,J. et al. Melatonin enhances interleukin-10 expression and suppresses chemotaxis to inhibit inflammation in situ and reduce the severity of experimental autoimmune encephalomyelitis. Int Immunopharmacol. v.31, p.169-77, 2016.
COMMENTZ, J. C.; HELMKE, K. Precocious puberty and decreased melatonin1583 secretion due to a hypothalamic hamartoma. Horm.Res. v.44, n. 6, p. 271-275,1584 1995.
CZECHOWSKA, G. et al. Protective effects of melatonin against thioacetamide induced liver fibrosis in rats. J Physiol Pharmacol. v.66, p.567-79, 2015.
DEBOSREE Ghosh; Sudeshna Paul, Aindrila Chattopadhyay, Debasish Bandyopadhy. Melatonin and aqueous curry leaf extract in combination protects against lead induced oxidative stress mediated injury to rat heart: a new approach. Journal of Pharmacy Research 2015,9(12),618-634.
DOMINGUEZ -Rodriguez A, Abreu-Gonzalez P, Reiter RJ. The potential usefulness of serum melatonin level to predict heart failure in patients with hypertensive cardiomyopathy. Int J Cardiol 2014; 174:415–417.
EMET M, Ozcan H, Ozel L, Yayla M, Halici Z, Hacimuftuoglu A. A review of melatonin, its receptors and drugs. Eur J Med. 2016; 48(2):135-41.
ESPINO J, Pariente JA, Rodriguez AB. Role of melatonin on diabetes-related metabolic disorders. World J Diabetes 2011; 2:82–91.
FARIAS JG, Zepeda AB, Calaf GM. Melatonin protects the heart, lungs and kidneys from oxidative stress under intermittent hypobaric hypoxia in rats. Biol Res. 2012; 45(1):81-5.
FAVERO G, Rodella LF, Reiter RJ, et al. Melatonin and its atheroprotective effects: a review. Mol Cell Endocrinol 2014; 382:926–937.
FAVERO G, Franceschetti L, Buffoli B, Moghadasian MH, Reiter RJ, Rodella LF, et al. Melatonin: Protection against age-related cardiac pathology. Ag Res Rev. 2016; 22: S1568-1637. 16.
FOSCHINI D, Prestes J, Charro MA. Relação entre exercício físico, dano muscular e dor muscular de início tardio. Rev Bras Cineantropom Desempenho Hum 2007;9(1):101-6.
GHAELI P, Vejdani S, Ariamanesh A, et al. Effect of melatonin on cardiac injury after primary percutaneous coronary intervention: a randomized controlled trial. Iran J Pharm Res 2015; 14:851–855.
GOC, Z. et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP. Chin J Physiol. v.1, p. 28-34 2017.
GOOLEY, JJ, Lu J, Fischer D, Saper CB. A broad role for melanopsin in nonvisual photoreception. J Neurosci 2003; 23:7093–7106.
HARDELAND, R, Pandi-Perumal SR, Cardinali DP. Melatonin. Int J Biochem Cell Biol. 2006; 38:313–316.
HARDELAND, R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance. Endocrine. v. 27, p. 111-118, 2015.
HIGASSHI; T Maruhashi, K Noma, Y Kihara Oxidative stress and endothelial dysfunction: Clinical evidence and therapeutic implications, Trends in Cardiovascular Medicine Volume 24, Issue 4, May 2014, Pages 165-169.
JOCKERS, R, Delagrange P, Dubocovich ML, Markus RP, Renault N, Tosini G, et al. Update on melatonin receptors: IUPHAR Review. Br J Pharmacology. 2016; 173:2702-25.
KANG, J. W.; KOH, E. J.; LEE, S. M. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. v.50, p. 403-411, 2011.
KOCIC, G., Tomovic, K., Kocic, H., et al., 2017. Antioxidative, membrane protective and antiapoptotic effects of melatonin, in silico study of physico-chemical profile and efficiency of nanoliposome delivery compared to betaine. RSC Adv. 7, 1271–1281.
LI, X.; ZHANG, M.; TANG, W. Effects of melatonin on streptozotocin-induced retina neuronal apoptosis in high blood glucose rat. Neurochem Res. v.38, p.669- 76, 2013.
LIN, X, Zhao T, Lin CH et al. Melatonin provides protection against heat strokeinduced myocardial injury in male rats. J Pharm Pharmacol. 2018 Jun;70(6):760-767.
MANCHESTER LC, et al. Melatonin: an ancient molecule that makes oxygen metabolically tolerable. J Pineal Res. v.59, p. 403-19, 2015
ONK D, et al. Melatonin Attenuates Contrast-Induced Nephropathy in Diabetic Rats: The Role of Interleukin-33 and Oxidative Stress. Mediators Inflamm. v.2016, p. 508-28, 2016.
PANDI-PERUMAL, S. R. et al. Melatonin antioxidative defense: therapeutical implications for aging and neurodegenerative processes. Neurotox Res. v.23, p.267-300, 2013.
REITER, R. J. et al. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans – Acta Biochim. Pol.v. 50, p. 1129-1146, 2003.
RODRIGUEZ C, et al. Regulation of antioxidant enzymes: a significant role for melatonin. J Pineal Res. 2004;36(1):1–9.
ROSEN, P P Nawroth, G King, W Möller, H J Tritschler, L Packer. The role of oxidative stress in the onset and progression of diabetes and its complications: a summary of a Congress Series sponsored by UNESCO-MCBN, the American Diabetes Association and the German Diabetes Society – May-Jun 2001;17(3):189-212.
SIMKO F, Baka T, Paulis L, Reiter RJ. Elevated heart rate and non dripping heart rate as potential targets for melatonin: a review. J Pineal Res. 2016; 61:127-37.
SKENE, DJ, Arendt J. Human circadian rhythms: physiological and therapeutic relevance of light and melatonin. Ann Clin Biochem. 2006; 43:344–353.
SUN H, Huang FF, Qu S. Melatonin: a potential intervention for hepatic steatosis. Lipids Health Dis. 2015; 14:75.
SUN H, Gusdon AM, Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr Opin Lipidol. 2016; 27(4):408-13.
TAN DX, Manchester LC, Reiter RJ, et al. Ischemia/reperfusion-induced arrhythmias in the isolated rat heart: prevention by melatonin. J Pineal Res. 1998; 25:184–191.
TARE M, Parkington HC, Wallace EM et al. Maternal melatonin administration mitigates coronary stiffness and endothelial dysfunction, and improves heart resiliência to insult in growth restricted lambs. 2014
YANG Y, Sun Y, Yi W, Li Y, Fan C, Xin Z, et al. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases. J Pineal Res. 2014;57(4):357-66. doi: 10.1111/jpi.12175.
YU L, Sun Y, Cheng L, Jin Z, Yang Y, Zhai M, et al. Melatonin receptor mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1. J Pineal Res. 2014; 57(2):228-38.
ZHANG, Y. et al. Melatonin protects against arsenic trioxide-induced liver injury by the upregulation of Nrf2 expression through the activation of PI3K/AKT pathway. Oncotarget. 2017.
ADJUNTO ARCHIVO
Figura 1: Evaluación de los niveles de TBARS (nmol / mg de proteína) en el tejido cardíaco de los animales en los diferentes grupos experimentales) * Las medias seguidas de la misma letra no difieren significativamente por la prueba de Kruskal-Wallis con la prueba post-hoc de Dunn (p < 0,05). GC: control; GI: inducido a hiperlipidemia; GIM: inducido a hiperlipidemia y tratado con melatonina.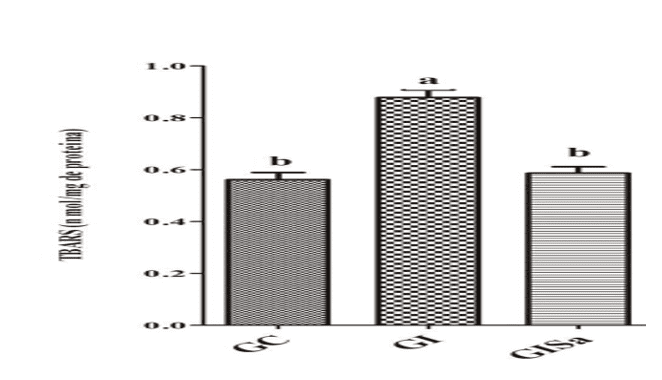
Figura 2. Evaluación de los niveles de GSH (nmol / mg de proteína) en el tejido cardíaco de los animales en los diferentes grupos experimentales) * Las medias seguidas de la misma letra no difieren significativamente por la prueba de Kruskal-Wallis con la prueba post-hoc de Dunn (p < 0,05). GC: control; GI: inducido a hiperlipidemia; GIM: inducido a hiperlipidemia y tratado con melatonina.
Tabla 1: Análisis bioquímico de grupos experimentales
 [1] Licenciado en Nutrición por el Centro Universitario Uninassau.
[1] Licenciado en Nutrición por el Centro Universitario Uninassau.
[2] Estudiante de Maestría en Nutrición Comunitaria y Salud Pública por FCNAUP Graduado en Nutrición por el Centro Universitario Uninassau.
[3] Consejero. Doctor en Biociencia Animal. Máster en Biociencia Animal. Especialización en Morfología. Licenciado en Ciencias Biológicas.
Enviado: Agosto, 2020.
Aprobado: Octubre de 2020.