ARTICLE ORIGINAL
FERREIRA, Fernanda Amorim [1], PARAÍBA, Isabella Maria Rios [2], ELIAS, Laíse de Souza [3]
FERREIRA, Fernanda Amorim. PARAÍBA, Isabella Maria Rios. ELIAS, Laíse de Souza. Effet de melatonin sur la morphophysiologie cardiaque des rats a induit l’hyperlipidémie. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 10, vol. 13, p. 130-143. octobre 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/nutrition-fr/effet-de-la-melatonine
RÉSUMÉ
Les hyperlipidémies sont classées comme altérations métaboliques et sont liées à des maladies cardiovasculaires, qui mettent en évidence les maladies athérotiques coronaires. Les maladies cardiovasculaires ont une participation remarquable aux taux de mortalité dans le monde entier et, par conséquent, elle a été la cible de recherches qui recherchent l’innovation thérapeutique. La mélatonine est une hormone produite dans une phase environnementale de l’obscurité par la glande pinéale qui joue antioxydant, hypolipidémiant, fonction anti-inflammatoire, entre autres, démontrant ainsi être une molécule puissante dans le traitement des maladies cardiovasculaires. Ainsi, l’objectif de ce travail est d’évaluer l’effet de la mélatonine sur le stress oxydatif et les paramètres biochimiques chez les rats induits par l’hyperlipidémie. Pour cela, 15 rats albinos mâles (Rattus norvegicus albinus) ont été utilisés, âgés de 150 jours, provenant du bioterium du département de morphologie et de physiologie animale de l’Université rurale fédérale du Pernambuco. Ces animaux ont été gardés dans des cages, avec l’alimentation et l’eau ad libitum, la température de 22 ° C et l’éclairage artificiel qui permettra d’établir une photopériod de 12 heures de lumière et 12 heures sombre (cycle inversé). En conclusion, les études ont prouvé que le melatonin a des effets sur réduire la peroxydation de lipide, les niveaux de kinase de créatine (CK) aussi bien que réduire le glutathion réduit. En tant que médicament bon marché et bien toléré, la mélatonine peut être une nouvelle option thérapeutique pour les maladies cardiovasculaires et les personnes atteintes d’hyperlipidémie.
Mots-clés: Athérosclérose, mélatonine, coeur, hyperlipidémie, stress oxydatif.
INTRODUCTION
Les hyperlipidémies sont des altérations métaboliques qui se produisent lorsque les taux de lipides circulants dépassent les limites de la normalité dans la circulation sanguine (BEVILACQUA et al., 2007). Cette production non réglementée peut causer de graves problèmes, y compris des maladies cardiovasculaires (MCV), comme l’hypertension, l’athérosclérose, en plus des dommages causés à différents organes et tissus, caractérisant ainsi un grave problème de santé publique (EMET et al., 2016).
Les maladies cardiovasculaires ont une participation remarquable aux taux de mortalité dans le monde entier et, par conséquent, ont été la cible de recherches qui recherchent des innovations thérapeutiques. (SIMKO et al., 2016). Ainsi, au cours des dernières décennies, la recherche de nouveaux médicaments pour le traitement de l’hyperlipidémie a évalué le rôle des substances qui agissent dans le contrôle de l’augmentation du profil lipidique et de l’inflammation, en plus de protéger l’endothélium vasculaire contre le stress oxydatif (JOCKERS et al., 2016). Parmi ces substances, la mélatonine a reçu beaucoup de répercussions pour le traitement des lésions dans divers organes, y compris le cœur (YANG et al., 2014).
La mélatonine (N-acétyl-5-méthoxytryptaline) (MEL) est une hormone neuroendocrine produite par la glande pinéale (HARDELAND et coll., 2006). Sa sécrétion est régulée par le cycle lumière/obscurité de l’environnement à travers le noyau suprachiasmatique (SKENE et al., 2006). Depuis que sa biosynthèse a commencé la nuit, à partir de photorécepteurs rétiniens qui envoient un signal à la glande pinéale, stimulant la production et la libération de mélatonine (GOOLEY et al., 2003). Le mécanisme d’action de MEL dépend des récepteurs membranaires appelés MT1, MT2 et MT3, qui sont exprimés individuellement et ensemble dans divers tissus et organes, les deux premiers étant exprimés dans le coeur et dans l’artère de rat (CAHILL ; GRACE; BESHARSE, 1991) (LI; ZHANG; TANG, 2013).
En présentant des récepteurs largement distribués par le corps, MEL peut être responsable d’une série d’événements physiologiques (FARÍAS; ZEPEDA; CALAF, 2012). Initialement, sa fonction était limitée à la régulation du cycle veille/sommeil(SUN; HUANG; QU, 2015) cependant, au fil des ans d’autres fonctions ont également été rapportées, telles que son rôle antioxydant et anti-inflammatoire, dans la régulation du métabolisme de lipide et de glucose, (AGIL et al., 2011) (ESPINO; PARIENTE; RODRIGUEZ, 2011) ainsi que son effet cardioprotecteur, ayant un rôle important sur les maladies cardiaques (TAN et al., 1998), comme les lésions de l’ischémie-reperfusion myocardique, l’athérosclérose, l’hypertension et l’insuffisance cardiaque. (FAVERO et al., 2012) (BENOVA et al., 2013) (DOMINGUEZ; ABREU-GONZALEZ; REITER, 2014).
Des études chez les rats ont révélé que MEL a produit un effet cardioprotecteur contre la cardiotoxicité induite par les agents chimiothérapeutiques et récemment l’amplitude de l’effet protecteur cardiaque exercé par MEL (SUN ; GUSDON; QU, 2016). En outre, la mélatonine s’est trouvée efficace en réduisant les effets de l’ischémie induite sur les coeurs des rats (YU et autres, 2014), en abaissant la fréquence cardiaque, en réduisant les niveaux de protéines de kinase de créatine, (FAVERO et al., 2016), préservation de la microstructure cardiomyocyte (LIN et coll., 2018), réduction des arythmies cardiaques et oxydation lipidique résultant de processus ischémiques cardiaques (TARE et al., 2014), en plus d’améliorer la fonction cardiaque et le flux sanguin (ZHANG et al., 2017).
Compte tenu de l’augmentation croissante de l’hyperlipidémie (KANG; KOH; LEE, 2011) et par conséquent maladies cardiovasculaires (HARDELAND, 2015) et que la mélatonine joue la fonction antioxydante, (PANDI-PERUMAL et al., 2013) (COMMENTZ; HELMKE, 1995), (REITER et al., 2013) anti-inflammatoire et hypolipidémiant (ALLEGRA et al., 2003), il est nécessaire d’étudier l’efficacité de l’effet de la mélatonine sur la morphophysiologie cardiaque chez les rats induits par l’hyperlipidémie. Ainsi, cette recherche peut contribuer au développement de méthodes thérapeutiques complémentaires dans le traitement de l’hyperlipidémie, ainsi que des maladies cardiovasculaires. La présente étude visait à évaluer l’effet de la mélatonine sur la morphophysiologie cardiaque des rats induits à l’hyperlipidémie.
1. MATÉRIAUX ET MÉTHODES
1.1 GROUPES EXPÉRIMENTAUX
Nous avons utilisé 15 rats albinos mâles (Rattus norvegicus albinus), âgés de 150 jours, du bioterium du Département de morphologie et de physiologie animale de l’Université rurale fédérale du Pernambuco. Ces animaux ont été gardés dans des cages, avec l’alimentation et l’eau ad libitum, la température de 22 ° C et l’éclairage artificiel qui a établi une photopériod de 12 heures de lumière et 12 heures sombre (cycle inversé). Les animaux ont été pesés et répartis au hasard en trois groupes expérimentaux : GC: rats sans induction de l’hyperlipidémie ; GI: rats induits à l’hyperlipidémie et traités avec le placebo ; GM : rats induits à l’hyperlipidémie et traités avec le melatonin.
1.2 INDUCTION DE L’HYPERLIPIDÉMIE
Pour induire l’hyperlipidémie, Triton WR 1339 a été administré intraperitoneally pendant trente jours, également connu sous le nom de tyloxapol, un détergent non anionique de la structure polymérique, à une dose de 400mg/kg de poids corporel, dissous dans NaCl à 0.9%. Cette substance a été utilisée dans des études expérimentales parce qu’elle est capable de causer l’hyperlipidémie chez les animaux. Des analyses biochimiques ont été employées pour suivre l’hyperlipidémie après le troisième jour de l’induction, selon Labtest® kits, suivant les catalogues spécifiés : LDL, HDL, triglycérides et cholestérol total. Les animaux non induits à l’hyperlipidémie (GC) ont reçu des doses équivalentes de solution saline de la même manière.
1.3 ADMINISTRATION DE MELATONIN
La mélatonine a été administrée oralement (VO), ainsi 10mg/kg de melatonin a été dissous dans 200 microlitres d’alcool. Puis, à 7 h.m., cette solution a été diluée dans l’eau potable des animaux, il est à noter que les bouteilles ont été recouvertes de papier d’aluminium pour protéger la teneur en luminosité.
1.4 ANALYSE BIOCHIMIQUE
Des échantillons de sang ont été prélevés dans les périodes précédant l’induction et après le traitement. Pour analyse avant la période d’induction, les rats ont été mobilisés par confinement mécanique et le sang recueilli par perforation caudale latérale avec l’utilisation du cathéter (24G). Pour l’analyse après induction et son traitement respectif, le sang a été recueilli par perforation cardiaque. Le matériau a été centrifugé, l’overnnatant emballé à Eppendorf et conservé dans un congélateur à -20°C jusqu’au moment des dosages. À cette fin, le kit Labtest® a été utilisé, suivant le catalogue spécifique : protéine CK (133-1/500).
1.5 ANALYSE OXYDATIVE DE STRESS : PEROXYDATION DE LIPIDE ET GLUTATHION RÉDUITE
La peroxydation lipidique a été estimée en mesurant les niveaux des substances réactives d’acide thiobarbituric (TBARS), alors que le glutathion réduit (GSH) a été déterminé en mesurant des groupes de sulfhydron non protéiques. Pour cela, des fragments du coeur ont été macérés dans KCl, 1.15% dans une proportion de 10 ml/1g jusqu’à homogénéisation complète du matériel rassemblé. L’homogénéate a été transféré à un tube à essai, auquel 2mL de régent (0,375% d’acide thiobarbituric et 75% d’acide trichloroacetic) a été ajouté à chaque mL du mélange. Les tubes en double ont été scellés et chauffés dans un bain d’eau (100 °C) pendant 15 minutes. L’overnum a été séparé et l’absorption mesurée à 535 nm.
1.6 PROCÉDURES ÉTHIQUES
L’expérience a été développée conformément aux principes éthiques de l’expérimentation animale, conformément à la loi n° 11 794 du 8 octobre 2008, et le projet a été approuvé par la Commission d’éthique sur l’utilisation des animaux (CEUA) de l’Université rurale fédérale de Pernambuco (UFRPE – numéro de processus 23082.015842/2014) (ANNEXE A).
1.7 ANALYSE STATISTIQUE
Des analyses statistiques ont été effectuées à l’aide de la méthode non paramétrique Kruskal-Wallis, où les moyens ont été comparés par le test Wilcoxon-Mann Whitney, soit 95 % de l’importance.
2. RESULTATS ET DISCUSSION
Les dommages oxydatifs induits dans les cellules et les tissus ont été liés à des processus physiologiques et à l’étiologie de diverses maladies, telles que le vieillissement, et les maladies chroniques telles que le diabète, le cancer et l’athérosclérose, où on observe souvent l’augmentation du contenu des espèces réactives d’oxygène (EROs) les plus importantes dans le contexte biologique (ROSEN et al., 2001) (HIGASSHI et al., 2014).
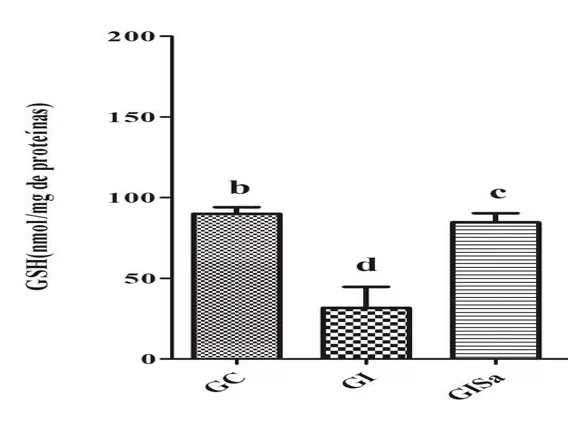
Les analyses des niveaux de TBARS dans le tissu cardiaque après induction à l’hyperlipidémie ont indiqué des valeurs élevées par rapport au groupe témoin. Cependant, le traitement de melatonin a atténué des niveaux de TBARs, présentant des valeurs semblables à GC (figure 1). L’analyse tissulaire des niveaux de GSH dans le groupe induit et traité avec le melatonin étaient supérieures aux animaux du groupe gi, démontrant également des valeurs semblables à celles du groupe témoin (figure 2). Avec ceci, nous avons réalisé que la melatonin a pu réduire des dommages oxydants.
Cette hormone a la capacité d’enlever l’oxygène réactif (EROs) et les espèces d’azote (NRE), agissant pour empêcher des dommages oxydants (ALVES et al., 2014) en plus de stimuler l’expression des enzymes antioxydantes (PANDI-PERUMAL et al.,2013) par la croissance de l’expression du Keap1-Nrf2 (MANCHESTER et al., 2015).
ONK (2016) a constaté que l’utilisation de 20mg/kg de mélatonine a entraîné une diminution des niveaux de TBARS. De même, Debosree Ghosh (2015) a montré que la dose minimale de 10 mg/kg de mélatonine était nécessaire pour se protéger contre la peroxydation accrue des lipides dans les globules rouges des rats.
De nombreuses études ont été rapportées démontrant l’effet isolé de la mélatonine sur la promotion des niveaux de GSH, par exemple, des niveaux accrus de GSH ont été démontrés chez les animaux atteints de lésions hépatiques induites par le thioacetamide (TAA) et traités par mélatonine (10 mg/kg) Czechowska (2015) et Goc (2017), ont observé des niveaux élevés de GSH dans le tissu hépatique d’animaux traités avec 10 mg/kg de MEL seul ou en combinaison avec le nitroprusside de sodium (SNP), un médicament antihypertenseur aux effets toxiques, par rapport à l’administration isolée du SNP.
Dans notre étude, le groupe induit à l’hyperlipidémie et traité avec le melatonin, a démontré une réduction des niveaux de protéine Ck comparé au groupe hyperlipidémique (GI), cependant, par rapport au groupe témoin, aucune modification significative n’a été observée (tableau 1).
La créatine kinase (CK) est une enzyme qui joue un rôle important dans la production d’énergie pour le métabolisme musculaire. Il est présent principalement dans les tissus musculaires, mais se trouve également dans les tissus cérébraux (BRANCACCIO et al., 2008). Parmi les molécules utilisées comme marqueur de lésions cardiaques, la créatine kinase (CK) est souvent décrite comme le meilleur marqueur indirect de dommages aux tissus musculaires (FOSCHINI et al., 2017). Cette réduction des niveaux de CK peut être attribuée aux effets de stabilisation de membrane donnés par MEL. Des études in vitro montrent que MEL est capable d’inhiber l’internalisation de la phosphatidylserine, de l’expression bax et de l’oxidase de xanthine, causant ainsi la stabilisation de la bicouche lipidique (KOCIC et al., 2017).
Ghaeli (2015), rapporte que dans les patients présentant l’infarctus du myocarde avec le surnivelage de ST-segment soumis à l’intervention coronaire percutanée primaire, l’administration de melatonin plus le traitement standard a considérablement diminué le niveau kinase-MB de créatine. En outre, MEL a toujours des effets anti-inflammatoires et anti-apoptotiques, étant ainsi en mesure d’agir dans le contrôle des maladies cardiovasculaires (CHEN et al., 2016).
3. CONCLUSION
En conclusion, les études ont prouvé que le melatonin a des effets sur réduire la peroxydation de lipide, les niveaux de kinase de créatine (CK) aussi bien que l’augmentation du glutathion réduit chez les rats hyperlipidemia-induits.
RÉFÉRENCES
AGIL, A, Navarro-Alarcon M, Ruiz R, et al. Beneficial effects of melatonin on obesity and lipid profile in young Zucker diabetic fatty rats. J Pineal Res 2011; 50:207–212.
ALLEGRA, M.; REITER, R. J.; TAN, D. X.; et al. The chemistry of melatonin’s interaction with species. J. Pineal Res., v.34, n.1, p. 1–10, 2003.
ALVES, R.S.C. et al. A melatonina e o sono em crianças. Pediatria. v. 1, p. 587-594,2004.
BRANCACCIO, P.; Maffulli, N.; Buonauro, R. Serum enzyme monitoring in sports medicine. Clin Sports Med 2008. 27:1-1.
BENOVA, T, Viczenczova C, Radosinska J, et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol 2013; 91:633–639.
BEVILACQUA, MR, GIMENO SGA, BEVILACQUA MR, Matsumura LK, et al. Hiperlipidemias e Fatores Dietéticos: Estudo Transversal Entre Nipo-Brasileiros. Arq Bras Endocrinol Metab. 2007 mar/out; 51/4: 547-558.
CAHILL, GM, Grace MS, Besharse JC. Rhythmic regulation of retinal melatonin: metabolic pathways, neurochemical mechanisms, and the ocular circadian clock. Cell Mol Neurobiol 1991; 11:529–560.
CHEN, S,J. et al. Melatonin enhances interleukin-10 expression and suppresses chemotaxis to inhibit inflammation in situ and reduce the severity of experimental autoimmune encephalomyelitis. Int Immunopharmacol. v.31, p.169-77, 2016.
COMMENTZ, J. C.; HELMKE, K. Precocious puberty and decreased melatonin1583 secretion due to a hypothalamic hamartoma. Horm.Res. v.44, n. 6, p. 271-275,1584 1995.
CZECHOWSKA, G. et al. Protective effects of melatonin against thioacetamide induced liver fibrosis in rats. J Physiol Pharmacol. v.66, p.567-79, 2015.
DEBOSREE Ghosh; Sudeshna Paul, Aindrila Chattopadhyay, Debasish Bandyopadhy. Melatonin and aqueous curry leaf extract in combination protects against lead induced oxidative stress mediated injury to rat heart: a new approach. Journal of Pharmacy Research 2015,9(12),618-634.
DOMINGUEZ -Rodriguez A, Abreu-Gonzalez P, Reiter RJ. The potential usefulness of serum melatonin level to predict heart failure in patients with hypertensive cardiomyopathy. Int J Cardiol 2014; 174:415–417.
EMET M, Ozcan H, Ozel L, Yayla M, Halici Z, Hacimuftuoglu A. A review of melatonin, its receptors and drugs. Eur J Med. 2016; 48(2):135-41.
ESPINO J, Pariente JA, Rodriguez AB. Role of melatonin on diabetes-related metabolic disorders. World J Diabetes 2011; 2:82–91.
FARIAS JG, Zepeda AB, Calaf GM. Melatonin protects the heart, lungs and kidneys from oxidative stress under intermittent hypobaric hypoxia in rats. Biol Res. 2012; 45(1):81-5.
FAVERO G, Rodella LF, Reiter RJ, et al. Melatonin and its atheroprotective effects: a review. Mol Cell Endocrinol 2014; 382:926–937.
FAVERO G, Franceschetti L, Buffoli B, Moghadasian MH, Reiter RJ, Rodella LF, et al. Melatonin: Protection against age-related cardiac pathology. Ag Res Rev. 2016; 22: S1568-1637. 16.
FOSCHINI D, Prestes J, Charro MA. Relação entre exercício físico, dano muscular e dor muscular de início tardio. Rev Bras Cineantropom Desempenho Hum 2007;9(1):101-6.
GHAELI P, Vejdani S, Ariamanesh A, et al. Effect of melatonin on cardiac injury after primary percutaneous coronary intervention: a randomized controlled trial. Iran J Pharm Res 2015; 14:851–855.
GOC, Z. et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP. Chin J Physiol. v.1, p. 28-34 2017.
GOOLEY, JJ, Lu J, Fischer D, Saper CB. A broad role for melanopsin in nonvisual photoreception. J Neurosci 2003; 23:7093–7106.
HARDELAND, R, Pandi-Perumal SR, Cardinali DP. Melatonin. Int J Biochem Cell Biol. 2006; 38:313–316.
HARDELAND, R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance. Endocrine. v. 27, p. 111-118, 2015.
HIGASSHI; T Maruhashi, K Noma, Y Kihara Oxidative stress and endothelial dysfunction: Clinical evidence and therapeutic implications, Trends in Cardiovascular Medicine Volume 24, Issue 4, May 2014, Pages 165-169.
JOCKERS, R, Delagrange P, Dubocovich ML, Markus RP, Renault N, Tosini G, et al. Update on melatonin receptors: IUPHAR Review. Br J Pharmacology. 2016; 173:2702-25.
KANG, J. W.; KOH, E. J.; LEE, S. M. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. v.50, p. 403-411, 2011.
KOCIC, G., Tomovic, K., Kocic, H., et al., 2017. Antioxidative, membrane protective and antiapoptotic effects of melatonin, in silico study of physico-chemical profile and efficiency of nanoliposome delivery compared to betaine. RSC Adv. 7, 1271–1281.
LI, X.; ZHANG, M.; TANG, W. Effects of melatonin on streptozotocin-induced retina neuronal apoptosis in high blood glucose rat. Neurochem Res. v.38, p.669- 76, 2013.
LIN, X, Zhao T, Lin CH et al. Melatonin provides protection against heat strokeinduced myocardial injury in male rats. J Pharm Pharmacol. 2018 Jun;70(6):760-767.
MANCHESTER LC, et al. Melatonin: an ancient molecule that makes oxygen metabolically tolerable. J Pineal Res. v.59, p. 403-19, 2015
ONK D, et al. Melatonin Attenuates Contrast-Induced Nephropathy in Diabetic Rats: The Role of Interleukin-33 and Oxidative Stress. Mediators Inflamm. v.2016, p. 508-28, 2016.
PANDI-PERUMAL, S. R. et al. Melatonin antioxidative defense: therapeutical implications for aging and neurodegenerative processes. Neurotox Res. v.23, p.267-300, 2013.
REITER, R. J. et al. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans – Acta Biochim. Pol.v. 50, p. 1129-1146, 2003.
RODRIGUEZ C, et al. Regulation of antioxidant enzymes: a significant role for melatonin. J Pineal Res. 2004;36(1):1–9.
ROSEN, P P Nawroth, G King, W Möller, H J Tritschler, L Packer. The role of oxidative stress in the onset and progression of diabetes and its complications: a summary of a Congress Series sponsored by UNESCO-MCBN, the American Diabetes Association and the German Diabetes Society – May-Jun 2001;17(3):189-212.
SIMKO F, Baka T, Paulis L, Reiter RJ. Elevated heart rate and non dripping heart rate as potential targets for melatonin: a review. J Pineal Res. 2016; 61:127-37.
SKENE, DJ, Arendt J. Human circadian rhythms: physiological and therapeutic relevance of light and melatonin. Ann Clin Biochem. 2006; 43:344–353.
SUN H, Huang FF, Qu S. Melatonin: a potential intervention for hepatic steatosis. Lipids Health Dis. 2015; 14:75.
SUN H, Gusdon AM, Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr Opin Lipidol. 2016; 27(4):408-13.
TAN DX, Manchester LC, Reiter RJ, et al. Ischemia/reperfusion-induced arrhythmias in the isolated rat heart: prevention by melatonin. J Pineal Res. 1998; 25:184–191.
TARE M, Parkington HC, Wallace EM et al. Maternal melatonin administration mitigates coronary stiffness and endothelial dysfunction, and improves heart resiliência to insult in growth restricted lambs. 2014
YANG Y, Sun Y, Yi W, Li Y, Fan C, Xin Z, et al. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases. J Pineal Res. 2014;57(4):357-66. doi: 10.1111/jpi.12175.
YU L, Sun Y, Cheng L, Jin Z, Yang Y, Zhai M, et al. Melatonin receptor mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1. J Pineal Res. 2014; 57(2):228-38.
ZHANG, Y. et al. Melatonin protects against arsenic trioxide-induced liver injury by the upregulation of Nrf2 expression through the activation of PI3K/AKT pathway. Oncotarget. 2017.
ATTACHEMENT
Figure 1: Évaluation des taux de TBARS (nmol / mg protéine) dans le tissu cardiaque des animaux de nos différents groupes expérimentaux) * Les milieux suivis de la même lettre ne diffèrent pas significativement par le test de Kruskal-Wallis avec le test post-hoc de Dunn (p < 0,05). CG: contrôle; GI: hyperlipidémie induite; GIM: hyperlipidémie induite et traitée à la mélatonine.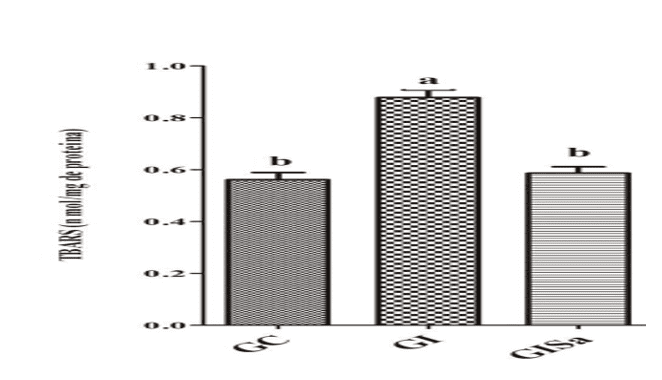
Figure 2. Évaluation des taux de GSH (nmol / mg protéine) dans le tissu cardiaque des animaux des différents groupes expérimentaux) * Les moyennes suivies de la même lettre ne diffèrent pas significativement par le test de Kruskal-Wallis avec le test post-hoc de Dunn (p < 0,05). CG: contrôle; GI: induit à une hyperlipidémie; GIM: induite à une hyperlipidémie et traitée avec de la mélatonine.
Tableau 1 : Analyse biochimique des groupes expérimentaux
[1] Diplômé en nutrition du Centre universitaire Uninassau.
[2] L’étudiant à la maîtrise en nutrition communautaire et santé publique du FCNAUP est diplômé en nutrition du Centre universitaire Uninassau.
[3] Conseiller d’orientation. Doctorat en bioscience animale. Maîtrise en bioscience animale. Spécialisation en morphologie. Diplôme en sciences biologiques.
Soumis : août 2020.
Approuvé : octobre 2020.