ARTÍCULO DE REVISIÓN
COELHO, Taiane [1], KERPEL, Raquel [2]
COELHO, Taiane. KERPEL, Raquel. Psicobióticos en el tratamiento de la depresión: una nueva mirada a la salud mental: una revisión de búsqueda sistemática. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año. 07, ed. 05, vol. 01, pág. 125-152. Mayo 2022. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/nutricion/psicobioticos-en-el-tratamiento, DOI: 10.32749/nucleodoconhecimento.com.br/nutricion/psicobioticos-en-el-tratamiento
RESUMEN
El Trastorno Depresivo Mayor (TDM) es un trastorno psíquico multifactorial, tratado convencionalmente con medicamentos antidepresivos. Los síntomas provocados por la propia sintomatología depresiva y los efectos secundarios provocados por los medicamentos son algunos de los factores que interfieren negativamente en la adherencia a los tratamientos farmacológicos. Actualmente, después de que los probióticos hayan mostrado efectos psicotrópicos, el campo científico ha intensificado los esfuerzos para comprender si la suplementación con probióticos sirve como tratamiento para los trastornos psiquiátricos. Por lo tanto, el presente estudio formuló la siguiente pregunta: ¿los psicobióticos (probióticos) pueden ser denotados como un tratamiento para el Trastorno Depresivo Mayor? Objetivo: responder a la pregunta orientadora a través de una revisión de estudios que complementaron psicobióticos con la intención de tratar el Trastorno Depresivo Mayor. Metodología: para esta revisión se diseñó una búsqueda sistemática, donde durante el mes de septiembre de 2021 se realizaron las búsquedas en las bases de datos; Pubmed, Google Scholar y Scielo, utilizando los descriptores “probiotics AND depression AND dysbiosis” en inglés y portugués, y filtros para la selección de estudios publicados entre 2005 y 2021. Después de seleccionar los materiales, los duplicados se gestionaron en EndNote y los la calidad metodológica de los ensayos aleatorios se evaluó mediante la herramienta Risk of Bias-2 (ROB 2). Resultados: hubo preferencia por 10 estudios; preclínico (n=4), aleatorizado (n=5) y piloto abierto (n=1), que cumplió con los criterios de inclusión y mostró resultados significativos en las puntuaciones de depresión en escalas psiquiátricas; demostrando la disminución de la anhedonia, reactividad cognitiva e insomnio en pacientes diagnosticados con Trastorno Depresivo Mayor, además, se observaron cambios significativos en factores que pueden estar asociados a la patogenia de la depresión, como la disbiosis, y el estado inflamatorio frente a la disminución de biomarcadores inflamatorios. Consideraciones finales: de acuerdo con la revisión de datos, se obtuvo la siguiente respuesta a la pregunta orientadora: los psicobióticos pueden ser denotados como un tratamiento para el Trastorno Depresivo Mayor. Sin embargo, debido a la necesidad de una mejor comprensión del eje intestino-cerebro y los mecanismos de acción de los psicobióticos, se recomienda la suplementación como terapia complementaria a los fármacos antidepresivos. Por lo tanto, se deben realizar estudios con muestras más grandes y períodos de intervención más prolongados.
Palabras clave: Trastorno Depresivo Mayor, Probióticos, Disbiosis.
1. INTRODUCCIÓN
Según la Organización Mundial de la Salud (OMS, 2020) alrededor de 300 millones de personas sufren trastornos depresivos en todo el mundo. Este trastorno ha prevalecido entre hombres (5 a 12%) y mujeres (10 a 25%), y ocupa el segundo lugar en la carga de enfermedades que causan más daños en el ámbito económico y social, y en el campo de la salud (MOTTA; MORÉE; NUNES, 2017; ZALAR; HALSBERGER; PETERLIN, 2018).
Según el Manual Diagnóstico y Estadístico de los Trastornos Mentales-5 (DSM-V), el Trastorno Depresivo Mayor (TDM) se diagnostica cuando una persona experimenta al menos 5 de los siguientes síntomas durante 2 semanas: estado de ánimo deprimido, anhedonia, culpa excesiva, pensamientos suicidas la ideación, cambios en el apetito y el sueño, retraso psicomotor, falta de concentración y fatiga. Entre estos criterios, la anhedonia o el estado de ánimo depresivo (o ambos) deben estar presentes para ser considerados para el diagnóstico (BAPTISTA, 2018).
Al momento del diagnóstico, el uso de antidepresivos se considera la primera opción de tratamiento, sin embargo, del 30 al 40 % de los pacientes no muestran respuestas significativas, mientras que del 60 al 70 % no experimentan la remisión esperada de la enfermedad (YUAN et al., 2020). Además, también es común que los pacientes abandonen los tratamientos farmacológicos, debido a los efectos secundarios y dificultades para seguir una rutina (IBANEZ et al., 2014). Entre otras razones, el estigma social, la falta de recursos y de profesionales capacitados también son obstáculos para la adherencia al tratamiento (OMS, 2020).
Como resultado, la búsqueda de nuevas terapias ha tenido repercusiones entre los investigadores, arraigando el término “eje intestino-cerebro” en el lenguaje científico. Los mecanismos de este eje han sido ampliamente estudiados después de los insights de la investigación que evidenciaron que el intestino y el cerebro tienen una comunicación bidireccional y una estructura compleja que vincula el sistema nervioso central con el sistema nervioso entérico y con múltiples vías metabólicas, inflamatorias y endocrinas. Por lo tanto, es presumible que en estos “caminos subyacentes” haya una serie de factores a examinar (KONTUREK; BRZOZOWSKI; KONTUREK, 2011; MAYER, 2011).
Hasta el momento se entiende que dentro de esta comunicación la microbiota intestinal es uno de los principales factores intermediarios. Este hecho hace que sea una prioridad para el tratamiento comprender cómo los microbios intestinales generan señales a través de múltiples vías. Además, también es fundamental considerar que existen disparidades en la composición de la microbiota entre individuos y en diferentes poblaciones clínicas. Así, modular y trasplantar la microbiota son alternativas discutidas para el tratamiento de enfermedades y trastornos psiquiátricos (BERCIK; COLLINS; VERDU, 2012; DORÉ et al., 2013; SMITS et al., 2013).
Sin embargo, la microbiota intestinal es compleja y comprende aproximadamente 100 billones de microorganismos vivos que generan una composición relativamente estable para toda la vida. Esta composición, aunque “estable”, puede sufrir cambios denominados “estado de disbiosis”, un desequilibrio asociado muchas veces a diversas enfermedades (FORSYTHE et al., 2010; RODRÍGUEZ et al., 2015). Se considera que varios factores influyen en este estado (de disbiosis). Según David et al. (2014) y Wu et al. (2011) la dieta es una de ellas, mientras que Goodrich et al. (2014) consideran la genética, Yatsunenko et al. (2012) edad, O’mahony et al. (2009) y Werbner et al. (2019) estrés, y Markle et al. (2013) la influencia que ejercen diferentes hormonas sexuales.
En consecuencia, con el objetivo de reequilibrar la microbiota, los probióticos han llegado a ser exponencialmente estudiados. La investigación también ha empleado el uso de prebióticos, ya que los prebióticos y los probióticos funcionan en sinergia y suavizan la presencia de bacterias dañinas en el intestino proporcionando ajustes importantes (VARAVALLO; THOMÉ; THESHIMA, 2008; TSAI et al., 2019).
Recientemente, en el campo de la psiquiatría, los probióticos también se han convertido en objeto de investigación luego de que se evidenciara que producen “efectos psicotrópicos”, por lo que fueron conceptualizados como psicobióticos: “un organismo vivo que, cuando se ingiere en cantidades adecuadas, produce un beneficio para la salud de los pacientes que padecen enfermedades psiquiátricas” (DINAN; STANTON; CRYAN, 2013; DINAN; CRYAN, 2016).
Ante la profundización de la búsqueda de psicobióticos, se observa que los artículos de revisión reportan con mayor frecuencia estudios preclínicos, y aún son pocas las revisiones sobre estudios que intervinieron en humanos diagnosticados con TDM (BERCIK; COLLINS; VERDU, 2012; CRYAN; O’MAHONY, 2011; HUANG; WANG; HU, 2016; LIU; WALSH; SHEEHAN, 2019; YONG et al., 2020). Así, nuevas revisiones que analicen la calidad metodológica de los estudios más recientes son vitales para esta creciente área de investigación.
Por lo tanto, el presente estudio formuló la siguiente pregunta: ¿los psicobióticos pueden ser denotados como un tratamiento para el Trastorno Depresivo Mayor? Por lo tanto, se determinó el objetivo: responder a la pregunta orientadora a través de una revisión de estudios que complementaron psicobióticos con la intención de tratar el Trastorno Depresivo Mayor. Estos suplementos se administran tanto en forma adyuvante de los fármacos antidepresivos, como en forma autónoma (es decir, sin que la suplementación se combine con ningún medicamento antidepresivo).
2. MATERIALES Y MÉTODOS
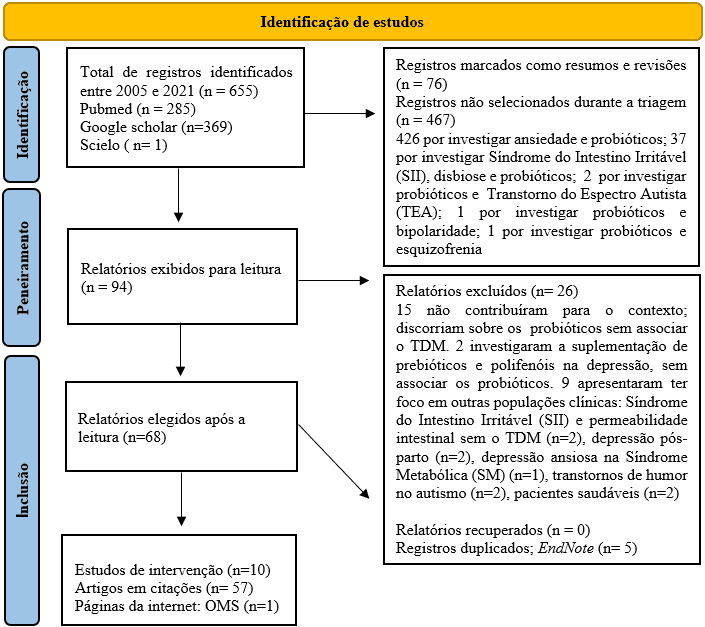
Esta es una revisión de búsqueda sistemática (FERENHOF; FERNANDES, 2016). En el cual, se recolectaron datos desde principios hasta fines de septiembre de 2021, a través de tres bases de datos: Pubmed, Google Scholar y Scielo, donde se utilizaron filtros para seleccionar estudios publicados entre los años 2005 y 2021, y plazos previstos por la Descriptores de Ciencias de la Salud (DeCS/MeSH), en inglés: “probiotics AND depression, probiotics AND depression AND dysbiosis”, y en portugués: “probióticos e depressão, probióticos e depressão e disbiose”. Los pasos de este proceso se describen en el diagrama de flujo (Figura 1) a continuación.
Figura 1 – Diseño de búsqueda de diagrama de flujo (PRSMA 2020)
2.1 DETALLES DE BÚSQUEDAS Y EXTRACCIÓN DE DATOS
Después de las búsquedas, se identificaron un total de 655 artículos, donde 94 de estos artículos fueron recolectados para su lectura, ya que presentaban información relevante. Entre ellos, 26 fueron excluidos, por no contribuir al desarrollo teórico, e investigaron el uso de probióticos sin asociar Trastorno Depresivo Mayor. Finalmente, fueron seleccionados 68 materiales que fueron presentados en portugués (n=65), inglés (n=2) y español (n=1). De estos, 10 estudios de intervención contribuyeron a la extracción de datos, y 5 de ellos (aleatorizados) evaluaron su calidad metodológica mediante la herramienta Risk of Bias-2 (ROB-2); proporcionada de forma gratuita por la organización Cochrane. Posteriormente, en la base de datos SCI Journal (Science Journal Impact Factor), se verificó el Factor de Impacto (FI) de las revistas que publicaron los estudios seleccionados (como se muestra en la Tabla 3).
Previo a la elegibilidad de los 10 estudios, se definieron los siguientes criterios de inclusión: presentación de texto completo, análisis de los efectos de la suplementación con probióticos en humanos o roedores, de ambos sexos, adultos y ancianos, diagnosticados con conductas depresivas y TDM según el DSM- Los criterios IV/V, finalmente, se definieron como criterios de no inclusión: estudios que analizaran otros trastornos psiquiátricos (ejemplo: ansiedad, bipolaridad).
3. RESULTADOS
Desde la perspectiva de las nuevas terapias, Logan y Katzman (2005) plantearon que la suplementación con probióticos es una propuesta válida para estudios, ya que, en vista de su hipótesis, la suplementación servirá como terapia adyuvante para el Trastorno Depresivo Mayor, ya que tiene la capacidad de reducir las respuestas inflamatorias, mejorar el estado nutricional y aliviar el estrés oxidativo.
Estudios de intervención en humanos y en modelos animales corroboran esta propuesta, del mismo modo que los estudios seleccionados en esta revisión mostraron efectos de esta naturaleza. En estudios preclínicos se demostró que existe una correlación entre la disbiosis, la permeabilidad intestinal y las conductas depresivas (ARSENEAULT-BRÉARD et al., 2012; LI et al., 2019; QIU et al., 2021). En el análisis se percibe que esta relación involucra también a los metabolitos derivados de la microbiota y su potencial influencia en la formación de serotonina (5-HT); neurotransmisor fundamental para la homeostasis emocional. La suplementación con probióticos en ratas tuvo efectos sobre la microbiota intestinal y aumentó los niveles de 5-HT en la corteza frontal. Estos efectos pueden ser un aporte importante ya que la sintomatología depresiva se relaciona con menores concentraciones de serotonina en esta zona del cerebro (LI et al., 2019). También se observaron otros aspectos positivos sobre el epitelio intestinal a través de las proteínas Zonulin y E-cadherina, y sobre el estado inflamatorio por la disminución de citocinas proinflamatorias (ARSENEAULT-BRÉARD et al., 2012; QIU et al., 2021). Además de los efectos sobre las vías inflamatorias, las regulaciones generadas sobre la expresión de genes en los receptores del sistema nervioso también parecen contribuir al efecto antidepresivo durante la suplementación. La especie L. helveticus MCC1848 se destacó por modular el patrón de expresión génica (Drd3 y Htr1a) de NAC; área del cerebro relacionada con la recompensa, sugiriendo el restablecimiento de los sistemas dopaminérgico y serotoninérgico. Sin embargo, dado que estos hallazgos son indicativos de que los probióticos pueden contribuir al tratamiento, es necesario investigar si estos efectos también ocurren en humanos (MAEHATA et al., 2019).
Apoyando esta búsqueda, Akkasheh et al. (2016) fueron uno de los primeros en intervenir en humanos diagnosticados con MDD y lograr resultados positivos en la escala BDI (Beck Depression Inventory) después de 8 semanas con la suplementación con Lactobacillus y Bifidobacterium. Sin embargo, en este estudio se usaron probióticos como tratamiento adjunto a un medicamento antidepresivo, lo que constituye una probabilidad de que los efectos tardarían más de 8 semanas en ocurrir si no se complementaran con el medicamento, por lo que las duraciones de las pruebas deben estudiarse más de cerca. (ROMIJN et al., 2017)
Por el contrario, los investigadores han considerado analizar diferentes cepas y plazos de intervención. Además, ha habido un enfoque en la co-suplementación de vitaminas, minerales y probióticos, especialmente en los cambios de humor (JAMILIAN et al., 2018; OSTADMOHAMMADI et al., 2019). Sin embargo, esta co-suplementación aún es escasa en TDM, lo que genera un mayor interés en la suplementación simbiótica, ya que han mostrado efectos positivos sobre la microbiota y la salud mental de pacientes sanos (GHORBANI et al., 2018). Aún así, Reininghaus et al. (2020) destacaron que la co-suplementación de vitaminas y simbióticos puede ser un camino interesante para el tratamiento de la depresión, ya que en sus resultados se observaron efectos expresivos sobre vías inflamatorias y metabólicas. Según los autores de este estudio, profundizar en la búsqueda mediante el análisis de las rutas metabólicas puede ser clave para comprender mejor el curso de las enfermedades y la interrelación entre los trastornos mentales y los procesos inflamatorios. Como se ve en las repercusiones favorables sobre las escalas psiquiátricas y los biomarcadores inflamatorios, los estudios seleccionados dan motivos para mejorar esta perspectiva (CHAHWAN et al., 2019; GHORBANI et al., 2018; MAJEED et al., 2018; REITER et al., 2020; WALLACE; MILEV, 2021).
Los resultados de los estudios preclínicos (Gráfico 1), ensayos aleatorizados y ensayos piloto abiertos (Gráfico 2) se presentan a continuación.
Tabla 1 – Estudios que realizaron intervenciones en modelos animales
| Autor / año / país | Animales/pruebas | UFC probióticos/duración | Resultados | Grupos/ placebo | Conflicto de intereses | Limitaciones |
|
Arseneault- Breárd et al. (2012) Canadá |
40 Ratas
Sprague-Dawley Natación forzada, interacción social, evitación pasiva |
Probio’Stick L . helveticus B . longum
1 billón de UFC Diluido en agua (200 ml) 14 dias |
↓ Depresión
↓ Permea-bilidad intestinal ↓ Citocina IL-1β ↑ Interacción social |
4 grupos (n=10)
Maltodextrina diluida en agua (200ml) |
Declarado no contener |
Cirugía torácica e infarto de miocardio |
|
Li et al. (2019) China |
50 Ratas
Wistar CUMS, natación forzada, preferencia por sacarosa |
B. longum L.rhamnosus 1 x 10 9 UFC Via sonda28 dias |
↓ Depresión
↑ 5 –HT/TPH2 corteza frontal ↓ Firmicutes y Tenericutes ↑ Control de peso |
5 grupos (n = 10)
Solución salina vía tubo |
Declarado no contener |
No se analizó la intervención de la microbiota de los modelos de depresión adicional, se complementaron los probióticos comunes y solo se reconocieron firmas metabólicas centrales en el estudio |
| Maehata et al.
(2019) Japón |
48 Ratas C57BL / 6J (B6) e ICR Interacción social, preferencia por la sacarosa, nado forzado |
L. helveticus MCC1848 1 x 10 9 UFC Se agregó preparación probiótica a la dieta formulada (AIN93G) 7 días |
↓ Anhedonia |
3 grupos (n= 16) Dieta formulada sin el probiótico |
Declarado no contener | Se utilizó un modelo animal que presenta depresión leve con menor estrés físico. |
|
Qiu et al.(2021) China |
32 Ratas C57BL / 6J Preferencia por sacarosa, natación forzada (LPS – inyección de inducción de depresión) |
Lac L. delbrueckii. subsp. bulgaricus 1 x 10 9 UFC a través de la sonda 7 días |
↓ Depresión ↓ Disbiosis ↓ Permeabilidad intestinal ↓ Súper activación de microglia ↓ TLR4 y NLRP3 ↓ citocina IL-1β ↑ ZO-1 y E-caderina |
4 grupos (n=8) Suero fisiológico vía tubo |
Declarado no contener | Sin descripciones |
Fuente: elaboración original organizada por los autores de esta revisión. Título: ↑ aumentado, ↓ reducido. CFU Unidades Formadoras de Colonias, 5-HT Serotonina, TPH2 Triptófano Hidroxilasa 2, ZO-1 Zonula Occludens-1.
Tabla 2 – Estudios que realizaron intervenciones en humanos
| Autor/año/país | Participantes/edad/ diagnóstico/escalas |
Suplemento de UFC/duración/fármaco | Resultados | Grupos/placebo | Conflicto de intereses | Limitaciones |
|
Ghorbani et al. (2018) Iran |
40 pacientes 18 – 65 años TD moderadoHAM-D |
Familact H ® Simbiótico 2 cápsulas/díaL. casei, L. rhamnosus, L. acidophilus, L. bulgaricus, B. breve, B. longum 3x 108, 2 x 109, 2 × 108, 1 × 109 UFC6 semanasFármaco: (clorhidrato de fluoxetina) por 10 semanas |
↓ De-presión | 2 grupos (n=20)
Estearato de magnesio |
Declarado no contener | Muestra pequeña, período de suplementación corto |
| Majeed et al. (2018)
India |
40 pacientes 20 – 65 años TDMHAM-D, MADRS, CES-D |
LactoSpore ® 1 cápsula/diaB. coagulans MTCC 5856 (esporas) 2 × 109 UFC90 diasFármaco: no utilizado |
↓ De-presión
↓ Insom-nio ↓ Sínto-mas ↓ Mielo-peroxidasa |
2 grupos (n=20)
Píldora formulada de manera idéntica sin el probiótico |
Indicó que este trabajo fue patrocinado y apoyado por Sabinsa Corporation NJ 08520, EE. UU. | Pequeña muestra |
| Chahwan et al.(2019)Australia |
71 pacientes
DT leve/moderada a severa 18 años + MINI, BDI-II, DASS-21 BAI, LEIDS-R |
Ecologic ®Barrier 2 sobre polvo/díaB. bifidum, B. lactis W51, B. lactis W52, L. acidophilus, B. breve, L. casei, L. salvarius, L. lactis, L. lactis W58, 1 × 1010 UFC8 semanasFármaco: no se usa |
↓ Depresión
↓ Reactividad cognitiva |
2 grupos (n=34 probiótico, n=37 placebos)
Almidón de maíz y maltodextrina |
Declarado en contenedor | La alta tasa de deserción se puede atribuir a las visitas semanales. En el post-ensayo (semana 9) los participantes estuvieron ausentes |
|
Reininghaus et al. (2020) Australia |
61 pacientes
18 – 75 años TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Simbiótico
1 sobre/día B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC D-biotina añadida (125 mg) 28 dias Fármaco: antidepresivos convencionales |
↓ Depresión
↑ Regulación en la vía IL-17 ↑ Regulación de maneras metabólico (KEGG) ↑ R. gauvreauii y Coprococcus |
2 grupos (n=28 probióticos, n=33 placebos)
Bebida idéntica sin el probiótico, biotina añadida por razones éticas |
Declarado no contener | Una muestra pequeña, los fumadores entre los dos grupos, el corto período de suplementación y la dieta hospitalaria pueden haber influido en los resultados. Había discontinuidad; asignación inicial (n=82) |
|
Reiter et al. (2020) Austria |
61 pacientes
18 – 75 años TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Simbiótico1 sobre polvo/díaB. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC 4 semanas Fármaco: antidepresivos convencionales de los participantes |
↓Depre-sión
↓ Cito-cina IL-6 |
2 grupos (n=28 probióticos, n=33 placebos)
Bebida idéntica sin el probiótico, biotina añadida por razones éticas |
Declarado no contenerr | Los efectos de diferentes medicamentos, el corto período de suplementación, la diferencia de edad y género de los participantes pueden influir en la microbiota. Había discontinuidad; asignación inicial (n=82) |
|
Wallace y Milev et al. (2021) Canadá |
10 pacientes
18 – 75 años TDM CAN-BIND, MADRS, QIDS-SR16, SHAPS |
CEREBIOME ® 1 sobre polvo/díaB. longum, L. helveticus3 x 109 UFC8 semanasFármaco: no utilizado |
↓ Depre-sión
↓ Anhe-donia ↑ Calidad de sueño |
No hubo grupo placebo | Declarado no contener | Muestra pequeña, 70% eran mujeres, período corto de suplementación y el método no fue ciego sin grupo placebo |
Fuente: elaboración original organizada por los autores de esta revisión. Leyenda: ↑ aumentada, ↓ reducida. Todos los estudios en humanos seleccionaron ambos sexos masculino ♂ y femenino ♀. Unidades formadoras de colonias de la UFC. Síndrome del Intestino Irritable del SII. Escalas: BAI Inventario de Ansiedad de Beck, BDI Inventario de Depresión de Beck, CAN-BIND Red Canadiense para la Integración de Biomarcadores en la Depresión, CES-D Centro de Estudios Epidemiológicos Escala de Depresión, HAM-D Escala de Calificación de Hamilton para la Depresión, LEIDS-R Índice de Sensibilidad a la Depresión de Leiden – Escala de calificación de depresión MADRS revisada – Montgamarey – Asberg, MINI Entrevista neuropsiquiátrica internacional mini, QIDS-SR16 Inventario rápido de sintomatología depresiva, Escala de calificación de síntomas SCL-90-90 -R-SCL-Revisited, Escala de placer SHAPS Snaith-Hamilton.
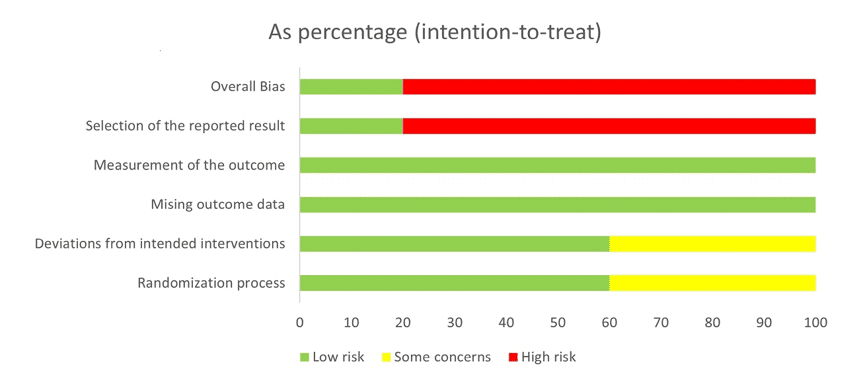
De acuerdo con la extracción de datos, se realizó un análisis evaluativo del riesgo de sesgo de los estudios aleatorizados en 5 dominios de la herramienta ROB-2 (Figura 2), resultando en el gráfico (Figura 2.1) a continuación.
Figura 2 – Análisis del riesgo de sesgo en ensayos aleatorizados
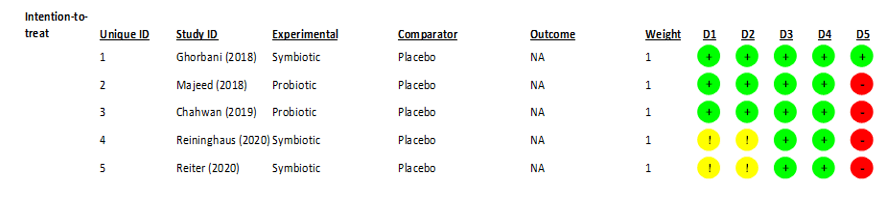
Figura 2.1 – Porcentajes de riesgo de sesgo en el gráfico
A continuación, los 10 estudios seleccionados y sus intervenciones (marcados con una X) se presentan juntos y en orden cronológico.
Tabla 3 – Intervenciones aplicadas en el conjunto de estudios
| N | Autor/año | Título, revista/país, revista: Factor de impacto (FI) | Probióticos | Antidepresivo | Prebióticos | Vitaminas | Efectos colaterales |
| I | Arseneault- Breárd et al. (2012) | Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. Canadá. Br J Nutr. FI – WSG: 3.334, Índice H: 188, FI – Scopus: 4.105 | X | ||||
| II | Li et al. (2019) |
Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. China. Neurogastroenterol Motil. FI – WSG: 3,008, Índice H: 42, FI – Scopus: 3,65 | X | X | |||
| III | Maehata et al. (2019) | Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Japón. Biosci Biotech Bioch. FI – WSG: 1.516, Índice H: 116, FI – Scopus: 1,986 | X |
| IV | Qiu et al.(2021) | Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. China. Ann Transl Med. FI – WSG: 3.297, Índice H: 48, FI – Scopus: N/D | X | ||||
| V | Ghorbani et al. (2018) | The Effect of Synbiotic as a Adjuvant Therapy to Fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Iran. Arch Neurosci. FI – N/D | X | X | X | X | |
| VI | Majeed et al. (2018) | Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. India. Food Nutr Res. FI – WSG: 0,756, Índice H:24, FI – Scopus:1.259 | X | ||||
| VII | Chahwan et al. (2019) | A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Australia. J Affect Disord. FI – WSG: 3.892, Índice H: 188, FI – Scopus: 5,104 | X | X |
| VIII | Reinin-ghauset al. (2020) | PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression—A Randomized Controlled Trial. Austria. Nutrients. FI – WSG: 4.546 , Índice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| IX | Reiter et al.(2020) | Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Austria. Nutrients. FI – WSG: 4.546 , Índice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| X | Wallace e Milev (2021) | Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Canadá. Front Psychiatry. FI – WSG: 4.157, Índice H: N/D, FI – Scopus: 7.864 | X |
Fuente: elaboración original organizada por los autores de esta revisión. Leyenda: Factor de impacto FI, índice H: Google Scholar, N/A no definido, WSG Web of Science Group.
4. DISCUSIÓN
Según la Organización Mundial de la Salud (OMS, 2020) el trastorno depresivo se ha presentado como una condición preocupante para el siglo XXI, ya que se refleja en las crecientes tasas de suicidio. El campo científico ha reiterado constantemente sobre este tema, y ha intensificado los esfuerzos para desarrollar nuevos tratamientos que puedan contribuir a la mejora de los síntomas depresivos a través de la modulación intestinal (KELLY et al., 2016; YONG et al., 2020).
Sin embargo, en la literatura predominan los estudios preclínicos que complementaron psicobióticos y obtuvieron resultados significativos sobre disbiosis, permeabilidad intestinal y neuroquímica cerebral (ARSENEAULT-BRÉARD et al., 2012; CRYAN; O’MAHONY, 2011; LI et al., 2019; ; MAEHATA et al., 2019; QIU et al., 2021; YONG et al., 2020). Afortunadamente, este escenario está cambiando y cada vez más se fomentan los estudios en humanos, reconociendo que los probióticos benefician a la microbiota y a múltiples vías endocrinas, inflamatorias y neurales. Sin embargo, esta heterogeneidad de acción demanda una mayor comprensión del “microbioma entérico-intestino-cerebral” (DINAN; CRYAN, 2016; CRYAN; O’MAHONY, 2011; HEMARAJATA; VERSALOVIC, 2013).
Los diferentes resultados en los biomarcadores y en las puntuaciones de las escalas psiquiátricas corroboran esta afirmación, pues deja claro que los mecanismos de acción varían según el género y la especie del probiótico suplementado. Hasta la fecha, los mecanismos más investigados son bacterias de los géneros Lactobacillus y Bifidobacterium, que han demostrado ser en gran medida seguras, incluso en el tratamiento de los trastornos depresivos (IVANOV; HONDA, 2012; VIZCAÍNO et al., 2016; ZAWISTOWSKA-ROJEK; TYSKI, 2018; ).
Sin embargo, la dieta y los factores nutricionales también tienen valor en esta investigación (DASH et al., 2015; HOLSCHER, 2017; LEDOCHOWSKI et al., 2000; LIU; CAO; ZHANG, 2015; SUZUKI, 2020; SKONIECZNA-ŻYDECKA et al., 2018). Según Logan y Katzman (2005), mejorar el estado nutricional y promover los efectos antiinflamatorios es fundamental para lograr un mayor éxito en el alivio de los síntomas depresivos.
En vista de esto, vale la pena señalar que la co-suplementación de un simbiótico y vitamina B7 (D-biotina) mostró competencias para regular las vías metabólicas e inflamatorias y beneficiar la microbiota intestinal de pacientes con TDM. Además, los resultados de esta co-suplementación mostraron aumentos en las concentraciones de Ruminococcus gauvreauii y Coprococcus; que se relacionan predominantemente con un aumento en la calidad de vida, sin embargo, no expresaron ningún efecto sobre la permeabilidad intestinal. Aun así, considerando los resultados, Reininghaus et al. (2020) concluyeron que existe una conexión importante entre la calidad de la dieta, la microbiota intestinal y la salud mental, lo que alentó a nuevos estudios a incluir el análisis de las vías metabólicas junto con las investigaciones de las vías inflamatorias.
Hasta la fecha, el mayor interés está en comprender la actividad cerebral y las respuestas inflamatorias en la disbiosis y los trastornos psiquiátricos (LEVY et al., 2017; TILLISCH et al., 2013; TRAN et al., 2019). Se cree que las citoquinas proinflamatorias juegan un papel importante en la patogenia de la depresión, y con eso, la interleuquina-6 (IL-6) ha ganado atención. Por el contrario, las respuestas del sistema inmunitario se llevan a cabo en cascada y abarcan una amplia interacción sistémica, por lo que se necesitan más investigaciones sobre los subtipos de inflamación en los diferentes grados de depresión (REITER et al., 2020). En consecuencia, es fundamental ampliar el análisis a otros tipos de cepas probióticas y observar la integridad de las respuestas inmunitarias innatas, ya que esta también es una interfaz a escudriñar (MAJEED et al., 2018).
Tanto la suplementación con prebióticos como con probióticos han demostrado capacidad para actuar sobre la inmunidad y diversas enfermedades (DIDARI et al., 2015; SLAVIN, 2013; VIZCAÍNO et al., 2016; ZALAR; HALSBERGER; PETERLIN, 2018). Así, en estos suplementos se deben considerar las disparidades de la microbiota de cada individuo. Por ejemplo, en pacientes deprimidos suele encontrarse la “microbiota de la depresión”, con predominio de bacterias del filo Firmicutes, Bacteroidetes y Actinobacteria. Esta diversidad que conforma la microbiota ha estimulado el análisis taxonómico de bacterias intestinales residentes de diferentes poblaciones clínicas con el fin de compararlas y comprender sus respuestas (GOODMAN et al., 2011; NEISH, 2009; SARTOR, 2008; ZHENG et al., 2016).
Eventualmente, hay estudios que exponen las disparidades de la microbiota durante la suplementación con probióticos. Chahwan et al. (2019) en su estudio analizaron las diferencias en la composición de la microbiota entre individuos diagnosticados con depresión leve, moderada y severa, y demostraron que no había diferencia significativa entre elles, ya en la comparación entre individuos no deprimidos y deprimidos, hubo un predominio de Ruminococcus gnavus en aquellos diagnosticados con depresión severa. En este estudio, también se observaron efectos secundarios como náuseas y somnolencia durante la suplementación con Lactobacillus y Bifidobacterium. Al igual que este, otro estudio también describió efectos secundarios en sujetos del grupo placebo y probiótico, a pesar de ello, ambos estudios lograron una buena adherencia a los tratamientos (CHAHWAN et al., 2019; GHORBANI et al., 2018). En comparación con el estudio de Majeed et al. (2018) La suplementación con Bacillus coagulans MTCC 5856 no causó efectos secundarios y atenuó precisamente los síntomas gastrointestinales y el insomnio de los pacientes diagnosticados con TDM y Síndrome del Intestino Irritable.
Ante este problema, es importante destacar que los síntomas gastrointestinales son comúnmente reportados en alteraciones de la microbiota intestinal y en trastornos psiquiátricos. Y, por tanto, esta relación ha dirigido la atención de los investigadores hacia la suplementación de simbióticos en la salud en general (CARDING et al., 2015; MAJEED et al., 2018; O’HARA; SHANAHAN, 2006). Los probióticos y simbióticos ya han mostrado efectos positivos en la salud mental, las respuestas inflamatorias y los síntomas gastrointestinales relacionados con el TDM (GHORBANI et al., 2018; MAJEED et al., 2018; REININGHAUS et al., 2020; REITER et al., 2020).
Sin embargo, en esta revisión, los estudios que complementaron los simbióticos y beneficiaron las vías inflamatorias mantuvieron los medicamentos psicotrópicos convencionales de sus participantes (REININGHAUS et al., 2020; REITER et al., 2020). Así, de los seis estudios en humanos, solo tres demostraron los efectos de los probióticos en su forma autónoma, es decir, sin utilizar fármacos (CHAHWAN et al., 2019; MAJEED et al., 2018; WALLACE; MILEV, 2021). Entre ellos, uno de los estudios más recientes analizó los efectos de los probióticos en 10 pacientes sin tratamiento previo con antidepresivos. Por lo tanto, Wallace y Milev (2021) obtuvieron resultados positivos en la sintomatología depresiva dentro de las 4 a 8 semanas, sin embargo, durante el diseño de este estudio, los participantes no fueron ciegos y no hubo un grupo de placebo para las comparaciones.
Sin embargo, es necesario considerar que a pesar de los resultados, la mayoría de los estudios son independientes de la elección de la administración; ya sea con o sin medicación, describió limitaciones y presentó riesgos de sesgo. Este hecho propone nuevos estudios con diseños de investigación mejor diseñados y una mayor comprensión del sistema de comunicación y respuesta del eje intestino-cerebro. Después de todo, es posible que hasta ahora la investigación haya presentado solo la punta de un “iceberg” que ocupará el campo científico por algún tiempo, pero que en cierto modo ya ha revelado perspectivas prometedoras para el área de la psiquiatría nutricional (GRENHAM et al., 2011; SARRIS et al., 2015).
5. CONSIDERACIONES FINALES
De acuerdo con la revisión de datos y citas organizadas en este estudio, es posible echar un vistazo a la pregunta orientadora: “¿los psicobióticos pueden ser denotados como un tratamiento para el Trastorno Depresivo Mayor?” Y para concluir unánimemente: los estudios sugieren que los psicobióticos pueden denotarse como un tratamiento para el Trastorno Depresivo Mayor, ya que los efectos psicotrópicos que producen fueron efectivos para reducir los síntomas depresivos de los pacientes en un plazo de 4 a 8 semanas, tal como se observa en los resultados de las escalas psiquiátricas validado para este análisis.
Además de los síntomas depresivos, se optimizaron simultáneamente otros factores importantes para el reequilibrio de la salud mental, como la calidad del sueño y la reducción de las respuestas inflamatorias, que pasaron a destacarse dentro de la temática, generando la ciencia de que se llevará a cabo una conjetura de miradas para que este tratamiento pueda ser posible. Por ello, es fundamental considerar los suplementos: que cada individuo tenga disparidades en su microbiota, al mismo tiempo que la composición de la microbiota intestinal está íntimamente ligada a las respuestas inflamatorias. Sin embargo, es posible que los diferentes subtipos de inflamación no aparezcan en el análisis de un único biomarcador inflamatorio, siendo, por tanto, pertinente tomar estas perspectivas para futuras investigaciones, ya que la regulación del estado inflamatorio ha repercutido como uno de los vías de acceso para el alivio de los síntomas depresivos. A partir de ahí, se vincula a esta línea de pensamiento la importancia de abarcar investigaciones que evalúen vías inflamatorias y metabólicas frente a factores nutricionales, ya que, según la evidencia, una mirada más profunda en este aspecto también puede ser importante para posteriores discusiones.
Además, el campo científico expresa que es necesario un mayor conocimiento del eje intestino-cerebro y los mecanismos de las diferentes cepas probióticas, ante ello se recomienda la suplementación de psicobióticos como terapia adyuvante de los fármacos antidepresivos.
Finalmente, a través de la extracción de datos y el análisis evaluativo de la calidad metodológica de los estudios aleatorizados, realizados en esta revisión, se formalizaron las siguientes pautas para los estudios posteriores: se debe planificar mejor el diseño metodológico, para que los estudios futuros tienen un menor riesgo de sesgo en los dominios: sesgo general, selección de resultados, desviaciones en la intervención prevista y proceso de aleatorización. Además, dadas las limitaciones descritas, es fundamental que futuros estudios realicen intervenciones con periodos de prueba más prolongados, en muestras más amplias, considerando la suplementación de psicobióticos de forma adyuvante y autónoma, de modo que sea posible distinguir los efectos de probióticos y los efectos de los antidepresivos. Porque, de cara a la mejora de los estudios, es probable que se enciendan más luces dentro de las discusiones sobre salud mental, y así, los conocimientos obtenidos hasta ahora sobre el eje intestino-cerebro serán cada vez más claros.
REFERENCIAS
AKKASHEH, Ghodarz et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition, Estados Unidos, vol. 32, n.3, p.315-20, mar. 2016. Disponível em: doi:10.1016/j.nut.2015.09.003 Acesso em: 01/09/2021.
ARSENEAULT-BRÉARD, Jessica et al. Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. The British Journal of Nutrition, Canadá, vol. 107, n. 12, p. 1793-9, jun. 2012. Disponível em: doi:10.1017/S0007114511005137 Acesso em: 13/09/2021.
BAPTISTA, Makilim Nunes. Avaliando “depressões”: dos critérios diagnósticos às escalas psicométricas. Avaliação Psicológica, Brasil, vol. 17, n. 3, p. 301-310, set. 2018. Disponível em: http://dx.doi.org/10.15689/ap.2018.1703.14265.03 Acesso em: 01/09/2021.
BERCIK, P.; COLLINS, S.M.; VERDU, E.F. Microbes and the gut-brain axis. Neurogastroenterol Motil, Canadá, vol. 24, n.5, p. 405-13, mai. 2012. Disponível em: https://doi.org/10.1111/j.1365-2982.2012.01906.x Acesso em: 01/09/2021.
CARDING, Simon et al. Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, Reino Unido, vol. 26, p. 26191, fev. 2015. Disponível em: doi: 10.3402/mehd.v26.26191 Acesso em: 02/09/2021.
CHAHWAN, Bahia et al. Gut feelings: A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Journal of Affective Disorders, Austrália, vol. 253, p. 317-326, jun. 2019. Disponível em: doi:10.1016/j.jad.2019.04.097 Acesso em: 13/09/2021.
CRYAN, J. F.; O’MAHONY, S. M. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterology and Motility, Irlanda, vol. 23, n.3, p. 187-92, mar. 2011. Disponível em: doi:10.1111/j.1365-2982.2010.01664.x Acesso em: 01/09/2021.
DASH, Sarah et al. The gut microbiome and diet in psychiatry: focus on depression. Current Opinion in Psychiatry, Austrália, vol. 28,1, n. 1, p. 1-6, jan. 2015. Disponível em: doi:10.1097/YCO.0000000000000117 Acesso: 02/09/2021.
DAVID, Lawrence A., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature, Estados Unidos, vol. 505, n. 7484 p. 559-63, jan. 2014. Disponível em: doi:10.1038/nature12820 Acesso em: 01/09/2021.
DIDARI, Tina et al. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World Journal of Gastroenterology, Irã, vol. 21, n. 10, p. 3072-84, mar. 2015. Disponível em: doi:10.3748/wjg.v21.i10.3072 Acesso em: 02/09/2021.
DINAN, Timothy G.; STANTON, Catarina; CRYAN, John F. Psychobiotics: a novel class of psychotropic. Biological Psychiatry, Irlanda, vol. 74, n. 10, p. 720-6, nov. 2013. Disponível em: doi:10.1016/j.biopsych.2013.05.001 Acesso em: 01/09/2021.
DINAN, Timothy G.; CRYAN, John F. Mood by microbe: towards clinical translation. Genome Medicine, Irlanda, vol. 8, n. 1, p. 36, abr. 2016. Disponível em: doi:10.1186/s13073-016-0292-1 Acesso em: 01/09/2021.
DORÉ, Joël et al. Hot topics in gut microbiota. United European Gastroenterol J, França, vol. 1, n. 5, p. 311-318, out. 2013. Disponível em: doi:10.1177/2050640613502477 Acesso em: 01/09/2021.
FERENHOF, Helio Aisenberg; FERNANDES, Roberto Fabiano. Desmistificando a revisão de literatura como base para redação científica: método SSF. Revista ACB; Biblioteconomia em Santa Catarina – SC, Florianópolis, Brasil, vol. 21, n. 3, p. 550-563, ago./nov. 2016. Disponível em: file:///C:/Users/Usuario/Downloads/1194-6369-1-PB.pdf Acesso em: 01/09/2021.
FORSYTHE, Paul et al. Mood and gut feelings. Brain, Behavior, and Immunity, Canadá, vol. 24, n. 1, p. 9-16, jan. 2010. Disponível em: doi:10.1016/j.bbi.2009.05.058 Acesso em: 01/09/2021.
GHORBANI, Zeinab et al. The Effect of symbiotic as an Adjuvant Therapy to fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Arch Neurosci, Irã, vol. 5, n.2, p.60507, abr. 2018. Disponível em: doi: 10.5812/archneurosci.60507 Acesso em: 13/09/2021.
GOODMAN, Andrew L., et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proceedings of the National Academy of Sciences of the United States of America, Estados Unidos, vol. 108, n.15, p. 6252-7. abr. 2011. Disponível em: doi:10.1073/pnas.1102938108 Acesso em: 01/09/2021.
GOODRICH, Julia K., et al. Human genetics shape the gut microbiome. Cell, Estados Unidos, vol. 159, n. 4, p. 789-99, nov. 2014. Disponível em: doi:10.1016/j.cell.2014.09.053 Acesso em: 01/09/2021.
GRENHAM, Sue et al Brain-gut-microbe communication in health and disease. Front Physiol, Irlanda, vol. 2 p. 94, dez. 2011. Disponível em: https://doi.org/10.3389/fphys.2011.00094 Acesso em: 01/09/2021.
HEMARAJATA, Peera; VERSALOVIC, James. Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation. Therapeutic Advances in Gastroenterology, Estados Unidos, vol. 6, n. 1, p. 39-51. jan. 2013. Disponível em: doi:10.1177/1756283X12459294 Acesso em: 02/09/2021.
HOLSCHER, Hannah D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, Estados Unidos, vol. 8, n. 2, p. 172-184, mar. 2017. Disponível em: doi:10.1080/19490976.2017.1290756 Acesso em: 02/09/2021.
HUANG, Ruixue; WANG, Ke; HU, Jianan. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients, China, vol. 8, n. 8, p. 483, ago. 2016. Disponível em: https://doi.org/10.3390/nu8080483 Acesso em: 01/09/2021.
IBANEZ, Grazielle et al. Adesão e dificuldades relacionadas ao tratamento medicamentoso em pacientes com depressão. Rev Bras Enferm, Brasil, vol. 67, n. 4, p. 556-562, ago. 2014. Disponível em: https://doi.org/10.1590/0034-7167.2014670409 Acesso em: 01/09/2021.
IVANOV, Ivaylo I; HONDA, Quênia. Intestinal commensal microbes as immune modulators. Cell host & microbe, Estados Unidos, vol. 12, n. 4, p. 496-508, out. 2012. Disponível em: https://doi.org/10.1016/j.chom.2012.09.009 Acesso em: 02/09/2021.
JAMILIAN, Mehri et al. The effects of probiotic and selenium co-supplementation on parameters of mental health, hormonal profiles, and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 11, n. 1, p. 80, set. 2018. Disponível em: https://doi.org/10.1186/s13048-018-0457-1 Acesso em: 01/09/2021.
KELLY, John R., et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research, Irlanda, vol. 82, p. 109-118, nov. 2016. Disponível em: https://doi.org/10.1016/j.jpsychires.2016.07.019 Acesso em: 02/09/2021.
KONTUREK, Peter C.; BRZOZOWSKI, T.; KONTUREK, S. J. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. Journal of Physiology and Pharmacology, Alemanha, vol. 62, n. 6, p. 591-599, dez. 2011. Disponível em: https://www.jpp.krakow.pl/journal/archive/12_11/pdf/591_12_11_article.pdf Acesso em: 01/09/2021.
LEDOCHOWSKI, M., et al. Carbohydrate malabsorption syndromes and early signs of mental depression in females. Digestive Diseases and Sciences, Áustria, vol. 45, n. 7, p. 1255-9, jul. 2000. Disponível em: doi:10.1023/a:1005527230346 Acesso em: 02/09/2021.
LEVY, Maayan et al. Dysbiosis and the immune system. Nature Reviews. Immunology, Israel, vol. 17, n. 4, p. 219-232, mar. 2017. Disponível em: doi:10.1038/nri.2017.7 Acesso em: 02/09/2021.
LI, Huawei et al. Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Neurogastroenterol Motil, China, vol. 31, n. 10, p. 13677, jul. 2019. Disponível em: doi: 10.1111/nmo.13677 Acesso em: 13/09/2021.
LIU, Richard T.; WALSH, Rachel F.L.; SHEEHAN, Ana E. Prebiotics and probiotics for depression and anxiety: A systematic review and meta-analysis of controlled clinical trials. Neurosci Biobehav Rev, Estados Unidos, vol. 102, p. 13-23, abr. 2019. Disponível em: doi:10.1016/j.neubiorev.2019.03.023 Acesso em: 01/09/2021.
LIU, Xiaofei; CAO, Shangqing; ZHANG, Xuewu. Modulation of Gut Microbiota-Brain Axis by Probiotics, Prebiotics, and Diet. J Agric Food Chem, China, vol. 63, n. 36, p. 7885-7895, set. 2015. Disponível em: doi:10.1021/acs.jafc.5b02404 Acesso em: 02/09/2021.
LOGAN, Alan C.; KATZMAN Martin. Major depressive disorder: probiotics may be an adjuvant therapy. Med Hypotheses, Estados Unidos, vol. 64, n. 3, p. 533-538, out. 2005. Disponível em: doi:10.1016/j.mehy.2004.08.019 Acesso em: 02/09/2021.
MAEHATA, Hazuki et al. Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Bioscience, Biotechnology, and Biochemistry, Japão, vol. 83, n. 7 p. 1239-1247, mar. 2019. Disponível em: doi:10.1080/09168451.2019.1591263 Acesso em: 13/09/2021.
MAJEED, Muhammed et al. Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Food & Nutrition Research, Índia, vol. 62, jul. 2018. Disponível em: doi:10.29219/fnr.v62.1218 Acesso em: 13/09/2021.
MARKLE, Janet G. M., et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science, Canadá, vol. 339, n. 6123, p. 1084-8, jan. 2013. Disponível em: doi: 10.1126/science.1233521 Acesso em: 01/09/2021.
MAYER, Emeran A. Gut feelings: the emerging biology of gut-brain communication. Nature Reviews. Neuroscience, Estados Unidos, vol. 12, n. 8, p. 453-66, jul. 2011, Disponível em: doi:10.1038/nrn3071 Acesso em: 01/09/2021.
MOTTA, Cibele Cunha Lima; MORÉE, Carmen Leontina Ojeda Ocampo; NUNES, Carlos Henrique Sancineto da Silva. O atendimento psicológico ao paciente com diagnóstico de depressão na Atenção Básica. Cienc Saúde Colet, Brasil, vol. 22, n. 3, p. 911-920, mar. 2017. Disponível em: https://doi.org/10.1590/1413-81232017223.27982015 Acesso em: 01/09/2021.
NEISH, Andrew S. Microbes in gastrointestinal health and disease. Gastroenterologia, Estados Unidos. vol. 136, n. 1, p. 65-80, jan. 2009. Disponível em: doi:10.1053/j.gastro.2008.10.080 Acesso em: 02/09/2021.
O’HARA, Ann M.; SHANAHAN, Fergus. The gut flora as a forgotten organ. EMBO Reports, Irlanda, vol. 7, n. 7, p. 688-93, jul. 2006. Disponível em: doi:10.1038/sj.embor.7400731 Acesso em: 02/09/2021.
O’MAHONY, Siobhain M., et al. Early life stress alters behavior, immunity, and microbiota in rats: implications for irritable bowel syndrome and psychiatric illnesses. Biological Psychiatry, Irlanda, vol. 65, n. 3, p. 263-7, fev. 2009. Disponível em: doi:10.1016/j.biopsych.2008.06.026 Acesso em: 02/09/2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE (OPAS/OMS). Folha Informativa – Depressão. (Brasil, 2020). Disponível em: https://www.paho.org/pt/topicos/depressao Acesso em: 01/09/2021.
OSTADMOHAMMADI, Vahidreza et al. Vitamin D and probiotic co-supplementation affects mental health, hormonal, inflammatory and oxidative stress parameters in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 12, n. 1, p. 5, jan. 2019. Disponível em: doi:10.1186/s13048-019-0480-x Acesso em: 02/09/2021.
QIU, Xiangjie et al. Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Annals of Translational Medicine, China, vol. 9, n. 5 p. 366, mar. 2021. Disponível em: doi:10.21037/atm-20-4411 Acesso em: 13/09/2021.
REININGHAUS, Eva Z., et al. PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression-A Randomized Controlled Trial. Nutrients, Áustria, vol. 12, n. 11, p. 3422, nov. 2020. Disponível em: doi:10.3390/nu12113422 Acesso em:13/09/2021.
REITER, Alexandra et al. Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Nutrients, Áustria, vol. 12, n. 9, p. 2575, ago. 2020. Disponível em: doi:10.3390/nu12092575 Acesso em: 13/09/2021.
RODRÍGUEZ, Juan Miguel et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microbial Ecology in Health and Disease, Espanha, vol. 26, n. 26050, fev. 2015. Disponível em: doi:10.3402/mehd.v26.26050 Acesso em: 01/09/2021.
ROMIJN, Amy R., et al. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. The Australian and New Zealand Journal of Psychiatry, Nova Zelândia, vol. 51, n. 8, p. 810-821, ago. 2017. Disponível em: doi:10.1177/0004867416686694 Acesso em: 01/09/2021.
SARRIS, Jerome et al. Nutritional medicine as mainstream in psychiatry. The Lancet. Psychiatry, Estados Unidos, vol. 2, n. 3, p. 271-4, fev. 2015. Disponível em: doi:10.1016/S2215-0366(14)00051-0 Acesso em: 02/09/2021.
SKONIECZNA-ŻYDECKA, Karolina et al. Faecal Short Chain Fatty Acids Profile is Changed in Polish Depressive Women. Nutrients, Polônia, vol. 10, n. 12, p. 1939, dez. 2018. Disponível em: doi:10.3390/nu10121939 Acesso em: 02/09/2021.
SLAVIN, Joanne. Fiber and prebiotics: mechanisms and health benefits. Nutrients, Estados Unidos, vol. 5, n. 4, p. 1417-35, abr. 2013. Disponível em: doi:10.3390/nu5041417 Acesso em: 02/09/2021.
SMITS, Loek P., et al. Therapeutic potential of fecal microbiota transplantation. Gastroenterology, Holanda, vol. 145, n. 5, p. 946-53, set. 2013. Disponível em: doi:10.1053/j.gastro.2013.08.058 Acesso em: 02/09/2021.
SARTOR, R Balfour. Microbial influences in inflammatory bowel diseases. Gastroenterology, Estados Unidos, vol. 134, n. 2, p. 577-94, fev. 2008. Disponível em: doi:10.1053/j.gastro.2007.11.059 Acesso em: 02/09/2021.
SUZUKI, Takuya. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Animal Science Journal Nihon Chikusan Gakkaiho, Japão, vol. 91, n. 1, p. 13357, dez. 2020. Disponível em: doi:10.1111/asj.13357 Acesso em: 02/09/2021.
TILLISCH, Kirsten et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, Estados Unidos, vol. 144, n. 7, p. 1394-401; 1401.e1-4, mar. 2013. Disponível em: doi:10.1053/j.gastro.2013.02.043 Acesso em: 02/09/2021.
TRAN, Nhan et al. The gut-brain relationship: Investigating the effect of multispecies probiotics on anxiety in a randomized placebo-controlled trial of healthy young adults. Journal of Affective Disorders, Estados Unidos, vol. 252, p. 271-277, abr. 2019. Disponível em: doi:10.1016/j.jad.2019.04.043 Acesso em: 02/09/2021.
TSAI, Yu-Ling et al. Probiotics, prebiotics and amelioration of diseases. Journal of Biomedical Science, Taiwan, vol. 26, n. 1, p. 3, jan. 2019. Disponível em: doi:10.1186/s12929-018-0493-6 Acesso em: 01/09/2021.
VARAVALLO, Maurilio Antonio; THOMÉ, Julia Nigro; TESHIMA, Elisa. Aplicação de bactérias probióticas para profilaxia e tratamento de doenças gastrointestinais. Semina: Cienc Biol Saúde, Brasil, vol. 29, n. 1, p. 83-104, jun. 2008. Disponível em: http://dx.doi.org/10.5433/1679-0367.2008v29n1p83 Acesso em: 01/09/2021.
VIZCAÍNO, Ricnia et al. Usos clínicos de los probióticos. Arch Venez Pueric Pediatr, Venezuela, vol. 79, n. 1, p. 029-040, mar. 2016. Disponível em: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S000406492016000100007&lng=es&nrm=iso Acesso em: 01/09/2021.
WALLACE, Caroline J. K.; MILEV, Roumen V. The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Front Psychiatry, Canadá, vol. 12 p. 618279, fev. 2021. Disponível em: doi: 10.3389/fpsyt.2021.618279 Acesso em: 13/09/2021.
WERBNER, Michal et al. Social-Stress-Responsive Microbiota Induces Stimulation of Self-Reactive Effector T Helper Cells. MSystems, Israel, vol. 4, n. 4, p. 00292-18, mai. 2019. Disponível em: doi:10.1128/mSystems.00292-18 Acesso em: 01/09/2021.
WU, Gary D., et al. Linking long-term dietary patterns with gut microbial enterotypes. Science, Estados Unidos, vol. 334, n. 6052, p. 105-8, set. 2011. Disponível em: doi:10.1126/science.1208344 Acesso em: 01/09/2021.
YATSUNENKO, Tanya et al. Human gut microbiome viewed across age and geography. Nature, Estados Unidos, vol. 486, n. 7402, p. 222-7, mai. 2012. Disponível em: doi:10.1038/nature11053 Acesso em: 02/09/2021.
YONG, Shin Jie et al. Antidepressive Mechanisms of Probiotics and Their Therapeutic Potential. Frontiers in Neuroscience, Malásia, vol. 13, p. 1361, jan. 2020. Disponível em: doi:10.3389/fnins.2019.01361 Acesso em: 01/09/2021.
YUAN, Ziqi et al. Application of antidepressants in depression: A systematic review and meta-analysis. Journal of Clinical Neuroscience, China, vol. 80, p. 169-181, ago. 2020. Disponível em: doi:10.1016/j.jocn.2020.08.013 Acesso em: 01/09/2021.
ZALAR, Bojan; HALSBERGER, Alexandre; PETERLIN, Borut. The Role of Microbiota in Depression – a brief review. Psychiatria Danubina, Eslovênia, vol. 30, n. 2, p. 136-141, jun. 2018. Disponível em: doi:10.24869/psyd.2018.136 Acesso em: 01/09/2021.
ZAWISTOWSKA-ROJEK, Anna; TYSKI, Stefan. Are Probiotic Really Safe for Humans? Polish Journal of Microbiology, Polônia, vol. 67, n. 3, p. 251-258, set. 2018. Disponível em: doi:10.21307/pjm-2018-044 Acesso em: 02/09/2021.
ZHENG, P., et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Molecular Psychiatry, China, vol. 21, n. 6, p. 786-96, jun. 2016. Disponível em: doi:10.1038/mp.2016.44 Acesso em: 02/09/2021.
[1] Licenciada en Nutrición; Certificación en Psiquiatría Nutricional (INCCOR-RJ). ORCID: 0000-0002-1588-5679.
[2] Tutor. Licenciada en nutrición; doctorado en salud colectiva; Máster en Metabolismo y Dietética; Profesor en el campo de la nutrición. ORCID: 0000-0002-7556-2548.
Enviado: Marzo de 2022.
Aprobado: Mayo de 2022.