ORIGINALER ARTIKEL
FERREIRA, Fernanda Amorim [1], PARAÍBA, Isabella Maria Rios [2], ELIAS, Laíse de Souza [3]
FERREIRA, Fernanda Amorim. PARAÍBA, Isabella Maria Rios. ELIAS, Laíse de Souza. Wirkung von Melatonin auf die Herzmorphophysiologie von Ratten, die zu Hyperlipidämie induziert wurden. Revista Científica Multidisciplinar Núcleo do Conhecimento. Jahrgang 05, Ed. 10, Vol. 13, S. 130-143. Oktober 2020. ISSN: 2448-0959, Zugangslink: https://www.nucleodoconhecimento.com.br/ernahrung/wirkung-von-melatonin
ZUSAMMENFASSUNG
Hyperlipidämien werden als metabolische Veränderungen klassifiziert und stehen im Zusammenhang mit Herz-Kreislauf-Erkrankungen, die koronare athertotische Erkrankungen hervorheben. Herz-Kreislauf-Erkrankungen haben weltweit eine bemerkenswerte Beteiligung an den Sterblichkeitsraten, und deshalb war sie das Ziel der Forschung, die nach therapeutischen Innovationen strebt. Melatonin ist ein Hormon, das in einer Umweltphase der Dunkelheit von der Zirbeldrüse produziert wird, die unter anderem antioxidative, lipidsenkende, entzündungshemmende Funktion spielt und sich damit als starkes Molekül bei der Behandlung von Herz-Kreislauf-Erkrankungen zeigt. Das Ziel dieser Arbeit ist es daher, die Wirkung von Melatonin auf oxidativen Stress und biochemische Parameter bei Ratten zu bewerten, die durch Hyperlipidämie induziert werden. Dazu wurden 15 männliche Albinoratten (Rattus norvegicus albinus) im Alter von 150 Tagen aus dem Bioterium der Abteilung für Morphologie und Tierphysiologie der Föderalen Ländlichen Universität Pernambuco verwendet. Diese Tiere wurden in Käfigen gehalten, mit Fütterung und Wasser ad libitum, Temperatur von 22° C und künstliche Beleuchtung, die eine Photoperiode von 12 Stunden Licht und 12 Stunden dunkel (invertierter Zyklus) etablieren wird. Abschließend, Studien haben gezeigt, dass Melatonin Auswirkungen auf die Verringerung der Lipidperoxidation hat, Kreatinkinase (CK) Ebenen sowie verringerung reduzierte Glutathion. Als billiges und gut verträgliches Medikament, Melatonin kann eine neue therapeutische Option für Herz-Kreislauf-Erkrankungen und Personen mit Hyperlipidämie sein.
Schlüsselwörter: Atherosklerose, Melatonin, Herz, Hyperlipidämie, oxidativer Stress.
EINFÜHRUNG
Hyperlipidämien sind metabolische Veränderungen, die auftreten, wenn zirkulierende Lipidspiegel die Grenzen der Normalität im Blut überschreiten (BEVILACQUA et al., 2007). Diese unregulierte Produktion kann schwerwiegende Probleme verursachen, einschließlich Herz-Kreislauf-Erkrankungen (CVD), wie Bluthochdruck, Arteriosklerose, zusätzlich zu Schäden an verschiedenen Organen und Geweben, wodurch ein ernstes Problem der öffentlichen Gesundheit charakterisiert wird (EMET et al., 2016).
CVDs haben eine bemerkenswerte Beteiligung an den Sterblichkeitsraten weltweit und waren daher das Ziel von Forschungen, die therapeutische Innovationen suchen. (SIMKO et al., 2016). So hat die Suche nach neuen Medikamenten zur Behandlung von Hyperlipidämie in den letzten Jahrzehnten die Rolle von Substanzen, die bei der Kontrolle der Zunahme des Lipidprofils und der Entzündung wirken, neben dem Schutz des vaskulären Endothels vor oxidativem Stress (JOCKERS et al., 2016). Unter diesen Substanzen, Melatonin hat viel Reperkussion für die Behandlung von Läsionen in verschiedenen Organen erhalten, einschließlich des Herzens (YANG et al., 2014).
Melatonin (N-Acetyl-5-Methoxytryptaline) (MEL) ist ein neuroendokrines Hormon, das von der Zirbeldrüse (HARDELAND et al., 2006). Seine Sekretion wird durch den Umweltlicht-Dunkelheits-Zyklus durch den suprachiasmatischen Kern reguliert (SKENE et al., 2006). Da seine Biosynthese in der Nacht begann, von retinalen Photorezeptoren, die Signal an die Zirbeldrüse senden, Stimulierung der Produktion und Freisetzung von Melatonin (GOOLEY et al., 2003). Der Wirkmechanismus von MEL hängt von Membranrezeptoren namens MT1, MT2 und MT3 ab, die sowohl einzeln als auch zusammen in verschiedenen Geweben und Organen ausgedrückt werden, wobei die ersten beiden sowohl im Herzen als auch in der Rattenarterie ausgedrückt werden (CAHILL; GRACE; BESHARSE, 1991) (LI; ZHANG; TANG, 2013).
Durch die Darstellung von Rezeptoren, die weit vom Körper verteilt sind, kann MEL für eine Reihe von physiologischen Ereignissen verantwortlich sein (FARÍAS; ZEPEDA; CALAF, 2012). Ursprünglich war seine Funktion auf die Regulierung des Schlaf-Wach-Zyklus (SUN; HUANG, QU, 2015) jedoch, im Laufe der Jahre wurden auch andere Funktionen berichtet, wie seine antioxidative und entzündungshemmende Rolle, bei der Regulierung des Lipid- und Glukosestoffwechsels,(AGIL et al., 2011) (ESPINO; PARIENTE; RODRIGUEZ, 2011) sowie seine kardioprotektive Wirkung, die eine wichtige Rolle bei Herzerkrankungen spielt (TAN et al., 1998), wie Myokard-Ischämie-Reperfusionsverletzung, Arteriosklerose, Bluthochdruck und Herzinsuffizienz. (FAVERO et al., 2012) (BENOVA et al., 2013) (DOMINGUEZ; ABREU-GONZALEZ; REITER, 2014).
Studien an Ratten ergaben, dass MEL eine kardioprotektive Wirkung gegen Kardiotoxizität durch Chemotherapeutika und vor kurzem die Amplitude der von MEL ausgeübten kardialen Schutzwirkung (SUN; GUSDON; QU, 2016). Darüber hinaus wurde festgestellt, dass Melatonin bei der Verringerung der Auswirkungen der induzierten Ischämie auf die Herzen von Ratten (YU et al., 2014), Senkung der Herzfrequenz, Verringerung des Kreatinkinase-Proteinspiegels, (FAVERO et al., 2016), Erhaltung der Kardiomyozyten-Mikrostruktur (LIN et al., 2018), Reduktion von Herzrhythmusstörungen und Lipidoxidation infolge von herzischen ischämischen Prozessen ( TARE et al., 2014), zusätzlich zur Verbesserung der Herzfunktion und des Blutflusses (ZHANG et al., 2017).
Angesichts der zunehmenden Zunahme der Hyperlipidämie (KANG; KOH; LEE, 2011) und damit Herz-Kreislauf-Erkrankungen (HARDELAND, 2015) und dass Melatonin eine antioxidative Funktion spielt (PANDI-PERUMAL et al., 2013) (COMMENTZ; HELMKE, 1995), (REITER et al., 2013) entzündungshemmend und lipidsenkend (ALLEGRA et al., 2003), ist es notwendig, die Wirksamkeit der Wirkung von Melatonin auf die Herzmorphophysiologie bei Ratten zu untersuchen, die durch Hyperlipidämie induziert werden. So kann diese Forschung zur Entwicklung komplementärer therapeutischer Methoden bei der Behandlung von Hyperlipidämie sowie Herz-Kreislauf-Erkrankungen beitragen. Die vorliegende Studie zielte darauf ab, die Wirkung von Melatonin auf die Herzmorphophysiologie von Ratten zu bewerten, die zu Hyperlipidämie induziert wurden.
1. MATERIALIEN UND METHODEN
1.1 EXPERIMENTELLE GRUPPEN
Wir verwendeten 15 männliche Albino-Ratten (Rattus norvegicus albinus), 150 Tage alt, aus dem Bioterium der Abteilung für Morphologie und Tierphysiologie der Föderalen Ländlichen Universität Pernambuco. Diese Tiere wurden in Käfigen gehalten, mit Fütterung und Wasser ad libitum, Temperatur von 22° C und künstliche Beleuchtung, die eine Photoperiode von 12 Stunden Licht und 12 Stunden dunkel (invertierter Zyklus) etabliert. Die Tiere wurden gewogen und nach dem Zufallsprinzip in drei experimentelle Gruppen unterteilt: GC: Ratten ohne Induktion von Hyperlipidämie; GI: Ratten, die zu Hyperlipidämie induziert und mit Placebo behandelt werden; GM: Ratten, die zu Hyperlipidämie induziert und mit Melatonin behandelt werden.
1.2 INDUKTION VON HYPERLIPIDÄMIE
Um Hyperlipidämie zu induzieren, wurde Triton WR 1339 30 Tage lang intraperitoneal verabreicht, auch bekannt als Tyloxapol, ein nicht-anionisches Reinigungsmittel mit polymerer Struktur, in einer Dosis von 400mg/kg Körpergewicht, in NaCl bei 0,9% gelöst. Diese Substanz wurde in experimentellen Studien verwendet, weil sie hyperlipidämie bei Tieren verursachen kann. Biochemische Analysen wurden verwendet, um Hyperlipidämie nach dem dritten Tag der Induktion zu folgen, nach labtest® Kits, nach den angegebenen Katalogen: LDL, HDL, Triglyceride und Gesamtcholesterin. Tiere, die nicht zu Hyperlipidämie (GC) induziert wurden, erhielten auf die gleiche Weise gleichwertige Dosen von Salinelösung.
1.3 MELATONIN-VERABREICHUNG
Melatonin wurde oral verabreicht (VO), so dass 10mg/kg Melatonin in 200 Mikroliter Alkohol gelöst wurde. Dann, um 7:00 .m., wurde diese Lösung im Trinkwasser der Tiere verdünnt, es ist erwähnenswert, dass die Flaschen mit Aluminiumfolie beschichtet wurden, um den Leuchtkraftgehalt zu schützen.
1.4 BIOCHEMISCHE ANALYSE
In den Zeiträumen vor der Induktion und nach der Behandlung wurden Blutproben entnommen. Zur Analyse vor der Induktionsphase wurden die Ratten durch mechanische Einschließung mobilisiert und das Blut durch laterale kaudale Punktion mit Katheter (24G) gesammelt. Zur Analyse nach der Induktion und der jeweiligen Behandlung wurde das Blut durch Herzpunktion entnommen. Das Material wurde zentrifugiert, der Overnnatant in Eppendorf verpackt und bis zum Zeitpunkt der Dosierung bei -20°C in einem Gefrierschrank aufbewahrt. Zu diesem Zweck wurde das Labtest® Kit verwendet nach dem spezifischen Katalog: CK-Protein (133-1/500).
1.5 OXIDATIVE STRESSANALYSE: LIPIDPEROXIDATION UND REDUZIERTES GLUTATHION
Die Lipidperoxidation wurde durch Messung der Thiobarbitursäure-reaktiven Substanzen (TBARS) geschätzt, während reduziertes Glutathion (GSH) durch Messung von Nicht-Protein-Sulfhydrongruppen bestimmt wurde. Dazu wurden Fragmente des Herzens in KCl mazeriert, 1,15% in einem Anteil von 10 ml/1g bis zur vollständigen Homogenisierung des gesammelten Materials. Das Homogenat wurde in ein Reagenzglas übertragen, dem jeweils 2 ml Regent (0,375% Thiobarbitursäure und 75% Trichloressigsäure) zugesetzt wurde. Die Doppelrohre wurden 15 Minuten lang in einem Wasserbad (100 °C) versiegelt und erhitzt. Die Übernum wurde abgetrennt und die Absorption bei 535 nm gemessen.
1.6 ETHISCHE VERFAHREN
Das Experiment wurde in Übereinstimmung mit den ethischen Prinzipien in Tierversuchen gemäß dem Gesetz Nr. 11.794 vom 8. Oktober 2008 entwickelt und das Projekt wurde von der Ethikkommission für die Verwendung von Tieren (CEUA) der Föderalen Ländlichen Universität Pernambuco (UFRPE – Prozessnummer 23082.015842/2014) (ANNEX A) genehmigt.
1.7 STATISTISCHE ANALYSE
Statistische Analysen wurden mit der kruskal-Wallis nonparametrischen Methode durchgeführt, bei der die Mittel durch den Wilcoxon-Mann Whitney-Test verglichen wurden, 95% der Bedeutung.
2. RESULTS UND DISCUSSION
Die oxidativen Schäden, die in Zellen und Geweben induziert wurden, stehen im Zusammenhang mit physiologischen Prozessen und der Ätiologie verschiedener Krankheiten wie Alterung und chronischen Krankheiten wie Diabetes, Krebs und Arteriosklerose, wo häufig der Anstieg des Gehalts der wichtigsten reaktiven Sauerstoffspezies (EROs) im biologischen Kontext beobachtet wird (ROSEN et al., 2001) (HIGASSHI et al., 2014).
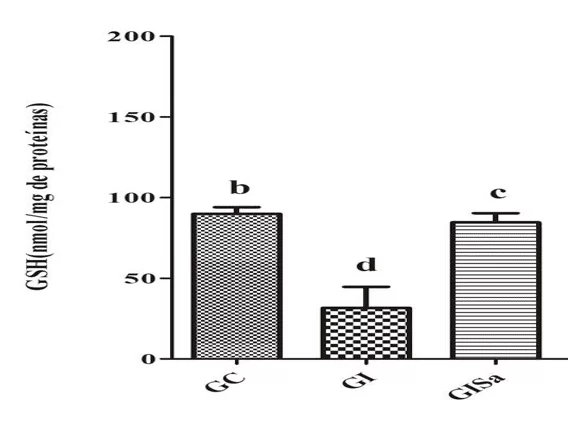
Analysen des TBARS-Spiegels im Herzgewebe nach der Induktion zur Hyperlipidämie ergaben im Vergleich zur Kontrollgruppe hohe Werte. Die Melatonin-Behandlung dämmte jedoch die TBARs-Spiegel und wies Werte auf, die GC ähneln (Abbildung 1). Die Gewebeanalyse der GSH-Spiegel in der mit Melatonin behandelten Gruppe war den Tieren der GI-Gruppe überlegen und zeigte auch Werte, die denen der Kontrollgruppe ähneln (Abbildung 2). Damit erkannten wir, dass Melatonin in der Lage war, oxidative Schäden zu reduzieren.
Dieses Hormon hat die Fähigkeit, reaktiven Sauerstoff (EROs) und Stickstoff (ERN) Arten zu entführen, die oxidative Schäden zu verhindern (ALVES et al., 2014) zusätzlich zur Stimulierung der Expression antioxidativer Enzyme (PANDI-PERUMAL et al., 2013) durch das Wachstum der Expression des Keap1-Nrf2 (MANCHESTER et al., 2015).
ONK (2016) fand heraus, dass die Verwendung von 20mg/kg Melatonin zu einem verringerten TBARS-Spiegel führte. In ähnlicher Weise zeigte Debosree Ghosh (2015), dass die Mindestdosis von 10 mg/kg Melatonin notwendig war, um vor erhöhter Lipidperoxidation in den roten Blutkörperchen von Ratten zu schützen.
Es wurden zahlreiche Studien berichtet, die die isolierte Wirkung von Melatonin auf die Förderung des GSH-Spiegels erhöhte GSH-Werte wurden bei Tieren mit Thioacetamid-induzierten Leberschäden (TAA) nachgewiesen und mit Melatonin (10 mg/kg) Czechowska (2015) und Goc (2017) behandelt, beobachteten hohe GSH-Werte im Lebergewebe von Tieren, die mit 10 mg/kg MEL allein oder in Kombination mit Natriumnitroprussid (SNP) behandelt wurden, einem antihypertensiven Medikament mit toxischen Wirkungen, verglichen mit der SNP-Administration isoliert.
In unserer Studie zeigte die Gruppe, die zu Hyperlipidämie induziert eging und mit Melatonin behandelt wurde, eine Verringerung des Ck-Proteinspiegels im Vergleich zur hyperlipidemischen Gruppe (GI), jedoch wurde in Bezug auf die Kontrollgruppe keine signifikante Veränderung beobachtet (Tabelle 1).
Kreatinkinase (CK) ist ein Enzym, das eine wichtige Rolle bei der Erzeugung von Energie für den Muskelstoffwechsel spielt. Es ist vorwiegend im Muskelgewebe vorhanden, findet sich aber auch im Hirngewebe (BRANCACCIO et al., 2008). Unter den Molekülen, die als Marker für Herzschäden verwendet werden, wird Kreatinkinase (CK) oft als der beste indirekte Marker für Schäden an Muskelgewebe (FOSCHINI et al., 2017). Diese Senkung des CK-Spiegels ist auf die Membranstabilisierungseffekte von MEL zurückzuführen. In-vitro Studien zeigen, dass MEL in der Lage ist, die Internalisierung von Phosphatidylserin, Bax-Expression und Xanthin-Oxidase zu hemmen und so eine Stabilisierung der Lipid-Bilayer (KOCIC et al., 2017).
Ghaeli (2015), berichtet, dass bei Patienten mit Myokardinfarkt mit ST-Segment-Überniveau, die einer primären perkutanen koronaren Intervention unterzogen wurden, die Melatonin-Verabreichung plus Standardbehandlung den Kreatinkinase-MB-Spiegel erheblich verringerte. Darüber hinaus hat MEL immer noch entzündungshemmende und anti-apoptotische Wirkungen, so dass es in der Lage ist, bei der Kontrolle von Herz-Kreislauf-Erkrankungen zu wirken (CHEN et al., 2016).
3. FAZIT
Abschließend, Studien haben gezeigt, dass Melatonin Auswirkungen auf die Verringerung der Lipidperoxidation hat, Kreatinkinase (CK) Ebenen sowie erhöhung der reduzierten Glutathion bei Hyperlipidämie-induzierten Ratten.
REFERENZEN
AGIL, A, Navarro-Alarcon M, Ruiz R, et al. Beneficial effects of melatonin on obesity and lipid profile in young Zucker diabetic fatty rats. J Pineal Res 2011; 50:207–212.
ALLEGRA, M.; REITER, R. J.; TAN, D. X.; et al. The chemistry of melatonin’s interaction with species. J. Pineal Res., v.34, n.1, p. 1–10, 2003.
ALVES, R.S.C. et al. A melatonina e o sono em crianças. Pediatria. v. 1, p. 587-594,2004.
BRANCACCIO, P.; Maffulli, N.; Buonauro, R. Serum enzyme monitoring in sports medicine. Clin Sports Med 2008. 27:1-1.
BENOVA, T, Viczenczova C, Radosinska J, et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol 2013; 91:633–639.
BEVILACQUA, MR, GIMENO SGA, BEVILACQUA MR, Matsumura LK, et al. Hiperlipidemias e Fatores Dietéticos: Estudo Transversal Entre Nipo-Brasileiros. Arq Bras Endocrinol Metab. 2007 mar/out; 51/4: 547-558.
CAHILL, GM, Grace MS, Besharse JC. Rhythmic regulation of retinal melatonin: metabolic pathways, neurochemical mechanisms, and the ocular circadian clock. Cell Mol Neurobiol 1991; 11:529–560.
CHEN, S,J. et al. Melatonin enhances interleukin-10 expression and suppresses chemotaxis to inhibit inflammation in situ and reduce the severity of experimental autoimmune encephalomyelitis. Int Immunopharmacol. v.31, p.169-77, 2016.
COMMENTZ, J. C.; HELMKE, K. Precocious puberty and decreased melatonin1583 secretion due to a hypothalamic hamartoma. Horm.Res. v.44, n. 6, p. 271-275,1584 1995.
CZECHOWSKA, G. et al. Protective effects of melatonin against thioacetamide induced liver fibrosis in rats. J Physiol Pharmacol. v.66, p.567-79, 2015.
DEBOSREE Ghosh; Sudeshna Paul, Aindrila Chattopadhyay, Debasish Bandyopadhy. Melatonin and aqueous curry leaf extract in combination protects against lead induced oxidative stress mediated injury to rat heart: a new approach. Journal of Pharmacy Research 2015,9(12),618-634.
DOMINGUEZ -Rodriguez A, Abreu-Gonzalez P, Reiter RJ. The potential usefulness of serum melatonin level to predict heart failure in patients with hypertensive cardiomyopathy. Int J Cardiol 2014; 174:415–417.
EMET M, Ozcan H, Ozel L, Yayla M, Halici Z, Hacimuftuoglu A. A review of melatonin, its receptors and drugs. Eur J Med. 2016; 48(2):135-41.
ESPINO J, Pariente JA, Rodriguez AB. Role of melatonin on diabetes-related metabolic disorders. World J Diabetes 2011; 2:82–91.
FARIAS JG, Zepeda AB, Calaf GM. Melatonin protects the heart, lungs and kidneys from oxidative stress under intermittent hypobaric hypoxia in rats. Biol Res. 2012; 45(1):81-5.
FAVERO G, Rodella LF, Reiter RJ, et al. Melatonin and its atheroprotective effects: a review. Mol Cell Endocrinol 2014; 382:926–937.
FAVERO G, Franceschetti L, Buffoli B, Moghadasian MH, Reiter RJ, Rodella LF, et al. Melatonin: Protection against age-related cardiac pathology. Ag Res Rev. 2016; 22: S1568-1637. 16.
FOSCHINI D, Prestes J, Charro MA. Relação entre exercício físico, dano muscular e dor muscular de início tardio. Rev Bras Cineantropom Desempenho Hum 2007;9(1):101-6.
GHAELI P, Vejdani S, Ariamanesh A, et al. Effect of melatonin on cardiac injury after primary percutaneous coronary intervention: a randomized controlled trial. Iran J Pharm Res 2015; 14:851–855.
GOC, Z. et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP. Chin J Physiol. v.1, p. 28-34 2017.
GOOLEY, JJ, Lu J, Fischer D, Saper CB. A broad role for melanopsin in nonvisual photoreception. J Neurosci 2003; 23:7093–7106.
HARDELAND, R, Pandi-Perumal SR, Cardinali DP. Melatonin. Int J Biochem Cell Biol. 2006; 38:313–316.
HARDELAND, R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance. Endocrine. v. 27, p. 111-118, 2015.
HIGASSHI; T Maruhashi, K Noma, Y Kihara Oxidative stress and endothelial dysfunction: Clinical evidence and therapeutic implications, Trends in Cardiovascular Medicine Volume 24, Issue 4, May 2014, Pages 165-169.
JOCKERS, R, Delagrange P, Dubocovich ML, Markus RP, Renault N, Tosini G, et al. Update on melatonin receptors: IUPHAR Review. Br J Pharmacology. 2016; 173:2702-25.
KANG, J. W.; KOH, E. J.; LEE, S. M. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. v.50, p. 403-411, 2011.
KOCIC, G., Tomovic, K., Kocic, H., et al., 2017. Antioxidative, membrane protective and antiapoptotic effects of melatonin, in silico study of physico-chemical profile and efficiency of nanoliposome delivery compared to betaine. RSC Adv. 7, 1271–1281.
LI, X.; ZHANG, M.; TANG, W. Effects of melatonin on streptozotocin-induced retina neuronal apoptosis in high blood glucose rat. Neurochem Res. v.38, p.669- 76, 2013.
LIN, X, Zhao T, Lin CH et al. Melatonin provides protection against heat strokeinduced myocardial injury in male rats. J Pharm Pharmacol. 2018 Jun;70(6):760-767.
MANCHESTER LC, et al. Melatonin: an ancient molecule that makes oxygen metabolically tolerable. J Pineal Res. v.59, p. 403-19, 2015
ONK D, et al. Melatonin Attenuates Contrast-Induced Nephropathy in Diabetic Rats: The Role of Interleukin-33 and Oxidative Stress. Mediators Inflamm. v.2016, p. 508-28, 2016.
PANDI-PERUMAL, S. R. et al. Melatonin antioxidative defense: therapeutical implications for aging and neurodegenerative processes. Neurotox Res. v.23, p.267-300, 2013.
REITER, R. J. et al. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans – Acta Biochim. Pol.v. 50, p. 1129-1146, 2003.
RODRIGUEZ C, et al. Regulation of antioxidant enzymes: a significant role for melatonin. J Pineal Res. 2004;36(1):1–9.
ROSEN, P P Nawroth, G King, W Möller, H J Tritschler, L Packer. The role of oxidative stress in the onset and progression of diabetes and its complications: a summary of a Congress Series sponsored by UNESCO-MCBN, the American Diabetes Association and the German Diabetes Society – May-Jun 2001;17(3):189-212.
SIMKO F, Baka T, Paulis L, Reiter RJ. Elevated heart rate and non dripping heart rate as potential targets for melatonin: a review. J Pineal Res. 2016; 61:127-37.
SKENE, DJ, Arendt J. Human circadian rhythms: physiological and therapeutic relevance of light and melatonin. Ann Clin Biochem. 2006; 43:344–353.
SUN H, Huang FF, Qu S. Melatonin: a potential intervention for hepatic steatosis. Lipids Health Dis. 2015; 14:75.
SUN H, Gusdon AM, Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr Opin Lipidol. 2016; 27(4):408-13.
TAN DX, Manchester LC, Reiter RJ, et al. Ischemia/reperfusion-induced arrhythmias in the isolated rat heart: prevention by melatonin. J Pineal Res. 1998; 25:184–191.
TARE M, Parkington HC, Wallace EM et al. Maternal melatonin administration mitigates coronary stiffness and endothelial dysfunction, and improves heart resiliência to insult in growth restricted lambs. 2014
YANG Y, Sun Y, Yi W, Li Y, Fan C, Xin Z, et al. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases. J Pineal Res. 2014;57(4):357-66. doi: 10.1111/jpi.12175.
YU L, Sun Y, Cheng L, Jin Z, Yang Y, Zhai M, et al. Melatonin receptor mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1. J Pineal Res. 2014; 57(2):228-38.
ZHANG, Y. et al. Melatonin protects against arsenic trioxide-induced liver injury by the upregulation of Nrf2 expression through the activation of PI3K/AKT pathway. Oncotarget. 2017.
ANHANG
Abbildung 1: Bewertung der TBARS-Spiegel (nmol / mg Protein) im Herzgewebe der Tiere in den verschiedenen Versuchsgruppen) * Mittelwerte, denen der gleiche Buchstabe folgt, unterscheiden sich durch den Kruskal-Wallis-Test mit Dunns Post-hoc-Test nicht signifikant (p <) 0,05). CG: Kontrolle; GI: induziert zu Hyperlipidämie; GIM: induziert zu Hyperlipidämie und behandelt mit Melatonin.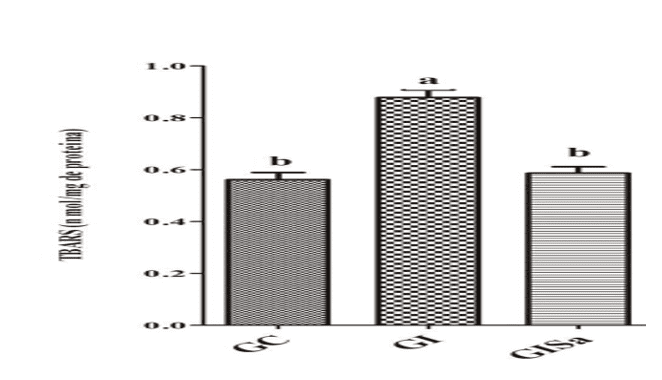
Abbildung 2. Bewertung der GSH-Spiegel (nmol / mg Protein) im Herzgewebe der Tiere in den verschiedenen Versuchsgruppen) * Die Mittelwerte, denen der gleiche Buchstabe folgt, unterscheiden sich im Kruskal-Wallis-Test mit Dunns Post-hoc-Test nicht signifikant (p <) 0,05). CG: Kontrolle; GI: induziert zu Hyperlipidämie; GIM: induziert zu Hyperlipidämie und behandelt mit Melatonin.
Tabelle 1: Biochemische Analyse von Versuchsgruppen
[1] Studium der Ernährung am Uninassau University Center.
[2] Master-Student in Community Nutrition and Public Health von FCNAUP Absolvierte in Ernährung vom Uninassau University Center.
[3] Beratungsberater. Promotion in Animal Bioscience. Master in Animal Bioscience. Spezialisierung in Morphologie. Abschluss in Biowissenschaften.
Eingereicht: August 2020.
Genehmigt: Oktober 2020.