ARTÍCULO DE REVISIÓN
FRANCO, Guilherme Sousa Leal [1]
FRANCO, Guilherme Sousa Leal. Insuficiencia renal aguda en la unidad de cuidados intensivos: Diagnóstico en pacientes gravemente heridos. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 11, Vol. 01, págs. 42-53. Noviembre de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/pacientes-gravemente-heridos
RESUMEN
La lesión renal aguda (LRA) es un síndrome clínico común en pacientes en estado crítico y se asocia con una estancia hospitalaria más larga, un mayor uso de los recursos hospitalarios y una mayor morbilidad y mortalidad. El objetivo general es presentar las definiciones actuales de Lesión Renal Aguda, perfil del paciente con este diagnóstico en unidades de cuidados intensivos y métodos de diagnóstico con énfasis en los nuevos métodos basados en la dosificación de biomarcadores. Para la preparación del artículo de revisión, se consultaron las diversas publicaciones científicas en las bases de datos de ScienceDirect, UptoDate, Medline/PubMed, Lilacs y SciELO, utilizando los términos Acute Kidney Injury (AKI), factores de riesgo, biomarcadores urinarios, nefropatía, UTI (Unidad de terapia intensiva), insuficiencia renal y terapia intensiva. Los resultados muestran que la terapia guiada por objetivos en el período perioperatorio está asociada con la reducción de complicaciones y el tiempo de hospitalización. Por lo tanto, TGO (transaminasa glutámico oxalacética) puede proporcionar efectos beneficiosos, evitando las dificultades de admisión a unidades de cuidados intensivos
Palabras clave: Acute Kidney Injury, biomarcadores, nefropatía, insuficiencia renal, cuidados intensivos.
1. INTRODUCCIÓN
La lesión renal aguda (LRA) es un síndrome clínico común asociado con hospitalización prolongada y un mayor uso de los recursos hospitalarios, y una mayor morbilidad y mortalidad (RONCO et al., 2013). Es un trastorno complejo que ocurre en una variedad de ambientes con manifestaciones clínicas que van desde una elevación mínima de la creatinina sérica a la insuficiencia renal aráurica (MEHTA et al., 2007)
En los últimos años, aunque se han realizado investigaciones significativas en el diagnóstico, la prevención y el tratamiento de la LRA, la incidencia y mortalidad secundaria a la disfunción renal aguda han permanecido elevadas (BELLOMO et al., 2004). Esta condición clínica puede ocurrir en cualquier entorno hospitalario con tasas de incidencia que oscilan entre el 1% y el 25% en pacientes gravemente heridos. Otros estudios reportan (CHERTOW et al., 1998; POR MENDONÇA et al., 2000) prevalencia de hasta el 5% al 7% de todos los pacientes hospitalizados y dos tercios de los pacientes en estado crítico (NIGWEKAR; WAIKAR, 2011), dependiendo de la población del estudio y de los criterios utilizados para definir su presencia.
También en la última década, el viejo término “insuficiencia renal aguda” ha sido reemplazado por criterios estandarizados de lesión renal aguda, incorporando pequeños cambios en la producción de creatinina y orina, como la Red de Lesiones Renales Agudas (AKIN) (SAWHNEY; FRASER, 2017). La lesión renal aguda (LRA) ocurre en hasta el 50% de los pacientes en la unidad de cuidados intensivos postquirúrgicas, con tasas de mortalidad notificadas del 15% al 80%, con más del 50% de los casos secundarios a la sepsis (COCA et al 2009; MAXWELL; BELL, 2017).
El objetivo general del artículo es llevar a cabo una revisión sistemática de la literatura abordando las definiciones actuales de Lesión Renal Aguda, el perfil del paciente con este diagnóstico en unidades de cuidados intensivos, y métodos de diagnóstico con énfasis en los nuevos modelos basados en la dosificación de biomarcadores.
2. MATERIAL Y MÉTODOS
Este estudio consiste en una revisión de la literatura, realizada entre febrero y octubre de 2018, basada en el análisis de publicaciones científicas, presentes en Internet, sobre datos de ScienceDirect, UptoDate, Medline/PubMed, Lilacs, SciELO, especialmente con los términos Acute Kidney Injury (AKI), Factores de Riesgo, Biomarcadores, Nefropatía, UTI, insuficiencia renal aguda y Cuidados Intensivos.
Según los criterios, en este estudio se incluyeron artículos científicos que describen el perfil de pacientes graves con insuficiencia renal aguda en el contexto de las unidades de cuidados intensivos. Se revisaron varias modalidades de estudios entre 1980 y 2018, incluyendo grandes estudios prospectivos aleatorios y multicéntricos, metaanálisis, estudios observacionales retrospectivos y revisiones literarias.
3. Revisión
3.1 INSUFICIENCIA RENAL AGUDA: DEFINICIÓN.
La insuficiencia renal aguda (IRA), actualmente llamada Lesión Renal Aguda (LRA), difiere de la IRC, principalmente porque es un síndrome clínico caracterizado por la disminución de la función renal que se produce en un corto período de tiempo (Tabla 1). Es una complicación relativamente común en pacientes en estado crítico y se asocia con alta morbilidad y mortalidad (NOGUEIRA; OLIVEIRA, 2007).
TABLA 01: Principales diferencias entre la insuficiencia renal aguda y la insuficiencia renal crónica
| Disfunción/Parámetro | IRA | IRC |
| Historia | Días/semanas | Meses/Años |
| Hemoglobina | Normal | Reducido |
| Renal “Mass” | Normal | Reducido |
| Osteoartritis | Out | Presente |
| Neuropatía periférica | Out | Presente |
| Creatinina sérica | Incrementado reversiblemente | Incrementado irreversiblemente |
Fuente: NOGUEIRA, OLIVEIRA (2007)
Hasta hace poco, no había acuerdo en la definición de lesión renal aguda ni un consenso claro sobre cómo prevenir o manejar esta enfermedad. Muchos modelos fueron incapaces de definir con precisión la elección de parámetros fisiológicos y clínicos adecuados para los ensayos de nuevos tratamientos. El tiempo, la intensidad y la modalidad de la terapia de reemplazo renal, el posible uso de tratamiento extracorpóreo de purificación sanguínea para enfermedades renales adicionales y la interacción entre la disfunción renal y las anomalías en otros órganos son factores que deben incluirse entre las iniciativas para estandarizar el tratamiento de este síndrome (RONCO et al., 2013).
3.2 INSUFICIENCIA RENAL AGUDA: DIAGNÓSTICO Y ES PROVISIONAL
Es difícil asegurar un diagnóstico temprano de vasoconstricción renal aguda incluso antes de que se produzcan disfunciones tubulares. En el pasado, el diagnóstico se basó en la respuesta de los niveles plasmáticos de urea del paciente con sospecha de IRA – si los niveles disminuyeron con la hidratación intravenosa sería una indicación de vasoconstricción reversible (MILLER et al., 1978).
El problema de este enfoque es que muchos pacientes entraron en una imagen de congestión pulmonar, hipoxia y el uso de ventilación mecánica temprana (SCHRIER et al., 2004). A partir de este punto, el foco de mayor atención en la investigación diagnóstica se convirtió en el análisis detallado de los sedimentos urinarios (DE MENDON-A et al., 2000).
Independientemente de la investigación, una historia detallada y precisa es crucial para diagnosticar una lesión renal aguda (IRA ) y determinar el tratamiento. Distinguir la lesión renal aguda de la enfermedad renal crónica es importante, pero hacer la distinción puede ser difícil. En casos de IRA no aclarado o en presencia de cilindros hemáticos de biopsia renal (MADAIO et al., 1990) – excepto en presencia de algunas situaciones, entre ellas la más común es la infección urinaria activa (MOTA, 2005).
La biopsia no reemplaza un buen examen clínico y anamnesis, pero ofrece la posibilidad de investigación histopatológica y descripción con detalles de la microestructura renal. Otra consideración es la diferenciación entre LRA y DRC (Enfermedad renal crónica) (YANG et al., 2014)
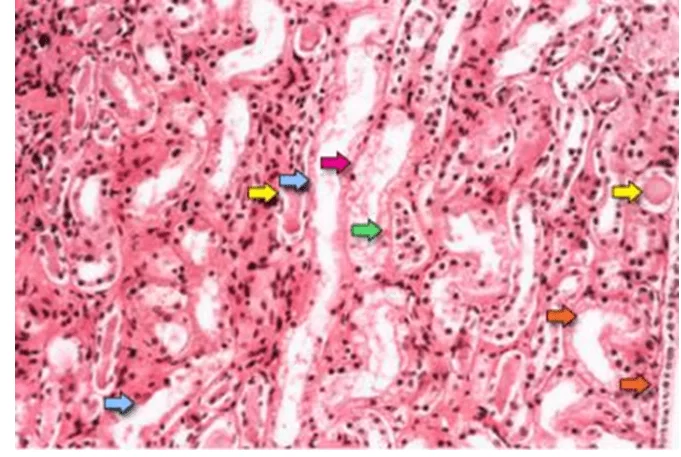
La Figura 01 muestra características sugestivas de necrosis tubular aguda que son la denudación difusa de las células tubulares renales con pérdida de borde del cepillo (flechas azules); aplanamiento de las células tubulares debido a la dilatación tubular (flechas naranjas); formación de cúmulo intratubular (flechas amarillas); y el desencamiento de las células, que es responsable de la formación de moldes granulares (flecha roja). Finalmente, la obstrucción intratubular debido al epitelio desnudo y los desechos celulares es evidente (flecha verde). Tenga en cuenta que las células epiteliales tubulares decapadas se unen debido a la reorganización de las moléculas de reacción intercelular (TAN et al., 2009).
FIGURA 01: Fotomicrografía de una muestra de biopsia renal muestra la región medular renal, que se compone principalmente de túbulos renales.
En un intento de estandarizar la definición y clasificación de AKI, se crearon algunos criterios, como Risk, Injury, Failure, Loss, End-Stage (RIFLE) y Acute Kidney Injury Network (AKIN). Hoy en día, estos criterios se utilizan ampliamente para clasificar AKI como una función de creatinina sérica y diuresis.
El estudio prospectivo de cohortes utilizando registros médicos de 190 pacientes ingresados en la Unidad de Cuidados Intensivos encontró que tanto la puntuación RIFLE como la AKIN y el KDIGO, de manera similar, son buenos predictores de mortalidad en pacientes que se encuentran bajo una condición grave. (LEVI et al., 2013).
GRAPH 01: Curva ROC y capacidad discriminatoria de muerte en pacientes gravemente heridos según criterios RIFLE, AKIN y KDIGO
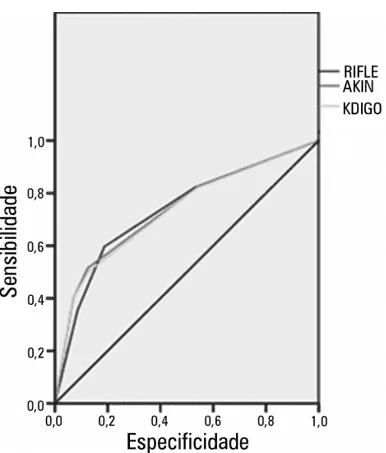
Fuente: LEVI et al. (2010)
Como se muestra en el gráfico 01, los autores encontraron que el área de la curva ROC (AUROC) calculada era 0,735 para el criterio RIFLE, 0,74 para el AKIN y 0,733 para el KDIGO, mostrando el valor p<0.0001 para la discriminación de muerte de los tres criterios (LEVI et al., 2010).
3.3 NUEVOS MARCADORES EN EL DIAGNÓSTICO DE LESIÓN RENAL AGUDA
La creatinina sérica, que es la prueba de laboratorio más utilizada para el diagnóstico de LRA , es un marcador imperfecto, ya que sus niveles reflejan las consecuencias funcionales tardías de la lesión en lugar de la lesión celular directa, y no son sensibles y específicos en el diagnóstico precoz de IRA (NADKARNI et al., 2017).
El desarrollo de nuevos biomarcadores para el diagnóstico precoz, la estratificación del riesgo y el pronóstico de la lesión renal aguda (LRA) es una de las principales prioridades en la investigación renal mundial (PARIKH et al., 2014). Algunas de las sustancias más prometedoras incluyen lipokalina asociada con gelatinasa de neutrófilos plasmáticos (NGAL) (MISHRA et al., 2005), molécula de lesión renal-1 (KIM-1), (HAN et al., 2002; ICHIMURA et al., 1998), IL-18 (MELNIKOV et al., 2001; PARIKH et al., 2004), cistatina C (HERGET-ROSENTHAL et al., 2004), proteína de unión a ácidos grasos hepáticos (L-FABP) (KANG et al., 2002; YOSHINO et al., 2003), IL-6 (D’AMICO; BAZZI, 2003), α / π Glutatión S-transferase (GST) (HARRISON et al., 1989; SUNDBERG et al., 1994), y N-acetil-β-d-glosaminidasa (NAG).
Varios estudios han demostrado la eficacia de los biomarcadores urinarios, interleucina-18 (IL-18); lipokalina correlacionada con la gelatinasa de neutrófilos plasmáticos (NGAL); molécula de lesión renal-1 (KIM-1) y proteína de unión a ácidos grasos de tipo hepático (L-FABP) para detectar AKI antes del cambio en la creatinina sérica (HO et al., 2015; LIN et al., 2015; NADKARNI et al., 2017). Algunos de los más prometedores incluyen lipokalina asociada con plasma neutrofilis gelatinasa (NGAL), molécula de lesión renal-1 (KIM-1), IL-18,23,24 cistatina C, proteína de unión a ácidos grasos hepáticos (L-FABP), IL-6.28 α / π glutatión S-transferasa (GST), y N-acetil-β-d-glosaminidasa (NAG).
En general, el rendimiento diagnóstico aparente de un biomarcador depende no sólo de su capacidad para detectar lesiones, sino también de la prevalencia de la enfermedad y de la sensibilidad y especificidad del estándar imperfecto del oro (LASSNIGG et al., 2004).
Algunos resultados ponen de relieve la importancia de las pruebas prospectivas y sistemáticas de las condiciones de almacenamiento de muestras a niveles de biomarcadores antes de la adopción de estas pruebas en la práctica clínica o la investigación (PARIKH et al., 2014), ya que las condiciones de almacenamiento de orina pueden interferir con la lectura de los resultados obtenidos.
Nadkarni et al., (2017) concluyó que varios factores disponibles a través de la prueba de cinta adhesiva de orina se asocian con el aumento de las concentraciones de biomarcadores urinarios que son independientes de la lesión renal clínica. Parece necesario realizar más estudios para evaluar la interferencia de elementos comunes de orina en los niveles de biomarcadores de interés en la exploración del impacto de la contabilidad de estos elementos en su rendimiento de pronóstico/diagnóstico.
Ho et al., (2015), concluido a través del metanálisis de 28 estudios que informaron de la medición intraoperatoria y/o postoperatoria temprana de biomarcadores en orina (n a 23 estudios) o plasma o suero (n a 12 estudios). Se concluyó que en adultos, los biomarcadores conocidos de orina, plasma y suero AKI tienen una discriminación modesta en el mejor de los casos cuando se mide dentro de las 24 horas después de las cirugías cardíacas, los mismos estudios señalan que estos biomarcadores todavía están disponibles sólo para la investigación que no está disponible en la práctica clínica de grandes centros.
3.4 IDENTIFICAR LA CAUSA DE LA IRA
En nuestro estudio, no se identificaron pruebas que compararan la precisión de la prueba de orina con otros métodos de diagnóstico como la biopsia y la toma de imágenes. Sin embargo, según Bell y Maxwell (2017), en un metaanálisis realizado por el National Clinical Guideline Centre en 2013, en el que se recogieron 126 publicaciones sobre prevención, diagnóstico y tratamiento de lesiones renales agudas en pacientes graves, se recomendó encarecidamente que la prueba de orina se realizara con investigación de sangre, proteínas, leucocitos, nitritos y muestras de glucosa en todos los pacientes tan pronto como se sospecha una lesión aguda. Se supone que el hallazgo de hematuria y proteinuria en la prueba de cinta de reactivos de orina en un paciente con AKI indica una enfermedad glomerular aguda probable o glomerulonefritis (UCHINO et al., 2004).
En un estudio epidemiológico prospectivo, multicéntrico y multinacional por Uchino et al., (2004), sepsis grave / shock séptico (43,8%), cirugía mayor (39,1%), baja producción cardíaca (29,7) e hipovolemia (28,2%) fueron las afecciones más comunes asociadas con el desarrollo de insuficiencia renal aguda en pacientes gravemente heridos.
Estos medicamentos se han demostrado, al menos en modelos animales de LRA, reducción del consumo de oxígeno y demandas metabólicas de células tubulares renales lesionadas, limitando así el daño isquémico de los segmentos tubulares medulares externos (HEYMAN et al., 1994).
3.5. ENFOQUES TERAPÉUTICOS EN EL MANEJO DE AKI
En un entorno de tratamiento agudo, a menudo se prescriben diuréticos para mantener o aumentar la producción de orina en pacientes con lesión renal aguda (LRA). La razón detrás de dar diuréticos es que pueden proteger el riñón de lesiones isquémicas mientras mantienen un estado no oligurico (KARAJALA et al., 2009).
Se han estudiado varios diuréticos con propiedades farmacológicas variables diuréticas (furosemida, bumetanida, torsemida), diuréticos tiazídicos (metolazona, hidroclorotiazida, a menudo administrados en combinación con diuréticos de bucle y diuréticos como el manitol) y se administran en el entorno AKI (KARAJALA y al., 2009). Los diuréticos de bucle son los diuréticos más potentes y siguen siendo los más indicados para tratar a los pacientes de LRA (NIGWEKAR; WAIKAR, 2011). El manejo de LRA tiene como objetivo prevenir y evitar daños persistentes como medicamentos nefrotóxicos e hipotensión, que disminuiría la TFG (tasa de filtración glomerular) y la oxigenación local.
4. CONSIDERACIONES FINALES
En resumen, se sabe que LRA es un síndrome desencadenado por una amplia gama de comorbilidades y situaciones de riesgo. El paciente gravemente hospitalizado en una unidad de cuidados intensivos todavía parece ser el más beneficiado de la posibilidad de un diagnóstico precoz y el manejo correcto de la lesión renal aguda.
A pesar de los avances en la investigación clínica y de laboratorio, todavía se percibe que su diagnóstico está ligado a la creatinina, la urea y el registro de diuresis del paciente. Estas medidas parecen ser eficaces sobre la base de la suposición de que ayudan a aumentar la supervivencia del paciente grave.
Es necesario realizar más estudios clínicos, así como estudios de metanálisis son de suma importancia para la identificación y organización del gran número de estudios de laboratorio que implican la recolección y dosificación de biomarcadores urinarios y plasmáticos alterados en presencia de insuficiencia renal aguda. Es necesario elaborar nuevos protocolos sobre cómo conservar muestras de orina para estas pruebas. Se destaca que la Red de Risk, Injury, Failure, Loss, End-Stage (RIFLE) y Acute Kidney Injury Network (AKIN), aunque ampliamente utilizada con buen grado de precisión no son efectivas en el diagnóstico temprano de procesos de lesiones glomerulares.
Por regla general, la aplicación de líquidos debe llevarse a cabo como cualquier otro tipo de medicamento, teniendo en cuenta sus indicaciones y limitaciones individuales. En este contexto, el reemplazo de volumen perioperatorio con soluciones iso-oncóticas se entiende como un aspecto ventajoso, incluso si se necesitan ensayos controlados aleatorios adicionales para contactar con su relevancia para el resultado. Así, en resumen, el desarrollo de una estrategia de administración racional de fluidos podría ayudar al tratamiento de pacientes sometidos a cirugía de bajo riesgo que tienen una pérdida insignificante de volumen intravascular con infusión cristaloides, a través de la combinación entre la administración cristaloides y coloide, cuidadosamente valorados en base a mediciones hemodinámicas.
Por último, la conclusión es que la Terapia Guiada por Objetivos en el período Perioperatorio se asocia con reducciones en las complicaciones y la duración de la hospitalización. Así, es posible lograr los efectos beneficiosos de TGO, en el que impide el ingreso a las unidades de cuidados intensivos.
5. REFERENCIAS
BELLOMO, R. et al. Open Access Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care, v. 4 n, 8, p. 204–212, 2004.
CHERTOW, G. et al. Independent association between acute renal failure and mortality following cardiac surgery. American Journal of Medicine, v. 104, n. 4, p. 343–348, 1998.
COCA, S. et al. Long-term Risk of Mortality and Other Adverse Outcomes After Acute Kidney Injury: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases, v. 53, n. 6, p. 961–973, 2009.
D’AMICO, G.; BAZZI, C. Urinary protein and enzyme excretion as markers of tubular damage. Current opinion in nephrology and hypertension, v. 12, n. 6, p. 639–43, 2003.
DE MENDONÇA, A. et al. Acute renal failure in the ICU: risk factors and outcome evaluated by the SOFA score. Intensive Care Medicine, v. 26, n. 7, p. 915–921, 2000.
HAN, W. et al. Kidney Injury Molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International, v. 62, n. 1, p. 237–244, 2002.
HARRISON, D. et al. Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury. Journal of clinical pathology, v. 42, n. 6, p. 624–8, 1989.
HERGET-ROSENTHAL, S. et al. Early detection of acute renal failure by serum cystatin C. Kidney International, v. 66, n. 3, p. 1115–1122, 2004.
HEYMAN, S. N. et al. Loop diuretics reduce hypoxic damage to proximal tubules of the isolated perfused rat kidney. Kidney International, v. 45, n. 4, p. 981–985, 1994.
HO, J. et al. Urinary, Plasma, and Serum Biomarkers’ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. American Journal of Kidney Diseases, v. 66, n. 6, p. 993–1005, 2015.
ICHIMURA, T. et al. Kidney injury molecule-1 (KIM-1), a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain, is up-regulated in renal cells after injury. The Journal of biological chemistry, v. 273, n. 7, p. 4135–42, 1998.
KANG, D.-H. et al. Role of the microvascular endothelium in progressive renal disease. Journal of the American Society of Nephrology: JASN, v. 13, n. 3, p. 806–16, 2002.
KARAJALA, V. et al. Diuretics in acute kidney injury. Minerva anestesiologica, v. 75, n. 5, p. 251–7, 2009.
LASSNIGG, A. et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study. Journal of the American Society of Nephrology: JASN, v. 15, n. 6, p. 1597–605, 2004.
LEVI, T. M. et al. Comparação dos critérios RIFLE, AKIN e KDIGO quanto à capacidade de predição de mortalidade em pacientes graves. Revista Brasileira de Terapia Intensiva, v. 25, n. 4, p. 290–296, 2013.
LIN, X. et al. Urine interleukin-18 in prediction of acute kidney injury: a systematic review and meta-analysis. Journal of Nephrology, v. 28, n. 1, p. 7–16, 2015.
MADAIO, M. P. et al. Renal Biopsy. Nephrology Forum. Kidney International, v. 38, p. 529-543, 1990.
MAXWELL, R.; BELL, C. M. Acute Kidney Injury in the Critically Ill. The Surgical clinics of North America, v. 97, n. 6, p. 1399–1418, 2017.
MEHTA, R. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Critical Care, v. 11, n. 2, p. R31, 2007.
MELNIKOV, V. et al. Impaired IL-18 processing protects caspase-1-deficient mice from ischemic acute renal failure. The Journal of clinical investigation, v. 107, n. 9, p. 1145–52, 2001.
MILLER, T. et al. Urinary diagnostic indices in acute renal failure: a prospective study. Annals of internal medicine, v. 89, n. 1, p. 47–50, 1978.
MISHRA, J. et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet, London, England, v. 365, n. 9466, p. 1231–8, 2005.
MOTA, P. C. Indications for renal biopsy. Acta Médica Portuguesa, v. 18, n. 2, p. 147–51, 2005.
NADKARNI, G. et al. Urinalysis findings and urinary kidney injury biomarker concentrations. BMC Nephrology, v. 18, n. 1, p. 218, 2017.
NIGWEKAR, S.; WAIKAR, S. Diuretics in Acute Kidney Injury. Seminars in Nephrology, v. 31, n. 6, p. 523–534, 2011.
NOGUEIRA, C. S.; OLIVEIRA, C. R. Degrandi. Disfunção renal: definição e diagnóstico. Medicina perioperatória, Rio de Janeiro, cap. 64, p. 571-577, 2007.
PARIKH, C. et al. Urinary interleukin-18 is a marker of human acute tubular necrosis. American journal of kidney diseases : the official journal of the National Kidney Foundation, v. 43, n. 3, p. 405–14, 2004.
PARIKH, C. et al. Urine Stability Studies for Novel Biomarkers of Acute Kidney Injury. American Journal of Kidney Diseases, v. 63, n. 4, p. 567–572, 2014.
RONCO, C. et al. Acute Dialysis Quality Initiative (ADQI). Contributions to nephrology. v. 182, p.1–4, 2013.
SAWHNEY, S.; FRASER, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in chronic kidney disease, v. 24, n. 4, p. 194–204, 2017.
SCHRIER, R. et al. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of clinical investigation, v. 114, n. 1, p. 5–14, 2004.
SUNDBERG, A. et al. Urinary π-Class Glutathione Transferase as an Indicator of Tubular Damage in the Human Kidney. Nephron, v. 67, n. 3, p. 308–316, 1994.
TAN, J. et al. Glomerular function, structure, and number in renal allografts from older deceased donors. Journal of the American Society of Nephrology : JASN, v. 20, n. 1, p. 181–8, 2009.
UCHINO, S. et al. Diuretics and mortality in acute renal failure. Critical Care Medicine, v. 32, n. 8, p. 1669–1677, 2004.
YANG, B. et al. Intravascular Administration of Mannitol for Acute Kidney Injury Prevention: A Systematic Review and Meta-Analysis. (B. Bussolati, Org.)PLoS ONE, v. 9, n. 1, p. e85029, 2014.
YOSHINO, J. et al. Leukemia inhibitory factor is involved in tubular regeneration after experimental acute renal failure. Journal of the American Society of Nephrology : JASN, v. 14, n. 12, p. 3090–101, 2003.
[1] Médico. Post graduado en Medicina de Cuidados Intensivos para Adultos.
Artículo: Octubre de 2020.
Aprobado: Noviembre, 2020.