ARTIGO DE REVISÃO
FRANCO, Guilherme Sousa Leal [1]
FRANCO, Guilherme Sousa Leal. Insuficiência renal aguda na unidade de terapia intensiva: Diagnóstico em pacientes graves. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 05, Ed. 11, Vol. 01, pp. 42-53. Novembro de 2020. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/pacientes-graves
RESUMO
A lesão renal aguda (LRA) é uma síndrome clínica comum em pacientes críticos e está associada a maior tempo de internação, maior utilização de recursos hospitalares, e maior morbimortalidade. O objetivo geral é apresentar as definições atuais de Lesão Renal Aguda, perfil do paciente com esse diagnóstico nas unidades de terapia intensiva e os métodos diagnósticos com ênfase nos novos métodos baseados na dosagem de biomarcadores. Para a elaboração do artigo de revisão foram consultadas as publicações científicas variadas nas bases de dados de ScienceDirect, UptoDate, Medline/PubMed, Lilacs e SciELO, por meio dos termos Acute Kidney Injury (AKI), fatores de risco, biomarcadores urinários, nefropatia, UTI, insuficiência renal e terapia intensiva. Os resultados demonstram que a Terapia Guiada por Objetivos no perioperatório associa-se a redução das complicações e do tempo de internação hospitalar. Deste modo, o TGO pode proporcionar efeitos benéficos, prevenindo as dificuldades da admissão nas Unidades de Terapia Intensiva
Palavras-chave: Acute Kidney Injury, biomarcadores, nefropatia, insuficiência renal, terapia intensiva.
1. INTRODUÇÃO
A lesão renal aguda (LRA) é uma síndrome clínica comum associada a internação prolongada e maior utilização de recursos hospitalares, e maior morbimortalidade (RONCO et al., 2013). É um distúrbio complexo que ocorre em uma variedade de ambientes com manifestações clínicas que vão desde uma elevação mínima da creatinina sérica até insuficiência renal anúrica (MEHTA et al., 2007)
Nos últimos anos, embora pesquisas significativas tenham sido dedicadas ao diagnóstico, prevenção e tratamento da LRA, a incidência e a mortalidade secundária à disfunção renal aguda permaneceram elevadas (BELLOMO et al., 2004). Essa condição clínica pode ocorrer em qualquer ambiente hospitalar com taxas de incidência que variam de 1% a 25% nos pacientes graves. Outros estudos relatam (CHERTOW et al., 1998; DE MENDONÇA et al., 2000) prevalência de até 5% a 7% de todos os pacientes internados e dois terços dos pacientes gravemente doentes (NIGWEKAR; WAIKAR, 2011), dependendo da população em estudo e os critérios utilizados para definir a sua presença.
Também na última década, o antigo termo “insuficiência renal aguda” foi substituído por critérios padronizados de Lesão Renal Aguda, incorporando pequenas alterações na creatinina e produção de urina, como a Rede de Lesão Renal Aguda (AKIN) (SAWHNEY; FRASER, 2017). A lesão renal aguda (LRA) ocorre em até 50% dos pacientes da unidade de terapia intensiva pós-cirúrgica, com mortalidades relatadas de 15% a 80%, com mais de 50% dos casos sendo secundárias à sepse (COCA et al 2009; MAXWELL; BELL, 2017).
O objetivo geral do artigo é realizar uma revisão sistemática de literatura abordando as definições atuais da Lesão Renal Aguda, o perfil do paciente com esse diagnóstico nas unidades de terapia intensiva, e métodos diagnósticos com ênfase nos novos modelos baseados na dosagem de biomarcadores.
2. MATERIAL E MÉTODOS
Este trabalho constitui-se de uma revisão da literatura, realizada entre fevereiro e outubro de 2018, baseando-se na análise de publicações científicas, presentes na internet, sobre os dados da ScienceDirect, UptoDate, Medline/PubMed, Lilacs, SciELO, sobretudo com os termos Acute Kidney Injury (AKI), Fatores de risco, Biomarcadores, Nefropatia, UTI, insuficiência renal aguda e Terapia intensiva.
De acordo com os critérios, foram incluídos neste trabalho artigos científicos que descrevem o perfil do paciente grave com insuficiência renal aguda no contexto das unidades de terapia intensiva. Diversas modalidades de estudos entre os anos de 1980 e 2018 foram revistas, incluindo grandes estudos prospectivos randomizados e multicêntricos, meta-análises, estudos observacionais retrospectivos e revisões literárias.
3. REVISÃO
3.1 INSUFICIÊNCIA RENAL AGUDA: DEFINIÇÃO.
A Insuficiência renal aguda (IRA), atualmente chamada de Lesão Renal Aguda (LRA) se diferencia da IRC, principalmente, por ser uma síndrome clínica caracterizada pelo declínio da função renal que ocorre em um curto período de tempo (tabela 1). É uma complicação relativamente comum em pacientes criticamente enfermos e é associada com a alta morbidade e mortalidade (NOGUEIRA; OLIVEIRA, 2007).
TABELA 01: Principais diferenças entre insuficiência renal aguda e insuficiência renal crônica
| Disfunção/ Parâmetro | IRA | IRC |
| História | Dias/semanas | Meses/Anos |
| Hemoglobina | Normal | Reduzida |
| “Massa” Renal | Normal | Reduzida |
| Osteodistrofia | Ausente | Presente |
| Neuropatia Periférica | Ausente | Presente |
| Creatinina Sérica | Reversivelmente Aumentada | Irreversivelmente Aumentada |
Fonte: NOGUEIRA, OLIVEIRA (2007)
Até recentemente, não havia concordância na definição de lesão renal aguda ou um consenso claro quanto ao como prevenir ou manejar esta enfermidade. Muitos modelos não conseguiram definir com precisão a escolha de parâmetros fisiológicos e clínicos apropriados para ensaios de novos tratamentos. O tempo, intensidade e modalidade de terapia de substituição renal, o possível uso de tratamento de purificação do sangue extracorpórea para doenças extra renais e a interação entre disfunção renal e anormalidades em outros órgãos são fatores que deveriam constar entre as iniciativas de padronização do manejo desta síndrome (RONCO et al., 2013).
3.2 INSUFICIÊNCIA RENAL AGUDA: DIAGNÓSTICO E ESTADIAMENTO
É difícil assegurar um diagnóstico precoce de vasoconstrição renal aguda antes mesmo que ocorram disfunções tubulares. No passado, o diagnóstico baseava-se na resposta dos níveis de uréia plasmática do paciente com suspeita de IRA – se os níveis diminuíssem com a hidratação endovenosa seria um indício de vasoconstrição reversível (MILLER et al., 1978).
O problema desta abordagem é que muitos pacientes entravam em um quadro de congestão pulmonar, hipóxia e uso de ventilação mecânica precoce (SCHRIER et al., 2004). A partir deste ponto, o foco de maior atenção na investigação diagnóstica passou a ser a análise minuciosa dos sedimentos urinários (DE MENDONÇA et al., 2000).
Independente das pesquisas, uma história detalhada e precisa é crucial para diagnosticar a lesão renal aguda (IRA) e determinar o tratamento. Distinguir a Lesão Renal Aguda da doença renal crônica é importante, mas fazer a distinção pode ser difícil. Em casos de IRA de origem não esclarecida ou na presença de cilindros hemáticos está indicada a biópsia renal (MADAIO et al., 1990) – exceto na vigência de algumas situações, dentre elas a mais comum é a infecção urinária ativa (MOTA, 2005).
A biópsia não substitui o bom exame clínico e anamnese, mas oferece uma possibilidade de investigação e descrição histopatológica com detalhamento da microestrutura renal. Outra consideração está na diferenciação entre LRA e DRC (YANG et al., 2014)
Na Figura 01 observam-se características sugestivas de necrose tubular aguda que são o desnudamento difuso das células tubulares renais com perda da borda em escova (setas azuis); achatamento das células tubulares renais devido à dilatação tubular (setas laranjas); formação de aglomerado intratubular (setas amarelas); e descamação das células, que é responsável pela formação de moldes granulares (seta vermelha). Finalmente, obstrução intratubular devido ao epitélio desnudo e detritos celulares é evidente (seta verde). Observe que as células epiteliais tubulares descamadas se aglutinam devido ao rearranjo das moléculas de adesão intercelular (TAN et al., 2009).
FIGURA 01: Fotomicrografia de uma amostra de biópsia renal mostra a região medular renal, que é composta principalmente de túbulos renais.
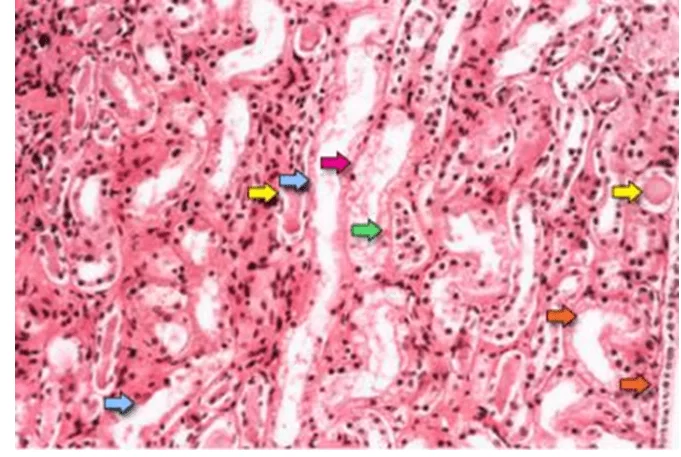
Na tentativa de padronizar a definição e a classificação da LRA, alguns critérios foram criados, tais como Risk, Injury, Failure, Loss, End-Stage (RIFLE) e Acute Kidney Injury Network (AKIN). Nos dias de hoje, tais critérios são bastante utilizados para classificar a LRA em função da creatinina sérica e da diurese.
O estudo de coorte prospectivo utilizando prontuários de 190 pacientes internados em Unidade de Terapia Intensiva constatou que tanto o escore RIFLE quanto o AKIN e o KDIGO, de maneira semelhante, são bons preditores de mortalidade em pacientes que estejam sob estado grave. (LEVI et al., 2013).
GRÁFICO 01: Curva ROC e capacidade discriminatória para óbito em pacientes graves segundo os critérios RIFLE, AKIN e KDIGO
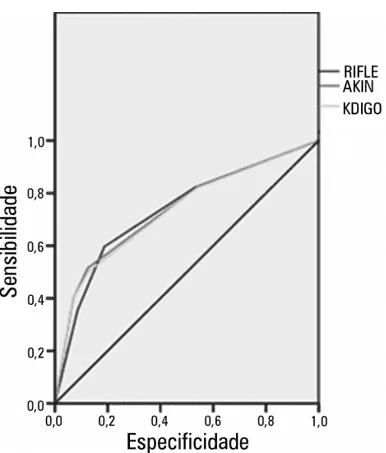
Conforme representado no Gráfico 01, os autores constataram que a área sobre a curva ROC (AUROC) calculada foi 0,735 para o critério RIFLE, 0,74 para o AKIN e de 0,733 para O KDIGO, mostrando o valor p<0,0001para a discriminação de óbito dos três critérios (LEVI et al., 2010).
3.3 NOVOS MARCADORES NO DIAGNÓSTICO DA LESÃO RENAL AGUDA
A creatinina sérica, que é o exame laboratorial mais utilizado para o diagnóstico de LRA é um marcador imperfeito, uma vez que seus níveis refletem consequências funcionais tardias da lesão, em vez de lesão direta da célula, e não são sensíveis e específicas no diagnóstico precoce da IRA (NADKARNI et al., 2017).
O desenvolvimento de novos biomarcadores para diagnóstico precoce, estratificação de risco e prognóstico de lesão renal aguda (LRA) é uma das principais prioridades na pesquisa renal mundial (PARIKH et al., 2014). Algumas das mais promissoras substâncias incluem lipocalina associada à gelatinase de neutrófilos plasmáticos (NGAL) (MISHRA et al., 2005), molécula de lesão renal-1 (KIM-1), (HAN et al., 2002; ICHIMURA et al., 1998), IL-18 (MELNIKOV et al., 2001; PARIKH et al., 2004), cistatina C (HERGET-ROSENTHAL et al., 2004), proteína de ligação ao ácido graxo hepático (L-FABP) (KANG et al., 2002; YOSHINO et al., 2003), IL-6 (D’AMICO; BAZZI, 2003), α / π glutationa S-transferase (GST) (HARRISON et al., 1989; SUNDBERG et al., 1994), e N-acetil-β-d-glicosaminidase (NAG).
Vários estudos mostraram a eficácia de biomarcadores urinários, a interleucina-18 (IL-18); lipocalina correlacionada com gelatinase de neutrófilos no plasma (NGAL); molécula de lesão renal-1 (KIM-1) e proteína de ligação a ácidos graxos do tipo fígado (L-FABP) para detectar LRA antes da mudança na creatinina sérica (HO et al., 2015; LIN et al., 2015; NADKARNI et al., 2017). Algumas das mais promissoras incluem lipocalina associada à gelatinase de neutrófilos plasmáticos (NGAL), molécula de lesão renal-1 (KIM-1), IL-18,23,24 cistatina C, proteína de ligação ao ácido graxo hepático (L-FABP), IL-6,28 α / π glutationa S-transferase (GST), e N-acetil-β-d-glicosaminidase (NAG).
Em geral, o desempenho diagnóstico aparente de um biomarcador depende não apenas de sua capacidade de detectar lesões, mas também da prevalência da doença e da sensibilidade e especificidade do padrão-ouro imperfeito (LASSNIGG et al., 2004).
Alguns resultados destacam a importância de testes prospectivos e sistemáticos das condições de armazenamento das amostras nos níveis de biomarcadores antes da adoção desses testes na prática clínica ou na pesquisa (PARIKH et al., 2014), uma vez que as condições de armazenamento da urina podem interferir na leitura dos resultados obtidos.
Nadkarni et al., (2017) concluiu que vários fatores disponíveis através do teste com fita reagente na urina estão associados a concentrações aumentadas de biomarcadores urinários que são independentes da lesão renal clínica. Novos estudos parecem ser necessários para avaliar a interferência de elementos de urina comuns nos níveis de biomarcadores de interesse em explorar o impacto da contabilização desses elementos em seu desempenho prognóstico / diagnóstico.
Ho et al., (2015), concluiu através de meta-análise de 28 estudos que relataram a medição intraoperatória e / ou pós-operatória precoce de biomarcadores na urina (n = 23 estudos) ou plasma ou soro (n = 12 estudos). Concluiu-se que em adultos, os biomarcadores conhecidos de urina, plasma e soro de LRA possuem discriminação modesta na melhor das hipóteses quando medidos dentro de 24 horas após cirurgias cardíacas, os mesmos estudos ressaltam que estes biomarcadores ainda estão disponíveis apenas para pesquisa não sendo disponibilizados na prática clínica dos grandes centros.
3.4 IDENTIFICANDO A CAUSA DA IRA
Em nosso estudo não foram identificados testes que compararam a acurácia do teste de urina com outros métodos diagnósticos como biópsia e exames de imagem. Mas, conforme Bell e Maxwell (2017), em uma meta-análise realizada pelo National Clinical Guideline Centre em 2013, na qual foram reunidas 126 publicações sobre prevenção, diagnósticos e manejo da lesão renal aguda no paciente grave, foi fortemente recomendado que o teste de urina fosse realizado com pesquisa de amostras de sangue, proteína, leucócitos, nitritos e glicose em todos os pacientes, assim que houver suspeita ou detecção de lesão renal aguda. Presume-se que o achado de hematúria e proteinúria no teste com fita reagente de urina em um paciente com IRA indique provável doença glomerular aguda ou glomerulonefrite (UCHINO et al., 2004).
Em estudo epidemiológico prospectivo, multicêntrico e multinacional feito por Uchino et al., (2004), Sepse grave / choque séptico (43,8%), cirurgia de grande porte (39,1), baixo débito cardíaco (29,7) e hipovolemia (28,2%) foram as condições mais comuns associadas ao desenvolvimento de insuficiência renal aguda em pacientes graves.
Tais fármacos têm sido mostrados, ao menos em modelos animais de LRA, redução do consumo de oxigênio e as demandas metabólicas de células tubulares renais lesadas, limitando assim o dano isquêmico dos segmentos tubulares medulares externos (HEYMAN et al., 1994).
3.5. ABORDAGENS TERAPÊUTICAS NO MANEJO DA IRA
Em um cenário de tratamento agudo, os diuréticos são frequentemente prescritos para manter ou aumentar a produção de urina em pacientes com Lesão Renal Aguda (LRA). A razão por trás de dar diuréticos é que eles podem proteger o rim de lesão isquêmica, mantendo um estado não oligúrico (KARAJALA et al., 2009).
Um número de diuréticos com propriedades farmacológicas variáveis diuréticos (furosemida, bumetanida, torsemida), tiazida diuréticos (metolazona, hidroclorotiazida, frequentemente administrado em combinação com diuréticos de alça e osmótico diuréticos como o manitol) foram estudados e estão administrado no cenário de AKI (KARAJALA et al., 2009). Os diuréticos de alça são os diuréticos mais potentes e continuam sendo os mais indicados para manejar pacientes com LRA (NIGWEKAR; WAIKAR, 2011). O manejo da LRA visa e evitar danos persistentes como drogas nefrotóxicas e hipotensão, o que diminuiria a TFG e o oxigenação local.
4. CONSIDERAÇÕES FINAIS
Em suma, sabe-se que a LRA é uma síndrome desencadeada por uma vasta gama de comorbidades e situações de risco. O paciente grave internado em unidade de terapia intensiva ainda parece ser o mais beneficiado com a possibilidade de diagnóstico precoce e correto manejo da Lesão Renal Aguda.
Apesar dos avanços na pesquisa clínica e laboratorial ainda se percebe que o seu diagnóstico está atrelado às dosagens de creatinina, uréia bem como o registro da diurese do paciente. Estas medidas parecem ser eficazes partindo-se do pressuposto de que elas auxiliam no aumento da sobrevida do paciente grave.
Mais estudos clínicos precisam ser realizados, assim como estudos de meta-análise são de suma importância para a identificação e organização do grande número de pesquisas laboratoriais envolvendo a coleta e a dosagem de biomarcadores urinários e plasmáticos alterados na vigência da insuficiência renal aguda. Novos protocolos sobre como conservar as amostras de urina para a realização destes exames precisam ser elaborados. Ressalta-se que o Risk, Injury, Failure, Loss, End-Stage (RIFLE) e Acute Kidney Injury Network (AKIN), apesar de extensamente utilizados com bom grau de acurácia não se mostram eficazes no diagnóstico precoce dos processos de lesão glomerular.
Em regra, a aplicação dos fluidos deve ser realizada como qualquer outro tipo de medicamento, considerando suas indicações e limitações individuais. Neste contexto, entende-se a reposição volêmica perioperatória com soluções iso-oncóticas como um aspecto vantajoso, conquanto se é necessário ensaios clínicos randomizados controlados adicionais, a fim de contatar sua relevância para o desfecho. Deste modo, em síntese, o desenvolvimento de uma estratégia racional de administração de fluidos poderia auxiliar o tratamento de pacientes submetidos à cirurgia de baixo risco que apresentam uma perda insignificante de volume intravascular com infusão de cristaloides, através da combinação entre a administração cristaloide e o colóide, cuidadosamente titulada com base em medidas hemodinâmicas.
Por fim, a conclusão é de que a Terapia Guiada por Objetivos no Perioperatório está associada a reduções nas complicações e na duração da internação hospitalar. Sendo assim, é possível se alcançar os efeitos benéficos da TGO, no qual previne a admissão na Unidades de Terapia Intensiva.
5. REFERÊNCIAS
BELLOMO, R. et al. Open Access Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care, v. 4 n, 8, p. 204–212, 2004.
CHERTOW, G. et al. Independent association between acute renal failure and mortality following cardiac surgery. American Journal of Medicine, v. 104, n. 4, p. 343–348, 1998.
COCA, S. et al. Long-term Risk of Mortality and Other Adverse Outcomes After Acute Kidney Injury: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases, v. 53, n. 6, p. 961–973, 2009.
D’AMICO, G.; BAZZI, C. Urinary protein and enzyme excretion as markers of tubular damage. Current opinion in nephrology and hypertension, v. 12, n. 6, p. 639–43, 2003.
DE MENDONÇA, A. et al. Acute renal failure in the ICU: risk factors and outcome evaluated by the SOFA score. Intensive Care Medicine, v. 26, n. 7, p. 915–921, 2000.
HAN, W. et al. Kidney Injury Molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International, v. 62, n. 1, p. 237–244, 2002.
HARRISON, D. et al. Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury. Journal of clinical pathology, v. 42, n. 6, p. 624–8, 1989.
HERGET-ROSENTHAL, S. et al. Early detection of acute renal failure by serum cystatin C. Kidney International, v. 66, n. 3, p. 1115–1122, 2004.
HEYMAN, S. N. et al. Loop diuretics reduce hypoxic damage to proximal tubules of the isolated perfused rat kidney. Kidney International, v. 45, n. 4, p. 981–985, 1994.
HO, J. et al. Urinary, Plasma, and Serum Biomarkers’ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. American Journal of Kidney Diseases, v. 66, n. 6, p. 993–1005, 2015.
ICHIMURA, T. et al. Kidney injury molecule-1 (KIM-1), a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain, is up-regulated in renal cells after injury. The Journal of biological chemistry, v. 273, n. 7, p. 4135–42, 1998.
KANG, D.-H. et al. Role of the microvascular endothelium in progressive renal disease. Journal of the American Society of Nephrology: JASN, v. 13, n. 3, p. 806–16, 2002.
KARAJALA, V. et al. Diuretics in acute kidney injury. Minerva anestesiologica, v. 75, n. 5, p. 251–7, 2009.
LASSNIGG, A. et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study. Journal of the American Society of Nephrology: JASN, v. 15, n. 6, p. 1597–605, 2004.
LEVI, T. M. et al. Comparação dos critérios RIFLE, AKIN e KDIGO quanto à capacidade de predição de mortalidade em pacientes graves. Revista Brasileira de Terapia Intensiva, v. 25, n. 4, p. 290–296, 2013.
LIN, X. et al. Urine interleukin-18 in prediction of acute kidney injury: a systematic review and meta-analysis. Journal of Nephrology, v. 28, n. 1, p. 7–16, 2015.
MADAIO, M. P. et al. Renal Biopsy. Nephrology Forum. Kidney International, v. 38, p. 529-543, 1990.
MAXWELL, R.; BELL, C. M. Acute Kidney Injury in the Critically Ill. The Surgical clinics of North America, v. 97, n. 6, p. 1399–1418, 2017.
MEHTA, R. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Critical Care, v. 11, n. 2, p. R31, 2007.
MELNIKOV, V. et al. Impaired IL-18 processing protects caspase-1-deficient mice from ischemic acute renal failure. The Journal of clinical investigation, v. 107, n. 9, p. 1145–52, 2001.
MILLER, T. et al. Urinary diagnostic indices in acute renal failure: a prospective study. Annals of internal medicine, v. 89, n. 1, p. 47–50, 1978.
MISHRA, J. et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet, London, England, v. 365, n. 9466, p. 1231–8, 2005.
MOTA, P. C. Indications for renal biopsy. Acta Médica Portuguesa, v. 18, n. 2, p. 147–51, 2005.
NADKARNI, G. et al. Urinalysis findings and urinary kidney injury biomarker concentrations. BMC Nephrology, v. 18, n. 1, p. 218, 2017.
NIGWEKAR, S.; WAIKAR, S. Diuretics in Acute Kidney Injury. Seminars in Nephrology, v. 31, n. 6, p. 523–534, 2011.
NOGUEIRA, C. S.; OLIVEIRA, C. R. Degrandi. Disfunção renal: definição e diagnóstico. Medicina perioperatória, Rio de Janeiro, cap. 64, p. 571-577, 2007.
PARIKH, C. et al. Urinary interleukin-18 is a marker of human acute tubular necrosis. American journal of kidney diseases : the official journal of the National Kidney Foundation, v. 43, n. 3, p. 405–14, 2004.
PARIKH, C. et al. Urine Stability Studies for Novel Biomarkers of Acute Kidney Injury. American Journal of Kidney Diseases, v. 63, n. 4, p. 567–572, 2014.
RONCO, C. et al. Acute Dialysis Quality Initiative (ADQI). Contributions to nephrology. v. 182, p.1–4, 2013.
SAWHNEY, S.; FRASER, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in chronic kidney disease, v. 24, n. 4, p. 194–204, 2017.
SCHRIER, R. et al. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of clinical investigation, v. 114, n. 1, p. 5–14, 2004.
SUNDBERG, A. et al. Urinary π-Class Glutathione Transferase as an Indicator of Tubular Damage in the Human Kidney. Nephron, v. 67, n. 3, p. 308–316, 1994.
TAN, J. et al. Glomerular function, structure, and number in renal allografts from older deceased donors. Journal of the American Society of Nephrology : JASN, v. 20, n. 1, p. 181–8, 2009.
UCHINO, S. et al. Diuretics and mortality in acute renal failure. Critical Care Medicine, v. 32, n. 8, p. 1669–1677, 2004.
YANG, B. et al. Intravascular Administration of Mannitol for Acute Kidney Injury Prevention: A Systematic Review and Meta-Analysis. (B. Bussolati, Org.)PLoS ONE, v. 9, n. 1, p. e85029, 2014.
YOSHINO, J. et al. Leukemia inhibitory factor is involved in tubular regeneration after experimental acute renal failure. Journal of the American Society of Nephrology : JASN, v. 14, n. 12, p. 3090–101, 2003.
[1] Médico. Pós graduado em Medicina Intensiva para Adultos.
Enviado: Outubro, 2020.
Aprovado: Novembro, 2020.

