ARTICLE DE RÉVISION
FRANCO, Guilherme Sousa Leal [1]
FRANCO, Guilherme Sousa Leal. Insuffisance rénale aiguë dans l’unité de soins intensifs : Diagnostic dans les patients grièvement blessés. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 11, vol. 01, pp. 42-53. novembre 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/sante/patients-grievement-blesses
RÉSUMÉ
Les lésions rénales aiguës (LRA) sont un syndrome clinique courant chez les patients gravement malades et sont associées à un séjour plus long à l’hôpital, à une utilisation accrue des ressources hospitalière et à une morbidité et une mortalité plus élevées. L’objectif général est de présenter les définitions actuelles des lésions rénales aiguës, le profil du patient présentant ce diagnostic dans les unités de soins intensifs et les méthodes diagnostiques en mettant l’accent sur les nouvelles méthodes basées sur la posologie des biomarqueurs. Pour la préparation de l’article de la revue, les diverses publications scientifiques ont été consultées dans les bases de données de ScienceDirect, UptoDate, Medline/PubMed, Lilacs et SciELO, en utilisant les termes Acute Kidney Injury (AKI), facteurs de risque, biomarqueurs urinaires, néphropathie, UTI (Unité de soins intensifs), insuffisance rénale et thérapie intensive. Les résultats montrent que la thérapie objective-guidée dans la période périopératoire est associée à la réduction des complications et du temps d’hospitalisation. Ainsi, le TGO (transaminase glutamique oxalacétique) peut fournir des effets bénéfiques, empêchant les difficultés d’admission dans les unités de soins intensifs
Mots-clés: Acute Kidney Injury, biomarqueurs, néphropathie, insuffisance rénale, soins intensifs.
1. INTRODUCTION
Les lésions rénales aiguës (LRA) sont un syndrome clinique courant associé à une hospitalisation prolongée et à une utilisation accrue des ressources hospitalières, ainsi qu’à une morbidité et une mortalité plus élevées (RONCO et al., 2013). C’est un désordre complexe qui se produit dans une série d’environnements avec des manifestations cliniques s’étendant d’une élévation minimale de créatinine de sérum à l’échec rénal anurique (MEHTA et al., 2007)
Au cours des dernières années, bien que des recherches importantes aient été consacrées au diagnostic, à la prévention et au traitement de l’AKI, l’incidence et la mortalité secondaires au dysfonctionnement rénal aigu sont demeurées élevées (BELLOMO et al., 2004). Cette condition clinique peut se produire dans n’importe quel environnement hospitalier avec des taux d’incidence allant de 1% à 25% dans les patients grièvement blessés. D’autres études font état (CHERTOW et al., 1998; Par MENDONÇA et al., 2000) prévalence de jusqu’à 5 % à 7 % de tous les patients hospitalisés et des deux tiers des patients gravement malades (NIGWEKAR; WAIKAR, 2011), selon la population étudiée et les critères utilisés pour définir sa présence.
Toujours au cours de la dernière décennie, l’ancien terme « insuffisance rénale aiguë » a été remplacé par des critères normalisés de lésion rénale aiguë, incorporant de petits changements dans la production de créatinine et d’urine, comme le Réseau des lésions rénales aiguës (AKIN) (SAWHNEY; FRASER, 2017). Les lésions rénales aiguës (AKI) se produisent dans jusqu’à 50% de patients dans l’unité post-chirurgicale de soins intensifs, avec des taux de mortalité rapportés de 15% à 80%, avec plus de 50% de cas étant secondaires au sepsis (COCA et autres 2009 ; MAXWELL; BELL, 2017).
L’objectif général de l’article est de mener une revue systématique de la littérature traitant des définitions actuelles des lésions rénales aiguës, du profil du patient présentant ce diagnostic dans les unités de soins intensifs, et des méthodes diagnostiques mettant l’accent sur les nouveaux modèles basés sur la posologie des biomarqueurs.
2. MATÉRIEL ET MÉTHODES
Cette étude se compose d’une revue de littérature, menée entre février et octobre 2018, basée sur l’analyse de publications scientifiques, présentes sur Internet, sur les données de ScienceDirect, UptoDate, Medline/PubMed, Lilacs, SciELO, notamment avec les termes Acute Kidney Injury (AKI), Facteurs de risque, Biomarqueurs, Néphropathie, UTI, insuffisance rénale aiguë et soins intensifs.
Selon les critères, des articles scientifiques décrivant le profil des patients graves présentant l’échec rénal aigu dans le contexte des unités de soins intensifs ont été inclus dans cette étude. Plusieurs modalités d’études entre 1980 et 2018 ont été revues, notamment de grandes études prospectives randomisées et multicentriques, des méta-analyses, des études observationnelles rétrospectives et des revues littéraires.
3. Examen
3.1 INSUFFISANCE RÉNALE AIGUË : DÉFINITION.
L’insuffisance rénale aiguë (IRA), actuellement appelée lésion rénale aiguë (LRA), diffère de l’AKI, principalement parce qu’il s’agit d’un syndrome clinique caractérisé par le déclin de la fonction rénale qui se produit dans un court laps de temps (tableau 1). C’est une complication relativement commune dans les patients gravement malades et est associée à la morbidité et à la mortalité élevées (NOGUEIRA ; OLIVEIRA, 2007).
TABLEAU 01 : Principales différences entre l’insuffisance rénale aiguë et l’insuffisance rénale chronique
| Dysfonctionnement/ Paramètre | IRA | IRC |
| Histoire | Jours/semaines | Mois/années |
| Hémoglobine | Normal | Réduit |
| « Messe » rénale | Normal | Réduit |
| Arthrose | Sortie | Présent |
| Neuropathie périphérique | Sortie | Présent |
| Sérum Créatinine | Augmentation inversée | Augmentation irréversible |
Source: NOGUEIRA, OLIVEIRA (2007)
Jusqu’à récemment, il n’y avait pas d’accord dans la définition des lésions rénales aiguës ou un consensus clair sur la façon de prévenir ou de gérer cette maladie. De nombreux modèles n’ont pas été en mesure de définir avec précision le choix de paramètres physiologiques et cliniques appropriés pour les essais de nouveaux traitements. Le temps, l’intensité et la modalité de la thérapie rénale de remplacement, l’utilisation possible du traitement extracorporel de purification du sang pour des maladies rénales supplémentaires et l’interaction entre le dysfonctionnement rénal et les anomalies dans d’autres organes sont des facteurs qui devraient être inclus parmi les initiatives visant à normaliser la gestion de ce syndrome (RONCO et autres, 2013).
3.2 INSUFFISANCE RÉNALE AIGUË : DIAGNOSTIC ET STADIFICATION
Il est difficile d’assurer un diagnostic tôt de vasoconstriction rénale aiguë même avant que des dysfonctionnements tubulaires se produisent. Dans le passé, le diagnostic était basé sur la réponse des niveaux d’urée de plasma du patient présentant l’AKI suspecté – si les niveaux ont diminué avec l’hydratation intraveineuse il serait une indication de vasoconstriction réversible (MILLER et al., 1978).
Le problème de cette approche est que beaucoup de patients sont entrés dans une image de congestion pulmonaire, d’hypoxie et de l’utilisation de la ventilation mécanique tôt (SCHRIER et al., 2004). À partir de ce moment, l’analyse détaillée des sédiments urinaires (DE MENDONÇA et al., 2000).
Indépendamment de la recherche, une histoire détaillée et précise est cruciale pour diagnostiquer les lésions rénales aiguës (IRA) et déterminer le traitement. Il est important de distinguer les lésions rénales aiguës des maladies rénales chroniques, mais il peut être difficile de faire la distinction. En cas d’IRA non clarifié ou en présence de cylindres hematiques biopsie rénale (MADAIO et al., 1990) – sauf en présence de certaines situations, dont la plus courante est l’infection urinaire active (MOTA, 2005).
La biopsie ne remplace pas un bon examen clinique et l’anamnésie, mais offre une possibilité d’investigation et de description histopathologiques avec des détails de la microstructure rénale. Une autre considération est la différenciation entre LRA et DRC (Maladie rénale chronique) (YANG et al., 2014)
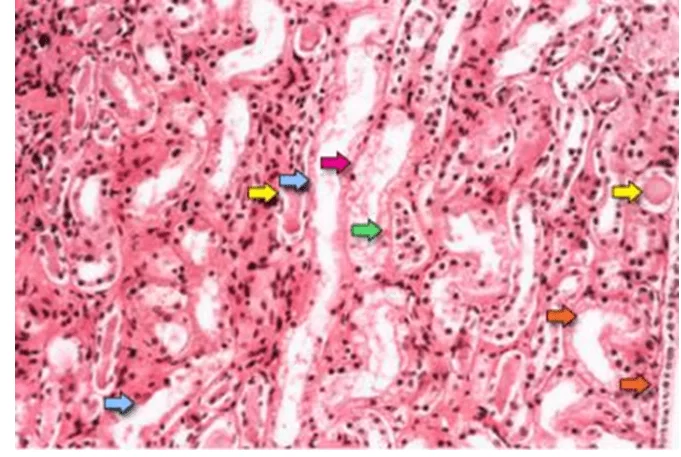
La figure 01 montre des caractéristiques suggestives de la nécrose tubulaire aiguë qui sont la dénudation diffuse des cellules tubulaires rénales avec perte de bord de brosse (flèches bleues); aplatissement des cellules tubulaires en raison de la dilatation tubulaire (flèches orange); formation d’amas intratubulaires (flèches jaunes); et le desoking des cellules, qui est responsable de la formation des moules granulaires (flèche rouge). Enfin, l’obstruction intratubulaire due à l’épithélium nu et aux débris cellulaires est évidente (flèche verte). Notez que les cellules épithéliales tubulaires delayered se s’unent en raison du réarrangement des molécules intercellulaires de réaction (TAN et al., 2009).
FIGURE 01 : Le photomicrographe d’un échantillon de biopsie rénale montre la région médullaire rénale, qui est composée principalement de tubules rénaux.
Dans le but de normaliser la définition et la classification de l’LRA, certains critères ont été créés, comme le Risk, Injury, Failure, Loss, End-Stage (RIFLE) et Acute Kidney Injury Network (AKIN) Aujourd’hui, ces critères sont largement utilisés pour classer l’AKI en fonction de la créatinine sérique et de la diurèse.
L’étude prospective de cohorte utilisant des dossiers médicaux de 190 patients admis à l’unité de soins intensifs a constaté que le score de RIFLE et l’AKIN et le KDIGO, d’une manière semblable, sont de bons prédicteurs de la mortalité dans les patients qui sont dans l’état grave. (LEVI et al., 2013).
GRAPHIQUE 01: Courbe ROC et capacité discriminatoire de décès chez les patients gravement malades selon les critères RIFLE, AKIN et KDIGO
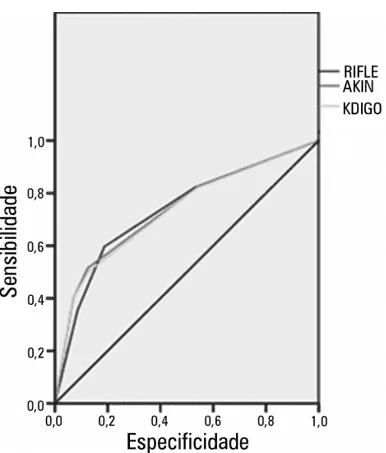
Source : LEVI et al.(2010)
Comme le montre le graphique 01, les auteurs ont constaté que la superficie sur la courbe ROC (AUROC) calculée était de 0,735 pour le critère RIFLE, de 0,74 pour l’AKIN et de 0,733 pour le KDIGO, ce qui montre la valeur p<0001 pour la discrimination de décès des trois critères (LEVI et al., 2010).
3.3 NOUVEAUX MARQUEURS DANS LE DIAGNOSTIC DES DOMMAGES RÉNAUX AIGUS
La créatinine de sérum, qui est le test de laboratoire le plus employé pour le diagnostic de l’LRA , est un marqueur imparfait, puisque ses niveaux reflètent les conséquences fonctionnelles tardives de la lésion plutôt que des dommages directs de cellules, et ne sont pas sensibles et spécifiques dans le diagnostic tôt d’IRA (NADKARNI et al., 2017).
Le développement de nouveaux biomarqueurs pour le diagnostic précoce, la stratification des risques et le pronostic des lésions rénales aiguës (LRA) est l’une des principales priorités de la recherche rénale mondiale (PARIKH et al., 2014). Certaines des substances les plus prometteuses comprennent la lipocaline associée à la gélatinase des neutrophiles plasmatiques (NGAL) (MISHRA et al., 2005), la molécule de lésion rénale-1 (KIM-1), (HAN et al., 2002; ICHIMURA et al., 1998), IL-18 (MELNIKOV et al., 2001; PARIKH et al., 2004), cystatine C (HERGET-ROSENTHAL et al., 2004), protéine hépatique de liaison aux acides gras (L-FABP) (KANG et al., 2002; YOSHINO et al., 2003), IL-6 (D’AMICO; BAZZI, 2003), α / π glutathion S-transférase (GST) (HARRISON et al., 1989; SUNDBERG et al., 1994 ) et la N-acétyl-β-d-glycosaminidase (NAG).
Plusieurs études ont montré l’efficacité des biomarqueurs urinaires, l’interleukine-18 (IL-18); lipocaline corrélée avec la gélatinase neutrophile plasmatique (NGAL); la molécule de lésion rénale-1 (KIM-1) et la protéine de liaison aux acides gras de type hépatique (L-FABP) pour détecter l’AKI avant le changement de la créatinine sérique (HO et al., 2015; LIN et al., 2015; NADKARNI et al., 2017). Parmi les plus prometteurs figurent la lipocaline associée à la gélatinase des neutrophiles plasmatiques (NGAL), la molécule de lésion rénale-1 (KIM-1), l’IL-18,23,24 cystatine C, la protéine de liaison des acides gras hépatiques (L-FABP) , IL-6,28 α / π glutathion S-transférase (GST) et N-acétyl-β-d-glycosaminidase (NAG).
En général, la performance diagnostique apparente d’un biomarqueur dépend non seulement de sa capacité à détecter les lésions, mais aussi de la prévalence de la maladie et de la sensibilité et la spécificité de l’étalon-or imparfait (LASSNIGG et al., 2004).
Certains résultats soulignent l’importance des tests prospectifs et systématiques des conditions d’entreposage des échantillons aux niveaux des biomarqueurs avant l’adoption de ces tests en pratique clinique ou en recherche (PARIKH et al., 2014), puisque les conditions de stockage de l’urine peuvent interférer avec la lecture des résultats obtenus.
Nadkarni et al., (2017) a conclu que plusieurs facteurs disponibles par l’essai de bande de reagent d’urine sont associés aux concentrations accrues des biomarqueurs urinaires qui sont indépendants des dommages cliniques de rein. D’autres études semblent nécessaires pour évaluer l’interférence des éléments communs d’urine dans les niveaux des biomarqueurs d’intérêt en explorant l’impact de la comptabilité de ces éléments sur leur exécution pronostique/diagnostique.
Ho et al., (2015), conclu par une méta-analyse de 28 études qui ont rapporté une mesure peropératoire et/ou postopératoire précoce des biomarqueurs dans l’urine (n = 23 études) ou le plasma ou le sérum (n = 12 études). Il a été conclu que chez les adultes, les biomarqueurs connus de l’urine, du plasma et du sérum LRA ont une discrimination modeste, au mieux, lorsqu’ils sont mesurés dans les 24 heures suivant les chirurgies cardiaques, les mêmes études soulignent que ces biomarqueurs ne sont toujours disponibles que pour la recherche qui n’est pas disponible dans la pratique clinique des grands centres.
3.4 IDENTIFIER LA CAUSE DE LA COLÈRE
Dans notre étude, aucun test n’a été identifié qui comparait l’exactitude du test d’urine à d’autres méthodes diagnostiques telles que la biopsie et l’imagerie. Toutefois, selon Bell et Maxwell (2017), dans une méta-analyse menée par le National Clinical Guideline Centre en 2013, dans laquelle 126 publications sur la prévention, le diagnostic et la prise en charge des lésions rénales aiguës chez les patients graves ont été recueillies, il a été fortement recommandé que le test d’urine soit effectué avec des recherches sur le sang, les protéines, les leucocytes, les nitrites et les échantillons de glucose chez tous les patients dès que des lésions rénales aiguës sont suspectées ou détectables. On suppose que la conclusion de l’hématurie et de la proteinuria dans le test de bande de réagent d’urine dans un patient présentant IRA indique la maladie glomerular aiguë probable ou la glomerulonephritis (UCHINO et autres, 2004).
Dans une étude épidémiologique prospective, multicentrique et multinationale menée par Uchino et al., (2004), septicémie sévère /choc septique (43,8 %), chirurgie majeure (39,1 %), faible débit cardiaque (29,7) et hypovolémie (28,2 %) étaient les conditions les plus communes liées au développement de l’échec rénal aigu dans les patients grièvement blessés.
De tels médicaments ont été montrés, au moins dans les modèles animaux de l’LRA, la réduction de la consommation d’oxygène et les exigences métaboliques des cellules tubulaires rénales blessées, limitant ainsi les dommages ischémiques des segments tubulaires médullaires externes (HEYMAN et al., 1994).
3.5. APPROCHES THÉRAPEUTIQUES DANS LA GESTION DE L’IRA
Dans un cadre de traitement aigu, les diurétiques sont souvent prescrits pour maintenir ou augmenter la production d’urine chez les patients souffrant de lésions rénales aiguës (LRA). La raison derrière donner des diurétiques est qu’ils peuvent protéger le rein contre les dommages ischémiques tout en maintenant un état non oligurique (KARAJALA et al., 2009).
Un certain nombre de diurétiques aux propriétés pharmacologiques variables diurétiques (furosémide, bumetanida, torse), diurétiques de thiazide (métalazone, hydrochlorothiazide, souvent administrés en combinaison avec des diurétiques en boucle et des diurétiques comme le mannitol) ont été étudiés et administrés en milieu AKI (KARAJALA et al., 2009). Les diurétiques de boucle sont les diurétiques les plus puissants et restent les plus indiqués pour gérer des patients d’LRA (NIGWEKAR ; WAIKAR, 2011). La gestion d’LRA vise à prévenir et à éviter les dommages persistants tels que les médicaments néphroxiques et l’hypotension, ce qui diminuerait le TFG (Taux de filtration glomérulaire) et l’oxygénation locale.
4. CONSIDÉRATIONS FINALES
En bref, on sait que l’LRA est un syndrome déclenché par un large éventail de comorbidités et de situations à risque. Le patient sévèrement hospitalisé dans une unité de soins intensifs semble toujours être le plus bénéficié de la possibilité d’un diagnostic précoce et d’une prise en charge correcte des lésions rénales aiguës.
En dépit des avances dans la recherche clinique et de laboratoire, il est toujours perçu que son diagnostic est lié à la créatinine, à l’urée et au dossier de diurèse du patient. Ces mesures semblent efficaces en partant du principe qu’elles aident à accroître la survie du patient sévère.
D’autres études cliniques doivent être menées, ainsi que des études de méta-analyse sont d’une importance primordiale pour l’identification et l’organisation du grand nombre d’études de laboratoire impliquant la collecte et la posologie de biomarqueurs urinaires et plasmatiques modifiés en présence d’insuffisance rénale aiguë. De nouveaux protocoles sur la façon de conserver les échantillons d’urine pour ces tests doivent être élaborés. Il est souligné que le Risk, Injury, Failure, Loss, End-Stage (RIFLE) et Acute Kidney Injury Network (AKIN), bien qu’largement utilisé avec un bon degré de précision ne sont pas efficaces dans le diagnostic précoce des processus de lésions glomériaires.
En règle générale, l’application de liquides doit être effectuée comme tout autre type de médicament, compte tenu de leurs indications et de leurs limites individuelles. Dans ce contexte, le remplacement du volume périopératoire par des solutions iso-onctiques est compris comme un aspect avantageux, même si d’autres essais contrôlés randomisés sont nécessaires afin de contacter sa pertinence pour le résultat. Ainsi, en résumé, le développement d’une stratégie rationnelle d’administration des fluides pourrait aider le traitement des patients subissant une chirurgie à faible risque qui ont une perte insignifiante de volume intravasculaire avec perfusion cristalloïde, grâce à la combinaison entre l’administration cristalloïde et colloïde, soigneusement titrée sur la base de mesures hémodynamiques.
Enfin, la conclusion est que la thérapie objective-guidée dans la période périopératoire est associée à des réductions des complications et de la durée de l’hospitalisation. Ainsi, il est possible d’obtenir les effets bénéfiques du TGO, dans lequel il empêche l’admission aux unités de soins intensifs.
5. RÉFÉRENCES
BELLOMO, R. et al. Open Access Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care, v. 4 n, 8, p. 204–212, 2004.
CHERTOW, G. et al. Independent association between acute renal failure and mortality following cardiac surgery. American Journal of Medicine, v. 104, n. 4, p. 343–348, 1998.
COCA, S. et al. Long-term Risk of Mortality and Other Adverse Outcomes After Acute Kidney Injury: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases, v. 53, n. 6, p. 961–973, 2009.
D’AMICO, G.; BAZZI, C. Urinary protein and enzyme excretion as markers of tubular damage. Current opinion in nephrology and hypertension, v. 12, n. 6, p. 639–43, 2003.
DE MENDONÇA, A. et al. Acute renal failure in the ICU: risk factors and outcome evaluated by the SOFA score. Intensive Care Medicine, v. 26, n. 7, p. 915–921, 2000.
HAN, W. et al. Kidney Injury Molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International, v. 62, n. 1, p. 237–244, 2002.
HARRISON, D. et al. Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury. Journal of clinical pathology, v. 42, n. 6, p. 624–8, 1989.
HERGET-ROSENTHAL, S. et al. Early detection of acute renal failure by serum cystatin C. Kidney International, v. 66, n. 3, p. 1115–1122, 2004.
HEYMAN, S. N. et al. Loop diuretics reduce hypoxic damage to proximal tubules of the isolated perfused rat kidney. Kidney International, v. 45, n. 4, p. 981–985, 1994.
HO, J. et al. Urinary, Plasma, and Serum Biomarkers’ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. American Journal of Kidney Diseases, v. 66, n. 6, p. 993–1005, 2015.
ICHIMURA, T. et al. Kidney injury molecule-1 (KIM-1), a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain, is up-regulated in renal cells after injury. The Journal of biological chemistry, v. 273, n. 7, p. 4135–42, 1998.
KANG, D.-H. et al. Role of the microvascular endothelium in progressive renal disease. Journal of the American Society of Nephrology: JASN, v. 13, n. 3, p. 806–16, 2002.
KARAJALA, V. et al. Diuretics in acute kidney injury. Minerva anestesiologica, v. 75, n. 5, p. 251–7, 2009.
LASSNIGG, A. et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study. Journal of the American Society of Nephrology: JASN, v. 15, n. 6, p. 1597–605, 2004.
LEVI, T. M. et al. Comparação dos critérios RIFLE, AKIN e KDIGO quanto à capacidade de predição de mortalidade em pacientes graves. Revista Brasileira de Terapia Intensiva, v. 25, n. 4, p. 290–296, 2013.
LIN, X. et al. Urine interleukin-18 in prediction of acute kidney injury: a systematic review and meta-analysis. Journal of Nephrology, v. 28, n. 1, p. 7–16, 2015.
MADAIO, M. P. et al. Renal Biopsy. Nephrology Forum. Kidney International, v. 38, p. 529-543, 1990.
MAXWELL, R.; BELL, C. M. Acute Kidney Injury in the Critically Ill. The Surgical clinics of North America, v. 97, n. 6, p. 1399–1418, 2017.
MEHTA, R. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Critical Care, v. 11, n. 2, p. R31, 2007.
MELNIKOV, V. et al. Impaired IL-18 processing protects caspase-1-deficient mice from ischemic acute renal failure. The Journal of clinical investigation, v. 107, n. 9, p. 1145–52, 2001.
MILLER, T. et al. Urinary diagnostic indices in acute renal failure: a prospective study. Annals of internal medicine, v. 89, n. 1, p. 47–50, 1978.
MISHRA, J. et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet, London, England, v. 365, n. 9466, p. 1231–8, 2005.
MOTA, P. C. Indications for renal biopsy. Acta Médica Portuguesa, v. 18, n. 2, p. 147–51, 2005.
NADKARNI, G. et al. Urinalysis findings and urinary kidney injury biomarker concentrations. BMC Nephrology, v. 18, n. 1, p. 218, 2017.
NIGWEKAR, S.; WAIKAR, S. Diuretics in Acute Kidney Injury. Seminars in Nephrology, v. 31, n. 6, p. 523–534, 2011.
NOGUEIRA, C. S.; OLIVEIRA, C. R. Degrandi. Disfunção renal: definição e diagnóstico. Medicina perioperatória, Rio de Janeiro, cap. 64, p. 571-577, 2007.
PARIKH, C. et al. Urinary interleukin-18 is a marker of human acute tubular necrosis. American journal of kidney diseases : the official journal of the National Kidney Foundation, v. 43, n. 3, p. 405–14, 2004.
PARIKH, C. et al. Urine Stability Studies for Novel Biomarkers of Acute Kidney Injury. American Journal of Kidney Diseases, v. 63, n. 4, p. 567–572, 2014.
RONCO, C. et al. Acute Dialysis Quality Initiative (ADQI). Contributions to nephrology. v. 182, p.1–4, 2013.
SAWHNEY, S.; FRASER, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in chronic kidney disease, v. 24, n. 4, p. 194–204, 2017.
SCHRIER, R. et al. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of clinical investigation, v. 114, n. 1, p. 5–14, 2004.
SUNDBERG, A. et al. Urinary π-Class Glutathione Transferase as an Indicator of Tubular Damage in the Human Kidney. Nephron, v. 67, n. 3, p. 308–316, 1994.
TAN, J. et al. Glomerular function, structure, and number in renal allografts from older deceased donors. Journal of the American Society of Nephrology : JASN, v. 20, n. 1, p. 181–8, 2009.
UCHINO, S. et al. Diuretics and mortality in acute renal failure. Critical Care Medicine, v. 32, n. 8, p. 1669–1677, 2004.
YANG, B. et al. Intravascular Administration of Mannitol for Acute Kidney Injury Prevention: A Systematic Review and Meta-Analysis. (B. Bussolati, Org.)PLoS ONE, v. 9, n. 1, p. e85029, 2014.
YOSHINO, J. et al. Leukemia inhibitory factor is involved in tubular regeneration after experimental acute renal failure. Journal of the American Society of Nephrology : JASN, v. 14, n. 12, p. 3090–101, 2003.
[1] Médecin. Diplômé en médecine des soins intensifs pour adultes.
Soumis : octobre 2020.
Approuvé : novembre 2020.


