ARTÍCULO ORIGINAL
BRITO, Maysa Vasconcelos de [1], FRANÇA, Ana Maria Braga da Silva [2], FECURY, Amanda Alves [3], OLIVEIRA, Euzébio de [4], DENDASCK, Carla Viana [5], DIAS, Cláudio Alberto Gellis de Mattos [6]
BRITO, Maysa Vasconcelos de. Et al. Perfil epidemiológico de la malaria grave en recién nacidos y adolescentes atendidos en 2016 en un hospital de referencia en el Estado de Amapá, Brasil. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 06, Vol. 12, págs. 05 y 23. Junio de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/la-malaria-grave, DOI: 10.32749/nucleodoconhecimento.com.br/salud/la-malaria-grave
RESUMEN
El actual estudio tuvo en cuenta no sólo las infecciones del falciparum del Plasmodium que se recomienda comúnmente como la causa principal de la malaria severa, pero las complicaciones relacionadas con el vivax del Plasmodium se han descrito cuidadosamente. El objetivo de este artículo fue identificar el perfil epidemiológico, clínico y de laboratorio de la malaria grave en pacientes tratados en el Hospital de Niños y Adolescentes de Macapá – Amapá. Se realizó un estudio epidemiológico, descriptivo de carácter retrospectivo. Los datos se obtuvieron a través de la consulta en las historias clínicas de los pacientes para el año 2016. La malaria severa fue considerada 47 casos. Predominó el sexo masculino con el 63,8% y la edad hasta los 5 años con el 59,6% de los casos. En cuanto a la especie, las infecciones por P. vivax se destacaron con mayor frecuencia con un 72% frente a P. falciparum con un 28% de los casos. Los meses con mayor número de hospitalizaciones fueron septiembre y noviembre, ambos con un 17%. Las principales manifestaciones clínicas encontradas fueron: fiebre, palidez y tos. Las condiciones que indican gravedad fueron las que más se presentaron: vómitos 87%, ictericia 23%, disnea y edad <1 año, ambas con 21%. Los exámenes hematológicos mostraron que el 91% de los pacientes presentaba glóbulos rojos por debajo de los valores de referencia y el 100% de los casos presentaba hemoglobina y hematocrito bajos; se evidenció trombocitopenia en el 72% de los casos. Los resultados alterados de las dosis bioquímicas clínicamente más importantes fueron: urea, transaminasas, glicimea y proteína C reactiva. La identificación de datos epidemiológicos, clínicos y de laboratorio sobre el paludismo grave contribuye al diagnóstico precoz y al tratamiento adecuado de la enfermedad.
Palabras llave: Malaria grave, Plasmodium vivax, epidemiología.
INTRODUCCIÓN
El paludismo es un importante problema de salud pública de gran interés mundial. Es una enfermedad infecciosa causada por protozoos del género Plasmodium transmitida por la picadura del mosquito hembra del género Anopheles infectado. Las principales especies asociadas con la malaria humana son Plasmodium falciparum, P. vivax, P.malarie e P. ovale. Recientemente, algunos casos de la malaria se han divulgado de infecciones de P. knowlesi e P. cynomolgi, especie conocida que causa malaria en simios (TA et al., 2014; RAMASSAMI, 2014). Los más comunes y probados encontrados en Brasil son: P.vivax, P. falciparum e P. malarie, desde el P. ovale es más común en regiones de África (BRASIL, 2009).
El desarrollo de vectores transmisores de la malaria es muy factible en la Amazônia legal. El estado de Amapá es un estado de la región norte, un componente de la Amazônia Legal y uno de los estados con un entorno más favorable para la procreación del vector y la transmisión de la malaria. En relación a Brasil, el Estado de Amapá se encuentra entre las zonas de riesgo medio y alto de contaminación (SANTOS; SANTOS, 2011).
La aparición de casos de malaria está relacionada con varios factores, incluyendo las actividades de extractivismo de los recursos naturales, capaces de potenciar la transmisión de la enfermedad. | En este sentido, Amapá se presenta como una región que tiene su economía y supervivencia en el uso de los recursos naturales (MACIEL; OLIVEIRA, 2014). Dado el ambiente favorable y las necesidades de la población para utilizar los recursos naturales, la infección por malaria es alta en Amapá, y los casos con mayor incidencia son los causados por P. vivax, (90% de los casos) (SANTOS; SANTOS, 2011).
La evidencia muestra que el espectro clínico de la malaria está influenciado por la intensidad de la transmisión, la especie de parásito y el estado inmunológico del paciente. Por lo tanto, la presentación clínica de la malaria parece diferir entre niños y adultos (WASSMER et al., 2015).
GOL
Identificar el perfil epidemiológico, clínico y de laboratorio de la malaria grave en recién nacidos y adolescentes atendidos en 2016 en un hospital de referencia en el estado de Amapá, Brasil.
MÉTODO
Se trata de un estudio epidemiológico descriptivo de carácter retrospectivo, desarrollado en el Hospital de Niños y Adolescentes (HCA) ubicado en la ciudad de Macapá en el Estado de Amapá, norte de Brasil. Los datos para esta investigación fueron obtenidos por consulta con la base de datos del Servicio de Archivo Médico (SAME) del HCA. Para registrar la información recolectada, se eliminaron de la base de datos los siguientes temas: variables demográficas (sexo, edad, origen…), variables clínicas: número de hospitalizaciones, tiempo de hospitalización, especies infectantes (P. vivax, P. falciparum, P. malarie), manifestaciones clínicas (fiebre, mialgia, escalofrío, oliguria, ictericia, hiperpirexia (superior a 41ºC), convulsiones, etc.) y resultados de pruebas de laboratorio (hemograma, hemoscopia (gota gruesa) y dosis bioquímicas (urea, creatinina, aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT), PCR (Proteína C Reactiva) y glucemia).
Se incluyeron niños y adolescentes de ambos sexos (29 días desde el nacimiento hasta los 15 años de edad) tratados del 1 de enero al 31 de diciembre de 2016, con confirmación de laboratorio de malaria (investigación de plasmodium con resultados positivos) y que presentaron manifestaciones clínicas y de laboratorio de malaria grave según lo descrito en la Guía Práctica de Malaria del año 2010. que tiene las condiciones indicativas de gravedad de la enfermedad y necesidad de hospitalización: pacientes inmunosuprimidos, pacientes con cualquiera de los signos de peligro de malaria grave: (hiperpirexia mayor de 41ºC, convulsiones, hiperparasitemia ( >200,000/mm3 ), vómitos repetidos, oliguria, dispineia, anemia intensa , ictericia, sangrado e hipoción arterial.
El proyecto de investigación fue presentado y aprobado por el Comité de Ética e Investigación del Colegio Estácio de Macapá, de acuerdo con los estándares éticos establecidos en la Resolución Nº 466 del Consejo Nacional de Salud del 12 de diciembre de 2012, que trata de la investigación con seres humanos (BRASIL, 2013).
RESULTADOS Y DISCUSIÓN
La Amazônia, región donde se encuentra el estado de Amapá, contribuye a la formación del vínculo epidemiológico de la transmisión de la malaria debido a sus aspectos geográficos, climáticos y socioculturales. Así, el conocimiento de la dinámica de la enfermedad, desde la perspectiva de la peculiaridad de cada región endémica y grupo de edad de desarrollo poblacional, es de gran importancia. (BRASIL, 2016).
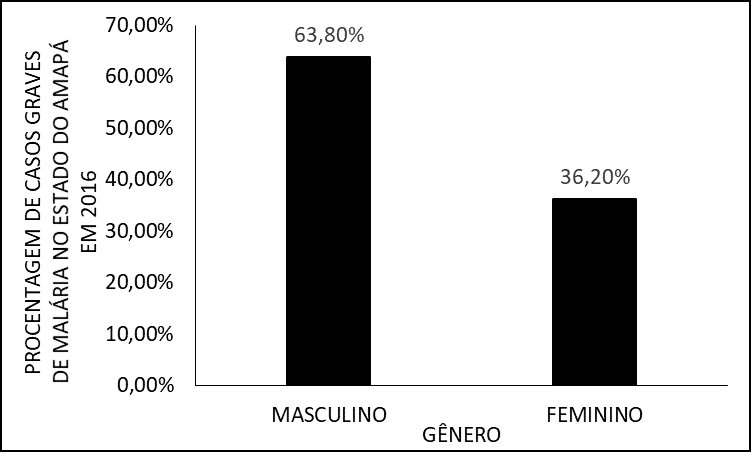
Inicialmente, los aspectos epidemiológicos de los pacientes en estudio se caracterizaron en cuanto a sexo, grupo de edad, origen y especies infectantes. Así, predominó el sexo masculino, que totalizaron 63,8% (n=30) de los casos, mientras que apenas 36,2% (n=17) pertenecían al sexo femenino (Figura 1).
Figura 1 – Porcentaje de casos de malaria grave en 2016 en el estado de Amapá, por sexo.
Según Monteiro, Ribeiro e Fernandes (2013), los individuos de ambos sexos están en riesgo de contraer malaria. Los hombres tienden a ser menos cuidadosos con la salud que las mujeres. El trabajo en zonas propensas a la presencia de vectores también suele ser ocupado por hombres (ALMEIDA et al., 2020).
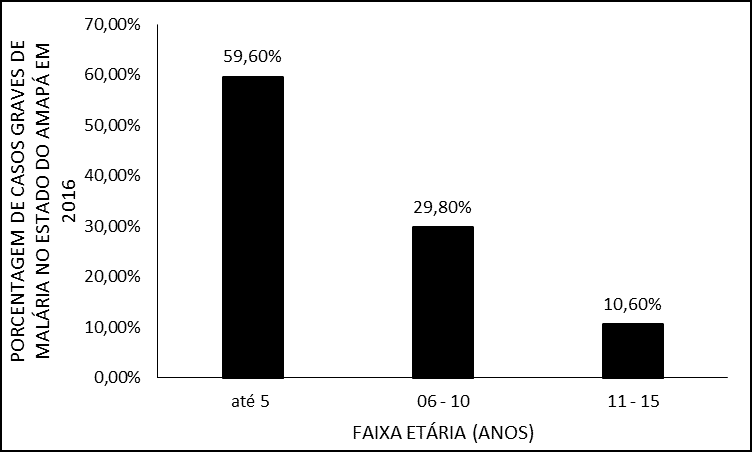
Más de la mitad 28 (59,6%) de los casos ocurrieron en pacientes que pertenecieron a los grupos de edad hasta 5 años; seguido de 6 a 10 años, con 29,8% (n=14) de los casos. Sólo el 10,6% (n=5) de los casos ocurrieron en pacientes de 11 a 15 años (Figura 2).
Figura 2 – Porcentaje de casos de malaria grave en 2016 en el estado de Amapá, por grupo de edad.
En cuanto al grupo de edad hasta los 5 años, en el que el número de casos fue mayor, puede estar relacionado con la susceptibilidad del niño a adquirir enfermedades, también porque forman parte del grupo de riesgo y el hecho de que en este estudio prevalece la primera infección el 94% de los casos, lo que es un factor que contribuye a la gravedad ya que el individuo no presenta ninguna inmunidad específica contra el plasmodium (VENTURA et al., 1999; GOMES et al., 2011; RIBEIRO, 2012).
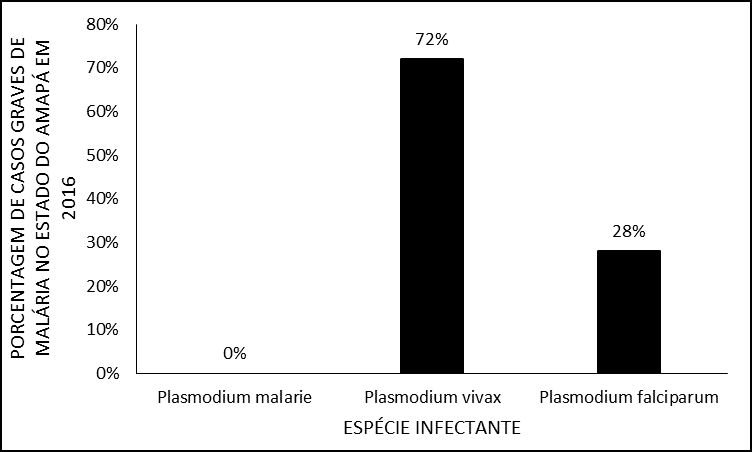
En cuanto a las especies infectantes, en este estudio no se registró en la historia clínica la presencia de P. malarie o malaria mixta, con una mayor frecuencia de infecciones por Plasmodium vivax con un 72% (n = 34) en comparación con P. falciparum que involucraron el 28% (n = 13) de los casos registrados (Figura 3).
Figura 3 – Porcentaje de casos de malaria grave en 2016 en el estado de Amapá, por grupo de edad.
Este hallazgo corrobora lo encontrado por Santos e Santos (2011), quienes en su estudio mostraron una mayor incidencia de infección por P. vivax en el estado de Amapá. Por otro lado, al analizar el aspecto de severidad, esta cantidad de infección por P. vivax no es tan común, ya que la mayoría de las encuestas muestran malaria severa relacionada con P. falciparum (KIRCHGATTER; PORTILLO, 2005; GOMES, 2011; MIOTO; GALHARDI; AMARANTE, 2012; PARISE, 2009).
El origen de estos pacientes según la tabla 1 muestra que entre los municipios de Amapá, Macapá se destacó con 29 casos, 79% (n=23) P. vivax y el 21% (6) P. falciparum. Ya que se puede atribuir al hecho de que la obra se realizó en la Capital.
Tabla 1 – Distribución de pacientes internados en el HCA con malaria severa según el municipio de residencia y especies infecciosas en 2016, Macapá-AP.
Un hecho similar se observó en un estudio, desarrollado en un hospital de referencia de Belém do Pará, en el que los demás municipios por sí solos tampoco fueron representativos (MONTEIRO; RIBEIRO; FERNANDES, 2013). Así, aunque todo el estado de Amapá es un área endémica, se supone que la población está siendo asistida, con diagnóstico y tratamiento adecuados en las unidades de menor complejidad en los municipios de residencia.
También en la tabla 1, la distribución de especies por municipio difiere de las otras presentadas, Ferreira Gomes con 75% (3/4) y Porto Grande 67% (2/3) de infección por P. Falciparum, es donde predominan levemente los casos de infección por esta especie, hallazgo que es común en varios estudios donde prevalecen casos de malaria grave causada por P. falciparum (KIRCHGATTER; PORTILLO, 2005; PARISE, 2009; GOMES, 2011; MIOTO; GALHARDI; AMARANTE, 2012).
El municipio de Amapa con el menor número de casos fue Oiapoque con sólo 1 causado por P. vivax. Los 3 casos restantes fueron atendidos en pacientes de otro estado, en este caso Pará de las ciudades de Breves y Afuá, 67% (n=2) P. vivax y 33% (1) P. falciparum.
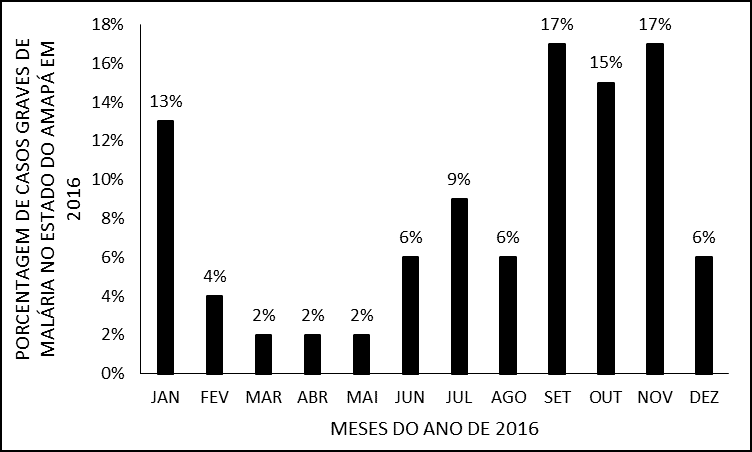
Los meses con mayor frecuencia de hospitalizaciones por malaria grave fueron septiembre y noviembre con 8 (17%) de hospitalizaciones cada uno. Mientras que los meses de marzo, abril y mayo fueron los que presentaron el menor número, sólo el 2% (1) de hospitalización, como se muestra en (figura 4). La estacionalidad de la malaria es variable en cada estado de la región amazónica, pero en general, hay un pico de casos en el período de transición entre las estaciones seca y húmeda (BRASIL, 2016).
Figura 4 – Porcentaje de casos de malaria grave en 2016 en el estado de Amapá, durante meses del año.
El principal vector de la malaria en Brasil, Anopheles darlingi, se reproduce en grandes cantidades en aguas de bajo flujo, profundas y sombreadas, y su reproducción disminuye en períodos lluviosos (MONTEIRO; RIBEIRO; FERNANDES, 2013). En el estado de Amapá, el mes de septiembre presenta un bajo índice de precipitaciones y noviembre el inicio de la temporada de lluvias, hecho que puede justificar el mayor número de hospitalizaciones por malaria severa en este estudio. Ciertamente, además del cambio climático, otros factores, como el socioambiental y principalmente, las variaciones en la calidad y cantidad de las acciones de control pueden estar relacionados con la mayor o menor incidencia de la enfermedad (BRASIL, 2016).
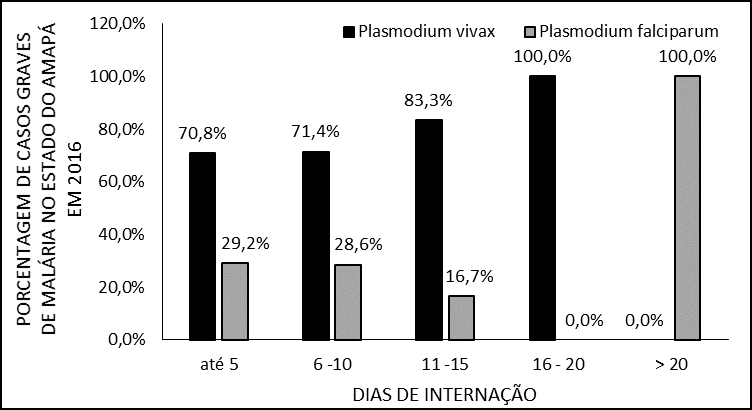
En cuanto a la duración de la estancia, varios factores pueden influir en la estancia de estos pacientes en el ámbito hospitalario, (figura 5) muestra que la mayoría de los pacientes permanecieron hospitalizados hasta 5 días. Los dos pacientes infectados por P. vivax que permanecieron entre 16 y 20 días presentaban deshidratación, anemia y trombocitopenia, uno de los cuales tenía más, leucopenia, ictericia, coluria y resultados muy altos de las transaminasas.
Figura 5 – Porcentaje de casos de malaria grave en 2016 en el estado de Amapá, por días de hospitalización.
El paciente con más de 20 días de infección por P. falciparum, tenía un año, parasitemia alta de 192.000f/mm3, hepatoesplenoglia, trombocitopenia, anemia severa y se le realizó transfusión de concentrado de hematíes. Está bien documentado que la anemia grave, una manifestación clínica presente en el paludismo grave, es un factor importante que contribuye a la morbilidad, la duración de la estancia e incluso la mortalidad, y ocurre en las infecciones por P. falciparum y, con bastante frecuencia, también en P. vivax (PRICE et al., 2007; Naing et al., 2014).
Según la información analizada, el tiempo transcurrido hasta el diagnóstico de la malaria, que también es un factor decisivo para la curación o evolución a gravedad, fueron: hasta 3 días 40%, 4 a 5 días 38% de los pacientes, 6 a 10 días 17% y 11 a 15 días 4% de los casos. Todos los pacientes fueron dados de alta sólo después de la mejoría del personal clínico y de laboratorio, con derivación para control ambulatorio con infección pediátrica, no hubo registro de muerte en el período estudiado.
Las manifestaciones clínicas más frecuentemente encontradas fueron: fiebre, palidez, tos, distensión abdominal, dolor abdominal, deshidratación, cefalea, escalofrío y diarrea (tabla 2). La fiebre estuvo presente en el 100% de los casos, lo que para Ramos (2006), es la razón principal que lleva a la mayoría de los pacientes a buscar atención médica y a realizar pruebas diagnósticas complementarias.
La palidez, a su vez, ocurrió en el 96% de los pacientes, ya que es una manifestación clínica muy frecuente en casos de malaria, un resultado similar al de Ventura et al. (1999) que en su estudio también se realizó con niños y adolescentes (85%) palidez presentada.
Las frialdades y el dolor de cabeza ocurrieron en el solamente 30% (14/47) de los pacientes. Estos son los síntomas que con mayor frecuencia acompañan a la fiebre, formando la clásica tríada de la malaria (BRASIL, 2009). Puede que no se haya observado bien por la falta de registro en el momento de la anamnesis, bien porque se trata de un estudio con casos graves en los que las manifestaciones pueden presentarse de forma atípica.
El dolor abdominal estuvo presente en (32%) y diarrea (23%) de los pacientes, según Ramos (2006), pueden tener origen de malaria, pero en áreas endémicas, las condiciones socioeconómicas suelen ser precarias, con saneamiento inadecuado que puede conducir a infecciones por parásitos intestinales por ingestión de alimentos y agua contaminada, que pueden sumar e intensificar estos síntomas en el momento de la infección.
Infectaron a los pacientes que tenían ascitis, colauria, somnolencia, y diarrea con P. vivax. Ésos con esplenomegalia, anorexia y taquicardia tenían infección de P. falciparum, las otras manifestaciones en la tabla 2 ocurrieron tanto en las infecciones por P. falciparum así como por P. vivax.
Tabla 2 – Distribución de las manifestaciones clínicas presentes en pacientes hospitalizados en el HCA con malaria grave en 2016. Macapá, Amapá.
Recientemente, se ha puesto de relieve la aparición de casos graves de paludismo por P. vivax (SIROMA, 2016; WASSMER et al., 2015; LACERDA et al., 2012). Muchas de las manifestaciones clínicas más graves que ocurren en la malaria por P. falciparum también se han descrito en pacientes con P. vivax (MONTEIRO; RIBEIRO; FERNANDES, 2013; SALAS et al., 2013). Como se evidencia en el presente estudio (Tabla 3), los pacientes diagnosticados de paludismo por P. vivax presentaron vómitos, ictericia, disnea, anemia intensa, oliguria, convulsiones y hemorragias. Son condiciones que indican gravedad y necesidad de hospitalización (BRASIL, 2010).
La condición grave más frecuente fueron los vómitos, 100% en pacientes infectados por P. falciparum y 68% en los infectados por P. vivax, situación que en la historia clínica justificó buena parte de las hospitalizaciones, debido a que los niños no tolera la medicación oral, por lo que requiere medicación intravenosa. Según Ramos (2006), los vómitos pueden dificultar el correcto tratamiento, provocando la no ingesta de medicamentos o una absorción inadecuada de los mismos, además de provocar deshidratación, como se observa en la (Tabla 2) donde el 30% (14/47) mostró deshidración.
Se registraron signos y síntomas respiratorios como tos (tabla 2) y dispina (tabla 3) en pacientes infectados por P. falciparum según P. Vivax, sin embargo, no se puede afirmar que fueron causados exclusivamente por malaria, porque los resultados de los gases de sangre, de la espirometría y de las examinaciones radiográficas de la mayoría no eran analizados, solamente este último en un paciente diagnosticado con malaria asociada a pulmonía.
Los signos y síntomas respiratorios y las complicaciones pulmonares han sido objeto de un estudio. Val et al. (2017) mostró que las complicaciones respiratorias se asociaron significativamente con casos de pacientes con malaria grave que murieron. Carvalho et al. (2010) informó que P. Vivax tiene la capacidad de adherirse a las células endoteliales pulmonares humanas. Para Salas et al. (2013) los procesos fisiopatógenos podrían ser compartidos por estas dos especies, como el secuestro de eritrocitos infectados de la circulación periférica a órganos vitales (pulmón, cerebro y riñones) y la citoadhesión a la pared endotelial de los capilares de estos órganos.
Según Carvalho et al. (2010), estas observaciones conducen a una modificación de los paradigmas actuales de patogénesis de la malaria y allana el camino para investigar la fisiopatología de las infecciones por P. vivax porque como los eritrocitos infectados por P. vivax no tienen estructuras de botón (cambios en la superficie) y debido a que todas las formas del parásito se pueden observar en la sangre periférica de los pacientes, se ha convertido en dogma que P. vivax no tiene capacidad para secuestrar y, por lo tanto, para no ser citogripus (LOPES et al., 2014).
Otra condición de la severidad encontrada era anemia intensa en (5/47) casos, con 4 infecciones de P. vivax y 1 por P. falciparum. La anemia severa, que se define como hematocrito por debajo del 15% y hemoglobina por debajo de 5g/dL, suele estar presente en la malaria grave debido a la intensa destrucción y secuestro de glóbulos rojos, alteración de la eritropoyesis y posibles hemorragias (BRASIL, 2010; GOMES et al., 2011; SIROMA, 2016).
En el actual estudio, nueve pacientes que experimentaron la transfusión de sangre requirieron el concentrado rojo del glóbulo, y 2 de los 9 plaquetas también requeridas, de estos 9 pacientes ocho fueron infectados por P. vivax, y sólo uno por P. falciparum. El paciente con hemorragia era uno de los pacientes que experimentó la transfusión de sangre del concentrado y de las plaquetas rojos del glóbulo.
Las complicaciones similares se relacionaron con el mlary severo que implicaba P. vivax se han descrito en otros estudios como anemia grave, disfunción hepática, ictericia, trombocitopenia con o sin sangrado (WASSMER et al., 2015; LACERDA et al., 2012; SALAS et al., 2013;)
Con respecto a la edad <1 año en la que hubo (10/47) pacientes (Tabla 3), para Gomes et al (2011), la gravedad de la malaria depende de la relación entre el huésped (vulnerabilidad y estado inmunológico) y Plasmodium spp (especie densidad infecciosa y parasitaria). Y los niños pequeños, los primeros infectados y las mujeres embarazadas son los hospedadores más vulnerables a las formas graves de la enfermedad, como se ha mencionado en el transcurso del trabajo.
Tabla 3 – Distribución de las condiciones que indican gravedad y necesidad de hospitalización según la especie infectante en pacientes hospitalizados con malaria severa en 2016, Macapá – AP.
El de mayor nivel de parasitemia fue registrado en la infección de P. falciparum con 192.000f/mm³. Entre los pacientes estudiados, P. vivax mostró un nivel máximo de 30.000v/mm³. Los principales eventos patógenos atribuidos a P. falciprum están bien descritos en la literatura como la capacidad de infectar eritrocitos en todas las etapas, presentando así altas parasitemias, el fenómeno de secuestro de eritrocitos infectados de la circulación sanguínea periférica y la capacidad de adectum al endotelio de capilares de órganos internos, de modo que pocas formas maduras se observan en muestras de sangre periférica durante la infección (KIRCHGATTER; PORTILLO, 2005; CARVALHO et al., 2010).
En cuanto al perfil de laboratorio (Tabla 4), las pruebas hematológicas mostraron que el 91% (43/47) de los pacientes tenían glóbulos rojos por debajo de los valores de referencia y el 100% de los casos tenían hemoglobina y hematocrito bajos. Tenían trombocitopenia (número reducido de plaquetas) n=34 pacientes, entre éstos, el 71% (n=24) tenían malaria de P. vivax e 29 % (n=10) P. falciparum. Estas evidencias hematológicas son muy frecuentes, especialmente en casos de malaria severa (RAMOS, 2006; LACERDA et al., 2012; SIROMA, 2016).
Tabla 4 – Distribución de los resultados de las pruebas de laboratorio de los pacientes tratados con malaria grave en 2016, Macapá – AP.
En cuanto a las dosis de urea y creatinina que evalúan las funciones renales, sólo se destacó la urea con valores altos, lo que puede indicar afectación renal. De los (23/47) pacientes que experimentaron esta prueba, el solamente 17% (n=4) tenían valores altos, que eran afectados por P. vivax.
Por otro lado, las pruebas que forman parte de la evaluación hepática, la aspartato aminotransferasa (AST) y la alanina aminotransferasa (ALT) se realizaron en el 68% (32/47) de los pacientes, y de los 32, presentaron valores elevados de (AST) 72% (n=23), entre los cuales el 22% (n=7) fueron P. falciparum y el 50% (n=16) fueron P.vivax. Y el 44% (14/32) tenían altos resultados de (ALT), y el 19% (n=6) eran P. falciparum e 25% (n=8) eram P. vivax.
La elevación de las transaminasas (Tabla 4) así como la presencia de ictericia (Tabla 3) muestran insuficiencia hepática, como el ciclo asexual del plasmodio llamado pre-eritrocito o esquizogonia tisular, que se produce en el hígado rompiendo los hepatocitos, dando lugar finalmente a un proceso inflamatorio en este órgano (RAMOS, 2006; BRASIL, 2009).
En cuanto a la prueba de glucosa en sangre, se detectó que sólo 7/47 (15%) se realizaron, donde de este total (n=1) se vieron afectados por P. Vivax , presentó hipoglucemia que es una ocurrencia común en la malaria grave, por lo general ocurre en asociación con otras complicaciones (GOMES, 2011; RIBEIRO, 2012).
Cabe señalar que 40/47 (85%) de los pacientes no se sometieron a pruebas glucémicas, según la Guia Prático de Tratamento de Malária no Brasil, la glucemia es una de las determinaciones de laboratorio, así como el hemograma, la determinación de parasitemia, los gases arteriales y los parámetros de la función renal y hepática (BRASIL, 2010). La falta de documentación de los resultados de las pruebas de los pacientes dificulta la observación de la dinámica de la enfermedad, es decir, el seguimiento del perfil clínico de los pacientes.
La proteína C-reactiva (PCR) fue realizada en el 79% (37/47) de los pacientes, cuyo el 97% (n = 36) tenían niveles de la proteína C-reactiva. Los pacientes con niveles altos fueron 24% (n=9) P. falciparum e 73% (n=27) P. vivax.
La proteína C reactiva se sintetiza en el hígado es un marcador inespecico que se eleva en las respuestas de fase aguda cuando la lesión tisular es estimulante, incluyendo infecciones por diversos microorganismos (COLLARES, 2006). Ya se han identificado pruebas sobre el aumento de los niveles en el plasma de proteínas C reactivas y la progresión de la gravedad de la malaria (LACERDA et al., 2012).
P. vivax y P. Falciparum es la principal especie que causa la malaria humana, ya que son responsables de la mayoría de los casos de morbilidad y mortalidad en el mundo. Mientras que P. falciparum es considerada la especie más letal, P. vivax es considerado el más ampliamente distribuido en el mundo (BATTLE et al., 2014).
CONCLUSIONES
Este estudio evidenció el perfil epidemiológico, clínico y de laboratorio de la malaria grave en niños y adolescentes, teniendo en cuenta no sólo las infecciones por Plasmodium falciparum que comúnmente se recomiendan como la principal causa de malaria grave, sino que las complicaciones relacionadas con Plasmodium vivax han sido cuidadosamente descritas.
En el presente estudio, fue posible observar P. falciparum y P. vivax asociados con malaria severa. Se encontró una alta proporción de infección por P. vivax, responsable del único caso de hemorragia, los únicos dos casos de convulsiones y ocho transfusiones de sangre. El hallazgo de muchas hospitalizaciones por infección por P. vivax destaca el potencial de gravedad de esta especie.
Sin embargo, otros estudios son necesarios aclarar los mecanismos patofisiológicos que llevan a la malaria severa de P. vivax . Dado que el nuevo escenario de malaria muestra que Plasmodium vivax ha estado cambiando su forma de interactuar con el huésped humano, y ya no puede considerarse un parásito benigno. El hallazgo de este cambio de paradigma aumenta aún más los desafíos en el control de esta enfermedad, en vista de P. vivax es considerada la especie más prevalente en el mundo, esto puede tener repercusiones en un empeoramiento de la situación actual de malaria.
A pesar de que el presente estudio no traduce la prevalencia poblacional de Amapá, los datos aquí presentados pueden contribuir a orientar las demandas de atención, favorecer mejores adaptaciones de los servicios especializados. Porque la identificación de datos epidemiológicos, clínicos y de laboratorio sobre la malaria grave es una estrategia para el diagnóstico precoz y el tratamiento adecuado, con el objetivo de mitigar los impactos causados por la enfermedad.
REFERENCIAS
ALMEIDA, H.K. S. et al. Casos confirmados de malária no Brasil entre os anos de 2011 e 2015. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 05, Ed. 04, Vol. 07, pp. 05-16, 2020. ISSN: 2448-0959, Disponível em: <https://www.nucleodoconhecimento.com.br/saude/malaria-no-brasil>, DOI: 10.32749/nucleodoconhecimento.com.br/saude/malaria-no-brasil
BATTLE, K. E. et al. Geographical variation in Plasmodium vivax relapse. Malaria Journal, 2014, 13:144. https://doi.org/10.1186/1475-2875-13-144.
BOTELHO, C. et al. Manifestações respiratórias na malária por Plamodium falciparum e vivax. Rev. Inst. Med. trop. São Paulo, 1987 29(6):337-345.
BRASIL. Revista Pan-Amazônica de Saúde, v.4, n.2, p.33-43, 2013. Disponível em: <http://dx.doi.org/10.5123/S2176-62232013000200005
BRASIL. Ministério da Saúde. Guia prático de tratamento da malária no Brasil. Brasília: Ministério da Saúde, 2010.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Plano de eliminação de malária no Brasil. Brasília: Ministério da Saúde, 2016.
BRASIL. Ministério da Saúde. Conselho Nacional de Saúde. Resolução Nº 466, de 12 de dezembro de 2012. Diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF, 13 jun. 2013. Seção I, p.59-62.
______. Ministério da Saúde. Manual de diagnóstico laboratorial da malária. 2 ed. Brasília: Ministério da Saúde, 2009.
CARDOSO, Rosilene Ferreira. Efeito da sazonalidade na curva endêmica da malária por Plasmodium falciparum e vivax no garimpo do Lourenço: uma série temporal histórica na Zona da Amazônia Brasileira. UFRGS. 2014. Disponível em: http://hdl.handle.net/ 10183/114973. Acesso em: 06/11/2017.
CARVALHO, Bruna O. et al. On the Cytoadhesion of Plasmodium vivax–Infected Erythrocytes, The Journal of Infectious Diseases, Volume 202, Issue 4, 15 August 2010, Pages 638–647, https://doi.org/10.1086/654815. Acess: 12/09/2017.
COLLARES, Guilherme Birchal; PAULINO, Urquiza Helena Meira. Aplicações clínicas atuais da proteína c reativa. Rev Med Minas Gerais, 2006; 16(4): 227-333. Disponível em: http://rmmg.org/artigo/detalhes/579. Acesso em: 15/11/2017.
GOMES, Andréia Patricia. et al. Malária grave por Plasmodium falciparum. Rev Ter Intensiva. Viçosa (MG). v 23, n 358 – 369, 2011.
HADDAD, Nagib. Metodologia de estudos em ciências da saúde. São Paulo: Roca; 2004.
KIRCHGATTER, Karin; PORTILO, Hernando A. Del. Aspectos Clínicos e Moleculares da Malária Grave. Anais da Academia Brasileira de Ciências. Rio de Janeiro, v. 77, n 3, 2005.
LACERDA, M. V. et al. Understanding the clinical spectrum of complicated Plasmodium vivax malaria: a systematic review on the contributions of the Brazilian literature. Malaria Journal, 11, 12.2012.
LOPES, Stefanie C. P. et al. Paucity of Plasmodium vivaxMature Schizonts in Peripheral Blood Is Associated With Their Increased Cytoadhesive Potential, The Journal of Infectious Diseases, Volume 209, Issue 9, 1 May 2014, Pages 1403–1407, https://doi.org/10.1093/infdis/jiu018. Acess: 12/09/2017.
MACIEL, Giovana Belem Moreira Lima; OLIVEIRA, Elaine Cristina de. Perfil entomológico e epidemiológico da malária em região garimpeira no norte do Mato Grosso, 2011. Epidemiol. Serv. Saúde, Brasília, v. 23, n. 2, p. 355-360, jun. 2014.
MIOTO, Leide Daiana; GALHARDI, Ligia Carla Faccin; AMARANTE, Marla Karine. Aspectos parasitológicos e imunológicos da malária. Biosaúde, Londrina, v. 14, n. 1, 2012. Disponível: http://www.uel.br/revistas/uel/index.php/biosaude/article/view/ 24324/17894. Acesso em: 07/11/2017.
MONTEIRO, M. R. C. C.; RIBEIRO, M. C.; FERNANDES, S. C. Aspectos clínicos e epidemiológicos da malária em um hospital universitário de Belém, Estado do Pará,
NAING, Cho et al. “Is Plasmodium Vivax Malaria a Severe Malaria?: A Systematic Review and Meta-Analysis.” PLoS Neglected Tropical Diseases 8.8 (2014): e3071. PMC. Web. 16 Nov. 2017. Doi: 10.1371/journal.pntd.0003071
PARISE, Éldi Vendrame. Malária grave em Palmas, Estado do Tocantins: relato de caso. Rev. Soc. Bras. Med. Trop. [online]. 2009, vol.42, n.4, pp.463-468. ISSN 0037-8682. http://dx.doi.org/10.1590/S0037-86822009000400021.
PRICE, R. N. et al. Vivax malaria: neglected and not benign. The American Journal of Tropical Medicine and Hygiene, Volume 77, Issue 6_Suppl, Dec 2007, p. 79 – 87. DOI: https://doi.org/10.4269/ajtmh.2007.77.79
RAMASAMY, Ranjan. Zoonotic malaria–global overview and research and policy needs. Frontiers in public health, v. 2, 2014.
RAMOS, Cristina Bastos Silva Raposo. Malária vivax na pré-amazônia maranhense: aspectos epidemiológicos e características clínicas. 2006. 110 f., il. Dissertação (Mestrado em Ciências Florestais)-Universidade de Brasília, Brasília, 2006.
SALAS, Briegel de Las et al. Adherence to human lung microvascular endothelial cells (HMVEC-L) of Plasmodium vivax isolates from Colombia. Malaria Journal. 2013,12: 347-10.1186/1475-2875-12-347. https://doi.org/10.1186/1475-2875-12-347. Access: 12/11/2017.
SANTOS, Rafael Cleison Silva dos; SANTOS, Elinaldo da Conceição dos. Malária: cobaias humanas no Amapá. Estação Científica (UNIFAP). Macapá, v. 1, n. 2, p. 143-150, 2011. Disponível em: https://periodicos.unifap.br/index.php/estacao/article/ download/ 244/cleisonv1n2.pdf. Acesso : 08/10/2016.
SIROMA, Thais Keiko; FERRARI, Eduardo Cal; RIGO, Rosângela Silva. Plasmodium vivax: causa de malária grave. Revista da Sociedade Brasileira de Clínica Médica. 2016 jul-set;14(3):166-71. Disponível: http://www.sbcm.org.br/revistas/RBCM/RBCM-2016-03.pdf#page=47
TA, Thuy H. et al. First case of a naturally acquired human infection with Plasmodium cynomolgi. Malaria journal, v. 13, n. 1, p. 68, 2014.
VAL, Fernando et al. Are respiratory complications of Plasmodium vivax malaria na underestimated problem?. Malaria Journal, v. 16, n. 1, p. 495, 2017.
VENTURA, Ana Maria Revorêdo da Silva, Et al. Malária por Plasmodium vivax em crianças e adolescentes – aspectos epidemiológicos, clínicos e laboratoriais. J Pediatr 75: 187-194, 1999.
WASSMER, Samuel C. et al. “Investigating the Pathogenesis of Severe Malaria: A Multidisciplinary and Cross-Geographical Approach.” The American Journal of Tropical Medicine and Hygiene 93.3 Suppl (2015): 42–56. PMC. http://doi.org/10.4269/ajtmh.14-0841 Web. 19 June 2017.
[1] Biomédica, Doctora en Enfermedades Trópicas, Profesora e investigadora del Colegio Estácio de Sá, Macapá.
[2] Biomédica, Técnica del Hospital de Niños y Adolescentes (Macapá – Amapá).
[3] Biomédica, Doctora en Enfermedades Trópicas, Profesora e investigadora del Curso de Medicina del Campus Macapá y del Programa de Posgrado en Ciencias de la Salud (PPGCS), Universidad Federal de Amapá (UNIFAP).
[4] Biólogo, Doctor en Enfermedades Trópicas, Profesor e investigador del Curso de Educación Física, Universidad Federal de Pará (UFPA).
[5] Teóloga, Doctora en Psicoanálisis Clínica. Trabaja desde hace 15 años con Metodología Científica (Método de Investigación) en Orientación de Producción Científica para Estudiantes de Maestría y Doctorado. Especialista en Investigación de Mercados e Investigación en Salud.
[6] Biólogo, Doctor en Investigación en Teoría y Comportamiento, Profesor e investigador del Programa de Posgrado en Educación Profesional y Tecnológica (PROFEPT) del Instituto de Educación Básica, Técnica y Tecnológica de Amapá (FIPA).
Enviado: Junio de 2020.
Aprobado: Junio de 2020.