ARTICLE ORIGINAL
BRITO, Maysa Vasconcelos de [1], FRANÇA, Ana Maria Braga da Silva [2], FECURY, Amanda Alves [3], OLIVEIRA, Euzébio de [4], DENDASCK, Carla Viana [5], DIAS, Cláudio Alberto Gellis de Mattos [6]
BRITO, Maysa Vasconcelos de. Et al. Profil épidémiologique du paludisme grave chez les nouveau-nés et les adolescents traités en 2016 dans un hôpital de référence de l’État d’Amapá, au Brésil. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 06, Vol. 12, p. 05 à 23. Juin 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/sante/paludisme-grave, DOI: 10.32749/nucleodoconhecimento.com.br/sante/paludisme-grave
RÉSUMÉ
La présente étude a pris en compte non seulement les infections causées par Plasmodium falciparum, qui est couramment recommandé comme la principale cause de paludisme grave, mais les complications liées à Plasmodium vivax ont été soigneusement décrites. Le but de cet article était d’identifier le profil épidémiologique, clinique et biologique du paludisme grave chez les patients traités à l’Hôpital pour enfants et adolescents de Macapá – Amapá. Une étude épidémiologique descriptive rétrospective a été réalisée. Les données ont été obtenues en consultant les dossiers médicaux des patients pour l’année 2016. 47 cas ont été considérés comme un paludisme grave. Il y avait une prédominance de patients masculins avec 63,8% et âgés jusqu’à 5 ans avec 59,6% des cas. Quant aux espèces, les infections par P. vivax se sont distinguées avec une fréquence plus élevée avec 72 % par rapport à P. falciparum avec 28 % des cas. Les mois avec le plus grand nombre d’hospitalisations étaient septembre et novembre, tous deux avec 17%. Les principales manifestations cliniques retrouvées étaient : fièvre, pâleur et toux. Les conditions qui indiquent la gravité qui se sont produites le plus : vomissements 87%, ictère 23%, dyspnée et âge < 1 an, tous deux avec 21%. Les examens hématologiques ont montré que 91% des patients avaient des globules rouges en dessous des valeurs de référence et 100% des cas avaient un taux d’hémoglobine et d’hématocrite bas ; une thrombopénie a été mise en évidence dans 72 % des cas. Les résultats modifiés des dosages biochimiques les plus importants sur le plan clinique étaient : l’urée, les transaminases, la glycémie et la protéine C-réactive. L’identification des données épidémiologiques, cliniques et de laboratoire sur le paludisme grave contribue au diagnostic précoce et au traitement adéquat de la maladie.
Mots-clés : Paludisme grave, Plasmodium vivax, épidémiologie.
INTRODUCTION
Le paludisme est un problème de santé publique important d’un grand intérêt mondial. C’est une maladie infectieuse causée par des protozoaires du genre Plasmodium transmis par la piqûre d’un moustique femelle infecté du genre Anopheles. Les principales espèces associées au paludisme humain sont : Plasmodium falciparum, P. vivax, P. malarie et P. ovale. Récemment, certains cas de paludisme dus à des infections à P. knowlesi et P. cynomolgi, espèces connues qui causent le paludisme chez les singes, ont été signalés (TA et al., 2014; RAMASSAMI, 2014). Les plus communs et avérés être trouvés au Brésil sont : P. vivax, P. falciparum et P. malrie, puisque P. ovale est plus commun dans les régions d’Afrique (BRASIL, 2009).
Le développement de vecteurs de transmission du paludisme est très réalisable en Amazônia légale. L’État d’Amapá est un État de la région nord, une composante de l’Amazônia légale et l’un des États avec un environnement plus favorable à la procréation du vecteur et à la transmission du paludisme. En ce qui concerne le Brésil, l’État d’Amapá fait partie des zones à risque moyen et élevé de contamination (SANTOS; SANTOS, 2011).
L’apparition de cas de paludisme est liée à plusieurs facteurs, dont les activités d’extraction des ressources naturelles, capables de potentialiser la transmission de la maladie. | En ce sens, l’Amapá se présente comme une région qui a son économie et sa survie dans l’utilisation des ressources naturelles (MACIEL; OLIVEIRA, 2014). Compte tenu de l’environnement favorable et des besoins de la population à utiliser les ressources naturelles, l’infection palustre est élevée en Amapá, et les cas avec l’incidence plus élevée sont ceux causés par P. vivax, (90% des cas) (SANTOS; SANTOS, 2011).
Les preuves montrent que le spectre clinique du paludisme est influencé par l’intensité de la transmission, l’espèce de parasite et l’état immunitaire du patient. Ainsi, la présentation clinique du paludisme semble différer entre les enfants et les adultes (WASSMER et al., 2015).
OBJECTIF
Identifier le profil épidémiologique, clinique et de laboratoire du paludisme grave chez les nouveau-nés et les adolescents traités en 2016 dans un hôpital de référence de l’État d’Amapá, au Brésil.
MÉTHODE
Il s’agit d’une étude épidémiologique descriptive à caractère rétrospectif, réalisée à l’Hôpital pour enfants et adolescents (HCA) situé dans la ville de Macapá dans l’État d’Amapá, au nord du Brésil. Les données de cette recherche ont été obtenues en consultation avec la base de données du Medical Archive Service (SAME) du HCA. Pour enregistrer les informations recueillies, les sujets suivants ont été retirés de la base de données : variables démographiques (sexe, âge, origine…), variables cliniques : nombre d’hospitalisations, temps d’hospitalisation, espèces infectantes (P. vivax, P. falciparum, P. malarie), manifestations cliniques (fièvre, myalgie, frissons, oligurie, jaunisse, hyperpyrexie (supérieure à 41 ºC), convulsions, etc.) et résultats d’analyses de laboratoire (numération globulaire, hémomoscopie (goutte épaisse) et dosages biochimiques (urée, créatinine, aspartate aminotransférase (AST) et alanine aminotransférase (ALT), PCR (protéine C réactive) et glycémie).
Les enfants et les adolescents des deux sexes (âgés de 29 jours de la naissance à l’âge de 15 ans) traités du 1er janvier au 31 décembre 2016, avec confirmation en laboratoire du paludisme (recherche sur le plasmodium avec des résultats positifs) et qui présentaient des manifestations cliniques et de laboratoire du paludisme sévère conformément au guide pratique sur le paludisme de l’année 2010, ont été inclus. qui présente les conditions indicatives de la gravité de la maladie et de la nécessité d’hospitalisation: patients immunodéprimés, patients présentant l’un des signes de danger pour le paludisme grave: (hyperpyrexie supérieure à 41ºC, convulsions, hyperparasitémie ( >200 000/mm3), vomissements répétés, oligurie, dyspinénie, anémie intense jaunisse, saignement et hypotion artérielle.
Le projet de recherche a été soumis et approuvé par le Comité d’éthique et de recherche du Collège Estácio de Macapá, conformément aux normes éthiques établies dans la résolution no 466 du Conseil national de la santé du 12 décembre 2012, qui traite de la recherche avec des êtres humains (BRASIL, 2013).
RÉSULTATS ET DISCUSSION
L’Amazônia, région où se trouve l’État d’Amapá, contribue à la formation du lien épidémiologique de transmission du paludisme en raison de ses aspects géographiques, climatiques et socioculturels. Ainsi, la connaissance de la dynamique de la maladie, du point de vue de la particularité de chaque région endémique et groupe d’âge du développement de la population, est d’une grande importance. (BRASIL, 2016).
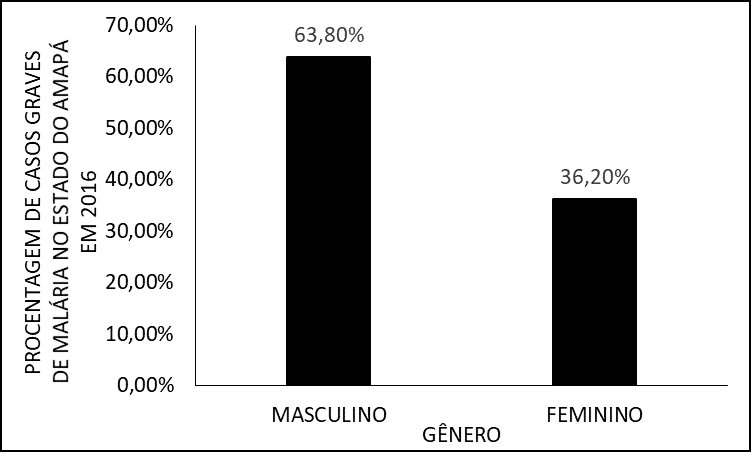
Initialement, les aspects épidémiologiques des patients à l’étude ont été caractérisés concernant le sexe, le groupe d’âge, l’origine et les espèces infectantes. Ainsi, il y avait une prédominance de patients de sexe masculin, qui totalisent 63,8 % (n = 30) des cas, tandis que seulement 36,2 % (n = 17) appartenaient à des femmes (figure 1).
Figure 1 – Pourcentage de cas de paludisme grave en 2016 dans l’État d’Amapá, par sexe.
Selon Monteiro, Ribeiro et Fernandes (2013), les personnes des deux sexes sont à risque de contracter le paludisme. Les hommes ont tendance à faire moins attention à la santé que les femmes. Le travail dans les zones sujettes à la présence de vecteurs est également généralement occupé par les hommes (ALMEIDA et al., 2020).
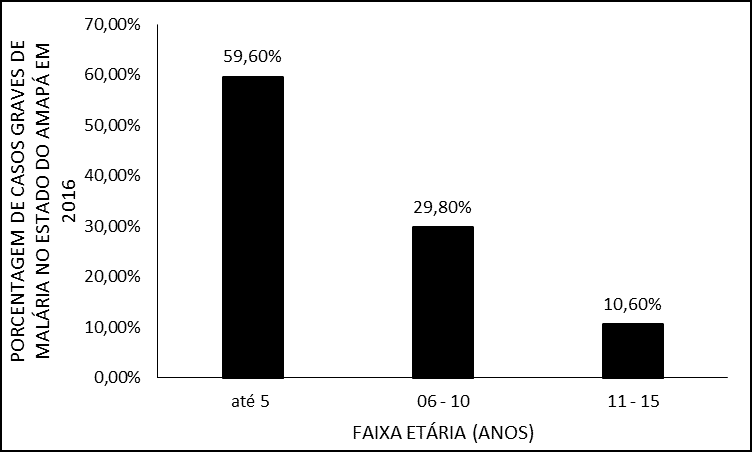
Plus de la moitié (59,6 %) des cas se sont produits dans les patients qui ont appartenu aux groupes d’âge jusqu’à 5 ans ; ont suivi de 6 à 10 ans, avec 29,8 % (n = 14) des cas. Seulement 10,6 % (n = 5) des cas sont survenus chez des patients âgés de 11 à 15 ans (figure 2).
Figure 2 – Pourcentage de cas de paludisme grave en 2016 dans l’État d’Amapá, par groupe d’âge.
En ce qui concerne le groupe d’âge jusqu’à 5 ans, dans lequel le nombre de cas était plus élevé, il peut être lié à la susceptibilité de l’enfant à contracter des maladies, également parce qu’ils font partie du groupe à risque et le fait que dans cette étude, la première infection prévaut 94% des cas, ce qui est un facteur qui contribue à la gravité puisque l’individu ne présente aucune immunité spécifique contre le plasmodium (VENTURA et al. , 1999; GOMES et al., 2011; RIBEIRO, 2012).
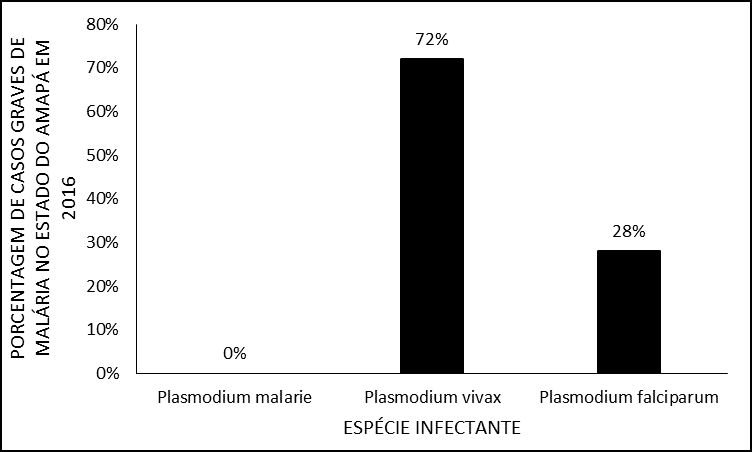
Quant aux espèces infectantes, dans cette étude il n’y avait pas d’enregistrement dans les dossiers médicaux de la présence de P. malarie ou de paludisme mixte, avec une fréquence plus élevée d’infections par Plasmodium vivax avec 72% (n=34) par rapport à P. falciparum plus de 28 % (n=13) des cas enregistrés (Figure 3).
Figure 3 – Pourcentage de cas de paludisme grave en 2016 dans l’État d’Amapá, par groupe d’âge.
Ce résultat corrobore celui trouvé par Santos e Santos (2011), qui dans leur étude montrent une incidence plus élevée de l’infection de P. vivax dans l’État d’Amapá. D’autre part, lors de l’analyse de l’aspect de la gravité de cette quantité d’infection P. vivax n’est pas aussi commun, car la plupart des enquêtes ont le paludisme grave lié au P. falciparum (KIRCHGATTER; PORTILLO, 2005; GOMES, 2011; MIOTO; GALHARDI; AMARANTE, 2012; PARISE, 2009).
L’origine de ces patients selon le tableau 1 montre que parmi les municipalités d’Amapá, Macapá s’est démarqué avec 29 cas, 79% (n = 23) P. vivax et 21 % (6) P. falciparum. Puisque cela peut être attribué au fait que les travaux ont été effectués dans la capitale.
Tableau 1 – Répartition des patients hospitalisés dans l’HCA avec un paludisme sévère selon la municipalité de résidence et les espèces infectieuses en 2016, Macapá-AP.
Un événement similaire a été observé dans une étude, développée dans un hôpital de référence à Belém do Pará, dans lequel les autres municipalités seules n’étaient pas non plus représentatives (MONTEIRO; RIBEIRO; FERNANDES, 2013). Ainsi, bien que l’ensemble de l’État d’Amapá soit une zone endémique, on suppose que la population est aidée, avec un diagnostic et un traitement adéquats dans les unités de moindre complexité dans les municipalités de résidence.
Toujours sur le tableau 1, la répartition des espèces par commune diffère des autres présentées, Ferreira Gomes avec 75% (3/4) et Porto Grande 67% (2/3) d’infection par P. falciparum, c’est là qu’elle se vérifie une légère prédominance des cas d’infection par cette espèce, constat commun à plusieurs études où prévalent les cas de paludisme grave à P. falciparum (KIRCHGATTER; PORTILLO, 2005; PARISE, 2009; GOMES, 2011; MIOTO; GALHARDI; AMARANTE, 2012).
La municipalité d’Amapa avec le plus petit nombre de cas était Oiapoque avec seulement 1 causé par P. vivax. Les 3 cas restants ont été suivis chez des patients d’un autre État, dans ce cas Pará des villes de Breves et Afuá, 67% (n= 2) P. vivax e 33% (1) P. falciparum.
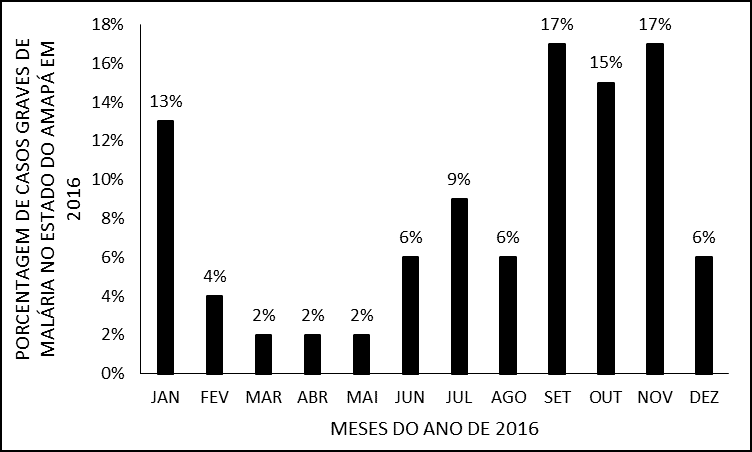
Les mois où la fréquence d’hospitalisations pour paludisme grave a été la plus élevée ont été septembre et novembre avec 8 (17 %) des hospitalisations chacune. Alors que les mois de mars, avril et mai ont été ceux qui ont eu le plus faible nombre seulement 2 % (1) d’hospitalisation, comme le montre (figure 4). La saisonnalité du paludisme est variable dans chaque État de la région Amazônia, mais en général, il y a un pic de cas dans la période de transition entre les saisons sèche et humide (BRASIL, 2016).
Figure 4 – Pourcentage de cas de paludisme grave en 2016 dans l’État d’Amapá, pendant des mois de l’année.
Le principal vecteur du paludisme au Brésil, Anopheles darlingi, se reproduit en grand nombre dans les eaux à faible débit, profondes et ombragées, et sa reproduction diminue en période de pluie (MONTEIRO; RIBEIRO; FERNANDES, 2013). Dans l’État d’Amapá, le mois de septembre présente un faible indice de précipitations et novembre le début de la saison des pluies, un fait qui peut justifier le plus grand nombre d’hospitalisations pour paludisme grave dans cette étude. Certes, en plus du changement climatique, d’autres facteurs, tels que socio-environnementaux et principalement, les variations dans la qualité et la quantité des mesures de lutte peuvent être liés à l’incidence plus ou moins élevée de la maladie (BRASIL, 2016).
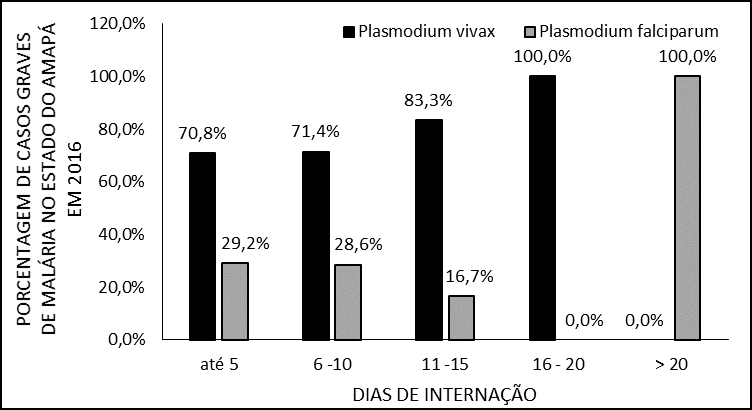
Quant à la durée de séjour, plusieurs facteurs peuvent influencer le séjour de ces patients en milieu hospitalier, (figure 5) montre que la plupart des patients sont restés hospitalisés jusqu’à 5 jours. Les deux patients infectés par P. vivax qui sont restés pendant 16 à 20 jours présentaient tous deux une déshydratation, une anémie et une thrombocytopénie, dont l’un avait davantage, une leucopénie, un ictère, une colurie et des résultats très élevés au test des transaminases.
Figure 5 – Pourcentage de cas de paludisme grave en 2016 dans l’État d’Amapá, pour les jours d’hospitalisation.
Le patient avec plus de 20 jours avec l’infection de P. Falciparum, était d’un an, a présenté la parasitémie élevée de 192.000f/mm3, hepatosplenomeglia, thrombocytopénie, anémie intense et a subi la transfusion du concentré de globule rouge. On l’a bien documenté que l’anémie intense, une manifestation clinique présente dans le paludisme grave et est un facteur important contribuant à la morbidité, au temps d’hospitalisation et même à la mortalité, se produisant dans des infections de P. falciparum et assez souvent aussi par P.vivax (PRICE et al., 2007; Naing et al., 2014).
Selon les informations analysées, le temps écoulé jusqu’au diagnostic du paludisme, qui est également un facteur décisif pour la guérison ou l’évolution vers la gravité, étaient: jusqu’à 3 jours 40%, 4 à 5 jours 38% des patients, 6 à 10 jours 17% et 11 à 15 jours 4% des cas. Tous les patients ont été déchargés seulement après amélioration du personnel clinique et de laboratoire, avec la référence pour la commande de patient avec l’infection pédiatrique, il n’y avait aucun enregistrement de la mort dans la période étudiée.
Les manifestations cliniques les plus fréquemment constatées étaient : fièvre, pâleur, toux, ballonnements, douleurs abdominales, déshydratation, maux de tête, frissons et diarrhée (tableau 2). La fièvre était présente dans 100% des cas, ce qui, pour Ramos (2006), est la principale raison qui conduit la plupart des patients à consulter un médecin et à effectuer des tests diagnostiques complémentaires.
La pâleur, à son tour, s’est produite chez 96% des patients, car il s’agit d’une manifestation clinique très fréquente dans les cas de paludisme, un résultat similaire à celui de Ventura et al. (1999) que dans son étude également menée auprès d’enfants et d’adolescents (85%) pallor présenté.
Les frissons et le mal de tête tous les deux se sont produits dans seulement 30% (14/47) des patients. Ce sont des symptômes qui accompagnent le plus souvent la fièvre, formant la triade classique du paludisme (BRASIL, 2009). Il peut ne pas avoir été observé soit en raison de l’absence d’enregistrement à l’heure de l’anamnèse, soit parce qu’il s’agit d’une étude avec des cas graves où les manifestations peuvent présenter d’une manière atypique.
La douleur abdominale était présente dans (32%) et la diarrhée (23 %) des patients, selon Ramos (2006), peuvent avoir l’origine de malaria, mais dans les zones endémiques, les conditions socio-économiques sont habituellement précaires, avec un assainissement inadéquat qui peut conduire à des infections par des parasites intestinaux par ingestion de nourriture et d’eau contaminée, qui peuvent s’additionnent et intensifier ces symptômes au moment de l’infection.
Les patients qui ont eu l’ascite, le choluria, la somnolence, et la diarrhée ont été infectés par P. vivax. Ceux avec la splénomégalie, l’anorexie et le taquicardia ont eu l’infection de P. Falciparum, les autres manifestations dans le tableau 2 se sont produites dans les infections de P. falciparum ainsi que par P. vivax.
Tableau 2 – Répartition des manifestations cliniques présentes chez les patients hospitalisés dans l’HCA avec un paludisme sévère en 2016. Macapá, Amapá.
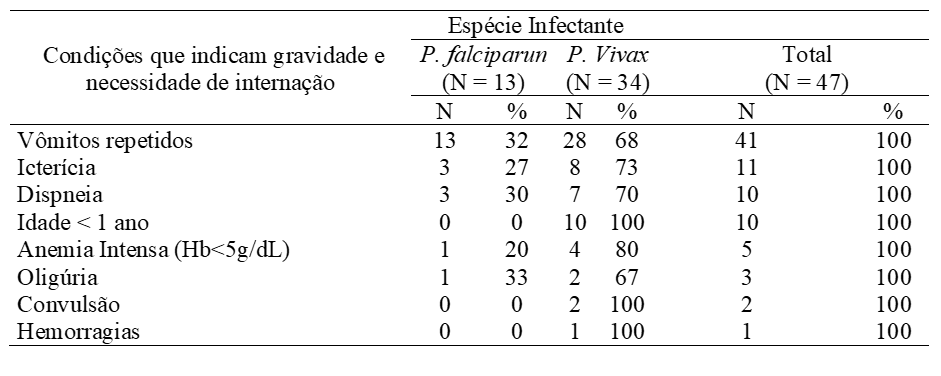
Récemment, la survenue de cas graves de paludisme à P. vivax a été soulignée (SIROMA, 2016 ; WASSMER et al., 2015 ; LACERDA et al., 2012). Bon nombre des manifestations cliniques les plus graves qui surviennent dans le paludisme à P. falciparum ont également été décrites chez des patients atteints de P. vivax (MONTEIRO ; RIBEIRO ; FERNANDES, 2013 ; SALAS et al., 2013). Comme le montre la présente étude (tableau 3), les patients diagnostiqués avec un paludisme à P. vivax ont présenté des vomissements, un ictère, une dyspnée, une anémie intense, une oligurie, des convulsions et une hémorragie. Ce sont des conditions qui indiquent la gravité et la nécessité d’une hospitalisation (BRASIL, 2010).
L’affection grave la plus fréquente était les vomissements, 100 % chez les patients infectés par P. falciparum et 68 % chez ceux infectés par P. vivax, situation qui, dans les dossiers médicaux, justifiait une bonne partie des hospitalisations, du fait que les enfants ne tolérait pas les médicaments oraux, nécessitant donc des médicaments par voie intraveineuse. Selon Ramos (2006), les vomissements peuvent entraver le bon traitement, entraînant une non-prise de médicaments ou une absorption inadéquate de ceux-ci, en plus de conduire à une déshydratation, comme le montre le (tableau 2) où 30% (14/47) ont montré déshydratation.
Des signes et symptômes respiratoires tels que la toux (tableau 2) et la dyspine (tableau 3) ont été enregistrés chez les patients infectés par P. falciparum selon P. Vivax, cependant, on ne peut pas affirmer qu’ils ont été causés exclusivement par le paludisme, parce que les résultats des gaz sanguins, de la spirométrie et des examens radiographiques de la majorité n’ont pas été analysés, seulement ce dernier dans un patient diagnostiqué avec le paludisme lié à la pneumonie.
Les signes et symptômes respiratoires et les complications pulmonaires ont fait l’objet d’une étude. Val et al. (2017) ont montré que les complications respiratoires étaient significativement associées aux cas de décès de patients atteints de paludisme grave. Carvalho et al. (2010) ont indiqué que P. Vivax a la capacité d’adhérer aux cellules endothéliales pulmonaires humaines. Pour Salas et al. (2013) les processus physiopathogènes pourraient être partagés par ces deux espèces, tels que la séquestration des érythrocytes infectés de la circulation périphérique dans les organes vitaux (poumon, cerveau et reins) et la cytoadhésion à la paroi endothéliale des capillaires de ces organes.
Selon Carvalho et al. (2010), ces observations conduisent à une modification des paradigmes actuels de la pathogenèse du paludisme et ouvrent la voie à l’étude de la physiopathologie des infections à P. vivax parce que comme les érythrocytes infectés par P. vivax n’ont pas de structures bouton (changements à la surface) et parce que toutes les formes du parasite peuvent être observées dans le sang périphérique des patients, il est devenu dogme que P. vivax n’a pas la capacité d’enlever et, par conséquent, de ne pas être cytogripus (LOPES et al., 2014).
Une autre condition de sévérité trouvée était anémie intense dans (5/47) cas, avec 4 infections de P. vivax et 1 par P. falciparum. L’anémie sévère, qui est définie comme l’hématocrite à moins de 15 % et l’hémoglobine à moins de 5g/dL, est habituellement présente dans le paludisme grave en raison de la destruction et de la séquestration intenses des globules rouges, de l’altération de l’érythropoïèse et des hémorragies possibles (BRASIL, 2010; GOMES et al., 2011; SIROMA, 2016).
Dans la présente étude, neuf patients qui ont subi la transfusion sanguine ont eu besoin du concentré de globule rouge, et 2 des 9 plaquettes également exigées, de ces 9 patients huit ont été infectés par P. vivax, et un seul par P. falciparum. Le patient présentant l’hémorragie était un des patients qui ont subi la transfusion sanguine du concentré et des plaquettes de globule rouge.
Complications semblables liées à mlary grave impliquant P. vivax ont été décrits dans d’autres études telles que l’anémie sévère, le dysfonctionnement hépatique, la jaunisse, la thrombocytopénie avec ou sans saignement (WASSMER et al., 2015; LACERDA et al., 2012; SALAS et al., 2013; )
Concernant l’âge < 1 an auquel il y avait (10/47) patients (tableau 3), pour Gomes et al (2011), la gravité du paludisme dépend de la relation entre l’hôte (vulnérabilité et statut immunitaire) et Plasmodium spp (espèce densité infectieuse et parasitaire). Et les jeunes enfants, les premières femmes infectées et enceintes sont des hôtes plus vulnérables aux formes sévères de la maladie, comme cela a été évoqué au cours des travaux.
Tableau 3 – Répartition des conditions qui indiquent la gravité et le besoin d’hospitalisation selon les espèces infectantes chez les patients hospitalisés pour un paludisme grave en 2016, Macapá – AP.
Le niveau le plus élevé de parasitémie a été enregistré dans l’infection à P. falciparum avec 192 000f/mm³. Parmi les patients étudiés, P. vivax a montré un niveau maximum de 30 000 v/mm³. Les principaux événements pathogènes attribués à P. falciprum sont bien décrits dans la littérature, tels que la capacité d’infecter les érythrocytes à tous les stades, présentant ainsi des parasitémies élevées, le phénomène de séquestration des érythrocytes infectés de la circulation sanguine périphérique et la capacité d’adhérer à la endothélium capillaire des organes internes, de sorte que peu de formes matures sont observées dans les échantillons de sang périphérique lors de l’infection (KIRCHGATTER ; PORTILLO, 2005 ; CARVALHO et al., 2010).
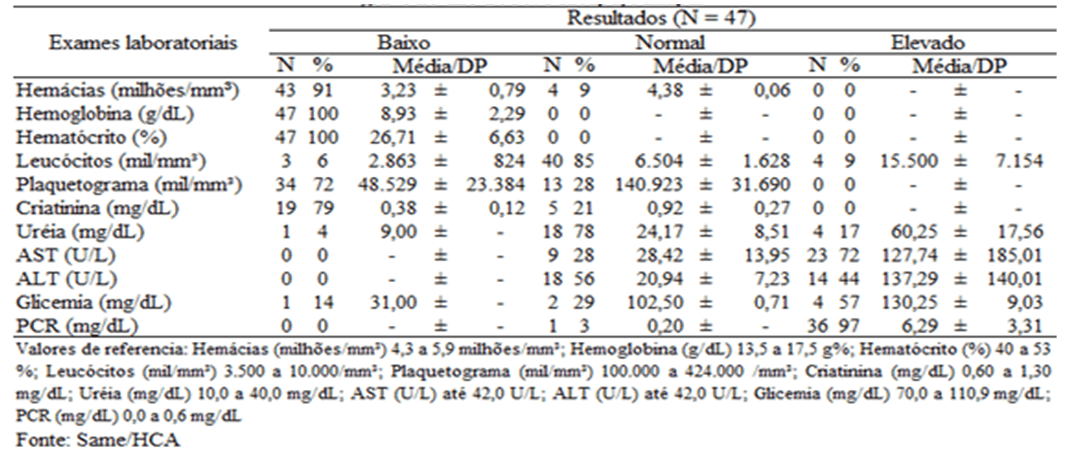
En ce qui concerne le profil de laboratoire (tableau 4), les tests hématologiques ont montré que 91% (43/47) des patients avaient des globules rouges inférieurs aux valeurs de référence et que 100% des cas avaient une faible teneur en hémoglobine et en hématocrite. Ils ont eu la thrombocytopénie (nombre réduit de plaquettes) n=34 patients, parmi ces deux, 71% (n=24) ont eu le paludisme de P. vivax e 29% (n=10) P. falciparum. Ces preuves hématologiques sont très fréquentes, en particulier dans les cas de paludisme grave (RAMOS, 2006; LACERDA et al., 2012; SIROMA, 2016).
Tableau 4 Distribution des résultats des tests de laboratoire des patients traités par paludisme sévère en 2016, Macapá – AP.
En ce qui concerne les doses d’urée et de créatinine qui évaluent les fonctions rénales, seule l’urée s’est démarquée avec des valeurs élevées, ce qui peut indiquer une atteinte rénale. Des (23/47) patients qui ont subi cet essai, seulement 17% (n=4) ont eu des valeurs élevées, qui ont été affectées par P. vivax.
D’autre part, les essais qui font partie de l’évaluation de foie, l’aminotransférase d’aspartate (AST) et l’aminotransférase d’Alanine (ALT) ont été tous les deux exécutés dans 68% (32/47) des patients, et des 32, ils ont eu des valeurs élevées de (AST) 72% (n=23), parmi lesquels 22% (n=7) étaient P. falciparum et 50% (n = 16) étaient P. vivax. Et 44% (14/32) ont eu des résultats élevés de (ALT), et 19% (n= 6) étaient P. falciparum e 25% (n=8) eram P. vivax.
L’élévation des transaminases (tableau 4) ainsi que la présence de jaunisse (tableau 3) montrent une insuffisance hépatique, comme le cycle asexué de plasmodium appelé schizogonia pré-érythrocytaire ou tissulaire, se produit dans le foie brisant les hépatocytes, conduisant éventuellement à un processus inflammatoire dans cet organe (RAMOS, 2006; BRASIL, 2009).
Quant au test de glycémie, il a été détecté que seulement 7/47 (15%) ont été exécutés, où de ce total (n = 1) affecté par P. Vivax , l’hypoglycémie présentée qui est un phénomène courant dans le paludisme grave, survient habituellement en association avec d’autres complications (GOMES, 2011; RIBEIRO, 2012).
Il est à noter que 40/47 (85%) des patients n’ont pas subi de tests glycémiques, selon le Guia Prático de Tratamento de Malária no Brasil, la glycémie est l’une des déterminations de laboratoire, ainsi que la numération globale, la détermination de la parasitémie, des gaz sanguins artériels et des paramètres de la fonction rénale et hépatique (BRASIL, 2010). Le manque de documentation des résultats des tests des patients rend difficile l’observation de la dynamique de la maladie, c’est-à-dire la traçabilité du profil clinique des patients.
La protéine C réactive (CRP) a été exécutée dans 79% (37/47) des patients, dont 97% (n = 36) ont eu des niveaux élevés de protéine C réactive. Les patients présentant des niveaux élevés étaient 24% (n=9) P. falciparum e 73% (n=27) P. vivax.
La protéine C réactive est synthétisée dans le foie est un marqueur non spécifique qui augmente dans les réponses de phase aiguë lorsque les lésions tissulaires sont stimulantes, y compris les infections par divers micro-organismes (COLLARES, 2006). Des preuves ont déjà été identifiées sur l’augmentation des niveaux dans le plasma de la protéine C réactive et la progression de la gravité du paludisme (LACERDA et al., 2012).
P. vivax et P. falciparum sont les principales espèces responsables du paludisme humain, car ils sont responsables de la plupart des cas de morbidité et de mortalité dans le monde. Tandis que P. falciparum est considéré comme l’espèce la plus mortelle, P. vivax est considéré comme le plus largement distribué sur le globe (BATTLE et al., 2014).
CONCLUSIONS
Cette étude a mis en évidence le profil épidémiologique, clinique et de laboratoire du paludisme grave chez les enfants et les adolescents, en tenant compte non seulement des infections à Plasmodium falciparum qui est couramment recommandée comme principale cause de paludisme grave, mais les complications liées à Plasmodium vivax ont été soigneusement décrites.
Dans la présente étude, il a été possible d’observer à la fois P. falciparum et P. vivax associés au paludisme grave. Une forte proportion d’infections à P. vivax a été trouvée, responsable du seul cas d’hémorragie, des deux seuls cas de convulsions et de huit transfusions sanguines. La découverte de nombreuses hospitalisations pour infection à P. vivax met en évidence le potentiel de gravité de cette espèce.
Cependant, d’autres études sont nécessaires pour clarifier les mécanismes pathophysiologiques qui mènent au paludisme grave de P. vivax. Depuis le nouveau scénario de paludisme montre que Plasmodium vivax a changé sa façon d’interagir avec l’hôte humain, et ne peut plus être considéré comme un parasite bénin. La conclusion de ce changement de paradigme augmente encore les défis en commandant cette maladie, en raison de P. vivax est considéré comme l’espèce la plus répandue dans le monde, ce qui peut avoir des répercussions sur une aggravation de la situation actuelle du paludisme.
Même si la présente étude ne traduit pas la prévalence de la population d’Amapá, les données présentées ici peuvent contribuer à orienter les demandes de soins, favoriser de meilleures adaptations des services spécialisés. Parce que l’identification des données épidémiologiques, cliniques et de laboratoire sur le paludisme grave est une stratégie de diagnostic précoce et de traitement approprié, visant à atténuer les impacts causés par la maladie.
RÉFÉRENCES
ALMEIDA, H.K. S. et al. Casos confirmados de malária no Brasil entre os anos de 2011 e 2015. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 05, Ed. 04, Vol. 07, pp. 05-16, 2020. ISSN: 2448-0959, Disponível em: <https://www.nucleodoconhecimento.com.br/saude/malaria-no-brasil>, DOI: 10.32749/nucleodoconhecimento.com.br/saude/malaria-no-brasil
BATTLE, K. E. et al. Geographical variation in Plasmodium vivax relapse. Malaria Journal, 2014, 13:144. https://doi.org/10.1186/1475-2875-13-144.
BOTELHO, C. et al. Manifestações respiratórias na malária por Plamodium falciparum e vivax. Rev. Inst. Med. trop. São Paulo, 1987 29(6):337-345.
BRASIL. Revista Pan-Amazônica de Saúde, v.4, n.2, p.33-43, 2013. Disponível em: <http://dx.doi.org/10.5123/S2176-62232013000200005
BRASIL. Ministério da Saúde. Guia prático de tratamento da malária no Brasil. Brasília: Ministério da Saúde, 2010.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Plano de eliminação de malária no Brasil. Brasília: Ministério da Saúde, 2016.
BRASIL. Ministério da Saúde. Conselho Nacional de Saúde. Resolução Nº 466, de 12 de dezembro de 2012. Diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF, 13 jun. 2013. Seção I, p.59-62.
______. Ministério da Saúde. Manual de diagnóstico laboratorial da malária. 2 ed. Brasília: Ministério da Saúde, 2009.
CARDOSO, Rosilene Ferreira. Efeito da sazonalidade na curva endêmica da malária por Plasmodium falciparum e vivax no garimpo do Lourenço: uma série temporal histórica na Zona da Amazônia Brasileira. UFRGS. 2014. Disponível em: http://hdl.handle.net/ 10183/114973. Acesso em: 06/11/2017.
CARVALHO, Bruna O. et al. On the Cytoadhesion of Plasmodium vivax–Infected Erythrocytes, The Journal of Infectious Diseases, Volume 202, Issue 4, 15 August 2010, Pages 638–647, https://doi.org/10.1086/654815. Acess: 12/09/2017.
COLLARES, Guilherme Birchal; PAULINO, Urquiza Helena Meira. Aplicações clínicas atuais da proteína c reativa. Rev Med Minas Gerais, 2006; 16(4): 227-333. Disponível em: http://rmmg.org/artigo/detalhes/579. Acesso em: 15/11/2017.
GOMES, Andréia Patricia. et al. Malária grave por Plasmodium falciparum. Rev Ter Intensiva. Viçosa (MG). v 23, n 358 – 369, 2011.
HADDAD, Nagib. Metodologia de estudos em ciências da saúde. São Paulo: Roca; 2004.
KIRCHGATTER, Karin; PORTILO, Hernando A. Del. Aspectos Clínicos e Moleculares da Malária Grave. Anais da Academia Brasileira de Ciências. Rio de Janeiro, v. 77, n 3, 2005.
LACERDA, M. V. et al. Understanding the clinical spectrum of complicated Plasmodium vivax malaria: a systematic review on the contributions of the Brazilian literature. Malaria Journal, 11, 12.2012.
LOPES, Stefanie C. P. et al. Paucity of Plasmodium vivaxMature Schizonts in Peripheral Blood Is Associated With Their Increased Cytoadhesive Potential, The Journal of Infectious Diseases, Volume 209, Issue 9, 1 May 2014, Pages 1403–1407, https://doi.org/10.1093/infdis/jiu018. Acess: 12/09/2017.
MACIEL, Giovana Belem Moreira Lima; OLIVEIRA, Elaine Cristina de. Perfil entomológico e epidemiológico da malária em região garimpeira no norte do Mato Grosso, 2011. Epidemiol. Serv. Saúde, Brasília, v. 23, n. 2, p. 355-360, jun. 2014.
MIOTO, Leide Daiana; GALHARDI, Ligia Carla Faccin; AMARANTE, Marla Karine. Aspectos parasitológicos e imunológicos da malária. Biosaúde, Londrina, v. 14, n. 1, 2012. Disponível: http://www.uel.br/revistas/uel/index.php/biosaude/article/view/ 24324/17894. Acesso em: 07/11/2017.
MONTEIRO, M. R. C. C.; RIBEIRO, M. C.; FERNANDES, S. C. Aspectos clínicos e epidemiológicos da malária em um hospital universitário de Belém, Estado do Pará,
NAING, Cho et al. “Is Plasmodium Vivax Malaria a Severe Malaria?: A Systematic Review and Meta-Analysis.” PLoS Neglected Tropical Diseases 8.8 (2014): e3071. PMC. Web. 16 Nov. 2017. Doi: 10.1371/journal.pntd.0003071
PARISE, Éldi Vendrame. Malária grave em Palmas, Estado do Tocantins: relato de caso. Rev. Soc. Bras. Med. Trop. [online]. 2009, vol.42, n.4, pp.463-468. ISSN 0037-8682. http://dx.doi.org/10.1590/S0037-86822009000400021.
PRICE, R. N. et al. Vivax malaria: neglected and not benign. The American Journal of Tropical Medicine and Hygiene, Volume 77, Issue 6_Suppl, Dec 2007, p. 79 – 87. DOI: https://doi.org/10.4269/ajtmh.2007.77.79
RAMASAMY, Ranjan. Zoonotic malaria–global overview and research and policy needs. Frontiers in public health, v. 2, 2014.
RAMOS, Cristina Bastos Silva Raposo. Malária vivax na pré-amazônia maranhense: aspectos epidemiológicos e características clínicas. 2006. 110 f., il. Dissertação (Mestrado em Ciências Florestais)-Universidade de Brasília, Brasília, 2006.
SALAS, Briegel de Las et al. Adherence to human lung microvascular endothelial cells (HMVEC-L) of Plasmodium vivax isolates from Colombia. Malaria Journal. 2013,12: 347-10.1186/1475-2875-12-347. https://doi.org/10.1186/1475-2875-12-347. Access: 12/11/2017.
SANTOS, Rafael Cleison Silva dos; SANTOS, Elinaldo da Conceição dos. Malária: cobaias humanas no Amapá. Estação Científica (UNIFAP). Macapá, v. 1, n. 2, p. 143-150, 2011. Disponível em: https://periodicos.unifap.br/index.php/estacao/article/ download/ 244/cleisonv1n2.pdf. Acesso : 08/10/2016.
SIROMA, Thais Keiko; FERRARI, Eduardo Cal; RIGO, Rosângela Silva. Plasmodium vivax: causa de malária grave. Revista da Sociedade Brasileira de Clínica Médica. 2016 jul-set;14(3):166-71. Disponível: http://www.sbcm.org.br/revistas/RBCM/RBCM-2016-03.pdf#page=47
TA, Thuy H. et al. First case of a naturally acquired human infection with Plasmodium cynomolgi. Malaria journal, v. 13, n. 1, p. 68, 2014.
VAL, Fernando et al. Are respiratory complications of Plasmodium vivax malaria na underestimated problem?. Malaria Journal, v. 16, n. 1, p. 495, 2017.
VENTURA, Ana Maria Revorêdo da Silva, Et al. Malária por Plasmodium vivax em crianças e adolescentes – aspectos epidemiológicos, clínicos e laboratoriais. J Pediatr 75: 187-194, 1999.
WASSMER, Samuel C. et al. “Investigating the Pathogenesis of Severe Malaria: A Multidisciplinary and Cross-Geographical Approach.” The American Journal of Tropical Medicine and Hygiene 93.3 Suppl (2015): 42–56. PMC. http://doi.org/10.4269/ajtmh.14-0841 Web. 19 June 2017.
[1] Biomédical, doctorat en maladies tropiques, professeur et chercheur au Collège Estácio de Sá, Macapá.
[2] Biomédical, Technique de l’Hôpital pour enfants et adolescents (Macapá – Amapá).
[3] Biomédical, doctorat en maladies tropiques, professeur et chercheur du cours de médecine du campus Macapá et du programme d’études supérieures en sciences de la santé (PPGCS), Université fédérale d’Amapá (UNIFAP).
[4] Biologiste, docteur en maladies topiques, professeur et chercheur du cours d’éducation physique, Université fédérale du Pará (UFPA).
[5] Théologien, docteur en psychanalyse clinique. Il travaille depuis 15 ans avec la Méthodologie Scientifique (Méthode de Recherche) dans l’Orientation de Production Scientifique pour les étudiants en Master et Doctorat. Spécialiste en études de marché et recherche en santé.
[6] Biologiste, docteur en recherche théorique et comportementale, professeur et chercheur du Programme d’études supérieures en éducation professionnelle et technologique (PROFEPT) de l’Institut d’éducation fondamentale, technique et technologique de l’Amapá (IFAP).
Déposée : Juin 2020.
Approuvé : Juin 2020.