ARTICOLO DI RECENSIONE
COELHO, Taiane [1], KERPEL, Raquel [2]
COELHO, Taiane. KERPEL, Rachel. Psicobiotici nel trattamento della depressione: un nuovo sguardo sulla salute mentale – una revisione sistematica della ricerca. Revista Científica Multidisciplinar Núcleo do Conhecimento. Anno. 07, ed. 05, vol. 01, pag. 125-152. Maggio 2022. ISSN: 2448-0959, Link di accesso: https://www.nucleodoconhecimento.com.br/nutrizione/psicobiotici, DOI: 10.32749/nucleodoconhecimento.com.br/nutrizione/psicobiotici
RIEPILOGO
Il Disturbo Depressivo Maggiore (DDM) è un disturbo psichico multifattoriale, convenzionalmente trattato con farmaci antidepressivi. I sintomi causati dalla stessa sintomatologia depressiva e gli effetti collaterali causati dai farmaci sono alcuni dei fattori che interferiscono negativamente nell’aderenza ai trattamenti farmacologici. Attualmente, dopo che i probiotici hanno mostrato effetti psicotropi, il campo scientifico ha intensificato gli sforzi per capire se l’integrazione di probiotici serve come trattamento per i disturbi psichiatrici. Pertanto, il presente studio ha formulato la seguente domanda: gli psicobiotici (probiotici) possono essere indicati come trattamento per il Disturbo Depressivo Maggiore? Obiettivo: rispondere alla domanda guida attraverso una rassegna di studi che integravano la psicobiotica con l’intento di trattare il Disturbo Depressivo Maggiore. Metodologia: per questa revisione è stata progettata una ricerca sistematica, dove, nel mese di settembre 2021, sono state effettuate le ricerche nelle banche dati; Pubmed, Google Scholar e Scielo, utilizzando i descrittori “probiotics AND depression AND dysbiosis” in inglese e portoghese, e filtri per la selezione degli studi pubblicati tra il 2005 e il 2021. Dopo aver selezionato i materiali, i duplicati sono stati gestiti in EndNote e il la qualità metodologica degli studi randomizzati è stata valutata utilizzando lo strumento Risk of Bias-2 (ROB 2). Risultati: c’è stata una preferenza per 10 studi; preclinico (n=4), randomizzato (n=5) e pilota aperto (n=1), che soddisfacevano i criteri di inclusione e mostravano risultati significativi sui punteggi della depressione su scale psichiatriche; dimostrando la diminuzione di anedonia, reattività cognitiva e insonnia nei pazienti con diagnosi di Disturbo Depressivo Maggiore, inoltre, sono stati osservati cambiamenti significativi su fattori che possono essere associati alla patogenesi della depressione, come la disbiosi, e lo stato infiammatorio a fronte di la diminuzione dei biomarcatori infiammatori. Considerazioni finali: secondo la revisione dei dati, alla domanda guida è stata ottenuta la seguente risposta: gli psicobiotici possono essere indicati come trattamento per il Disturbo Depressivo Maggiore. Tuttavia, a causa della necessità di una migliore comprensione dell’asse intestino-cervello e dei meccanismi d’azione degli psicobiotici, l’integrazione è raccomandata come terapia aggiuntiva ai farmaci antidepressivi. Pertanto, dovrebbero essere eseguiti studi con campioni più grandi e periodi di intervento più lunghi.
Parole chiave: Disturbo Depressivo Maggiore, Probiotici, Disbiosi.
1. INTRODUZIONE
Secondo l’Organizzazione Mondiale della Sanità (OMS, 2020) circa 300 milioni di persone nel mondo soffrono di disturbi depressivi. Questo disturbo ha prevalso tra uomini (dal 5 al 12%) e donne (dal 10 al 25%) e occupa il secondo posto nel carico delle malattie che causano più danni in ambito economico, sociale e sanitario (MOTTA; MORÉE; NUNES, 2017; ZALAR; HALSBERGER; PETERLIN, 2018).
Secondo il Manuale diagnostico e statistico dei disturbi mentali-5 (DSM-V), il Disturbo Depressivo Maggiore (DDM) viene diagnosticato quando una persona manifesta almeno 5 dei seguenti sintomi per 2 settimane: umore depresso, anedonia, senso di colpa eccessivo, suicidio ideazione, alterazioni dell’appetito e del sonno, ritardo psicomotorio, mancanza di concentrazione e affaticamento. Tra questi criteri, per essere presi in considerazione per la diagnosi, devono essere presenti anedonia o umore depresso (o entrambi) (BAPTISTA, 2018).
Al momento della diagnosi, l’uso di antidepressivi è considerata la prima opzione di trattamento, tuttavia, dal 30 al 40% dei pazienti non mostra risposte significative, mentre dal 60 al 70% non sperimenta la prevista remissione della malattia (YUAN et al., 2020 ). Inoltre, è anche comune che i pazienti abbandonino i trattamenti farmacologici, a causa di effetti collaterali e difficoltà nel seguire una routine (IBANEZ et al., 2014). Tra le altre ragioni, anche lo stigma sociale, la mancanza di risorse e di professionisti formati sono ostacoli all’adesione al trattamento (OMS, 2020).
Di conseguenza, la ricerca di nuove terapie ha avuto ripercussioni tra i ricercatori, radicando nel linguaggio scientifico il termine “asse intestino-cervello”. I meccanismi di questo asse sono stati ampiamente studiati dopo gli approfondimenti della ricerca che hanno evidenziato che l’intestino e il cervello hanno una comunicazione bidirezionale e una struttura complessa che collega il sistema nervoso centrale al sistema nervoso enterico e a molteplici vie metaboliche, infiammatorie ed endocrine. Pertanto, è presumibile che in questi “percorsi sottostanti” ci siano una serie di fattori da esaminare (KONTUREK; BRZOZOWSKI; KONTUREK, 2011; MAYER, 2011).
Finora si è capito che all’interno di questa comunicazione il microbiota intestinale è uno dei principali fattori intermedi. Questo fatto rende una priorità per il trattamento capire come i microbi intestinali generano segnali su più percorsi. Inoltre, è anche essenziale considerare che esistono disparità nella composizione del microbiota tra individui e in diverse popolazioni cliniche. Pertanto, la modulazione e il trapianto del microbiota vengono discusse alternative per il trattamento di malattie e disturbi psichiatrici (BERCIK; COLLINS; VERDU, 2012; DORÉ et al., 2013; SMITS et al., 2013).
Tuttavia, il microbiota intestinale è complesso e comprende circa 100 trilioni di microrganismi viventi che generano una composizione relativamente stabile per tutta la vita. Questa composizione, sebbene “stabile”, può subire cambiamenti detti “stato di disbiosi”, uno squilibrio spesso associato a una serie di malattie (FORSYTHE et al., 2010; RODRÍGUEZ et al., 2015). Si ritiene che diversi fattori influenzino questo stato (di disbiosi). Secondo David et al. (2014) e Wu et al. (2011) la dieta è una di queste, mentre Goodrich et al. (2014) considerano la genetica, Yatsunenko et al. (2012) età, O’mahony et al. (2009) e Werbner et al. (2019) stress e Markle et al. (2013) l’influenza esercitata da diversi ormoni sessuali.
Di conseguenza, con l’obiettivo di riequilibrare il microbiota, i probiotici sono arrivati ad essere studiati in modo esponenziale. La ricerca ha anche impiegato l’uso di prebiotici, poiché prebiotici e probiotici lavorano in sinergia e ammorbidiscono la presenza di batteri nocivi nell’intestino fornendo importanti aggiustamenti (VARAVALLO; THOMÉ; THESHIMA, 2008; TSAI et al., 2019).
Recentemente, nel campo della psichiatria, anche i probiotici sono diventati oggetto di ricerca dopo che è stato evidenziato che producono “effetti psicotropi”, e per questo sono stati concettualizzati come psicobiotici: “un organismo vivente che, se ingerito in quantità adeguate, produce un beneficio per la salute dei pazienti affetti da malattie psichiatriche” (DINAN; STANTON; CRYAN, 2013; DINAN; CRYAN, 2016).
In vista dell’approfondimento della ricerca sugli psicobiotici, si osserva che gli articoli di revisione hanno riportato più frequentemente studi preclinici, e sono ancora poche le revisioni su studi intervenuti nell’uomo con diagnosi di DDM (BERCIK; COLLINS; VERDU, 2012). ; CRYAN; O’MAHONY, 2011; HUANG; WANG; HU, 2016; LIU; WALSH; SHEEHAN, 2019; YONG et al., 2020). Pertanto, nuove revisioni che analizzano la qualità metodologica degli studi più recenti sono vitali per questa crescente area di ricerca.
Pertanto, il presente studio ha formulato la seguente domanda: gli psicobiotici possono essere indicati come trattamento per il Disturbo Depressivo Maggiore? Pertanto, l’obiettivo è stato determinato: rispondere alla domanda guida attraverso una revisione degli studi che integravano la psicobiotica con l’intenzione di trattare il Disturbo Depressivo Maggiore. Questi supplementi vengono somministrati sia nella forma adiuvante dei farmaci antidepressivi, sia nella forma autonoma (cioè senza che l’integrazione sia combinata con alcun farmaco antidepressivo).
2. MATERIALI E METODI
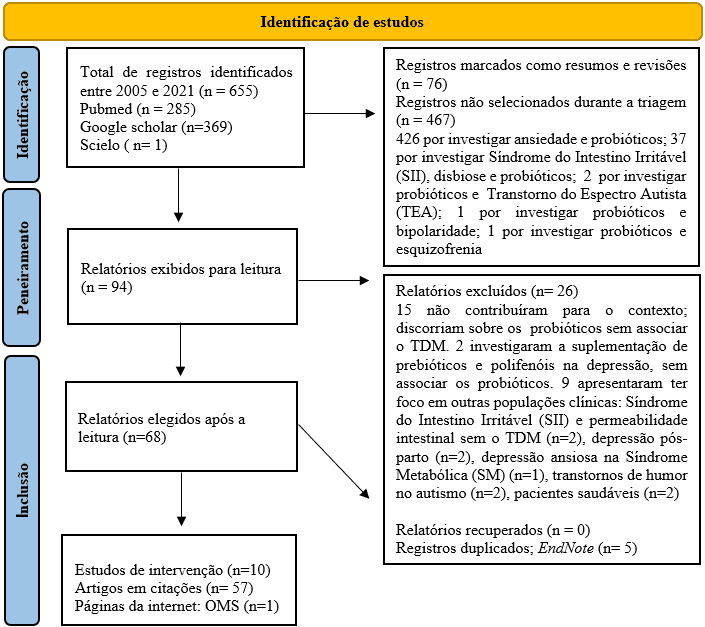
Questa è una revisione di ricerca sistematica (FERENHOF; FERNANDES, 2016). In cui i dati sono stati raccolti dall’inizio alla fine di settembre 2021, attraverso tre banche dati: Pubmed, Google Scholar e Scielo, dove sono stati utilizzati filtri per selezionare gli studi pubblicati tra gli anni 2005 e 2021. 2021, e termini forniti dal Health Science Descriptors (DeCS/MeSH), in inglese: probiotics AND depression, probiotics AND depression AND dysbiosis, e in portoghese: probióticos e depressão, probióticos e depressão e disbiose. Le fasi di questo processo sono state descritte nel diagramma di flusso (Figura 1) di seguito.
Figura 1 – Schema di ricerca del diagramma di flusso (PRSMA 2020)
2.1 DETTAGLI DELLE RICERCHE ED ESTRAZIONE DEI DATI
Dopo le ricerche, sono stati identificati un totale di 655 articoli, di cui 94 sono stati raccolti per la lettura, poiché presentavano informazioni rilevanti. Tra questi, 26 sono stati esclusi, in quanto non hanno contribuito allo sviluppo teorico, e hanno studiato l’uso dei probiotici senza associare il MDD. Infine, sono stati selezionati 68 materiali presentati in portoghese (n=65), inglese (n=2) e spagnolo (n=1). Di questi, 10 studi di intervento hanno contribuito all’estrazione dei dati e 5 di essi (randomizzati) hanno avuto la loro qualità metodologica valutata utilizzando lo strumento Risk of Bias-2 (ROB-2); fornito gratuitamente dall’organizzazione Cochrane. Subito dopo, nel database SCI Journal (Science Journal Impact Factor), è stato verificato l’Impact Factor (IF) delle riviste che hanno pubblicato gli studi selezionati (come mostrato in Tabella 3).
Prima dell’ammissibilità dei 10 studi, sono stati definiti i seguenti criteri di inclusione: presentazione del testo completo, analisi degli effetti della supplementazione di probiotici nell’uomo o nei roditori, di entrambi i sessi, adulti e anziani, con diagnosi di comportamenti depressivi e DDM come DSM- Criteri IV/V, infine, come criteri di non inclusione sono stati definiti: studi che hanno analizzato altri disturbi psichiatrici (esempio: ansia, bipolarità).
3. RISULTATI
Dal punto di vista delle nuove terapie, Logan e Katzman (2005) hanno affermato che la supplementazione di probiotici è una valida proposta di studio, perché, in considerazione della loro ipotesi, la supplementazione fungerà da terapia adiuvante per il MDD, poiché ha la capacità di ridurre le risposte infiammatorie, migliorare lo stato nutrizionale e alleviare lo stress ossidativo.
Studi di intervento sull’uomo e su modelli animali corroborano questa proposta, allo stesso modo in cui gli studi selezionati in questa rassegna hanno mostrato effetti di questa natura. Negli studi preclinici, è stato dimostrato che esiste una correlazione tra disbiosi, permeabilità intestinale e comportamenti depressivi (ARSENEAULT-BRÉARD et al., 2012; LI et al., 2019; QIU et al., 2021). In analisi, si percepisce che questa relazione coinvolge anche i metaboliti derivati dal microbiota e la loro potenziale influenza sulla formazione della serotonina (5-HT); neurotrasmettitore fondamentale per l’omeostasi emotiva. La supplementazione di probiotici nei ratti ha avuto effetti sul microbiota intestinale e ha aumentato i livelli di 5-HT nella corteccia frontale. Questi effetti possono essere un contributo importante poiché la sintomatologia depressiva è correlata a concentrazioni più basse di serotonina in quest’area del cervello (LI et al., 2019). Altri aspetti positivi sono stati osservati anche sull’epitelio intestinale attraverso le proteine Zonulina ed E-caderina, e sullo stato infiammatorio dovuto alla diminuzione delle citochine proinfiammatorie (ARSENEAULT-BRÉARD et al., 2012; QIU et al., 2021) . Oltre agli effetti sulle vie infiammatorie, anche le regolazioni generate sull’espressione dei geni nei recettori del sistema nervoso sembrano contribuire all’effetto antidepressivo durante l’integrazione. La specie L. helveticus MCC1848 si è distinta modulando il pattern delle espressioni geniche (Drd3 e Htr1a) di NAC; area del cervello correlata alla ricompensa, suggerendo il ristabilimento dei sistemi dopaminergico e serotoninergico. Poiché questi risultati sono indicativi del fatto che i probiotici possono contribuire al trattamento, tuttavia, è necessario indagare se questi effetti si verificano anche nell’uomo (MAEHATA et al., 2019).
A sostegno di questa ricerca, Akkasheh et al. (2016) sono stati tra i primi a intervenire sugli esseri umani con diagnosi di DDM e hanno ottenuto risultati positivi sulla scala BDI (Inventario della depressione di Beck) dopo 8 settimane con la supplementazione di Lactobacillus e Bifidobacterium. Tuttavia, in questo studio i probiotici sono stati usati come trattamento aggiuntivo a un farmaco antidepressivo, costituendo una probabilità che gli effetti avrebbero richiesto più di 8 settimane per manifestarsi se non fossero stati integrati con il farmaco, quindi la durata del test dovrebbe essere studiata più da vicino. (ROMIJN et al., 2017).
Al contrario, i ricercatori hanno preso in considerazione l’analisi di diversi ceppi e tempi di intervento. Inoltre, c’è stato un focus sulla co-integrazione di vitamine, minerali e probiotici, specialmente nei cambiamenti di umore (JAMILIAN et al., 2018; OSTADMOHAMMADI et al., 2019). Tuttavia, questa co-supplementazione è ancora scarsa nel DDM, portando a un maggiore interesse per l’integrazione simbiotica, poiché hanno già mostrato effetti positivi sul microbiota e sulla salute mentale di pazienti sani (GHORBANI et al., 2018). Tuttavia, Reininghaus et al. (2020) hanno evidenziato che la co-integrazione di vitamine e simbiotici può essere un percorso interessante per il trattamento della depressione, poiché nei loro risultati sono stati osservati effetti espressivi sulle vie infiammatorie e metaboliche. Secondo gli autori di questo studio, approfondire la ricerca attraverso l’analisi delle vie metaboliche può servire come chiave per una migliore comprensione del decorso delle malattie e dell’interrelazione tra disturbi mentali e processi infiammatori. Come si vede nelle ripercussioni favorevoli sulle scale psichiatriche e sui biomarcatori infiammatori, gli studi selezionati forniscono le basi per migliorare questa prospettiva (CHAHWAN et al., 2019; GHORBANI et al., 2018; MAJEED et al., 2018; REITER et al., 2020; WALLACE; MILEV, 2021).
Di seguito sono presentati i risultati degli studi preclinici (Grafico 1), degli studi randomizzati e degli studi pilota aperti (Grafico 2).
Tabella 1 – Studi che hanno eseguito interventi su modelli animali
| Autore/
anno/paese |
Animali/test | CFU probiotici/durata | Risultati | Gruppi/placebo | Conflitto d’interessi | Limitazioni |
|
Arseneault- Breárd et al. (2012) Canada |
40 Ratti
Sprague-Dawley Nuoto forzato, interazione sociale, evitamento passivo |
Probio’Stick
L . helveticus B . longum 1 miliardo di CFU Diluito in acqua (200 ml) 14 giorni |
↓ Depres-sione
↓ Perme-abilità intestinale ↓ IL-1β citochina ↑ Interazione sociale |
4 gruppi (n=10)
Maltodestrine diluite in acqua (200ml) |
Dichiarato di non contenere |
Chirurgia toracica e infarto del miocardio |
|
Li et al. (2019) Cina |
50 Ratti
Wistar CUMS, nuoto forzato, preferenza per il saccarosio |
B. longum
L.rhamnosus 1 x 10 9 UFC tramite sonda 28 giorni |
↓ Depres-sione
↑ 5 –HT/TPH2 corteccia frontale ↓ Firmicutes e Tenericutes ↑ Controllo del peso |
5 gruppi (n = 10)
Soluzione salina in tubo |
Dichiarato di non contenere |
L’intervento sul microbiota dei modelli di depressione extra non è stato analizzato, sono stati integrati probiotici comuni e nello studio sono state riconosciute solo le firme metaboliche centrali |
| Maehata et al.
(2019) Giappone |
48 Ratti C57BL / 6J (B6) e ICR Interazione sociale, preferenza per il saccarosio, nuoto forzato |
L. helveticus MCC1848 Alla dieta formulata è stato aggiunto il preparato probiotico (AIN93G) 7 giorni |
↓ Anedonia |
3 gruppi (n= 16) Dieta formulata senza il probiotico |
Dichiarato di non contenere |
È stato utilizzato un modello animale che presenta una lieve depressione con meno stress fisico. |
| Qiu et al.(2021)
Cina |
32 Ratti C57BL / 6J Preferenza di saccarosio, nuoto forzato (LPS – iniezione di induzione della depressione) |
Lac L. delbrueckii. subsp. bulgaricus 1 x 10 9 UFC tramite sonda 7 giorni |
↓ Depressione ↓ Disbiosi ↓ Permeabilità intestinale ↓ Super attivazione della microglia ↓ TLR4 e NLRP3 ↓ IL-1β citochina ↑ ZO-1 e E-caderina |
4 gruppi (n=8) Siero fisiologico in provetta |
Dichiarato di non contenere | Nessuna descrizione |
Fonte: elaborazione originale a cura degli autori di questa recensione. Didascalia: ↑ aumentato, ↓ ridotto. Unità formanti colonie CFU, serotonina 5-HT, TPH2 triptofano idrossilasi 2, ZO-1 Zonula Occludens-1.
Tabella 2 – Studi che hanno eseguito interventi sull’uomo
|
Autore/ anno/paese |
Partecipanti/età/ diagnosi/scale | Integrazione CFU/durata/farmaco | Risultati | Gruppi/ placebo |
Conflitto d’interessi | Limitazioni |
|
Ghorbani et al. (2018) Iran |
40 pazienti 18 – 65 anni TD moderatoHAM-D |
Familact H ® Simbiotico
2 capsule/giorno L. casei, L. rhamnosus, L. acidophilus, L. bulgaricus, B. breve, B. longum 6 settimane Droga: (Fluoxetina cloridrato) |
↓ De-pressione | 2 gruppi (n=20)
Stearato |
Dichiarato di non contenere | Piccolo campione, breve periodo di integrazione |
| Majeed et al. (2018)
India |
40 pazienti 20 – 65 anni DDMHAM-D, MADRS, CES-D |
LactoSpore ® 1 capsula/giornoB. coagulans MTCC 5856 (spore) 2 × 109 UFC90 giorniFarmaco: non utilizzato |
↓ De-pressione
↓ Ins-onnia ↓ Sintomi ↓ Mielo-perossidasi |
2 gruppi (n=20)
Pillola identicamente formulata senza il probiotico |
Ha dichiarato che questo lavoro è stato sponsorizzato e supportato da Sabinsa Corporation NJ 08520, USA | Piccolo campione |
| Chahwan et al. (2019) Australia | 71 pazienti
TD luce/da moderata a grave 18 anni + MINI, BDI-II, DASS-21 BAI, LEIDS-R |
Ecologic ® Barrier
2 bustine di polvere/giorno B. bifidum, B. lactis W51, B. lactis W52, L. acidophilus, B. breve, L. casei, L. salvarius, L. lactis, L. lactis W58, 1 × 1010 UFC 8 settimane Farmaco: non utilizzato |
↓ De-pressione
↓ Reattività |
2 gruppi (n=34 probiotici, n=37 placebo)
Amido di mais e maltodestrine |
Dichiarato di non contenere | L’alto tasso di abbandono può essere attribuito alle visite settimanali. Nel post-trial (settimana 9) i partecipanti erano assenti |
|
Reininghaus et al. (2020) Australia |
61 pazienti
18 – 75 anni TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Simbiotico
1 bustina di polvere/giorno B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC D-biotina aggiunta (125 mg) 28 giorni Droga: antidepressivi convenzionali dei partecipanti |
↓ De-pressione
↑ Rego-lazione nel percorso IL-17 ↑ Rego-lazione delle vie metaboliche (KEGG) ↑ R. gauvreauii e Coprococcus |
2 gruppi (n=28 probiotici, n=33 placebo)
bevanda identica senza il probiotico, aggiunta di biotina per ragioni etiche |
Dichiarato di non contenere | Un piccolo campione, i fumatori tra i due gruppi, un breve periodo di integrazione e la dieta ospedaliera potrebbero aver influenzato i risultati. C’era discontinuità; allocazione iniziale (n=82) |
| Reiter et al. (2020) Austria | 61 pazienti
18 – 75 anni DDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Simbiotico 1 bustina di polvere/giornoB. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC4 settimaneDroga: antidepressivi convenzionali dei partecipanti |
↓ De-pressione
↓ IL- 6 citochina |
2 gruppi (n=28 probiotici, n=33 placebo)
Bevanda identica senza il probiotico, aggiunta di biotina per motivi etici |
Dichiarato di non contenere | Gli effetti di diversi farmaci, il breve periodo di integrazione, l’età e la differenza di genere dei partecipanti possono influenzare il microbiota. C’era discontinuità; allocazione iniziale (n=82) |
| Wallace e Milev et al.(2021) Canada |
10 pazienti
18 – 75 anni DDM CAN-BIND, MADRS, QIDS-SR16, SHAPS |
CEREBIOME ® 1 bustina di polvere/giornoB. longum, L. helveticus 3 x 109 UFC8 settimane Farmaco: non utilizzato |
↓ De-pressione
↓ Ane-donia ↑ Qualità del sonno |
Non c’era un gruppo placebo | Dichiarato di non contenere | Piccolo campione, il 70% erano donne, un breve periodo di integrazione e il metodo era non cieco senza il gruppo placebo |
Fonte: elaborazione originale a cura degli autori di questa recensione. Didascalia: ↑ aumentata, ↓ ridotta. Tutti gli studi sull’uomo hanno selezionato entrambi i sessi maschio ♂ e femmina ♀. Unità formanti colonie UFC. Sindrome dell’intestino irritabile IBS. Scale: BAI Inventario dell’ansia di Beck, BDI Inventario della depressione di Beck, CAN-BIND Rete canadese di integrazione dei biomarcatori della depressione, CES-D Scala della depressione del Centro per gli studi epidemiologici, HAM-D Scala di valutazione di Hamilton per la depressione, LEIDS-R Indice di sensibilità alla depressione di Leida – Rivisto, MADRS Scala di valutazione della depressione – Montgamarey – Asberg, MINI Mini Intervista Neuropsichiatrica Internazionale, QIDS-SR16 Inventario rapido della sintomatologia depressiva, SCL-90 Scala di valutazione dei sintomi-90 -R-SCL-Vendicato, SHAPS Scala del piacere di Snaith-Hamilton.
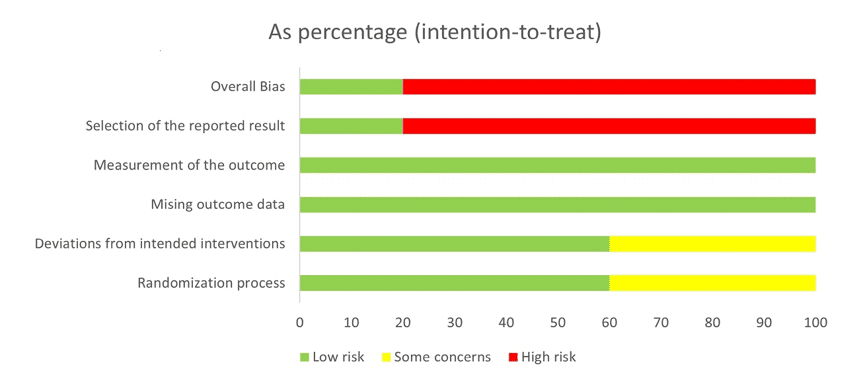
Secondo l’estrazione dei dati, è stata eseguita un’analisi valutativa del rischio di bias degli studi randomizzati in 5 domini dello strumento ROB-2 (Figura 2), risultando nel grafico (Figura 2.1) di seguito.
Figura 2 – Analisi del rischio di bias negli studi randomizzati
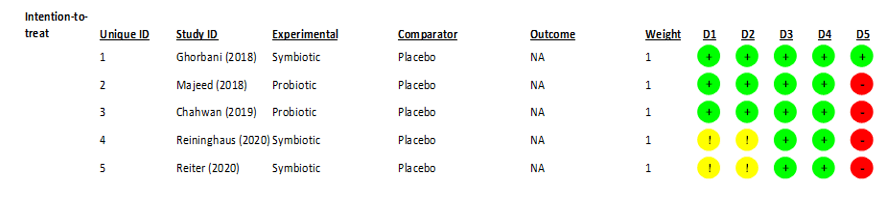
Figura 2.1 – Percentuali di rischio di bias nel grafico
Successivamente, i 10 studi selezionati e i loro interventi (contrassegnati da una X) vengono presentati insieme e in ordine cronologico.
Tabella 3 – Interventi applicati nell’insieme degli studi
| N | Autore/anno | Titolo, rivista/paese, rivista: Fattore d’impatto (FI) | Probiotici | Antidepressivo | Prebiotici | Vitamine | Effetti collaterali |
| I | Arseneault- Breárd et al.(2012) | Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. Canada. Br J Nutr. FI – WSG: 3.334, Indice H: 188, FI – Scopus: 4.105 | X | ||||
| II | Li et al. (2019) |
Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Cina. Neurogastroenterol Motil. FI – WSG: 3,008, Indice H: 42, FI – Scopus: 3,65 | X | X | |||
| III | Maehata et al. (2019) | Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Giappone. Biosci Biotech Bioch. FI – WSG: 1.516, Indice H: 116, FI – Scopus: 1,986 | X |
| IV | Qiu et al.(2021) | Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Cina. Ann Transl Med. FI – WSG: 3.297, Indice H: 48, FI – Scopus: N/D | X | ||||
| V | Ghorbani et al. (2018) | The Effect of Synbiotic as a Adjuvant Therapy to Fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Iran. Arch Neurosci. FI – N/D | X | X | X | X | |
| VI | Majeed et al. (2018) | Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. India. Food Nutr Res. FI – WSG: 0,756, Indice H:24, FI – Scopus:1.259 | X | ||||
| VII | Chahwan et al. (2019) | A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Australia. J Affect Disord. FI – WSG: 3.892, Indice H: 188, FI – Scopus: 5,104 | X | X |
| VIII | Reinin-ghauset al. (2020) | PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression—A Randomized Controlled Trial. Australia. Nutrients. FI – WSG: 4.546 , Indice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| IX | Reiter et al.(2020) | Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Austria. Nutrients. FI – WSG: 4.546 , Indice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| X | Wallace e Milev (2021) | Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Canada. Front Psychiatry. FI – WSG: 4.157, Indice H: N/D, FI – Scopus: 7.864 | X |
Fonte: elaborazione originale a cura degli autori di questa recensione. Didascalia: FI Impact Factor, H Index – Google Scholar, N/A non definito, WSG Web of Science Group.
4. DISCUSSIONE
Secondo l’Organizzazione Mondiale della Sanità (OMS, 2020) il disturbo depressivo è stato presentato come una condizione preoccupante per il 21° secolo, poiché riflette sui crescenti tassi di suicidio. Il campo scientifico ha costantemente ribadito questo argomento, e intensificato gli sforzi per sviluppare nuovi trattamenti che possano contribuire al miglioramento dei sintomi depressivi attraverso la modulazione intestinale (KELLY et al., 2016; YONG et al., 2020).
Tuttavia, in letteratura, predominano gli studi preclinici che integrano gli psicobiotici e ottengono risultati significativi su disbiosi, permeabilità intestinale e neurochimica cerebrale (ARSENEAULT-BRÉARD et al., 2012; CRYAN; O’MAHONY, 2011; LI et al., 2019; MAEHATA et al., 2019; QIU et al., 2021; YONG et al., 2020). Fortunatamente, questo scenario sta cambiando e gli studi sull’uomo sono sempre più incoraggiati, riconoscendo che i probiotici apportano benefici al microbiota e alle molteplici vie endocrine, infiammatorie e neurali. Tuttavia, questa eterogeneità di azione richiede una maggiore comprensione del “microbioma enterico-intestino-cervello” (DINAN; CRYAN, 2016; CRYAN; O’MAHONY, 2011; HEMARAJATA; VERSALOVIC, 2013).
I diversi risultati nei biomarcatori e nei punteggi delle scale psichiatriche corroborano questa affermazione, in quanto chiarisce che i meccanismi d’azione variano a seconda del genere e della specie del probiotico integrato. Ad oggi, i meccanismi più studiati sono i batteri dei generi Lactobacillus e Bifidobacterium, che si sono dimostrati ampiamente sicuri, anche nel trattamento dei disturbi depressivi (IVANOV; HONDA, 2012; VIZCAÍNO et al., 2016; ZAWISTOWSKA-ROJEK; TYSKI, 2018).
Tuttavia, anche la dieta e i fattori nutrizionali hanno valore in questa indagine (DASH et al., 2015; HOLSCHER, 2017; LEDOCHOWSKI et al., 2000; LIU; CAO; ZHANG, 2015; SUZUKI, 2020; SKONIECZNA-ŻYDECKA et al., 2018). Secondo Logan e Katzman (2005), il miglioramento dello stato nutrizionale e la promozione degli effetti anti-infiammatori è eminente per ottenere un maggiore successo nell’alleviare i sintomi depressivi.
In considerazione di ciò, vale la pena notare che la co-supplementazione di un simbiotico e della vitamina B7 (D-biotina) ha mostrato competenze per regolare le vie metaboliche e infiammatorie e favorire il microbiota intestinale dei pazienti con DDM. Inoltre, i risultati di questa co-supplementazione hanno mostrato aumenti delle concentrazioni di Ruminococcus gauvreauii e Coprococcus; che sono prevalentemente legati ad un aumento della qualità della vita, tuttavia, non hanno espresso alcun effetto sulla permeabilità intestinale. Anche così, considerando i risultati, Reininghaus et al. (2020) hanno concluso che esiste un’importante connessione tra qualità della dieta, microbiota intestinale e salute mentale, incoraggiando nuovi studi a includere l’analisi delle vie metaboliche insieme alle indagini sulle vie infiammatorie.
Ad oggi, il maggiore interesse è nella comprensione dell’attività cerebrale e delle risposte infiammatorie nella disbiosi e nei disturbi psichiatrici (LEVY et al., 2017; TILLISCH et al., 2013; TRAN et al., 2019). Si ritiene che le citochine pro-infiammatorie svolgano un ruolo importante nella patogenesi della depressione e, con ciò, l’interleuchina-6 (IL-6) ha acquisito attenzione. Al contrario, le risposte del sistema immunitario sono eseguite a cascata e comprendono un’ampia interazione sistemica, quindi sono necessarie ulteriori indagini sui sottotipi di infiammazione nei diversi gradi di depressione (REITER et al., 2020). Di conseguenza, è essenziale estendere l’analisi ad altri tipi di ceppi probiotici e osservare l’integrità delle risposte immunitarie innate, poiché anche questa è un’interfaccia da esaminare (MAJEED et al., 2018).
Sia la supplementazione prebiotica che quella probiotica hanno dimostrato capacità di agire sull’immunità e su varie malattie (DIDARI et al., 2015; SLAVIN, 2013; VIZCAÍNO et al., 2016; ZALAR; HALSBERGER; PETERLIN, 2018). Pertanto, in questi supplementi, devono essere considerate le disparità del microbiota di ciascun individuo. Ad esempio, nei pazienti depressi si riscontra solitamente il “microbiota depressivo”, con predominanza di batteri del phylum Firmicutes, Bacteroidetes e Actinobacteria. Questa diversità che costituisce il microbiota ha stimolato l’analisi tassonomica di batteri intestinali residenti di diverse popolazioni cliniche al fine di confrontarli e comprenderne le risposte (GOODMAN et al., 2011; NEISH, 2009; SARTOR, 2008; ZHENG et al., 2016).
Alla fine, ci sono studi che espongono le disparità del microbiota durante l’integrazione di probiotici. Chahwan et al. (2019) nel loro studio hanno analizzato le differenze nella composizione del microbiota tra individui con diagnosi di depressione lieve, moderata e grave e hanno mostrato che non vi era alcuna differenza significativa tra loro, mentre nel confronto tra individui non depressi e depressi c’era una predominanza di Ruminococcus gnavus in quelli con diagnosi di depressione grave. In questo studio, sono stati osservati anche effetti collaterali come nausea e sonnolenza durante l’integrazione di Lactobacillus e Bifidobacterium. Come questo, anche un altro studio ha descritto gli effetti collaterali nei soggetti del gruppo placebo e probiotico, nonostante ciò, entrambi gli studi hanno ottenuto una buona aderenza ai trattamenti (CHAHWAN et al., 2019; GHORBANI et al., 2018). Rispetto allo studio di Majeed et al. (2018) L’integrazione di Bacillus coagulans MTCC 5856 non ha causato effetti collaterali e ha attenuato precisamente i sintomi gastrointestinali e l’insonnia dei pazienti con diagnosi di DDM e sindrome dell’intestino irritabile.
Di fronte a questo problema, è importante sottolineare che i sintomi gastrointestinali sono comunemente riportati nei disturbi del microbiota intestinale e nei disturbi psichiatrici. E, quindi, questa relazione ha indirizzato l’attenzione dei ricercatori sull’integrazione dei simbiotici nella salute in generale (CARDING et al., 2015; MAJEED et al., 2018; O’HARA; SHANAHAN, 2006). Infatti, probiotici e simbiotici hanno già mostrato effetti positivi sulla salute mentale, sulle risposte infiammatorie e sui sintomi gastrointestinali legati alla DDM (GHORBANI et al., 2018; MAJEED et al., 2018; REININGHAUS et al., 2020; REITER et al., 2020).
Tuttavia, in questa recensione, gli studi che integravano i simbionti e apportavano benefici ai percorsi infiammatori hanno mantenuto i farmaci psicotropi convenzionali dei partecipanti (REININGHAUS et al., 2020; REITER et al., 2020). Pertanto, dei sei studi sull’uomo, solo tre hanno mostrato gli effetti dei probiotici nella loro forma autonoma, cioè senza l’uso di farmaci (CHAHWAN et al., 2019; MAJEED et al., 2018; WALLACE; MILEV, 2021). Tra questi, uno degli studi più recenti ha analizzato gli effetti dei probiotici in 10 pazienti naive ai farmaci antidepressivi. Pertanto, Wallace e Milev (2021) hanno ottenuto risultati positivi sulla sintomatologia depressiva entro 4-8 settimane, tuttavia, durante la progettazione di questo studio, i partecipanti sono rimasti non ciechi e non c’era un gruppo placebo per il confronto.
Tuttavia, è necessario considerare che, nonostante i risultati, la maggior parte degli studi è indipendente dalla scelta della somministrazione; con o senza farmaci, ha descritto limitazioni e ha presentato rischi di bias. Questo fatto propone nuovi studi con progetti di ricerca meglio progettati e una maggiore comprensione del sistema di comunicazione e risposta dell’asse intestino-cervello. Del resto è possibile che finora la ricerca abbia presentato solo la punta di un “iceberg” che occuperà da tempo il campo scientifico, ma che in un certo senso ha già fatto emergere prospettive promettenti per l’area della psichiatria nutrizionale (GRENHAM et al., 2011; SARRIS et al., 2015).
5. CONSIDERAZIONI FINALI
Secondo la revisione dei dati e le citazioni organizzate in questo studio, è possibile dare un’occhiata alla domanda guida: “gli psicobiotici possono essere indicati come trattamento per il Disturbo Depressivo Maggiore?” E per concludere all’unanimità: gli studi suggeriscono che gli psicobiotici possono essere indicati come trattamento per il Disturbo Depressivo Maggiore, poiché gli effetti psicotropi in cui producono erano efficaci nel ridurre i sintomi depressivi dei pazienti entro 4-8 settimane, come osservato nei risultati delle scale psichiatriche validato per questa analisi.
Oltre alla sintomatologia depressiva, sono stati contestualmente ottimizzati altri importanti fattori di riequilibrio della salute mentale, come la qualità del sonno e la riduzione delle risposte infiammatorie, che sono venuti a emergere all’interno del tema, generando la scienza che una congettura di sguardi da veicolare in modo che questo trattamento possa essere reso possibile. Pertanto, è essenziale considerare gli integratori: che ogni individuo abbia disparità nel proprio microbiota, allo stesso tempo che la composizione del microbiota intestinale è strettamente legata alle risposte infiammatorie. Tuttavia, è possibile che i diversi sottotipi di infiammazione non compaiano nell’analisi di un singolo biomarcatore infiammatorio, essendo, quindi, pertinente assumere queste prospettive per indagini future, poiché la regolazione dello stato infiammatorio ha avuto ripercussioni come uno dei vie di accesso per il sollievo dei sintomi depressivi. Da ciò, a questa linea di pensiero è collegata l’importanza di coprire indagini che valutano le vie infiammatorie e metaboliche a fronte di fattori nutrizionali, poiché, secondo l’evidenza, uno sguardo più approfondito su questo aspetto può essere importante anche per ulteriori discussioni.
Inoltre, il campo scientifico esprime la necessità di una maggiore comprensione dell’asse intestino-cervello e dei meccanismi dei diversi ceppi probiotici, in considerazione di ciò si raccomanda l’integrazione di psicobiotici come terapia adiuvante di farmaci antidepressivi.
Infine, attraverso l’estrazione dei dati, e l’analisi valutativa della qualità metodologica degli studi randomizzati, effettuata in questa rassegna, sono state formalizzate le seguenti linee guida per gli studi successivi: il disegno metodologico deve essere meglio pianificato, in modo che gli studi futuri hanno un minor rischio di bias nei domini: bias generale, selezione dei risultati, deviazioni nell’intervento previsto e processo di randomizzazione. Inoltre, viste le limitazioni descritte, è fondamentale che gli studi futuri eseguano interventi con periodi di prova più lunghi, su campioni più ampi, considerando l’integrazione di psicobiotici in forma coadiuvante e autonoma, in modo che sia possibile distinguere gli effetti di probiotici e gli effetti degli antidepressivi. Perché, visto il miglioramento degli studi, è probabile che si accendano più luci all’interno delle discussioni sulla salute mentale, e così, le conoscenze finora ottenute sull’asse intestino-cervello diventeranno sempre più chiare.
RIFERIMENTI
AKKASHEH, Ghodarz et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition, Estados Unidos, vol. 32, n.3, p.315-20, mar. 2016. Disponível em: doi:10.1016/j.nut.2015.09.003 Acesso em: 01/09/2021.
ARSENEAULT-BRÉARD, Jessica et al. Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. The British Journal of Nutrition, Canadá, vol. 107, n. 12, p. 1793-9, jun. 2012. Disponível em: doi:10.1017/S0007114511005137 Acesso em: 13/09/2021.
BAPTISTA, Makilim Nunes. Avaliando “depressões”: dos critérios diagnósticos às escalas psicométricas. Avaliação Psicológica, Brasil, vol. 17, n. 3, p. 301-310, set. 2018. Disponível em: http://dx.doi.org/10.15689/ap.2018.1703.14265.03 Acesso em: 01/09/2021.
BERCIK, P.; COLLINS, S.M.; VERDU, E.F. Microbes and the gut-brain axis. Neurogastroenterol Motil, Canadá, vol. 24, n.5, p. 405-13, mai. 2012. Disponível em: https://doi.org/10.1111/j.1365-2982.2012.01906.x Acesso em: 01/09/2021.
CARDING, Simon et al. Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, Reino Unido, vol. 26, p. 26191, fev. 2015. Disponível em: doi: 10.3402/mehd.v26.26191 Acesso em: 02/09/2021.
CHAHWAN, Bahia et al. Gut feelings: A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Journal of Affective Disorders, Austrália, vol. 253, p. 317-326, jun. 2019. Disponível em: doi:10.1016/j.jad.2019.04.097 Acesso em: 13/09/2021.
CRYAN, J. F.; O’MAHONY, S. M. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterology and Motility, Irlanda, vol. 23, n.3, p. 187-92, mar. 2011. Disponível em: doi:10.1111/j.1365-2982.2010.01664.x Acesso em: 01/09/2021.
DASH, Sarah et al. The gut microbiome and diet in psychiatry: focus on depression. Current Opinion in Psychiatry, Austrália, vol. 28,1, n. 1, p. 1-6, jan. 2015. Disponível em: doi:10.1097/YCO.0000000000000117 Acesso: 02/09/2021.
DAVID, Lawrence A., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature, Estados Unidos, vol. 505, n. 7484 p. 559-63, jan. 2014. Disponível em: doi:10.1038/nature12820 Acesso em: 01/09/2021.
DIDARI, Tina et al. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World Journal of Gastroenterology, Irã, vol. 21, n. 10, p. 3072-84, mar. 2015. Disponível em: doi:10.3748/wjg.v21.i10.3072 Acesso em: 02/09/2021.
DINAN, Timothy G.; STANTON, Catarina; CRYAN, John F. Psychobiotics: a novel class of psychotropic. Biological Psychiatry, Irlanda, vol. 74, n. 10, p. 720-6, nov. 2013. Disponível em: doi:10.1016/j.biopsych.2013.05.001 Acesso em: 01/09/2021.
DINAN, Timothy G.; CRYAN, John F. Mood by microbe: towards clinical translation. Genome Medicine, Irlanda, vol. 8, n. 1, p. 36, abr. 2016. Disponível em: doi:10.1186/s13073-016-0292-1 Acesso em: 01/09/2021.
DORÉ, Joël et al. Hot topics in gut microbiota. United European Gastroenterol J, França, vol. 1, n. 5, p. 311-318, out. 2013. Disponível em: doi:10.1177/2050640613502477 Acesso em: 01/09/2021.
FERENHOF, Helio Aisenberg; FERNANDES, Roberto Fabiano. Desmistificando a revisão de literatura como base para redação científica: método SSF. Revista ACB; Biblioteconomia em Santa Catarina – SC, Florianópolis, Brasil, vol. 21, n. 3, p. 550-563, ago./nov. 2016. Disponível em: file:///C:/Users/Usuario/Downloads/1194-6369-1-PB.pdf Acesso em: 01/09/2021.
FORSYTHE, Paul et al. Mood and gut feelings. Brain, Behavior, and Immunity, Canadá, vol. 24, n. 1, p. 9-16, jan. 2010. Disponível em: doi:10.1016/j.bbi.2009.05.058 Acesso em: 01/09/2021.
GHORBANI, Zeinab et al. The Effect of symbiotic as an Adjuvant Therapy to fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Arch Neurosci, Irã, vol. 5, n.2, p.60507, abr. 2018. Disponível em: doi: 10.5812/archneurosci.60507 Acesso em: 13/09/2021.
GOODMAN, Andrew L., et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proceedings of the National Academy of Sciences of the United States of America, Estados Unidos, vol. 108, n.15, p. 6252-7. abr. 2011. Disponível em: doi:10.1073/pnas.1102938108 Acesso em: 01/09/2021.
GOODRICH, Julia K., et al. Human genetics shape the gut microbiome. Cell, Estados Unidos, vol. 159, n. 4, p. 789-99, nov. 2014. Disponível em: doi:10.1016/j.cell.2014.09.053 Acesso em: 01/09/2021.
GRENHAM, Sue et al Brain-gut-microbe communication in health and disease. Front Physiol, Irlanda, vol. 2 p. 94, dez. 2011. Disponível em: https://doi.org/10.3389/fphys.2011.00094 Acesso em: 01/09/2021.
HEMARAJATA, Peera; VERSALOVIC, James. Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation. Therapeutic Advances in Gastroenterology, Estados Unidos, vol. 6, n. 1, p. 39-51. jan. 2013. Disponível em: doi:10.1177/1756283X12459294 Acesso em: 02/09/2021.
HOLSCHER, Hannah D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, Estados Unidos, vol. 8, n. 2, p. 172-184, mar. 2017. Disponível em: doi:10.1080/19490976.2017.1290756 Acesso em: 02/09/2021.
HUANG, Ruixue; WANG, Ke; HU, Jianan. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients, China, vol. 8, n. 8, p. 483, ago. 2016. Disponível em: https://doi.org/10.3390/nu8080483 Acesso em: 01/09/2021.
IBANEZ, Grazielle et al. Adesão e dificuldades relacionadas ao tratamento medicamentoso em pacientes com depressão. Rev Bras Enferm, Brasil, vol. 67, n. 4, p. 556-562, ago. 2014. Disponível em: https://doi.org/10.1590/0034-7167.2014670409 Acesso em: 01/09/2021.
IVANOV, Ivaylo I; HONDA, Quênia. Intestinal commensal microbes as immune modulators. Cell host & microbe, Estados Unidos, vol. 12, n. 4, p. 496-508, out. 2012. Disponível em: https://doi.org/10.1016/j.chom.2012.09.009 Acesso em: 02/09/2021.
JAMILIAN, Mehri et al. The effects of probiotic and selenium co-supplementation on parameters of mental health, hormonal profiles, and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 11, n. 1, p. 80, set. 2018. Disponível em: https://doi.org/10.1186/s13048-018-0457-1 Acesso em: 01/09/2021.
KELLY, John R., et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research, Irlanda, vol. 82, p. 109-118, nov. 2016. Disponível em: https://doi.org/10.1016/j.jpsychires.2016.07.019 Acesso em: 02/09/2021.
KONTUREK, Peter C.; BRZOZOWSKI, T.; KONTUREK, S. J. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. Journal of Physiology and Pharmacology, Alemanha, vol. 62, n. 6, p. 591-599, dez. 2011. Disponível em: https://www.jpp.krakow.pl/journal/archive/12_11/pdf/591_12_11_article.pdf Acesso em: 01/09/2021.
LEDOCHOWSKI, M., et al. Carbohydrate malabsorption syndromes and early signs of mental depression in females. Digestive Diseases and Sciences, Áustria, vol. 45, n. 7, p. 1255-9, jul. 2000. Disponível em: doi:10.1023/a:1005527230346 Acesso em: 02/09/2021.
LEVY, Maayan et al. Dysbiosis and the immune system. Nature Reviews. Immunology, Israel, vol. 17, n. 4, p. 219-232, mar. 2017. Disponível em: doi:10.1038/nri.2017.7 Acesso em: 02/09/2021.
LI, Huawei et al. Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Neurogastroenterol Motil, China, vol. 31, n. 10, p. 13677, jul. 2019. Disponível em: doi: 10.1111/nmo.13677 Acesso em: 13/09/2021.
LIU, Richard T.; WALSH, Rachel F.L.; SHEEHAN, Ana E. Prebiotics and probiotics for depression and anxiety: A systematic review and meta-analysis of controlled clinical trials. Neurosci Biobehav Rev, Estados Unidos, vol. 102, p. 13-23, abr. 2019. Disponível em: doi:10.1016/j.neubiorev.2019.03.023 Acesso em: 01/09/2021.
LIU, Xiaofei; CAO, Shangqing; ZHANG, Xuewu. Modulation of Gut Microbiota-Brain Axis by Probiotics, Prebiotics, and Diet. J Agric Food Chem, China, vol. 63, n. 36, p. 7885-7895, set. 2015. Disponível em: doi:10.1021/acs.jafc.5b02404 Acesso em: 02/09/2021.
LOGAN, Alan C.; KATZMAN Martin. Major depressive disorder: probiotics may be an adjuvant therapy. Med Hypotheses, Estados Unidos, vol. 64, n. 3, p. 533-538, out. 2005. Disponível em: doi:10.1016/j.mehy.2004.08.019 Acesso em: 02/09/2021.
MAEHATA, Hazuki et al. Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Bioscience, Biotechnology, and Biochemistry, Japão, vol. 83, n. 7 p. 1239-1247, mar. 2019. Disponível em: doi:10.1080/09168451.2019.1591263 Acesso em: 13/09/2021.
MAJEED, Muhammed et al. Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Food & Nutrition Research, Índia, vol. 62, jul. 2018. Disponível em: doi:10.29219/fnr.v62.1218 Acesso em: 13/09/2021.
MARKLE, Janet G. M., et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science, Canadá, vol. 339, n. 6123, p. 1084-8, jan. 2013. Disponível em: doi: 10.1126/science.1233521 Acesso em: 01/09/2021.
MAYER, Emeran A. Gut feelings: the emerging biology of gut-brain communication. Nature Reviews. Neuroscience, Estados Unidos, vol. 12, n. 8, p. 453-66, jul. 2011, Disponível em: doi:10.1038/nrn3071 Acesso em: 01/09/2021.
MOTTA, Cibele Cunha Lima; MORÉE, Carmen Leontina Ojeda Ocampo; NUNES, Carlos Henrique Sancineto da Silva. O atendimento psicológico ao paciente com diagnóstico de depressão na Atenção Básica. Cienc Saúde Colet, Brasil, vol. 22, n. 3, p. 911-920, mar. 2017. Disponível em: https://doi.org/10.1590/1413-81232017223.27982015 Acesso em: 01/09/2021.
NEISH, Andrew S. Microbes in gastrointestinal health and disease. Gastroenterologia, Estados Unidos. vol. 136, n. 1, p. 65-80, jan. 2009. Disponível em: doi:10.1053/j.gastro.2008.10.080 Acesso em: 02/09/2021.
O’HARA, Ann M.; SHANAHAN, Fergus. The gut flora as a forgotten organ. EMBO Reports, Irlanda, vol. 7, n. 7, p. 688-93, jul. 2006. Disponível em: doi:10.1038/sj.embor.7400731 Acesso em: 02/09/2021.
O’MAHONY, Siobhain M., et al. Early life stress alters behavior, immunity, and microbiota in rats: implications for irritable bowel syndrome and psychiatric illnesses. Biological Psychiatry, Irlanda, vol. 65, n. 3, p. 263-7, fev. 2009. Disponível em: doi:10.1016/j.biopsych.2008.06.026 Acesso em: 02/09/2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE (OPAS/OMS). Folha Informativa – Depressão. (Brasil, 2020). Disponível em: https://www.paho.org/pt/topicos/depressao Acesso em: 01/09/2021.
OSTADMOHAMMADI, Vahidreza et al. Vitamin D and probiotic co-supplementation affects mental health, hormonal, inflammatory and oxidative stress parameters in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 12, n. 1, p. 5, jan. 2019. Disponível em: doi:10.1186/s13048-019-0480-x Acesso em: 02/09/2021.
QIU, Xiangjie et al. Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Annals of Translational Medicine, China, vol. 9, n. 5 p. 366, mar. 2021. Disponível em: doi:10.21037/atm-20-4411 Acesso em: 13/09/2021.
REININGHAUS, Eva Z., et al. PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression-A Randomized Controlled Trial. Nutrients, Áustria, vol. 12, n. 11, p. 3422, nov. 2020. Disponível em: doi:10.3390/nu12113422 Acesso em:13/09/2021.
REITER, Alexandra et al. Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Nutrients, Áustria, vol. 12, n. 9, p. 2575, ago. 2020. Disponível em: doi:10.3390/nu12092575 Acesso em: 13/09/2021.
RODRÍGUEZ, Juan Miguel et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microbial Ecology in Health and Disease, Espanha, vol. 26, n. 26050, fev. 2015. Disponível em: doi:10.3402/mehd.v26.26050 Acesso em: 01/09/2021.
ROMIJN, Amy R., et al. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. The Australian and New Zealand Journal of Psychiatry, Nova Zelândia, vol. 51, n. 8, p. 810-821, ago. 2017. Disponível em: doi:10.1177/0004867416686694 Acesso em: 01/09/2021.
SARRIS, Jerome et al. Nutritional medicine as mainstream in psychiatry. The Lancet. Psychiatry, Estados Unidos, vol. 2, n. 3, p. 271-4, fev. 2015. Disponível em: doi:10.1016/S2215-0366(14)00051-0 Acesso em: 02/09/2021.
SKONIECZNA-ŻYDECKA, Karolina et al. Faecal Short Chain Fatty Acids Profile is Changed in Polish Depressive Women. Nutrients, Polônia, vol. 10, n. 12, p. 1939, dez. 2018. Disponível em: doi:10.3390/nu10121939 Acesso em: 02/09/2021.
SLAVIN, Joanne. Fiber and prebiotics: mechanisms and health benefits. Nutrients, Estados Unidos, vol. 5, n. 4, p. 1417-35, abr. 2013. Disponível em: doi:10.3390/nu5041417 Acesso em: 02/09/2021.
SMITS, Loek P., et al. Therapeutic potential of fecal microbiota transplantation. Gastroenterology, Holanda, vol. 145, n. 5, p. 946-53, set. 2013. Disponível em: doi:10.1053/j.gastro.2013.08.058 Acesso em: 02/09/2021.
SARTOR, R Balfour. Microbial influences in inflammatory bowel diseases. Gastroenterology, Estados Unidos, vol. 134, n. 2, p. 577-94, fev. 2008. Disponível em: doi:10.1053/j.gastro.2007.11.059 Acesso em: 02/09/2021.
SUZUKI, Takuya. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Animal Science Journal Nihon Chikusan Gakkaiho, Japão, vol. 91, n. 1, p. 13357, dez. 2020. Disponível em: doi:10.1111/asj.13357 Acesso em: 02/09/2021.
TILLISCH, Kirsten et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, Estados Unidos, vol. 144, n. 7, p. 1394-401; 1401.e1-4, mar. 2013. Disponível em: doi:10.1053/j.gastro.2013.02.043 Acesso em: 02/09/2021.
TRAN, Nhan et al. The gut-brain relationship: Investigating the effect of multispecies probiotics on anxiety in a randomized placebo-controlled trial of healthy young adults. Journal of Affective Disorders, Estados Unidos, vol. 252, p. 271-277, abr. 2019. Disponível em: doi:10.1016/j.jad.2019.04.043 Acesso em: 02/09/2021.
TSAI, Yu-Ling et al. Probiotics, prebiotics and amelioration of diseases. Journal of Biomedical Science, Taiwan, vol. 26, n. 1, p. 3, jan. 2019. Disponível em: doi:10.1186/s12929-018-0493-6 Acesso em: 01/09/2021.
VARAVALLO, Maurilio Antonio; THOMÉ, Julia Nigro; TESHIMA, Elisa. Aplicação de bactérias probióticas para profilaxia e tratamento de doenças gastrointestinais. Semina: Cienc Biol Saúde, Brasil, vol. 29, n. 1, p. 83-104, jun. 2008. Disponível em: http://dx.doi.org/10.5433/1679-0367.2008v29n1p83 Acesso em: 01/09/2021.
VIZCAÍNO, Ricnia et al. Usos clínicos de los probióticos. Arch Venez Pueric Pediatr, Venezuela, vol. 79, n. 1, p. 029-040, mar. 2016. Disponível em: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S000406492016000100007&lng=es&nrm=iso Acesso em: 01/09/2021.
WALLACE, Caroline J. K.; MILEV, Roumen V. The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Front Psychiatry, Canadá, vol. 12 p. 618279, fev. 2021. Disponível em: doi: 10.3389/fpsyt.2021.618279 Acesso em: 13/09/2021.
WERBNER, Michal et al. Social-Stress-Responsive Microbiota Induces Stimulation of Self-Reactive Effector T Helper Cells. MSystems, Israel, vol. 4, n. 4, p. 00292-18, mai. 2019. Disponível em: doi:10.1128/mSystems.00292-18 Acesso em: 01/09/2021.
WU, Gary D., et al. Linking long-term dietary patterns with gut microbial enterotypes. Science, Estados Unidos, vol. 334, n. 6052, p. 105-8, set. 2011. Disponível em: doi:10.1126/science.1208344 Acesso em: 01/09/2021.
YATSUNENKO, Tanya et al. Human gut microbiome viewed across age and geography. Nature, Estados Unidos, vol. 486, n. 7402, p. 222-7, mai. 2012. Disponível em: doi:10.1038/nature11053 Acesso em: 02/09/2021.
YONG, Shin Jie et al. Antidepressive Mechanisms of Probiotics and Their Therapeutic Potential. Frontiers in Neuroscience, Malásia, vol. 13, p. 1361, jan. 2020. Disponível em: doi:10.3389/fnins.2019.01361 Acesso em: 01/09/2021.
YUAN, Ziqi et al. Application of antidepressants in depression: A systematic review and meta-analysis. Journal of Clinical Neuroscience, China, vol. 80, p. 169-181, ago. 2020. Disponível em: doi:10.1016/j.jocn.2020.08.013 Acesso em: 01/09/2021.
ZALAR, Bojan; HALSBERGER, Alexandre; PETERLIN, Borut. The Role of Microbiota in Depression – a brief review. Psychiatria Danubina, Eslovênia, vol. 30, n. 2, p. 136-141, jun. 2018. Disponível em: doi:10.24869/psyd.2018.136 Acesso em: 01/09/2021.
ZAWISTOWSKA-ROJEK, Anna; TYSKI, Stefan. Are Probiotic Really Safe for Humans? Polish Journal of Microbiology, Polônia, vol. 67, n. 3, p. 251-258, set. 2018. Disponível em: doi:10.21307/pjm-2018-044 Acesso em: 02/09/2021.
ZHENG, P., et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Molecular Psychiatry, China, vol. 21, n. 6, p. 786-96, jun. 2016. Disponível em: doi:10.1038/mp.2016.44 Acesso em: 02/09/2021.
[1] Laureato in Nutrizione; Certificazione in Psichiatria Nutrizionale (INCCOR-RJ). ORCID: 0000-0002-1588-5679.
[2] Consulente. Laureato in nutrizione; Dottorato di ricerca in salute collettiva; Master in metabolismo e dietetica; Professore nel campo della nutrizione. ORCID: 0000-0002-7556-2548.
Inviato: Marzo 2022.
Approvato: Maggio 2022.