ARTICLE DE REVUE
COELHO, Taiane [1], KERPEL, Raquel [2]
COELHO, Taiane. KERPEL, Rachel. Psychobiotiques dans le traitement de la dépression : un nouveau regard sur la santé mentale – une revue de recherche systématique. Revista Científica Multidisciplinar Núcleo do Conhecimento. An. 07, éd. 05, Vol. 01, p. 125-152. Mai 2022. ISSN : 2448-0959, Lien d’accès : https://www.nucleodoconhecimento.com.br/nutrition-fr/psychobiotiques, DOI : 10.32749/nucleodoconhecimento.com.br/nutrition-fr/psychobiotiques
RÉSUMÉ
Le trouble dépressif majeur (TDM) est un trouble psychique multifactoriel, traité classiquement par des médicaments antidépresseurs. Les symptômes causés par la symptomatologie dépressive elle-même et les effets secondaires causés par les médicaments sont quelques-uns des facteurs qui interfèrent négativement dans l’adhésion aux traitements pharmacologiques. Actuellement, après que les probiotiques ont montré des effets psychotropes, le domaine scientifique a intensifié ses efforts pour comprendre si la supplémentation en probiotiques sert de traitement pour les troubles psychiatriques. Par conséquent, la présente étude a formulé la question suivante : les psychobiotiques (probiotiques) peuvent-ils être considérés comme un traitement du trouble dépressif majeur ? Objectif : répondre à la question directrice en passant en revue les études qui ont complété les psychobiotiques dans le but de traiter le trouble dépressif majeur. Méthodologie : pour cette revue, une recherche systématique a été conçue, où, au cours du mois de septembre 2021, les recherches ont eu lieu dans les bases de données ; Pubmed, Google Scholar et Scielo, en utilisant les descripteurs « probiotics AND depression AND dysbiosis » en anglais et en portugais, et des filtres pour la sélection des études publiées entre 2005 et 2021. Après sélection des matériaux, les doublons ont été gérés dans EndNote, et le la qualité méthodologique des essais randomisés a été évaluée à l’aide de l’outil Risk of Bias-2 (ROB 2). Résultats : il y avait une préférence pour 10 études ; préclinique (n = 4), randomisée (n = 5) et pilote ouvert (n = 1), qui répondaient aux critères d’inclusion et ont montré des résultats significatifs sur les scores de dépression sur des échelles psychiatriques ; démontrant la diminution de l’anhédonie, de la réactivité cognitive et de l’insomnie chez les patients diagnostiqués avec un trouble dépressif majeur, en outre, des changements significatifs ont été observés sur des facteurs pouvant être associés à la pathogenèse de la dépression, tels que la dysbiose, et l’état inflammatoire face à la diminution des biomarqueurs inflammatoires. Considérations finales : selon l’examen des données, la réponse suivante a été obtenue pour la question directrice : les psychobiotiques peuvent être désignés comme un traitement du trouble dépressif majeur. Cependant, en raison de la nécessité de mieux comprendre l’axe intestin-cerveau et les mécanismes d’action des psychobiotiques, la supplémentation est recommandée comme traitement d’appoint aux antidépresseurs. Par conséquent, des études avec des échantillons plus importants et des périodes d’intervention plus longues doivent être réalisées.
Mots clés : Trouble dépressif majeur, Probiotiques, Dysbiose.
1. INTRODUCTION
Selon l’Organisation mondiale de la santé (OMS, 2020), environ 300 millions de personnes souffrent de troubles dépressifs dans le monde. Ce trouble prévaut chez les hommes (5 à 12 %) et les femmes (10 à 25 %), et occupe la deuxième place dans le fardeau des maladies qui causent le plus de dégâts dans la sphère économique et sociale, et dans le domaine de la santé (MOTTA ; MORÉE ; NUNES, 2017 ; ZALAR ; HALSBERGER ; PETERLIN, 2018).
Selon le Manuel diagnostique et statistique des troubles mentaux-5 (DSM-V), le trouble dépressif majeur (TDM) est diagnostiqué lorsqu’une personne éprouve au moins 5 des symptômes suivants pendant 2 semaines : humeur dépressive, anhédonie, culpabilité excessive, tendances suicidaires idéation, modifications de l’appétit et du sommeil, retard psychomoteur, manque de concentration et fatigue. Parmi ces critères, l’anhédonie ou l’humeur dépressive (ou les deux) doivent être présentes pour être envisagées pour le diagnostic.
Lors du diagnostic, l’utilisation d’antidépresseurs est considérée comme la première option de traitement, cependant, 30 à 40% des patients ne présentent pas de réponses significatives, tandis que 60 à 70% ne connaissent pas la rémission attendue de la maladie (YUAN et al., 2020 ). De plus, il est également courant que les patients abandonnent les traitements pharmacologiques, en raison d’effets secondaires et de difficultés à suivre une routine (IBANEZ et al., 2014). Entre autres raisons, la stigmatisation sociale, le manque de ressources et de professionnels formés sont également des obstacles à l’observance du traitement (OMS, 2020).
En conséquence, la recherche de nouvelles thérapies a eu des répercussions parmi les chercheurs, enracinant le terme « axe intestin-cerveau » dans le langage scientifique. Les mécanismes de cet axe ont été largement étudiés après des insights de recherches qui ont mis en évidence que l’intestin et le cerveau ont une communication bidirectionnelle et une structure complexe qui relie le système nerveux central au système nerveux entérique et à de multiples voies métaboliques, inflammatoires et endocriniennes. Par conséquent, on peut supposer que dans ces « voies sous-jacentes », il y a un certain nombre de facteurs à examiner (KONTUREK ; BRZOZOWSKI ; KONTUREK, 2011 ; MAYER, 2011).
Jusqu’à présent, il est entendu qu’au sein de cette communication, le microbiote intestinal est l’un des principaux facteurs intermédiaires. Ce fait en fait une priorité pour le traitement de comprendre comment les microbes intestinaux génèrent une signalisation sur plusieurs voies. De plus, il est également essentiel de considérer qu’il existe des disparités dans la composition du microbiote entre les individus et dans les différentes populations cliniques. Ainsi, moduler et transplanter le microbiote sont des alternatives discutées pour le traitement des maladies et troubles psychiatriques (BERCIK ; COLLINS ; VERDU, 2012 ; DORÉ et al., 2013 ; SMITS et al., 2013).
Cependant, le microbiote intestinal est complexe, comprenant environ 100 billions de micro-organismes vivants qui génèrent une composition relativement stable tout au long de la vie. Cette composition, bien que « stable », peut subir des modifications appelées « état de dysbiose », un déséquilibre souvent associé à un certain nombre de maladies (FORSYTHE et al., 2010 ; RODRÍGUEZ et al., 2015). Plusieurs facteurs sont considérés comme influençant cet état (de dysbiose). Selon David et al. (2014) et Wu et al. (2011) le régime alimentaire en fait partie, tandis que Goodrich et al. (2014) considèrent la génétique, Yatsunenko et al. (2012) âge, O’mahony et al. (2009) et Werbner et al. (2019) stress, et Markle et al. (2013) l’influence exercée par différentes hormones sexuelles.
Dès lors, dans le but de rééquilibrer le microbiote, les probiotiques sont étudiés de manière exponentielle. La recherche a également utilisé l’utilisation de prébiotiques, car les prébiotiques et les probiotiques agissent en synergie et atténuent la présence de bactéries nocives dans l’intestin, apportant des ajustements importants (VARAVALLO ; THOMÉ ; THESHIMA, 2008 ; TSAI et al., 2019).
Récemment, dans le domaine de la psychiatrie, les probiotiques sont également devenus la cible de recherches après qu’il a été mis en évidence qu’ils produisaient des « effets psychotropes », et pour cette raison ils ont été conceptualisés comme des psychobiotiques : « un organisme vivant qui, lorsqu’il est ingéré en quantités adéquates, produit un bénéfice pour la santé des patients souffrant de maladies psychiatriques » (DINAN ; STANTON ; CRYAN, 2013 ; DINAN ; CRYAN, 2016).
Au vu de l’approfondissement de la recherche de psychobiotiques, on observe que les articles de revue ont plus fréquemment rapporté des études précliniques, et il existe encore peu de revues d’études intervenues chez l’homme diagnostiqué TDM (BERCIK ; COLLINS ; VERDU, 2012) ; CRYAN ; O’MAHONY, 2011 ; HUANG ; WANG ; HU, 2016 ; LIU ; WALSH ; SHEEHAN, 2019 ; YONG et al., 2020). Ainsi, de nouvelles revues analysant la qualité méthodologique des études les plus récentes sont vitales pour ce domaine de recherche en plein essor.
Par conséquent, la présente étude a formulé la question suivante : les psychobiotiques peuvent-ils être considérés comme un traitement du trouble dépressif majeur ? Par conséquent, l’objectif a été déterminé : répondre à la question directrice par un examen des études qui ont complété les psychobiotiques dans le but de traiter le trouble dépressif majeur. Ces compléments sont administrés à la fois sous forme adjuvante d’antidépresseurs, et sous forme autonome (c’est-à-dire sans que la supplémentation ne soit associée à un quelconque médicament antidépresseur).
2. MATÉRIELS ET MÉTHODES
Il s’agit d’une revue de recherche systématique (FERENHOF ; FERNANDES, 2016). Dans laquelle, des données ont été collectées du début à la fin septembre 2021, à travers trois bases de données : Pubmed, Google Scholar et Scielo, où des filtres ont été utilisés pour sélectionner les études publiées entre les années 2005 et 2021, et les termes fournis par le Health Science Descriptors (DeCS/MeSH), en anglais : “probiotics AND depression, probiotics AND depression AND dysbiosis”, et en portugais : “probióticos e depressão, probióticos e depressão e disbiose”. Les étapes de ce processus ont été décrites dans l’organigramme (Figure 1) ci-dessous.
Figure 1 – Conception de recherche d’organigramme (PRISMA 2020)
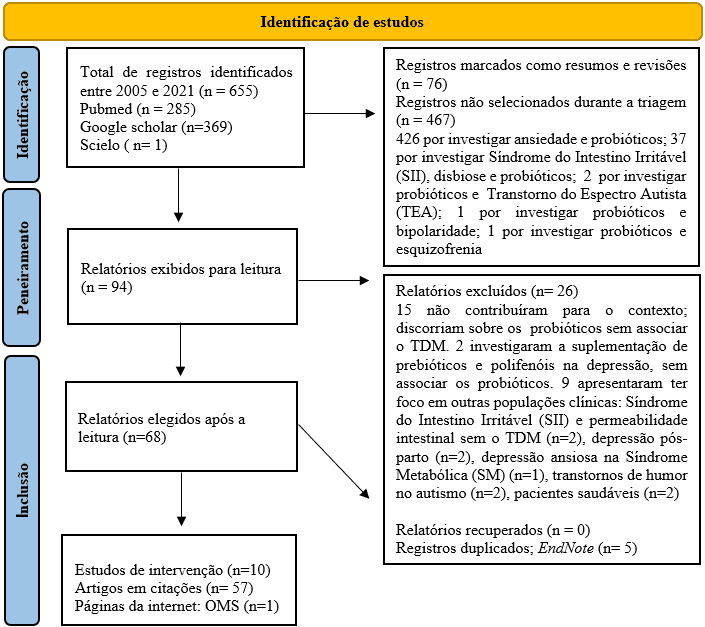
2.1 DÉTAILS DES RECHERCHES ET DE L’EXTRACTION DES DONNÉES
Après les recherches, un total de 655 articles ont été identifiés, dont 94 ont été collectés pour être lus, car ils présentaient des informations pertinentes. Parmi eux, 26 ont été exclus, car n’ayant pas contribué au développement théorique, et ont enquêté sur l’utilisation de probiotiques sans associer de Trouble dépressif majeur. Enfin, 68 documents présentés en portugais (n=65), anglais (n=2) et espagnol (n=1) ont été sélectionnés. Parmi celles-ci, 10 études d’intervention ont contribué à l’extraction des données, et 5 d’entre elles (randomisées) ont vu leur qualité méthodologique évaluée à l’aide de l’outil Risk of Bias-2 (ROB-2) ; fourni gratuitement par l’organisation Cochrane. Peu de temps après, dans la base de données SCI Journal (Science Journal Impact Factor), le facteur d’impact (FI) des revues ayant publié les études sélectionnées a été vérifié (comme indiqué dans le tableau 3).
Avant l’éligibilité des 10 études, les critères d’inclusion suivants ont été définis : présentation du texte intégral, analyse des effets de la supplémentation en probiotiques chez l’homme ou les rongeurs, des deux sexes, adultes et personnes âgées, diagnostiqués avec des comportements dépressifs, et TDM comme le DSM- Des critères IV/V, enfin, comme critères de non inclusion ont été définis : études ayant analysé d’autres troubles psychiatriques (exemple : anxiété, bipolarité).
3. RÉSULTATS
Du point de vue des nouvelles thérapies, Logan et Katzman (2005) ont déclaré que la supplémentation en probiotiques est une proposition valable pour les études, car, compte tenu de leur hypothèse, la supplémentation servira de thérapie adjuvante pour le trouble dépressif majeur, car elle a la capacité de réduire les réponses inflammatoires, améliorer l’état nutritionnel et atténuer le stress oxydatif.
Des études d’intervention chez l’homme et dans des modèles animaux corroborent cette proposition, de la même manière que les études sélectionnées dans cette revue ont montré des effets de cette nature. Dans des études précliniques, il a été montré qu’il existe une corrélation entre la dysbiose, la perméabilité intestinale et les comportements dépressifs (ARSENEAULT-BRÉARD et al., 2012 ; LI et al., 2019 ; QIU et al., 2021). En analyse, on s’aperçoit que cette relation implique également des métabolites issus du microbiote et leur influence potentielle sur la formation de sérotonine (5-HT) ; neurotransmetteur fondamental pour l’homéostasie émotionnelle. La supplémentation en probiotiques chez le rat a eu des effets sur le microbiote intestinal et a augmenté les niveaux de 5-HT dans le cortex frontal. Ces effets peuvent être une contribution importante puisque la symptomatologie dépressive est liée à des concentrations plus faibles de sérotonine dans cette zone du cerveau (LI et al., 2019). D’autres aspects positifs ont également été observés sur l’épithélium intestinal via les protéines Zonuline et E-cadhérine, et sur l’état inflammatoire dû à la diminution des cytokines pro-inflammatoires (ARSENEAULT-BRÉARD et al., 2012 ; QIU et al., 2021) . Outre les effets sur les voies inflammatoires, les régulations générées sur l’expression des gènes dans les récepteurs du système nerveux semblent également contribuer à l’effet antidépresseur lors de la supplémentation. L’espèce L. helveticus MCC1848 s’est démarquée en modulant le schéma d’expression des gènes (Drd3 et Htr1a) de NAC ; zone du cerveau liée à la récompense, suggérant un rétablissement des systèmes dopaminergique et sérotoninergique. Cependant, comme ces résultats indiquent que les probiotiques peuvent contribuer au traitement, il est nécessaire de déterminer si ces effets se produisent également chez l’homme (MAEHATA et al., 2019).
À l’appui de cette recherche, Akkasheh et al. (2016) ont été l’un des premiers à intervenir chez l’homme diagnostiqué avec un TDM et à obtenir des résultats positifs sur l’échelle BDI (Beck Depression Inventory) après 8 semaines avec une supplémentation en Lactobacillus et Bifidobacterium. Cependant, dans cette étude, les probiotiques ont été utilisés comme traitement d’appoint à un médicament antidépresseur, constituant une probabilité que les effets mettent plus de 8 semaines à se produire s’ils n’étaient pas complétés par le médicament, les durées des tests devraient donc être étudiées de plus près précision. (ROMIJN et al., 2017).
En revanche, les chercheurs ont envisagé d’analyser différentes souches et délais d’intervention. De plus, l’accent a été mis sur la co-supplémentation en vitamines, minéraux et probiotiques, en particulier dans les changements d’humeur (JAMILIAN et al., 2018 ; OSTADMOHAMMADI et al., 2019). Cependant, cette co-supplémentation est encore rare dans le TDM, ce qui conduit à un plus grand intérêt pour la supplémentation symbiotique, car ils ont déjà montré des effets positifs sur le microbiote et la santé mentale de patients sains (GHORBANI et al., 2018). Pourtant, Reininghaus et al. (2020) ont souligné que la co-supplémentation en vitamines et symbiotiques peut être une voie intéressante pour le traitement de la dépression, puisque dans leurs résultats des effets expressifs sur les voies inflammatoires et métaboliques ont été observés. Selon les auteurs de cette étude, approfondir la recherche en analysant les voies métaboliques peut servir de clé pour une meilleure compréhension de l’évolution des maladies et de l’interrelation entre les troubles mentaux et les processus inflammatoires. Comme en témoignent les répercussions favorables sur les échelles psychiatriques et les biomarqueurs inflammatoires, les études sélectionnées permettent d’améliorer cette perspective (CHAHWAN et al., 2019 ; GHORBANI et al., 2018 ; MAJEED et al., 2018 ; REITER et al., 2020 ; WALLACE ; MILEV, 2021).
Les résultats des études précliniques (graphique 1), des essais randomisés et des essais pilotes ouverts (graphique 2) sont présentés ci-dessous.
Tableau 1 – Études ayant réalisé des interventions sur des modèles animaux
| Auteur / année / pays | Animaux/tests | CFU probiotiques/durée | Résultats | Groupes/placebo | Conflit d’interêts | Limites |
|
Arseneault- Breárd et al. (2012) Canada |
40 Rats
Sprague-Dawley Natation forcée, interaction sociale, évitement passif |
Probio’Stick
L . helveticus B . longum 1 milliard d’UFC Dilué dans l’eau (200ml) 14 journées |
↓ Dépres-sion
↓ Perméa-bilité intestinale ↓ cytokine IL-1β ↑ Inter-actions sociales |
4 groupes (n=10)
Maltodextrine diluée dans l’eau (200ml) |
Déclaré ne pas contenir |
Chirurgie thoracique et infarctus du myocarde |
|
Li et al. (2019) Chine |
50 Rats
Wistar CUMS, nage forcée, préférence pour le saccharose |
B. longum L.rhamnosus
1 x 10 9 UFC par sonde 28 journées |
↓ Dépres-sion
↑ 5 –HT/TPH2 córtex-frontal ↓ Firmi-cutes et Tenericutes ↑ Le contrôle du poids |
5 groupes (n = 10)
groupes salins via sonde |
Déclaré ne pas contenir |
L’intervention du microbiote des modèles de dépression supplémentaire n’a pas été analysée, les probiotiques courants ont été complétés et seules les signatures métaboliques centrales ont été reconnues dans l’étude |
| Maehata et al.
(2019) Japon |
48 Rats C57BL / 6J (B6) et ICR Interaction sociale, préférence pour le saccharose, nage forcée |
L. helveticus MCC1848 1 x 10 9 UFC Une préparation probiotique a été ajoutée au régime formulé (AIN93G) 7 journées |
↓ Anhédonie |
3 groupes (n= 16) Régime formulé sans le probiotique |
Déclaré ne pas contenir | Un modèle animal qui présente une dépression légère avec moins de stress physique a été utilisé. |
|
Qiu et al. (2021) Chine |
32 Rats C57BL / 6J Préférence pour le saccharose, nage forcée (LPS – injection d’induction de dépression) |
Lac L. delbrueckii. subsp. bulgaricus 1 x 10 9 UFC par sonde 7 journées |
↓ Dépression ↓ Dysbiose ↓ perméabilité intestinale ↓ Super activation de la microglie ↓ TLR4 et NLRP3 ↓ IL-1β cytokine ↑ ZO-1 et E-cadhérine |
4 groupes (n=8) Sérum physiologique via tube |
Déclaré ne pas contenir | Sans descriptif |
Source : élaboration originale organisée par les auteurs de cette revue. Légende : ↑ augmentée, ↓ réduite. Unités Formant Colonie CFU, Sérotonine 5-HT, TPH2 Tryptophane Hydroxylase 2, ZO-1 Zonula Occludens-1.
Tableau 2 – Études ayant réalisé des interventions chez l’homme
| Auteur/ année/pays |
Participants/âge/diagnostic/échelles | Supplémentation en UFC/durée/médicament | Résultats | groupes/placebo | Conflit d’interêts | Limites |
|
Ghorbani et al. (2018) Iran |
40 patients
18 – 65 ans TD modérée HAM-D |
Familact H ® Symbiotique2 gélules/jourL. casei, L. rhamnosus, L. acidophilus, L. bulgaricus, B. breve, B. longum 3x 108, 2 x 109, 2 × 108, 1 × 109 UFC6 semainesMédicament : (chlorhydrate de fluoxétine)pendant 10 semaines |
↓ Dé-pression | 2 groupes (n=20)
Stéarate de magnésium |
Déclaré ne pas contenir | Petit échantillon, courte période de supplémentation |
| Majeed et al. (2018)
Inde |
40 patients
20 – 65 ans TDM HAM-D, MADRS, CES-D |
LactoSpore ®
1 gélule/jour B. coagulans, MTCC 5856 (esporos) 2 × 109 UFC 90 journées Médicament : non utilisé |
↓ Dé-pression
↓ Insomnie ↓ Symp-tômes ↓ Myélo-peroxydase |
2 groupes (n=20)
Pilule formulée à l’identique sans le probiotique |
A déclaré que ce travail a été parrainé et soutenu par Sabinsa Corporation NJ 08520, USA | Petit échantillon |
| Chahwan et al. (2019) Australie | 71 patients
TD leve/moderado a grave 18 ans+ MINI, BDI-II, DASS-21 BAI, LEIDS-R |
Ecologic ® Barrier
2 sachets de poudre/jour B. bifidum, B. lactis W51, B. lactis W52, L. acidophilus, B. breve, L. casei, L. salvarius, L. lactis, L. lactis W58, 1 × 1010 UFC 8 semaines Médicament : non utilisé |
↓ Dé-pression
↓ Réactivité cognitive |
2 groupes (n=34 probiotique, n=37 placebos)
Amidon de maïs et maltodextrine |
Déclaré ne pas contenir | Le taux d’attrition élevé peut être attribué aux visites hebdomadaires. Dans la période post-essai (semaine 9), les participants étaient absents |
|
Reininghaus et al. (2020) Australie |
61 patients
18 – 75 ans TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Symbiotique
1 sachet de poudre/jour B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC D-biotine ajoutée (125 mg) 28 journées Médicament : antidépresseurs conventionnels des participants |
↓ Dé-pression
↑ Régulation dans la voie IL-17 ↑ Régulation des voies métaboliques (KEGG) ↑ R. gauvreauii et Coprococcus |
2 groupes (n=28 probiotiques, n=33 placebos)
Boisson identique sans le probiotique, biotine ajoutée pour des raisons éthiques |
Déclaré ne pas contenir | Petit échantillon, fumeurs entre les deux groupes, courte période de supplémentation et alimentation hospitalière peuvent avoir influencé les résultats. Il y avait discontinuité; allocation initiale (n=82) |
|
Reiter et al. (2020) Autriche |
61 patients
18 – 75 ans TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Symbiotique
1 sachet de poudre/jour B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC 4 semaines Médicament : antidépresseurs conventionnels des participants |
↓ Dé-pression
↓ Cytokine IL-6 |
2 groupes (n=28 probiotiques, n=33 placebos)
Boisson identique sans le probiotique, biotine ajoutée pour des raisons éthiques |
Déclaré ne pas contenir | Les effets de différents médicaments, la courte période de supplémentation, la différence d’âge et de sexe des participants peuvent influencer le microbiote. Il y avait discontinuité; allocation initiale (n=82) |
|
Wallace e Milev et al. (2021) Canada |
10 patients
18 – 75 ans TDM CAN-BIND, MADRS, QIDS-SR16, SHAPS |
CEREBIOME ®
1 sachet de poudre/jour B. longum, L. helveticus 8 semaines Médicament : non utilisé |
↓ Dé-pression
↓ Anhé-donie ↑ Qualité du sommeil |
Il n’y avait pas de groupe placebo | Déclaré ne pas contenir | Petit échantillon, 70 % étaient des femmes, courte période de supplémentation, et la méthode était non aveugle sans groupe placebo |
Source : élaboration originale organisée par les auteurs de cette revue. Légende : ↑ augmentée, ↓ réduite. Toutes les études humaines ont sélectionné les deux sexes mâle ♂ et femelle ♀. Unités de formation de colonies UFC. Syndrome du côlon irritable du SCI. Échelles : BAI Inventaire de l’anxiété de Beck, BDI Inventaire de la dépression de Beck, CAN-BIND Réseau canadien d’intégration des biomarqueurs de la dépression, CES-D Échelle de dépression du Centre d’études épidémiologiques, HAM-D Échelle d’évaluation de Hamilton pour la dépression, LEIDS-R Indice de sensibilité à la dépression de Leiden-Révisé, MADRS Échelle d’évaluation de la dépression – Montgamarey – Asberg, MINI Mini Entretien neuropsychiatrique international, QIDS-SR16 Inventaire rapide de la symptomatologie dépressive, SCL-90 Échelle d’évaluation des symptômes-90-R-SCL-Riposté, SHAPS Échelle de plaisir SHAPS Snaith-Hamilton.
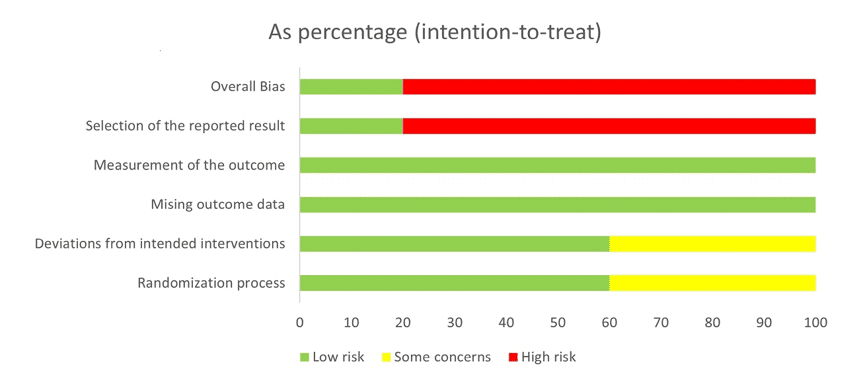
Selon l’extraction des données, une analyse évaluative du risque de biais des études randomisées a été réalisée dans 5 domaines de l’outil ROB-2 (Figure 2), aboutissant au graphique (Figure 2.1) ci-dessous.
Figure 2 – Analyse du risque de biais dans les essais randomisés
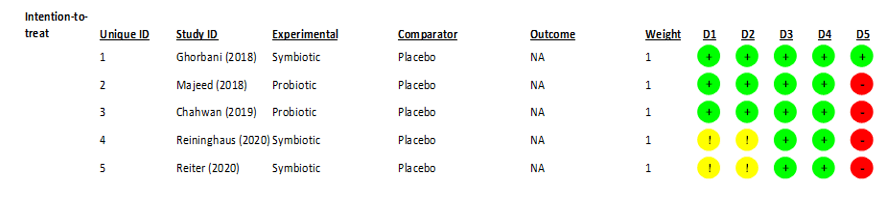
Figure 2.1 – Pourcentages de risque de biais dans le graphique
Ensuite, les 10 études sélectionnées et leurs interventions (marquées d’un X) sont présentées ensemble, et par ordre chronologique.
Tableau 3 – Interventions appliquées dans l’ensemble des études
| N | Auteur/année | Titre, revue/pays, revue : Impact Factor (IF) | Probiotiques | Antidépresseur | Prébiotiques | Vitamines | Effets secondaires |
| I | Arseneault- Breárd et al.(2012) | Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. Canada. Br J Nutr. FI – WSG: 3.334, Indice H: 188, FI – Scopus: 4.105 | X | ||||
| II | Li et al. (2019) |
Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Chine. Neurogastroenterol Motil. FI – WSG: 3,008, Indice H: 42, FI – Scopus: 3,65 | X | X | |||
| III | Maehata et al. (2019) | Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Japon. Biosci Biotech Bioch. FI – WSG: 1.516, Indice H: 116, FI – Scopus: 1,986 | X |
| IV | Qiu et al.(2021) | Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Chine. Ann Transl Med. FI – WSG: 3.297, Indice H: 48, FI – Scopus: N/D | X | ||||
| V | Ghorbani et al. (2018) | The Effect of Synbiotic as a Adjuvant Therapy to Fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Iran. Arch Neurosci. FI – N/D | X | X | X | X | |
| VI | Majeed et al. (2018) | Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Inde. Food Nutr Res. FI – WSG: 0,756, Indice H:24, FI – Scopus:1.259 | X | ||||
| VII | Chahwan et al. (2019) | A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Australie. J Affect Disord. FI – WSG: 3.892, Indice H: 188, FI – Scopus: 5,104 | X | X |
| VIII | Reinin-ghauset al. (2020) | PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression—A Randomized Controlled Trial. Autriche. Nutrients. FI – WSG: 4.546 , Indice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| IX | Reiter et al.(2020) | Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Autriche. Nutrients. FI – WSG: 4.546 , Indice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| X | Wallace et Milev (2021) | Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Canada. Front Psychiatry. FI – WSG: 4.157, Indice H: N/D, FI – Scopus: 7.864 | X |
Source : élaboration originale organisée par les auteurs de cette revue. Légende : Facteur d’impact FI, indice H – Google Scholar, N/A Non défini, WSG Web of Science Group.
4. DISCUSSION
Selon l’Organisation mondiale de la santé (OMS, 2020), le trouble dépressif a été présenté comme une condition préoccupante pour le 21e siècle, car il reflète l’augmentation des taux de suicide. Le domaine scientifique n’a cessé de réitérer sur ce sujet, et intensifié ses efforts pour développer de nouveaux traitements pouvant contribuer à l’amélioration des symptômes dépressifs grâce à la modulation intestinale (KELLY et al., 2016 ; YONG et al., 2020).
Cependant, dans la littérature, les études précliniques complémentant les psychobiotiques prédominent et ont obtenu des résultats significatifs sur la dysbiose, la perméabilité intestinale et la neurochimie cérébrale (ARSENEAULT-BRÉARD et al., 2012 ; CRYAN ; O’MAHONY, 2011 ; LI et al., 2019; MAEHATA et al., 2019 ; QIU et al., 2021 ; YONG et al., 2020). Heureusement, ce scénario est en train de changer et les études sur l’homme sont de plus en plus encouragées, reconnaissant que les probiotiques sont bénéfiques pour le microbiote et les multiples voies endocriniennes, inflammatoires et neurales. Cependant, cette hétérogénéité d’action nécessite une meilleure compréhension du « microbiome entérique-intestin-cerveau » (DINAN ; CRYAN, 2016 ; CRYAN ; O’MAHONY, 2011 ; HEMARAJATA ; VERSALOVIC, 2013).
Les différents résultats des biomarqueurs et des scores des échelles psychiatriques corroborent cette affirmation, car il ressort clairement que les mécanismes d’action varient selon le sexe et l’espèce du probiotique supplémenté. À ce jour, les mécanismes les plus étudiés sont les bactéries des genres Lactobacillus et Bifidobacterium, qui se sont révélées largement sûres, y compris dans le traitement des troubles dépressifs (IVANOV ; HONDA, 2012 ; VIZCAÍNO et al., 2016 ; ZAWISTOWSKA-ROJEK ; TYSKI, 2018 ; ).
Cependant, le régime alimentaire et les facteurs nutritionnels ont également une valeur dans cette enquête (DASH et al., 2015 ; HOLSCHER, 2017 ; LEDOCHOWSKI et al., 2000 ; LIU ; CAO ; ZHANG, 2015 ; SUZUKI, 2020 ; SKONIECZNA-ŻYDECKA et al. , 2018). Selon Logan et Katzman (2005), l’amélioration de l’état nutritionnel et la promotion des effets anti-inflammatoires sont éminentes pour obtenir un plus grand succès dans le soulagement des symptômes dépressifs.
Dans ce contexte, il convient de noter que la co-supplémentation d’un symbiotique et de la vitamine B7 (D-biotine) a montré des compétences pour réguler à la fois les voies métaboliques et inflammatoires, et bénéficier au microbiote intestinal des patients atteints de TDM. De plus, les résultats de cette co-supplémentation ont montré des augmentations des concentrations de Ruminococcus gauvreauii et Coprococcus ; qui sont principalement liés à une augmentation de la qualité de vie, n’ont cependant pas exprimé d’effet sur la perméabilité intestinale. Même ainsi, compte tenu des résultats, Reininghaus et al. (2020) ont conclu qu’il existe un lien important entre la qualité de l’alimentation, le microbiote intestinal et la santé mentale, encourageant de nouvelles études à inclure l’analyse des voies métaboliques parallèlement aux enquêtes sur les voies inflammatoires.
À ce jour, le plus grand intérêt est de comprendre l’activité cérébrale et les réponses inflammatoires dans la dysbiose et les troubles psychiatriques (LEVY et al., 2017 ; TILLISCH et al., 2013 ; TRAN et al., 2019). On pense que les cytokines pro-inflammatoires jouent un rôle important dans la pathogenèse de la dépression, et avec cela, l’interleukine-6 (IL-6) a gagné du terrain. En revanche, les réponses du système immunitaire s’effectuent en cascades et englobent une large interaction systémique. Il est donc nécessaire de poursuivre les recherches sur les sous-types d’inflammation aux différents degrés de dépression (REITER et al., 2020). Il est donc essentiel d’étendre l’analyse à d’autres types de souches probiotiques, et d’observer l’intégrité des réponses immunitaires innées, car c’est aussi une interface à scruter (MAJEED et al., 2018).
La supplémentation prébiotique et probiotique a démontré sa capacité à agir sur l’immunité et diverses maladies (DIDARI et al., 2015 ; SLAVIN, 2013 ; VIZCAÍNO et al., 2016 ; ZALAR ; HALSBERGER ; PETERLIN, 2018). Ainsi, dans ces compléments, les disparités du microbiote de chaque individu doivent être prises en compte. Par exemple, chez les patients déprimés, on retrouve généralement le « microbiote dépressif », avec une prédominance de bactéries du phylum Firmicutes, Bacteroidetes et Actinobacteria. Cette diversité qui compose le microbiote a stimulé l’analyse taxonomique des bactéries intestinales résidentes de différentes populations cliniques afin de les comparer et de comprendre leurs réponses (GOODMAN et al., 2011 ; NEISH, 2009 ; SARTOR, 2008 ; ZHENG et al., 2016).
Enfin, il existe des études qui exposent les disparités du microbiote lors de la supplémentation en probiotiques. Chawan et al. (2019) dans leur étude ont analysé les différences de composition du microbiote entre les individus diagnostiqués avec une dépression légère, modérée et sévère, et ont montré qu’il n’y avait pas de différence significative entre eux, alors que dans la comparaison entre les individus non déprimés et déprimés, il y avait une prédominance de Ruminococcus gnavus chez ceux diagnostiqués avec une dépression sévère. Dans cette étude, des effets secondaires tels que des nausées et de la somnolence ont également été observés lors de la supplémentation en Lactobacillus et Bifidobacterium. Comme celle-ci, une autre étude a également décrit des effets secondaires chez les sujets du groupe placebo et probiotique, malgré cela, les deux études ont obtenu une bonne observance des traitements (CHAHWAN et al., 2019 ; GHORBANI et al., 2018). Par rapport à l’étude de Majeed et al. (2018) La supplémentation en Bacillus coagulans MTCC 5856 n’a pas provoqué d’effets secondaires et a atténué précisément les symptômes gastro-intestinaux et l’insomnie des patients diagnostiqués avec un TDM et le syndrome du côlon irritable.
Face à cette problématique, il est important de souligner que les symptômes gastro-intestinaux sont fréquemment rapportés dans les troubles du microbiote intestinal, et dans les troubles psychiatriques. Et, par conséquent, cette relation a attiré l’attention des chercheurs sur la supplémentation en symbiotiques dans la santé en général (CARDING et al., 2015 ; MAJEED et al., 2018 ; O’HARA ; SHANAHAN, 2006). En effet, les probiotiques et les symbiotiques ont déjà montré des effets positifs sur la santé mentale, les réponses inflammatoires et les symptômes gastro-intestinaux liés au TDM (GHORBANI et al., 2018 ; MAJEED et al., 2018 ; REININGHAUS et al., 2020 ; REITER et al., 2020).
Cependant, dans cette revue, les études qui ont complété les symbiotiques et ont bénéficié des voies inflammatoires ont maintenu les médicaments psychotropes conventionnels de leurs participants (REININGHAUS et al., 2020 ; REITER et al., 2020). Ainsi, sur les six études chez l’homme, seules trois ont montré les effets des probiotiques sous leur forme autonome, c’est-à-dire sans recours à des médicaments (CHAHWAN et al., 2019 ; MAJEED et al., 2018 ; WALLACE ; MILEV, 2021). Parmi eux, l’une des études les plus récentes a analysé les effets des probiotiques chez 10 patients naïfs d’antidépresseurs. Ainsi, Wallace et Milev (2021) ont obtenu des résultats positifs sur la symptomatologie dépressive en 4 à 8 semaines, cependant, lors de la conception de cette étude, les participants sont restés non aveugles, et il n’y avait pas de groupe placebo pour les comparaisons.
Cependant, il faut considérer que malgré les résultats, la plupart des études sont indépendantes du choix de l’administration ; avec ou sans médicament, décrit les limites et présente des risques de biais. Ce fait propose de nouvelles études avec des plans de recherche mieux conçus et une meilleure compréhension du système de communication et de réponse de l’axe intestin-cerveau. Après tout, il est possible que jusqu’à présent la recherche n’ait présenté que la partie émergée d’un «iceberg» qui occupera le champ scientifique pendant un certain temps, mais qui d’une certaine manière a déjà révélé des perspectives prometteuses pour le domaine de la psychiatrie nutritionnelle (GRENHAM et al., 2011 ; SARRIS et al., 2015).
5. CONSIDÉRATIONS FINALES
Selon l’examen des données et les citations organisées dans cette étude, il est possible de jeter un coup d’œil à la question directrice : « les psychobiotiques peuvent-ils être désignés comme un traitement du trouble dépressif majeur ? » Et pour conclure à l’unanimité : les études suggèrent que les psychobiotiques peuvent être désignés comme un traitement du trouble dépressif majeur, puisque les effets psychotropes qu’ils produisent ont été efficaces pour réduire les symptômes dépressifs des patients en 4 à 8 semaines, comme observé dans les résultats des échelles psychiatriques validé pour cette analyse.
En plus des symptômes dépressifs, d’autres facteurs importants pour le rééquilibrage de la santé mentale ont été simultanément optimisés, tels que la qualité du sommeil et la réduction des réponses inflammatoires, qui se sont démarqués au sein du thème, générant la science qu’une conjecture des regards à mener afin que ce traitement puisse être rendu possible. Il est donc essentiel de penser à la supplémentation : que chaque individu présente des disparités dans son microbiote, en même temps que la composition du microbiote intestinal est étroitement liée aux réponses inflammatoires. Cependant, il est possible que les différents sous-types d’inflammation n’apparaissent pas sur l’analyse d’un seul biomarqueur inflammatoire, étant donc pertinent de prendre ces perspectives pour de futures investigations, puisque la régulation de l’état inflammatoire a eu des répercussions comme l’un des voies d’accès pour le soulagement des symptômes dépressifs. À partir de là, l’importance de couvrir les investigations évaluant les voies inflammatoires et métaboliques face aux facteurs nutritionnels est liée à cette ligne de pensée, car, selon les preuves, un examen plus approfondi de cet aspect peut également être important pour des discussions ultérieures.
De plus, le domaine scientifique exprime qu’une meilleure compréhension de l’axe intestin-cerveau et des mécanismes des différentes souches probiotiques est nécessaire, dans cette optique, la supplémentation en psychobiotiques est recommandée comme traitement adjuvant des antidépresseurs.
Enfin, à travers l’extraction de données, et l’analyse évaluative de la qualité méthodologique des études randomisées, réalisée dans cette revue, les lignes directrices suivantes ont été formalisées pour les études ultérieures : le design méthodologique doit être mieux planifié, afin que les études futures ont un risque de biais plus faible dans les domaines : biais général, sélection des résultats, déviations dans l’intervention prévue et processus de randomisation. De plus, compte tenu des limites décrites, il est essentiel que les études futures réalisent des interventions avec des périodes de test plus longues, dans des échantillons plus importants, en considérant la supplémentation en psychobiotiques sous une forme adjuvante et autonome, afin qu’il devienne possible de distinguer les effets de probiotiques et les effets des antidépresseurs. Parce que, compte tenu de l’amélioration des études, il est probable que davantage de lumières s’allumeront dans les discussions sur la santé mentale, et ainsi, les connaissances obtenues jusqu’à présent sur l’axe intestin-cerveau deviendront de plus en plus claires.
RÉFÉRENCES
AKKASHEH, Ghodarz et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition, Estados Unidos, vol. 32, n.3, p.315-20, mar. 2016. Disponível em: doi:10.1016/j.nut.2015.09.003 Acesso em: 01/09/2021.
ARSENEAULT-BRÉARD, Jessica et al. Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. The British Journal of Nutrition, Canadá, vol. 107, n. 12, p. 1793-9, jun. 2012. Disponível em: doi:10.1017/S0007114511005137 Acesso em: 13/09/2021.
BAPTISTA, Makilim Nunes. Avaliando “depressões”: dos critérios diagnósticos às escalas psicométricas. Avaliação Psicológica, Brasil, vol. 17, n. 3, p. 301-310, set. 2018. Disponível em: http://dx.doi.org/10.15689/ap.2018.1703.14265.03 Acesso em: 01/09/2021.
BERCIK, P.; COLLINS, S.M.; VERDU, E.F. Microbes and the gut-brain axis. Neurogastroenterol Motil, Canadá, vol. 24, n.5, p. 405-13, mai. 2012. Disponível em: https://doi.org/10.1111/j.1365-2982.2012.01906.x Acesso em: 01/09/2021.
CARDING, Simon et al. Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, Reino Unido, vol. 26, p. 26191, fev. 2015. Disponível em: doi: 10.3402/mehd.v26.26191 Acesso em: 02/09/2021.
CHAHWAN, Bahia et al. Gut feelings: A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Journal of Affective Disorders, Austrália, vol. 253, p. 317-326, jun. 2019. Disponível em: doi:10.1016/j.jad.2019.04.097 Acesso em: 13/09/2021.
CRYAN, J. F.; O’MAHONY, S. M. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterology and Motility, Irlanda, vol. 23, n.3, p. 187-92, mar. 2011. Disponível em: doi:10.1111/j.1365-2982.2010.01664.x Acesso em: 01/09/2021.
DASH, Sarah et al. The gut microbiome and diet in psychiatry: focus on depression. Current Opinion in Psychiatry, Austrália, vol. 28,1, n. 1, p. 1-6, jan. 2015. Disponível em: doi:10.1097/YCO.0000000000000117 Acesso: 02/09/2021.
DAVID, Lawrence A., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature, Estados Unidos, vol. 505, n. 7484 p. 559-63, jan. 2014. Disponível em: doi:10.1038/nature12820 Acesso em: 01/09/2021.
DIDARI, Tina et al. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World Journal of Gastroenterology, Irã, vol. 21, n. 10, p. 3072-84, mar. 2015. Disponível em: doi:10.3748/wjg.v21.i10.3072 Acesso em: 02/09/2021.
DINAN, Timothy G.; STANTON, Catarina; CRYAN, John F. Psychobiotics: a novel class of psychotropic. Biological Psychiatry, Irlanda, vol. 74, n. 10, p. 720-6, nov. 2013. Disponível em: doi:10.1016/j.biopsych.2013.05.001 Acesso em: 01/09/2021.
DINAN, Timothy G.; CRYAN, John F. Mood by microbe: towards clinical translation. Genome Medicine, Irlanda, vol. 8, n. 1, p. 36, abr. 2016. Disponível em: doi:10.1186/s13073-016-0292-1 Acesso em: 01/09/2021.
DORÉ, Joël et al. Hot topics in gut microbiota. United European Gastroenterol J, França, vol. 1, n. 5, p. 311-318, out. 2013. Disponível em: doi:10.1177/2050640613502477 Acesso em: 01/09/2021.
FERENHOF, Helio Aisenberg; FERNANDES, Roberto Fabiano. Desmistificando a revisão de literatura como base para redação científica: método SSF. Revista ACB; Biblioteconomia em Santa Catarina – SC, Florianópolis, Brasil, vol. 21, n. 3, p. 550-563, ago./nov. 2016. Disponível em: file:///C:/Users/Usuario/Downloads/1194-6369-1-PB.pdf Acesso em: 01/09/2021.
FORSYTHE, Paul et al. Mood and gut feelings. Brain, Behavior, and Immunity, Canadá, vol. 24, n. 1, p. 9-16, jan. 2010. Disponível em: doi:10.1016/j.bbi.2009.05.058 Acesso em: 01/09/2021.
GHORBANI, Zeinab et al. The Effect of symbiotic as an Adjuvant Therapy to fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Arch Neurosci, Irã, vol. 5, n.2, p.60507, abr. 2018. Disponível em: doi: 10.5812/archneurosci.60507 Acesso em: 13/09/2021.
GOODMAN, Andrew L., et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proceedings of the National Academy of Sciences of the United States of America, Estados Unidos, vol. 108, n.15, p. 6252-7. abr. 2011. Disponível em: doi:10.1073/pnas.1102938108 Acesso em: 01/09/2021.
GOODRICH, Julia K., et al. Human genetics shape the gut microbiome. Cell, Estados Unidos, vol. 159, n. 4, p. 789-99, nov. 2014. Disponível em: doi:10.1016/j.cell.2014.09.053 Acesso em: 01/09/2021.
GRENHAM, Sue et al Brain-gut-microbe communication in health and disease. Front Physiol, Irlanda, vol. 2 p. 94, dez. 2011. Disponível em: https://doi.org/10.3389/fphys.2011.00094 Acesso em: 01/09/2021.
HEMARAJATA, Peera; VERSALOVIC, James. Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation. Therapeutic Advances in Gastroenterology, Estados Unidos, vol. 6, n. 1, p. 39-51. jan. 2013. Disponível em: doi:10.1177/1756283X12459294 Acesso em: 02/09/2021.
HOLSCHER, Hannah D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, Estados Unidos, vol. 8, n. 2, p. 172-184, mar. 2017. Disponível em: doi:10.1080/19490976.2017.1290756 Acesso em: 02/09/2021.
HUANG, Ruixue; WANG, Ke; HU, Jianan. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients, China, vol. 8, n. 8, p. 483, ago. 2016. Disponível em: https://doi.org/10.3390/nu8080483 Acesso em: 01/09/2021.
IBANEZ, Grazielle et al. Adesão e dificuldades relacionadas ao tratamento medicamentoso em pacientes com depressão. Rev Bras Enferm, Brasil, vol. 67, n. 4, p. 556-562, ago. 2014. Disponível em: https://doi.org/10.1590/0034-7167.2014670409 Acesso em: 01/09/2021.
IVANOV, Ivaylo I; HONDA, Quênia. Intestinal commensal microbes as immune modulators. Cell host & microbe, Estados Unidos, vol. 12, n. 4, p. 496-508, out. 2012. Disponível em: https://doi.org/10.1016/j.chom.2012.09.009 Acesso em: 02/09/2021.
JAMILIAN, Mehri et al. The effects of probiotic and selenium co-supplementation on parameters of mental health, hormonal profiles, and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 11, n. 1, p. 80, set. 2018. Disponível em: https://doi.org/10.1186/s13048-018-0457-1 Acesso em: 01/09/2021.
KELLY, John R., et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research, Irlanda, vol. 82, p. 109-118, nov. 2016. Disponível em: https://doi.org/10.1016/j.jpsychires.2016.07.019 Acesso em: 02/09/2021.
KONTUREK, Peter C.; BRZOZOWSKI, T.; KONTUREK, S. J. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. Journal of Physiology and Pharmacology, Alemanha, vol. 62, n. 6, p. 591-599, dez. 2011. Disponível em: https://www.jpp.krakow.pl/journal/archive/12_11/pdf/591_12_11_article.pdf Acesso em: 01/09/2021.
LEDOCHOWSKI, M., et al. Carbohydrate malabsorption syndromes and early signs of mental depression in females. Digestive Diseases and Sciences, Áustria, vol. 45, n. 7, p. 1255-9, jul. 2000. Disponível em: doi:10.1023/a:1005527230346 Acesso em: 02/09/2021.
LEVY, Maayan et al. Dysbiosis and the immune system. Nature Reviews. Immunology, Israel, vol. 17, n. 4, p. 219-232, mar. 2017. Disponível em: doi:10.1038/nri.2017.7 Acesso em: 02/09/2021.
LI, Huawei et al. Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Neurogastroenterol Motil, China, vol. 31, n. 10, p. 13677, jul. 2019. Disponível em: doi: 10.1111/nmo.13677 Acesso em: 13/09/2021.
LIU, Richard T.; WALSH, Rachel F.L.; SHEEHAN, Ana E. Prebiotics and probiotics for depression and anxiety: A systematic review and meta-analysis of controlled clinical trials. Neurosci Biobehav Rev, Estados Unidos, vol. 102, p. 13-23, abr. 2019. Disponível em: doi:10.1016/j.neubiorev.2019.03.023 Acesso em: 01/09/2021.
LIU, Xiaofei; CAO, Shangqing; ZHANG, Xuewu. Modulation of Gut Microbiota-Brain Axis by Probiotics, Prebiotics, and Diet. J Agric Food Chem, China, vol. 63, n. 36, p. 7885-7895, set. 2015. Disponível em: doi:10.1021/acs.jafc.5b02404 Acesso em: 02/09/2021.
LOGAN, Alan C.; KATZMAN Martin. Major depressive disorder: probiotics may be an adjuvant therapy. Med Hypotheses, Estados Unidos, vol. 64, n. 3, p. 533-538, out. 2005. Disponível em: doi:10.1016/j.mehy.2004.08.019 Acesso em: 02/09/2021.
MAEHATA, Hazuki et al. Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Bioscience, Biotechnology, and Biochemistry, Japão, vol. 83, n. 7 p. 1239-1247, mar. 2019. Disponível em: doi:10.1080/09168451.2019.1591263 Acesso em: 13/09/2021.
MAJEED, Muhammed et al. Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Food & Nutrition Research, Índia, vol. 62, jul. 2018. Disponível em: doi:10.29219/fnr.v62.1218 Acesso em: 13/09/2021.
MARKLE, Janet G. M., et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science, Canadá, vol. 339, n. 6123, p. 1084-8, jan. 2013. Disponível em: doi: 10.1126/science.1233521 Acesso em: 01/09/2021.
MAYER, Emeran A. Gut feelings: the emerging biology of gut-brain communication. Nature Reviews. Neuroscience, Estados Unidos, vol. 12, n. 8, p. 453-66, jul. 2011, Disponível em: doi:10.1038/nrn3071 Acesso em: 01/09/2021.
MOTTA, Cibele Cunha Lima; MORÉE, Carmen Leontina Ojeda Ocampo; NUNES, Carlos Henrique Sancineto da Silva. O atendimento psicológico ao paciente com diagnóstico de depressão na Atenção Básica. Cienc Saúde Colet, Brasil, vol. 22, n. 3, p. 911-920, mar. 2017. Disponível em: https://doi.org/10.1590/1413-81232017223.27982015 Acesso em: 01/09/2021.
NEISH, Andrew S. Microbes in gastrointestinal health and disease. Gastroenterologia, Estados Unidos. vol. 136, n. 1, p. 65-80, jan. 2009. Disponível em: doi:10.1053/j.gastro.2008.10.080 Acesso em: 02/09/2021.
O’HARA, Ann M.; SHANAHAN, Fergus. The gut flora as a forgotten organ. EMBO Reports, Irlanda, vol. 7, n. 7, p. 688-93, jul. 2006. Disponível em: doi:10.1038/sj.embor.7400731 Acesso em: 02/09/2021.
O’MAHONY, Siobhain M., et al. Early life stress alters behavior, immunity, and microbiota in rats: implications for irritable bowel syndrome and psychiatric illnesses. Biological Psychiatry, Irlanda, vol. 65, n. 3, p. 263-7, fev. 2009. Disponível em: doi:10.1016/j.biopsych.2008.06.026 Acesso em: 02/09/2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE (OPAS/OMS). Folha Informativa – Depressão. (Brasil, 2020). Disponível em: https://www.paho.org/pt/topicos/depressao Acesso em: 01/09/2021.
OSTADMOHAMMADI, Vahidreza et al. Vitamin D and probiotic co-supplementation affects mental health, hormonal, inflammatory and oxidative stress parameters in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 12, n. 1, p. 5, jan. 2019. Disponível em: doi:10.1186/s13048-019-0480-x Acesso em: 02/09/2021.
QIU, Xiangjie et al. Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Annals of Translational Medicine, China, vol. 9, n. 5 p. 366, mar. 2021. Disponível em: doi:10.21037/atm-20-4411 Acesso em: 13/09/2021.
REININGHAUS, Eva Z., et al. PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression-A Randomized Controlled Trial. Nutrients, Áustria, vol. 12, n. 11, p. 3422, nov. 2020. Disponível em: doi:10.3390/nu12113422 Acesso em:13/09/2021.
REITER, Alexandra et al. Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Nutrients, Áustria, vol. 12, n. 9, p. 2575, ago. 2020. Disponível em: doi:10.3390/nu12092575 Acesso em: 13/09/2021.
RODRÍGUEZ, Juan Miguel et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microbial Ecology in Health and Disease, Espanha, vol. 26, n. 26050, fev. 2015. Disponível em: doi:10.3402/mehd.v26.26050 Acesso em: 01/09/2021.
ROMIJN, Amy R., et al. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. The Australian and New Zealand Journal of Psychiatry, Nova Zelândia, vol. 51, n. 8, p. 810-821, ago. 2017. Disponível em: doi:10.1177/0004867416686694 Acesso em: 01/09/2021.
SARRIS, Jerome et al. Nutritional medicine as mainstream in psychiatry. The Lancet. Psychiatry, Estados Unidos, vol. 2, n. 3, p. 271-4, fev. 2015. Disponível em: doi:10.1016/S2215-0366(14)00051-0 Acesso em: 02/09/2021.
SKONIECZNA-ŻYDECKA, Karolina et al. Faecal Short Chain Fatty Acids Profile is Changed in Polish Depressive Women. Nutrients, Polônia, vol. 10, n. 12, p. 1939, dez. 2018. Disponível em: doi:10.3390/nu10121939 Acesso em: 02/09/2021.
SLAVIN, Joanne. Fiber and prebiotics: mechanisms and health benefits. Nutrients, Estados Unidos, vol. 5, n. 4, p. 1417-35, abr. 2013. Disponível em: doi:10.3390/nu5041417 Acesso em: 02/09/2021.
SMITS, Loek P., et al. Therapeutic potential of fecal microbiota transplantation. Gastroenterology, Holanda, vol. 145, n. 5, p. 946-53, set. 2013. Disponível em: doi:10.1053/j.gastro.2013.08.058 Acesso em: 02/09/2021.
SARTOR, R Balfour. Microbial influences in inflammatory bowel diseases. Gastroenterology, Estados Unidos, vol. 134, n. 2, p. 577-94, fev. 2008. Disponível em: doi:10.1053/j.gastro.2007.11.059 Acesso em: 02/09/2021.
SUZUKI, Takuya. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Animal Science Journal Nihon Chikusan Gakkaiho, Japão, vol. 91, n. 1, p. 13357, dez. 2020. Disponível em: doi:10.1111/asj.13357 Acesso em: 02/09/2021.
TILLISCH, Kirsten et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, Estados Unidos, vol. 144, n. 7, p. 1394-401; 1401.e1-4, mar. 2013. Disponível em: doi:10.1053/j.gastro.2013.02.043 Acesso em: 02/09/2021.
TRAN, Nhan et al. The gut-brain relationship: Investigating the effect of multispecies probiotics on anxiety in a randomized placebo-controlled trial of healthy young adults. Journal of Affective Disorders, Estados Unidos, vol. 252, p. 271-277, abr. 2019. Disponível em: doi:10.1016/j.jad.2019.04.043 Acesso em: 02/09/2021.
TSAI, Yu-Ling et al. Probiotics, prebiotics and amelioration of diseases. Journal of Biomedical Science, Taiwan, vol. 26, n. 1, p. 3, jan. 2019. Disponível em: doi:10.1186/s12929-018-0493-6 Acesso em: 01/09/2021.
VARAVALLO, Maurilio Antonio; THOMÉ, Julia Nigro; TESHIMA, Elisa. Aplicação de bactérias probióticas para profilaxia e tratamento de doenças gastrointestinais. Semina: Cienc Biol Saúde, Brasil, vol. 29, n. 1, p. 83-104, jun. 2008. Disponível em: http://dx.doi.org/10.5433/1679-0367.2008v29n1p83 Acesso em: 01/09/2021.
VIZCAÍNO, Ricnia et al. Usos clínicos de los probióticos. Arch Venez Pueric Pediatr, Venezuela, vol. 79, n. 1, p. 029-040, mar. 2016. Disponível em: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S000406492016000100007&lng=es&nrm=iso Acesso em: 01/09/2021.
WALLACE, Caroline J. K.; MILEV, Roumen V. The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Front Psychiatry, Canadá, vol. 12 p. 618279, fev. 2021. Disponível em: doi: 10.3389/fpsyt.2021.618279 Acesso em: 13/09/2021.
WERBNER, Michal et al. Social-Stress-Responsive Microbiota Induces Stimulation of Self-Reactive Effector T Helper Cells. MSystems, Israel, vol. 4, n. 4, p. 00292-18, mai. 2019. Disponível em: doi:10.1128/mSystems.00292-18 Acesso em: 01/09/2021.
WU, Gary D., et al. Linking long-term dietary patterns with gut microbial enterotypes. Science, Estados Unidos, vol. 334, n. 6052, p. 105-8, set. 2011. Disponível em: doi:10.1126/science.1208344 Acesso em: 01/09/2021.
YATSUNENKO, Tanya et al. Human gut microbiome viewed across age and geography. Nature, Estados Unidos, vol. 486, n. 7402, p. 222-7, mai. 2012. Disponível em: doi:10.1038/nature11053 Acesso em: 02/09/2021.
YONG, Shin Jie et al. Antidepressive Mechanisms of Probiotics and Their Therapeutic Potential. Frontiers in Neuroscience, Malásia, vol. 13, p. 1361, jan. 2020. Disponível em: doi:10.3389/fnins.2019.01361 Acesso em: 01/09/2021.
YUAN, Ziqi et al. Application of antidepressants in depression: A systematic review and meta-analysis. Journal of Clinical Neuroscience, China, vol. 80, p. 169-181, ago. 2020. Disponível em: doi:10.1016/j.jocn.2020.08.013 Acesso em: 01/09/2021.
ZALAR, Bojan; HALSBERGER, Alexandre; PETERLIN, Borut. The Role of Microbiota in Depression – a brief review. Psychiatria Danubina, Eslovênia, vol. 30, n. 2, p. 136-141, jun. 2018. Disponível em: doi:10.24869/psyd.2018.136 Acesso em: 01/09/2021.
ZAWISTOWSKA-ROJEK, Anna; TYSKI, Stefan. Are Probiotic Really Safe for Humans? Polish Journal of Microbiology, Polônia, vol. 67, n. 3, p. 251-258, set. 2018. Disponível em: doi:10.21307/pjm-2018-044 Acesso em: 02/09/2021.
ZHENG, P., et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Molecular Psychiatry, China, vol. 21, n. 6, p. 786-96, jun. 2016. Disponível em: doi:10.1038/mp.2016.44 Acesso em: 02/09/2021.
[1] Diplômée en nutrition ; Certification en psychiatrie nutritionnelle (INCCOR-RJ). ORCID : 0000-0002-1588-5679.
[2] Conseiller. Diplômée en nutrition; Doctorat en santé collective; Master en métabolisme et diététique; Professeur dans le domaine de la nutrition. ORCID : 0000-0002-7556-2548.
Envoyé : Mars 2022.
Approuvé : Mai 2022.


