ARTIGO DE REVISÃO
COELHO, Taiane [1], KERPEL, Raquel [2]
COELHO, Taiane. KERPEL, Raquel. Psicobióticos no tratamento da depressão: um novo olhar para a saúde mental – revisão de busca sistematizada. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 05, Vol. 01, pp. 125-152. Maio de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/nutricao/psicobioticos, DOI: 10.32749/nucleodoconhecimento.com.br/nutricao/psicobioticos
RESUMO
O Transtorno Depressivo Maior (TDM) é um distúrbio psíquico multifatorial, tratado convencionalmente com medicamentos antidepressivos. Os sintomas ocasionados pela própria sintomatologia depressiva e os efeitos colaterais provocados pelos medicamentos são alguns dos fatores que interferem negativamente na adesão dos tratamentos farmacológicos. Atualmente, após os probióticos apresentarem efeitos psicotrópicos, o campo científico tem intensificado esforços para compreender se a suplementação de probióticos serve como tratamento para os transtornos psiquiátricos. Diante disso, o presente estudo formulou o seguinte questionamento: os psicobióticos (probióticos) podem ser denotados como tratamento para o Transtorno Depressivo Maior? Objetivo: responder à questão norteadora através de uma revisão de estudos que suplementaram psicobióticos com a intenção de tratar o Transtorno Depressivo Maior. Metodologia: para esta revisão foi delineado uma busca sistematizada, onde, durante o mês de setembro de 2021, as buscas ocorreram nas bases de dados; Pubmed, Google Scholar, e Scielo, por meio dos descritores “probiotics AND depression AND dysbiosis” em inglês, e em português, e filtragens para a seleção de estudos publicados entre os anos 2005 e 2021. Após a seleção dos materiais, as duplicatas foram gerenciadas no EndNote, e a qualidade metodológica dos estudos randomizados foi avaliada através da ferramenta Risk of Bias-2 (ROB 2). Resultados: houve a predileção de 10 estudos; pré-clínicos (n=4), randomizados (n=5) e piloto aberto (n=1), que cumpriram os critérios de inclusão, e evidenciaram resultados significativos sobre os escores de depressão em escalas psiquiátricas; demonstrando a diminuição da anedonia, reatividade cognitiva, e a insônia de pacientes diagnosticados com o Transtorno Depressivo Maior, além disso, foram observadas mudanças significativas sobre fatores que podem estar associados a patogênese da depressão, como a disbiose, e o estado inflamatório diante a diminuição de biomarcadores inflamatórios. Considerações finais: de acordo com a revisão dos dados, obteve-se a seguinte resposta para a questão norteadora: os psicobióticos podem ser denotados como tratamento para o Transtorno Depressivo Maior. Porém, em razão da necessidade de uma compreensão maior sobre o eixo intestino-cérebro e os mecanismos de ação dos psicobióticos, recomenda-se a suplementação como terapia adjuvante de medicamentos antidepressivos. Sendo assim, estudos com amostras maiores e períodos mais prolongados de intervenção devem ser realizados.
Palavras-chave: Transtorno Depressivo Maior, Probióticos, Disbiose.
1. INTRODUÇÃO
Segundo a Organização Mundial da Saúde (OMS, 2020) cerca de 300 milhões de pessoas sofrem de transtornos depressivos no mundo. Esta desordem tem prevalecido entre homens (5 a 12%) e mulheres (10 a 25%), e ocupado o segundo lugar na carga de doenças que mais causam prejuízos na esfera econômico-social, e no campo da saúde (MOTTA; MORÉE; NUNES, 2017; ZALAR; HALSBERGER; PETERLIN, 2018).
De acordo com o Manual Diagnóstico e Estatístico de Transtornos Mentais-5 (DSM-V), o Transtorno Depressivo Maior (TDM) é diagnosticado quando uma pessoa experimenta pelo menos 5 dos seguintes sintomas durante 2 semanas: humor deprimido, anedonia, culpa excessiva, ideação suicida, alterações no apetite e no sono, retardo psicomotor, falta de concentração e fadiga. Entre esses critérios, a anedonia ou humor deprimido (ou ambos) devem estar presentes para ser considerado o diagnóstico (BAPTISTA, 2018).
Quando diagnosticado, o uso de antidepressivos é considerado a primeira opção para o tratamento, porém, 30 a 40% dos pacientes não apresentam respostas significativas, enquanto 60 a 70% não experimentam a esperada remissão da doença (YUAN et al., 2020). Além disso, também é comum os pacientes desistirem dos tratamentos farmacológicos, em razão dos efeitos colaterais e das dificuldades em seguir uma rotina (IBANEZ et al., 2014). Entre outros motivos, o estigma social, a falta de recursos e de profissionais treinados também são obstáculos para a adesão do tratamento (OMS, 2020).
Em virtude disso, a busca por novas terapêuticas tem repercutido entre os pesquisadores, enraizando na linguagem científica o termo “eixo intestino-cérebro.” Os mecanismos deste eixo têm sido amplamente estudados após insights de pesquisas que evidenciaram que o intestino e o cérebro possuem uma comunicação bidirecional e uma estruturação complexa que liga o sistema nervoso central ao sistema nervoso entérico e a múltiplas vias metabólicas, inflamatórias e endócrinas. Sendo assim presumível que nestes “caminhos subjacentes” exista uma série de fatores a serem examinados (KONTUREK; BRZOZOWSKI; KONTUREK, 2011; MAYER, 2011).
Até o momento é compreendido que dentro desta comunicação a microbiota intestinal é um dos fatores principais de intermédio. Este fato faz com que seja uma prioridade para o tratamento compreender como os micróbios intestinais geram sinalizações sobre as múltiplas vias. Além disso, também é indispensável considerar que existem disparidades na composição da microbiota entre os indivíduos e nas diferentes populações clínicas. Desta forma, modular e transplantar a microbiota são alternativas discutidas para o tratamento de doenças e transtornos psiquiátricos (BERCIK; COLLINS; VERDU, 2012; DORÉ et al., 2013; SMITS et al., 2013).
No entanto, a microbiota intestinal é complexa, e formada por aproximadamente 100 trilhões de microrganismos vivos que geram uma composição ao longo da vida relativamente estável. Essa composição apesar de “estável” pode sofrer alterações denominadas como “estado de disbiose” um desequilíbrio frequentemente associado com uma série de doenças (FORSYTHE et al., 2010; RODRÍGUEZ et al., 2015). Diversos fatores são considerados influenciadores deste estado (de disbiose). Segundo David et al. (2014) e Wu et al. (2011) a dieta é um deles, já Goodrich et al. (2014) consideram a genética, Yatsunenko et al. (2012) a idade, O’mahony et al. (2009) e Werbner et al. (2019) o estresse, e Markle et al. (2013) a influência exercida por diferentes hormônios sexuais.
Em consequência, com o objetivo de reequilibrar a microbiota, os probióticos vieram a ser exponencialmente estudados. As pesquisas também têm empregado o uso de prebióticos, visto que, prebióticos e probióticos trabalham em sinergismo e suavizam a presença de bactérias nocivas no intestino proporcionando ajustes importantes (VARAVALLO; THOMÉ; THESHIMA, 2008; TSAI et al., 2019).
Recentemente, na área da psiquiatria os probióticos também se tornaram alvo de pesquisas após ser evidenciado que eles produzem “efeitos psicotrópicos”, e por este motivo foram conceituados como psicobióticos: “um organismo vivo que quando ingerido em quantidades adequadas, produz um benefício na saúde dos pacientes que sofrem de doenças psiquiátricas” (DINAN; STANTON; CRYAN, 2013; DINAN; CRYAN, 2016).
Diante o aprofundamento da busca sobre os psicobióticos, observa-se que os artigos de revisão têm reportado com maior frequência estudos pré-clínicos, sendo ainda escassa revisões sobre os estudos que interviram em humanos diagnosticados com o TDM (BERCIK; COLLINS; VERDU, 2012; CRYAN; O’MAHONY, 2011; HUANG; WANG; HU, 2016; LIU; WALSH; SHEEHAN, 2019; YONG et al., 2020). Com isso, novas revisões analisando a qualidade metodológica dos estudos mais recentes se fazem vitais para essa área crescente de pesquisas.
Portanto, o presente estudo formulou o seguinte questionamento: os psicobióticos podem ser denotados como tratamento para o Transtorno Depressivo Maior? Diante disso, determinou-se como objetivo: responder à questão norteadora através de uma revisão de estudos que suplementaram psicobióticos com a intenção de tratar o Transtorno Depressivo Maior. Sendo essas suplementações administradas tanto na forma adjuvante de medicamentos antidepressivos, quanto na forma autônoma (ou seja, sem a suplementação estar aliada a algum medicamento antidepressivo).
2. MATERIAIS E MÉTODOS
Trata-se de uma revisão de busca sistematizada (FERENHOF; FERNANDES, 2016). No qual, os dados foram coletados do começo até o fim do mês de setembro de 2021, através de três bases de dados: Pubmed, Google Scholar, e Scielo, onde foram utilizadas filtragens para a seleção de estudos publicados entre os anos de 2005 e 2021, e termos cedidos pelos Descritores em Ciência da Saúde (DeCS/MeSH), em inglês: probiotics AND depression, probiotics AND depression AND dysbiosis, e em português: probióticos e depressão, probióticos e depressão e disbiose. As etapas deste processo foram descritas no fluxograma (Figura 1) a seguir.
Figura 1 – Delineamento das buscas em Fluxograma (PRISMA 2020)
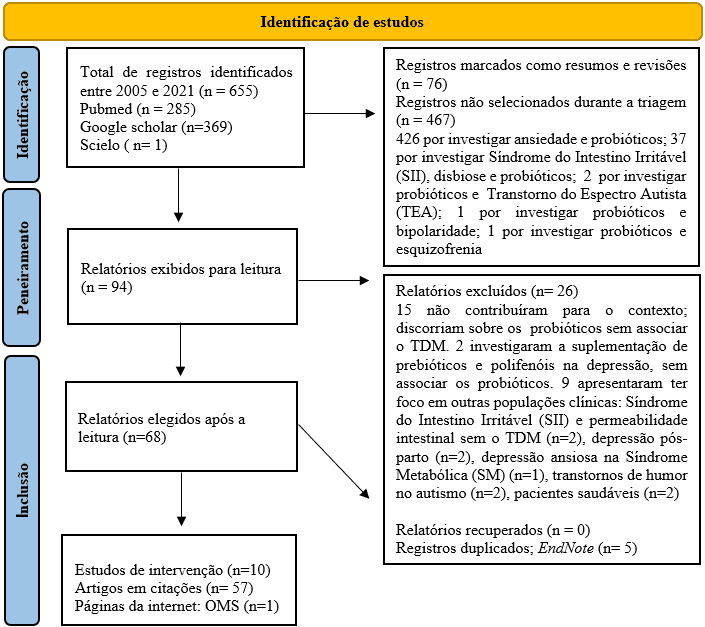
2.1 DETALHAMENTO DAS BUSCAS E EXTRAÇÃO DE DADOS
Após as buscas, um total de 655 artigos foram identificados, onde 94 desses artigos foram coletados para a leitura, pois, apresentaram informações relevantes. Dentre eles, 26 foram excluídos, pois, não contribuíram para o desenvolvimento teórico, e investigaram o uso de probióticos sem associar o Transtorno Depressivo Maior. Por fim, 68 materiais que se apresentaram em português (n=65), inglês (n=2) e espanhol (n=1) foram selecionados. Destes, 10 estudos de intervenção contribuíram para a extração de dados, e 5 deles (randomizados) tiveram sua qualidade metodológica avaliada através da ferramenta Risk of Bias–2 (ROB-2); cedida gratuitamente pela organização Cochrane. Logo após, no banco de dados do SCI Journal (Science Journal Impact Factor), verificou-se o Fator de Impacto (FI) das revistas que publicaram os estudos selecionados (conforme apresentado no Quadro 3).
De modo precedente a elegibilidade dos 10 estudos, foram definidos os seguintes critérios de inclusão: apresentação de texto completo, análise dos efeitos da suplementação de probióticos em humanos ou roedores, ambos os sexos, adultos e idosos, diagnosticados com comportamentos depressivos, e TDM conforme os critérios do DSM-IV/V, por fim, como critério de não-inclusão ficou definido: estudos que analisaram outras desordens psiquiátricas (exemplo: ansiedade, bipolaridade).
3. RESULTADOS
Sob a perspectiva de novas terapêuticas, Logan e Katzman (2005) afirmaram que a suplementação de probióticos é uma proposta válida de estudos, pois, diante a sua hipótese, a suplementação servirá como terapia adjuvante para o Transtorno Depressivo Maior, visto que possui capacidades para reduzir respostas inflamatórias, melhorar o estado nutricional e amenizar o estresse oxidativo.
Estudos de intervenção em humanos e em modelos animais corroboram com esta proposta, de mesmo modo que os estudos selecionados nesta revisão evidenciaram efeitos desta natureza. Nos estudos pré-clínicos foi apresentado que há uma correlação entre a disbiose, permeabilidade intestinal, e comportamentos depressivos (ARSENEAULT-BRÉARD et al., 2012; LI et al., 2019; QIU et al., 2021). Em análise, é percebido que essa relação também envolve metabólitos derivados da microbiota e a seu potencial influência sobre a formação de serotonina (5-HT); neurotransmissor fundamental para a homeostase emocional. A suplementação de probióticos em ratos gerou efeitos na microbiota intestinal e aumentou os níveis de 5-HT no córtex-frontal. Esses efeitos podem ser uma contribuição importante visto que a sintomatologia depressiva está relacionada a concentrações menores de serotonina nesta área do cérebro (LI et al., 2019). Outros aspectos positivos também foram observados sobre o epitélio intestinal através das proteínas Zonulina e E-caderina, e sobre o estado inflamatório diante a diminuição de citocinas pró-inflamatórias (ARSENEAULT-BRÉARD et al., 2012; QIU et al., 2021). Além dos efeitos sobre as vias inflamatórias, as regulações geradas sobre a expressão de genes em receptores do sistema nervoso também parecem contribuir para o efeito antidepressivo durante a suplementação. A espécie L. helveticus MCC1848 destacou-se ao modular o padrão de expressões gênicas (Drd3 e Htr1a) do NAC; área do cérebro relacionada a recompensa, sugerindo reestabelecer os sistemas dopaminérgicos e serotonérgicos. Conforme estes achados é indicativo que os probióticos podem contribuir para o tratamento, porém, é necessário investigar se esses efeitos também acontecem em humanos (MAEHATA et al., 2019).
Apoiando esta busca, Akkasheh et al. (2016) foram um dos primeiros a intervir em humanos diagnosticados com TDM e lograr resultados positivos na escala BDI (Inventário de Depressão de Beck) após 8 semanas com a suplementação de Lactobacillus e Bifidobacterium. No entanto, neste estudo os probióticos foram utilizados como tratamento adjuvante de um medicamento antidepressivo, constituindo uma probabilidade de que os efeitos levariam mais que 8 semanas para acontecer se não fossem suplementados com o medicamento, por isso as durações dos testes devem ser estudadas com maior precisão (ROMIJN et al., 2017).
Em contraste, os pesquisadores têm considerado a análise de diferentes cepas, e prazos de intervenção. Além disso, tem surgido o olhar para a co-suplementação de vitaminas, minerais e probióticos, principalmente nas alterações de humor (JAMILIAN et al., 2018; OSTADMOHAMMADI et al., 2019). No entanto, essa co-suplementação ainda é escassa no TDM, sendo conduzido um interesse maior sobre a suplementação de simbióticos, visto que já apresentaram efeitos positivos na microbiota e na saúde mental de pacientes saudáveis (GHORBANI et al., 2018). Ainda assim, Reininghaus et al. (2020) ressaltaram que a co-suplementação de vitaminas e simbióticos pode ser um caminho interessante para o tratamento da depressão, já que em seus resultados foram observados efeitos expressivos sobre vias inflamatórias e metabólicas. Segundo os autores deste estudo, aprofundar a busca analisando vias metabólicas pode servir como uma chave para o conhecimento mais aprimorado do curso das doenças, e a inter-relação entre transtornos mentais e processos inflamatórios. Conforme visto nas repercussões favoráveis em escalas psiquiátricas, e biomarcadores inflamatórios, os estudos selecionados trazem fundamentos para esta perspectiva ser aprimorada (CHAHWAN et al., 2019; GHORBANI et al., 2018; MAJEED et al., 2018; REITER et al., 2020; WALLACE; MILEV, 2021).
A seguir são apresentados os desfechos de estudos pré-clínicos (Quadro 1), ensaios randomizados e piloto aberto (Quadro 2).
Quadro 1 – Estudos que realizaram intervenções em modelos animais
| Autor(es)/ ano/país | Animais/testes | Probióticos UFC/duração | Resultados | Grupos/ placebo | Conflito de interesses | Limitações |
|
Arseneault- Breárd et al. (2012) Canadá |
40 Ratos
Sprague-Dawley Natação forçada, interação social, esquiva passiva |
Probio’Stick
L . helveticus B . longum 1 bilhão UFC Diluído em água (200ml) 14 dias |
↓ Depressão
↓ Permeabili-dade intestinal ↓ IL-1β citocina ↑ Interação social |
4 grupos (n=10)
Maltodextrina diluída em água (200ml) |
Declarado não conter |
Cirurgia torácica e Infarto do Miocárdio |
|
Li et al. (2019) China |
50 Ratos
Wistar CUMS, natação forçada, preferência de sacarose |
B. longum
L.rhamnosus 1 x 10 9 UFC Via sonda 28 dias |
↓ Depressão
↑ 5 –HT/TPH2 córtex-frontal ↓ Firmicutes e Tenericutes ↑ Controle do peso |
5 grupos (n = 10)
Solução salina via sonda |
Declarado não conter |
Não foi analisado a intervenção em microbiota de modelos de depressão extra, foi suplementado probióticos comuns, e apenas assinaturas metabólicas centrais foram reconhecidas no estudo |
| Maehata et al.
(2019) Japão |
48 Ratos C57BL / 6J (B6) e ICR Interação social, preferência de sacarose, natação forçada |
L. helveticus MCC1848 1 x 10 9 UFC Preparação probiótica foi adicionada a dieta formulada (AIN93G) 7 dias |
↓ Anedonia |
3 grupos (n= 16) Dieta formulada sem o probiótico |
Declarado não conter | Foi utilizado um modelo animal que apresenta depressão branda com menor estresse físico |
| Qiu et al.(2021)
China |
32 Ratos C57BL / 6J Preferência de sacarose, natação forçada (LPS – injeção para indução da depressão) |
Lac L. delbrueckii. subsp. bulgaricus 1 x 10 9 UFC Via sonda 7 dias |
↓ Depressão ↓ Disbiose ↓ Permeabilidade intestinal ↓ Super ativação da micróglia ↓ TLR4 e NLRP3 ↓ IL-1β citocina ↑ ZO-1 e E-caderina |
4 grupos (n=8) Soro fisiológico via sonda |
Declarado não conter | Sem descrições |
Fonte: elaboração original organizada pelas autoras desta revisão. Legenda: ↑ aumentou, ↓ reduziu. UFC Unidades Formadoras de Colônias, 5-HT Serotonina, TPH2 Triptofano Hidroxilase 2, ZO-1 Zonula Occludens-1.
Quadro 2 – Estudos que realizaram intervenções em humanos
| Autor(es)/ ano/país |
Participantes/idade/ diagnóstico/ escalas | Suplementação UFC/duração/ fármaco | Resultados | Grupos/placebo | Conflito de interesses | Limitações |
|
Ghorbani et al. (2018) Irã |
40 pacientes
18 – 65 anos TD moderado HAM-D |
Familact H ®
Simbiótico 2 cápsula/dia L. casei, L. rhamnosus, L. acidophilus, L. bulgaricus, B. breve, B. longum 3x 108, 2 x 109, 2 × 108, 1 × 109 UFC 6 semanas Fármaco: |
↓ Depres-são | 2 grupos (n=20)
Estearato |
Declarado não conter | Amostra pequena, período curto de suplementação |
| Majeed et al. (2018)
Índia |
40 pacientes
20 – 65 anos TDM HAM-D, MADRS, CES-D |
LactoSpore ®
1 cápsula/dia B. coagulans MTCC 5856 (esporos) 2 × 109 UFC 90 dias Fármaco: não foi utilizado |
↓ Depres-são
↓ Insônia ↓ Sinto-mas ↓ Mielope-roxidase |
2 grupos (n=20)
Comprimido |
Declarado que este trabalho foi patrocinado e apoiado pela Sabinsa Corporation NJ 08520, EUA | Amostra pequena |
| Chahwan et al. (2019) Austrália | 71 pacientes
TD leve/moderado a grave 18 anos + MINI, BDI-II, DASS-21 BAI, LEIDS-R |
Ecologic ® Barrier
2 pó sachê/dia B. bifidum, B. lactis W51, B. lactis W52, L. acidophilus, B. breve, L. casei, L. salvarius, L. lactis, L. lactis W58, 1 × 1010 UFC 8 semanas Fármaco: não foi utilizado |
↓ Depressão
↓ Reati-vidade |
2 grupos (n=34 probiótico, n=37 placebos)
Amido de milho e maltodextrina |
Declarado não conter |
A alta taxa de atrito pode ser atribuída as visitas semanais. No pós-julgamento (semana 9) faltou participantes |
|
Reininghaus et al. (2020) Austrália |
61 pacientes
18 – 75 anos TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS Simbiótico
1 pó sachê/dia B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC Adicionado D-biotina (125 mg) 28 dias Fármaco: antidepressivos convencionais |
↓ Depressão
↑ Regulação na via da IL-17 ↑ Regulação ↑ R. gauvreauii e Coprococcus |
2 grupos (n=28 probióticos, n=33 placebos)
Bebida idêntica |
Declarado não conter |
Amostra pequena, tabagistas entre os dois grupos, período curto de suplementação, e a dieta hospitalar pode ter influenciado os resultados. Houve descontinuidade; alocação inicial (n=82) |
|
Reiter et al. (2020) Áustria |
61 pacientes
18 – 75 anos TDM HAM – D, BDI-II, SCL-90 |
OMNi-BiOTiC ® STRESS
Simbiótico 1 pó sachê/dia B. bifidum, B. lactis W51, B. lactis W52, L.acidophilus, L. casei, L.paracasei, L.plantarum, L. salivarius, L. lactis ≥ 2,5 × 109 UFC 4 semanas Fármaco: antidepressivos convencionais dos participantes |
↓ De-pressão
↓ IL- 6 citocina |
2 grupos (n=28 probióticos, n=33 placebos)
Bebida idêntica sem o probiótico, adicionada biotina por questão ética |
Declarado não conter | Efeitos de diferentes medicamentos, período curto de suplementação, a idade e a diferença de sexo dos participantes podem influenciar na microbiota. Houve descontinuidade; alocação inicial (n=82) |
|
Wallace e Milev et al. (2021) Canadá |
10 pacientes 18 – 75 anos TDM CAN-BIND, MADRS, QIDS-SR16, SHAPS |
CEREBIOME ® 1 pó sachê/dia B. longum, L. helveticus 3 x 109 UFC 8 semanas Fármaco: não foi utilizado |
↓ De-pressão ↓ Ane-donia ↑ Qua-lidade do sono |
Não houve grupo placebo |
Declarado não conter |
Amostra pequena, 70% eram mulheres, curto período de suplementação, e o método era não cego sem grupo placebo |
Fonte: elaboração original organizada pelas autoras desta revisão. Legenda: ↑ aumentou, ↓ reduziu. Todos os estudos em humanos selecionaram ambos os sexos masculino ♂ e feminino ♀. UFC Unidades Formadoras de Colônias. SII Síndrome do Intestino Irritável. Escalas: BAI Inventário de ansiedade de Beck, BDI Inventário de Depressão de Beck, CAN-BIND Rede Canadense de Integração de Biomarcadores em Depressão, CES-D Escala de Depressão do Centro de Estudos Epidemiológicos, HAM-D Escala de Avaliação de Hamilton para Depressão, LEIDS-R Índice de Sensibilidade à Depressão de Leiden – Revisado, MADRS Escala de Classificação de Depressão – Montgamarey – Asberg, MINI Mini Entrevista Neuropsiquiátrica Internacional, QIDS-SR16 Inventário Rápido de Sintomatologia Depressiva, SCL-90 Escala de Avaliação de Sintomas-90-R-SCL-Revidado, SHAPS Escala de Prazer Snaith-Hamilton.
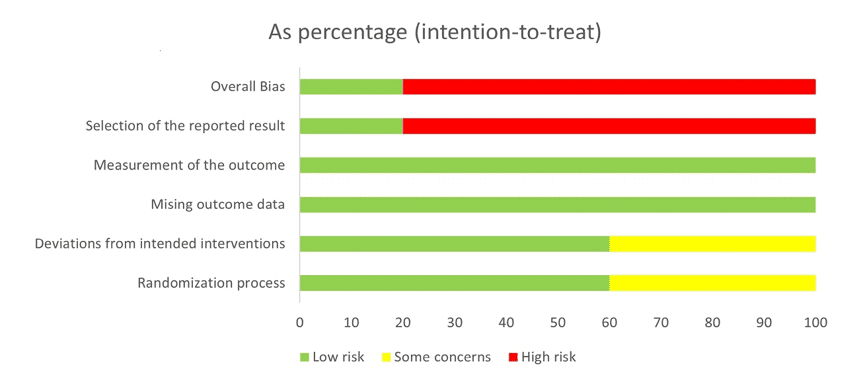
Conforme a extração de dados, foi realizada a análise avaliativa dos riscos de vieses dos estudos randomizados em 5 domínios da ferramenta ROB-2 (Figura 2), originando-se o gráfico (Figura 2.1) a seguir.
Figura 2 – Análises dos riscos de vieses nos estudos randomizados
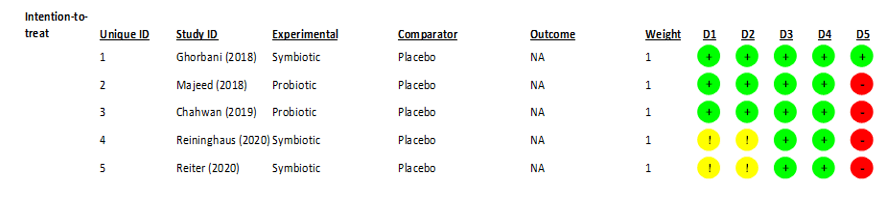
Figura 2.1 – Porcentagens dos riscos de vieses em gráfico
A seguir, os 10 estudos selecionados e suas intervenções (demarcadas com X) são apresentadas de maneira conjunta, e em ordem cronológica.
Quadro 3 – Intervenções aplicadas no conjunto de estudos
| N | Autor(es)/ano | Título, periódico/país, revista: Fator de Impacto (FI) | Probióticos | Antidepressivo | Prebióticos | Vitaminas | Efeitos colaterais |
| I | Arseneault- Breárd et al.(2012) | Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. Canadá. Br J Nutr. FI – WSG: 3.334, Índice H: 188, FI – Scopus: 4.105 | X | ||||
| II | Li et al. (2019) |
Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. China. Neurogastroenterol Motil. FI – WSG: 3,008, Índice H: 42, FI – Scopus: 3,65 | X | X | |||
| III | Maehata et al. (2019) | Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Japão. Biosci Biotech Bioch. FI – WSG: 1.516, Índice H: 116, FI – Scopus: 1,986 | X |
| IV | Qiu et al.(2021) | Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. China. Ann Transl Med. FI – WSG: 3.297, Índice H: 48, FI – Scopus: N/D | X | ||||
| V | Ghorbani et al. (2018) | The Effect of Synbiotic as a Adjuvant Therapy to Fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Irã. Arch Neurosci. FI – N/D | X | X | X | X | |
| VI | Majeed et al. (2018) | Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Índia. Food Nutr Res. FI – WSG: 0,756, Índice H:24, FI – Scopus:1.259 | X | ||||
| VII | Chahwan et al. (2019) | A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Austrália. J Affect Disord. FI – WSG: 3.892, Índice H: 188, FI – Scopus: 5,104 | X | X |
| VIII | Reinin-ghauset al. (2020) | PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression—A Randomized Controlled Trial. Áustria. Nutrients. FI – WSG: 4.546 , Índice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| IX | Reiter et al.(2020) | Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Áustria. Nutrients. FI – WSG: 4.546 , Índice H: 115, FI – Scopus: 5,929 | X | X | X | X | |
| X | Wallace e Milev (2021) | Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Canadá. Front Psychiatry. FI – WSG: 4.157, Índice H: N/D, FI – Scopus: 7.864 | X |
Fonte: elaboração original organizada pelas autoras desta revisão. Legenda: FI Fator de Impacto, Índice H – Google Scholar, N/D Não Definido, WSG Web of Science Group.
4. DISCUSSÃO
Segundo a Organização Mundial da Saúde (OMS, 2020) o transtorno depressivo tem se apresentado como uma condição preocupante para o século XXI, por refletir nos índices crescentes de suicídio. Em constância o campo científico tem reiterado sobre este tema, e intensificado esforços para desenvolver novos tratamentos que possam contribuir para a melhora dos sintomas depressivos através da modulação intestinal (KELLY et al., 2016; YONG et al., 2020).
Porém, na literatura predominam estudos pré-clínicos que suplementaram psicobióticos, e obtiveram resultados significativos sobre a disbiose, permeabilidade intestinal e neuroquímica cerebral (ARSENEAULT-BRÉARD et al., 2012; CRYAN; O’MAHONY, 2011; LI et al., 2019; MAEHATA et al., 2019; QIU et al., 2021; YONG et al., 2020). Felizmente este cenário está mudando, e os estudos em humanos estão sendo cada vez mais encorajados, reconhecendo que os probióticos beneficiam a microbiota e múltiplas vias endócrinas, inflamatórias e neurais. No entanto, essa heterogeneidade de ação demanda uma compreensão maior sobre o “microbioma entérico-intestino-cérebro” (DINAN; CRYAN, 2016; CRYAN; O’MAHONY, 2011; HEMARAJATA; VERSALOVIC, 2013).
Os diferentes resultados em biomarcadores e na pontuação de escalas psiquiátricas corroboram com esta afirmativa, pois, torna claro que os mecanismos de ação variam conforme o gênero e espécie do probiótico suplementado. Até o momento, os mecanismos mais investigados são de bactérias dos gêneros Lactobacillus e Bifidobacterium, que se mostraram amplamente seguras, inclusive no tratamento de transtornos depressivos (IVANOV; HONDA, 2012; VIZCAÍNO et al., 2016; ZAWISTOWSKA-ROJEK; TYSKI, 2018).
Todavia, a dieta e os fatores nutricionais também têm valor nesta investigação (DASH et al., 2015; HOLSCHER, 2017; LEDOCHOWSKI et al., 2000; LIU; CAO; ZHANG, 2015; SUZUKI, 2020; SKONIECZNA-ŻYDECKA et al., 2018). Segundo Logan e Katzman (2005) melhorar o estado nutricional e promover efeitos anti-inflamatórios é eminente para obter-se um êxito maior no alívio dos sintomas depressivos.
Diante disto, torna-se válido destacar que a co-suplementação de um simbiótico e vitamina B7 (D-biotina) mostraram competências para regular tanto vias metabólicas quanto inflamatórias, e beneficiar a microbiota intestinal de pacientes com TDM. Além disso, os desfechos dessa co-suplementação apresentaram acréscimos nas concentrações de Ruminococcus gauvreauii e Coprococcus; que em predominância estão relacionadas com aumento na qualidade de vida, porém, não expressaram efeito algum sobre a permeabilidade intestinal. Mesmo assim, em consideração aos resultados, Reininghaus et al. (2020) concluíram que existe uma conexão importante entre a qualidade da dieta, microbiota intestinal, e saúde mental, incentivando que os novos estudos incluam a análise de vias metabólicas junto as investigações sobre vias inflamatórias.
Até o momento, o interesse maior está em compreender a atividade cerebral e as respostas inflamatórias na disbiose e nos transtornos psiquiátricos (LEVY et al., 2017; TILLISCH et al., 2013; TRAN et al., 2019). Acredita-se que citocinas pró-inflamatórias apresentam um papel importante sobre a patogênese da depressão, e com isso, a Interleucina-6 (IL-6) tem ganhado foco. Contraponto as respostas do sistema imune são realizadas em cascatas e abrangem ampla interação sistêmica, sendo assim, necessário que existam mais investigações sobre os subtipos de inflamação nos diferentes graus de depressão (REITER et al., 2020). Em consonância é essencial estender as análises para outros tipos de cepas probióticas, e observar a integridade das respostas imune inata, visto que esta também é uma interface a serem minuciada (MAJEED et al., 2018).
Tanto a suplementação de prebióticos quanto de probióticos têm demonstrado habilidades de ação sobre a imunidade e diversas doenças (DIDARI et al., 2015; SLAVIN, 2013; VIZCAÍNO et al., 2016; ZALAR; HALSBERGER; PETERLIN, 2018). Com isso, nestas suplementações devem ser consideradas as disparidades da microbiota de cada indivíduo. Por exemplo, nos pacientes deprimidos geralmente encontra-se a “microbiota da depressão” com a predominância de bactérias do filo Firmicutes, Bacteroidetes e Actinobacteria. Essa diversidade que compõe a microbiota tem estimulado a análise taxonômica das bactérias intestinais residentes de diferentes populações clínicas com o objetivo de compará-las, e compreender suas respostas (GOODMAN et al., 2011; NEISH, 2009; SARTOR, 2008; ZHENG et al., 2016).
Eventualmente, há estudos que expõem as disparidades da microbiota durante a suplementação de probióticos. Chahwan et al. (2019) em seu estudo analisou as diferenças na composição da microbiota entre indivíduos diagnosticados com depressão leve, moderada e grave, e evidenciou não haver significativa diferença entre eles, já na comparação entre indivíduos não deprimidos e deprimidos houve a predominância de Ruminococcus gnavus naqueles diagnosticados com depressão grave. Neste estudo também foram observados efeitos colaterais como náusea e sonolência durante a suplementação de Lactobacillus e Bifidobacterium. Assim como este, outro estudo também descreveu efeitos colaterais em indivíduos do grupo placebo e probióticos, apesar disso, os dois estudos obtiveram uma boa adesão dos tratamentos (CHAHWAN et al., 2019; GHORBANI et al., 2018). Em comparação no estudo de Majeed et al. (2018) a suplementação de Bacillus coagulans MTCC 5856 não provocou efeitos colaterais e atenuou justamente os sintomas gastrointestinais e a insônia de pacientes diagnosticados com TDM e Síndrome do Intestino Irritável.
Diante desta questão, é importante ressaltar que os sintomas gastrointestinais são comumente relatados nas perturbações da microbiota intestinal, e nos transtornos psiquiátricos. E, por isso, essa relação tem direcionado a atenção dos pesquisadores para a suplementação de simbióticos na saúde em geral (CARDING et al., 2015; MAJEED et al., 2018; O’HARA; SHANAHAN, 2006). Pois, os probióticos e simbióticos já evidenciaram efeitos positivos sobre a saúde mental, respostas inflamatórias, e sintomas gastrointestinais ligados ao TDM (GHORBANI et al., 2018; MAJEED et al., 2018; REININGHAUS et al., 2020; REITER et al., 2020).
No entanto, nesta revisão, os estudos que suplementaram simbióticos e beneficiaram vias inflamatórias, mantiveram os medicamentos psicotrópicos convencionais de seus participantes (REININGHAUS et al., 2020; REITER et al., 2020). Com isso, dos seis estudos em humanos apenas três apresentaram os efeitos dos probióticos em sua forma autônoma, ou seja, sem usar medicamentos (CHAHWAN et al., 2019; MAJEED et al., 2018; WALLACE; MILEV, 2021). Dentre eles, um dos estudos mais recentes analisou os efeitos dos probióticos em 10 pacientes virgens de fármacos antidepressivos. De tal forma, Wallace e Milev (2021) obtiveram resultados positivos sobre a sintomatologia depressiva dentro de 4 a 8 semanas, porém, durante o delineamento deste estudo os participantes se mantiveram não-cegos, e não houve um grupo placebo para comparativos.
Contudo, é preciso considerar que apesar dos resultados, a maioria dos estudos independe da escolha de administração; seja com ou sem medicamentos, descreveram limitações e apresentaram riscos de vieses. Este fato propõe novos estudos com delineamentos de pesquisa mais bem planejados, e uma compreensão maior sobre o sistema de comunicação e resposta do eixo intestino-cérebro. Afinal, é possível que até agora as pesquisas tenham apresentado apenas a ponta de um “iceberg” que ocupará o campo científico por algum tempo, mas que de certa forma já tem revelado perspectivas promissoras para a área de psiquiatria nutricional (GRENHAM et al., 2011; SARRIS et al., 2015).
5. CONSIDERAÇÕES FINAIS
De acordo com a revisão de dados, e citações organizadas neste estudo, é possível retomar o olhar para a questão norteadora: “os psicobióticos podem ser denotados como tratamento para o Transtorno Depressivo Maior?” E concluir com unanimidade: os estudos sugerem que os psicobióticos podem ser denotados como tratamento para o Transtorno Depressivo Maior, pois, os efeitos psicotrópicos no qual produzem tiveram eficácia em reduzir os sintomas depressivos dos pacientes dentro de 4 a 8 semanas, conforme observado nos desfechos de escalas psiquiátricas validadas para esta análise.
Além da sintomatologia depressiva, simultaneamente outros fatores importantes para o reequilíbrio da saúde mental foram otimizados, como a qualidade do sono, e a diminuição de respostas inflamatórias, que vieram a se destacar dentro ao tema, gerando a ciência de que é preciso uma conjectura de olhares a serem realizados para que esse tratamento possa ser viabilizado. Sendo, portanto, imprescindível considerar diante as suplementações: que cada indivíduo possui disparidades em sua microbiota, ao mesmo tempo que, a composição da microbiota intestinal está intimamente ligada às respostas inflamatórias. Porém, é possível que os diferentes subtipos de inflamação não se apresentem sobre a análise de um só biomarcador inflamatório, sendo, portanto, pertinente levar estes olhares para investigações futuras, visto que, a regulação do estado inflamatório tem repercutido como uma das vias de acesso para o alívio da sintomatologia depressiva. A partir disso, conecta-se a esta linha de pensamento a importância de abranger as investigações avaliando vias inflamatórias e metabólicas diante fatores nutricionais, pois, segundo as evidências, aprofundar o olhar também sobre esse aspecto pode ser algo importante para novas discussões.
Ademais, o campo científico expressa que é necessária uma compreensão maior sobre o eixo intestino-cérebro e os mecanismos de diferentes cepas probióticas, diante disso, recomenda-se a suplementação de psicobióticos como terapia adjuvante de medicamentos antidepressivos.
Por fim, mediante a extração de dados, e a análise avaliativa da qualidade metodológica dos estudos randomizados, realizada nesta revisão, formalizaram-se os seguintes direcionamentos para os estudos subsequentes: o delineamento metodológico deve ser mais bem planejado, de modo que, os estudos futuros tenham um risco de viés menor nos domínios: viés geral, seleção dos resultados, desvios na intervenção pretendida, e processo de randomização. Além disso, visando as limitações descritas, é essencial que os estudos futuros realizem intervenções tendo períodos de testes mais prolongados, em amostras maiores considerando a suplementação de psicobióticos na forma adjuvante e autônoma, para que assim, se torne possível distinguir os efeitos dos probióticos e os efeitos dos antidepressivos. Pois, diante do aprimoramento dos estudos, é provável que mais luzes se acendam dentro das discussões sobre a saúde mental, e assim, se torne cada vez mais claro os conhecimentos obtidos até o momento sobre o eixo intestino-cérebro.
REFERÊNCIAS
AKKASHEH, Ghodarz et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition, Estados Unidos, vol. 32, n.3, p.315-20, mar. 2016. Disponível em: doi:10.1016/j.nut.2015.09.003 Acesso em: 01/09/2021.
ARSENEAULT-BRÉARD, Jessica et al. Combination of Lactobacillus helveticus R0052 and Bifidobacterium longum R0175 reduces post-myocardial infarction depression symptoms and restores intestinal permeability in a rat model. The British Journal of Nutrition, Canadá, vol. 107, n. 12, p. 1793-9, jun. 2012. Disponível em: doi:10.1017/S0007114511005137 Acesso em: 13/09/2021.
BAPTISTA, Makilim Nunes. Avaliando “depressões”: dos critérios diagnósticos às escalas psicométricas. Avaliação Psicológica, Brasil, vol. 17, n. 3, p. 301-310, set. 2018. Disponível em: http://dx.doi.org/10.15689/ap.2018.1703.14265.03 Acesso em: 01/09/2021.
BERCIK, P.; COLLINS, S.M.; VERDU, E.F. Microbes and the gut-brain axis. Neurogastroenterol Motil, Canadá, vol. 24, n.5, p. 405-13, mai. 2012. Disponível em: https://doi.org/10.1111/j.1365-2982.2012.01906.x Acesso em: 01/09/2021.
CARDING, Simon et al. Dysbiosis of the gut microbiota in disease. Microbial Ecology in Health and Disease, Reino Unido, vol. 26, p. 26191, fev. 2015. Disponível em: doi: 10.3402/mehd.v26.26191 Acesso em: 02/09/2021.
CHAHWAN, Bahia et al. Gut feelings: A randomised, triple-blind, placebo-controlled trial of probiotics for depressive symptoms. Journal of Affective Disorders, Austrália, vol. 253, p. 317-326, jun. 2019. Disponível em: doi:10.1016/j.jad.2019.04.097 Acesso em: 13/09/2021.
CRYAN, J. F.; O’MAHONY, S. M. The microbiome-gut-brain axis: from bowel to behavior. Neurogastroenterology and Motility, Irlanda, vol. 23, n.3, p. 187-92, mar. 2011. Disponível em: doi:10.1111/j.1365-2982.2010.01664.x Acesso em: 01/09/2021.
DASH, Sarah et al. The gut microbiome and diet in psychiatry: focus on depression. Current Opinion in Psychiatry, Austrália, vol. 28,1, n. 1, p. 1-6, jan. 2015. Disponível em: doi:10.1097/YCO.0000000000000117 Acesso: 02/09/2021.
DAVID, Lawrence A., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature, Estados Unidos, vol. 505, n. 7484 p. 559-63, jan. 2014. Disponível em: doi:10.1038/nature12820 Acesso em: 01/09/2021.
DIDARI, Tina et al. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World Journal of Gastroenterology, Irã, vol. 21, n. 10, p. 3072-84, mar. 2015. Disponível em: doi:10.3748/wjg.v21.i10.3072 Acesso em: 02/09/2021.
DINAN, Timothy G.; STANTON, Catarina; CRYAN, John F. Psychobiotics: a novel class of psychotropic. Biological Psychiatry, Irlanda, vol. 74, n. 10, p. 720-6, nov. 2013. Disponível em: doi:10.1016/j.biopsych.2013.05.001 Acesso em: 01/09/2021.
DINAN, Timothy G.; CRYAN, John F. Mood by microbe: towards clinical translation. Genome Medicine, Irlanda, vol. 8, n. 1, p. 36, abr. 2016. Disponível em: doi:10.1186/s13073-016-0292-1 Acesso em: 01/09/2021.
DORÉ, Joël et al. Hot topics in gut microbiota. United European Gastroenterol J, França, vol. 1, n. 5, p. 311-318, out. 2013. Disponível em: doi:10.1177/2050640613502477 Acesso em: 01/09/2021.
FERENHOF, Helio Aisenberg; FERNANDES, Roberto Fabiano. Desmistificando a revisão de literatura como base para redação científica: método SSF. Revista ACB; Biblioteconomia em Santa Catarina – SC, Florianópolis, Brasil, vol. 21, n. 3, p. 550-563, ago./nov. 2016. Disponível em: file:///C:/Users/Usuario/Downloads/1194-6369-1-PB.pdf Acesso em: 01/09/2021.
FORSYTHE, Paul et al. Mood and gut feelings. Brain, Behavior, and Immunity, Canadá, vol. 24, n. 1, p. 9-16, jan. 2010. Disponível em: doi:10.1016/j.bbi.2009.05.058 Acesso em: 01/09/2021.
GHORBANI, Zeinab et al. The Effect of symbiotic as an Adjuvant Therapy to fluoxetine in Moderate Depression: A Randomized Multicenter Trial. Arch Neurosci, Irã, vol. 5, n.2, p.60507, abr. 2018. Disponível em: doi: 10.5812/archneurosci.60507 Acesso em: 13/09/2021.
GOODMAN, Andrew L., et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proceedings of the National Academy of Sciences of the United States of America, Estados Unidos, vol. 108, n.15, p. 6252-7. abr. 2011. Disponível em: doi:10.1073/pnas.1102938108 Acesso em: 01/09/2021.
GOODRICH, Julia K., et al. Human genetics shape the gut microbiome. Cell, Estados Unidos, vol. 159, n. 4, p. 789-99, nov. 2014. Disponível em: doi:10.1016/j.cell.2014.09.053 Acesso em: 01/09/2021.
GRENHAM, Sue et al Brain-gut-microbe communication in health and disease. Front Physiol, Irlanda, vol. 2 p. 94, dez. 2011. Disponível em: https://doi.org/10.3389/fphys.2011.00094 Acesso em: 01/09/2021.
HEMARAJATA, Peera; VERSALOVIC, James. Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation. Therapeutic Advances in Gastroenterology, Estados Unidos, vol. 6, n. 1, p. 39-51. jan. 2013. Disponível em: doi:10.1177/1756283X12459294 Acesso em: 02/09/2021.
HOLSCHER, Hannah D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes, Estados Unidos, vol. 8, n. 2, p. 172-184, mar. 2017. Disponível em: doi:10.1080/19490976.2017.1290756 Acesso em: 02/09/2021.
HUANG, Ruixue; WANG, Ke; HU, Jianan. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients, China, vol. 8, n. 8, p. 483, ago. 2016. Disponível em: https://doi.org/10.3390/nu8080483 Acesso em: 01/09/2021.
IBANEZ, Grazielle et al. Adesão e dificuldades relacionadas ao tratamento medicamentoso em pacientes com depressão. Rev Bras Enferm, Brasil, vol. 67, n. 4, p. 556-562, ago. 2014. Disponível em: https://doi.org/10.1590/0034-7167.2014670409 Acesso em: 01/09/2021.
IVANOV, Ivaylo I; HONDA, Quênia. Intestinal commensal microbes as immune modulators. Cell host & microbe, Estados Unidos, vol. 12, n. 4, p. 496-508, out. 2012. Disponível em: https://doi.org/10.1016/j.chom.2012.09.009 Acesso em: 02/09/2021.
JAMILIAN, Mehri et al. The effects of probiotic and selenium co-supplementation on parameters of mental health, hormonal profiles, and biomarkers of inflammation and oxidative stress in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 11, n. 1, p. 80, set. 2018. Disponível em: https://doi.org/10.1186/s13048-018-0457-1 Acesso em: 01/09/2021.
KELLY, John R., et al. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research, Irlanda, vol. 82, p. 109-118, nov. 2016. Disponível em: https://doi.org/10.1016/j.jpsychires.2016.07.019 Acesso em: 02/09/2021.
KONTUREK, Peter C.; BRZOZOWSKI, T.; KONTUREK, S. J. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. Journal of Physiology and Pharmacology, Alemanha, vol. 62, n. 6, p. 591-599, dez. 2011. Disponível em: https://www.jpp.krakow.pl/journal/archive/12_11/pdf/591_12_11_article.pdf Acesso em: 01/09/2021.
LEDOCHOWSKI, M., et al. Carbohydrate malabsorption syndromes and early signs of mental depression in females. Digestive Diseases and Sciences, Áustria, vol. 45, n. 7, p. 1255-9, jul. 2000. Disponível em: doi:10.1023/a:1005527230346 Acesso em: 02/09/2021.
LEVY, Maayan et al. Dysbiosis and the immune system. Nature Reviews. Immunology, Israel, vol. 17, n. 4, p. 219-232, mar. 2017. Disponível em: doi:10.1038/nri.2017.7 Acesso em: 02/09/2021.
LI, Huawei et al. Effects of regulating gut microbiota on the serotonin metabolism in the chronic unpredictable mild stress rat model. Neurogastroenterol Motil, China, vol. 31, n. 10, p. 13677, jul. 2019. Disponível em: doi: 10.1111/nmo.13677 Acesso em: 13/09/2021.
LIU, Richard T.; WALSH, Rachel F.L.; SHEEHAN, Ana E. Prebiotics and probiotics for depression and anxiety: A systematic review and meta-analysis of controlled clinical trials. Neurosci Biobehav Rev, Estados Unidos, vol. 102, p. 13-23, abr. 2019. Disponível em: doi:10.1016/j.neubiorev.2019.03.023 Acesso em: 01/09/2021.
LIU, Xiaofei; CAO, Shangqing; ZHANG, Xuewu. Modulation of Gut Microbiota-Brain Axis by Probiotics, Prebiotics, and Diet. J Agric Food Chem, China, vol. 63, n. 36, p. 7885-7895, set. 2015. Disponível em: doi:10.1021/acs.jafc.5b02404 Acesso em: 02/09/2021.
LOGAN, Alan C.; KATZMAN Martin. Major depressive disorder: probiotics may be an adjuvant therapy. Med Hypotheses, Estados Unidos, vol. 64, n. 3, p. 533-538, out. 2005. Disponível em: doi:10.1016/j.mehy.2004.08.019 Acesso em: 02/09/2021.
MAEHATA, Hazuki et al. Heat-killed Lactobacillus helveticus strain MCC1848 confers resilience to anxiety or depression-like symptoms caused by subchronic social defeat stress in mice. Bioscience, Biotechnology, and Biochemistry, Japão, vol. 83, n. 7 p. 1239-1247, mar. 2019. Disponível em: doi:10.1080/09168451.2019.1591263 Acesso em: 13/09/2021.
MAJEED, Muhammed et al. Bacillus coagulans MTCC 5856 for the management of major depression with irritable bowel syndrome: a randomised, double-blind, placebo controlled, multi-centre, pilot clinical study. Food & Nutrition Research, Índia, vol. 62, jul. 2018. Disponível em: doi:10.29219/fnr.v62.1218 Acesso em: 13/09/2021.
MARKLE, Janet G. M., et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science, Canadá, vol. 339, n. 6123, p. 1084-8, jan. 2013. Disponível em: doi: 10.1126/science.1233521 Acesso em: 01/09/2021.
MAYER, Emeran A. Gut feelings: the emerging biology of gut-brain communication. Nature Reviews. Neuroscience, Estados Unidos, vol. 12, n. 8, p. 453-66, jul. 2011, Disponível em: doi:10.1038/nrn3071 Acesso em: 01/09/2021.
MOTTA, Cibele Cunha Lima; MORÉE, Carmen Leontina Ojeda Ocampo; NUNES, Carlos Henrique Sancineto da Silva. O atendimento psicológico ao paciente com diagnóstico de depressão na Atenção Básica. Cienc Saúde Colet, Brasil, vol. 22, n. 3, p. 911-920, mar. 2017. Disponível em: https://doi.org/10.1590/1413-81232017223.27982015 Acesso em: 01/09/2021.
NEISH, Andrew S. Microbes in gastrointestinal health and disease. Gastroenterologia, Estados Unidos. vol. 136, n. 1, p. 65-80, jan. 2009. Disponível em: doi:10.1053/j.gastro.2008.10.080 Acesso em: 02/09/2021.
O’HARA, Ann M.; SHANAHAN, Fergus. The gut flora as a forgotten organ. EMBO Reports, Irlanda, vol. 7, n. 7, p. 688-93, jul. 2006. Disponível em: doi:10.1038/sj.embor.7400731 Acesso em: 02/09/2021.
O’MAHONY, Siobhain M., et al. Early life stress alters behavior, immunity, and microbiota in rats: implications for irritable bowel syndrome and psychiatric illnesses. Biological Psychiatry, Irlanda, vol. 65, n. 3, p. 263-7, fev. 2009. Disponível em: doi:10.1016/j.biopsych.2008.06.026 Acesso em: 02/09/2021.
ORGANIZAÇÃO MUNDIAL DA SAÚDE (OPAS/OMS). Folha Informativa – Depressão. (Brasil, 2020). Disponível em: https://www.paho.org/pt/topicos/depressao Acesso em: 01/09/2021.
OSTADMOHAMMADI, Vahidreza et al. Vitamin D and probiotic co-supplementation affects mental health, hormonal, inflammatory and oxidative stress parameters in women with polycystic ovary syndrome. Journal of Ovarian Research, Irã, vol. 12, n. 1, p. 5, jan. 2019. Disponível em: doi:10.1186/s13048-019-0480-x Acesso em: 02/09/2021.
QIU, Xiangjie et al. Lactobacillus delbrueckii alleviates depression-like behavior through inhibiting toll-like receptor 4 (TLR4) signaling in mice. Annals of Translational Medicine, China, vol. 9, n. 5 p. 366, mar. 2021. Disponível em: doi:10.21037/atm-20-4411 Acesso em: 13/09/2021.
REININGHAUS, Eva Z., et al. PROVIT: Supplementary Probiotic Treatment and Vitamin B7 in Depression-A Randomized Controlled Trial. Nutrients, Áustria, vol. 12, n. 11, p. 3422, nov. 2020. Disponível em: doi:10.3390/nu12113422 Acesso em:13/09/2021.
REITER, Alexandra et al. Interleukin-6 Gene Expression Changes after a 4-Week Intake of a Multispecies Probiotic in Major Depressive Disorder-Preliminary Results of the PROVIT Study. Nutrients, Áustria, vol. 12, n. 9, p. 2575, ago. 2020. Disponível em: doi:10.3390/nu12092575 Acesso em: 13/09/2021.
RODRÍGUEZ, Juan Miguel et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microbial Ecology in Health and Disease, Espanha, vol. 26, n. 26050, fev. 2015. Disponível em: doi:10.3402/mehd.v26.26050 Acesso em: 01/09/2021.
ROMIJN, Amy R., et al. A double-blind, randomized, placebo-controlled trial of Lactobacillus helveticus and Bifidobacterium longum for the symptoms of depression. The Australian and New Zealand Journal of Psychiatry, Nova Zelândia, vol. 51, n. 8, p. 810-821, ago. 2017. Disponível em: doi:10.1177/0004867416686694 Acesso em: 01/09/2021.
SARRIS, Jerome et al. Nutritional medicine as mainstream in psychiatry. The Lancet. Psychiatry, Estados Unidos, vol. 2, n. 3, p. 271-4, fev. 2015. Disponível em: doi:10.1016/S2215-0366(14)00051-0 Acesso em: 02/09/2021.
SKONIECZNA-ŻYDECKA, Karolina et al. Faecal Short Chain Fatty Acids Profile is Changed in Polish Depressive Women. Nutrients, Polônia, vol. 10, n. 12, p. 1939, dez. 2018. Disponível em: doi:10.3390/nu10121939 Acesso em: 02/09/2021.
SLAVIN, Joanne. Fiber and prebiotics: mechanisms and health benefits. Nutrients, Estados Unidos, vol. 5, n. 4, p. 1417-35, abr. 2013. Disponível em: doi:10.3390/nu5041417 Acesso em: 02/09/2021.
SMITS, Loek P., et al. Therapeutic potential of fecal microbiota transplantation. Gastroenterology, Holanda, vol. 145, n. 5, p. 946-53, set. 2013. Disponível em: doi:10.1053/j.gastro.2013.08.058 Acesso em: 02/09/2021.
SARTOR, R Balfour. Microbial influences in inflammatory bowel diseases. Gastroenterology, Estados Unidos, vol. 134, n. 2, p. 577-94, fev. 2008. Disponível em: doi:10.1053/j.gastro.2007.11.059 Acesso em: 02/09/2021.
SUZUKI, Takuya. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Animal Science Journal Nihon Chikusan Gakkaiho, Japão, vol. 91, n. 1, p. 13357, dez. 2020. Disponível em: doi:10.1111/asj.13357 Acesso em: 02/09/2021.
TILLISCH, Kirsten et al. Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, Estados Unidos, vol. 144, n. 7, p. 1394-401; 1401.e1-4, mar. 2013. Disponível em: doi:10.1053/j.gastro.2013.02.043 Acesso em: 02/09/2021.
TRAN, Nhan et al. The gut-brain relationship: Investigating the effect of multispecies probiotics on anxiety in a randomized placebo-controlled trial of healthy young adults. Journal of Affective Disorders, Estados Unidos, vol. 252, p. 271-277, abr. 2019. Disponível em: doi:10.1016/j.jad.2019.04.043 Acesso em: 02/09/2021.
TSAI, Yu-Ling et al. Probiotics, prebiotics and amelioration of diseases. Journal of Biomedical Science, Taiwan, vol. 26, n. 1, p. 3, jan. 2019. Disponível em: doi:10.1186/s12929-018-0493-6 Acesso em: 01/09/2021.
VARAVALLO, Maurilio Antonio; THOMÉ, Julia Nigro; TESHIMA, Elisa. Aplicação de bactérias probióticas para profilaxia e tratamento de doenças gastrointestinais. Semina: Cienc Biol Saúde, Brasil, vol. 29, n. 1, p. 83-104, jun. 2008. Disponível em: http://dx.doi.org/10.5433/1679-0367.2008v29n1p83 Acesso em: 01/09/2021.
VIZCAÍNO, Ricnia et al. Usos clínicos de los probióticos. Arch Venez Pueric Pediatr, Venezuela, vol. 79, n. 1, p. 029-040, mar. 2016. Disponível em: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S000406492016000100007&lng=es&nrm=iso Acesso em: 01/09/2021.
WALLACE, Caroline J. K.; MILEV, Roumen V. The Efficacy, Safety, and Tolerability of Probiotics on Depression: Clinical Results From an Open-Label Pilot Study. Front Psychiatry, Canadá, vol. 12 p. 618279, fev. 2021. Disponível em: doi: 10.3389/fpsyt.2021.618279 Acesso em: 13/09/2021.
WERBNER, Michal et al. Social-Stress-Responsive Microbiota Induces Stimulation of Self-Reactive Effector T Helper Cells. MSystems, Israel, vol. 4, n. 4, p. 00292-18, mai. 2019. Disponível em: doi:10.1128/mSystems.00292-18 Acesso em: 01/09/2021.
WU, Gary D., et al. Linking long-term dietary patterns with gut microbial enterotypes. Science, Estados Unidos, vol. 334, n. 6052, p. 105-8, set. 2011. Disponível em: doi:10.1126/science.1208344 Acesso em: 01/09/2021.
YATSUNENKO, Tanya et al. Human gut microbiome viewed across age and geography. Nature, Estados Unidos, vol. 486, n. 7402, p. 222-7, mai. 2012. Disponível em: doi:10.1038/nature11053 Acesso em: 02/09/2021.
YONG, Shin Jie et al. Antidepressive Mechanisms of Probiotics and Their Therapeutic Potential. Frontiers in Neuroscience, Malásia, vol. 13, p. 1361, jan. 2020. Disponível em: doi:10.3389/fnins.2019.01361 Acesso em: 01/09/2021.
YUAN, Ziqi et al. Application of antidepressants in depression: A systematic review and meta-analysis. Journal of Clinical Neuroscience, China, vol. 80, p. 169-181, ago. 2020. Disponível em: doi:10.1016/j.jocn.2020.08.013 Acesso em: 01/09/2021.
ZALAR, Bojan; HALSBERGER, Alexandre; PETERLIN, Borut. The Role of Microbiota in Depression – a brief review. Psychiatria Danubina, Eslovênia, vol. 30, n. 2, p. 136-141, jun. 2018. Disponível em: doi:10.24869/psyd.2018.136 Acesso em: 01/09/2021.
ZAWISTOWSKA-ROJEK, Anna; TYSKI, Stefan. Are Probiotic Really Safe for Humans? Polish Journal of Microbiology, Polônia, vol. 67, n. 3, p. 251-258, set. 2018. Disponível em: doi:10.21307/pjm-2018-044 Acesso em: 02/09/2021.
ZHENG, P., et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Molecular Psychiatry, China, vol. 21, n. 6, p. 786-96, jun. 2016. Disponível em: doi:10.1038/mp.2016.44 Acesso em: 02/09/2021.
[1] Graduada em Nutrição; Certificação em Psiquiatria Nutricional (INCCOR-RJ). ORCID: 0000-0002-1588-5679.
[2] Orientadora. Graduada em nutrição; Doutora em saúde coletiva; Mestra em metabolismo e dietética; Docente na área de nutrição. ORCID: 0000-0002-7556-2548.
Enviado: Março, 2022.
Aprovado: Maio, 2022.


Uma resposta
Amei o estudo tenho 3 irmãos que sofre de depressão inclusive com tentativa de suicídio 3x . Gostaria como fazer esses probiótico para auxiliar no melhoramento de uma vida sem sentido, viver de qualquer jeito , para que eles possam dá um sentido novo na vida. Obrigada me ajudou muito a entender muita coisa.