ARTICLE ORIGINAL
BEDIN, Rafael Antonio Caldart [1], SCHULTZ, Maisa [2], BEDIN, Antonio [3]
BEDIN, Rafael Antonio Caldart. SCHULTZ, Maisa. BEDIN, Antonio. Anesthésie pour lapins soumis à des chirurgies expérimentales: Rapport d’une série de huit anesthésies. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 06, Vol. 03, pp. 151-158. juin 2020. ISSN: 2448-0959, Lien d’accès: https://www.nucleodoconhecimento.com.br/sante/anesthesie-pour-lapins
RÉSUMÉ
L’anesthésie pour les animaux de laboratoire est une source de préoccupation biomédicale et l’un des dilemmes les plus présents dans le débat bioéthique actuel. L’utilisation d’agents anesthésiques en chirurgie expérimentale vise l’analgésie et le confinement des animaux, afin d’atteindre un degré raisonnable de relaxation musculaire et de produire suffisamment d’analgésie. Cette pratique exige l’utilisation de protocoles pour l’administration de doses sûres et efficaces. Huit lapins néo-zélandais soumis à des laparotomies démontrant la discipline de la technique chirurgicale du cours médical local. Pour le médicament préanesthésique, l’acépromazine 1 mg.kg-1 associée à la kétamine 15 mg.kg-1 a été utilisée sous-cutanée pour les médicaments préanesthésiques. L’anesthésie a été maintenue avec l’isoflurane et l’oxygène sous le masque laryngeal dans le système d’anesthésie de mapleson et sous la respiration spontanée. L’hydratation a été effectuée avec la solution 10-ml.kg-1 toutes les heures. Matelas thermique a été utilisé. Pour la surveillance, un stéthoscope précordial, une oximétrie des impulsions et des paramètres cliniques ont été utilisés. Pour l’euthanasie, la kétamine 10 mg.kg-1 associée au chlorure de potassium 19,1 % 1 ml.kg-1 par voie intraveineuse a été utilisée. Le poids moyen des lapins était de 2721,25±275,01 grammes et la durée de la procédure anesthésique était de 120±87 minutes. Discussion. Dans les anesthésies à long terme, telles que les laparotomies, il est recommandé et l’utilisation de médicaments préanesthésiques et plus tard l’induction anesthésique faite par la combinaison d’agents. Cependant, la gestion anesthésique exige la surveillance pour empêcher des doses insuffisantes ou exagérées de se produire.
Mots-clés: Lapins, isoflurane, anesthésie générale.
INTRODUCTION
L’anesthésie des animaux de laboratoire fait l’objet d’un débat éthique et a été l’un des sujets les plus contradictoires dans ce domaine de la connaissance (BEDIN et.al., 2013). L’utilisation d’anesthésiques en chirurgie expérimentale vise à contenir l’animal, afin d’atteindre un degré raisonnable de relaxation musculaire et de produire suffisamment d’analgésie. Cette pratique exige l’utilisation de protocoles pour l’administration de doses sûres et efficaces (BEDIN et.al., 2013).
REVUE BIBLIOGRAPHIQUE
Les lapins présentent habituellement le stress dû à la gestion préopératoire et pendant le médicament préanesthésique et pendant l’induction avec des agents anesthésiques intraveineux ou volatils. Ici, vous pouvez ajouter du stress avec la manipulation de l’animal pour l’administration de l’anesthésie et peut entraîner un arrêt respiratoire et cardiaque. L’apparition d’une infection respiratoire par Pasteurella multocida peut entraîner de graves complications respiratoires pendant l’anesthésie. Dans l’examen préopératoire de ces animaux, nous devrions prêter une attention particulière à la présence des symptômes respiratoires (écoulement nasal et bruits adventitious à l’auscultation), qui peuvent être des indications fortes de l’infection de région respiratoire (BEDIN et.al.,2013).
L’anesthésie chez les lapins peut aller de la simple sedation aux plans d’anesthésie profonde, qui permettent des interventions chirurgicales de plus en plus grandes. L’utilisation d’anesthésiques volatils halogènes chez les lapins est souvent utilisée pour des procédures à long terme, en particulier lorsqu’elle vise à maintenir l’homéostasie des animaux aussi équilibrée que possible (BEDIN et.al., 2013).
Après l’administration du médicament pré-anesthésique, attendez 15 minutes que le masque laryngé soit adapté, en le connectant à l’appareil d’anesthésie. 50 à 100% d’O2 et 1 à 5% d’isoflurane peuvent être utilisés (BEDIN et.al., 2013; RAILLARD et.al., 2019; TUNCALI et.al., 2018). La procédure d’intubation trachéale présente de grandes difficultés techniques lorsque les animaux sont des lapins (BEDIN et.al., 2013). La visualisation de la glotte au laryngoscope est pratiquement impossible chez ces animaux (BEDIN et.al., 2013). La technique aveugle, guidée par la respiration, est généralement la méthode d’intubation la plus fréquente chez le lapin. En raison de la difficulté de l’intubation trachéale, la trachéotomie ou les masques laryngés sont utilisés par de nombreuses personnes qui travaillent dans ce domaine (THOMPSON et.al., 2017). Les procédures anesthésiques chez le lapin peuvent être maintenues sous un masque facial ou un masque laryngé avec de l’oxygène et un anesthésique halogéné en respiration spontanée (BEDIN et.al., 2013).
Dans les procédures dans lesquelles la ventilation pulmonaire est nécessaire, cela peut être manuel, avec l’utilisation d’un système Mapleson D, ou la ventilation mécanique contrôlée avec un filtre circulaire (BEDIN et.al., 2013). La surveillance est principalement cliniquement basée en observant des données vitales telles que la fréquence cardiaque, la fréquence respiratoire, la coloration muqueuse, et la présence de réflexes oculopalpebraal. Ils sont couramment utilisés pour ce stéthoscope précordial de surveillance, l’électrocardioscope et l’oximétrie des impulsions. Les autres moniteurs devraient être utilisés en fonction des besoins imposés par la conception de l’étude, et les capnographes, la pression artérielle invasive et non invasive peuvent être utiles.
La période postopératoire fait partie du protocole anesthésique, et le soin apporté à l’animal est fondamental en ce moment. Les complications telles que la dépression respiratoire, qui peuvent se produire pendant l’acte anesthésique, deviennent mortelles dans cette période. Après la fin de la procédure anesthésique-chirurgicale, les animaux doivent être référés pour la récupération anesthésique. Cet endroit doit rester silencieux, avec une faible lumière, et pour éviter le stress des animaux, il faut avoir une manipulation minimale. Si l’euthanasie est prévue dans le protocole d’étude, les techniques de ce monsieur devraient fournir l’inconscience suivie de l’arrêt du rythme cardiaque et de l’arrêt respiratoire et définitif des fonctions cérébrales. Idéalement, la technique minimiserait l’anxiété vécue par l’animal avant la perte de conscience.
Pour les lapins, les techniques les plus utilisées pour l’euthanasie sont : le CO2 inhalé, les agents inhalés, les barbituriques veineux et le chlorure de potassium veineux, qui n’est utilisé chez les animaux soumis qu’à une sedation profonde parce que l’injection veineuse est douloureuse (BEDIN et.al., 2013).
Sur la base de ces données de la littérature, il a été adopté comme une procédure anesthésique utilisée comme couramment dans la discipline de la technique opératoire et l’anesthésiologie du cours médical de l’Université de Joinville région (UNIVILLE) pour l’anesthésie chez les lapins (BEDIN et.al., 2013):
- Après identification, le pesage est effectué : cette identification et l’enregistrement des animaux font partie intégrante de la période préopératoire. Après pesage, cet animal doit être identifié avec son nombre et le poids correspondant.
- Pour les médicaments préanesthésiques, l’acépromazine 1 mg.kg-1 et la kétamine 15 mg.kg-1 sont utilisés environ quinze à vingt minutes avant le début de la trichotomie.
- La trichotomie est exécutée dans la région antérieure du cou, de l’abdomen et de la marge d’oreille.
- L’immobilisation est effectuée sur la table d’opération à tout:00.
- Le cathétérisme veineux est effectué dans la veine marginale de l’oreille, avec un cathéter de 24 G. Par la suite, l’installation intraveineuse de la solution saline de 0,9 % de 250 ml est effectuée.
- Pour la kétamine d’anesthésie 5 à 10 mg.kg-1 en doses séquentielles, si nécessaire. Le masque laryngeal numéro 1 est utilisé pour la ventilation. Dans certaines situations (chirurgies thoraciques), l’intubation trachéale avec canule numéro 2 ou 3 ou trachéostomie est effectuée.
- La surveillance est effectuée avec un stéthoscope précordial (ou si possible, œsophagien), l’oximétrie des impulsions (le cas où disponible) et l’électrocardiocopie (le cas où c’est disponible).
- Pour l’anesthésie par inhalation utilisée pour l’entretien, l’isoflurane se compose de 1% à 3% d’isoflurane et d’oxygène de deux à trois litres par minute sous masque dans le système Mapleson D.
- Des signes vitaux sont notés toutes les 5 à 10 minutes pour la préparation du formulaire d’anesthésie.
- Pendant la période post-anesthésique, les données sont notées du début du rétablissement jusqu’à la restauration de la conscience et les modèles physiologiques sont dans la gamme normale.
- Pour le contrôle postopératoire de la douleur, le paracétamol oral est utilisé entre 10 et 15 mg.kg-1, trois fois par jour, ayant dipyrone ici comme alternative.
- Si le protocole d’étude prévoit l’euthanasie, il peut être effectué dans une chambre d’inhalation de CO2 avec 10 l.min-1 pendant 10 minutes. Le deuxième choix peut être le chlorure de potassium à 19,1 % 1 ml.kg-1 veineux, mais avec le sedate animal avec kétamine 1 à 10 mg mg.kg-1 veineux ou sous-cutané quinze à vingt minutes avant chlorure de potassium (BEDIN et.al., 2013).
RAPPORT DE CAS
Les anesthésies qui font partie de cette série ont été autorisées par le Comité d’éthique sur la recherche sur l’utilisation des animaux de la région de Joinville (CEUA) numéro 0103/2018.
Huit lapins néo-zélandais soumis à des laparotomies démontrant la discipline de la technique opérationnelle du cours médical local (tableau 1).
Tableau 1. Démographie.

Pour les médicaments préanesthésiques, l’acépromazine 1 mg.kg-1 a été utilisée avec de la kétamine 15 mg.kg-1 sous-cutanée (tableau 2).
Tableau 2. Médicaments préanesthésiques et peropératoires.
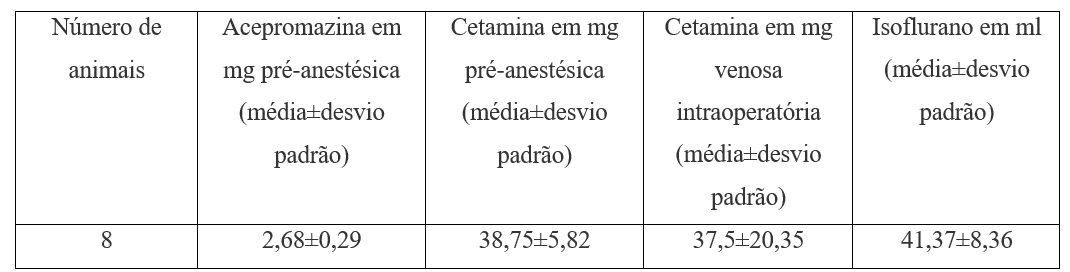
Pour le maintien de l’anesthésie, l’isoflurane et l’oxygène ont été utilisés dans vaporisateur non calibré après le passage du masque laryngeal numéro 1 et mapleson D système d’anesthésie par inhalation sous respiration spontanée toujours. L’hydratation était avec saline 10 ml.kg-1 (tableau 2). Matelas thermique a été utilisé. Pour la surveillance, un stéthoscope précordial, une oximétrie des impulsions et des paramètres cliniques (mouvements involontaires, réflexe oculopalpebral) ont été utilisés. Pour l’euthanasie, 10 kétamines mg.kg-1 ont suivi 5 à 15 minutes après l’utilisation du chlorure de potassium 19,1 % 1 ml.kg-1, également par voie intraveineuse (tableau 3).
Tableau 3. Médicaments contre l’euthanasie.

DISCUSSION
L’isoflurane est souvent utilisé comme agent unique ou associé aux opioïdes pour les interventions anesthésiques chez les lapins (BAILEY et.al., 2017; TEARNEY et.al.,2015). L’administration de fentanyl chez les lapins anesthésiés à l’isoflurane a permis d’améliorer la pression artérielle moyenne et la production cardiaque, comparativement à l’isoflurane seul (BAILEY et et.al., 2017; TEARNEY et.al., 2015). L’acétazine (tranquillisant majeur) et la kétamine (anesthésique dissociatif) sont des médicaments fréquemment utilisés comme médicament préanesthésique et anesthésique pour les lapins1,8,9. L’acépromazine et la kétamine réduisent la consommation d’isoflurane en tant qu’anesthésique principal chez les lapins (BEDIN et.al., 2013; BOTMAN et.al., 2019; ECKLEY et.al., 2020).
CONCLUSION
Dans les anesthésies à long terme, telles que les laparotomies, il est recommandé et l’utilisation de médicaments préanesthésiques et plus tard l’induction anesthésique faite par la combinaison d’agents (ECKLEY et.al., 2020). Cependant, la gestion anesthésique exige la surveillance pour empêcher des doses insuffisantes ou exagérées de se produire. Pour éviter que des variations ne se produisent, il est recommandé de surveiller les signes vitaux dès le début de la prise en charge des animaux soumis à l’anesthésie par inhalation et toute la période pendant laquelle l’anesthésie est maintenue jusqu’à l’euthanasie (BEDIN et.al., 2013).
RÉFÉRENCES
ATALAN, Güneri e colab. Comparison of systemic effects of midazolam, ketamine, and isoflurane anaesthesia in rabbits. Journal of Veterinary Research (Poland), v. 63, n. 2, p. 275–283, 2019.
BAILEY, Ryan S. e BARTER, Linda S. e PYPENDOP, Bruno H. Pharmacokinetics of dexmedetomidine in isoflurane-anesthetized New Zealand White rabbits. Veterinary Anaesthesia and Analgesia, v. 44, n. 4, p. 876–882, 1 Jul 2017.
BEDIN, Antonio e JUNIOR, Harry e KRELING, Patricia. Anestesia para cirurgia experimental em coelhos. v. 42, n. 2, p. 33–37, 2013.
BOTMAN, Julie e colab. Postanaesthetic effects of ketamine-midazolam and ketamine-medetomidine on gastrointestinal transit time in rabbits anaesthetised with isoflurane. Veterinary Record, 2019.
ECKLEY, Samantha S e colab. Acepromazine and Chlorpromazine as Pharmaceutical-grade Alternatives to Chlorprothixene for Pupillary Light Reflex Imaging in Mice. Journal of the American Association for Laboratory Animal Science : JAALAS, 8 Jan 2020. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/31915106>. Acesso em: 10 fev 2020.
RAILLARD, Mathieu e colab. Anaesthetic and perioperative management of 14 male new zealand white rabbits for calvarial bone surgery. Animals, v. 9, n. 11, 1 Nov 2019.
TEARNEY, Caitlin C. e BARTER, Linda S. e PYPENDOP, Bruno H. Cardiovascular effects of equipotent doses of isoflurane alone and isoflurane plus fentanyl in New Zealand white rabbits (Oryctolagus cuniculus). American Journal of Veterinary Research, v. 76, n. 7, p. 591–598, 6 Jul 2015.
THOMPSON, Krista L. e MEIER, Thomas R. e SCHOLZ, Jodi A. Endotracheal intubation of rabbits using a polypropylene guide catheter. Journal of Visualized Experiments, v. 2017, n. 129, 13 Nov 2017.
TUNCALI, Bahattin e colab. Retrospective Evaluation of Patients who Underwent Laparoscopic Bariatric Surgery. Turkish Journal of Anesthesia and Reanimation, v. 46, n. 4, p. 297–304, 16 Ago 2018. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/30140537>. Acesso em: 29 set 2019.
[1] Diplômé en médecine.
[2] Diplômé de l’école de médecine.
[3] Anesthésiste. Maître de la santé. Docteur en anesthésiologie.
Envoyé : Avril, 2020.
Approuvé : juin 2020.


