ARTÍCULO ORIGINAL
BEDIN, Rafael Antonio Caldart [1], SCHULTZ, Maisa [2], BEDIN, Antonio [3]
BEDIN, Rafael Antonio Caldart. SCHULTZ, Maisa. BEDIN, Antonio. Anestesia para conejos sometida a cirugías experimentales: Informe de una serie de ocho anestesias. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 06, Vol. 03, págs. 151-158. Junio de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/anestesia-para-conejos
RESUMEN
La anestesia para animales de laboratorio es una fuente de preocupación biomédica y uno de los dilemas más presentes en el actual debate bioético. El uso de agentes anestésicos en la cirugía experimental tiene como objetivo la analgesia y la contención animal, con el fin de lograr un grado razonable de relajación muscular y producir suficiente analgesia. Esta práctica requiere el uso de protocolos para la administración de dosis seguras y eficientes. Ocho conejos neozelandeses sometidos a laparotomías que demostraban la disciplina de la técnica quirúrgica del curso médico local. Para la medicación preanestésica, acepromazina 1 mg.kg-1 asociado con ketamina 15 mg.kg-1 por vía subcutánea se utilizó para la medicación preanestésica. La anestesia se mantuvo con isoflurano y oxígeno bajo máscara laríngea en el sistema de anestesia mapleson d y bajo respiración espontánea. La hidratación se realizó con una solución de 10-ml.kg-1 cada hora. Se utilizó colchón térmico. Para el monitoreo, se utilizó un estetoscopio precordial, oximetría de pulso y parámetros clínicos. Para la eutanasia, se utilizó ketamina 10 mg.kg-1 asociada con cloruro de potasio 19,1% 1 ml.kg-1 por vía intravenosa. El peso medio de los conejos fue de 2721,25±275,01 gramos y la duración del procedimiento anestésico fue de 120±87 minutos. Discusión. En las anestesias a largo plazo, como las laparotomías, se recomienda el uso de medicamentos preanestésicos y más tarde la inducción anestésica realizada por la combinación de agentes. Sin embargo, el manejo anestésico requiere monitoreo para evitar que se produzcan dosis insuficientes o exageradas.
Palabras clave: Conejos, isoflurano, anestesia general.
INTRODUCCIÓN
La anestesia para animales de laboratorio es un tema de debate ético y ha sido uno de los temas más conflictivos en este campo del conocimiento (BEDIN et.al., 2013). El uso de anestésicos en cirugía experimental tiene como objetivo contener al animal, con el fin de lograr un grado razonable de relajación muscular y producir suficiente analgesia. Esta práctica requiere el uso de protocolos para la administración de dosis seguras y eficientes (BEDIN et.al., 2013).
REVISIÓN BIBLIOGRÁFICA
Los conejos suelen presentar estrés debido al manejo preoperatorio y durante la medicación preanestésica y durante la inducción con agentes anestésicos intravenosos o volátiles. Aquí se puede añadir estrés con la manipulación del animal para la administración de anestesia y puede resultar en paro respiratorio y cardíaco. La aparición de una infección respiratoria por Pasteurella multocida puede provocar complicaciones respiratorias graves durante la anestesia. En el examen preoperatorio de estos animales, debemos prestar mucha atención a la presencia de síntomas respiratorios (nariz ceñida y ruidos aventureros a la auscultación), que pueden ser fuertes indicios de infección del tracto respiratorio (BEDIN et.al.,2013).
La anestesia en conejos puede variar desde una simple sedación hasta planos de anestesia profunda, que permiten procedimientos quirúrgicos más pequeños y más grandes. El uso de anestésicos volátiles halogenados en conejos se utiliza a menudo para procedimientos a largo plazo, especialmente cuando se pretende mantener la homeostasis de los animales lo más equilibrada posible (BEDIN et.al., 2013).
Después de la administración de medicamentos preanestésicos, son 15 minutos para adaptar la mascarilla laríngea, conectándola al dispositivo de anestesia. O2 del 50 al 100% y el isoflurano del 1 al 5% (BEDIN et.al.,2013; RAILLARD et.al.,2019; TUNCALI et.al., 2018). El procedimiento de intubación traqueal presenta una gran dificultad técnica cuando los animales son conejos (BEDIN et.al., 2013). La visualización del laringoscopio glotwith es prácticamente imposible en estos animales (BEDIN et.al., 2013). La técnica de respiración orientada a ciegos suele ser el modo más frecuente para la intubación en conejos. Debido a la dificultad de intubación traqueal, la traqueotomía o las máscaras laríngeas son utilizadas por muchos que trabajan en esta área (THOMPSON et.al., 2017). Los procedimientos anestésicos en conejos se pueden mantener bajo máscara facial o máscara laríngea con oxígeno y agente anestésico halogenado en la respiración espontánea (BEDIN et.al., 2013).
En los procedimientos en los que se necesita ventilación pulmonar, esto puede ser manual, con el uso de un sistema Mapleson D, o ventilación controlada mecánica con un filtro circular (BEDIN et.al., 2013). El monitoreo se basa principalmente clínicamente mediante la observación de datos vitales como la frecuencia cardíaca, la frecuencia respiratoria, la tinción de la mucosa y la presencia de reflejos oculopalpebraales. Se utilizan rutinariamente para este estetoscopio precordial de monitoreo, electrocardoscopio y oximetría de pulso. Los otros monitores deben utilizarse de acuerdo con las necesidades impuestas por el diseño del estudio, y los capnógrafos, la presión arterial invasiva y no invasiva pueden ser útiles.
El período postoperatorio es parte del protocolo anestésico, y el cuidado dado al animal es fundamental en este momento. Las complicaciones como la depresión respiratoria, que puede ocurrir durante el acto anestésico, se vuelven mortales en este período. Después del final del procedimiento anestésico-quirúrgico, los animales deben ser referidos para la recuperación anestésica. Este lugar debe permanecer en silencio, con poca luz, y para evitar el estrés de los animales, uno debe tener un manejo mínimo. Si la eutanasia está prevista en el protocolo de estudio, las técnicas para este señor deben proporcionar inconsciencia seguida de cese de los latidos del corazón y la terminación respiratoria y definitiva de las funciones cerebrales. Idealmente, la técnica minimizaría la ansiedad experimentada por el animal antes de la pérdida de conciencia.
En el caso de los conejos, las técnicas más utilizadas para la eutanasia son: CO2 inhalado, agentes inhalados, barbitúricos venosos y cloruro de potasio venoso, que sólo se utiliza en animales sometidos a sedación profunda porque la inyección venosa es dolorosa (BEDIN et.al., 2013).
Sobre la base de estos datos de la literatura, se ha adoptado como un procedimiento anestésico utilizado como habitualmente en la disciplina de La Técnica Operativa y Anestesiología del Curso Médico de la Universidad de Joinville (UNIVILLE) para la anestesia en conejos (BEDIN et.al., 2013):
- Tras la identificación, se realiza el pesaje: esta identificación y el registro de los animales son parte integral del período preoperatorio. Después del pesaje, este animal debe ser identificado con su número y el peso correspondiente.
- Para la medicación preanestésica, acepromazina 1 mg.kg-1 y ketamina 15 mg.kg-1 se utilizan alrededor de quince a veinte minutos antes del comienzo de la tricotomía.
- La tricotomía se realiza en la región anterior del cuello, el abdomen y el margen auditivo.
- La inmovilización se realiza en la mesa de operaciones en absoluto:00.
- El cateterismo venoso se realiza en la vena marginal del oído, con un catéter de 24 G. Posteriormente, se realiza la instalación intravenosa de 0,9% 250 ml de solución salina.
- Para la anestesia de ketamina 5 a 10 mg.kg-1 en dosis secuenciales, si es necesario. La máscara laríngea número 1 se utiliza para la ventilación. En ciertas situaciones (cirugías torácicas) se realiza intubación traqueal con cánula número 2 o 3 o traqueotomía.
- La monitorización se realiza con un estetoscopio precordial (o si es posible, esofágico), oximetría de pulso (cuando esté disponible) y electrocardiocopia (cuando esté disponible).
- Para la anestesia inhalación utilizada para el mantenimiento, el isoflurano consiste en un 1% a 3% de isoflurano y oxígeno de dos a tres litros por minuto bajo máscara en el sistema Mapleson D.
- Los signos vitales se observan cada 5 a 10 minutos para la preparación de la forma de anestesia.
- Durante el período post-anestésico, los datos se observan desde el comienzo de la recuperación hasta la restauración de la conciencia y los patrones fisiológicos están dentro del rango normal.
- Para el control del dolor postoperatorio, el paracetamol oral se utiliza entre 10 y 15 mg.kg-1, tres veces al día, teniendo dipyrone aquí como alternativa.
- Si el protocolo de estudio prevé la eutanasia, se puede realizar en una cámara de inhalación de CO2 con 10 l.min-1 durante 10 minutos. La segunda opción puede ser cloruro de potasio al 19,1 % 1 ml.kg-1 venoso, pero con el seso animal con ketamina 1 a 10 mg mg.kg-1 venoso o subcutáneo quince a veinte minutos antes del cloruro de potasio (BEDIN et.al., 2013).
INFORME DEL CASO
Las anestesias que forman parte de esta serie fueron autorizadas por el Comité de ética de investigación de uso animal de la Región de Joinville (CEUA) número 0103/2018.
Ocho conejos neozelandeses sometidos a laparotomías que demostraban la disciplina de la técnica operativa del curso médico local (tabla 1).
Tabla 1. Demografía.

Para la medicación preanestésica, se utilizó acepromazina 1 mg.kg-1 con ketamina 15 mg.kg-1 por vía subcutánea (Tabla 2).
Cuadro 2. Medicamentos preanestésicos e intraoperatorios.
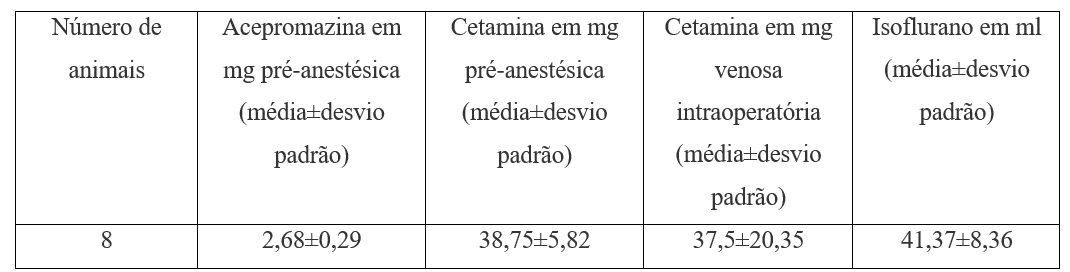
Para el mantenimiento de la anestesia, el isoflurano y el oxígeno se utilizaron en vaporizador sin calibrar después del paso de la máscara laríngea número 1 y el sistema de anestesia por inhalación mapleson D bajo respiración espontánea siempre. La hidratación fue con solución salina 10 ml.kg-1 (tabla 2). Se utilizó colchón térmico. Para el monitoreo, se utilizó un estetoscopio precordial, oximetría de pulso y parámetros clínicos (movimientos involuntarios, reflejo oculopalpebral). Para la eutanasia, 10 mg.kg-1 ketamina seguidos de 5 a 15 minutos después de que se utilizara el cloruro de potasio 19,1% 1 ml.kg-1, también por vía intravenosa (Tabla 3).
Cuadro 3. Medicamentos para la eutanasia.

DISCUSIÓN
El isoflurano se usa a menudo como agente único o asociado con opioides para procedimientos anestésicos en conejos (BAILEY et.al., 2017; TEARNEY et.al., 2015). La administración de fentanilo en conejos anestesiados con isoflurano resultó en una mejor presión arterial media y gasto cardíaco, en comparación con isoflurano solo (BAILEY et al., 2017; TEARNEY et.al., 2015). La acepromazina (tranquilizante principal) y la ketamina (anestésico disociativo) son medicamentos que se utilizan con frecuencia como medicación preanestésica y anestésica para conejos1,8,9. Tanto la acepromacina como la ketamina reducen el consumo de isoflurano como anestésico principal en conejos (BEDIN et.al., 2013; BOTMAN et.al., 2019; ECKLEY et.al., 2020).
CONCLUSIÓN
En las anestesias a largo plazo, como las laparotomías, se recomienda y el uso de medicamentos preanestésicos y posteriormente la inducción anestésica realizada por la combinación de agentes (ECKLEY et.al., 2020). Sin embargo, el manejo anestésico requiere monitoreo para evitar que se produzcan dosis insuficientes o exageradas. Para evitar que ocurran variaciones, se recomienda controlar los signos vitales desde el comienzo del tratamiento de los animales sometidos a anestesia inhalación y todo el período durante el cual se mantiene la anestesia hasta la eutanasia (BEDIN et.al., 2013).
REFERENCIAS
ATALAN, Güneri e colab. Comparison of systemic effects of midazolam, ketamine, and isoflurane anaesthesia in rabbits. Journal of Veterinary Research (Poland), v. 63, n. 2, p. 275–283, 2019.
BAILEY, Ryan S. e BARTER, Linda S. e PYPENDOP, Bruno H. Pharmacokinetics of dexmedetomidine in isoflurane-anesthetized New Zealand White rabbits. Veterinary Anaesthesia and Analgesia, v. 44, n. 4, p. 876–882, 1 Jul 2017.
BEDIN, Antonio e JUNIOR, Harry e KRELING, Patricia. Anestesia para cirurgia experimental em coelhos. v. 42, n. 2, p. 33–37, 2013.
BOTMAN, Julie e colab. Postanaesthetic effects of ketamine-midazolam and ketamine-medetomidine on gastrointestinal transit time in rabbits anaesthetised with isoflurane. Veterinary Record, 2019.
ECKLEY, Samantha S e colab. Acepromazine and Chlorpromazine as Pharmaceutical-grade Alternatives to Chlorprothixene for Pupillary Light Reflex Imaging in Mice. Journal of the American Association for Laboratory Animal Science : JAALAS, 8 Jan 2020. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/31915106>. Acesso em: 10 fev 2020.
RAILLARD, Mathieu e colab. Anaesthetic and perioperative management of 14 male new zealand white rabbits for calvarial bone surgery. Animals, v. 9, n. 11, 1 Nov 2019.
TEARNEY, Caitlin C. e BARTER, Linda S. e PYPENDOP, Bruno H. Cardiovascular effects of equipotent doses of isoflurane alone and isoflurane plus fentanyl in New Zealand white rabbits (Oryctolagus cuniculus). American Journal of Veterinary Research, v. 76, n. 7, p. 591–598, 6 Jul 2015.
THOMPSON, Krista L. e MEIER, Thomas R. e SCHOLZ, Jodi A. Endotracheal intubation of rabbits using a polypropylene guide catheter. Journal of Visualized Experiments, v. 2017, n. 129, 13 Nov 2017.
TUNCALI, Bahattin e colab. Retrospective Evaluation of Patients who Underwent Laparoscopic Bariatric Surgery. Turkish Journal of Anesthesia and Reanimation, v. 46, n. 4, p. 297–304, 16 Ago 2018. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/30140537>. Acesso em: 29 set 2019.
[1] Se gradúa en medicina.
[2] Graduado de la escuela de medicina.
[3] Anestesiólogo. Maestría en Salud. Doctor en Anestesiología.
Enviado: Abril, 2020.
Aprobado: Junio de 2020.