CARTA ORIGINALE
RODRIGUES, Camila Juliano Salvador [1], SILVEIRA, Elita Ferreira da [2], VARGAS, Rafael da Silveira [3], GIACOMO, Giordano Gatti de [4], BIANCHIN, Marino Muxfeldt [5]
RODRIGUES, Camila Juliano Salvador. Et al. Marcatori di cellule staminali tumorali associati allo sviluppo e fenotipo aggressivo nel cancro al pancreas. Revista Científica Multidisciplinar Núcleo do Conhecimento. Anno 05, Ed. 10, Vol. 12, pp. 102-122. nell’ottobre 2020. ISSN:2448-0959, collegamento di accesso in: https://www.nucleodoconhecimento.com.br/salute/cancro-al-pancreas
SOMMARIO
Contesto: Le cellule staminali tumorali, note anche come cellule che avviano il tumore, sono suggerite per essere responsabili della resistenza ai farmaci e dello sviluppo del cancro a causa in parte della loro capacità di auto-rinnovarsi e differenziarsi in lignaggi eterogenei delle cellule tumorali. Obiettivo: Questo studio è stato progettato per studiare il ruolo delle cellule staminali tumorali nel cancro al pancreas. Metodi: un’analisi clinicatropatologia retrospettiva è stata intrapresa in 112 pazienti con diagnosi di adenocarcinoma duttale pancreatico tra il 2005 e il 2010 e l’immunoistochimica è stata eseguita con anticorpi contro CD133, CD24 e OCT4. La colorazione nucleare, citoplasmica o membrana positiva per ogni anticorpo è stata classificata in base all’intensità della colorazione, essendo classificata in gruppi di colorazione bassi/moderati o forti. I risultati sono stati analizzati in relazione ai parametri clinicopatologici di ciascun paziente. Risultati: C’era una relazione stabilita tra la colorazione dei marcatori con alcune variabili associate a prognosi peggiore, essendo i tre marcatori presenti nella maggior parte delle cellule tumorali e associati alla progressione del tumore. Supponiamo che le cellule staminali tumorali siano presenti fin dall’inizio dell’iniziazione tumorale e siano intrinsecamente correlate allo sviluppo del tumore. Anche se la presenza di cellule staminali è stata associata alla biologia molecolare di vari tumori, la loro espressione nel cancro al pancreas non è ancora stata clinicamente riportata. Conclusione: la presenza di cellule staminali e il loro ruolo nella tumorigenesi del cancro al pancreas possono essere considerati come fattori prognostici preziosi, anche se il meccanismo coinvolto necessita di ulteriori indagini. Una crescente ricerca sul ruolo delle cellule staminali tumorali e della carcinogenesi può in ultima analisi generare nuove idee per approcci diagnostici e terapeutici basati sul molecolare.
Parole chiave: Cellule staminali tumorali, cancro al pancreas, ANTIgene AC133, ANTIgene CD24, OCT4.
INTRODUZIONE
Nonostante i progressi nella diagnosi e nel trattamento del cancro negli ultimi decenni, rimane una delle cause più comuni di morte in tutto il mondo. Anche se potenzialmente curabile quando diagnosticato precocemente, la diagnosi precoce rimane una sfida nella pratica clinica quotidiana. Molti tumori sono diagnosticati in una fase avanzata, quando le opzioni terapeutiche non sono più efficaci (BARBOSA et al., 2018).
L’adenocarcinoma duttale pancreatico (PDAC) è una malattia altamente aggressiva di solito diagnosticata in uno stadio avanzato e per la quale sono disponibili poche terapie efficaci. È un neoplasma la cui incidenza è quasi uguale alla sua mortalità. Il motivo per cui il cancro al pancreas ha una prognosi così infausta e perché ha una risposta terapeutica così bassa alla chemioterapia e alla radioterapia sono domande che hanno motivato la ricerca di una risposta che possa modificare il corso di questa malattia. Nonostante i progressi nelle tecniche chirurgiche, che oggi sono considerate l’unica opzione curativa, il tasso medio di sopravvivenza a 5 anni è inferiore al 5% (1-3%) (BARBOSA et al., 2018; SOTO et al., 2006). È considerata la neoplasia con la prognosi peggiore su più di 60 tipi di cancro, un fatto evidenziato dal suo tasso di incidenza quasi uguale al tasso di mortalità (SAKORAFAS et al., 2000). Va notato che la diagnosi precoce del cancro, in una fase che può ancora essere curata, è associata a una maggiore efficacia terapeutica ed è attualmente uno dei modi per migliorare l’esito dei pazienti diagnosticati con cancro al pancreas (ALLEGRA; TRAPASSO, 2012).
La biologia molecolare del cancro al pancreas è direttamente correlata alla sua rapida progressione e alla bassa risposta terapeutica. È ben documentato che la comparsa di una cellula tumorale è il risultato di un accumulo di mutazioni nel suo DNA in grado di alterare morfologicamente e funzionalmente le sue proprietà normali (FANG et al., 2013; RICCI-VITIANI et al., 2007). L’attivazione di questo processo e la sua evoluzione molecolare, culminata nella formazione della cellula tumorale e delle sue caratteristiche pertinenti, caratterizzano il processo di carcinogenesi. È ben compreso nella letteratura che lo sviluppo di una neoplasia comporta una serie di cambiamenti molecolari che portano non solo all’emergere e alla sopravvivenza di una cellula tumorale, ma alla sua capacità di invadere i tessuti adiacenti e formare metastasi lontane (LI; JIAO, 2003).
Tra i processi più recenti implicati nella carcinogenesi e nella progressione tumorale, i cambiamenti nelle cellule staminali tumorali (CSC) sono ancora poco studiati nel cancro al pancreas senza risultati soddisfacenti e meritano maggiori sforzi per chiarire i loro effetti e la relazione nell’acquisizione di un fenotipo maligno pancreatico. Recenti evidenze hanno suggerito che i CSC svolgono un ruolo cruciale non solo nella generazione e nel mantenimento di diversi tessuti, ma anche nello sviluppo, nella progressione e nella resistenza terapeutica di diversi tipi di tumore (BALIC et al., 2012).
I CSC appartengono a un gruppo differenziato di cellule all’interno di un tumore con proprietà auto-rinnovanti e differenzianti, simili alle normali cellule staminali, dando origine a linee cellulari tumorali eterogenee che formano un tumore. Possono dividere e originare diverse cellule che costituiscono i tumori, perpetuando così la loro crescita e offrendo resistenza alla chemioterapia con meccanismi non ancora ben compresi. Per questo motivo, rappresentano un importante obiettivo di ricerca (TAI, 2005).
L’aggressività intrinseca del cancro al pancreas, con la sua elevata capacità di invasione locale, alto potenziale metastatico, diagnosi tardiva e resistenza terapeutica, sembra essere in parte correlata alla popolazione di CSC che costituiscono questi tumori (HU; FU, 2012). Inoltre, è stato dimostrato che il PDAC contiene non solo una popolazione omogenea di CSC, ma diverse sottopopolazioni che possono essere coinvolte nella progressione del tumore. Fino ad ora, i CSC pancreatici identificati costituiscono una minoranza di cellule componente tumorali (circa l’1-5%) e hanno un’elevata capacità di auto-rinnovamento (ANSARI et al., 2012). L’aspetto clinico più importante, tuttavia, è che questi CSC sono altamente resistenti alla chemioterapia e alla radioterapia, con conseguente resistenza e rapida recidiva della malattia. Attualmente, una delle grandi sfide dell’oncologia è identificare e studiare le caratteristiche di questi CSC, in particolare nel PDAC, in cui sono state fatte poche scoperte (KOBAYASHI; NORONHA, 2015).
MATERIALI E METODI
SELEZIONE DEI CASI E CAMPIONI DI TUMORE
I campioni di tessuto provengono da una coorte di 112 tumori pancreatici consecutivi diagnosticati dal 2005 al 2010, selezionati dalla cura di routine dell’Ospedale de Clènicas de Porto Alegre (HCPA), dal Dipartimento di Patologia e Gruppo di Tract Biliare e Pancreas. Le analisi immunostochimiche sono state eseguite in blocchi di tessuto incorporati in paraffina già conservati nel Dipartimento di Patologia dell’HCPA, dopo l’approvazione da parte del Comitato Scientifico e del Comitato Etico nella Ricerca Sanitaria dell’istituzione. Le seguenti variabili sono state registrate dalle cartelle cliniche: età, sesso, grado tumorale, stato di linfonodo, insorgenza di metastasi, trattamento ricevuto (tipo di chirurgia, radioterapia e chemioterapia), sopravvivenza libera dalla malattia e sopravvivenza complessiva.
TESSUTO MICROARRAY (TMA) ANALISI IMMUNOHISTOCHIMICA
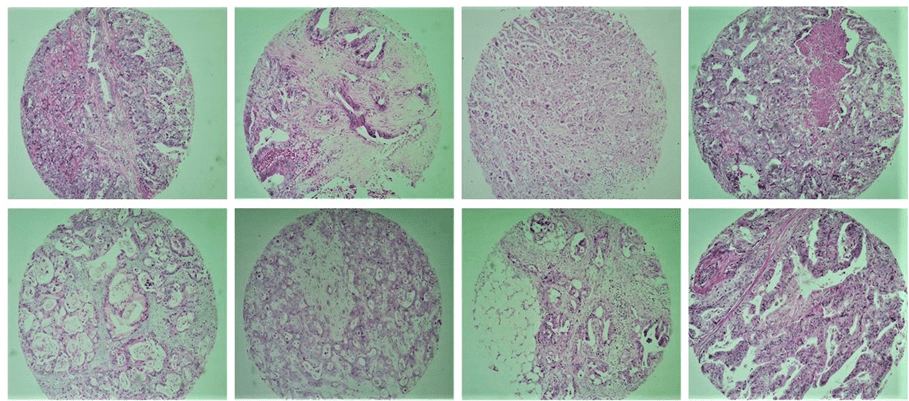
Tissue Microarray (TMA) array è una tecnica descritta per la prima volta da Kononen et al. (1998) ed è un ottimo strumento per la patologia investigativa. Si tratta di raggruppare in un singolo blocco un numero ragionevole di campioni di tessuto, consentendo così lo studio dell’espressione immunohistochimica dei marcatori molecolari, con un grande uso del materiale, la presenza di controllo interno e il tempo e il costo. Questa tecnica permette anche la standardizzazione delle reazioni, la rappresentatività efficiente attraverso l’uso di diverse aree del tumore, lo studio di un gran numero di campioni contemporaneamente, la facilità di interpretazione e la ricerca su larga scala di fattori prognostici o predittivi del cancro (Figura 1).
Fig. 1. Esemplifica alcuni campioni di tessuto tumorale inclusi nello studio con la tecnica TMA
ANALISI STATISTICA
Per verificare l’associazione tra variabili immunostochimiche e intensità di immunoreazione con le variabili di caratterizzazione degli individui, è stato utilizzato un approccio non parametrico con il test esatto di Fisher. Per verificare l’associazione dell’età variabile numerica con le variabili e l’intensità immunostochimiche, è stato utilizzato il test Mann-Whitney U.
L’associazione tra marcatori di cellule staminali e diverse caratteristiche clinicopatologiche dei pazienti è stata [inclusi età, sesso, differenziazione tumorale, stadio, categoria Tumore-Nodo-Metastasi (TNM) e resezione tumorale] valutata dal coefficiente di correlazione di Pearson o dai test χ2, a seconda dei casi. Per quanto è stato fatto per l’intensità, le categorie sono state dicotomizzate in intensità bassa/moderata (0-2+) o ad alta intensità (≥3+).
Il metodo Kaplan-Meier è stato utilizzato per stimare la probabilità di sopravvivenza. Le curve di sopravvivenza sono state confrontate utilizzando il test log-rank, che afferma sotto l’ipotesi nulla che le funzioni di sopravvivenza non differiscano l’una dall’altra.
Il tempo di sopravvivenza complessivo è stato misurato dal momento dell’intervento chirurgico o della biopsia alla data del decesso (a seguito di qualsiasi causa) o all’ultimo follow-up. Il tempo di sopravvivenza senza malattia è stato misurato dalla data della diagnosi isterologica o dell’intervento chirurgico fino alla data del primo evento di fallimento senza malattia (definito come ricaduta locoregionale), malattia lontana o morte a causa di qualsiasi causa. Significato è stato stabilito a P < 0.05. Tutte le analisi statistiche sono state eseguite utilizzando R (versione 3.6.0).
RISULTATI
Le analisi immunostochimiche hanno indicato la presenza di marcatori di superficie delle cellule staminali tumorali per i tre anticorpi analizzati nelle cellule PDAC. In questo studio sono stati inclusi 112 pazienti con cancro al pancreas: 59 (52,6%) maschi e 53 (47,4%) femmine, con un’età mediana alla diagnosi di 63 anni (intervallo, 36-93 anni, SD ± 10,3) e un periodo di follow-up post-diagnosi mediano di 16,2 mesi.
Non c’era differenza significativa tra i sessi quando si confrontava l’intensità del segnale anticorpale. Cinquanta pazienti (48,08%) morì durante il periodo di follow-up.
Tra tutti i pazienti inclusi, 16 (15,2%) erano in fase patologica I, 32 (30,4%) erano in fase patologica II, 25 (23,8%) erano in fase patologica III e 32 (30,4%) erano in fase patologica IV. Nei casi in cui erano disponibili informazioni sul grado tumorale, il 2,8% dei carcinomi era ben differenziato, il 62,8% era moderatamente differenziato e il 34,2% era scarsamente differenziato.
Per quanto riguarda lo stadio TNM, l’11,2% erano T1 (tumore più piccolo di 2 cm), il 38,3% erano T2 (tumore più grande di 2 cm o che invadeva i tessuti vicini), il 19,6% erano T3 (tumore di qualsiasi dimensione invadendo i tessuti vicini, ma senza compromettere il plesso celiaco o l’arteria mesenterica superiore), il 21,5% era T4 (tumore di qualsiasi dimensione compromettente organi vitali e plesso celiaco o arteria mesenterica superiore) , e il 9,3% erano Tx (l’estensione del tumore è sconosciuta). Per il coinvolgimento dei linfonodi, il 31,7% era nello stadio N0 (nessuna metastasi dei linfonodi), il 31,7% era N1 (metastasi del linfonodo regionale), il 6,5% era N2 (più di una catena di linfonodi interessata) e il 29,9% era Nx (non valutabile). Per quanto riguarda la presenza di metastasi, il 66,6% si è trovato nello stadio M0 (nessuna metastasi distante), il 30,2% era M1 (metastasi distante) e il 3,6% era Mx (non valutabile).
Circa il 75,9% dei campioni sono stati ottenuti da tessuto tumorale pancreatico, e circa il 26% proviene da campioni di metastasi, con il fegato (65,7%) è il sito più colpito, seguito dai linfonodi (14,2%), dal peritoneo (8,5%) e da altri (11,4%).
Il trattamento palliativo è stato somministrato a 68 individui, ossi il 76,40% del numero totale di persone analizzate.
Per quanto riguarda la posizione del tumore, 81.6% dei tumori si trovavano nella testa del pancreas, 22.9% nel corpo, e 6.4% nella coda.
La tabella 1 riassume l’analisi descrittiva generale delle persone coinvolte nello studio.
Tabella 1. Analisi descrittiva generale
| Variabili | N | % |
| Sesso | ||
| Donna | 53 | 47.4 |
| Uomo | 59 | 52.6 |
| Età | ||
| 35-59 anni | 37 | 33.9 |
| 60-69 anni | 39 | 35.8 |
| 70-93 anni | 33 | 30.3 |
| Morte (n=104) | ||
| No | 54 | 51.9 |
| Sì | 50 | 48.1 |
| Trattamento chirurgico (n=108) | ||
| Palliativa | 42 | 38.9 |
| Chirurgia parziale | 19 | 17.6 |
| Dpt # | 47 | 43.5 |
| Trattamento chirurgico (n=89) | ||
| No | 21 | 23.6 |
| Sì | 68 | 76.4 |
| Differenziazione del tumore (n=105) | ||
| Ben differenziato | 3 | 2.9 |
| Moderato differenziato | 66 | 62.8 |
| Scarsa differenziata | 36 | 34.3 |
| Specimen/Campione (n=108) | ||
| Metastasi | 26 | 24.1 |
| Pancreas | 82 | 75.9 |
| Fase patologica tumorale T (n=107) | ||
| T1 | 12 | 11.2 |
| T2 | 41 | 38.3 |
| T3 | 21 | 19.6 |
| T4 | 23 | 21.5 |
| Tx | 10 | 9.4 |
| Fase patologica tumorale N (n=107) | ||
| N0 | 34 | 31.8 |
| N1 | 34 | 31.8 |
| N2 | 7 | 6.5 |
| Nx | 32 | 29.9 |
| Fase patologica tumorale M (n =109) | ||
| M0 | 72 | 66.1 |
| M1 | 33 | 30.2 |
| Mx | 4 | 3.7 |
| Fase generale patologica tumorale (n=105) | ||
| 1 | 16 | 15.2 |
| 2 | 32 | 30.5 |
| 3 | 25 | 23.8 |
| 4 | 32 | 30.5 |
| MTX (n=35) | ||
| Fegato | 23 | 65.7 |
| Linfonodi | 5 | 14.3 |
| Peritoneo | 3 | 8.6 |
| Altri | 4 | 11.4 |
| Località: Testa di tumore | ||
| Sì | 89 | 81.7 |
| Località: Coda Tumorale | ||
| Sì | 7 | 6.4 |
| Posizione: Corpo tumorale | ||
| Sì | 25 | 22.9 |
| Totale | 112 | 100.0 |
#DPT: Duodenopancreatectomia
CD133 IMMUNOSTAINING NELLE CELLULE STAMINALI TUMORALI NELLE CELLULE ADENOCARCINOMA DEL DUTTATO PANCREATICO
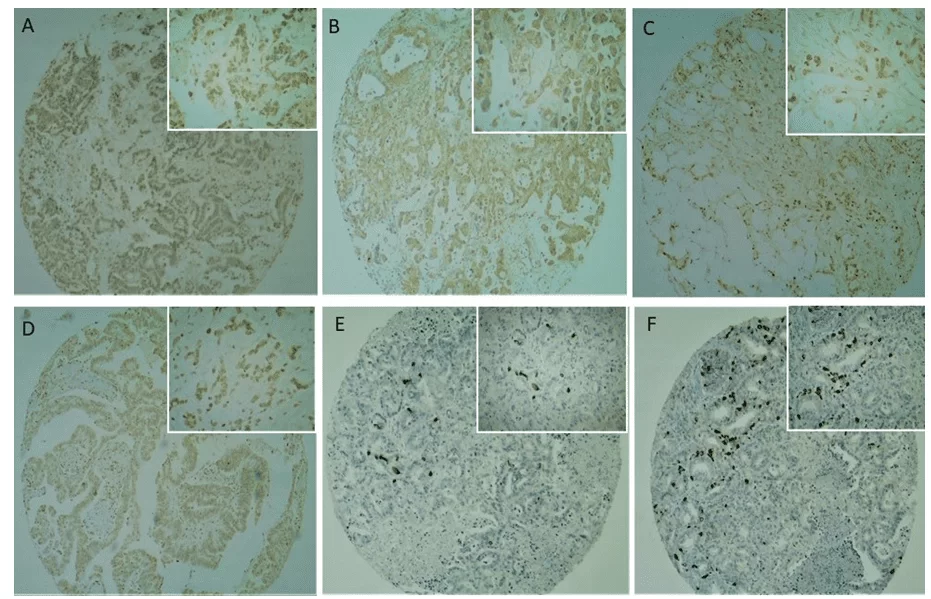
L’immunostaining CD133 era presente nella membrana plasmatica e nel citoplasma ad intensità da moderata a forte (figure 2C e 2D), con un’intensità prevalentemente forte. Una reazione positiva o negativa è stata confermata con il controllo positivo (placenta) utilizzato nello studio. Non è stata osservata alcuna immunoreattività CD133 nell’epitelio ductale pancreatico (Figura 2).
Fig. 2. Analisi immunostochimica dei marcatori di cellule staminali tumorali nei campioni di cancro al pancreas TMA. (2A, 2B) L’espressione CD24 è stata osservata principalmente nel citoplasma delle cellule tumorali. (2C, 2D) L’espressione CD133 è stata osservata principalmente nella membrana e nel citoplasma delle cellule tumorali, raramente nucleari. (2E, 2F) L’espressione OCT4 è stata osservata nel nucleo delle cellule tumorali, con un’espressione focale e una forte intensità. Il campo di ingrandimento più basso (40x) è rappresentato nel pannello globale e nel campo di ingrandimento più alto (100x) nel pannello ridotto.
Per quanto riguarda il trattamento chirurgico, il 95,1% dei pazienti sottoposti a trattamento 1 (shunt bileodigestivo) era cd133-positivo, il 70,0% dei pazienti sottoposti a trattamento 2 (chirurgia parziale) erano CD133-positivi e l’81,2% dei pazienti sottoposti a trattamento 3 (totale duodenopancreatectomia) erano CD133-positivi. C’era un’associazione significativa (P – 0,019) tra il trattamento chirurgico e il segnale CD133. Oltre al trattamento chirurgico, solo il tipo di campione è stato significativamente associato al segnale CD133, a un livello di significatività del 5%.
Il grado di differenziazione tumorale (buono, moderato o povero) non ha mostrato alcuna associazione significativa con l’immunostaining CD133 positivo, anche se è stato osservato che con il progredire del grado tumorale, l’intensità della colorazione è aumentata (83,7% nei tumori scarsamente differenziati). Non c’è stata nemmeno un’associazione significativa tra la messa in scena TNM e l’immunostaining CD133 positivo, ma nelle fasi successive l’etichettatura si intensifica, anche se qui si osserva la presenza di CSCs fin dalle prime fasi. Ciò corrobora l’ipotesi che i CSCs siano presenti dall’inizio del processo di carcinogenesi.
La tabella 2 mostra l’analisi descrittiva delle variabili insieme alla verifica della loro associazione con l’immunoreattività CD133, fornita dall’esatta prova di Fisher.
Tabella 2. Associazione di variabili con CD133 positivo.
| IHC CD133 positivo | valore di p | ||||
| No | Sì | ||||
| N | % | N | % | ||
| Sesso | 1,000 | ||||
| Donna | 8 | 15.1 | 45 | 84.9 | |
| Uomo | 9 | 15.5 | 49 | 84.5 | |
| Età | 1,000 | ||||
| 35-59 anni | 6 | 16.2 | 31 | 83.8 | |
| 60-69 anni | 6 | 15.0 | 34 | 85.0 | |
| 70-93 anni | 5 | 14.7 | 29 | 85.3 | |
| Morte (n=106) | 0,192 | ||||
| No | 6 | 11.1 | 48 | 88.9 | |
| Sì | 11 | 21.1 | 41 | 78.9 | |
| Trattamento chirurgico (n=109) | 0,019 | ||||
| Palliativa | 2 | 4.9 | 39 | 95.1 | |
| Chirurgia parziale | 6 | 30.0 | 14 | 70.0 | |
| Dpt # | 9 | 18.7 | 39 | 81.3 | |
| Trattamento palliativo (n=91) | 0,474 | ||||
| No | 4 | 18.2 | 18 | 81.8 | |
| Sì | 8 | 11.6 | 61 | 88.4 | |
| Grado di differenziazione (n=107) | 0,084 | ||||
| Ben differenziato | 2 | 66.7 | 1 | 33.3 | |
| Moderato differenziato | 9 | 13.4 | 58 | 86.6 | |
| Scarsa differenziata | 6 | 16.2 | 31 | 83.8 | |
| Specimen/campione (n=107) | 0,028 | ||||
| Metastasi | 7 | 29.2 | 17 | 70.9 | |
| Pancreas | 9 | 10.9 | 74 | 89.2 | |
| Fase T (n=109) | 0,587 | ||||
| T1 | 3 | 25.0 | 9 | 75.0 | |
| T2 | 5 | 12.5 | 35 | 87.5 | |
| T3 | 4 | 19.0 | 17 | 81.0 | |
| T4 | 2 | 8.0 | 23 | 92.0 | |
| Tx | 2 | 18.2 | 9 | 81.8 | |
| Fase N (n=109) | 0,830 | ||||
| N0 | 4 | 11.4 | 31 | 88.6 | |
| N1 | 6 | 17.6 | 28 | 82.4 | |
| N2 | 1 | 16.7 | 5 | 83.3 | |
| Nx | 5 | 14.7 | 29 | 85.3 | |
| Fase M (n=106) | 0,132 | ||||
| M0 | 8 | 11.3 | 63 | 88.7 | |
| M1 | 9 | 25.7 | 26 | 74.3 | |
| Mx | 0 | – | 5 | 100.0 | |
| Fase generale (n=107) | 0,133 | ||||
| 1 | 2 | 12.5 | 14 | 87.5 | |
| 2 | 5 | 15.6 | 27 | 84.4 | |
| 3 | 1 | 4.0 | 24 | 96.0 | |
| 4 | 9 | 26.5 | 25 | 73.5 | |
| MTX (n=34) | 0,645 | ||||
| Fegato | 7 | 30.4 | 16 | 69.6 | |
| Linfonodi | 3 | 60.0 | 2 | 40.0 | |
| Peritoneo | 1 | 25.0 | 3 | 75.0 | |
| Altri | 1 | 20.0 | 4 | 80.0 | |
| Località: Testa di tumore | 0,186 | ||||
| Sì | 12 | 13.2 | 79 | 86.8 | |
| Località: Coda Tumorale | 0,071 | ||||
| Sì | 3 | 42.9 | 4 | 57.1 | |
| Posizione: Corpo tumorale | 1,000 | ||||
| Sì | 4 | 16.0 | 21 | 84.0 | |
*Test esatto di Fisher
#DPT: Duodenopancreatectomia
La tabella 3 mostra i valori p e le associazioni delle variabili con intensità quando la colorazione CD133 era positiva. Con l’esatta prova di Fisher (P = 0,036), solo la fase M ha mostrato un’associazione significativa con l’intensità di CD133; vale a essere, i tumori che hanno già metastasizzato sono fortemente macchiati per CD133.
Tabella 3. Valori P di associazione con intensità.
| Variabili | Gruppi | valore di p | ||
| IHC CD133 –
Intensità quando positiva |
IHC CD24 –
Intensità quando positiva |
IHC OCT4 –
Intensità quando positiva |
||
| Sesso |
Donna | 0,222 | 0,438 | 0,619 |
| Uomo | ||||
| Morte | No | 1,000 | 0,235 | 0,627 |
| Sì | ||||
| Trattamento chirurgico |
Palliativa | 0,815 | 0,732 | 0,620 |
| Cir. Parziale | ||||
| Dpt # | ||||
| Trattamento palliativo |
No | 0,136 | 0,027 | 0,619 |
| Sì | ||||
| Grado di differenziazione | Ben differenziato | 0,266 | 0,442 | 0,407 |
| Moderato differenziato | ||||
| Scarsa differenziata | ||||
| Specimen/Sample | Metastasi | 0,848 | 0,201 | 0,488 |
| Pancreas | ||||
| Fase T |
T1 | 0,611 | 0,992 | 1,000 |
| T2 | ||||
| T3 | ||||
| T4 | ||||
| Tx | ||||
| Fase N | N0 | 0,560 | 0,920 | 0,180 |
| N1 | ||||
| N2 | ||||
| Nx | ||||
| Fase M | M0 | 0,036 | 0,350 | 0,078 |
| M1 | ||||
| Mx | ||||
| Fase generale | 1 | 0,337 | 0,380 | 0,218 |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| MTX | Fegato | 0,094 | 0,037 | 1,000 |
| Peritoneo | ||||
| Linfonodi | ||||
| Altri | ||||
*Test esatto di Fisher
#DPT: Duodenopancreatectomia
IMMUNOSTAINING CD24 NELLE CELLULE STAMINALI TUMORALI NELLE CELLULE ADENOCARCINOMA DEL DUTTATO PANCREATICO
L’immunostaining CD24 (figure 2A e 2B) era presente nella membrana plasmatica e nel citoplasma sia debole che moderato (41,6%) e forte (58,3%) intensità, ma ad un’intensità più debole rispetto a CD133 (figura 2C e 2D). Le reazioni positive e negative sono state confermate con il controllo positivo (placenta) utilizzato nello studio. La tabella 4 mostra l’analisi descrittiva delle variabili insieme alla verifica della loro associazione con la positività CD24, data dall’esatta prova di Fisher. Un segnale CD24 positivo è stato visto nel 98,3% dei maschi, ma non c’era alcuna associazione tra il sesso e la positività CD24 (P – 0,343). Solo il tipo di campione raccolto e il trattamento palliativo sono stati significativamente associati al segnale CD24, a un livello di significatività del 5% (rispettivamente P – 0,010 e 0,042).
Tabella 4. Associazione di variabili con CD24 positivo.
| IHC CD24 positivo | valore di p | ||||
| No | Sì | ||||
| N | % | N | % | ||
| Sesso | 0,343 | ||||
| Donna | 3 | 5.7 | 50 | 94.3 | |
| Uomo | 1 | 1.7 | 58 | 98.3 | |
| Età | 0,159 | ||||
| 35-59 anni | 3 | 8.1 | 34 | 91.9 | |
| 60-69 anni | 0 | – | 40 | 100.0 | |
| 70-93 anni | 1 | 2.9 | 34 | 97.1 | |
| Morte (n=07) | 0,618 | ||||
| No | 3 | 5.4 | 52 | 94.6 | |
| Sì | 1 | 1.9 | 51 | 98.1 | |
| Trattamento chirurgico (n=110) | 0,399 | ||||
| Palliativa | 3 | 7.1 | 39 | 92.9 | |
| Chirurgia parziale | 0 | – | 20 | 100.0 | |
| DPT# | 1 | 2.1 | 47 | 97.9 | |
| Trattamento palliativo (n=91) | 0,042 | ||||
| No | 3 | 13.6 | 19 | 86.4 | |
| Sì | 1 | 1.4 | 68 | 98.6 | |
| Grado di differenziazione (n=108) | 1,000 | ||||
| Ben differenziato | 0 | – | 3 | 100.0 | |
| Moderato differenziato | 3 | 4.4 | 65 | 95.6 | |
| Scarsa differenziata | 1 | 2.7 | 36 | 97.3 | |
| Specimen/campione (n=108) | 0,010 | ||||
| Metastasi | 1 | 4.0 | 23 | 95.9 | |
| Pancreas | 2 | 2.4 | 82 | 97.6 | |
| Fase T (n=110) | 0,705 | ||||
| T1 | 0 | – | 12 | 100.0 | |
| T2 | 1 | 2.4 | 40 | 97.6 | |
| T3 | 1 | 4.8 | 20 | 95.2 | |
| T4 | 1 | 4.0 | 24 | 96.0 | |
| Tx | 1 | 9.1 | 10 | 90.9 | |
| Fase N (n=110) | 0,881 | ||||
| N0 | 1 | 2.9 | 34 | 97.1 | |
| N1 | 2 | 5.9 | 32 | 94.1 | |
| N2 | 0 | – | 7 | 100.0 | |
| Nx | 1 | 2.9 | 33 | 97.1 | |
| Fase M | 1,000 | ||||
| M0 | 3 | 4.2 | 69 | 95.8 | |
| M1 | 1 | 2.9 | 34 | 97.1 | |
| Mx | 0 | – | 5 | 100.0 | |
| Fase generale (n=108) | 0,913 | ||||
| 1 | 1 | 6.2 | 15 | 93.8 | |
| 2 | 1 | 3.1 | 31 | 96.9 | |
| 3 | 1 | 3.8 | 25 | 96.2 | |
| 4 | 1 | 2.9 | 33 | 97.1 | |
| MTX (n=37) | 1,000 | ||||
| Fegato | 1 | 4.3 | 22 | 95.7 | |
| Linfonodi | 0 | – | 5 | 100.0 | |
| Peritoneo | 0 | – | 4 | 100.0 | |
| Altri | 0 | – | 5 | 100.0 | |
| Località: Testa di tumore | 0,550 | ||||
| Sì | 3 | 3.3 | 89 | 96.7 | |
| Località: Coda Tumorale | 1,000 | ||||
| Sì | 0 | – | 7 | 100.0 | |
| Posizione: Corpo tumorale | 1,000 | ||||
| Sì | 1 | 4.0 | 24 | 96.0 | |
*Test esatto di Fisher
#DPT: Duodenopancreatectomy
Non è stata osservata alcuna immunoreattività CD24 nell’epitelio ductale pancreatico normale. Un segnale CD24 positivo è stato visto nel 98,6% dei pazienti sottoposti a trattamento palliativo, che è stato significativo (P=0,042). A causa della loro messa in scena del tumore avanzato, avevano un segnale CD24 più forte rispetto agli individui che hanno subito duodenopancreatectomia totale. Il segnale CD24 era più forte negli individui che hanno subito un trattamento palliativo come opzione di trattamento (98,6%) rispetto a coloro che non l’hanno fatto (13,6%).
Il grado di differenziazione e messa in scena del tumore non ha mostrato alcuna associazione significativa con la colorazione CD24-positiva, né vi erano differenze significative tra tumori scarsamente differenziati o in fase avanzata rispetto ai tumori ben differenziati e in fase iniziale rispetto al CD24 positivo.
La tabella 3 mostra l’associazione delle variabili con intensità quando IL CD24 è stato positivo. Solo la presenza di metastasi (MTX) è stata significativamente associata all’intensità, dove il fegato e il peritoneo hanno mostrato una forte positività rispetto alle metastasi in altri siti, come i linfonodi e altri tessuti.
OCT4 IMMUNOSTAINING NELLE CELLULE STAMINALI TUMORALI NELLE CELLULE ADENOCARCINOMA DEL DUTTATO PANCREATICO
L’immunostaining OCT4 ha mostrato un modello diverso rispetto agli altri anticorpi testati. La frequenza dei casi positivi non era così alta come osservata con gli altri due anticorpi testati, ma quando positiva, la sua intensità era molto forte (Figura 1E e 1F). L’immunostaining si è verificato nel nucleo delle cellule tumorali nel 31,5% dei casi e non ha macchiato il 68,7% dei tumori analizzati. Non è stata osservata alcuna immunoreattività OCT4 nell’epitelio pdutorestico pancreatico. Nessuna variabile è stata significativamente associata al segnale OCT4, a un livello di significatività del 5%. L’età media del gruppo positivo OCT4 è stata di 62,62 anni e di 63,23 anni nel gruppo negativo OCT4. Tuttavia, non vi è stata alcuna differenza significativa tra i gruppi per quanto riguarda l’età (P – 0,547).
Anche se non statisticamente significativo, una scoperta interessante dall’analisi della colorazione OCT4 è che più differenziato il tumore, maggiore è l’intensità della colorazione, mentre i tumori scarsamente differenziati avevano bassa intensità di colorazione (66,6% vs 21,6%). Le cellule positive per OCT4 hanno un maggiore potenziale di differenziazione.
ANALISI DI SOPRAVVIVENZA
A proposito delle curve di sopravvivenza e della loro relazione con i tre marcatori, tutti i gruppi hanno presentato curve molto simili, in modo che il test log-rank non indichi alcuna differenza significativa tra le curve per quanto riguarda i segnali positivi provenienti dai tre anticorpi. Le curve Kaplan-Meier per l’intensità CD133, CD24 e OCT4, confermate dai valori p del test di log-rank, nessuna delle curve di sopravvivenza differisce in modo significativo rispetto all’intensità. Pertanto, la positività dei marcatori non altera la sopravvivenza dei pazienti inclusi nello studio.
DISCUSSIONI
I CSC sono stati recentemente associati alla progressione del cancro e utilizzati per identificare i fattori e gli obiettivi prognostici per la terapia in diversi tipi di cancro (DEAN et al., 2005). È notevole che il ruolo dei CSC non sia ben compreso o caratterizzato nel cancro al pancreas. Inoltre, sono state pubblicate poche relazioni sui modelli e gli effetti della presenza dei CSC. Considerando questa mancanza di dati, abbiamo analizzato retrospettivamente l’espressione dei CSC in campioni di cancro al pancreas usando l’immunohistochimica e verificato il suo ruolo nella progressione del tumore e nella resistenza terapeutica nell’adenocarcinoma pancreatico ductale.
La biologia molecolare del cancro al pancreas è direttamente correlata alla sua rapida progressione e alla bassa risposta terapeutica. È ben documentato che la comparsa di una cellula tumorale è il risultato di un accumulo di mutazioni nel suo DNA in grado di alterarla morfologicamente e funzionalmente (FANG et al., 2013; RICCI-VITIANI et al., 2007). L’innesco di questo processo e di tutta la sua evoluzione, culminato nella formazione della cellula tumorale e delle sue caratteristiche pertinenti, caratterizzano il processo di carcinogenesi, è già significativamente chiarito per diversi tipi di neoplasia. Tuttavia, per alcuni tipi di cancro come il cancro al pancreas, il processo rimane incerto (KOBAYASHI; NORONHA, 2015).
La maggior parte dei tumori maligni segue una storia naturale che può essere divisa in quattro fasi: trasformazione maligna, crescita delle cellule tumorali, invasione locale e metastasi. Il processo di carcinogenesi, o trasformazione maligna, si verifica in varie fasi e risultati dovuti all’accumulo di cambiamenti genetici e mutazioni, che sono innescati da diversi fattori, tra cui fattori ambientali come radiazioni e sostanze chimiche (AYOB; RAMASAMY, 2018). Tuttavia, affinché questo processo di carcinogenesi progredisca, potrebbe essere necessario avere alcune cellule con le caratteristiche delle cellule staminali, come il potenziale di auto-rinnovamento e rigenerazione, nonché un alto indice prolifertivo.
Prove recenti suggeriscono che le cellule staminali svolgono un ruolo cruciale non solo nella generazione e nel mantenimento di tessuti diversi, ma anche nello sviluppo e nella progressione di alcuni tipi di tumori (BALIC et al., 2012). Per diversi tumori solidi, è stato dimostrato che ospitano una sottopopolazione distinta di cellule tumorali che hanno caratteristiche di cellule staminali e sono quindi chiamate cellule staminali tumorali (CTT) o cellule tumorigene (MATSUDA et al., 2012). Le cellule staminali tumorali sembrano essere in grado di avviare e guidare la crescita tumorale nei tumori solidi. CD133, CD24 e OCT4 sono recentemente riportati marcatori prospettici per i CSC, espressi in una varietà di tumori; tuttavia, a nostra conoscenza, non è stato fatto alcun tentativo di rilevare la loro espressione nei campioni di cancro al pancreas (MAEDA et al., 2008).
Si può osservare che le cellule staminali tumorali, o marcatori superficiali delle cellule staminali tumorali come CD133, CD24 e OCT4 sono presenti nelle cellule tumorali del pancreas, confermando la relazione intrinseca tra il fenotipo maligno pancreatico e la presenza di cellule staminali. Non è stata osservata alcuna differenza significativa tra l’espressione degli anticorpi e il grado di differenziazione tumorale, supponendo che le cellule staminali tumorali siano presenti dall’inizio del tumore. Va notato che per gli anticorpi CD133 e CD24, la percentuale di cellule tumorali che esprimono marcatori è aumentata con il progredire del tumore. Quindi, i tumori più aggressivi e scarsamente differenziati hanno mostrato una maggiore positività per la presenza dell’anticorpo. Mentre d’altra parte, l’espressione dell’anticorpo OCT4 era più alta e più intensa nei tumori ben differenziati; quindi, più differenziato il tumore, maggiore è l’etichettatura. Le cellule che hanno il marcatore di cellule staminali per l’anticorpo OCT4 hanno un potenziale maggiore di differenziazione (VILLODRE et al., 2016). Questo può essere il motivo per cui OCT4 differiva in termini di espressione dagli altri marcatori che sono stati testati, anche se queste differenze non erano statisticamente significative.
Marcatore OCT4 è presente solo focalmente in campioni di tumore che sono stati positivi. Questa scoperta è d’accordo con la teoria secondo cui i CSC rappresentano solo una piccola parte della popolazione totale di cellule tumorali (PHI et al., 2018). Ad esempio, le cellule positive CD133 sono state rilevate nello 0,7-6,1% (RICCI-VITIANI et al., 2007), 1.8-24.5% (O’BRIEN et al., 2007) delle cellule tumorali primarie del colon, e nello 0,7-3,2% delle cellule tumorali pancreatiche primarie utilizzando l’analisi citometrica del flusso (HERMANN et al., 2007). La colorazione immunostochimica ha rivelato l’espressione CD133 nell’1-3% degli esemplari di carcinoma epatocellulare (MA et al., 2007).
Anche se l’etichettatura e l’espressione sono state osservate con una frequenza relativamente elevata in tutti i gradi di direzione del tumore, ad esempio, i tumori hanno espresso l’etichettatura per le cellule staminali tumorali indipendentemente dal grado di differenziazione, alcuni risultati favoriscono l’ipotesi che il numero di cellule staminali nei tumori sia maggiore nei tumori con un comportamento più aggressivo e con prognosi peggiore. Questa ipotesi è supportata dal fatto che CD133 è stato più frequentemente espresso in individui che hanno subito solo un trattamento palliativo (95,1%) con un’associazione significativa (valore p < 0,05) tra la presenza di anticorpi e il trattamento palliativo. Quando viene riferito che un paziente ha subito solo un trattamento palliativo, si presume che il tumore fosse in una fase significativamente avanzata e senza possibilità di intervento chirurgico curativo e quindi è stato eseguito solo un trattamento palliativo. Allo stesso modo, si può sopravvalutare che i tumori più aggressivi nelle fasi successive esprimono una maggiore etichettatura per l’anticorpo delle cellule staminali tumorali CD133. Diversi studi clinici hanno studiato la relazione tra l’espressione CD133 e gli esiti clinici dei tumori; tuttavia, i risultati sono controversi. Ad esempio, l’espressione CD133 è correlata alla prognosi infausta del cancro del colon e dell’epatocarcinoma (CAI et al., 2018).
Per quanto riguarda lo stadio TNM, l’etichettatura dei tre anticorpi (CD133, CD24 e OCT4) non è stata modificato lungo la progressione. È da notare che le cellule staminali tumorali erano presenti fin dalla fase iniziale e che non si ingrandisce durante la messa in scena. La prevalenza dei tre anticorpi e delle loro associazioni con le variabili era generalmente elevata, anche se non tutti gli anticorpi avevano un livello di significatività inferiore a P < 0,05.
Tutte le variabili che hanno contribuito a una prognosi sfavorevole, come la posizione del tumore alla testa pancreatica, l’età avanzata e la presenza di metastasi sono state tutte associate ad un’alta prevalenza soprattutto per l’espressione di CD133 e CD24. Inoltre, questo corroborato con l’idea che le cellule staminali tumorali quando presenti sono associate con rapida progressione del tumore e resistenza terapeutica. Le cellule staminali tumorali hanno alcune caratteristiche simili a quelle delle cellule staminali dell’organismo normale, come la capacità di auto-rigenerarsi e la pluripotenza, dando origine a linee cellulari tumorali eterogenee che formano lo stesso tumore (TAI et al., 2005). È probabile che le cellule staminali tumorali condivimettono molte delle proprietà delle cellule staminali normali che forniscono una lunga durata di vita, tra cui la relativa quiescenza, la resistenza ai farmaci e alle tossine attraverso l’espressione di diversi trasportatori, una capacità attiva di riparazione del DNA e una resistenza all’apoptosi. Pertanto, i tumori potrebbero avere una popolazione incorporata di cellule pluripotenti resistenti ai farmaci che possono sopravvivere alla chemioterapia e ripopolare il tumore (MARQUES et al., 2010).
Per definire se i CSC prevedessero l’esito clinico, abbiamo eseguito l’analisi di sopravvivenza di Kaplan-Meier e abbiamo mostrato che i gruppi presentavano curve molto simili. Pertanto, il test di classificazione del log non indica una differenza significativa tra le curve per quanto riguarda la presenza dei tre anticorpi. Anche se sono associati a variabili prognostiche peggiori come metastasi e opzioni terapeutiche di trattamento palliativo, nessuna associazione può essere fatta tra la presenza di cellule staminali tumorali e la sopravvivenza del paziente in questo caso; pertanto, la presenza di CSC non prevede una sopravvivenza peggiore.
La scoperta delle cellule staminali tumorali nei tumori solidi ha cambiato la nostra visione della carcinogenesi. Che le cellule staminali tumorali sono coinvolte nello sviluppo e nella progressione del tumore è un dato di fatto, dal momento che la loro presenza era significativa nella stragrande maggioranza dei tessuti analizzati e, recentemente, molti studi hanno associato la presenza di cellule staminali tumorali con lo sviluppo di diversi tipi di cancro.
CONSIDERAZIONI FINALI
Il processo di tumorigenesi, per quanto il soggetto è noto fino ad ora, comporta la progressiva acquisizione di molteplici mutazioni aberranti che culminano nell’espansione e nella proliferazione di sottopopolazioni cellulari più aggressive, contribuendo alla progressione e alla crescita del tumore. Anche se questa teoria è ben consolidata, l’identificazione delle cellule che sono in grado di causare la progressione del tumore è ancora oggetto di molti studi per caratterizzare meglio il processo di carcinogenesi e identificare queste cellule.
Gran parte delle informazioni che otteniamo e usiamo per la diagnosi, la prognosi e il trattamento dei neoplasmi pancreatici derivano da popolazioni eterogenee con vari gradi di maturazione e differenziazione. Sta diventando sempre più urgente caratterizzare i CSCs per la valutazione e la caratterizzazione del percorso cancerogeno dei tumori più aggressivi. La conseguenza diretta è lo sviluppo di strategie terapeutiche che possono agire sui CSCs e la possibilità di determinare, con un metodo facilmente accessibile, quali pazienti beneficeranno maggiormente di questo tipo di trattamento.
RIFERIMENTI
ALLEGRA, E.; TRAPASSO, S. Cancer stem cells in head and neck cancer. Onco Targets Ther., v.5, p.375-83, 2012.
ANSARI, D.; CHEN, B.C.; DONG, L.; ZHOU, M.T.; ANDERSSON, R. Pancreatic cancer: translational research aspects and clinical implications. World J Gastroenterol., v.18, n.13, p.1417-24, 2012.
AYOB, A.Z.; RAMASAMY, T.S. Cancer stem cells as key drivers of tumour progression. J Biomed Sci., v.25, n.20, 2018.
BALIC, A.; DORADO, J.; ALONSO-GÓMEZ, M.; HEESCHEN, C. Stem cells as the root of pancreatic ductal adenocarcinoma. Exp Cell Res., v.318, n.6, p.691-704, 2012.
BARBOSA, I.R.; SANTOS, C.A.; SOUZA, D.L.B. Pancreatic cancer in Brazil: mortality trends and projections until 2029. Arq. Gastroenterol., v.55, n.3, p.230-6, 2018.
CAI, X.; LI, J.; YUAN, X.; XIAO, J.; DOOLEY, S.; WAN, X., WHENG, W.; LU, L. CD133 expression in cancer cells predicts poor prognosis of non-mucin producing intrahepatic cholangiocarcinoma. J Transl Med., v.16, n.50, 2018.
DEAN, M.; FOJO, T.; BATES, S. Tumour stem cells and drug resistance. Nat Rev Cancer., v.5, n.4, p.275-84, 2005.
FANG, Y.; YAO, Q.; CHEN, Z.; XIANG, J.; WILLIAM, F.E.; GIBBS, R.A.; CHEN, C. Genetic and molecular alterations in pancreatic cancer: implications for personalized medicine. Med Sci Monit., v.19, p.916-26, 2013.
HERMANN, P.C.; HUBER, S.L.; HERRLER, T.; AICHER, A.; ELLWART, J.W.; GUBA, M.; BRUNS, C.J.; HEESCHEN, C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell., v.1, n.3, p.313-23, 2007.
HU, Y.; FU, L. Targeting cancer stem cells: a new therapy to cure cancer patients. Am J Cancer Res., v.2, n.3, p.340-56, 2012.
KOBAYASHI, N.C.C.; NORONHA, S.M.R. Cancer stem cells: a new approach to tumor development. Rev Assoc Med Bras., v.61, n.1, p.86-93, 2015.
KONONEN, J.; BUBENDORF, L.; KALLIONIMENI, A.; BÄRLUND, M.; SCHRAML, P.; LEIGHTON, S.; TORHORST, J.; MIHATSCH, M.J.; SAUTER, G.; KALLIONIMENI, O.P. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med., v.4, n.7, p.844-7, 1998.
LI, D.; JIAO, L. Molecular epidemiology of pancreatic cancer. Int J Gastrointest Cancer., v.33, n.1, p.3-14, 2003.
MA, S.; CHAN, K.W.; HU, L.; LEE, T.K.W.; WO, J.Y.H.; NG, I.O.L.; ZHENG, B.J.; GUAN, X.Y. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, v.132, n.7, p.2542-56, 2007.
MAEDA, S.; SHINCHI, H.; KURAHARA, H.; MATAKI, Y.; MAEMURA, K.; SATO, M.; NATSUGOE, S.; AIKOU, T.; TAKAO, S. CD133 expression is correlated with lymph node metastasis and vascular endothelial growth factor-C expression in pancreatic cancer. Br J Cancer., v.98, n.8, p.1389-97, 2008.
MARQUES, D.S.; SANDRINI, J.Z.; BOYLE, R.T.; MARINS, L.F.; TRINDADE, G.S. Relationships between multidrug resistance (MDR) and stem cell markers in human chronic myeloid leukemia cell lines. Leuk Res., v.34, n.6, p.757-62, 2010.
MATSUDA, Y.; KURE, S.; ISHIWATA, T. Nestin and other putative cancer steam cell markers in pancreatic cancer. Med Mol Morphol., v.45, n.2, p.59-65, 2012.
O’BRIEN, C.A.; POLLETT, A.; GALLINGER, S.; DICK, J.E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature, v.445, n.7123, p.106-10, 2007.
PHI, L.T.H.; SARI, I.N.; YANG, Y.G.; LEE, S.H.; JUN, N.; KIM, K.S.; LEE, Y.K.; KWON, H.Y. Cancer Stem Cells (CSCs) in Drug Resistance and their Therapeutic Implications in Cancer Treatment. Stem Cells Int., n.5416923, 2018.
RICCI-VITIANI, L.; LOMBARDI, D.G.; PILOZZI, E.; BIFFONI, M.; TODARO, M.; PESCHLE, C.; DE MARIA, R. Identification and expansion of human colon-cancer-initiating cells. Nature, v.445, p.111-5, 2007.
SAKORAFAS, G.H.; TSIOTOU, A.G.; TSIOTOS, G.G. Molecular biology of pancreatic cancer; oncogenes, tumor suppressor genes, growth factors, and their receptors from a clinical perspective. Cancer Treat Rev., v.26, n.1, p.29-52, 2000.
SOTO, J.L.; BARBERA, V.M.; SACEDA, M.; CARRATO, A. Molecular biology of exocrine pancreatic cancer. Clin Transl Oncol., v.8, p.306-12, 2006.
TAI, M.H.; CHANG, C.C.; OLSON, L.K.; TROSKO, J.E. Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis. Carcinogenesis, v.26, n.2, p.495-502, 2005.
VILLODRE, E.S.; KIPPER, F.C.; PEREIRA, M.B.; LENZ, G. Roles of OCT4 in tumorigenesis, cancer therapy resistance and prognosis. Cancro Trattare Rev., v.51, p.1-9, 2016[1].
MSc in Scienze Mediche, Programma Post-laurea in Medicina: Scienze Mediche, Università Federale di Rio Grande do Sul (UFRGS), Brasile.
[2] Dottorato in Scienze Fisiologiche, Università Federale di Rio Grande (FURG), Brasile.
[3] MSc in Genetica e Biologia Molecolare, Università Federale di Rio Grande do Sul (UFRGS), Brasile.
[4] Studente di Medicina universitario presso l’Università Federale di Rio Grande (FURG), Brasile.
[5] Dottorato in Scienze Biologiche (Biochimica) presso l’Università Federale di Rio Grande do Sul (UFRGS), con dottorato in neuroscienze – Università della California Irvine.
Inviato: settembre, 2020.
Approvato: ottobre 2020.