ARTICLE ORIGINAL
RODRIGUES, Camila Juliano Salvador [1], SILVEIRA, Elita Ferreira da [2], VARGAS, Rafael da Silveira [3], GIACOMO, Giordano Gatti de [4], BIANCHIN, Marino Muxfeldt [5]
RODRIGUES, Camila Juliano Salvador. Et al. Marqueurs de cellules souches cancéreuses associés au développement et au phénotype agressif dans le cancer pancréatique. Revista Científica Multidisciplinar Núcleo do Conhecimento. Année 05, Ed. 10, vol. 12, p. 102-122. octobre 2020. ISSN:2448-0959, Lien d’accès dans: https://www.nucleodoconhecimento.com.br/sante/cancer-pancreatique
ABSTRAIT
Contexte : Les cellules souches cancéreuses, également connues sous le nom de cellules tumorales, sont suggérées pour être responsables de la résistance aux médicaments et du développement du cancer en partie en raison de leur capacité à se renouveler et à se différencier en lignées hétérogènes de cellules cancéreuses. Objectif : Cette étude a été conçue pour étudier le rôle des cellules souches cancéreuses dans le cancer du pancréas. Méthodes : Une analyse clinicopathologique rétrospective a été entreprise dans 112 patients diagnostiqués avec l’adénocarcinome ductal pancréatique entre 2005 et 2010, et l’immunohistochimie a été exécutée avec des anticorps contre CD133, CD24, et OCT4. La coloration nucléaire, cytoplasmique ou membranaire positive pour chaque anticorps a été évaluée sur l’intensité de coloration, étant classée en groupes de coloration faible/modéré ou fort. Les résultats ont été analysés par rapport aux paramètres clinicopathologiques de chaque patient. Résultats : Il y avait une relation établie entre la coloration des marqueurs avec quelques variables liées au pronostic plus mauvais, étant les trois marqueurs présents dans la plupart des cellules de tumeur et associés à la progression de tumeur. Nous supposons que les cellules souches cancéreuses sont présentes dès le début de l’initiation tumorale et sont intrinsèquement liées au développement de la tumeur. Bien que la présence de cellules souches ait été associée à la biologie moléculaire de diverses tumeurs, leur expression dans le cancer pancréatique n’a pas encore été cliniquement rapportée. Conclusion : La présence des cellules souches et leur rôle dans la tumeur de cancer pancréatique peuvent être considérés comme des facteurs pronostiques valables, bien que le mécanisme impliqué ait besoin d’investigation plus loin. L’amélioration du rôle des cellules souches cancéreuses et de la carcinogenèse peut en fin de compte générer de nouvelles idées pour des approches diagnostiques et thérapeutiques moléculaires.
Mots clés: Cellules souches cancéreuses, cancer du pancréas, Antigène AC133, Antigène CD24, OCT4.
INTRODUCTION
Malgré les progrès réalisés dans le diagnostic et le traitement du cancer au cours des dernières décennies, il demeure l’une des causes de décès les plus courantes dans le monde. Bien que potentiellement guérissable lorsqu’il est diagnostiqué tôt, le diagnostic précoce demeure un défi dans la pratique clinique quotidienne. De nombreux cancers sont diagnostiqués à un stade avancé, lorsque les options thérapeutiques ne sont plus efficaces (BARBOSA et al., 2018).
L’adénocarcinome ductal pancréatique (PDAC) est une maladie très agressive habituellement diagnostiquée à un stade avancé et pour laquelle peu de thérapies efficaces sont disponibles. C’est un néoplasme dont l’incidence est presque égale à sa mortalité. La raison pour laquelle le cancer du pancréas a un tel pronostic pauvre et pourquoi il a une réponse thérapeutique si faible à la chimiothérapie et la radiothérapie sont des questions qui ont motivé la recherche d’une réponse qui peut modifier le cours de cette maladie. Malgré les progrès des techniques chirurgicales, qui sont aujourd’hui considérées comme la seule option curative, le taux moyen de survie à 5 ans est inférieur à 5% (1-3%) (BARBOSA et al., 2018; SOTO et al., 2006). Il est considéré comme la néoplasie avec le pire pronostic de plus de 60 types de cancers, un fait démontré par son taux d’incidence presque égalant le taux de mortalité (SAKORAFAS et al., 2000). Il convient de noter que la détection précoce du cancer, à un stade qui peut encore être guéri, est associée à une plus grande efficacité thérapeutique et est actuellement l’un des moyens d’améliorer les résultats des patients diagnostiqués avec le cancer du pancréas (ALLEGRA; TRAPASSO, 2012).
La biologie moléculaire du cancer du pancréas est directement liée à sa progression rapide et à sa faible réponse thérapeutique. Il est bien documenté que l’apparition d’une cellule tumorale est le résultat d’une accumulation de mutations dans son ADN capable de modifier morphologiquement et fonctionnellement ses propriétés normales (FANG et al., 2013; RICCI-VITIANI et al., 2007). Le déclenchement de ce processus et de son évolution moléculaire, culminant dans la formation de la cellule tumorale et de ses caractéristiques pertinentes, caractérisent le processus de carcinogenèse. Il est bien compris dans la littérature que le développement d’une néoplasie implique un ensemble de changements moléculaires qui conduisent non seulement à l’émergence et la survie d’une cellule tumorale, mais à sa capacité d’envahir les tissus adjacents et de former des métastases lointaines (LI; JIAO, 2003).
Parmi les processus les plus récemment impliqués dans la carcinogenèse et la progression de tumeur, les changements dans les cellules souches cancéreuses (CSC) sont encore mal étudiés dans le cancer pancréatique sans résultats satisfaisants, et ils méritent de plus grands efforts dans l’élucidation de leurs effets et de la relation dans l’acquisition d’un phénotype maligne pancréatique. Des preuves récentes ont suggéré que les CSC jouent un rôle crucial non seulement dans la génération et l’entretien de différents tissus, mais aussi dans le développement, la progression et la résistance thérapeutique de différents types de tumeurs (BALIC et al., 2012).
Les CSC appartiennent à un groupe différencié de cellules dans une tumeur avec des propriétés auto-renouvelées et différenciantes, semblables aux cellules souches normales, donnant lieu à des lignes hétérogènes de cellules de tumeur qui forment une tumeur. Ils peuvent diviser et provenir de plusieurs cellules qui composent les tumeurs, perpétuant ainsi leur croissance et offrant une résistance à la chimiothérapie par des mécanismes pas encore bien compris. Pour cette raison, ils représentent un objectif de recherche important (TAI, 2005).
L’agressivité intrinsèque du cancer du pancréas, avec sa grande capacité d’invasion locale, son potentiel métastatique élevé, son diagnostic tardif et sa résistance thérapeutique, semble être en partie liée à la population de CSC qui composent ces tumeurs (HU; FU, 2012). En outre, il a été démontré que le PDAC contient non seulement une population homogène de CSC, mais diverses sous-populations qui peuvent être impliquées dans la progression de tumeur. Jusqu’à présent, les CSC pancréatiques identifiés constituent une minorité de cellules tumorales (environ 1 à 5 %), et ont une grande capacité d’auto-renouvellement (ANSARI et al., 2012). L’aspect clinique le plus important, cependant, est que ces CSC sont fortement résistants à la chimiothérapie et à la radiothérapie, ayant pour résultat la résistance et la répétition rapide de la maladie. À l’heure actuelle, l’un des grands défis de l’oncologie est d’identifier et d’étudier les caractéristiques de ces CSC, en particulier dans le PDAC, où peu de découvertes ont été faites (KOBAYASHI; NORONHA, 2015).
MATÉRIAUX ET PROCÉDÉS
SÉLECTION DE CAS ET ÉCHANTILLONS DE TUMEURS
Les échantillons de tissus provenaient d’une cohorte de 112 cancers du pancréas consécutifs diagnostiqués de 2005 à 2010, sélectionnés parmi les soins de routine de l’Hôpital de Clínicas de Porto Alegre (HCPA), par le Département de pathologie et le Groupe du tractus biliaire et du pancréas. Des analyses immunohistorichimiques ont été effectuées dans des blocs de tissus incorporés à la paraffine déjà stockés au Département de pathologie de l’HCPA, après approbation par le Comité scientifique et le Comité d’éthique en recherche en santé de l’établissement. Les variables suivantes ont été enregistrées à partir des dossiers médicaux : âge, sexe, grade de tumeur, statut de ganglion lymphatique, occurrence de métastase, traitement reçu (type de chirurgie, radiothérapie, et chimiothérapie), la survie libre de la maladie, et la survie globale.
ANALYSE IMMUNOHISTOCHIMIQUE DE MICROARRAY TISSULAIRE (TMA)
Tissue Microarray (TMA) tableau est une technique décrite pour la première fois par Kononen et al. (1998) et est un excellent outil pour la pathologie d’investigation. Il s’agit de regrouper en un seul bloc un nombre raisonnable d’échantillons de tissus, permettant ainsi l’étude de l’expression immunohistochimique des marqueurs moléculaires, avec une grande utilisation du matériau, la présence de contrôle interne, et le temps et le coût. Cette technique permet également la normalisation des réactions, la représentativité efficace par l’utilisation de différentes zones de la tumeur, l’étude d’un grand nombre d’échantillons simultanément, la facilité d’interprétation et la recherche à grande échelle des facteurs pronostiques ou prédictifs du cancer (figure 1).
Fig. 1. Illustre certains échantillons de tissus tumoraux inclus dans l’étude par la technique TMA
ANALYSE STATISTIQUE
Pour vérifier l’association entre les variables immunohistochimiques et l’intensité de l’immunoréaction avec les variables de caractérisation des individus, une approche non paramétrique a été utilisée avec le test exact de Fisher. Pour vérifier l’association de l’âge variable numérique avec les variables immunohistochimiques et l’intensité, le test Mann-Whitney U a été utilisé.
L’association entre les marqueurs de cellules souches et les différentes caractéristiques clinicopathologiques des patients [y compris l’âge, le sexe, la différenciation tumorale, le stade, la catégorie Tumor-Node-Metastasis (TNM) et la résection tumorale] a été évaluée par le coefficient de corrélation de Pearson ou les essais de X2, selon le cas. Pour l’intensité, les catégories ont été dichotomies en intensité faible/modérée (0-2+) ou en intensité élevée (≥3+).
La méthode Kaplan-Meier a été utilisée pour estimer la probabilité de survie. Les courbes de survie ont été comparées à l’aide du test de log-rank, qui affirme sous l’hypothèse nulle que les fonctions de survie ne diffèrent pas les unes des autres.
Le temps de survie global a été mesuré du moment de la chirurgie ou de la biopsie à la date du décès (à la suite d’une cause quelconque) ou au dernier suivi. Le temps de survie sans maladie a été mesuré de la date du diagnostic histologique ou de la chirurgie à la date du premier événement d’échec sans maladie (défini comme rechute locorégionale), maladie éloignée, ou la mort à la suite de n’importe quelle cause. L’importance a été établie à P < 0,05. Toutes les analyses statistiques ont été effectuées à l’aide de R (version 3.6.0).
RÉSULTATS
Les analyses immunohistochimiques ont indiqué la présence des marqueurs de surface de cellules souches de tumeur pour les trois anticorps analysés dans les cellules de PDAC. Un total de 112 patients atteints d’un cancer du pancréas ont été inclus dans cette étude : 59 (52,6 %) hommes et 53 (47,4 %) femmes, avec un âge médian au diagnostic de 63 ans (gamme, 36-93 ans, SD ± 10,3) et une période médiane de suivi post-diagnostic de 16,2 mois.
Il n’y avait aucune différence significative entre les sexes en comparant l’intensité du signal d’anticorps. Cinquante patients (48.08%) décédé au cours de la période de suivi.
Parmi tous les patients inclus, 16 (15,2 %) étaient au stade pathologique I, 32 (30,4%) étaient au stade pathologique II, 25 (23,8%) étaient au stade pathologique III, et 32 (30,4 %) étaient au stade pathologique IV. Dans les cas où l’information sur le grade de tumeur était disponible, 2.8% des carcinomes étaient bien différenciés, 62.8% étaient modérément différenciés, et 34.2% étaient mal différenciés.
En ce qui concerne le stade TNM, 11,2% étaient T1 (tumeur inférieure à 2 cm), 38,3% étaient T2 (tumeur supérieure à 2 cm ou envahir les tissus voisins), 19,6% étaient T3 (tumeur de toute taille envahissant les tissus voisins, mais sans compromettre le plexus coeliaque ou l’artère mésentérique supérieure), 21,5% étaient T4 (tumeur de n’importe quelle taille compromettant les organes vitaux et le plexus coeliaque ou artère mésentérique supérieure) , et 9.3% étaient Tx (étendue de la tumeur est inconnue). Pour la participation aux ganglions lymphatiques, 31,7 % se trouvaient au stade N0 (pas de métastase des ganglions lymphatiques), 31,7 % étaient N1 (métastase régionale des ganglions lymphatiques), 6,5 % étaient N2 (plus d’une chaîne de ganglions lymphatiques affectée) et 29,9 % étaient Nx (non évaluable). En ce qui concerne la présence de métastases, 66,6 % étaient au stade M0 (pas de métastases lointaines), 30,2 % étaient M1 (métastases lointaines) et 3,6 % étaient Mx (non évaluable).
Environ 75,9 % des échantillons ont été obtenus à partir de tissus tumoraux pancréatiques, et environ 26 % provenaient d’échantillons de métastases, le foie (65,7 %) le site le plus touché, suivi des ganglions lymphatiques (14,2 %), du péritoine (8,5 %) et des autres (11,4 %).
Le traitement palliatif a été donné à 68 personnes, soit 76,40 % du nombre total de personnes analysées.
En ce qui concerne l’emplacement de la tumeur, 81,6% des tumeurs ont été localisées dans la tête du pancréas, 22,9% dans le corps, et 6,4% dans la queue.
Le tableau 1 résume l’analyse descriptive générale des personnes impliquées dans l’étude.
Tableau 1. Analyse descriptive générale
| Variables | ¡n | % |
| Sexe | ||
| Femelle | 53 | 47.4 |
| Mâle | 59 | 52.6 |
| Âge | ||
| 35-59 ans | 37 | 33.9 |
| 60-69 ans | 39 | 35.8 |
| 70-93 ans | 33 | 30.3 |
| Décès (n=104) | ||
| non | 54 | 51.9 |
| Oui | 50 | 48.1 |
| Traitement chirurgical (n=108) | ||
| Palliatifs | 42 | 38.9 |
| Chirurgie partielle | 19 | 17.6 |
| DPT# | 47 | 43.5 |
| Traitement chirurgical (n=89) | ||
| non | 21 | 23.6 |
| Oui | 68 | 76.4 |
| Différenciation tumorale (n = 105) | ||
| Bien différencié | 3 | 2.9 |
| Modéré différencié | 66 | 62.8 |
| Pauvre différencié | 36 | 34.3 |
| Spécimen/Échantillon (n=108) | ||
| Métastase | 26 | 24.1 |
| Pancréas | 82 | 75.9 |
| Stade pathologique T de tumeur (n=107) | ||
| T1 | 12 | 11.2 |
| T2 | 41 | 38.3 |
| T3 | 21 | 19.6 |
| T4 | 23 | 21.5 |
| Tx | 10 | 9.4 |
| Stade pathologique de tumeur N (n= 107) | ||
| N0 | 34 | 31.8 |
| N1 | 34 | 31.8 |
| N2 | 7 | 6.5 |
| Nx | 32 | 29.9 |
| Stade pathologique M de tumeur (n = 109) | ||
| M0 | 72 | 66.1 |
| M1 | 33 | 30.2 |
| Mx | 4 | 3.7 |
| Stade général pathologique de tumeur (n=105) | ||
| 1 | 16 | 15.2 |
| 2 | 32 | 30.5 |
| 3 | 25 | 23.8 |
| 4 | 32 | 30.5 |
| MTX (n=35) | ||
| Foie | 23 | 65.7 |
| Ganglions lymphatiques | 5 | 14.3 |
| Péritoine | 3 | 8.6 |
| Autres | 4 | 11.4 |
| Lieu: Tête de tumeur | ||
| Oui | 89 | 81.7 |
| Lieu: Tumeur Tail | ||
| Oui | 7 | 6.4 |
| Lieu: Corps tumoral | ||
| Oui | 25 | 22.9 |
| Total | 112 | 100.0 |
#DPT: Duodénopancréatectomie
IMMUNOSTAINING CD133 DANS LES CELLULES SOUCHES CANCÉREUSES DANS LES CELLULES ADÉNOCARCINOMES DUCTALES PANCRÉATIQUES
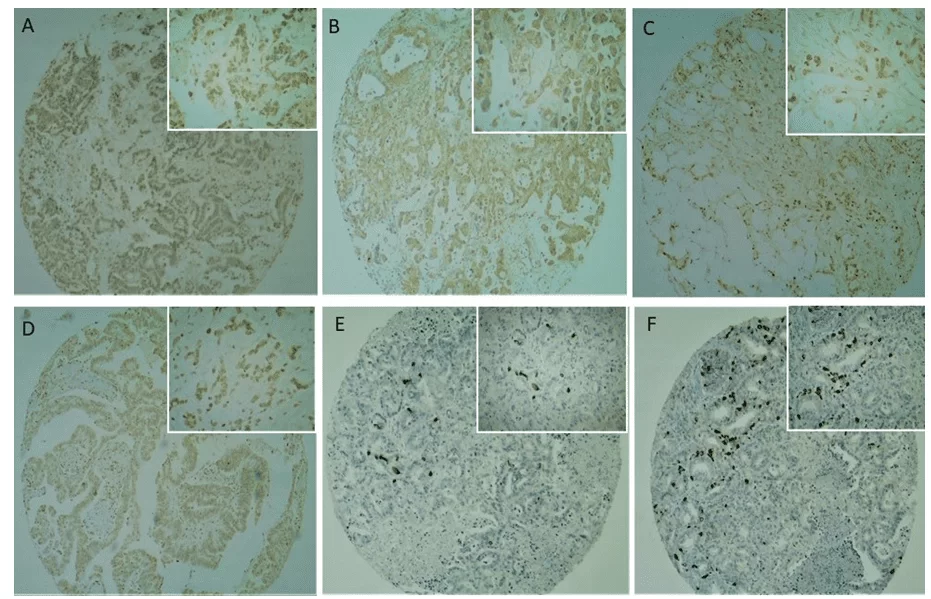
L’immunostaining CD133 était présent dans la membrane plasmatique et le cytoplasme à intensité modérée à forte (figures 2C et 2D), avec une intensité principalement forte. Une réaction positive ou négative a été confirmée avec le contrôle positif (placenta) utilisé dans l’étude. Aucune immunoréactivité CD133 n’a été observée dans l’épithélium canalaire pancréatique normal (figure 2).
Fig. 2. Analyse immunohistochimique des marqueurs de cellules souches cancéreuses dans des échantillons de cancer du pancréas TMA. (2A, 2B) L’expression de CD24 a été observée principalement dans le cytoplasme des cellules tumorales. (2C, 2D) L’expression de CD133 a été observée principalement dans la membrane et le cytoplasme des cellules tumorales, rarement nucléaires. (2E, 2F) L’expression d’OCT4 a été observée dans le nucléo des cellules tumorales, avec une expression focale et une forte intensité. Le champ de grossissement le plus bas (40x) est représenté dans le panneau global et le champ de grossissement le plus élevé (100x) dans le panneau réduit.
En ce qui concerne le traitement chirurgical, 95,1% des patients subissant le traitement 1 (shunt bileodigestive) étaient CD133-positifs, 70.0% des patients subissant le traitement 2 (chirurgie partielle) étaient CD133-positif, et 81.2% des patients subissant le traitement 3 (duodenopancreatectomy total) étaient CD133-positifs. Il y avait une association significative (P = 0,019) entre le traitement chirurgical et le signal de CD133. En plus du traitement chirurgical, seul le type d’échantillon a été significativement associé au signal de CD133, à un niveau d’importance de 5%.
Le degré de différenciation de tumeur (bon, modéré, ou pauvre) n’a montré aucune association significative avec l’immunostaining positif de CD133, bien qu’il ait été observé qu’au fur et à mesure que le grade de tumeur progressait, l’intensité de coloration a augmenté (83,7% dans les tumeurs mal différenciées). Il n’y avait pas non plus d’association significative entre la mise en scène du TNM et l’immunostaining positif du CD133, mais à des stades ultérieurs, l’étiquetage s’intensifie, même si la présence de CSC dès les premiers stades est observée ici. Ceci corrobore l’hypothèse que les CSC sont présents depuis le début du processus de carcinogenèse.
Le tableau 2 montre l’analyse descriptive des variables ainsi que la vérification de leur association avec l’immunoréactivité CD133 , donnée par le test exact de Fisher.
Tableau 2. Association de variables avec CD133 positif.
| IHC CD133 positif | valeur p* | ||||
| non | Oui | ||||
| ¡n | % | ¡n | % | ||
| Sexe | 1,000 | ||||
| Femelle | 8 | 15.1 | 45 | 84.9 | |
| Mâle | 9 | 15.5 | 49 | 84.5 | |
| Âge | 1,000 | ||||
| 35-59 ans | 6 | 16.2 | 31 | 83.8 | |
| 60-69 ans | 6 | 15.0 | 34 | 85.0 | |
| 70-93 ans | 5 | 14.7 | 29 | 85.3 | |
| Décès (n=106) | 0,192 | ||||
| non | 6 | 11.1 | 48 | 88.9 | |
| Oui | 11 | 21.1 | 41 | 78.9 | |
| Traitement chirurgical (n=109) | 0,019 | ||||
| Palliatifs | 2 | 4.9 | 39 | 95.1 | |
| Chirurgie partielle | 6 | 30.0 | 14 | 70.0 | |
| DPT# | 9 | 18.7 | 39 | 81.3 | |
| Traitement palliatif (n= 91) | 0,474 | ||||
| non | 4 | 18.2 | 18 | 81.8 | |
| Oui | 8 | 11.6 | 61 | 88.4 | |
| Degré de différenciation (n=107) | 0,084 | ||||
| Bien différencié | 2 | 66.7 | 1 | 33.3 | |
| Modéré différencié | 9 | 13.4 | 58 | 86.6 | |
| Pauvre différencié | 6 | 16.2 | 31 | 83.8 | |
| Spécimen/échantillon (n=107) | 0,028 | ||||
| Métastase | 7 | 29.2 | 17 | 70.9 | |
| Pancréas | 9 | 10.9 | 74 | 89.2 | |
| Étape T (n=109) | 0,587 | ||||
| T1 | 3 | 25.0 | 9 | 75.0 | |
| T2 | 5 | 12.5 | 35 | 87.5 | |
| T3 | 4 | 19.0 | 17 | 81.0 | |
| T4 | 2 | 8.0 | 23 | 92.0 | |
| Tx | 2 | 18.2 | 9 | 81.8 | |
| Étape N (n=109) | 0,830 | ||||
| N0 | 4 | 11.4 | 31 | 88.6 | |
| N1 | 6 | 17.6 | 28 | 82.4 | |
| N2 | 1 | 16.7 | 5 | 83.3 | |
| Nx | 5 | 14.7 | 29 | 85.3 | |
| Étape M (n=106) | 0,132 | ||||
| M0 | 8 | 11.3 | 63 | 88.7 | |
| M1 | 9 | 25.7 | 26 | 74.3 | |
| Mx | 0 | – | 5 | 100.0 | |
| Étape générale (n=107) | 0,133 | ||||
| 1 | 2 | 12.5 | 14 | 87.5 | |
| 2 | 5 | 15.6 | 27 | 84.4 | |
| 3 | 1 | 4.0 | 24 | 96.0 | |
| 4 | 9 | 26.5 | 25 | 73.5 | |
| MTX (n=34) | 0,645 | ||||
| Foie | 7 | 30.4 | 16 | 69.6 | |
| Ganglions lymphatiques | 3 | 60.0 | 2 | 40.0 | |
| Péritoine | 1 | 25.0 | 3 | 75.0 | |
| Autres | 1 | 20.0 | 4 | 80.0 | |
| Lieu: Tête de tumeur | 0,186 | ||||
| Oui | 12 | 13.2 | 79 | 86.8 | |
| Lieu: Tumeur Tail | 0,071 | ||||
| Oui | 3 | 42.9 | 4 | 57.1 | |
| Lieu: Corps tumoral | 1,000 | ||||
| Oui | 4 | 16.0 | 21 | 84.0 | |
*Test exact de Fisher
#DPT: Duodénopancréatectomie
Le tableau 3 montre les valeurs p et les associations de variables avec intensité lorsque la coloration du CD133 était positive. Selon le test exact de Fisher (P = 0 036), seul le stade M a montré une association significative avec l’intensité du CD133; c’est-à-dire que les tumeurs qui ont déjà métastasé sont fortement tachées pour CD133.
Tableau 3. P-valeurs d’association avec l’intensité.
| Variables | Groupes |
valeur p* | ||
| IHC CD133 –
Intensité lorsqu’elle est positive |
IHC CD24 –
Intensité lorsqu’elle est positive |
IHC OCT4 –
Intensité lorsqu’elle est positive |
||
| Sexe |
Femelle | 0,222 | 0,438 | 0,619 |
| Mâle | ||||
| Mort | non | 1,000 | 0,235 | 0,627 |
| Oui | ||||
| Traitement chirurgical |
Palliatifs | 0,815 | 0,732 | 0,620 |
| Cir. Partielle | ||||
| Dpt # | ||||
| Traitement palliatif | non | 0,136 | 0,027 | 0,619 |
| Oui | ||||
| Degré de différenciation | Bien différencié | 0,266 | 0,442 | 0,407 |
| Modéré différencié | ||||
| Pauvre différencié | ||||
| Spécimen/Échantillon | Métastase | 0,848 | 0,201 | 0,488 |
| Pancréas | ||||
| Étape T | T1 | 0,611 | 0,992 | 1,000 |
| T2 | ||||
| T3 | ||||
| T4 | ||||
| Tx | ||||
| Étape N | N0 | 0,560 | 0,920 | 0,180 |
| N1 | ||||
| N2 | ||||
| Nx | ||||
| Étape M | M0 | 0,036 | 0,350 | 0,078 |
| M1 | ||||
| Mx | ||||
| Scène générale |
1 | 0,337 | 0,380 | 0,218 |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| MTX | Foie | 0,094 | 0,037 | 1,000 |
| Péritoine | ||||
| Ganglions lymphatiques | ||||
| Autres | ||||
*Test exact de Fisher
#DPT: Duodénopancréatectomie
IMMUNOSTAINING CD24 DANS LES CELLULES SOUCHES CANCÉREUSES DANS LES CELLULES ADÉNOCARCINOME DUCTALE PANCRÉATIQUES
L’immunostaining cd24 (figures 2A et 2B) était présent dans la membrane plasmatique et le cytoplasme à la fois faible/modérée (41,6 %) et fort (58,3%) intensités, mais à une intensité plus faible par rapport au CD133 (figures 2C et 2D). Les réactions positives et négatives ont été confirmées avec le contrôle positif (placenta) employé dans l’étude. Le tableau 4 montre l’analyse descriptive des variables ainsi que la vérification de leur association avec la positivité du CD24, donnée par le critère exact de Fisher. Un signal positif de CD24 a été vu dans 98,3% des mâles, mais il n’y avait aucune association entre le sexe et la positivité de CD24 (P = 0,343). Seul le type d’échantillon prélevé et le traitement palliatif ont été significativement associés au signal CD24, à un niveau d’importance de 5 % (P = 0 010 et 0 042 respectivement).
Tableau 4. Association de variables avec CD24 positif.
| IHC CD24 positif | valeur p* | ||||
| non | Oui | ||||
| ¡n | % | ¡n | % | ||
| Sexe | 0,343 | ||||
| Femelle | 3 | 5.7 | 50 | 94.3 | |
| Mâle | 1 | 1.7 | 58 | 98.3 | |
| Âge | 0,159 | ||||
| 35-59 ans | 3 | 8.1 | 34 | 91.9 | |
| 60-69 ans | 0 | – | 40 | 100.0 | |
| 70-93 ans | 1 | 2.9 | 34 | 97.1 | |
| Décès (n=107) | 0,618 | ||||
| non | 3 | 5.4 | 52 | 94.6 | |
| Oui | 1 | 1.9 | 51 | 98.1 | |
| Traitement chirurgical (n=110) | 0,399 | ||||
| Palliatifs | 3 | 7.1 | 39 | 92.9 | |
| Chirurgie partielle | 0 | – | 20 | 100.0 | |
| DPT# | 1 | 2.1 | 47 | 97.9 | |
| Traitement palliatif (n=91) | 0,042 | ||||
| non | 3 | 13.6 | 19 | 86.4 | |
| Oui | 1 | 1.4 | 68 | 98.6 | |
| Degré de différenciation (n=108) | 1,000 | ||||
| Bien différencié | 0 | – | 3 | 100.0 | |
| Modéré différencié | 3 | 4.4 | 65 | 95.6 | |
| Pauvre différencié | 1 | 2.7 | 36 | 97.3 | |
| Spécimen/échantillon (n=108) | 0,010 | ||||
| Métastase | 1 | 4.0 | 23 | 95.9 | |
| Pancréas | 2 | 2.4 | 82 | 97.6 | |
| Étape T (n=110) | 0,705 | ||||
| T1 | 0 | – | 12 | 100.0 | |
| T2 | 1 | 2.4 | 40 | 97.6 | |
| T3 | 1 | 4.8 | 20 | 95.2 | |
| T4 | 1 | 4.0 | 24 | 96.0 | |
| Tx | 1 | 9.1 | 10 | 90.9 | |
| Étape N (n=110) | 0,881 | ||||
| N0 | 1 | 2.9 | 34 | 97.1 | |
| N1 | 2 | 5.9 | 32 | 94.1 | |
| N2 | 0 | – | 7 | 100.0 | |
| Nx | 1 | 2.9 | 33 | 97.1 | |
| Étape M | 1,000 | ||||
| M0 | 3 | 4.2 | 69 | 95.8 | |
| M1 | 1 | 2.9 | 34 | 97.1 | |
| Mx | 0 | – | 5 | 100.0 | |
| Étape générale (n=108) | 0,913 | ||||
| 1 | 1 | 6.2 | 15 | 93.8 | |
| 2 | 1 | 3.1 | 31 | 96.9 | |
| 3 | 1 | 3.8 | 25 | 96.2 | |
| 4 | 1 | 2.9 | 33 | 97.1 | |
| MTX (n=37) | 1,000 | ||||
| Foie | 1 | 4.3 | 22 | 95.7 | |
| Ganglions lymphatiques | 0 | – | 5 | 100.0 | |
| Péritoine | 0 | – | 4 | 100.0 | |
| Autres | 0 | – | 5 | 100.0 | |
| Lieu: Tête de tumeur | 0,550 | ||||
| Oui | 3 | 3.3 | 89 | 96.7 | |
| Lieu: Tumeur Tail | 1,000 | ||||
| Oui | 0 | – | 7 | 100.0 | |
| Lieu: Corps tumoral | 1,000 | ||||
| Oui | 1 | 4.0 | 24 | 96.0 | |
*Test exact de Fisher
#DPT: Duodénopancréatectomie
Aucune immunoréactivité CD24 n’a été observée dans l’épithélium ductal pancréatique normal. Un signal positif de CD24 a été vu dans 98,6% des patients subissant le traitement palliatif, qui était significatif (P = 0,042). En raison de leur mise en scène avancée de tumeur, ils ont eu un signal de CD24 plus fort comparé aux individus qui ont subi le duodenopancreatectomy total. Le signal CD24 était plus fort chez les personnes qui ont subi un traitement palliatif en tant qu’option de traitement (98,6 %) comparativement à ceux qui ne l’ont pas fait (13,6 %).
Le degré de différenciation et de mise en scène de tumeur n’a montré aucune association significative avec la coloration CD24-positive, ni il n’y avait des différences significatives entre les tumeurs mal différenciées ou avancées comparées aux tumeurs bien différenciées et tôt-étape en ce qui concerne le CD24 positif.
Le tableau 3 montre l’association des variables avec l’intensité lorsque le CD24 était positif. Seule la présence de métastases (MTX) a été significativement associée à l’intensité, où le foie et le péritoine ont montré une forte positivité par rapport à la métastase dans d’autres emplacements, tels que les ganglions lymphatiques et d’autres tissus.
IMMUNOSTAINING OCT4 DANS LES CELLULES SOUCHES CANCÉREUSES DANS LES CELLULES ADÉNOCARCINOME DUCTALE PANCRÉATIQUES
L’immunostaining d’OCT4 a montré un modèle différent par rapport aux autres anticorps testés. La fréquence des cas positifs n’était pas aussi élevée qu’observée avec les deux autres anticorps testés, mais lorsqu’elle était positive, son intensité était très forte (figures 1E et 1F). Immunostaining s’est produit dans le noyau de cellules tumorales dans 31,5% des cas et n’a pas tache 68,7% des tumeurs analysées. Aucune immunoréactivité d’OCT4 n’a été observée dans l’épithélium ductal pancréatique normal. Aucune variable n’a été significativement associée au signal OCT4, à un niveau d’importance de 5 %. L’âge moyen du groupe oct4-positif était de 62,62 ans, et de 63,23 ans dans le groupe oct4 négatif. Cependant, il n’y avait pas de différence significative entre les groupes en ce qui concerne l’âge (P = 0,547).
Bien qu’elle ne soit pas statistiquement significative, une conclusion intéressante de l’analyse de coloration d’OCT4 est que plus la tumeur différenciée, plus l’intensité de coloration est grande, tandis que les tumeurs mal différenciées ont eu une faible intensité de coloration (66,6% contre 21,6%). Les cellules positives pour les OCT4 ont un plus grand potentiel de différenciation.
ANALYSE DE SURVIE
En ce qui concerne les courbes de survie et leur relation avec les trois marqueurs, tous les groupes ont présenté des courbes très semblables, de sorte que le test de log-rank n’indique aucune différence significative entre les courbes en ce qui concerne les signaux positifs des trois anticorps. Les courbes Kaplan-Meier pour l’intensité CD133, CD24 et OCT4, confirmées par les valeurs p-d’essai de log-rank, aucune des courbes de survie ne diffère significativement en ce qui concerne l’intensité. Par conséquent, la positivité des marqueurs ne modifie pas la survie des patients inclus dans l’étude.
DISCUSSION
Les CSCs ont récemment été associés à la progression du cancer et utilisés pour identifier les facteurs pronostiques et les cibles de thérapie dans plusieurs types de cancer (DEAN et al., 2005). Il est à noter que le rôle des CSCs n’est pas bien compris ou caractérisé dans le cancer du pancréas. De plus, peu de rapports ont été publiés sur les tendances et les effets de la présence des CSCs. Considérant ce manque de données, nous avons rétrospectivement analysé l’expression des CSCs dans des échantillons de cancer pancréatique utilisant l’immunohistochimie et vérifié son rôle dans la progression de tumeur et la résistance thérapeutique dans l’adénocarcinome pancréatique ductal.
La biologie moléculaire du cancer du pancréas est directement liée à sa progression rapide et à sa faible réponse thérapeutique. Il est bien documenté que l’apparition d’une cellule tumorale est le résultat d’une accumulation de mutations dans son ADN capable de la modifier morphologiquement et fonctionnellement (FANG et al., 2013; RICCI-VITIANI et al., 2007). Le déclencheur de ce processus et de toute son évolution, culminant dans la formation de la cellule tumorale et de ses caractéristiques pertinentes, caractérisent le processus de carcinogenèse, est déjà significativement élucidé pour plusieurs types de néoplasies. Cependant, pour certains types de cancer tels que le cancer du pancréas, le processus reste incertain (KOBAYASHI; NORONHA, 2015).
La plupart des tumeurs malignes suivent une histoire naturelle qui peut être divisée en quatre étapes : transformation maligne, croissance de cellules tumorales, invasion locale, et métastase. Le processus de carcinogenèse, ou transformation maligne, se produit à divers stades et résultats dus à l’accumulation de changements génétiques et de mutations, qui sont déclenchés par plusieurs facteurs, y compris des facteurs environnementaux tels que le rayonnement et les produits chimiques (AYOB; RAMASAMY, 2018). Cependant, pour que ce processus de carcinogenèse progresse, il peut être nécessaire d’avoir certaines cellules avec les caractéristiques des cellules souches, telles que le potentiel d’auto-renouvellement et de régénération, ainsi qu’un indice prolifératif élevé.
Des preuves récentes suggèrent que les cellules souches jouent un rôle crucial non seulement dans la production et l’entretien de différents tissus, mais aussi dans le développement et la progression de certains types de tumeurs (BALIC et al., 2012). Pour plusieurs tumeurs solides, il a été démontré qu’elles abritent une sous-population distincte de cellules tumorales qui ont des caractéristiques de cellules souches et sont donc appelées cellules souches tumorales (CT) ou cellules tumorigènes (MATSUDA et al., 2012). Les cellules souches cancéreuses semblent être en mesure d’initier et de stimuler la croissance tumorale dans les tumeurs solides. Les CD133, CD24 et OCT4 sont récemment signalés marqueurs potentiels pour les CSC, exprimés dans une variété de tumeurs; cependant, à notre connaissance, aucune tentative n’a été faite pour détecter leur expression dans les spécimens de cancer du pancréas (MAEDA et al., 2008).
On peut observer que les cellules souches tumorales, ou marqueurs de surface de cellules souches tumorales tels que CD133, CD24, et OCT4 sont présents dans les cellules tumorales cancéreuses pancréatiques, confirmant la relation intrinsèque entre le phénotype malin pancréatique et la présence de cellules souches. Aucune différence significative n’a été observée entre l’expression d’anticorps et le degré de différenciation de tumeur, supposant que les cellules souches de tumeur ont été présentes depuis l’initiation de tumeur. Il convient de noter que pour les anticorps CD133 et CD24, le pourcentage de cellules tumorales exprimant des marqueurs a augmenté au fur et à mesure que la tumeur progressait. Par conséquent, les tumeurs plus agressives et mal différenciées ont montré une plus grande positivité pour la présence de l’anticorps. Tandis que d’autre part, l’expression de l’anticorps d’OCT4 était plus élevée et plus intense dans les tumeurs bien différenciées ; ainsi, plus la tumeur différenciait, plus l’étiquetage était grand. Les cellules qui ont le marqueur de cellules souches de l’anticorps OCT4 ont un potentiel de différenciation plus élevé (VILLODRE et al., 2016). C’est peut-être la raison pour laquelle les OCT4 différaient en termes d’expression des autres marqueurs testés, bien que ces différences n’aient pas été statistiquement significatives.
Le marqueur d’OCT4 n’est présent que dans les échantillons de tumeurs qui étaient positifs. Cette découverte est en accord avec la théorie selon laquelle les CSC ne représentent qu’une très petite partie de la population totale de cellules tumorales (PHI et al., 2018). Par exemple, des cellules positives cd133 ont été détectées dans 0,7-6,1 % (RICCI-VITIANI et al., 2007), 1.8-24.5% (O’BRIEN et al., 2007) des cellules cancéreuses primaires du côlon, et dans 0,7-3,2 % des cellules cancéreuses pancréatiques primaires utilisant l’analyse cytométrique du flux (HERMANN et al., 2007). La coloration immunohistochimique a révélé l’expression de CD133 dans 1-3% des spécimens de carcinome hépatocellulaire (MA et al., 2007).
Bien que l’étiquetage et l’expression aient été observés avec une fréquence relativement élevée dans tous les degrés de direction de tumeur, par exemple, les tumeurs ont exprimé l’étiquetage pour des cellules souches cancéreuses indépendamment du degré de différenciation, quelques résultats favorisent l’hypothèse que le nombre de cellules souches dans les tumeurs est plus grand dans les tumeurs avec le comportement plus agressif et avec le pronostic plus mauvais. Cette hypothèse est étayée par le fait que le CD133 s’exprimait plus fréquemment chez les personnes qui n’ont subi que des traitements palliatifs (95,1 %) avec une association significative (p-valeur < 0,05) entre la présence d’anticorps et le traitement palliatif. Quand il est rapporté qu’un patient a subi seulement le traitement palliatif, on suppose que la tumeur était à un stade sensiblement avancé et sans possibilité d’intervention chirurgicale curative et donc seulement le traitement palliatif a été exécuté. De même, on peut surestimer que les tumeurs les plus agressives aux stades ultérieurs expriment une plus grande étiquetage pour l’anticorps de cellules souches tumorales CD133. Plusieurs études cliniques ont étudié la relation entre l’expression de CD133 et les résultats cliniques des tumeurs ; cependant, les résultats sont controversés. Par exemple, l’expression du CD133 est liée au mauvais pronostic du cancer du côlon et de l’hépatocarcinome (CAI et al., 2018).
En ce qui concerne l’étape du TNM, l’étiquetage des trois anticorps (CD133, CD24 et OCT4) n’a pas changé le long de la progression. Il est à noter que les cellules souches tumorales étaient présentes dès le stade le plus précoce et qu’elles ne s’agrandissent pas pendant la mise en scène. La prévalence des trois anticorps et de leurs associations avec les variables était généralement élevée, bien que tous les anticorps n’aient pas un niveau d’importance inférieur à P < 0,05.
Toutes les variables qui ont contribué à un pronostic défavorable, tels que l’emplacement de la tumeur pancréatique de tête, l’âge avancé, et la présence des métastases ont toutes été associées à la prédominance élevée particulièrement pour l’expression de CD133 et CD24. En outre, ceci a corroboré avec l’idée que les cellules souches de tumeur lorsqu’elles sont présentes sont associées à la progression rapide de tumeur et à la résistance thérapeutique. Les cellules souches cancéreuses ont certaines caractéristiques semblables à celles des cellules souches normales de l’organisme, telles que la capacité de s’auto-régénérer et la pluripotence, donnant lieu à des lignées de cellules tumorales hétérogènes qui forment la même tumeur (TAI et al., 2005). Les cellules souches cancéreuses sont susceptibles de partager bon nombre des propriétés des cellules souches normales qui assurent une longue durée de vie, y compris la quiescence relative, la résistance aux médicaments et aux toxines par l’expression de plusieurs transporteurs, une capacité active de réparation de l’ADN et une résistance à l’apoptose. Par conséquent, les tumeurs pourraient avoir une population intégrée de cellules pluripotentes pharmacorésistantes qui peuvent survivre à la chimiothérapie et repeupler la tumeur (MARQUES et al., 2010).
Afin de définir si les CSC prédisaient les résultats cliniques, nous avons effectué l’analyse de survie de Kaplan-Meier et avons montré que les groupes présentaient des courbes très semblables. Par conséquent, le test de log-rank n’indique pas de différence significative entre les courbes en ce qui concerne la présence des trois anticorps. Bien qu’ils soient associés à de pires variables pronostiques telles que la métastase et les options thérapeutiques de traitement palliatif, aucune association ne peut être faite entre la présence des cellules souches de tumeur et la survie de patient dans ce cas ; par conséquent, la présence de CSC ne prévoit pas une survie pire.
La découverte de cellules souches cancéreuses dans des tumeurs solides a changé notre vision de la carcinogenèse. Que les cellules souches tumorales sont impliquées dans le développement et la progression de la tumeur est un fait, puisque leur présence était significative dans la grande majorité des tissus analysés et, récemment, de nombreuses études ont associé la présence de cellules souches tumorales avec le développement de plusieurs types de cancer.
CONSIDÉRATIONS FINALES
Le processus de tumorigenèse, dans la mesure où le sujet est connu jusqu’à présent, implique l’acquisition progressive de multiples mutations aberrantes qui culminent dans l’expansion et la prolifération de sous-populations cellulaires plus agressives, contribuant à la progression et la croissance tumorale. Bien que cette théorie soit bien établie, l’identification des cellules qui sont capables de causer la progression de tumeur fait toujours l’objet de nombreuses études pour mieux caractériser le processus de carcinogenèse et identifier ces cellules.
Une grande partie de l’information que nous obtenons et utilisons pour le diagnostic, le pronostic, et le traitement des néoplasmes pancréatiques dérive de populations hétérogènes avec des degrés variables de maturation et de différenciation. Il devient de plus en plus urgent de caractériser les CSC pour l’évaluation et la caractérisation de la voie cancérigène des tumeurs les plus agressives. La conséquence directe est l’élaboration de stratégies thérapeutiques qui peuvent agir sur les CSC et la possibilité de déterminer, par une méthode facilement accessible, quels patients bénéficieront le plus de ce type de traitement.
RÉFÉRENCES
ALLEGRA, E.; TRAPASSO, S. Cancer stem cells in head and neck cancer. Onco Targets Ther., v.5, p.375-83, 2012.
ANSARI, D.; CHEN, B.C.; DONG, L.; ZHOU, M.T.; ANDERSSON, R. Pancreatic cancer: translational research aspects and clinical implications. World J Gastroenterol., v.18, n.13, p.1417-24, 2012.
AYOB, A.Z.; RAMASAMY, T.S. Cancer stem cells as key drivers of tumour progression. J Biomed Sci., v.25, n.20, 2018.
BALIC, A.; DORADO, J.; ALONSO-GÓMEZ, M.; HEESCHEN, C. Stem cells as the root of pancreatic ductal adenocarcinoma. Exp Cell Res., v.318, n.6, p.691-704, 2012.
BARBOSA, I.R.; SANTOS, C.A.; SOUZA, D.L.B. Pancreatic cancer in Brazil: mortality trends and projections until 2029. Arq. Gastroenterol., v.55, n.3, p.230-6, 2018.
CAI, X.; LI, J.; YUAN, X.; XIAO, J.; DOOLEY, S.; WAN, X., WHENG, W.; LU, L. CD133 expression in cancer cells predicts poor prognosis of non-mucin producing intrahepatic cholangiocarcinoma. J Transl Med., v.16, n.50, 2018.
DEAN, M.; FOJO, T.; BATES, S. Tumour stem cells and drug resistance. Nat Rev Cancer., v.5, n.4, p.275-84, 2005.
FANG, Y.; YAO, Q.; CHEN, Z.; XIANG, J.; WILLIAM, F.E.; GIBBS, R.A.; CHEN, C. Genetic and molecular alterations in pancreatic cancer: implications for personalized medicine. Med Sci Monit., v.19, p.916-26, 2013.
HERMANN, P.C.; HUBER, S.L.; HERRLER, T.; AICHER, A.; ELLWART, J.W.; GUBA, M.; BRUNS, C.J.; HEESCHEN, C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell., v.1, n.3, p.313-23, 2007.
HU, Y.; FU, L. Targeting cancer stem cells: a new therapy to cure cancer patients. Am J Cancer Res., v.2, n.3, p.340-56, 2012.
KOBAYASHI, N.C.C.; NORONHA, S.M.R. Cancer stem cells: a new approach to tumor development. Rev Assoc Med Bras., v.61, n.1, p.86-93, 2015.
KONONEN, J.; BUBENDORF, L.; KALLIONIMENI, A.; BÄRLUND, M.; SCHRAML, P.; LEIGHTON, S.; TORHORST, J.; MIHATSCH, M.J.; SAUTER, G.; KALLIONIMENI, O.P. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med., v.4, n.7, p.844-7, 1998.
LI, D.; JIAO, L. Molecular epidemiology of pancreatic cancer. Int J Gastrointest Cancer., v.33, n.1, p.3-14, 2003.
MA, S.; CHAN, K.W.; HU, L.; LEE, T.K.W.; WO, J.Y.H.; NG, I.O.L.; ZHENG, B.J.; GUAN, X.Y. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, v.132, n.7, p.2542-56, 2007.
MAEDA, S.; SHINCHI, H.; KURAHARA, H.; MATAKI, Y.; MAEMURA, K.; SATO, M.; NATSUGOE, S.; AIKOU, T.; TAKAO, S. CD133 expression is correlated with lymph node metastasis and vascular endothelial growth factor-C expression in pancreatic cancer. Br J Cancer., v.98, n.8, p.1389-97, 2008.
MARQUES, D.S.; SANDRINI, J.Z.; BOYLE, R.T.; MARINS, L.F.; TRINDADE, G.S. Relationships between multidrug resistance (MDR) and stem cell markers in human chronic myeloid leukemia cell lines. Leuk Res., v.34, n.6, p.757-62, 2010.
MATSUDA, Y.; KURE, S.; ISHIWATA, T. Nestin and other putative cancer steam cell markers in pancreatic cancer. Med Mol Morphol., v.45, n.2, p.59-65, 2012.
O’BRIEN, C.A.; POLLETT, A.; GALLINGER, S.; DICK, J.E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature, v.445, n.7123, p.106-10, 2007.
PHI, L.T.H.; SARI, I.N.; YANG, Y.G.; LEE, S.H.; JUN, N.; KIM, K.S.; LEE, Y.K.; KWON, H.Y. Cancer Stem Cells (CSCs) in Drug Resistance and their Therapeutic Implications in Cancer Treatment. Stem Cells Int., n.5416923, 2018.
RICCI-VITIANI, L.; LOMBARDI, D.G.; PILOZZI, E.; BIFFONI, M.; TODARO, M.; PESCHLE, C.; DE MARIA, R. Identification and expansion of human colon-cancer-initiating cells. Nature, v.445, p.111-5, 2007.
SAKORAFAS, G.H.; TSIOTOU, A.G.; TSIOTOS, G.G. Molecular biology of pancreatic cancer; oncogenes, tumor suppressor genes, growth factors, and their receptors from a clinical perspective. Cancer Treat Rev., v.26, n.1, p.29-52, 2000.
SOTO, J.L.; BARBERA, V.M.; SACEDA, M.; CARRATO, A. Molecular biology of exocrine pancreatic cancer. Clin Transl Oncol., v.8, p.306-12, 2006.
TAI, M.H.; CHANG, C.C.; OLSON, L.K.; TROSKO, J.E. Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis. Carcinogenesis, v.26, n.2, p.495-502, 2005.
VILLODRE, E.S.; KIPPER, F.C.; PEREIRA, M.B.; LENZ, G. Roles of OCT4 in tumorigenesis, cancer therapy resistance and prognosis. Cancer Treat Rev., v.51, p.1-9, 2016.
Maît[1]rise en sciences médicales, Programme de troisième cycle en médecine : Sciences médicales, Université fédérale de Rio Grande do Sul (RFRGS), Brésil.
[2] Doctorat en sciences physiologiques, Université fédérale de Rio Grande (FURG), Brésil.
[3] MSc en génétique et biologie moléculaire, Université fédérale de Rio Grande do Sul (RFRGS), Brésil.
[4] Étudiant en médecine de premier cycle à l’Université fédérale de Rio Grande (FURG), Brésil.
[5] Doctorat en sciences biologiques (biochimie) à l’Université fédérale de Rio Grande do Sul (URBGS), avec doctorat en neurosciences – University of California Irvine.
Soumis : septembre 2020.
Approuvé : octobre 2020.