ARTÍCULO ORIGINAL
RODRIGUES, Camila Juliano Salvador [1], SILVEIRA, Elita Ferreira da [2], VARGAS, Rafael da Silveira [3], GIACOMO, Giordano Gatti de [4], BIANCHIN, Marino Muxfeldt [5]
RODRIGUES, Camila Juliano Salvador. Et al. Marcadores de células madre cancerosas asociados con el desarrollo y fenotipo agresivo en el cáncer de páncreas. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 05, Ed. 10, Vol. 12, págs. 102-122. Octubre de 2020. ISSN:2448-0959, Enlace de acceso en: https://www.nucleodoconhecimento.com.br/salud/cancer
RESUMEN
Antecedentes: Se sugiere que las células madre cancerosas, también conocidas como células que inician tumores, son responsables de la resistencia a los medicamentos y el desarrollo del cáncer debido en parte a su capacidad de auto-renovarse y diferenciarse en linajes heterogéneos de las células cancerosas. Objetivo: Este estudio fue diseñado para investigar el papel de las células madre cancerosas en el cáncer de páncreas. Métodos: Se realizó un análisis clínicopatológico retrospectivo en 112 pacientes diagnosticados con adenocarcinoma ductal pancreático entre 2005 y 2010, y se realizó inmunohistoquímica con anticuerpos contra CD133, CD24 y OCT4. La tinción nuclear, citoplasmática o de membrana positiva para cada anticuerpo se calificó en la intensidad de la tinción, siendo clasificada en grupos de tinción bajos/moderados o fuertes. Los resultados se analizaron en relación con los parámetros clínicapatológicos de cada paciente. Resultados: Hubo una relación establecida entre la tinción de los marcadores con algunas variables asociadas con peor pronóstico, siendo los tres marcadores presentes en la mayoría de las células tumorales y asociados con la progresión tumoral. Suponemos que las células madre cancerosas están presentes desde el comienzo de la iniciación tumoral y están intrínsecamente relacionadas con el desarrollo tumoral. Aunque la presencia de células madre se ha asociado con la biología molecular de varios tumores, su expresión en el cáncer de páncreas aún no se ha divulgado clínicamente. Conclusión: La presencia de células madre y su papel en la tumorigenesis del cáncer de páncreas pueden considerarse como factores de pronóstico valiosos, aunque el mecanismo implicado necesita una investigación adicional. El aumento de la información sobre el papel de las células madre cancerosas y la carcinogénesis puede generar en última instancia nuevas ideas para enfoques diagnósticos y terapéuticos de base molecular.
Palabras clave: Células madre cancerosas, cáncer de páncreas, antígeno AC133, antígeno CD24, OCT4.
INTRODUCCIÓN
A pesar de los progresos en el diagnóstico y tratamiento del cáncer en las últimas décadas, sigue siendo una de las causas más comunes de muerte en todo el mundo. Si bien es potencialmente curable cuando se diagnostica a tiempo, el diagnóstico precoz sigue siendo un desafío en la práctica clínica diaria. Muchos tipos de cáncer se diagnostican en una etapa tardía, cuando las opciones terapéuticas ya no son efectivas (BARBOSA et al., 2018).
El adenocarcinoma ductal pancreático (PDAC) es una enfermedad altamente agresiva generalmente diagnosticada en una etapa avanzada y para la cual se dispone de pocas terapias eficaces. Es una neoplasia cuya incidencia es casi igual a su mortalidad. La razón por la que el cáncer de páncreas tiene un pronóstico tan pobre y por qué tiene una respuesta terapéutica tan baja a la quimioterapia y la radioterapia son preguntas que han motivado la búsqueda de una respuesta que pueda modificar el curso de esta enfermedad. A pesar de los avances en las técnicas quirúrgicas, que hoy en día se consideran la única opción curativa, la tasa de supervivencia promedio de 5 años es inferior al 5% (1-3%) (BARBOSA et al., 2018; SOTO et al., 2006). Se considera la neoplasia con el peor pronóstico de más de 60 tipos de cánceres, hecho evidenciado por su tasa de incidencia casi igualada a la tasa de mortalidad (SAKORAFAS et al., 2000). Cabe señalar que la detección temprana del cáncer, en una etapa que todavía se puede curar, se asocia con una mayor eficacia terapéutica y actualmente es una de las maneras de mejorar el resultado de los pacientes diagnosticados con cáncer de páncreas (ALLEGRA; TRAPASSO, 2012).
La biología molecular del cáncer de páncreas está directamente relacionada con su rápida progresión y baja respuesta terapéutica. Está bien documentado que la aparición de una célula tumoral es el resultado de una acumulación de mutaciones en su ADN capaces de alterar morfológica y funcionalmente sus propiedades normales (FANG et al., 2013; RICCI-VITIANI et al., 2007). La activación de este proceso y su evolución molecular, que culmina en la formación de la célula tumoral y sus características pertinentes, caracterizan el proceso de carcinogénesis. Es bien entendido en la literatura que el desarrollo de una neoplasia implica un conjunto de cambios moleculares que conducen no sólo a la aparición y supervivencia de una célula tumoral, sino a su capacidad para invadir tejidos adyacentes y formar metástasis distantes (LI; JIAO, 2003).
Entre los procesos implicados más recientemente en la carcinogénesis y la progresión tumoral, los cambios en las células madre cancerosas (CSC) todavía están mal estudiados en cáncer de páncreas sin resultados satisfactorios, y merecen mayores esfuerzos para esclarecer sus efectos y relación en la adquisición de un fenotipo maligno pancreático. La evidencia reciente ha sugerido que las CSC desempeñan un papel crucial no sólo en la generación y mantenimiento de diferentes tejidos, sino también en el desarrollo, progresión y resistencia terapéutica de diferentes tipos de tumores (BALIC et al., 2012).
Los CSCs pertenecen a un grupo diferenciado de células dentro de un tumor con propiedades autorrenuevantes y diferenciadoras, similares a las células madre normales, dando lugar a líneas celulares tumorales heterogéneas que forman un tumor. Pueden dividir y originar varias células que componen tumores, perpetuando así su crecimiento y ofreciendo resistencia a la quimioterapia por mecanismos aún no bien entendidos. Debido a esto, representan un objetivo importante de investigación (TAI, 2005).
La agresividad intrínseca del cáncer de páncreas, con su alta capacidad de invasión local, alto potencial metastásico, diagnóstico tardío y resistencia terapéutica, parece estar parcialmente relacionada con la población de CSC que componen estos tumores (HU; FU, 2012). Además, se ha demostrado que el PDAC contiene no sólo una población homogénea de CSC, sino diversas subpoblaciones que pueden estar involucradas en la progresión tumoral. Hasta ahora, las CSC pancreáticas identificadas constituyen una minoría de células de componentes tumorales (alrededor del 1-5%), y tienen una alta capacidad de auto-renovación (ANSARI et al., 2012). El aspecto clínico más importante, sin embargo, es que estas CSC son altamente resistentes a la quimioterapia y la radioterapia, lo que resulta en resistencia y rápida recurrencia de la enfermedad. Actualmente, uno de los grandes retos de la oncología es identificar y estudiar las características de estas CSC, especialmente en PDAC, en la que se han realizado pocos descubrimientos (KOBAYASHI; NORONHA, 2015).
MATERIALES Y MÉTODOS
SELECCIÓN DE CASOS Y MUESTRAS DE TUMORES
Las muestras de tejido fueron de una cohorte de 112 cánceres de páncreas consecutivos diagnosticados de 2005 a 2010, seleccionados de la atención rutinaria del Hospital de Clínicas de Porto Alegre (HCPA), por el Departamento de Patología y Grupo de Tracto Biliar y Páncreas. Los análisis inmunohistoquímicos se realizaron en bloques de tejido incrustados en parafina ya almacenados en el Departamento de Patología de HCPA, previa aprobación del Comité Científico y del Comité de Etica en Investigación Sanitaria de la institución. Se registraron las siguientes variables a partir de registros médicos: edad, sexo, grado tumoral, estado de los ganglios linfáticos, aparición de metástasis, tratamiento recibido (tipo de cirugía, radioterapia y quimioterapia), supervivencia libre de enfermedades y supervivencia general.
ANÁLISIS INMUNOHISTOQUÍMICO DE MICROARRAY DE TISSUE (TMA)
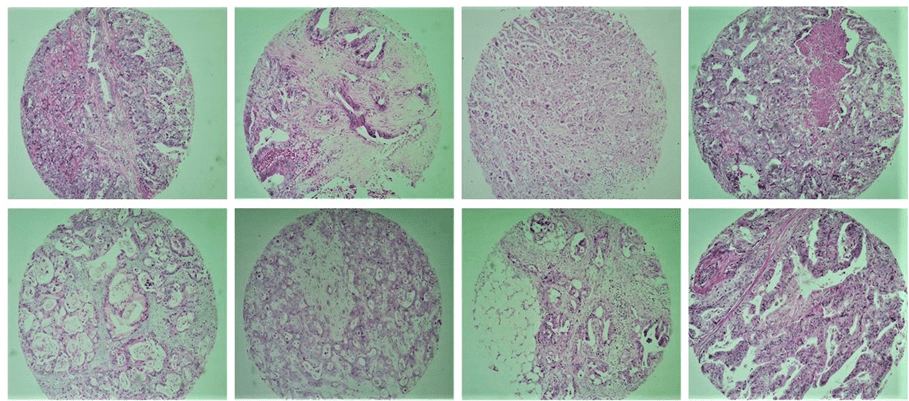
La matriz de microarray de tejido (TMA) es una técnica descrita por primera vez por Kononen et al. (1998) y es una gran herramienta para la patología de investigación. Se trata de agrupar en un solo bloque un número razonable de muestras de tejido, permitiendo así el estudio de la expresión inmunohistoquímica de marcadores moleculares, con gran uso del material, presencia de control interno, y tiempo y rentabilidad. Esta técnica también permite la estandarización de reacciones, la representatividad eficiente a través del uso de diferentes áreas del tumor, el estudio de un gran número de muestras simultáneamente, la facilidad de interpretación y la investigación a gran escala de factores de pronóstico o predictivos del cáncer (Figura 1).
1. Ejemplifica algunas muestras de tejido tumoral incluidas en el estudio mediante la técnica TMA
ANÁLISIS ESTADÍSTICO
Para verificar la asociación entre las variables inmunohistoquímicas y la intensidad de la inmunoreacción con las variables de caracterización de los individuos, se utilizó un enfoque no paramétrico con la prueba exacta de Fisher. Para verificar la asociación de la edad numérica variable con variables inmunohistoquímicas e intensidad, se utilizó la prueba Mann-Whitney U.
La asociación entre los marcadores de células madre y las diferentes características clínicas de los pacientes se evaluó [incluida la edad, el sexo, la diferenciación tumoral, el estadio, la categoría Tumor-Nodo-Metástasis (TNM) y la resección del tumor] mediante el coeficiente de correlación de Pearson o las pruebas χ2, según corresponda. Para la intensidad, las categorías se dicotomizaron en intensidad baja/moderada (0-2+) o de alta intensidad (≥3+).
El método Kaplan-Meier se utilizó para estimar la probabilidad de supervivencia. Las curvas de supervivencia se compararon utilizando la prueba log-rank, que afirma bajo la hipótesis nula que las funciones de supervivencia no difieren entre sí.
El tiempo de supervivencia global se midió desde el momento de la cirugía o la biopsia hasta la fecha de la muerte (como resultado de cualquier causa) o hasta el último seguimiento. El tiempo de supervivencia libre de enfermedad se midió desde la fecha del diagnóstico o cirugía histológica hasta la fecha del primer evento de fracaso libre de enfermedad (definido como recaída locoregional), enfermedad distante o muerte como resultado de cualquier causa. El significado se estableció en P < 0.05. Todos los análisis estadísticos se realizaron utilizando R (versión 3.6.0).
RESULTADOS
Los análisis inmunohistoquímicos indicaron la presencia de marcadores de superficie de células madre tumorales para los tres anticuerpos analizados en células PDAC. Un total de 112 pacientes con cáncer de páncreas fueron incluidos en este estudio: 59 (52,6%) machos y 53 (47,4%) las mujeres, con una mediana de edad al diagnóstico de 63 años (rango, 36-93 años, SD ± 10,3) y un período medio de seguimiento posterior al diagnóstico de 16,2 meses.
No hubo diferencia significativa entre los sexos al comparar la intensidad de la señal de anticuerpos. Cincuenta pacientes (48,08%) murió durante el período de seguimiento.
Entre todos los pacientes incluidos, 16 (15,2%) estaban en la etapa patológica I, 32 (30,4%) estaban en la etapa patológica II, 25 (23,8%) en la etapa patológica III, y 32 (30,4%) estaban en la etapa patológica IV. En los casos en que se disponían de información sobre el grado tumoral, el 2,8% de los carcinomas estaban bien diferenciados, el 62,8% estaban moderadamente diferenciados y el 34,2% estaban mal diferenciados.
En cuanto a la etapa TNM, el 11,2% eran T1 (tumor menor de 2 cm), el 38,3% eran T2 (tumor de más de 2 cm o tejidos vecinos invasores), el 19,6% eran T3 (tumor de cualquier tamaño invadiendo tejidos cercanos, pero sin comprometer el plexo celíaco o arteria mesentérica superior), 21,5% eran T4 (tumor de cualquier tamaño que compromete órganos vitales y plexo celíaco o arteria mesentérica superior) , y el 9,3% fueron Tx (se desconoce la extensión del tumor). Para la afectación de los ganglios linfáticos, el 31,7% se encontraba en la etapa N0 (sin metástasis de los ganglios linfáticos), el 31,7% era N1 (metástasis de los ganglios linfáticos regionales), el 6,5% era N2 (más de una cadena de ganglios linfáticos afectada) y el 29,9% en Nx (no evaluable). En cuanto a la presencia de metástasis, el 66,6% estaba en la etapa M0 (sin metástasis distantes), el 30,2% eran M1 (metástasis distantes) y el 3,6% eran Mx (no evaluables).
Alrededor del 75,9% de las muestras se obtuvieron del tejido tumoral pancreático, y alrededor del 26% fueron de muestras de metástasis, con el hígado (65,7%) siendo el sitio más afectado, seguido de los ganglios linfáticos (14,2%), peritoneo (8,5%) y otros (11,4%).
Se dio tratamiento paliativo a 68 individuos, es decir, el 76,40% del número total de personas analizadas.
En cuanto a la ubicación del tumor, el 81,6% de los tumores se localizaron en la cabeza del páncreas, el 22,9% en el cuerpo y el 6,4% en la cola.
La Tabla 1 resume el análisis descriptivo general de las personas involucradas en el estudio.
Tabla 1. Análisis descriptivo general
| Variables | N | % |
| Sexo | ||
| Mujer | 53 | 47.4 |
| masculino | 59 | 52.6 |
| Edad | ||
| 35-59 años | 37 | 33.9 |
| 60-69 años | 39 | 35.8 |
| 70-93 años | 33 | 30.3 |
| Muerte (n=104) | ||
| No | 54 | 51.9 |
| Sí | 50 | 48.1 |
| Tratamiento quirúrgico (n=108) | ||
| Paliativo | 42 | 38.9 |
| Cirugía parcial | 19 | 17.6 |
| DPT# | 47 | 43.5 |
| Tratamiento quirúrgico (n=89) | ||
| No | 21 | 23.6 |
| Sí | 68 | 76.4 |
| Diferenciación de tumores (n=105) | ||
| Bien diferenciado | 3 | 2.9 |
| Moderado diferenciado | 66 | 62.8 |
| Pobre diferenciado | 36 | 34.3 |
| Espécimen/Muestra (n=108) | ||
| Metástasis | 26 | 24.1 |
| Páncreas | 82 | 75.9 |
| Etapa patológica tumoral T (n=107) | ||
| T1 | 12 | 11.2 |
| T2 | 41 | 38.3 |
| T3 | 21 | 19.6 |
| T4 | 23 | 21.5 |
| Tx | 10 | 9.4 |
| Etapa patológica tumoral N (n=107) | ||
| N0 | 34 | 31.8 |
| N1 | 34 | 31.8 |
| N2 | 7 | 6.5 |
| Nx | 32 | 29.9 |
| Etapa patológica tumoral M (n=109) | ||
| M0 | 72 | 66.1 |
| M1 | 33 | 30.2 |
| Mx | 4 | 3.7 |
| Etapa general patológica tumoral (n=105) | ||
| 1 | 16 | 15.2 |
| 2 | 32 | 30.5 |
| 3 | 25 | 23.8 |
| 4 | 32 | 30.5 |
| MTX (n.o 35) | ||
| Hígado | 23 | 65.7 |
| Nodos linfáticos | 5 | 14.3 |
| Peritoneo | 3 | 8.6 |
| Otros | 4 | 11.4 |
| Ubicación: Cabeza del tumor | ||
| Sí | 89 | 81.7 |
| Ubicación: Cola del tumor | ||
| Sí | 7 | 6.4 |
| Ubicación: Cuerpo del tumor | ||
| Sí | 25 | 22.9 |
| Total | 112 | 100.0 |
#DPT: Duodenopancreatectomía
CD133 INMUNOSUTENCIÓN EN CÉLULAS MADRE CANCEROSAS EN CÉLULAS DE ADENOCARCINOMA DUCTAL PANCREÁTICO
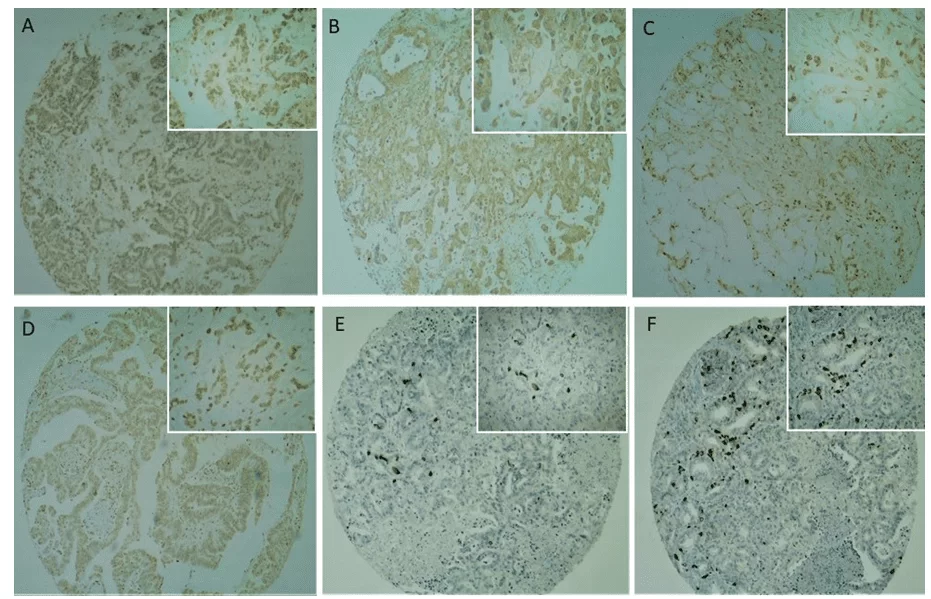
La inmunostaining CD133 estuvo presente en la membrana plasmática y el citoplasma a intensidad moderada a fuerte (Figuras 2C y 2D), con una intensidad predominantemente fuerte. Se confirmó una reacción positiva o negativa con el control positivo (placenta) utilizado en el estudio. No se observó inmunoreactividad cd133 en epitelio ductal pancreático normal (Figura 2).
2. Análisis inmunohistoquímico de marcadores de células madre cancerosas en muestras de cáncer de páncreas TMA. (2A, 2B) Se observó la expresión CD24 principalmente en el citoplasma de las células tumorales. (2C, 2D) La expresión CD133 se observó principalmente en la membrana y el citoplasma de las células tumorales, raramente nucleares. (2E, 2F) Se observó la expresión OCT4 en el nucleo de las células tumorales, con una expresión focal y una intensidad fuerte. El campo de aumento más bajo (40x) se representa en el panel global y en el campo de aumento más alto (100x) en el panel reducido.
En cuanto al tratamiento quirúrgico, el 95,1% de los pacientes sometidos a tratamiento 1 (derivación bileodigestiva) fueron CD133 positivos, el 70,0% de los pacientes sometidos a tratamiento 2 (cirugía parcial) fueron CD133 positivos y el 81,2% de los pacientes sometidos al tratamiento 3 (duodenocreatectomía total) fueron CD133 positivos. Hubo una asociación significativa (P -0,019) entre el tratamiento quirúrgico y la señal CD133. Además del tratamiento quirúrgico, sólo el tipo de muestra se asoció significativamente con la señal CD133, a un nivel de significancia del 5%.
El grado de diferenciación tumoral (bueno, moderado o pobre) no mostró ninguna asociación significativa con la inmunostainidad positiva CD133, aunque se observó que a medida que avanzaba el grado tumoral, la intensidad de tinción aumentaba (83,7% en tumores mal diferenciados). Tampoco hubo una asociación significativa entre la puesta en escena de TNM y la inmunostaining CD133 positiva, pero en etapas posteriores el etiquetado se intensifica, a pesar de que la presencia de CSC desde las primeras etapas se observa aquí. Esto corrobora la hipótesis de que las CSC han estado presentes desde el comienzo del proceso de carcinogénesis.
La Tabla 2 muestra el análisis descriptivo de las variables junto con la verificación de su asociación con la inmunorreactividad CD133, dada por la prueba exacta de Fisher.
Cuadro 2. Asociación de variables con CD133 positivo.
| IHC CD133 positivo | valor p* | ||||
| No | Sí | ||||
| N | % | N | % | ||
| Sexo | 1,000 | ||||
| Mujer | 8 | 15.1 | 45 | 84.9 | |
| masculino | 9 | 15.5 | 49 | 84.5 | |
| Edad | 1,000 | ||||
| 35-59 años | 6 | 16.2 | 31 | 83.8 | |
| 60-69 años | 6 | 15.0 | 34 | 85.0 | |
| 70-93 años | 5 | 14.7 | 29 | 85.3 | |
| Muerte (n =106) | 0,192 | ||||
| No | 6 | 11.1 | 48 | 88.9 | |
| Sí | 11 | 21.1 | 41 | 78.9 | |
| Tratamiento Quirúrgico (n =109) | 0,019 | ||||
| Paliativo | 2 | 4.9 | 39 | 95.1 | |
| Cirugía parcial | 6 | 30.0 | 14 | 70.0 | |
| Dpto # | 9 | 18.7 | 39 | 81.3 | |
| Tratamiento paliativo (n =91) | 0,474 | ||||
| No | 4 | 18.2 | 18 | 81.8 | |
| Sí | 8 | 11.6 | 61 | 88.4 | |
| Grado de diferenciación (n =107) | 0,084 | ||||
| Bien diferenciado | 2 | 66.7 | 1 | 33.3 | |
| Moderado diferenciado | 9 | 13.4 | 58 | 86.6 | |
| Pobre diferenciado | 6 | 16.2 | 31 | 83.8 | |
| Espécimen/muestra (n =107) | 0,028 | ||||
| Metástasis | 7 | 29.2 | 17 | 70.9 | |
| Páncreas | 9 | 10.9 | 74 | 89.2 | |
| Etapa T (n =109) | 0,587 | ||||
| T1 | 3 | 25.0 | 9 | 75.0 | |
| T2 | 5 | 12.5 | 35 | 87.5 | |
| T3 | 4 | 19.0 | 17 | 81.0 | |
| T4 | 2 | 8.0 | 23 | 92.0 | |
| Tx | 2 | 18.2 | 9 | 81.8 | |
| Etapa N (n =109) | 0,830 | ||||
| N0 | 4 | 11.4 | 31 | 88.6 | |
| N1 | 6 | 17.6 | 28 | 82.4 | |
| N2 | 1 | 16.7 | 5 | 83.3 | |
| Nx | 5 | 14.7 | 29 | 85.3 | |
| Etapa M (n =106) | 0,132 | ||||
| M0 | 8 | 11.3 | 63 | 88.7 | |
| M1 | 9 | 25.7 | 26 | 74.3 | |
| Mx | 0 | – | 5 | 100.0 | |
| Etapa general (n =107) | 0,133 | ||||
| 1 | 2 | 12.5 | 14 | 87.5 | |
| 2 | 5 | 15.6 | 27 | 84.4 | |
| 3 | 1 | 4.0 | 24 | 96.0 | |
| 4 | 9 | 26.5 | 25 | 73.5 | |
| MTX (n=34) | 0,645 | ||||
| Hígado | 7 | 30.4 | 16 | 69.6 | |
| Nodos linfáticos | 3 | 60.0 | 2 | 40.0 | |
| Peritoneo | 1 | 25.0 | 3 | 75.0 | |
| Otros | 1 | 20.0 | 4 | 80.0 | |
| Ubicación: Cabeza del tumor | 0,186 | ||||
| Sí | 12 | 13.2 | 79 | 86.8 | |
| Ubicación: Cola del tumor | 0,071 | ||||
| Sí | 3 | 42.9 | 4 | 57.1 | |
| Ubicación: Cuerpo del tumor | 1,000 | ||||
| Sí | 4 | 16.0 | 21 | 84.0 | |
*Prueba exacta de Fisher
#DPT: Duodenopancreatectomía
La Tabla 3 muestra los valores p y las asociaciones de variables con intensidad cuando la tinción cd133 fue positiva. Según la prueba exacta de Fisher (P=0,036), sólo la etapa M mostró una asociación significativa con la intensidad de CD133; es decir, los tumores que ya han hecho metástasis están fuertemente manchados para CD133.
Cuadro 3. Valores P de asociación con intensidad.
| Variables | Grupos | valor p* | ||
| IHC CD133 – Intensidad cuando es positiva |
IHC CD24 – Intensidad cuando es positiva |
IHC OCT4 – Intensidad cuando es positiva |
||
| Sexo |
Mujer | 0,222 | 0,438 | 0,619 |
| masculino | ||||
| Muerte |
No | 1,000 | 0,235 | 0,627 |
| Sí | ||||
| Tratamiento quirúrgico |
Paliativo | 0,815 | 0,732 | 0,620 |
| Cir. Parcial | ||||
| DPT# | ||||
| Tratamiento paliativo |
No | 0,136 | 0,027 | 0,619 |
| Sí | ||||
| Grado de diferenciación | Bien diferenciado | 0,266 | 0,442 | 0,407 |
| Moderado diferenciado | ||||
| Pobre diferenciado | ||||
| Espécimen/Muestra | Metástasis | 0,848 | 0,201 | 0,488 |
| Páncreas | ||||
| Etapa T | T1 | 0,611 | 0,992 | 1,000 |
| T2 | ||||
| T3 | ||||
| T4 | ||||
| Tx | ||||
| Etapa N | N0 | 0,560 | 0,920 | 0,180 |
| N1 | ||||
| N2 | ||||
| Nx | ||||
| Etapa M | M0 | 0,036 | 0,350 | 0,078 |
| M1 | ||||
| Mx | ||||
| Etapa General | 1 | 0,337 | 0,380 | 0,218 |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| MTX | Hígado | 0,094 | 0,037 | 1,000 |
| Peritoneo | ||||
| Nodos linfáticos | ||||
| Otros | ||||
*Prueba exacta de Fisher
#DPT: Duodenopancreatectomía
CD24 INMUNOSUTENCIÓN EN CÉLULAS MADRE CANCEROSAS EN CÉLULAS DE ADENOCARCINOMA DUCTAL PANCREÁTICO
La inmunostaining CD24 (Figuras 2A y 2B) estuvo presente en la membrana plasmática y el citoplasma en ambos débiles/moderados (41,6%) fuerte (58,3%) intensidades, pero con una intensidad más débil en comparación con CD133 (Figuras 2C y 2D). Las reacciones positivas y negativas se confirmaron con el control positivo (placenta) utilizado en el estudio. El Cuadro 4 muestra el análisis descriptivo de las variables junto con la verificación de su asociación con la positividad CD24, dada por la prueba exacta de Fisher. Se vio una señal POSITIVA de CD24 en el 98,3% de los varones, pero no hubo asociación entre el sexo y la positividad de CD24 (P a 0,343). Sólo el tipo de muestra recogida y el tratamiento paliativo se asociaron significativamente con la señal CD24, a un nivel de significancia del 5% (P= 0,010 y 0,042 respectivamente).
Cuadro 4. Asociación de variables con CD24 positivo.
| IHC CD24 positivo | valor p* | ||||
| No | Sí | ||||
| N | % | N | % | ||
| Sexo | 0,343 | ||||
| Mujer | 3 | 5.7 | 50 | 94.3 | |
| masculino | 1 | 1.7 | 58 | 98.3 | |
| Edad | 0,159 | ||||
| 35-59 años | 3 | 8.1 | 34 | 91.9 | |
| 60-69 años | 0 | – | 40 | 100.0 | |
| 70-93 años | 1 | 2.9 | 34 | 97.1 | |
| Muerte (n=107) | 0,618 | ||||
| No | 3 | 5.4 | 52 | 94.6 | |
| Sí | 1 | 1.9 | 51 | 98.1 | |
| Tratamiento Quirúrgico (n=110) | 0,399 | ||||
| Paliativo | 3 | 7.1 | 39 | 92.9 | |
| Cirugía parcial | 0 | – | 20 | 100.0 | |
| Dpto # | 1 | 2.1 | 47 | 97.9 | |
| Tratamiento paliativo (n=91) | 0,042 | ||||
| No | 3 | 13.6 | 19 | 86.4 | |
| Sí | 1 | 1.4 | 68 | 98.6 | |
| Grado de diferenciación (n=108) | 1,000 | ||||
| Bien diferenciado | 0 | – | 3 | 100.0 | |
| Moderado diferenciado | 3 | 4.4 | 65 | 95.6 | |
| Pobre diferenciado | 1 | 2.7 | 36 | 97.3 | |
| Espécimen/muestra (n=108) | 0,010 | ||||
| Metástasis | 1 | 4.0 | 23 | 95.9 | |
| Páncreas | 2 | 2.4 | 82 | 97.6 | |
| Etapa T (n=110) |
0,705 | ||||
| T1 | 0 | – | 12 | 100.0 | |
| T2 | 1 | 2.4 | 40 | 97.6 | |
| T3 | 1 | 4.8 | 20 | 95.2 | |
| T4 | 1 | 4.0 | 24 | 96.0 | |
| Tx | 1 | 9.1 | 10 | 90.9 | |
| Etapa N (n=110) | 0,881 | ||||
| N0 | 1 | 2.9 | 34 | 97.1 | |
| N1 | 2 | 5.9 | 32 | 94.1 | |
| N2 | 0 | – | 7 | 100.0 | |
| Nx | 1 | 2.9 | 33 | 97.1 | |
| Etapa M | 1,000 | ||||
| M0 | 3 | 4.2 | 69 | 95.8 | |
| M1 | 1 | 2.9 | 34 | 97.1 | |
| Mx | 0 | – | 5 | 100.0 | |
| Etapa general (n=108) | 0,913 | ||||
| 1 | 1 | 6.2 | 15 | 93.8 | |
| 2 | 1 | 3.1 | 31 | 96.9 | |
| 3 | 1 | 3.8 | 25 | 96.2 | |
| 4 | 1 | 2.9 | 33 | 97.1 | |
| MTX (n=37) | 1,000 | ||||
| Hígado | 1 | 4.3 | 22 | 95.7 | |
| Nodos linfáticos | 0 | – | 5 | 100.0 | |
| Peritoneo | 0 | – | 4 | 100.0 | |
| Otros | 0 | – | 5 | 100.0 | |
| Ubicación: Cabeza del tumor | 0,550 | ||||
| Sí | 3 | 3.3 | 89 | 96.7 | |
| Ubicación: Cola del tumor | 1,000 | ||||
| Sí | 0 | – | 7 | 100.0 | |
| Ubicación: Cuerpo del tumor | 1,000 | ||||
| Sí | 1 | 4.0 | 24 | 96.0 | |
*Prueba exacta de Fisher
#DPT: Duodenopancreatectomía
No se observó inmunorreactividad de CD24 en epitelio ductal pancreático normal. Se ha observado una señal positiva de CD24 en el 98,6 % de los pacientes sometidos a tratamiento paliativo, que fue significativo (P a 0,042). Debido a su estadificación avanzada del tumor, tenían una señal CD24 más fuerte en comparación con los individuos que se sometieron a duodenopancreatectomía total. La señal CD24 fue más fuerte en individuos que se sometieron a tratamiento paliativo como opción de tratamiento (98,6%) en comparación con los que no lo hicieron (13,6%).
El grado de diferenciación y estadificación del tumor no mostró ninguna asociación significativa con la tinción positiva cd24, ni hubo diferencias significativas entre tumores mal diferenciados o en etapa avanzada en comparación con tumores bien diferenciados y en estadio temprano con respecto a CD24 positivo.
La Tabla 3 muestra la asociación de variables con intensidad cuando CD24 fue positivo. Sólo la presencia de metástasis (MTX) se asoció significativamente con la intensidad, donde el hígado y el peritoneo mostraron una fuerte positividad en comparación con la metástasis en otros sitios, como los ganglios linfáticos y otros tejidos.
OCT4 INMUNOSU MANCHA EN CÉLULAS MADRE CANCEROSAS EN CÉLULAS DE ADENOCARCINOMA DUCTAL PANCREÁTICO
La inmunostaining OCT4 mostró un patrón diferente en relación con los otros anticuerpos analizados. La frecuencia de los casos positivos no fue tan alta como se observó con los otros dos anticuerpos analizados, pero cuando fue positivo, su intensidad fue muy fuerte (Figuras 1E y 1F). La inmunostaining se produjo en el núcleo de las células tumorales en el 31,5% de los casos y no de tinción del 68,7% de los tumores analizados. No se observó inmunoreactividad OCT4 en epitelio ductal pancreático normal. Ninguna variable se asoció significativamente con la señal OCT4, a un nivel de significancia del 5%. La edad media del grupo OCT4 positivo fue de 62,62 años y de 63,23 años en el grupo OCT4 negativo. Sin embargo, no hubo ninguna diferencia significativa entre los grupos con respecto a la edad (P = 0,547).
Aunque no es estadísticamente significativo, un hallazgo interesante del análisis de tinción OCT4 es que cuanto más diferenciado el tumor, mayor era la intensidad de tinción, mientras que los tumores mal diferenciados tenían baja intensidad de tinción (66,6% vs 21,6%). Las células positivas para OCT4 tienen un mayor potencial de diferenciación.
ANÁLISIS DE SUPERVIVENCIA
Sobre las curvas de supervivencia y su relación con los tres marcadores, todos los grupos presentaron curvas muy similares, por lo que la prueba log-rank no indica ninguna diferencia significativa entre las curvas con respecto a las señales positivas de los tres anticuerpos. Las curvas Kaplan-Meier para la intensidad CD133, CD24 y OCT4, confirmadas por los valores p de prueba log-rank, ninguna de las curvas de supervivencia difiere significativamente con respecto a la intensidad. Por lo tanto, la positividad de los marcadores no altera la supervivencia de los pacientes incluidos en el estudio.
DISCUSIÓN
Los CSC se han asociado recientemente con la progresión del cáncer y se han utilizado para identificar los factores de pronóstico y las dianas para la terapia en varios tipos de cáncer (DEAN et al., 2005). Es notable que el papel de las CSC no se entiende bien ni se caracteriza en el cáncer de páncreas. Además, se han publicado pocos informes sobre los patrones y efectos de la presencia de las CSC. Teniendo en cuenta esta falta de datos, analizamos retrospectivamente la expresión de las CSC en muestras de cáncer de páncreas utilizando inmunohistoquímica y verificamos su papel en la progresión tumoral y la resistencia terapéutica en el adenocarcinoma pancreático ductal.
La biología molecular del cáncer de páncreas está directamente relacionada con su rápida progresión y baja respuesta terapéutica. Está bien documentado que la aparición de una célula tumoral es el resultado de una acumulación de mutaciones en su ADN capaces de alterarla morfológica y funcionalmente (FANG et al., 2013; RICCI-VITIANI et al., 2007). El desencadenante de este proceso y toda su evolución, que culmina en la formación de la célula tumoral y sus características pertinentes, caracterizan el proceso de carcinogénesis, ya está significativamente aclarado para varios tipos de neoplasias. Sin embargo, para ciertos tipos de cáncer como el cáncer de páncreas, el proceso sigue siendo incierto (KOBAYASHI; NORONHA, 2015).
La mayoría de los tumores malignos siguen una historia natural que se puede dividir en cuatro etapas: transformación maligna, crecimiento de células tumorales, invasión local y metástasis. El proceso de carcinogénesis, o transformación maligna, se produce en varias etapas y resultados debido a la acumulación de cambios genéticos y mutaciones, que son desencadenados por varios factores, incluyendo factores ambientales como la radiación y los productos químicos (AYOB; RAMASAMY, 2018). Sin embargo, para que este proceso de carcinogénesis progrese, puede ser necesario tener ciertas células con las características de las células madre, como el potencial de auto-renovación y regeneración, así como un alto índice proliferativo.
La evidencia reciente sugiere que las células madre desempeñan un papel crucial no sólo en la generación y el mantenimiento de diferentes tejidos, sino también en el desarrollo y progresión de ciertos tipos de tumores (BALIC et al., 2012). Para varios tumores sólidos, se ha demostrado que albergan una subpoblación distinta de células tumorales que tienen características de células madre y, por lo tanto, se denominan células madre tumorales (CTT) o células tumorigénicas (MATSUDA et al., 2012). Las células madre cancerosas parecen ser capaces de iniciar e impulsar el crecimiento tumoral en tumores sólidos. CD133, CD24 y OCT4 se han notificado recientemente marcadores prospectivos para las CSC, expresados en una variedad de tumores; sin embargo, hasta nuestro conocimiento, no se ha hecho ningún intento de detectar su expresión en muestras de cáncer de páncreas (MAEDA et al., 2008).
Se puede observar que las células madre tumorales, o marcadores de superficie de células madre tumorales como CD133, CD24 y OCT4 están presentes en las células tumorales de cáncer de páncreas, lo que confirma la relación intrínseca entre el fenotipo maligno pancreático y la presencia de células madre. No se observó ninguna diferencia significativa entre la expresión de anticuerpos y el grado de diferenciación tumoral, suponiendo que las células madre tumorales han estado presentes desde el inicio del tumor. Cabe señalar que para los anticuerpos CD133 y CD24, el porcentaje de células tumorales que expresan marcadores aumentó a medida que el tumor progresaba. Por lo tanto, los tumores más agresivos y mal diferenciados presentaban una mayor positividad para la presencia del anticuerpo. Mientras que por otro lado, la expresión del anticuerpo OCT4 fue mayor e intensa en tumores bien diferenciados; por lo tanto, cuanto más diferenciado sea el tumor, mayor será el etiquetado. Las células que tienen el marcador de células madre para el anticuerpo OCT4 tienen un mayor potencial de diferenciación (VILLODRE et al., 2016). Esta puede ser la razón por la que OCT4 difería en términos de expresión de los otros marcadores que se probaron, aunque estas diferencias no fueron estadísticamente significativas.
El marcador OCT4 solo está presente focalmente en muestras tumorales que fueron positivas. Este hallazgo está de acuerdo con la teoría de que las CSC representan sólo una porción muy pequeña de la población total de células tumorales (PHI et al., 2018). Por ejemplo, se detectaron células positivas CD133 en 0,7-6,1% (RICCI-VITIANI et al., 2007), 1.8-24.5% (O’BRIEN et al., 2007) de las células primarias de cáncer de colon, y en 0,7-3,2% de las células primarias del cáncer de páncreas utilizando el análisis citométrico de flujo (HERMANN et al., 2007). La tinción inmunohistoquímica reveló la expresión de CD133 en el 1-3% de los especímenes de carcinoma hepatocelular (MA et al., 2007).
Aunque se observaron etiquetados y expresiones con una frecuencia relativamente alta en todos los grados de dirección tumoral, por ejemplo, los tumores expresaron el etiquetado de las células madre cancerosas independientemente del grado de diferenciación, algunos hallazgos favorecen la hipótesis de que el número de células madre en los tumores es mayor en tumores con un comportamiento más agresivo y con peor pronóstico. Esta hipótesis está respaldada por el hecho de que CD133 se expresó con mayor frecuencia en individuos que se sometieron a un tratamiento paliativo (95,1%) con una asociación significativa (valor p < 0,05) entre la presencia de anticuerpos y tratamiento paliativo. Cuando se informa que un paciente se sometió a un tratamiento paliativo, se supone que el tumor estaba en una etapa significativamente avanzada y sin posibilidad de intervención quirúrgica curativa y, por lo tanto, sólo se realizó un tratamiento paliativo. Del mismo modo, se puede exagerar que los tumores más agresivos en etapas posteriores expresan un mayor etiquetado para el anticuerpo de células madre tumorales CD133. Varios estudios clínicos han investigado la relación entre la expresión CD133 y los resultados clínicos de los tumores; sin embargo, los resultados son controvertidos. Por ejemplo, la expresión CD133 está relacionada con el mal pronóstico del cáncer de colon y el hepatocarcinoma (CAI et al., 2018).
En cuanto a la etapa TNM, el etiquetado de los tres anticuerpos (CD133, CD24 y OCT4) no cambió a lo largo de la progresión. Es notable que las células madre tumorales estuvieron presentes desde la etapa más temprana y que no se agrandan durante la estadificación. La prevalencia de los tres anticuerpos y sus asociaciones con las variables fue generalmente alta, aunque no todos los anticuerpos tenían un nivel de significancia inferior al de P < 0,05.
Todas las variables que contribuyeron a un pronóstico desfavorable, como la ubicación del tumor pancreático de la cabeza, la edad avanzada y la presencia de metástasis se asociaron con una alta prevalencia especialmente para la expresión de CD133 y CD24. Además, esto corroboró con la idea de que las células madre tumorales cuando están presentes se asocian con la progresión rápida del tumor y la resistencia terapéutica. Las células madre cancerosas tienen ciertas características similares a las de las células madre del organismo normal, como la capacidad de auto-regeneración y pluripotencia, dando lugar a líneas celulares tumorales heterogéneas que forman el mismo tumor (TAI et al., 2005). Es probable que las células madre cancerosas compartan muchas de las propiedades de las células madre normales que proporcionan una larga vida útil, incluyendo la reposo relativa, la resistencia a los medicamentos y las toxinas a través de la expresión de varios transportadores, una capacidad activa de reparación del ADN y una resistencia a la apoptosis. Por lo tanto, los tumores podrían tener una población incorporada de células pluripotentes farmacorresistentes que pueden sobrevivir a la quimioterapia y repoblar el tumor (MARQUES et al., 2010).
Con el fin de definir si las CSC predijó el resultado clínico, realizamos análisis de supervivencia de Kaplan-Meier y demostramos que los grupos presentaban curvas muy similares. Por lo tanto, la prueba log-rank no indica una diferencia significativa entre las curvas con respecto a la presencia de los tres anticuerpos. Aunque están asociados con variables de peor pronóstico como la metástasis y las opciones terapéuticas de tratamiento paliativo, no se puede establecer ninguna asociación entre la presencia de células madre tumorales y la supervivencia del paciente en este caso; por lo tanto, la presencia de CSC no predice una peor supervivencia.
El descubrimiento de células madre cancerosas en tumores sólidos ha cambiado nuestra visión de la carcinogénesis. Que las células madre tumorales están involucradas en el desarrollo y progresión tumoral es un hecho, ya que su presencia fue significativa en la gran mayoría de los tejidos analizados y, recientemente, muchos estudios han asociado la presencia de células madre tumorales con el desarrollo de varios tipos de cáncer.
CONSIDERACIONES FINALES
El proceso de tumorigenesis, hasta donde se conoce el sujeto hasta ahora, implica la adquisición progresiva de múltiples mutaciones aberrantes que culminan en la expansión y proliferación de subpoblaciones celulares más agresivas, contribuyendo a la progresión y crecimiento tumoral. Aunque esta teoría está bien establecida, la identificación de células que son capaces de causar la progresión tumoral sigue siendo objeto de muchos estudios para caracterizar mejor el proceso de carcinogénesis e identificar estas células.
Gran parte de la información que obtenemos y utilizamos para el diagnóstico, pronóstico y tratamiento de neoplasias pancreáticas deriva de poblaciones heterogéneas con diferentes grados de maduración y diferenciación. Cada vez es más urgente caracterizar a las CSC para la evaluación y caracterización de la vía cancerígena de los tumores más agresivos. La consecuencia directa es el desarrollo de estrategias terapéuticas que puedan actuar sobre las CSC y la posibilidad de determinar, por un método de fácil acceso, qué pacientes se beneficiarán más de este tipo de tratamiento.
REFERENCIAS
ALLEGRA, E.; TRAPASSO, S. Cancer stem cells in head and neck cancer. Onco Targets Ther., v.5, p.375-83, 2012.
ANSARI, D.; CHEN, B.C.; DONG, L.; ZHOU, M.T.; ANDERSSON, R. Pancreatic cancer: translational research aspects and clinical implications. World J Gastroenterol., v.18, n.13, p.1417-24, 2012.
AYOB, A.Z.; RAMASAMY, T.S. Cancer stem cells as key drivers of tumour progression. J Biomed Sci., v.25, n.20, 2018.
BALIC, A.; DORADO, J.; ALONSO-GÓMEZ, M.; HEESCHEN, C. Stem cells as the root of pancreatic ductal adenocarcinoma. Exp Cell Res., v.318, n.6, p.691-704, 2012.
BARBOSA, I.R.; SANTOS, C.A.; SOUZA, D.L.B. Pancreatic cancer in Brazil: mortality trends and projections until 2029. Arq. Gastroenterol., v.55, n.3, p.230-6, 2018.
CAI, X.; LI, J.; YUAN, X.; XIAO, J.; DOOLEY, S.; WAN, X., WHENG, W.; LU, L. CD133 expression in cancer cells predicts poor prognosis of non-mucin producing intrahepatic cholangiocarcinoma. J Transl Med., v.16, n.50, 2018.
DEAN, M.; FOJO, T.; BATES, S. Tumour stem cells and drug resistance. Nat Rev Cancer., v.5, n.4, p.275-84, 2005.
FANG, Y.; YAO, Q.; CHEN, Z.; XIANG, J.; WILLIAM, F.E.; GIBBS, R.A.; CHEN, C. Genetic and molecular alterations in pancreatic cancer: implications for personalized medicine. Med Sci Monit., v.19, p.916-26, 2013.
HERMANN, P.C.; HUBER, S.L.; HERRLER, T.; AICHER, A.; ELLWART, J.W.; GUBA, M.; BRUNS, C.J.; HEESCHEN, C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell., v.1, n.3, p.313-23, 2007.
HU, Y.; FU, L. Targeting cancer stem cells: a new therapy to cure cancer patients. Am J Cancer Res., v.2, n.3, p.340-56, 2012.
KOBAYASHI, N.C.C.; NORONHA, S.M.R. Cancer stem cells: a new approach to tumor development. Rev Assoc Med Bras., v.61, n.1, p.86-93, 2015.
KONONEN, J.; BUBENDORF, L.; KALLIONIMENI, A.; BÄRLUND, M.; SCHRAML, P.; LEIGHTON, S.; TORHORST, J.; MIHATSCH, M.J.; SAUTER, G.; KALLIONIMENI, O.P. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med., v.4, n.7, p.844-7, 1998.
LI, D.; JIAO, L. Molecular epidemiology of pancreatic cancer. Int J Gastrointest Cancer., v.33, n.1, p.3-14, 2003.
MA, S.; CHAN, K.W.; HU, L.; LEE, T.K.W.; WO, J.Y.H.; NG, I.O.L.; ZHENG, B.J.; GUAN, X.Y. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, v.132, n.7, p.2542-56, 2007.
MAEDA, S.; SHINCHI, H.; KURAHARA, H.; MATAKI, Y.; MAEMURA, K.; SATO, M.; NATSUGOE, S.; AIKOU, T.; TAKAO, S. CD133 expression is correlated with lymph node metastasis and vascular endothelial growth factor-C expression in pancreatic cancer. Br J Cancer., v.98, n.8, p.1389-97, 2008.
MARQUES, D.S.; SANDRINI, J.Z.; BOYLE, R.T.; MARINS, L.F.; TRINDADE, G.S. Relationships between multidrug resistance (MDR) and stem cell markers in human chronic myeloid leukemia cell lines. Leuk Res., v.34, n.6, p.757-62, 2010.
MATSUDA, Y.; KURE, S.; ISHIWATA, T. Nestin and other putative cancer steam cell markers in pancreatic cancer. Med Mol Morphol., v.45, n.2, p.59-65, 2012.
O’BRIEN, C.A.; POLLETT, A.; GALLINGER, S.; DICK, J.E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature, v.445, n.7123, p.106-10, 2007.
PHI, L.T.H.; SARI, I.N.; YANG, Y.G.; LEE, S.H.; JUN, N.; KIM, K.S.; LEE, Y.K.; KWON, H.Y. Cancer Stem Cells (CSCs) in Drug Resistance and their Therapeutic Implications in Cancer Treatment. Stem Cells Int., n.5416923, 2018.
RICCI-VITIANI, L.; LOMBARDI, D.G.; PILOZZI, E.; BIFFONI, M.; TODARO, M.; PESCHLE, C.; DE MARIA, R. Identification and expansion of human colon-cancer-initiating cells. Nature, v.445, p.111-5, 2007.
SAKORAFAS, G.H.; TSIOTOU, A.G.; TSIOTOS, G.G. Molecular biology of pancreatic cancer; oncogenes, tumor suppressor genes, growth factors, and their receptors from a clinical perspective. Cancer Treat Rev., v.26, n.1, p.29-52, 2000.
SOTO, J.L.; BARBERA, V.M.; SACEDA, M.; CARRATO, A. Molecular biology of exocrine pancreatic cancer. Clin Transl Oncol., v.8, p.306-12, 2006.
TAI, M.H.; CHANG, C.C.; OLSON, L.K.; TROSKO, J.E. Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis. Carcinogenesis, v.26, n.2, p.495-502, 2005.
VILLODRE, E.S.; KIPPER, F.C.; PEREIRA, M.B.; LENZ, G. Roles of OCT4 in tumorigenesis, cancer therapy resistance and prognosis. Cancer Treat Rev., v.51, p.1-9, 2016.
[1]Máster en Ciencias Médicas, Programa de Posgrado en Medicina: Ciencias Médicas, Universidad Federal de Rio Grande do Sul (UFRGS), Brasil.
[2] Doctor en Ciencias Fisiológicas, Universidad Federal de Río Grande (FURG), Brasil.
[3] Máster en Genética y Biología Molecular, Universidad Federal de Rio Grande do Sul (UFRGS), Brasil.
[4] Estudiante de Medicina de Grado en la Universidad Federal de Río Grande (FURG), Brasil.
[5] Doctor en Ciencias Biológicas (Bioquímica) en la Universidad Federal de Rio Grande do Sul (UFRGS), con doctorado sándwich en neurociencia – Universidad de California Irvine.
Artículo: Septiembre de 2020.
Aprobado: Octubre de 2020.