ORIGINALER ARTIKEL
RODRIGUES, Camila Juliano Salvador [1], SILVEIRA, Elita Ferreira da [2], VARGAS, Rafael da Silveira [3], GIACOMO, Giordano Gatti de [4], BIANCHIN, Marino Muxfeldt [5]
RODRIGUES, Camila Juliano Salvador. Et al. Krebsstammzellenmarker, die mit der Entwicklung und dem aggressiven Phänotyp bei Bauchspeicheldrüsenkrebs in Verbindung gebracht werden. Revista Científica Multidisciplinar Núcleo do Conhecimento. Jahrgang 05, Ed. 10, Vol. 12, S. 102-122. Oktober 2020. ISSN:2448-0959, Zugriffslink in: https://www.nucleodoconhecimento.com.br/gesundheit/bauchspeicheldruesenkrebs
ZUSAMMENFASSUNG
Hintergrund: Krebsstammzellen, auch tumorinitiierende Zellen genannt, sollen für die Arzneimittelresistenz und Die Krebsentwicklung verantwortlich sein, was zum Teil auf ihre Fähigkeit zurückzuführen ist, sich selbst zu erneuern und sich in heterogene Abstammungen von Krebszellen zu differenzieren. Ziel: Diese Studie wurde entwickelt, um die Rolle von Krebsstammzellen bei Bauchspeicheldrüsenkrebs zu untersuchen. Methode: Eine retrospektive klinische Analyse wurde bei 112 Patienten durchgeführt, bei denen zwischen 2005 und 2010 ein pankreasisches adenokarzinom diagnostiziert wurde, und die Immunhistochemie wurde mit Antikörpern gegen CD133, CD24 und OCT4 durchgeführt. Positive Kern-, Zytoplasma- oder Membranfärbung für jeden Antikörper wurde nach der Färbungsintensität bewertet, wobei er in niedrige/moderate oder starke Färbegruppen eingeteilt wurde. Die Ergebnisse wurden relativ zu den klinischpathologischen Parametern jedes Patienten analysiert. Ergebnisse: Es gab eine etablierte Beziehung zwischen der Färbung der Marker mit einigen Variablen, die mit schlechterer Prognose verbunden sind, da die drei Marker in den meisten Tumorzellen vorhanden und mit der Tumorprogression assoziiert sind. Wir nehmen an, dass Krebsstammzellen seit Beginn der Tumorinitiation vorhanden sind und intrinsisch mit der Tumorentwicklung zusammenhängen. Obwohl das Vorhandensein von Stammzellen mit der Molekularbiologie verschiedener Tumoren in Verbindung gebracht wurde, wurde ihre Ausdruck bei Bauchspeicheldrüsenkrebs noch nicht klinisch berichtet. Schlußfolgerung: Das Vorhandensein von Stammzellen und ihre Rolle bei der Tumortumorgenese bei Bauchspeicheldrüsenkrebs kann als wertvolle prognostische Faktoren angesehen werden, obwohl der beteiligte Mechanismus einer weiteren Untersuchung bedarf. Zunehmende Einblicke in die Rolle von Krebsstammzellen und Karzinogenese können letztlich neue Ideen für molekulare diagnostische und therapeutische Ansätze hervorbringen.
Schlagworte: Krebsstammzellen, Bauchspeicheldrüsenkrebs, AC133 Antigen, CD24 Antigen, OCT4.
EINFÜHRUNG
Trotz der Fortschritte bei der Krebsdiagnose und -behandlung in den letzten Jahrzehnten ist sie nach wie vor eine der häufigsten Todesursachen weltweit. Während potenziell heilbar, wenn früh diagnostiziert, Frühdiagnose bleibt eine Herausforderung in der täglichen klinischen Praxis. Viele Krebsarten werden in einem späten Stadium diagnostiziert, wenn therapeutische Optionen nicht mehr wirksam sind (BARBOSA et al., 2018).
Pankreas-Duktodasocarkinom (PDAC) ist eine hochaggressive Erkrankung, die in der Regel in einem fortgeschrittenen Stadium diagnostiziert wird und für die nur wenige wirksame Therapien zur Verfügung stehen. Es ist ein Neoplasma, dessen Inzidenz fast gleich seiner Sterblichkeit ist. Der Grund, warum Bauchspeicheldrüsenkrebs eine so schlechte Prognose hat und warum er eine so geringe therapeutische Reaktion auf Chemotherapie und Strahlentherapie hat, sind Fragen, die die Suche nach einer Antwort motiviert haben, die den Verlauf dieser Krankheit verändern kann. Trotz der Fortschritte in den chirurgischen Techniken, die heute als die einzige heilende Option gelten, ist die durchschnittliche 5-Jahres-Überlebensrate weniger als 5% (1-3%) (BARBOSA et al., 2018; SOTO et al., 2006). Es gilt als die Neoplasie mit der schlechtesten Prognose von mehr als 60 Krebsarten, eine Tatsache, die durch seine Inzidenzrate fast gleich der Sterblichkeitsrate (SAKORAFAS et al., 2000). Es sollte beachtet werden, dass die Früherkennung von Krebs in einem Stadium, das noch geheilt werden kann, mit einer größeren therapeutischen Wirksamkeit verbunden ist und derzeit eine der Möglichkeiten ist, das Ergebnis von Patienten mit Bauchspeicheldrüsenkrebs zu verbessern (ALLEGRA; TRAPASSO, 2012).
Die Molekularbiologie von Bauchspeicheldrüsenkrebs steht in direktem Zusammenhang mit seinem schnellen Fortschreiten und seiner geringen therapeutischen Reaktion. Es ist gut dokumentiert, dass das Auftreten einer Tumorzelle das Ergebnis einer Anhäufung von Mutationen in ihrer DNA ist, die in der Lage sind, ihre normalen Eigenschaften morphologisch und funktionell zu verändern (FANG et al., 2013; RICCI-VITIANI et al., 2007). Die Auslösung dieses Prozesses und seine molekulare Evolution, die in der Bildung der Tumorzelle und ihren relevanten Eigenschaften gipfelt, charakterisieren den Prozess der Karzinogenese. Es ist in der Literatur gut verstanden, dass die Entwicklung einer Neoplasie eine Reihe molekularer Veränderungen beinhaltet, die nicht nur zur Entstehung und zum Überleben einer Tumorzelle führen, sondern auch zu ihrer Fähigkeit, in benachbarte Gewebe einzudringen und entfernte Metastasen zu bilden (LI; JIAO, 2003).
Unter den Prozessen, die zuletzt in die Karzinogenese und Tumorprogression involviert waren, sind Veränderungen in Krebsstammzellen (CSCs) bei Bauchspeicheldrüsenkrebs noch immer schlecht untersucht, ohne zufriedenstellende Ergebnisse, und sie verdienen größere Anstrengungen bei der Aufklärung ihrer Auswirkungen und Beziehung beim Erwerb eines pankreatischen bösartigen Phänotyps. Jüngste Erkenntnisse deuten darauf hin, dass CSCs nicht nur bei der Erzeugung und Wartung verschiedener Gewebe eine entscheidende Rolle spielen, sondern auch bei der Entwicklung, Progression und therapeutischen Resistenz verschiedener Tumortypen (BALIC et al., 2012).
CSCs gehören zu einer differenzierten Gruppe von Zellen innerhalb eines Tumors mit sich selbst erneuernden und differenzierenden Eigenschaften, ähnlich wie normale Stammzellen, was zu heterogenen Tumorzelllinien führt, die einen Tumor bilden. Sie können mehrere Zellen teilen und herbeiführen, die Tumore bilden, wodurch ihr Wachstum fortbleibt und die Resistenz gegen Chemotherapie durch Mechanismen, die noch nicht gut verstanden sind, bietet. Aus diesem Grund stellen sie ein wichtiges Forschungsziel dar (TAI, 2005).
Die intrinsische Aggressivität von Bauchspeicheldrüsenkrebs mit seiner hohen Fähigkeit zur lokalen Invasion, hohem metastasierendem Potenzial, später Diagnose und therapeutischer Resistenz scheint teilweise mit der Population von CSCs zusammenzuhängt, aus denen diese Tumoren bestehen (HU; FU, 2012). Darüber hinaus hat sich gezeigt, dass PDAC nicht nur eine homogene Population von CSCs enthält, sondern auch verschiedene Subpopulationen, die an der Tumorprogression beteiligt sein können. Bisher stellen identifizierte Pankreas-CSCs eine Minderheit von Tumorkomponentenzellen (ca. 1-5%) dar und haben eine hohe Fähigkeit zur Selbsterneuerung (ANSARI et al., 2012). Der wichtigste klinische Aspekt ist jedoch, dass diese CSCs sehr resistent gegen Chemotherapie und Strahlentherapie sind, was zu Resistenzen und einem schnellen Wiederauftreten der Krankheit führt. Derzeit besteht eine der großen Herausforderungen der Onkologie darin, die Merkmale dieser CSCs zu identifizieren und zu untersuchen, insbesondere in PDAC, in denen nur wenige Entdeckungen gemacht wurden (KOBAYASHI; NORONHA, 2015).
MATERIALIEN UND METHODEN
FALLAUSWAHL UND TUMORPROBEN
Die Gewebeproben stammten aus einer Kohorte von 112 aufeinanderfolgenden Bauchspeicheldrüsenkrebsen, die von 2005 bis 2010 diagnostiziert wurden und aus der routinemäßigen Versorgung des Hospital de Clénicas de Porto Alegre (HCPA) von der Abteilung für Pathologie und Gruppe der Gallenwege und der Bauchspeicheldrüse ausgewählt wurden. Immunhistochemische Analysen wurden in Paraffin-eingebetteten Gewebeblöcken durchgeführt, die bereits in der Abteilung für Pathologie der HCPA gelagert wurden, nach Genehmigung durch den Wissenschaftlichen Ausschuss und den Ausschuss für Ethik in der Gesundheitsforschung der Institution. Die folgenden Variablen wurden aus medizinischen Aufzeichnungen aufgezeichnet: Alter, Geschlecht, Tumorgrad, Lymphknotenstatus, Auftreten von Metastasen, erhaltene Behandlung (Art der Operation, Strahlentherapie und Chemotherapie), krankheitsfreies Überleben und Gesamtüberleben.
TISSUE MICROARRAY (TMA) IMMUNOHISTOCHEMICAL ANALYSE
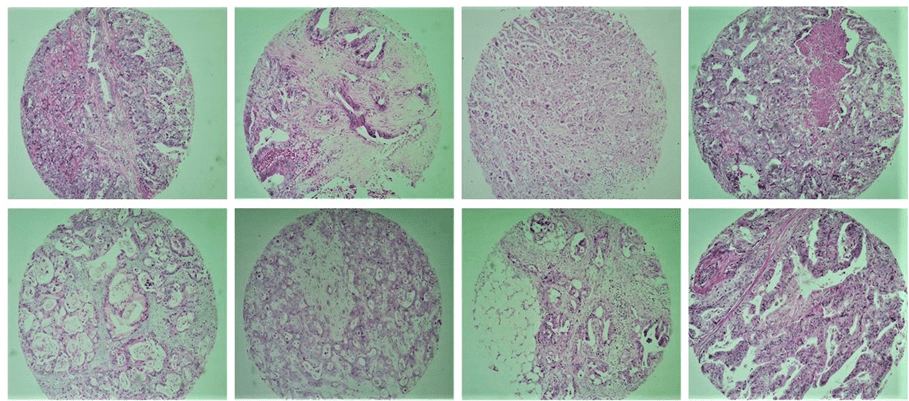
Tissue Microarray (TMA) Array ist eine Technik, die zuerst von Kononen et al. (1998) beschrieben wurde und ist ein großartiges Werkzeug für die Untersuchung pathologie. Es geht darum, eine angemessene Anzahl von Gewebeproben in einem einzigen Block zu gruppieren und so die Untersuchung der immunhistochemischen Expression molekularer Marker zu ermöglichen, mit großem Einsatz des Materials, Vorhandensein von interner Kontrolle sowie Zeit und Kosteneffizienz. Diese Technik ermöglicht auch die Standardisierung von Reaktionen, effiziente Repräsentativität durch die Verwendung verschiedener Bereiche des Tumors, Das Studium einer großen Anzahl von Proben gleichzeitig, einfache Interpretation und groß angelegte Forschung von prognostischen oder prädiktiven Faktoren von Krebs (Abbildung 1).
Abb. 1. Veranschaulicht einige Tumorgewebeproben, die in der Studie durch die TMA-Technik enthalten sind
STATISTISCHE ANALYSE
Um den Zusammenhang zwischen immunhistochemischen Variablen und der Immunreaktionsintensität mit den Charakterisierungsvariablen von Individuen zu überprüfen, wurde ein nicht-parametrischer Ansatz mit Fishers genauem Test verwendet. Um die Assoziation des numerischen Variablenalters mit immunhistochemischen Variablen und Intensität zu überprüfen, wurde der Mann-Whitney U-Test verwendet.
Der Zusammenhang zwischen Stammzellmarkern und verschiedenen klinisch-pathologischen Merkmalen der Patiente [einschließlich Alter, Geschlecht, Tumordifferenzierung, Stadium, Tumor-Node-Metastasis (TNM) -Kategorie und Tumorresektion] wurde anhand des Pearson-Korrelationskoeffizienten bzw. der Tests von 2 bewertet. Für die Intensität wurden die Kategorien in niedrige/moderate Intensität (0-2+) oder hohe Intensität (≥3+) unterteilt.
Die Kaplan-Meier-Methode wurde zur Schätzung der Überlebenswahrscheinlichkeit verwendet. Überlebenskurven wurden mit dem Log-Rank-Test verglichen, der unter der Nullhypothese behauptet, dass sich Überlebensfunktionen nicht voneinander unterscheiden.
Die Gesamtüberlebenszeit wurde vom Zeitpunkt der Operation oder Biopsie bis zum Todesdatum (aus irgendeinem Grund) oder bis zur letzten Nachbeobachtung gemessen. Die krankheitsfreie Überlebenszeit wurde vom Datum der histologischen Diagnose oder Operation bis zum Datum des ersten krankheitsfreien Versagensereignisses (definiert als lokoregionaler Rückfall), einer fernen Krankheit oder des Todes als Folge einer beliebigen Ursache gemessen. Signifikanz wurde bei P < 0,05 festgestellt. Alle statistischen Analysen wurden mit R (Version 3.6.0) durchgeführt.
ERGEBNISSE
Immunhistochemische Analysen zeigten das Vorhandensein von Tumorstammzell-Oberflächenmarkern für die drei Antikörper, die in PDAC-Zellen analysiert wurden. Insgesamt wurden 112 Patienten mit Bauchspeicheldrüsenkrebs in diese Studie einbezogen: 59 (52,6%) Männer und 53 (47,4%) Frauen mit einem mittleren Alter bei der Diagnose von 63 Jahren (Bereich, 36-93 Jahre, SD ± 10,3) und einer medianen Nachbeobachtungszeit nach der Diagnose von 16,2 Monaten.
Beim Vergleich der Antikörpersignalintensität gab es keinen signifikanten Unterschied zwischen den Geschlechtern. Fünfzig Patienten (48,08%) während der Nachbeobachtungszeit starb.
Von allen Patienten, die berücksichtigt wurden, waren 16 (15,2%) im pathologischen Stadium I, 32 (30,4%) im pathologischen Stadium II, 25 (23,8%) im pathologischen Stadium III und 32 (30,4%) im pathologischen Stadium IV. In Fällen, in denen Informationen über den Tumorgrad verfügbar waren, waren 2,8 % der Karzinome gut differenziert, 62,8 % waren mäßig differenziert und 34,2 % schlecht differenziert.
In Bezug auf die TNM-Stufe 11,2% waren T1 (Tumor kleiner als 2 cm), 38,3% t2 (Tumor größer als 2 cm oder eindringendes benachbartes Gewebe), 19,6% waren T3 (Tumor jeder Größe, der in nahegelegene Gewebe eindringt, aber ohne den Zöliakieplexus oder die überlegene mesenterische Arterie zu beeinträchtigen), 21,5% waren T4 (Tumor jeder Größe kompromittierende lebenswichtige Organe und Zöliakie oder überlegene meenterische Arterie) und 9,3% waren Tx (Ausdehnung des Tumors ist unbekannt). Bei der Lymphknotenbeteiligung befanden sich 31,7 % im Stadium N0 (keine Lymphknotenmetastasierung), 31,7 % waren N1 (regionale Lymphknotenmetastasierung), 6,5 % waren N2 (mehr als eine betroffene Lymphknotenkette) und 29,9 % Nx (nicht auswertbar). In Bezug auf das Vorhandensein von Metastasen waren 66,6% im Stadium M0 (keine entfernten Metastasen), 30,2% waren M1 (entfernte Metastasen) und 3,6% mx (nicht auswertbar).
Etwa 75,9 % der Proben wurden aus Bauchspeicheldrüsentumorgewebe gewonnen, und etwa 26 % stammten aus Metastasenproben, wobei die Leber (65,7 %) am stärksten betroffene Stelle, gefolgt von den Lymphknoten (14,2%), Peritoneum (8,5%) und anderen (11,4%).
Die palliative Behandlung wurde 68 Personen verabreicht, das sind 76,40 % der Gesamtzahl der analysierten Personen.
In Bezug auf die Lage des Tumors, 81,6% der Tumoren wurden im Kopf der Bauchspeicheldrüse, 22,9% im Körper und 6,4% im Schwanz.
Tabelle 1 fasst die allgemeine beschreibende Analyse der an der Studie beteiligten Personen zusammen.
Tabelle 1. Allgemeine Beschreibung
| Variablen | N | % |
| Sex | ||
| Weiblich | 53 | 47.4 |
| Männlich | 59 | 52.6 |
| Alter | ||
| 35-59 Jahre | 37 | 33.9 |
| 60-69 Jahre | 39 | 35.8 |
| 70-93 Jahre | 33 | 30.3 |
| Tod (n=104) | ||
| Nein | 54 | 51.9 |
| Ja | 50 | 48.1 |
| Chirurgische Behandlung (n=108) | ||
| Palliative | 42 | 38.9 |
| Teilchirurgie | 19 | 17.6 |
| Dpt # | 47 | 43.5 |
| Chirurgische Behandlung (n=89) | ||
| Nein | 21 | 23.6 |
| Ja | 68 | 76.4 |
| Tumordifferenzierung (n = 105) | ||
| Gut differenziert | 3 | 2.9 |
| Mäßig differenziert | 66 | 62.8 |
| Schlecht differenziert | 36 | 34.3 |
| Probe/Probe (n=108) | ||
| Metastase | 26 | 24.1 |
| Bauchspeicheldrüse | 82 | 75.9 |
| Tumorpathologisches Stadium T (n=107) | ||
| T1 | 12 | 11.2 |
| T2 | 41 | 38.3 |
| T3 | 21 | 19.6 |
| T4 | 23 | 21.5 |
| Tx | 10 | 9.4 |
| Tumorpathologisches Stadium N (n= 107) | ||
| N0 | 34 | 31.8 |
| N1 | 34 | 31.8 |
| N2 | 7 | 6.5 |
| Nx | 32 | 29.9 |
| Tumorpathologisches Stadium M (n = 109) | ||
| M0 | 72 | 66.1 |
| M1 | 33 | 30.2 |
| Mx | 4 | 3.7 |
| Tumorpathologisches allgemeines Stadium (n=105) | ||
| 1 | 16 | 15.2 |
| 2 | 32 | 30.5 |
| 3 | 25 | 23.8 |
| 4 | 32 | 30.5 |
| MTX (n=35) | ||
| Leber | 23 | 65.7 |
| Lymphknoten | 5 | 14.3 |
| Peritoneum | 3 | 8.6 |
| Andere | 4 | 11.4 |
| Ort: Tumorkopf | ||
| Ja | 89 | 81.7 |
| Ort: Tumor Schwanz | ||
| Ja | 7 | 6.4 |
| Ort: Tumor körper | ||
| Ja | 25 | 22.9 |
| gesamt | 112 | 100.0 |
#DPT: Duodenopanatomie
CD133 IMMUNOSTAINING IN CANCER STEM CELLS IN PANCREATIC DUCTAL ADENOCARCINOMA CELLS
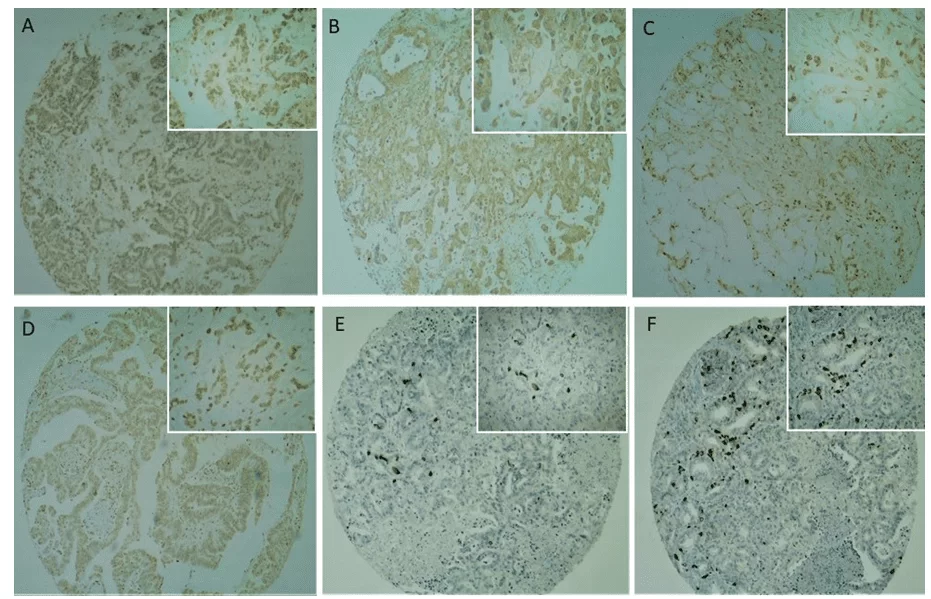
Cd133 Immunostainierung war in der Plasmamembran und Zytoplasma mit mäßiger bis starker Intensität vorhanden (Abbildungen 2C und 2D), mit einer überwiegend starken Intensität. Eine positive oder negative Reaktion wurde mit der in der Studie verwendeten Positivkontrolle (Plazenta) bestätigt. Keine CD133-Immunreaktivität wurde bei normalem pankreatischem duktalen Epithel beobachtet (Abbildung 2).
Abb. 2. Immunhistochemische Analyse von Krebsstammzellenmarkern in TMA-Pankreaskrebsproben. (2A, 2B) Die CD24-Expression wurde hauptsächlich im Zytoplasma von Tumorzellen beobachtet. (2C, 2D) Die CD133-Expression wurde hauptsächlich in der Membran und im Zytoplasma von Tumorzellen beobachtet, die selten nuklear sind. (2E, 2F) Die OCT4-Expression wurde im Nukleo von Tumorzellen mit einer fokalen Expression und starker Intensität beobachtet. Niedrigstes Vergrößerungsfeld (40x) werden im globalen Panel und das höchste Vergrößerungsfeld (100x) im reduzierten Bedienfeld dargestellt.
In Bezug auf die chirurgische Behandlung waren 95,1% der Patienten, die sich einer Behandlung 1 (bileodigestive Shunt) unterziehen, CD133-positiv, 70,0% der Patienten, die sich einer Behandlung unterziehen 2 (Teiloperation) cd133-positiv waren, und 81,2% der Patienten, die sich einer Behandlung unterziehen 3 (total duodenopancreatektomy) waren CD133-positiv. Es gab einen signifikanten Zusammenhang (P = 0,019) zwischen chirurgischer Behandlung und CD133-Signal. Neben der chirurgischen Behandlung war nur der Probentyp signifikant mit dem CD133-Signal assoziiert, bei einem Signifikanzniveau von 5%.
Der Grad der Tumordifferenzierung (gut, mäßig oder schlecht) zeigte keinen signifikanten Zusammenhang mit positiver CD133-Immunostainierung, obwohl beobachtet wurde, dass mit fortschreitender Tumorqualität die Färbeintensität zunahm (83,7% bei schlecht differenzierten Tumoren). Es gab auch keinen signifikanten Zusammenhang zwischen TNM-Inszenierung und positiver CD133-Immunostainierung, aber in späteren Stadien intensiviert sich die Kennzeichnung, obwohl hier das Vorhandensein von CSCs von den frühesten Stadien an beobachtet wird. Dies bestätigt die Hypothese, dass die CSCs seit Beginn des Carcinogenese-Prozesses vorhanden sind.
Tabelle 2 zeigt die beschreibende Analyse der Variablen zusammen mit der Überprüfung ihrer Assoziation mit CD133-Immunreaktivität, die durch Fishers genauen Test gegeben wird.
Tabelle 2. Zuordnung von Variablen mit positiver CD133.
| IHC CD133 positiv | p-Wert* | ||||
| Nein | Ja | ||||
| N | % | N | % | ||
| Sex | 1,000 | ||||
| Weiblich | 8 | 15.1 | 45 | 84.9 | |
| Männlich | 9 | 15.5 | 49 | 84.5 | |
| Alter | 1,000 | ||||
| 35-59 Jahre | 6 | 16.2 | 31 | 83.8 | |
| 60-69 Jahre | 6 | 15.0 | 34 | 85.0 | |
| 70-93 Jahre | 5 | 14.7 | 29 | 85.3 | |
| Tod (n=106) | 0,192 | ||||
| Nein | 6 | 11.1 | 48 | 88.9 | |
| Ja | 11 | 21.1 | 41 | 78.9 | |
| Chirurgische Behandlung (n=109) | 0,019 | ||||
| Palliative | 2 | 4.9 | 39 | 95.1 | |
| Teilchirurgie | 6 | 30.0 | 14 | 70.0 | |
| Dpt # | 9 | 18.7 | 39 | 81.3 | |
| Palliativbehandlung (n= 91) | 0,474 | ||||
| Nein | 4 | 18.2 | 18 | 81.8 | |
| Ja | 8 | 11.6 | 61 | 88.4 | |
| Differenzierungsgrad (n=107) | 0,084 | ||||
| Gut differenziert | 2 | 66.7 | 1 | 33.3 | |
| Mäßig differenziert | 9 | 13.4 | 58 | 86.6 | |
| Schlecht differenziert | 6 | 16.2 | 31 | 83.8 | |
| Probe/Probe (n=107) | 0,028 | ||||
| Metastase | 7 | 29.2 | 17 | 70.9 | |
| Bauchspeicheldrüse | 9 | 10.9 | 74 | 89.2 | |
| Stufe T (n=109) | 0,587 | ||||
| T1 | 3 | 25.0 | 9 | 75.0 | |
| T2 | 5 | 12.5 | 35 | 87.5 | |
| T3 | 4 | 19.0 | 17 | 81.0 | |
| T4 | 2 | 8.0 | 23 | 92.0 | |
| Tx | 2 | 18.2 | 9 | 81.8 | |
| Stufe N (n=109) | 0,830 | ||||
| N0 | 4 | 11.4 | 31 | 88.6 | |
| N1 | 6 | 17.6 | 28 | 82.4 | |
| N2 | 1 | 16.7 | 5 | 83.3 | |
| Nx | 5 | 14.7 | 29 | 85.3 | |
| Stufe M (n=106) | 0,132 | ||||
| M0 | 8 | 11.3 | 63 | 88.7 | |
| M1 | 9 | 25.7 | 26 | 74.3 | |
| Mx | 0 | – | 5 | 100.0 | |
| Allgemeine Stufe (n=107) | 0,133 | ||||
| 1 | 2 | 12.5 | 14 | 87.5 | |
| 2 | 5 | 15.6 | 27 | 84.4 | |
| 3 | 1 | 4.0 | 24 | 96.0 | |
| 4 | 9 | 26.5 | 25 | 73.5 | |
| MTX (n=34) | 0,645 | ||||
| Leber | 7 | 30.4 | 16 | 69.6 | |
| Lymphknoten | 3 | 60.0 | 2 | 40.0 | |
| Peritoneum | 1 | 25.0 | 3 | 75.0 | |
| Andere | 1 | 20.0 | 4 | 80.0 | |
| Ort: Tumorkopf | 0,186 | ||||
| Ja | 12 | 13.2 | 79 | 86.8 | |
| Ort: Tumor Schwanz | 0,071 | ||||
| Ja | 3 | 42.9 | 4 | 57.1 | |
| Ort: Tumor körper | 1,000 | ||||
| Ja | 4 | 16.0 | 21 | 84.0 | |
*Fishers genauer Test
#DPT: Duodenopanatomie
Tabelle 3 zeigt die p-Werte und Assoziationen von Variablen mit Intensität, wenn DIE CD133-Färbung positiv war. Durch Fishers exakten Test (P = 0,036) zeigte nur Stufe M eine signifikante Assoziation mit der Intensität von CD133; das heißt, Tumoren, die bereits metastasiert haben, sind stark für CD133 gefärbt.
Tabelle 3. P-Werte der Assoziation mit Intensität.
| Variablen | Gruppen |
p-Wert* | ||
| IHC CD133 –
Intensität bei positivem |
IHC CD24 –
Intensität bei positivem |
IHC OCT4 –
Intensität bei positivem |
||
| Sex | Weiblich | 0,222 | 0,438 | 0,619 |
| Männlich | ||||
| Tod |
Nein | 1,000 | 0,235 | 0,627 |
| Ja | ||||
| Chirurgische Behandlung |
Palliative | 0,815 | 0,732 | 0,620 |
| Cir. Teilweise | ||||
| Dpt # | ||||
| Palliativbehandlung | Nein | 0,136 | 0,027 | 0,619 |
| Ja | ||||
| Grad der Differenzierung | Gut differenziert | 0,266 | 0,442 | 0,407 |
| Mäßig differenziert | ||||
| Schlecht differenziert | ||||
| Probe/Probe | Metastase | 0,848 | 0,201 | 0,488 |
| Bauchspeicheldrüse | ||||
| Stufe T | T1 | 0,611 | 0,992 | 1,000 |
| T2 | ||||
| T3 | ||||
| T4 | ||||
| Tx | ||||
| Stufe N | N0 | 0,560 | 0,920 | 0,180 |
| N1 | ||||
| N2 | ||||
| Nx | ||||
| Stufe M | M0 | 0,036 | 0,350 | 0,078 |
| M1 | ||||
| Mx | ||||
| Allgemeine Bühne |
1 | 0,337 | 0,380 | 0,218 |
| 2 | ||||
| 3 | ||||
| 4 | ||||
| MTX | Leber | 0,094 | 0,037 | 1,000 |
| Peritoneum | ||||
| Lymphknoten | ||||
| Andere | ||||
*Fishers genauer Test
#DPT: Duodenopanatomie
CD24 IMMUNOSTAINING IN CANCER STEM CELLS IN PANCREATIC DUCTAL ADENOCARCINOMA CELLS
CD24-Immunostainierung (Abbildungen 2A und 2B) war in der Plasmamembran und im Zytoplasma sowohl schwach als auch mäßig (41,6%) und stark (58,3%) intensitätsweise, aber mit einer schwächeren Intensität im Vergleich zu CD133 (Abbildungen 2C und 2D). Die positiven und negativen Reaktionen wurden mit der in der Studie verwendeten positiven Kontrolle (Plazenta) bestätigt. Tabelle 4 zeigt die beschreibende Analyse der Variablen zusammen mit der Überprüfung ihrer Assoziation mit CD24 Positivität, die durch Fishers genauen Test gegeben wird. Ein positives CD24-Signal wurde bei 98,3% der Männer beobachtet, aber es gab keinen Zusammenhang zwischen Geschlecht und CD24-Positivität (P = 0,343). Nur die Art der entnommenen Probe und die palliative Behandlung waren signifikant mit dem CD24-Signal assoziiert, bei einem Signifikanzniveau von 5% (P = 0,010 bzw. 0,042).
Tabelle 4. Zuordnung von Variablen mit positivem CD24.
| IHC CD24 positiv | p-Wert* | ||||
| Nein | Ja | ||||
| N | % | N | % | ||
| Sex | 0,343 | ||||
| Weiblich | 3 | 5.7 | 50 | 94.3 | |
| Männlich | 1 | 1.7 | 58 | 98.3 | |
| Alter | 0,159 | ||||
| 35-59 Jahre | 3 | 8.1 | 34 | 91.9 | |
| 60-69 Jahre | 0 | – | 40 | 100.0 | |
| 70-93 Jahre | 1 | 2.9 | 34 | 97.1 | |
| Tod (n=107) | 0,618 | ||||
| Nein | 3 | 5.4 | 52 | 94.6 | |
| Ja | 1 | 1.9 | 51 | 98.1 | |
| Chirurgische Behandlung (n=110) | 0,399 | ||||
| Palliative | 3 | 7.1 | 39 | 92.9 | |
| Teilchirurgie | 0 | – | 20 | 100.0 | |
| Dpt # | 1 | 2.1 | 47 | 97.9 | |
| Palliativbehandlung (n=91) | 0,042 | ||||
| Nein | 3 | 13.6 | 19 | 86.4 | |
| Ja | 1 | 1.4 | 68 | 98.6 | |
| Differenzierungsgrad (n=108) | 1,000 | ||||
| Gut differenziert | 0 | – | 3 | 100.0 | |
| Mäßig differenziert | 3 | 4.4 | 65 | 95.6 | |
| Schlecht differenziert | 1 | 2.7 | 36 | 97.3 | |
| Probe/Probe (n=108) | 0,010 | ||||
| Metastase | 1 | 4.0 | 23 | 95.9 | |
| Bauchspeicheldrüse | 2 | 2.4 | 82 | 97.6 | |
| Stufe T (n=110) | 0,705 | ||||
| T1 | 0 | – | 12 | 100.0 | |
| T2 | 1 | 2.4 | 40 | 97.6 | |
| T3 | 1 | 4.8 | 20 | 95.2 | |
| T4 | 1 | 4.0 | 24 | 96.0 | |
| Tx | 1 | 9.1 | 10 | 90.9 | |
| Stufe N (n=110) | 0,881 | ||||
| N0 | 1 | 2.9 | 34 | 97.1 | |
| N1 | 2 | 5.9 | 32 | 94.1 | |
| N2 | 0 | – | 7 | 100.0 | |
| Nx | 1 | 2.9 | 33 | 97.1 | |
| Stufe M | 1,000 | ||||
| M0 | 3 | 4.2 | 69 | 95.8 | |
| M1 | 1 | 2.9 | 34 | 97.1 | |
| Mx | 0 | – | 5 | 100.0 | |
| Allgemeine Stufe (n=108) | 0,913 | ||||
| 1 | 1 | 6.2 | 15 | 93.8 | |
| 2 | 1 | 3.1 | 31 | 96.9 | |
| 3 | 1 | 3.8 | 25 | 96.2 | |
| 4 | 1 | 2.9 | 33 | 97.1 | |
| MTX (n=37) | 1,000 | ||||
| Leber | 1 | 4.3 | 22 | 95.7 | |
| Lymphknoten | 0 | – | 5 | 100.0 | |
| Peritoneum | 0 | – | 4 | 100.0 | |
| Andere | 0 | – | 5 | 100.0 | |
| Ort: Tumorkopf | 0,550 | ||||
| Ja | 3 | 3.3 | 89 | 96.7 | |
| Ort: Tumor Schwanz | 1,000 | ||||
| Ja | 0 | – | 7 | 100.0 | |
| Ort: Tumor körper | 1,000 | ||||
| Ja | 1 | 4.0 | 24 | 96.0 | |
*Fishers genauer Test
#DPT: Duodenopanatomie
Keine CD24-Immunreaktivität wurde im normalen pankreatischen duktalen Epithel beobachtet. Bei 98,6% der Patienten, die sich einer palliativen Behandlung unterziehen, wurde ein positives CD24-Signal beobachtet, was signifikant war (P = 0,042). Aufgrund ihrer fortgeschrittenen Tumor-Inszenierung hatten sie ein stärkeres CD24-Signal im Vergleich zu Personen, die eine totale Duodenopanatoktomie erlitten. Das CD24-Signal war stärker bei Personen, die sich einer palliativen Behandlung als Behandlungsoption unterzog (98,6%) im Vergleich zu denjenigen, die dies nicht taten (13,6 %).
Der Grad der Tumordifferenzierung und -inszenierung zeigte keinen signifikanten Zusammenhang mit CD24-positiver Färbung, noch gab es signifikante Unterschiede zwischen schlecht differenzierten oder fortgeschrittenen Tumoren im Vergleich zu gut differenzierten und frühstufigen Tumoren in Bezug auf positive CD24.
Tabelle 3 zeigt die Zuordnung von Variablen mit der Intensität, wenn CD24 positiv war. Nur das Vorhandensein von Metastasen (MTX) war signifikant mit der Intensität verbunden, wo die Leber und Peritoneum eine starke Positivität im Vergleich zu Metastasen an anderen Stellen, wie Lymphknoten und anderen Geweben, zeigten.
OCT4 IMMUNOSTAINING IN CANCER STEM CELLS IN PANCREATIC DUCTAL ADENOCARCINOMA CELLS
Die OCT4-Immunfärbung zeigte ein anderes Muster im Vergleich zu den anderen getesteten Antikörpern. Die Häufigkeit positiver Fälle war nicht so hoch wie bei den beiden anderen getesteten Antikörpern, aber wenn positiv, war ihre Intensität sehr stark (Abbildungen 1E und 1F). Immunostaining trat in 31,5% der Fälle im Tumorzellkern auf und färbte 68,7% der analysierten Tumoren nicht. Keine OCT4-Immunreaktivität wurde im normalen pankreatischen duktalen Epithel beobachtet. Keine Variable wurde signifikant mit OCT4-Signal assoziiert, bei 5% Signifikanzniveau. Das Durchschnittsalter der OCT4-positiven Gruppe betrug 62,62 Jahre und 63,23 Jahre in der OCT4-negativen Gruppe. Es gab jedoch keinen signifikanten Unterschied zwischen den Altersgruppen in Bezug auf das Alter (P = 0,547).
Obwohl statistisch nicht signifikant, ist ein interessanter Befund aus der OCT4-Färbungsanalyse, dass je differenzierter der Tumor, desto größer die Färbeintensität, während schlecht differenzierte Tumoren eine geringe Färbeintensität hatten (66,6% vs. 21,6%). Zellen, die für OCT4 positiv sind, haben ein größeres Differenzierungspotenzial.
ÜBERLEBENSANALYSE
Über Überlebenskurven und deren Verhältnis zu den drei Markern zeigten alle Gruppen sehr ähnliche Kurven, so dass der Log-Rank-Test keinen signifikanten Unterschied zwischen den Kurven in Bezug auf positive Signale der drei Antikörper anzeigt. Die Kaplan-Meier-Kurven für CD133, CD24 und OCT4-Intensität, die durch die Log-Rank-Test-p-Werte bestätigt werden, unterscheiden sich keine der Überlebenskurven hinsichtlich der Intensität signifikant. Daher ändert die Positivität der Marker nichts am Überleben der in der Studie enthaltenen Patienten.
DISKUSSION
CSCs wurden in letzter Zeit mit der Krebsprogression in Verbindung gebracht und verwendet, um die prognostischen Faktoren und Therapieziele bei verschiedenen Krebsarten zu identifizieren (DEAN et al., 2005). Es ist bemerkenswert, dass die Rolle von CSCs bei Bauchspeicheldrüsenkrebs nicht gut verstanden oder charakterisiert ist. Darüber hinaus wurden nur wenige Berichte über die Muster und Auswirkungen des Vorhandenseins von CSCs veröffentlicht. Angesichts dieses Mangels an Daten analysierten wir retrospektiv die Expression von CSCs in Proben von Bauchspeicheldrüsenkrebs unter Verwendung der Immunhistochemie und überprüften seine Rolle bei der Tumorprogression und therapeutischen Resistenz bei duktalen Pankreasadenokarzinom.
Die Molekularbiologie von Bauchspeicheldrüsenkrebs steht in direktem Zusammenhang mit seinem schnellen Fortschreiten und seiner geringen therapeutischen Reaktion. Es ist gut dokumentiert, dass das Auftreten einer Tumorzelle das Ergebnis einer Anhäufung von Mutationen in ihrer DNA ist, die in der Lage sind, sie morphologisch und funktionell zu verändern (FANG et al., 2013; RICCI-VITIANI et al., 2007). Der Auslöser dieses Prozesses und seiner gesamten Entwicklung, die in der Bildung der Tumorzelle und ihrer relevanten Eigenschaften gipfelt, charakterisiert den Karzinogenese-Prozess, ist bereits bei verschiedenen Arten von Neoplasie signifikant aufgeklärt. Bei bestimmten Krebsarten wie Bauchspeicheldrüsenkrebs bleibt der Prozess jedoch ungewiss (KOBAYASHI; NORONHA, 2015).
Die meisten bösartigen Tumoren folgen einer Natürlichen Geschichte, die in vier Stadien unterteilt werden kann: bösartige Transformation, Tumorzellwachstum, lokale Invasion und Metastasierung. Der Prozess der Karzinogenese, oder bösartige Transformation, tritt in verschiedenen Stadien und Ergebnissen aufgrund der Anhäufung von genetischen Veränderungen und Mutationen, die durch mehrere Faktoren ausgelöst werden, einschließlich Umweltfaktoren wie Strahlung und Chemikalien (AYOB; RAMASAMY, 2018). Damit dieser Prozess der Karzinogenese voranschreitet, kann es jedoch notwendig sein, bestimmte Zellen mit den Stammzelleigenschaften, wie das Potenzial für Selbsterneuerung und Regeneration, sowie einen hohen proliferativen Index zu haben.
Jüngste Erkenntnisse deuten darauf hin, dass Stammzellen nicht nur bei der Erzeugung und Erhaltung verschiedener Gewebe, sondern auch bei der Entwicklung und Progression bestimmter Tumorarten eine entscheidende Rolle spielen (BALIC et al., 2012). Bei mehreren soliden Tumoren wurde gezeigt, dass sie eine ausgeprägte Subpopulation von Tumorzellen mit Stammzelleigenschaften beherbergen und daher Tumorstammzellen (CTTs) oder tumorgenen Zellen (MATSUDA et al., 2012). Krebsstammzellen scheinen in der Lage zu sein, das Tumorwachstum bei soliden Tumoren zu initiieren und anzukurbeln. CD133, CD24 und OCT4 werden kürzlich als prospektive Marker für CSCs gemeldet, die in einer Vielzahl von Tumoren exprimiert werden; Unserer Kenntnis nach wurde jedoch kein Versuch unternommen, ihre Expression in Proben von Bauchspeicheldrüsenkrebs zu erkennen (MAEDA et al., 2008).
Es kann beobachtet werden, dass Tumorstammzellen oder Tumorstammzelloberflächenmarker wie CD133, CD24 und OCT4 in Bauchspeicheldrüsenkrebstumorzellen vorhanden sind, was die intrinsische Beziehung zwischen dem pankreatischen bösartigen Phänotyp und dem Vorhandensein von Stammzellen bestätigt. Es wurde kein signifikanter Unterschied zwischen der Antikörperexpression und dem Grad der Tumordifferenzierung beobachtet, vorausgesetzt, dass Tumorstammzellen seit der Tumorinitiierung vorhanden sind. Es sollte beachtet werden, dass bei CD133- und CD24-Antikörpern der Prozentsatz der markerexektierenden Tumorzellen mit fortschreitendem Verlauf des Tumors zunahm. Daher zeigten die aggressiveren, schlecht differenzierten Tumoren eine größere Positivität für das Vorhandensein des Antikörpers. Während auf der anderen Seite, die Expression des OCT4-Antikörpers war höher und intensiver in gut differenzierten Tumoren; Je differenzierter der Tumor also ist, desto größer ist die Etikettierung. Zellen, die den Stammzellmarker für den OCT4-Antikörper haben, haben ein höheres Differenzierungspotenzial (VILLODRE et al., 2016). Dies mag der Grund dafür sein, dass OCT4 sich in Bezug auf die Expression von den anderen getesteten Markern unterscheidet, obwohl diese Unterschiede statistisch nicht signifikant waren.
OCT4-Marker ist nur in Tumorproben, die positiv waren, fokal vorhanden. Dieser Befund stimmt mit der Theorie überein, dass CSCs nur einen sehr kleinen Teil der gesamten Tumorzellpopulation ausmachen (PHI et al., 2018). Zum Beispiel wurden CD133-positive Zellen bei 0,7-6,1% nachgewiesen (RICCI-VITIANI et al., 2007), 1.8-24.5% (O’BRIEN et al., 2007) der primären Dickdarmkrebszellen und in 0,7-3,2 % der primären Bauchspeicheldrüsenkrebszellen mittels zytometrischer Flussanalyse (HERMANN et al., 2007). Immunhistochemische Färbung ergab CD133-Expression in 1-3% der hepatozellulären Karzinom-Proben (MA et al., 2007).
Obwohl Etikettierung und Expression mit einer relativ hohen Häufigkeit in allen Graden der Tumorrichtung beobachtet wurden, z. B. Tumoren, die unabhängig vom Grad der Differenzierung als Etikettierung für Krebsstammzellen ausgedrückt wurden, begünstigen einige Ergebnisse die Hypothese, dass die Anzahl der Stammzellen in Tumoren bei Tumoren mit aggressiverem Verhalten und schlechterer Prognose größer ist. Diese Hypothese wird durch die Tatsache gestützt, dass CD133 häufiger bei Personen ausgedrückt wurde, die sich nur einer palliativen Behandlung unterzogen haben (95,1%). mit einem signifikanten Zusammenhang (p-Wert < 0,05) zwischen dem Vorhandensein von Antikörpern und palliativer Behandlung. Wenn berichtet wird, dass ein Patient nur einer palliativen Behandlung unterzogen wurde, wird angenommen, dass sich der Tumor in einem signifikant fortgeschrittenen Stadium befand und keine Möglichkeit eines kurativen chirurgischen Eingriffs und daher nur eine palliative Behandlung durchgeführt wurde. In ähnlicher Weise kann überbewertet werden, dass die aggressiveren Tumoren in späteren Stadien eine stärkere Kennzeichnung für den CD133 Tumorstammzellantikörper ausdrücken. Mehrere klinische Studien haben den Zusammenhang zwischen der CD133-Expression und den klinischen Ergebnissen von Tumoren untersucht; Die Ergebnisse sind jedoch umstritten. Zum Beispiel ist die CD133-Expression mit der schlechten Prognose von Dickdarmkrebs und Hepatokarzinom (CAI et al., 2018).
In Bezug auf die TNM-Stufe änderte sich die Kennzeichnung der drei Antikörper (CD133, CD24 und OCT4) während der Progression nicht. Bemerkenswert ist, dass die Tumorstammzellen vom frühesten Stadium an vorhanden waren und sich während der Inszenierung nicht vergrößern. Die Prävalenz der drei Antikörper und ihre Assoziationen mit den Variablen waren im Allgemeinen hoch, obwohl nicht alle Antikörper ein Signifikanzniveau hatten, das niedriger war als P < 0,05.
Alle Variablen, die zu einer ungünstigen Prognose beigetragen haben, wie die Lage des Bauchspeicheldrüsenkopftumors, das fortgeschrittene Alter und das Vorhandensein von Metastasen waren alle mit einer hohen Prävalenz verbunden, insbesondere für die Expression von CD133 und CD24. Darüber hinaus bestätigte dies mit der Idee, dass Tumorstammzellen, wenn vorhanden, mit einer schnellen Tumorprogression und therapeutischen Resistenz in Verbindung gebracht werden. Krebsstammzellen haben bestimmte Merkmale, die denen normaler Organismusstammzellen ähneln, wie die Fähigkeit zur Selbstregenerierung und Pluripotenz, wodurch heterogene Tumorzelllinien entstehen, die denselben Tumor bilden (TAI et al., 2005). Krebsstammzellen haben wahrscheinlich viele der Eigenschaften normaler Stammzellen, die eine lange Lebensdauer bieten, einschließlich relativer Ruhe, Resistenz gegen Medikamente und Toxine durch die Expression mehrerer Transporter, eine aktive DNA-Reparaturkapazität und eine Resistenz gegen Apoptose. Daher könnten Tumore eine eingebaute Population von medikamentenresistenten pluripotenten Zellen haben, die eine Chemotherapie überleben und den Tumor wieder bevölkern können (MARQUES et al., 2010).
Um zu definieren, ob CSCs das klinische Ergebnis vorhersagten, führten wir eine Kaplan-Meier-Überlebensanalyse durch und zeigten, dass die Gruppen sehr ähnliche Kurven aufwiesen. Daher weist der Log-Rank-Test nicht auf einen signifikanten Unterschied zwischen den Kurven in Bezug auf das Vorhandensein der drei Antikörper hin. Obwohl sie mit schlechteren prognostischen Variablen wie Metastasierung und therapeutischen Optionen für palliative Behandlungen in Verbindung gebracht werden, kann in diesem Fall kein Zusammenhang zwischen dem Vorhandensein von Tumorstammzellen und dem Überleben des Patienten hergestellt werden; Daher sagt das Vorhandensein von CSCs kein schlechteres Überleben voraus.
Die Entdeckung von Krebsstammzellen bei soliden Tumoren hat unsere Sicht auf die Karzinogenese verändert. Dass Tumorstammzellen an der Tumorentwicklung und -progression beteiligt sind, ist eine Tatsache, da ihre Anwesenheit in der überwiegenden Mehrheit der analysierten Gewebe signifikant war und in letzter Zeit viele Studien das Vorhandensein von Tumorstammzellen mit der Entwicklung mehrerer Krebsarten in Verbindung gebracht haben.
ENDGÜLTIGE ÜBERLEGUNGEN
Der Prozess der Tumorgenese, soweit das Thema bisher bekannt ist, beinhaltet den fortschreitenden Erwerb von multiplen aberranten Mutationen, die in der Ausdehnung und Proliferation aggressiverer Zellsubpopulationen gipfeln und zur Tumorprogression und zum Wachstum beitragen. Obwohl diese Theorie gut etabliert ist, ist die Identifizierung von Zellen, die in der Lage sind, die Tumorprogression zu verursachen, immer noch Gegenstand vieler Studien, um den Karzinogenese-Prozess besser zu charakterisieren und diese Zellen zu identifizieren.
Ein Großteil der Informationen, die wir für die Diagnose, Prognose und Behandlung von Pankreas-Neoplasmen erhalten und verwenden, stammt aus heterogenen Populationen mit unterschiedlichem Reifegrad und Differenzierung. Es wird immer dringlicher, die CSCs für die Bewertung und Charakterisierung des krebserregenden Weges der aggressivsten Tumoren zu charakterisieren. Die direkte Folge ist die Entwicklung therapeutischer Strategien, die auf CSCs wirken können, und die Möglichkeit, anhand einer leicht zugänglichen Methode zu bestimmen, welche Patienten am meisten von dieser Art der Behandlung profitieren werden.
VERWEISE
ALLEGRA, E.; TRAPASSO, S. Cancer stem cells in head and neck cancer. Onco Targets Ther., v.5, p.375-83, 2012.
ANSARI, D.; CHEN, B.C.; DONG, L.; ZHOU, M.T.; ANDERSSON, R. Pancreatic cancer: translational research aspects and clinical implications. World J Gastroenterol., v.18, n.13, p.1417-24, 2012.
AYOB, A.Z.; RAMASAMY, T.S. Cancer stem cells as key drivers of tumour progression. J Biomed Sci., v.25, n.20, 2018.
BALIC, A.; DORADO, J.; ALONSO-GÓMEZ, M.; HEESCHEN, C. Stem cells as the root of pancreatic ductal adenocarcinoma. Exp Cell Res., v.318, n.6, p.691-704, 2012.
BARBOSA, I.R.; SANTOS, C.A.; SOUZA, D.L.B. Pancreatic cancer in Brazil: mortality trends and projections until 2029. Arq. Gastroenterol., v.55, n.3, p.230-6, 2018.
CAI, X.; LI, J.; YUAN, X.; XIAO, J.; DOOLEY, S.; WAN, X., WHENG, W.; LU, L. CD133 expression in cancer cells predicts poor prognosis of non-mucin producing intrahepatic cholangiocarcinoma. J Transl Med., v.16, n.50, 2018.
DEAN, M.; FOJO, T.; BATES, S. Tumour stem cells and drug resistance. Nat Rev Cancer., v.5, n.4, p.275-84, 2005.
FANG, Y.; YAO, Q.; CHEN, Z.; XIANG, J.; WILLIAM, F.E.; GIBBS, R.A.; CHEN, C. Genetic and molecular alterations in pancreatic cancer: implications for personalized medicine. Med Sci Monit., v.19, p.916-26, 2013.
HERMANN, P.C.; HUBER, S.L.; HERRLER, T.; AICHER, A.; ELLWART, J.W.; GUBA, M.; BRUNS, C.J.; HEESCHEN, C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell., v.1, n.3, p.313-23, 2007.
HU, Y.; FU, L. Targeting cancer stem cells: a new therapy to cure cancer patients. Am J Cancer Res., v.2, n.3, p.340-56, 2012.
KOBAYASHI, N.C.C.; NORONHA, S.M.R. Cancer stem cells: a new approach to tumor development. Rev Assoc Med Bras., v.61, n.1, p.86-93, 2015.
KONONEN, J.; BUBENDORF, L.; KALLIONIMENI, A.; BÄRLUND, M.; SCHRAML, P.; LEIGHTON, S.; TORHORST, J.; MIHATSCH, M.J.; SAUTER, G.; KALLIONIMENI, O.P. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med., v.4, n.7, p.844-7, 1998.
LI, D.; JIAO, L. Molecular epidemiology of pancreatic cancer. Int J Gastrointest Cancer., v.33, n.1, p.3-14, 2003.
MA, S.; CHAN, K.W.; HU, L.; LEE, T.K.W.; WO, J.Y.H.; NG, I.O.L.; ZHENG, B.J.; GUAN, X.Y. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, v.132, n.7, p.2542-56, 2007.
MAEDA, S.; SHINCHI, H.; KURAHARA, H.; MATAKI, Y.; MAEMURA, K.; SATO, M.; NATSUGOE, S.; AIKOU, T.; TAKAO, S. CD133 expression is correlated with lymph node metastasis and vascular endothelial growth factor-C expression in pancreatic cancer. Br J Cancer., v.98, n.8, p.1389-97, 2008.
MARQUES, D.S.; SANDRINI, J.Z.; BOYLE, R.T.; MARINS, L.F.; TRINDADE, G.S. Relationships between multidrug resistance (MDR) and stem cell markers in human chronic myeloid leukemia cell lines. Leuk Res., v.34, n.6, p.757-62, 2010.
MATSUDA, Y.; KURE, S.; ISHIWATA, T. Nestin and other putative cancer steam cell markers in pancreatic cancer. Med Mol Morphol., v.45, n.2, p.59-65, 2012.
O’BRIEN, C.A.; POLLETT, A.; GALLINGER, S.; DICK, J.E. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature, v.445, n.7123, p.106-10, 2007.
PHI, L.T.H.; SARI, I.N.; YANG, Y.G.; LEE, S.H.; JUN, N.; KIM, K.S.; LEE, Y.K.; KWON, H.Y. Cancer Stem Cells (CSCs) in Drug Resistance and their Therapeutic Implications in Cancer Treatment. Stem Cells Int., n.5416923, 2018.
RICCI-VITIANI, L.; LOMBARDI, D.G.; PILOZZI, E.; BIFFONI, M.; TODARO, M.; PESCHLE, C.; DE MARIA, R. Identification and expansion of human colon-cancer-initiating cells. Nature, v.445, p.111-5, 2007.
SAKORAFAS, G.H.; TSIOTOU, A.G.; TSIOTOS, G.G. Molecular biology of pancreatic cancer; oncogenes, tumor suppressor genes, growth factors, and their receptors from a clinical perspective. Cancer Treat Rev., v.26, n.1, p.29-52, 2000.
SOTO, J.L.; BARBERA, V.M.; SACEDA, M.; CARRATO, A. Molecular biology of exocrine pancreatic cancer. Clin Transl Oncol., v.8, p.306-12, 2006.
TAI, M.H.; CHANG, C.C.; OLSON, L.K.; TROSKO, J.E. Oct4 expression in adult human stem cells: evidence in support of the stem cell theory of carcinogenesis. Carcinogenesis, v.26, n.2, p.495-502, 2005.
VILLODRE, E.S.; KIPPER, F.C.; PEREIRA, M.B.; LENZ, G. Roles of OCT4 in tumorigenesis, cancer therapy resistance and prognosis. Cancer Treat Rev., v.51, S.1-9, 2016.
[1]MSc in Medical Sciences, Postgraduate Program in Medicine: Medical Sciences, Federal University of Rio Grande do Sul (UFRGS), Brasilien.
[2] PhD in Physiologischewissenschaften, Federal University of Rio Grande (FURG), Brasilien.
[3] MSc in Genetik und Molekularbiologie, Federal University of Rio Grande do Sul (UFRGS), Brasilien.
[4] Medizinstudium an der Federal University of Rio Grande (FURG), Brasilien.
[5] PhD in Biological Sciences (Biochemistry) an der Federal University of Rio Grande do Sul (UFRGS), mit Sandwich-Doktortitel in Neurowissenschaften – University of California Irvine.
Eingereicht: September 2020.
Genehmigt: Oktober 2020.