ARTÍCULO DE REVISIÓN
TAVARES, Marcela Marçolla [1]
TAVARES, Marcela Marçolla. Uso de coloides y cristaloides en el período perioperatorio de pacientes graves: Controversias. Revista científica multidisciplinaria base de conocimiento. Año 05, Ed. 01, Vol. 01, págs. 05-21. Enero de 2020. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/salud/coloides-y-cristaloides
RESUMEN
Como el manejo del reemplazo de fluidos influye en el pronóstico del paciente, la investigación básica y clínica ha abordado los diversos aspectos que contribuyen a la administración de fluidos y volumen en el período perioperatorio. Todavía no hay consenso sobre cuándo y en quién indicar la optimización hemodinámica perioperatoria. No se resolvieron problemas adicionales como el papel relativo de la optimización de la relación cristaloides frente a los coloides. Este trabajo consiste en una revisión de la literatura, realizada entre febrero y octubre de 2019, en la que se realizó una consulta a diversas publicaciones científicas, presentes en Internet, a través de consultas en las bases de datos: ScienceDirect, UptoDate, Medline/PubMed, Lilacs, sciELO, con los términos Perioperative Fluid therapy, Hemodinámica, Reposición de Volumen, Crystalloid, Colloid. A partir de esto, se observó que los fluidos deben aplicarse como cualquier otro medicamento, respetando sus indicaciones y limitaciones individuales, que es la base del concepto de Terapia guiada por objetivos, un nuevo concepto que fomenta el encuadre del paciente de los criterios de inclusión para la optimización de fluidos. Refiriéndose a esto, los aspectos ventajosos del reemplazo de volumen perioperatorio con soluciones iso-oncóticas son comprensibles, aunque se necesitan ensayos controlados aleatorios adicionales para demostrar su relevancia para el resultado.
Palabras clave: Terapia de fluidos perioperatorio, hemodinámica, reemplazo de volumen.
1. INTRODUCCIÓN
Como el manejo del reemplazo de fluidos influye en el pronóstico del paciente, la investigación básica y clínica ha abordado los diversos aspectos que contribuyen a la administración de fluidos y volumen en el período perioperatorio. La investigación básica mejoró el conocimiento sobre la función de la barrera vascular endotelial y sus alteraciones funcionales responsables de la extravasación vascular. Los estudios clínicos que proclaman diferentes enfoques para el control de fluidos han mostrado resultados contradictorios y, en la mayoría de los casos, no se refieren a la base fisiológica de la barrera vascular. Sobre la base del metaanálisis de los últimos 30 años, se han realizado una serie de estudios realizados para reducir la mortalidad y la morbilidad quirúrgica mediante la manipulación deliberada y preventiva de la hemodinámica perioperatoria, evidenciando una tendencia de la comunidad científica a aclarar si la optimización hemodinámica es realmente beneficios[2]a.
Es responsable de estudios que se centraron principalmente en objetivos clínicos para guiar la terapia volumétrica en el período perioperatorio. Sin embargo, un razonamiento debe derivarse generalmente de hechos fisiológicos y estudios significativos y comparables. Por lo tanto, esta revisión resume los conocimientos relevantes sobre el efecto de los diferentes fluidos intravenosos y sobre la monitorización hemodinámica. Como todavía no hay consenso sobre este tema de gran interés para todos los anestesiólogos, el objetivo de este artículo es aclarar algunas ventajas y desventajas de los principales fluidos utilizados en la sustitución del volumen perioperatorio.
El papel relativo de optimizar la relación cristaloides versus coloides, aunque no se resuelve, hay evidencia que favorece soluciones equilibradas con una concentración de electrolitos similar a la que se encuentra en el plasma, y se deben evitar grandes volúmenes de solución salina, ya que inducen acidosis hiperclorémic[3]a.
2. MATERIAL Y MÉTODOS
Este trabajo consiste en una revisión de la literatura, realizada entre febrero y octubre de 2019, en la que se realizó una consulta a diversas publicaciones científicas, presentes en Internet, a través de una búsqueda, desde las bases de datos de ScienceDirect, UptoDate, Medline/PubMed, Lilacs, sciELO, principalmente con los términos Terapia fluida perioperatoria, Hemodinámica, Reposición volémica, Crystalloide, Colloid.
Los criterios para la inclusión en este estudio fueron los artículos científicos que describen las principales diferencias entre coloides y cristaloides, así como sus principales indicaciones en el período perioperatorio. Se revisaron varias modalidades de estudios entre 1980 y 2019, incluyendo estudios prospectivos aleatorios y multicéncionales, metaanálisis, estudios observacionales retrospectivos y revisiones de la literatura.
3. REVISIÓN
3.1 LA FISIOLOGÍA DE LA COMPARTIMENTACIÓN DE FLUIDOS
El agua corporal total para un individuo de 75 kg es de aproximadamente 45 L (60%). Dos tercios de esto (30 L) es agua intracelular. El tercio restante (15 L) en el compartimento extracelular se divide entre los compartimentos intravasculares (3 L) y extravasculares (12 L) (Fig. 1[4]). El volumen intravascular total es de aproximadamente 5 L y tiene componentes celulares (glóbulos rojos y blancos y plaquetas: 4[2 L]0%) y no celulares (plasma: 60%[3 L]). El plasma es una solución acuosa de iones inorgánicos (predominantemente cloruro de sodio), moléculas simples como la urea y moléculas orgánicas más grandes como la albúmina y las globulinas.
FIGURA 01: Modelo explicativo de distribución de fluidos en el cuerpo

Como se muestra en la Figura 01, se observa que una gran parte del volumen líquido se concentra en el medio intracelular, que se compone de solución de glicosato.
El aumento de la permeabilidad vascular debido a la activación inflamatoria con deterioro de la función celular endotelial puede ocurrir por una variedad de razones durante procedimientos quirúrgicos más grande[5]s. Específicamente, el traumatismo del tejido quirúrgico, la hipoperfusión tisular debido a una terapia fluida inadecuada, lesión/reperfusión de isquemia, sepsis (local o sangre) y el uso de bypass cardiopulmonar (por ejemplo, bypass cardiopulmonar) se reconocen como estímulos inflamatorios que pueden comprometer la función vascular[6].
3.2 REEMPLAZO DE VOLUMEN
El reemplazo de volumen debe indicarse siempre que sea necesario: 1) reemplazar la pérdida de sangre durante la cirugía, 2) Reemplazar las pérdidas por sudoración y producción de orina 3) Cirugías intestinales preoperatorias y 4) mantenimiento de pérdidas de tercer espacio[7].
Se entiende por tercer espacio como un término propuesto por Randall en 1952, para describir la situación en la que el líquido extracelular se pierde o se secuestra en una zona del cuerpo donde no participa en los intercambios, y por lo tanto no satisface las necesidades de agua del pacient[8]e.
3.3 ESTRATEGIA PERIOPERANTE DE HEMODINÁMICAMENTE OPTIMIZADA
Los pacientes que podrían beneficiarse de esta terapia son aquellos con alto riesgo de acuerdo con el índice de riesgo cardíaco revisado y la prueba de ejercicio cardiopulmonar preoperator[6]i[9]o,[10]
Según una revisión sistemática de la literatura sobre la optimización perioperatoria en pacientes con alto riesgo quirúrgico, se encontraron factores importantes que ayudarían a identificar a los pacientes que se beneficiarían más de la optimización de líquidos perioparatorio[11]s. Los resultados se describen en la Tabla 01, basada en los estudios de Mangano et al. (1996), Poldermans et al. (1999) y Shoemaker et al. (1988).
TABLA 01 – Criterios de inclusión para la optimización perioperatoria
| Histórico de enfermidade cardíaca ou pulmonar severa, como por exemplo DPOC, infarto agudo do miocárdio, e insuficiência cardíaca. |
| Cirurgias extensas que envolvam anastomoses do trato gastrointestinal (por exemplo, esofagectomia). |
| Perda massiva e abrupta de sangue (>2,5L) |
| Idade maior ou igual a 70 anos com reserve fisiológica limitada em um ou mais órgãos vitais. |
| Septicemia |
| Insuficiência Respiratória (PaO2 <60 mmHg e FIO2 >0.4) |
| Acometimento abdominal agudo como pancreatite, perfuração de vísceras ou sangramentos do TGI. |
| Insuficiência Renal Aguda |
| Doença vascular em estágio avançado |
Fuente: Tote; Terrenos (2006)
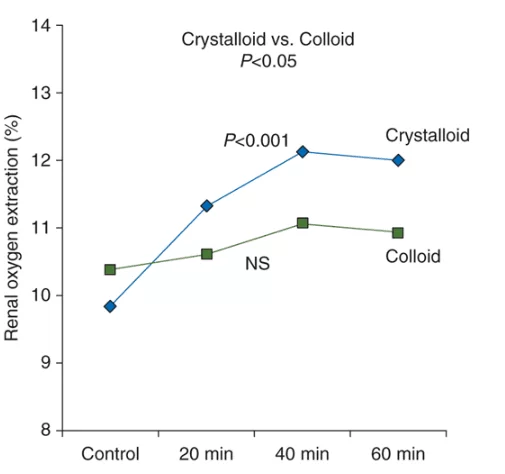
Sobre la base de un estudio en el que participaron 30 pacientes graves que se sometieron a cirugías cardíacas, se evidencó que a pesar del aumento del índice cardíaco y del flujo sanguíneo renal con ambos fluidos, ninguno de los fluidos mejoró la oxigenación renal, debido a que ambos indujeron la hemodilución. GFR aumentó en el cristaloides (28%), pero no en el grupo coloides, como se muestra en la Figura 0[12]2.
El mismo estudio mostró que el uso de cristaloides aumentó la tasa de filtración (24%) así como la extracción de oxígeno renal (23%), incluso sin aumentar el suministro vascular del componente, lo que sugiere que el aumento de la GFR – el principal determinante del consumo de oxígeno – no fue acompañado por un aumento proporcional en la fracción de oxígeno suministrado a los riñones. En otras palabras, sus resultados resumen en el gráfico (figura 02) que el cristaloides aumentó la extracción de oxígeno renal (P <0.001) 20, 40 y 60 min después del bolo, en contraste con el coloides (NS), lo que sugiere deterioro de la oxigenación renal en el segundo caso. El cambio en la extracción de oxígeno renal fue significativamente (P <0.05) más pronunciado en el grupo cristaloides en comparación con el grupo coloid[11]e.
FIGURA 02: Efectos de la perfusión cristalina (10 ml/kg) y coloides (20 ml/kg) en la extracción de oxígeno renal después de una cirugía cardíaca
3.4 EL TIPO DE FLUIDO PARA LA ESTRATEGIA DE OPTIMIZACIÓN HEMODINÁMICA
Numerosas presentaciones de soluciones están disponibles para el reemplazo de volumen, varían según la composición de iones y la presencia o ausencia de compuestos orgánicos. Así que tenemos la presencia de coloides y cristaloides.
Los coloides se consideran expansores plasmáticos porque causan menos pérdida capilar y menos edema pulmonar que los cristaloides. Reducen la expresión de mediadores inflamatorios, mejoran la microcirculación y la oxigenación de los tejidos, y promueven una mayor reanimación de volumen que los cristaloides. Sin embargo, ya se han observado efectos secundarios (CS[5]).
Los cristaloides, por otro lado, salen del compartimento intravascular antes y en mayor cantidad que los coloides y, por lo tanto, un volumen mayor es necesario para reponer los déficits (3 a 4 veces el volumen de cristaloides[6]). Algunas de las principales características de los cristaloides se presentan en las tablas 02 y coloides en la tabla 0[3]3.
TABLA 2 – Cristaloides principales y sus osmolaridades y concentraciones de sodio (Na+) y potasio (K+)
| Cristaloide | Osmolaridade (mOsm/L) | Na+ | K+ |
| Glucose 5% | 252 | — | — |
| Glucose 25% | 1260 | — | — |
| Glucose 50% | 2520 | — | — |
| Sodium chloride 0.9% | 308 | 154.0 | 154.0 |
| Sodium chloride and glucose | 264 | 31.0 | 31.0 |
| Ringer’s solution | 309 | 147.0 | 156.0 |
| Compound sodium lactatea | 278 | 131.0 | 111.0 |
| Plasmalyte B | 298.5 | 140 | 98 |
| Normasol | 280 | 140 | 98 |
Fuente: Adaptado de Grocott. Et al (2005)
En un estudio prospectivo y ciego en pacientes electivos que se sometieron a cirugía no cardíaca, reanimación de líquido intraoperatorio con uso coloide (6% HES), se redujo la incidencia de náuseas y vómitos postoperatorios, dolor intenso, edema periorbital y visión dobl[13]e.
En pacientes sometidos a cirugía abdominal mayor, cuando recibieron cristaloides solos, resultaron en acumulación de líquido intestinal en comparación con aquellos que también recibieron coloides (6% HES[14]). Esto conduce a un aumento del edema tisular. La asociación del edema tisular con la perfusión y la oxigenación deterioradas es controvertida[15]
TABLA 3: Los principales coloides y sus respectivos valores de peso molecular promedio ponderado (PMMP), número molecular medio ponderado (NMMP) y concentraciones de sodio (Na+) y cloro (Cl-)
| Solução | Coloide | PMMP(Da) | NMMP (Da) | Na+(mmol/L) | Cl- (mmol/L) |
| Gelofusine (4%) | Succinylated gelatin | 30,000 | 22,600 | 154 | 125 |
| Haemaccel (3.5%) | Polygeline | 35,000 | 24,300 | 145 | 145 |
| Voluven | Tetrastarch | 130,000 | 60,000 | 154 | 154 |
| Pentaspan | Pentastarch | 264,000 | 63,000 | 154 | 154 |
| HAES-steril 6% or 10% | Pentastarch | 200,000 | 60,000 | 154 | 154 |
| EloHase 6% | Hexastarch | 200,000 | 60,000 | 154 | 154 |
| Hespan 6% | Hetastarch | 450,000 | 70,000 | 150 | 150 |
| Hextend | Hetastarch | 670,000 | 70,000 | 143 | 124 |
| Gentran 40 | Dextran 40 | 40,000 | 25,000 | 154 | 154 |
| Gentran 70 | Dextran 70 | 70,000 | 39,000 | 154 | 154 |
| Rheomacrodex | Dextran 40 | 40,000 | 25,000 | 154 | 154 |
| Macrodex | Dextran 70 | 70,000 | 39,000 | 154 | 154 |
Adaptado de Grocott; Mito, mito, mito. GAN (2005)
Por otro lado, grandes cantidades de solución salina conducen a acidosis hiperclorí[16]mica y el estado de hipercoagulosa a[17]ún más evidenciado que el que normalmente se ve en la infusión de otros cristaloides[18].
3.5 USO RACIONAL DE FLUIDOS EN EL PERÍODO PERIOPERATORIO
Más que el tipo de líquido utilizado, existe una preocupación cada vez más clara para identificar las indicaciones reales de reemplazo de fluidos en el período perioperatorio.
Una de las estrategias más frecuentes es la Terapia Orientada a Objetivos (GOT), que se ha utilizado repetidamente para mejorar significativamente los resultados de la optimización hemodinámica, tanto a corto como a largo plaz[19]o[20], El enfoque TGO se centra en maximizar (optimizar) la salida cardíaca (CO) mediante la administración incremental de fluido[21]s.
El consenso nacional realizado en 2016 concluyó que el éxito en la Terapia Guiada por Objetivos (GOT) y otras estrategias restrictivas de fluidos sugieren que la planificación de fluidos perioperatorios debe enfatizar que la terapia con fluidos se administra sólo cuando hay una indicación[22] clara utilizando los criterios de inclusión presentados en la tabla 01.
Además, en cuanto a la estrategia terapéutica dirigida, hay 9 estudios en los que también se utilizó una estrategia terapéutica dirigida a un objetivo para maximizar las variables hemodinámicas relacionadas con el flujo de pacientes quirúrgicos, intra y postoperatorio[23]s. Los estudios encontraron que la estrategia de tratamiento redujo las complicaciones gastrointestinales y la duración de la estancia hospitalar[24]ia, tanto en el pabellón como en las unidades de cuidados intensivo[25]s.
Concomitantemente con el inicio del tratamiento, es importante destacar que, una vez iniciada, la evaluación de la capacidad de respuesta antes de la administración de fluidos no sólo puede ayudar en la detección de pacientes que necesitan líquidos, sino también evitar sobrecargas innecesarias y dañinas de líquidos. Esta evaluación consiste, por ejemplo, en observar parámetros dinámicos funcionales como cambios en la salida cardíaca durante las maniobras de pre-modificación de la carga, como la elevación pasiva de las extremidades inferiore[20]s.
En pacientes quirúrgicos de alto riesgo, el uso de un protocolo hemodinámico para mantener la perfusión tisular disminuyó la mortalidad y el fracaso de los órganos postoperatorio[26]s. El monitoreo de la salida cardíaca mediante el cálculo del transporte y el consumo de oxígeno también ayudó a guiar la terapi[18]a.
4. CONSIDERACIONES FINALES
El régimen de reemplazo ideal sería uno que disminuyó la mortalidad y mejoró la calidad de vida, disminuyó la insuficiencia múltiple de órganos y el uso de sangre, y fue de bajo costo. Evidentemente, este plan aún no se ha logrado. Como no hay directriz basada en la evidencia, en la práctica se utiliza una combinación de cristaloides y coloides, y es más importante saber cómo reemplazar que saber qué reemplazar.
Generalmente, los líquidos deben aplicarse como cualquier otro medicamento, respetando sus indicaciones y limitaciones individuales. Refiriéndose a esto, los aspectos ventajosos del reemplazo de volumen perioperatorio con soluciones iso-oncóticas son comprensibles, aunque se necesitan ensayos controlados aleatorios adicionales para demostrar su relevancia para el resultado. Resumiendo los argumentos citados anteriormente, una estrategia de administración racional de fluidos podría ser tratar a pacientes sometidos a cirugía de bajo riesgo con pérdida de volumen intravascular insignificante con perfusión cristaloides y utilizar una combinación de administración cristalina y coloide, cuidadosamente valorada en base a mediciones hemodinámicas.
Por último, llegamos a la conclusión de que la terapia guiada por objetivos en el período perioperatorio se asocia con reducciones en las complicaciones y la duración de la hospitalización. Los efectos beneficiosos de la OT se pueden lograr, evitando así las dificultades de admisión en las Unidades de Cuidados Intensivos.
5. REFERENCIAS
BRANDSTRUP, B.; SVENDSEN, P. E.; RASMUSSEN, M.; et al. Which goal for fluid therapy during colorectal surgery is followed by the best outcome: near-maximal stroke volume or zero fluid balance? British Journal of Anaesthesia. United Kingdom, v. 109, n.2 , p. 191–199, 17 jun. 2012. Disponível em: <https://ac-els-cdn.ez3.periodicos.capes.gov.br/S000709121732888X/1-s2.0-S000709121732888X-main.pdf?_tid=bde7ae63-beb3-46c9-9adc-e0f04482d0cf&acdnat=1539636094_9a27cfa1829cc5679acd68973a0e7357>. Acesso em: 15 out. 2019.
BUNDGAARD-NIELSEN, M.; HOLTE, K.; SECHER, N. H.; KEHLET, H. Monitoring of peri-operative fluid administration by individualized goal-directed therapy. Acta Anaesthesiologica Scandinavica. USA v. 51, n. 3, p. 331–340, mar. 2007. Wiley/Blackwell (10.1111). Disponível em: <http://doi.wiley.com/10.1111/j.1399-6576.2006.01221.x>. Acesso em: 16 out. 2019.
GOW, K. W.; PHANG, P. T.; TEBBUTT-SPEIRS, S. M.; et al. Effect of crystalloid administration on oxygen extraction in endotoxemic pigs. Journal of Applied Physiology. USA, v. 85, n. 5, p. 1667–1675, nov. 1998. American Physiological SocietyBethesda, MD . Disponível em: <http://www.physiology.org/doi/10.1152/jappl.1998.85.5.1667>. Acesso em: 15 out. 2019.
GROCOTT, M. P. W.; MYTHEN, M. G.; GAN, T. J. Perioperative Fluid Management and Clinical Outcomes in Adults. Anesthesia & Analgesia. USA, v. 100, n. 4, p. 1093–1106, 2005. Disponível em: <https://insights.ovid.com/crossref?an=00000539-200504000-00032>. Acesso em: 15 out. 2019..
GURGEL, S. T.; DO NASCIMENTO, P. Maintaining Tissue Perfusion in High-Risk Surgical Patients. Anesthesia & Analgesia. USA, v. 112, n. 6, p. 1384–1391, 2011. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/21156979>. Acesso em: 16 out. 2019..
HAMILTON, M. A.; CECCONI, M.; RHODES, A. A Systematic Review and Meta-Analysis on the Use of Preemptive Hemodynamic Intervention to Improve Postoperative Outcomes in Moderate and High-Risk Surgical Patients. Anesthesia & Analgesia. USA, v. 112, n. 6, p. 1392–1402, 2011. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/20966436>. Acesso em: 16 out. 2019.
HOLTE, K.; SHARROCK, N. E.; KEHLET, H. Pathophysiology and clinical implications of perioperative fluid excess. British Journal of Anaesthesia. United Kingdom, v. 84, n. 4, p. 622-632, oct. 2002. Disponível em: <https://www.ncbi.nlm.nih.gov/pubmed/12393365>. Acesso em: 16 out. 2019.
KELLUM, J. A. Saline-induced hyperchloremic metabolic acidosis. Critical care medicine. New York, v. 30, n. 1, p. 259–61, 2002. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/11902280>. Acesso em: 15 out. 2019.
LEE, T. H.; MARCANTONIO, E. R.; MANGIONE, C. M.; et al. Derivation and Prospective Validation of a Simple Index for Prediction of Cardiac Risk of Major Noncardiac Surgery. Circulation. Dallas, v. 100, n. 10, sep. 1999. Disponível em: < https://www.ncbi.nlm.nih.gov/pubmed/10477528>. Acesso em: 15 out. 2019.
LORENTZ, M. N. Reposição volêmica perioperatória. Rev Med Minas Gerais. Minas Gerais, v. 20, n. 4, p. 47–56, 2018. Disponível em: <http://rmmg.org/artigo/detalhes/1025>. Acesso em: 15 out. 2019.
MANGANO, D. T.; LAYUG, E. L.; WALLACE, A.; TATEO, I. Effect of Atenolol on Mortality and Cardiovascular Morbidity after Noncardiac Surgery. New England Journal of Medicine. Canada, v. 335, n. 23, p. 1713–1721, 1996. Massachusetts Medical Society . Disponível em: <http://www.nejm.org/doi/abs/10.1056/NEJM199612053352301>. Acesso em: 15 out. 2019.
MORETTI, E. W.; ROBERTSON, K. M.; EL-MOALEM, H.; GAN, T. J. Intraoperative Colloid Administration Reduces Postoperative Nausea and Vomiting and Improves Postoperative Outcomes Compared with Crystalloid Administration. Anesthesia & Analgesia. USA, v. 96, n. 2, p. 611–617, 2003. Disponível em: <https://insights.ovid.com/crossref?an=00000539-200302000-00056>. Acesso em: 15 out. 2019.
MYTHEN, M. G.; WEBB, A. R. Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery. Archives of surgery. Chicago, v. 130, n. 4, p. 423–9, 1995. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/7535996>. Acesso em: 16 out. 2019.
ØSTGAARD, G.; REED, R. K. Interstitial fluid accumulation does not influence oxygen uptake in the rabbit small intestine. Acta Anaesthesiologica Scandinavica. USA, v. 39, n. 2, p. 167–173, 1995. Wiley/Blackwell (10.1111). Disponível em: <http://doi.wiley.com/10.1111/j.1399-6576.1995.tb04037.x>. Acesso em: 15 out. 2019.
PEARSE, R.; DAWSON, D.; FAWCETT, J.; et al. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. Critical Care. New York, v. 9, n. 6, p. R687, 2005. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16356219>. Acesso em: 16 out. 2019.
PEREL, A.; HABICHER, M.; SANDER, M. Bench-to-bedside review: Functional hemodynamics during surgery – should it be used for all high-risk cases? Critical Care. New York, v. 17, n. 1, p. 203, 2013. BioMed Central. Disponível em: <http://ccforum.biomedcentral.com/articles/10.1186/cc11448>. Acesso em: 15 out. 2019.
POLDERMANS, D.; BOERSMA, E.; BAX, J. J.; et al. The Effect of Bisoprolol on Perioperative Mortality and Myocardial Infarction in High-Risk Patients Undergoing Vascular Surgery. New England Journal of Medicine. Canada, v. 341, n. 24, p. 1789–1794, 1999. Massachusetts Medical Society. Disponível em: <http://www.nejm.org/doi/abs/10.1056/NEJM199912093412402>. Acesso em: 15 out. 2019.
RAOBAIKADY, R.; DINESH, S.; HACKING, M.; WIGMORE, T. Cardiopulmonary exercise testing as a screening test for perioperative management of major cancer surgery: a pilot study. Critical Care. New York, v. 11, n. Suppl 2, p. 250, 2007. BioMed Central. Disponível em: <http://ccforum.biomedcentral.com/articles/10.1186/cc5410>. Acesso em: 15 out. 2019.
RIELLA MC, RIELLA CV, PACHALY MA, RIELLA LV. Metabolismo da água. In: Riella MC, org. Princípios de nefrologia e distúrbios hidroeletrolíticos. 5ª ed. Rio de Janeiro, Brasil: Guanabara Koogan; 2010. p. 105-38.
RUTTMANN, T. G.; JAMES, M. F.; VILJOEN, J. F. Haemodilution induces a hypercoagulable state. British Journal of Anaesthesia. United Kingdom, v. 76, n. 3, p. 412–414, 1996. Oxford University Press. Disponível em: <http://linkinghub.elsevier.com/retrieve/pii/S0007091217435483>. Acesso em: 16 out. 2019.
SHOEMAKER, W. C.; APPEL, P. L.; KRAM, H. B.; WAXMAN, K.; LEE, T. S. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest. Glenview, v. 94, n. 6, p. 1176–86, 1988. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/3191758>. Acesso em: 16 out. 2019.
SILVA, E. D.; PERRINO, A. C.; TERUYA, A.; et al. Brazilian Consensus on perioperative hemodynamic therapy goal guided in patients undergoing noncardiac surgery: fluid management strategy – produced by the São Paulo State Society of Anesthesiology (Sociedade de Anestesiologia do Estado de São Paulo – SAESP). Brazilian Journal of Anesthesiology (English Edition). São Paulo v. 66, n. 6, p. 557–571, 2016. Sociedade Brasileira de Anestesiologia. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0104001416301750>. Acesso em: 15 out. 2019.
SINCLAIR, S.; JAMES, S.; SINGER, M. Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial. BMJ (Clinical research ed.). London, v. 315, n. 7113, p. 909–12, 1997. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/9361539>. Acesso em: 16 out. 2019.
SKYTTE LARSSON, J.; BRAGADOTTIR, G.; KRUMBHOLZ, V.; et al. Effects of acute plasma volume expansion on renal perfusion, filtration, and oxygenation after cardiac surgery: a randomized study on crystalloid vs colloid. British Journal of Anaesthesia. United Kingdom, v. 115, n. 5, p. 736–742, 2015. Oxford University Press. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0007091217310759>. Acesso em: 15 out. 2019.
SUBRAMANIAM, B.; SUBRAMANIAM, K.; PARK, K. W. Volume Replacement Strategies and Outcome. International Anesthesiology Clinics. USA, v. 48, n. 1, p. 115–125, 2010. Disponível em: <https://insights.ovid.com/crossref?an=00004311-201004810-00009>. Acesso em: 16 out. 2019.
TOCANTINS, L. M.; CARROLL, R. T.; HOLBURN, R. H. The Clot Accelerating Effect of Dilution on Blood and Plasma. Relation to the Mechanism of Coagulation of Normal and Hemophilic Blood. Blood. Washington, v. 6, n. 8, 1951. Disponível em: <http://www.bloodjournal.org/content/6/8/720.short?sso-checked=true>. Acesso em: 15 out. 2019.
TOTE, S. P.; GROUNDS, R. M. Performing perioperative optimization of the high-risk surgical patient. British Journal of Anaesthesia. United Kingdom, v. 97, n. 1, p. 4–11, 2006. Oxford University Press. Disponível em: <http://linkinghub.elsevier.com/retrieve/pii/S0007091217351772>. Acesso em: 15 out. 2019.
APÉNDICE – REFERENCIAS EN NOTA A PIE DE PÁGINA
2. Hamilton, 2011.
3. Holte, 2002.
4. Grocott, 2005.
5. Brandstrup, 2012.
6. Lorentz, 2018.
7. Subramaniam, 2010.
8. Riella, 2010.
9. Lee, 1999.
10. Raobaikady, 2007.
11. Tote, 2006.
12. Skytte Larsson, 2015.
13. Moretti, 2003.
14. ØStgaard, 1995.
15. Gow, 1998.
16. Kellum, John.
17. Ruttmann, 1996.
18. Tocantins et al. 1951
19. Gurgel; Nascimento, 2011.
20. Hamilton, Cecconi, Rhodes, 2011.
21. Perel, Habicher, Sander, 2003.
22. Silva, Et al. 2016.
23. Bundgaard-Nielsen, 2007.
24. Mythen, 1995.
25. Sinclair, Stephen. James, Sally. Singer, Merrill, 1997.
26. Pearse, Ruppert, 2005.
[1] Médica. Postgrado en Medicina de Cuidados Intensivos para Adultos.
Enviado: Diciembre de 2019.
Aprobado: Enero de 2020.