ARTIGO DE REVISÃO
GONÇALVES, Joyce da Silva Bezerra [1], PEREIRA, Aline D’Avila [2]
GONÇALVES, Joyce da Silva Bezerra. PEREIRA, Aline D’Avila. JUNIOR, Adival José Reinert. Linhaça como fitoterápico na dislipidemia – Uma revisão bibliográfica. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 05, Ed. 04, Vol. 01, pp. 55-87. Abril de 2020. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/nutricao/linhaca-como-fitoterapico
RESUMO
A dislipidemia está incluída na doença crônica não transmissível. Estudos experimentais e epidemiológicos têm evidenciado que a linhaça (Linum usitatissimum), um fitoterápico com alegação de propriedades funcionais, visto altas concentrações de ácido alfa-linolênico (ALA), um composto da família do ômega-3, além de ser fonte de fibras e de lignana (principalmente o diglicosídeo secoisolariciresiol – SDG) que atuam de forma benéfica no perfil lipídico e, como consequência, na prevenção de doenças cardiovasculares. Dessa forma, o objetivo deste estudo foi evidenciar os efeitos da linhaça na dislipidemia. Para isso, foi realizada um estudo de natureza bibliográfica, descritiva e retrospectiva sobre a influência da ingestão da farinha de linhaça acerca do perfil lipídico. Foram utilizados artigos publicados no período de janeiro de 2008 até dezembro de 2018. Por meio dessa pesquisa, notou-se que a linhaça promoveu aumento da concentração de HDL (high density lipoprotein), em alguns estudos, mas atuou de forma majoritária na diminuição do triglicerídeos, do colesterol e do LDL (low density lipoprotein). Fica evidente, portanto, que a ingestão da farinha de linhaça atua no combate à dislipidemia, visto a presença dos seus compostos bioativos (ALA e SDG).
Palavras-chave: Fitoterapia, linhaça, ômega-3, dislipidemia.
1. INTRODUÇÃO
Fitoterapia é definido pelo uso de vegetais, tanto de forma interna como externa, para o tratamento de doenças, podendo ser utilizado na forma in natura ou medicamentosa (BRASIL, 2006). Nesse contexto, pode ser utilizado no tratamento de doenças crônicas não transmissíveis (DCNT), caracterizadas como enfermidades que se desenvolvem ao longo da vida, consideradas um problema de saúde pública, visto alta prevalência de óbitos (72,6% dos óbitos do ano de 2013) (WHO, 2010; DUNCAN et al., 2012; MS, 2018). A sua etiologia é multifatorial, no entanto, modificações no estilo de vida, como aumento da ingestão de alimentos industrializados, ricos em carboidratos simples, gorduras saturadas e pobres em ácidos graxos poli-insaturados são determinantes sociais para o desenvolvimento dessas doenças, visto que podem ocasionar obesidade, osteoporose, doenças cardiovasculares, dislipidemia, câncer, entre outros (PRASAD, 2005; MOREIRA et al., 2006; WHO, 2010; SBC, 2016; MS, 2018).
A dislipidemia é definida por distúrbios metabólicos que atuam nos níveis séricos de lipoproteínas circulantes. Pode ser caracterizada por hipercolesterolemia isolada, quando ocorre aumento do colesterol total e/ou fração de LDL (low density lipoprotein); hipertrigliceridemia isolada, quando há aumento dos triglicerídeos (TG); e hiperlipidemia mista, determinada quando o colesterol total e TG estão aumentados (SBC, 2013). Ademais, a dislipidemia ocorre quando há, além das modificações elucidadas, menor concentração de HDL (high density lipoprotein), ou seja, valores menores do que 40 mg/dl em adultos (FRUCHART et al., 2008).
O aumento de LDL e TG, acompanhado pela diminuição do HDL, é um dos causadores do desenvolvimento de doenças cardiovasculares como a aterosclerose (depósitos de placas de gordura ou ateromas, na parede das artérias) (MAGALHÃES et al., 2006). No entanto, quando o HDL está em nível adequado (> 40mg/dL), age de forma protetora, pois remove o excesso de colesterol dos tecidos e inibe a oxidação do LDL (TAN, 1980; LUSIS, 2000; VAN GAAL et al., 2006; MOORADIAN et al., 2008; TABLET; RYE, 2009). Segundo o Ministério da Saúde (MS), a dislipidemia pode ser prevenida a partir das mudanças no estilo de vida, desde a alimentação até a prática de atividade física (MS, 2018). Nesse contexto, pode-se destacar alguns nutrientes como as fibras, ácidos graxos poli-insaturados e lignanas, visto que esses compostos agem no perfil lipídico (BHATHENA et al., 2002; MELO et al., 2007; LONDERO et al., 2008; EUFRÁSIO et al., 2009).
Devido ao aumento da incidência e prevalência de dislipidemia, há uma procura por alimentos naturais com efeitos biológicos que levem a prevenção ou redução dessa enfermidade. Nesse sentido, a linhaça, por apresentar em sua composição o ácido graxo ômega-3, fibras e da lignana, pode ser um potente alimento na prevenção e tratamento da dislipidemia. Dessa forma, o objetivo desse estudo é evidenciar os efeitos da linhaça, como um fitoterápico, na dislipidemia, ressaltando o conceito de fitoterápico, DCNT, dislipidemia e metabolismo lipídico.
A pesquisa delineada é de natureza bibliográfica, descritiva e retrospectiva. Deste modo, foram selecionados artigos científicos que abordavam conceitos sobre linhaça e dislipidemia. As buscas foram realizadas nos bancos de dados virtuais: Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS), Biblioteca Regional de Medicina (BIREME), Scientific Electronic Library Online (SciELO) e Public MEDLINE (PubMed). Os descritores utilizados, em português foram: “linhaça”, “óleo de linhaça”, “dislipidemia”, “colesterol”, “HDL-colesterol”, “LDL-colesterol” e “triglicerídeos”. Em inglês, os termos utilizados “flaxseed”, “flaxseed oil”, “dyslipidemia”, “cholesterol”, “HDL-cholesterol”, “LDL-cholesterol” e “triglycerides”. Foram incluídos artigos em inglês ou português que fossem estudos experimentais, com amostras composta por humanos ou animais, que avaliaram o perfil lipídico de indivíduos que consumiram linhaça. O período de publicação dos estudos que foram avaliados e mostraram efeito do uso da linhaça foi de janeiro de 2008 até dezembro de 2018.
2. DESENVOLVIMENTO
Fitoterapia é uma palavra que tem origem grega do phyton que tem como significado “vegetal” e da therapeia que denota “tratamento” e é caracterizado pelo uso interno ou externo de vegetais para o tratamento de doenças, podendo ser utilizado na forma in natura ou administrado através de medicamentos (BRASIL, 2006).
Há relatos de uso de plantas medicinais desde 1500 a.C., sendo utilizado em várias partes do mundo como no Egito, Grécia, China, Índia, nos países da Europa, entre outros. No Brasil, houve colaboração dos negros, indígenas e portugueses (MIGUEL e MIGUEL, 1999), entretanto, em 2009, houve a criação do Programa Nacional de Plantas Medicinais e Fitoterápicos com o intuito de garantir o acesso seguro e racional às plantas medicinais e fitoterápicos. A ideia central desse programa foi incentivar a utilização da biodiversidade de forma sustentável e o progresso de dois fatores: cadeia produtiva e indústria nacional (BRASIL, 2006).
Vale ressaltar que para a utilização de fitoterapia na prática clínica, existem quatro passos fundamentais para que seja possível fazer uma prescrição considerada eficaz e segura para paciente. Em primeiro lugar, é preciso que o profissional identifique a planta que irá utilizar, a sua nomenclatura botânica ou nome científico correto, a parte da planta que irá ser utilizada, além de seu princípio ativo. Em seguida, o profissional deve saber a forma farmacêutica a ser prescrita para o paciente, assim como sua dose, horário e tempo de utilização para ter o efeito desse medicamento. No terceiro passo, é importante avaliar a toxidade, as reações adversas, as contraindicações e interações. Finalmente, no quarto e último passo, deve-se orientar o paciente sobre o local onde deverá manipular e/ou comprar o fitoterápico (VEIGA et al., 2008). Assim, utilizada de forma correta, a fitoterapia pode ser utilizada no tratamento e prevenção de doenças crônicas não-transmissíveis.
As mudanças ambientais relacionadas com os hábitos alimentares e com o estilo de vida têm favorecido o surgimento e o proliferação das DCNT (WHO, 2003). Essas doenças são caracterizadas por fatores de risco complexos e diversos, longo curso assintomático e pela evolução para graus variados de incapacidade ou morte (LESSA, 1998).
Atualmente, as DCNT são umas das maiores causadores de óbitos no planeta e têm proporcionado diversos prejuízos como: altos casos de mortes prematuras, perda ou diminuição da qualidade de vida, promovendo aumento do grau de limitação nas atividades, tanto de trabalho como de lazer; além disso, impacta a economia, as comunidades e a sociedade em geral (WHO, 2010; DUNCAN et al., 2012).
Nesse sentido, as DCNT são consideradas um problema de saúde pública, visto alta prevalência de óbitos (72,6% dos óbitos do ano de 2013) (WHO, 2010; SBC, 2013; SBC, 2016; MS, 2018). Dentre os fatores de risco que promovem a DCNT, pode-se destacar: a herança genética, o tabaco, o sedentarismo, hábitos alimentares não saudáveis e o consumo excessivo de álcool, responsáveis, na maioria dos casos, pelo alto índice de sobrepeso, obesidade e hipertensão arterial sistêmica (HAS), diabetes mellitus (DM), dislipidemia e osteoporose (MALTA et al., 2006; MS, 2009; SCHMIDT et al., 2011; MAZO, 2013; CAMARGOS; BOMFIM, 2017).
Vale ressaltar que homens e mulheres apresentam diferenças quanto à exposição aos causadores e aos protetores das DCNT. De acordo com dados do “Sistema de Monitoramento de Fatores de Risco e Proteção para DCNT por meio de Inquérito Telefônico de 2010”, existem cinco fatores de risco que foram selecionados como os mais prevalentes em homens do que em mulheres, sendo eles: o tabagismo, a ingestão excessiva de bebidas alcoólicas, o excesso de peso corporal, o consumo de carnes com alto teor de gordura e inatividade física. Por outro lado, dentre os fatores de proteção, destacou-se que o consumo de frutas e hortaliças, de forma regular, foi mais frequente em mulheres do que em homens (BRASIL, 2011).
Dentre as DCNT, pode-se destacar a obesidade, osteoporose, doenças cardiovasculares, dislipidemia, câncer, entre outros (SARTORELLI; FRANCO, 2003; WHO, 2010; DUNCAN et al., 2012). Contudo, segundo o Ministério da Saúde, essas doenças podem ser prevenidas a partir de uma alimentação saudável durante a vida (MS, 2018).
A dislipidemia é definida por distúrbios metabólicos que atuam nos níveis séricos de lipoproteínas circulantes. Pode ser caracterizada por hipercolesterolemia isolada, quando ocorre aumento do colesterol total e/ou fração de LDL (low density lipoprotein); hipertrigliceridemia isolada, quando há aumento dos triglicerídeos (TG); e hiperlipidemia mista, determinada quando o colesterol total e TG estão aumentados (SBC, 2013). Ademais, a dislipidemia ocorre quando há, além das modificações elucidadas, menor concentração de HDL (high density lipoprotein), ou seja, valores menores do que 40 mg/dl em adultos (FRUCHART et al., 2008).
A maior parte do colesterol sérico circulante é sintetizado pelo organismo e cerca de 33% é obtido na dieta. O controle dessa substância ocorre a partir da regulação da absorção de LDL, lipoproteína que realiza o transporte do colesterol endógeno, quando esse composto tem níveis aumentados, há o diagnóstico de dislipidemia (SBC, 2013)
O aumento de LDL e TG, acompanhado pela diminuição do HDL são fatores de risco para o desenvolvimento de doenças cardiovasculares como a aterosclerose (depósitos de placas de gordura ou ateromas, na parede das artérias) (MAGALHÃES et al., 2006). Entretanto, quando o HDL está adequado, ou seja, acima do valor de referência (> 40mg/dL), age promovendo proteção, uma vez que remove o excesso de colesterol dos tecidos, além de contribuir para a inibição da oxidação do LDL (LUSIS, 2000). Segundo o Ministério da Saúde (MS), a prevenção da dislipidemia pode ocorrer a partir de mudanças no estilo de vida, desde a alimentação até a prática de atividade física (MS, 2018).
Os TG compõem a maior parte da gordura ingerida. Depois de ser consumido, há ação das lipases pancreáticas que hidrolisam os TG em ácidos graxos livre, monoglicerídeos e diglicerídeos. A gordura ingerida é absorvida na forma de quilomícrons e transportada pela circulação enterro-hepática até o fígado onde é, então, metabolizada em VLDL (very low density lipoprotein). Para ser transportado no sangue, pelo fato de serem apolares, ocorre uma ligação com uma lipoproteína (XAVIER et al., 2013).
As VLDL são lipoproteínas com altas concentrações de TG, sendo sintetizadas e secretadas pelo fígado na circulação periférica. Ao ser transportado, liga-se aos tecidos, sendo formado, então o VLDL remanescente que é removido pelo fígado. O processo de degradação continua e, após a ação da lipase hepática, ocorre a síntese do LDL (XAVIER et al., 2013). O LDL tem conteúdo residual de TG e é o principal atuante que promove modificações nas concentrações de colesterol sérico, sendo dependente da atividade enzimática da hidroximetilglutaril (HMG) CoA redutase, que atua na síntese intracelular do colesterol hepático (XAVIER et al., 2013). O HDL também é sintetizado no fígado e o colesterol livre é esterificado pela enzima lecitina-colesterolaciltransferase. O colesterol, então, sobre o processo de esterificação, o que é fundamental para que haja a sua estabilização e seu deslocamento pelo plasma. Nesse contexto, alguns alimentos e nutrientes são capazes de modular esse metabolismo.
As fibras alimentares são caracterizadas como substâncias resistentes à digestão realizada pelo trato gastrointestinal. Elas se dividem entre: fibras solúveis (pectinas, gomas, mucilagens, beta-glucanas, psillium e algumas hemiceluloses) e insolúveis (celulose, algumas hemiceluloses e lignina). Dentre os alimentos fontes, pode-se destacar: cereais integrais, leguminosas, frutas e hortaliças (LAIRON et al., 2005; EUFRÁSIO et al., 2009).
Estudos evidenciam que as fibras atuam no metabolismo lipídico e, por isso, estão associadas à diminuição do risco de dislipidemia e doenças cardiovasculares (WU et al., 2003; LONDERO et al., 2008). A diminuição do colesterol ocorre, principalmente devido ao consumo de fibras solúveis (FIETZ; SALGADO, 1999; EUFRÁSIO et al., 2009). A sua ação está associada à formação de géis que se ligam aos sais biliares e são, então, eliminados nas fezes. Com essa união, há diminuição do colesterol sérico, visto que esse composto é utilizado na síntese de sais biliares (EASTWOOD, 1992; MELO et al., 2007).
Em relação aos TG, as fibras solúveis diminuem a sua absorção a nível intestinal, o que promove a sua diminuição sérica. Já as insolúveis atuam diminuindo o tempo de trânsito intestinal e, com isso, há diminuição da absorção de gorduras, podendo atuar na diminuição dos níveis séricos de TG (RAUPP, 1996).
Os principais ácidos graxos poli-insaturados da dieta humana, conforme a sua estrutura, são divididos em duas famílias: o ômega-3 (n-3) e ômega-6 (n-6). O ômega-3 é precursores do ácido alfa-linolênico (ALA), enquanto o ômega-6 do ácido linoleico (LA), caracterizados como ácidos graxos poli-insaturados de cadeia longa, além de serem essenciais, pois devem ser consumidos na dieta, já que nosso organismo não consegue sintetizá-los (MARTIN et al., 2006; DIRIENZO et al., 2008; VALENZUELA et al., 2011). A disponibilidade do ALA é limitada, pois está presente em poucos alimentos, como peixes de água fria (salmão, atum, sardinha), na linhaça, no óleo de canola e na chia (ALMEIDA et al., 2009; COSTA et al., 2011; MUNÕZ et al., 2013; CHACAR et al., 2018). Já o LA, predomina nas dietas ocidentais, pelo fato de estar presente na maioria dos óleos vegetais (milho, girassol, soja), nas margarinas e na gordura animal (PATCH et al., 2005).
Eles possuem essa designação de n-3 e n-6 pois refletem a localização da primeira dupla ligação entre carbonos em relação ao grupo metil-terminal da molécula. As estruturas desses ácidos graxos estão representadas na Figura 1 (MARTIN et al., 2006; DIRIENZO et al., 2008; VALENZUELA et al., 2011).
Figura 1 – Estrutura do ácido α-linolênico (A) e linoleico (B).
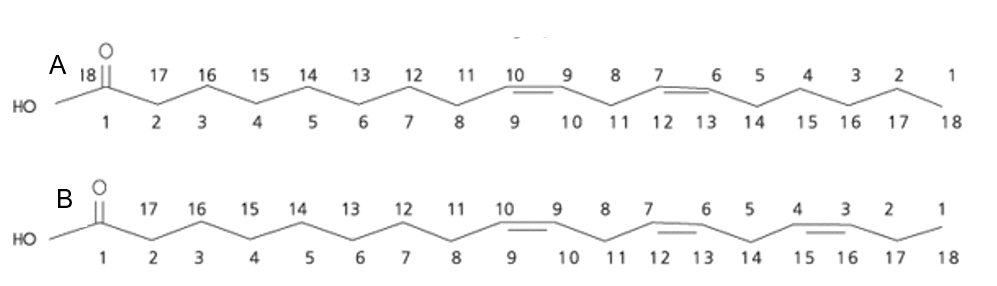
Os ácidos graxos LA e o ALA originam outros ácidos com cadeias mais longas, pois ocorre a dessaturação, a partir da inserção de dupla ligação, e elongados, pela adição de 2 unidades de carbono (DIRIENZO et al., 2008). Enquanto, o LA sofre modificações, podendo ser metabolicamente convertido em ácidos gama-linolênico, dihomo-gama-linolênico e araquidônico (AA), o ALA pode sofrer conversão em outros da série n-3 como o ácido eicosapentanoico (EPA) e docosahexanoico (DHA) (SALEM, 1999; VALENZUELA et al., 2011). Além disso, o ALA pode ser metabolizado para gerar energia através da β-oxidação, servindo como substrato para a cetogênese, sendo armazenado no tecido adiposo para utilização posterior, e armazenado nos fosfolipídios das membranas celulares (KANG, 2007; MORRIS, 2007; ALMEIDA et al., 2009).
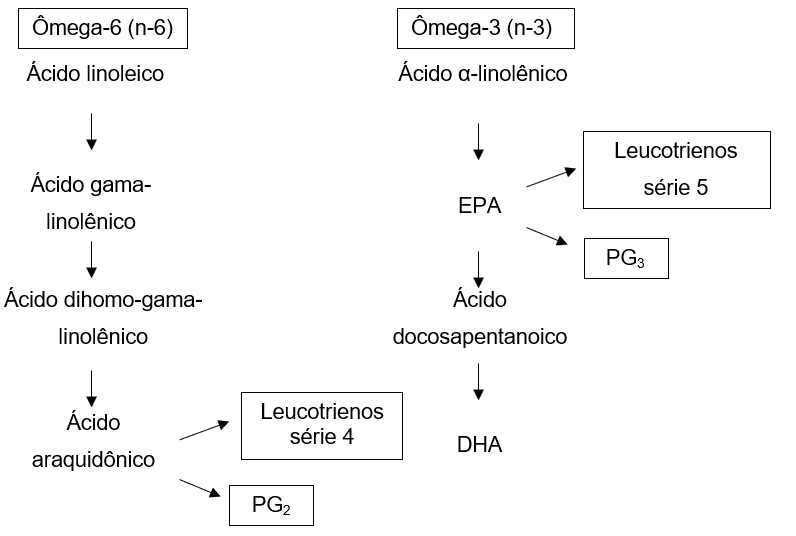
O AA, por sua vez, pode ser convertido em prostaglandina 2 (PG2) e leucotrienos da série 4, os quais possuem ação pró-inflamatória (WATKINS et al., 2000; LIU; DENBOW, 2001). O ácido graxo EPA pode sofrer conversão em prostaglandina 3 (PG3) e leucotrienos da série 5, os quais atuam na redução da síntese de PG2, além de diminuir o fator de necrose tumoral-alfa e interleucina-6 citocinas pró-inflamatórias, assim apresentado ação anti-inflamatória (GARÓFOLO; PETRILLI, 2006; GILSANZ et al., 2009; HALADE et al., 2010) (Figura 2).
Figura 2 – Metabolização dos ácidos graxos pertencentes à família do n-6 e n-3.
A dieta ocidental possui atualmente uma elevada razão entre n-6 e n-3, aproximadamente de 15:1 a 16:1. Isso ocorre, principalmente, devido à industrialização que promoveu o aumento exponencial do consumo de óleos refinados obtidos de oleaginosas com alto teor de n-6 e a redução da ingestão de frutas e hortaliças. Esse desequilíbrio nos tecidos e no sangue pode interferir na produção exacerbada de eicosanoides pró-inflamatórios que podem estimular a liberação de citocinas inflamatórias e proteínas de fase aguda. Dessa forma, proporciona uma inflamação crônica que pode contribuir para a formação da arteriosclerose, doença de Alzheimer, câncer, doenças cardiovasculares, síndrome metabólica, diabetes tipo 2, osteoporose e obesidade (SIMOPOULOS, 2006; MORRIS, 2007).
Um equilíbrio na razão desses ácidos graxos pode ajudar na redução dessas reações inflamatórias e diminuição dos riscos das doenças crônicas. Para melhorar o consumo de n-3 basta aumentar a ingestão de alimentos fontes como: linhaça, peixes de água fria e profundas (salmão, atum, sardinha), chia e nozes (BURDGE; WOOTTON, 2002; CANDELA et al., 2011; CHAÑI et al., 2018). Dessa forma, a razão pode variar de 1-10:1 (IOM, 2002; SIMOPOULOS, 2002; MARTIN et al., 2006; SIMOPOULOS, 2016) (Tabela 1).
Tabela 1 – Recomendações de n-6/n-3 na dieta.
| País ou instituição | n-6/n-3 | Referências |
| Canadá | 4-10:1 | SCR, 1990 |
| Estados Unidos e Canadá | 5:1 | IOM, 2002 |
| Estados Unidos | 2-3:1 | SIMOPOULOS et al., 1999 |
| Estados Unidos | 2-10:1 | SIMOPOULOS, 2002 |
| Estados Unidos | 1-10:1 | SIMOPOULOS, 2016 |
| Estados Unidos | 4:1 | SCHAEFER, 2002 |
| França | 5:1 | CHARDIGNY et al., 2001 |
| Japão | 2-4:1 | KRIS-ETHERTON et al., 2000 |
| Suécia | 5:1 | NCM, 1996 |
| WHO/FAO | 5-10:1 | WHO, 1995 |
Fonte: IOM (2002); SIMOPOULOS (2002); MARTINS et al. (2006); SIMOPOULOS (2016). IOM: Institute of Medicine; WHO: World Health Organization; FAO: Food and Agriculture Organization; SCR: Scientific Rewien Committe; NCM: Nordic Council of Ministeers.
Estudos evidenciam que a baixa razão de n-6/n-3 reduzem as concentrações de colesterol sérico e de triglicerídeos pela diminuição da produção hepática de lipoproteínas de densidade muito baixa ou VLDL (MORAES; COLLA, 2006; KINCHOKU, 2007; MONEGO, 2009). Segundo PIRILLO & CATAPANO (2015) e CHOI; CHOI-KWON (2015) o n-3 diminui a concentração de triglicerídeos devido à inibição da enzima HMG-CoA, enzima relacionada com a síntese de colesterol. Sobre o HDL, há diversos estudos na literatura elucidando que o aumento da sua concentração sérica está diretamente relacionado a diminuição do risco de desenvolver doenças cardiovasculares, visto que ele recolhe o excesso de colesterol e leva para ser metabolizado no fígado (TAN, 1980; VAN GAAL et al., 2006; MOORADIAN et al., 2008; TABLET; RYE, 2009). No entanto, o efeito do n-3 na concentração de HDL ainda não é consistente (GOYAL et al., 2014).
A lignana é um fitoestrógeno, um composto funcional e semelhante quimicamente ao estrógeno dos mamíferos (VERHEUS et al., 2007). O diglicosídeo secoisolariciresinol (SDG) é percursos das lignanas como o enterodiol (ED) e a enterolactona (EL), que são produzidos pela ação microbiota intestinal (PETERSON et al., 2010). A EL também pode ser formada através da oxidação do ED no cólon. A partir do momento que são sintetizadas, as lignanas dos mamíferos são transportadas pela circulação entero-hepática e são excretadas na urina (Setchell; Adlercreutz, 1988).
As lignanas têm efeitos antioxidantes visto que atuam na prevenção da formação de radicais livres (PRASAD, 1997; PRASAD, 2005). Dessa forma, há um efeito quimioprotetor relacionado ao sistema cardiovascular. A sua ação no metabolismo lipídico, é devido ao aumento da atividade de receptores de LDL, o que promove maior remoção dessa lipoproteína e da VLDL. Ademais, pode modular a atividade da enzima acil-CoA colesterol transferase, possuindo ação hipocolesterolêmica, colaborando, dessa forma, com a redução dos teores de LDL e TG séricos (BHATHENA et al., 2002).
A semente de linhaça (Linum usitatissimum) é uma oleaginosa que tem origem da planta do linho, a qual pertence à família Linaceae (MORRIS; VAISEY-GENSER, 2003; TRUCOM, 2006). É classificada como um alimento com alegação de propriedades funcionais, uma vez que possui uma das maiores fonte vegetais de ácido graxo ômega-3, o que pode ajudar na prevenção de doenças e promover saúde (BRASIL, 2008; SALES et al., 2010).
A planta da linhaça é aproveitada em quase toda sua totalidade. O caule é usado para a produção do linho utilizado para a confecção de roupas. A semente também pode ser utilizada como complemento alimentar, visto que possui propriedades que promovem benefícios à saúde (Batello, 2005). A parte interna da semente, conhecida como embrião é envolvida pela casca, a qual também é usada como composto funcional (OOMAH; MAZZA, 1997; WIESENBORN et al., 2002).
A linhaça possui duas variações, sendo uma da cor marrom e a outra dourada. A variedade marrom, é mais cultivada em regiões mais quentes, com clima caracterizado como quente e úmido, como é o caso do Brasil. Já a dourada, possui plantio em regiões frias como, por exemplo, os Estados Unidos e o Canadá. Sobre composição química, não há diferença, o que diverge é a localização do plantio e do cultivo (NOVELLO; POLLONIO, 2011).
No Brasil, o tipo mais encontrado é a linhaça marrom, cujo preço é menor que o da dourada, sendo esta última a mais comum na Europa (Canadian GrainS Commission, 2001). O Canadá é o país que possui maior produção mundial de linhaça. Dentre os países da América do Sul, a maior parte da produção encontra-se na Argentina (80 ton/ano). O Brasil tem uma baixa produção (21 ton/ano) quando comparado com os demais países (Aceites; Grasas, 2000; Turatti, 2000).
A degradação da qualidade ocorre especialmente com a umidade ou calor excessivos, e pode ser reconhecida pelo odor e pela descoloração interna e/ou externa da semente. A semente de linhaça pode ser armazenada por mais de 12 meses em ambientes com umidade entre 9 e 10% (Coskuner; Karababa, 2007).
A linhaça pode ser usada de várias formas, dentre elas, destaca-se: a farinha, servindo de ingrediente na elaboração de pães e biscoitos, macarrão, bolos e o óleo, que pode ser utilizado para temperar saladas ou em cápsulas para uso em suplementação (LEE; LIP, 2003; LEE et al., 2004; MACIEL et al., 2008; NOVELLO; POLLONIO, 2011). Vale ressaltar que para evitar oxidação fotoquímica, o óleo de linhaça deve ser envazado em embalagens escuras, ou seja, à prova de luz (MORRIS & VAISEY-GENSER, 2003; ROY et al., 2007)
A semente de linhaça utilizada diariamente fornece fibras, ALA e lignanas que são nutrientes importantes em uma dieta saudável (Morris, 2007). O aumento do consumo da semente e de seus produtos pela população está relacionado aos diversos benefícios na saúde e à prevenção de doenças que esse alimento funcional oferece, tais como: ser uma das maiores fontes de ácidos graxos da família do n-3, promover proteção cardiovascular e atividade anti-inflamatória (MORRIS, 2007).
Vale ressaltar que o n-3 disponível na linhaça só é disponível quando ocorre a trituração da semente de linhaça, e a farinha de linhaça (FL) é formada (MORRIS; VAISEY-GENSER, 2003). A FL contribui pouco para a ingestão total de carboidrato pois é pobre em açúcares e amidos, fornecendo apenas 1 grama por cada 100g. Com relação às fibras, a fração insolúvel é constituída, basicamente, de celulose e lignina, já a fração solúvel, é composta por mucilagem, um polissacarídeo relacionado à viscosidade quando há mistura com água ou outros líquidos (MORRIS; VAISEY-GENSER, 2003).
A farinha de linhaça apresenta como principais proteínas a albumina e a globulina, sendo essa a principal proteína de armazenamento (MADHUSUDHAN, 2009). O perfil de aminoácidos é semelhante ao da soja (MORRIS, 2007; MADHUSUDHAN, 2009). Apresenta teores relativamente elevados de arginina, ácido glutâmico e ácido aspártico, porém, a lisina, a metionina e a cistina são consideradas aminoácidos limitantes (HALL et al., 2006). A composição centesimal da FL encontra-se na Tabela 2.
Tabela 2 – Composição da farinha de linhaça (g/100g).
| Quantidade por porção | |
| Proteína (% nitrogênio x 6,25) | 22,3 |
| Gordura | 44,4 |
| % total de ácido graxos | |
| Ácido graxo monoinsaturado | 18,0 |
| Ácido graxo poli-insaturado | |
| Ácido alfa-linolênico | 58,2 |
| Ácido linoleico | 14,6 |
Fonte: Adaptado de MORRIS (2007).
A farinha de linhaça contém uma variedade de vitaminas e minerais (Tabela 3): vitaminas A, B1, B2, C, D, E, potássio, fósforo, magnésio, cálcio, enxofre, sódio, cloro, ferro e zinco (MADHUSUDHAN, 2009).
Tabela 3 – Composição de minerais da farinha de linhaça (g%).
| Minerais | Quantidade |
| Potássio | 0,74 |
| Fósforo | 0,70 |
| Magnésio | 0,38 |
| Cálcio | 0,21 |
| Enxofre | 0,21 |
| Sódio | 0,05 |
| Cloro | 0,40 |
| Ferro | 0,01 |
| Zinco | 0,06 |
Fonte: MADHUSUDHAN (2009).
Ademais, essa oleaginosa apresenta três tipos de ácidos fenólicos: os ácidos fenólicos, os flavonoides e as lignanas. As lignanas são compostos bioativos e fenólicos encontradas em altas concentrações na linhaça em comparação a outros alimentos. As enterolignanas, também chamadas de lignanas mamíferas, são produtos das lignanas consumidas na dieta que é convertida pela microbiota intestinal do homem (PETERSON et al., 2010). A principal lignana dessa semente é denominado de SDG, o qual se encontra na quantidade aproximada de 77 a 209 mg por colher de sopa da farinha (MORRIS, 2007).
Alguns fatores antinutricionais também estão presentes na linhaça. A linatina é uma delas, essa se liga a vitamina B6 diminuindo sua absorção e promovendo sua deficiência. Outros são linustatina, substância cianogênica, e o ácido fítico que são capazes de quelar zinco e cálcio (THOMPSON, 1993; SHIM et al., 2014).
O óleo de linhaça (OL) é fabricado a uma temperatura de 35ºC, caracterizada como a temperatura máxima permitida. O interior da semente de linhaça sofre uma “pressão a frio” e o óleo é, então, extraído (NOVELLO; POLLONIO, 2011). A Tabela 4 evidencia as informações nutricionais do óleo de linhaça.
Tabela 4 – Informação nutricional do óleo de linhaça (Giroil ®).
| Informação nutricional (porção de 13mL – 1 colher de sopa) | ||
| Quantidade por porção | %VD (*) | |
| VET | 117 Kcal/491 KJ | 8 |
| Carboidrato | 0 g | 0 |
| Proteína | 0 g | 0 |
| Gorduras totais, das quais: | 13 g | 24 |
| Gordura saturada | 1,2 g | 6 |
| Gordura monoinsaturada | 2,3 g | – |
| Gordura poli-insaturada | 9 g | – |
| Gordura trans | 0 g | – |
| Colesterol | 0 mg | – |
| Fibra | 0 g | 0 |
| Sódio | 3,2 mg | 0 |
| n-3 | 6,8 g | – |
| n-6 | 1,6 g | – |
| n-9 | 2,7 g | – |
(*) Valores diários recomendados com base em uma dieta de 2000 Kcal ou 9400 KJ. Seus valores diários podem ser maiores ou menores dependendo de suas necessidades energéticas. VET – Valor energético total; n-3 – ácido graxo ômega-3; n-6 – ácido graxo ômega-6; n-9 – ácido graxo ômega-9.
Fonte: Rótulo do óleo de linhaça (Giroil®).
Como pôde ser observado, o óleo de linhaça tem 6,8 g de ácidos graxos da família do n-3 e 1,6 g de ácidos graxos da família do n-6, evidenciando uma baixa razão de n-6/n-3, visto que tem maior proporção de n-3 do que n-6.
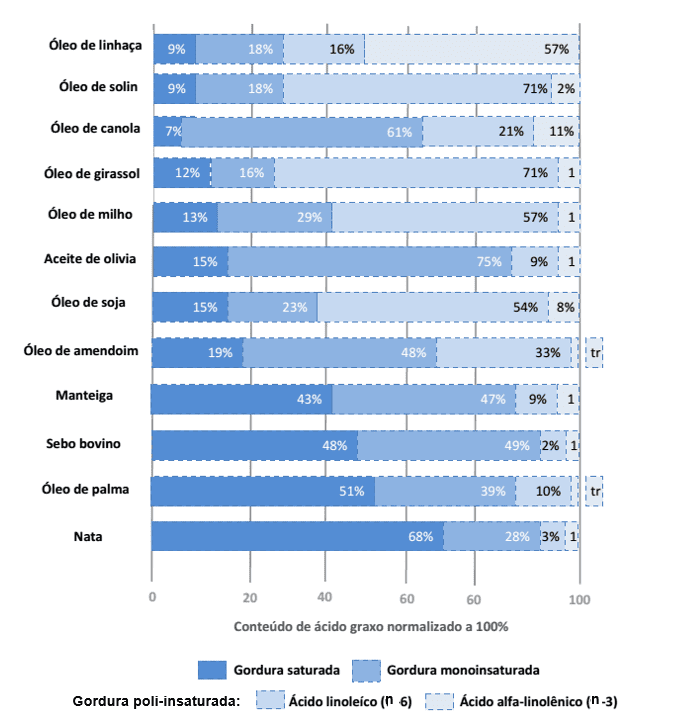
Na Figura 3, está representada a diferença, em relação à quantidade de gordura saturada e insaturada, do óleo de linhaça e de óleos. Pode-se observar que o óleo de linhaça apresenta a maior porcentagem de ALA, quando comparado aos outros, sendo o óleo de soja apresenta maior concentração de LA.
Figura 3 – Diferenças entre gordura saturada e insaturada em diferentes óleos.
Além disso, vale ressaltar a diferença entre óleo e farinha de linhaça. Enquanto o óleo de linhaça apresenta, em sua composição centesimal, apenas os ácidos graxos como n-3 e n-6 e a farinha de linhaça, por sua vez, é constituída de proteínas, carboidratos, ácidos graxos n-3 e n-6, fibras, lignana e cálcio (MORRIS, 2007; UNICAMP, 2011; USP, 2017). Assim, há de se inferir que o n-3 do óleo de linhaça está mais biodisponível do que na farinha de linhaça (PEREIRA et al., 2018).
As Tabela 5, 6, 7 e 8 evidenciam a atuação da FL ou OL no perfil lipídico.
Tabela 5 – Farinha ou óleo de linhaça no colesterol.
| Autor | Dieta | Grupo estudado | Resultado |
| PATADE et al., 2008 | Farinha de linhaça (30g/dia) | Mulheres-pós menopausa hipercolesterolêmicas | Redução de 7% no grupo FL |
| RIEDIGER et al., 2008 | Óleo de linhaça | Camundongos machos | Menor no grupo OL |
| SAXENA et al., 2008 | Farinha de linhaça (30g/dia) | Indivíduos hipercolesterolêmicos | Redução no grupo tratado |
| FIGUEIREDO et al., 2009 | Farinha de linhaça (25%) | Ratos machos com 21 dias | Menor no grupo FL |
| AKPOLAT et al., 2010 | Óleo de linhaça | Ratos hiperlipidêmicos com 150 dias | Menor no grupo OL |
| CARDOZO et al., 2010 | Farinha de linhaça (25%) | Ratos machos com 170 dias | Menor no grupo FL |
| DALEPRANE et al., 2010 | Farinha de linhaça (25%) | Ratos com 180 dias | Não houve diferença significativa |
| TROINA et al., 2010 | Farinha de linhaça (25%) | Ratos 21 dias de vida | Menor no grupo FL |
| TROINA et al., 2010 | Farinha de linhaça (25%) | Ratos com 150 dias | Maior no grupo FL |
| CARDOZO et al., 2014 | Farinha de linhaça (25%) | Ratos machos com 250 dias | Menor no grupo FL |
| RIBEIRO et al., 2014 | Farinha de linhaça (25%) | Ratas fêmeas – 30 dias pós-desmame | Menor no grupo FL |
| CASSANI et al., 2015 | Farinha de linhaça (60g/dia) | Homens com fatores de risco para doenças cardiovasculares | Menor no grupo tratado |
| COSTA et al., 2015 | Farinha de linhaça (25%) | Ratos machos com 21 dias | Menor no grupo FL |
| TORKAN et al., 2015 | Farinha de linhaça (30g/dia) | Humanos com hipercolesterolemia | Menor no grupo FL |
| PEREIRA et al., 2016 | Óleo de linhaça (7%) | Ratos com 21 dias | Menor no grupo OL |
| BABAJAFARI et al., 2018 | Óleo de linhaça | Humanos | Menor no grupo OL |
Fonte: elaborado pelo autor.
Tabela 6 – Farinha ou óleo de linhaça no HDL.
| Autor | Dieta | Grupo estudado | Resultado |
| BLOEDON et al., 2008 | Farinha de linhaça (40g/dia) | Homens e mulheres pós-menopausa | Menor no grupo FL |
| PATADE et al., 2008 | Farinha de linhaça (30g/dia) | Mulheres pós- menopausa hipercolesterolêmicas | Não houve diferença significativa |
| AKPOLAT et al., 2010 | Óleo de linhaça | Ratos hiperlipidêmicos com 150 dias | Não houve diferença significativa |
| DALEPRANE et al., 2010 | Farinha de linhaça (25%) | Ratos com 180 dias | Maior no grupo FL |
| SIMBALISTA et al., 2010 | Farinha de linhaça (25g/dia) | Homens e mulheres pós-menopausa | Menor no grupo FL |
| SOLTANI et al., 2013 | Farinha de linhaça (40g) | Pacientes hipercolesterolêmicos | Maior no grupo tratado |
| CARDOZO et al., 2014 | Farinha de linhaça (25%) | Ratos machos com 250 dias | Menor no grupo FL |
| RIBEIRO et al., 2014 | Farinha de linhaça (25%) | Ratas fêmeas – 30 dias pós-desmame | Não houve diferença significativa |
| COSTA et al., 2015 | Farinha de linhaça (25%) | Ratos machos com 21 dias | Maior no grupo FL |
| MACHADO et al., 2015 | Farinha de linhaça marrom ou dourada (28g/dia) | Humanos adolescentes | Não houve diferença significativa |
| PEREIRA et al., 2016 | Óleo de linhaça (7%) | Ratos com 21 dias | Maior no grupo OL |
Fonte: elaborado pelo autor.
Tabela 7 – Farinha ou óleo de linhaça no LDL.
| Autor | Dieta | Grupo estudado | Resultado |
| PATADE et al., 2008 | Farinha de linhaça (30g/dia) | Mulheres-pós menopausa hipercolesterolêmicas | Redução de 10% no grupo FL |
| SAXENA et al., 2008 | Farinha de linhaça (30g/dia) | Indivíduos hipercolesterolêmicos | Redução no grupo tratado |
| DALEPRANE et al., 2010 | Farinha de linhaça (25%) | Ratos com 180 dias | Menor no grupo FL |
| SOLTANI et al., 2013 | Farinha de linhaça (40g) | Pacientes hipercolesterolêmicos | Menor no grupo tratado |
| CASSANI et al., 2015 | Farinha de linhaça (60g/dia) | Homens com fatores de risco para doenças cardiovasculares | Menor no grupo tratado |
| TORKAN et al., 2015 | Farinha de linhaça (30g/dia) | Humanos com hipercolesterolemia | Menor no grupo FL |
Fonte: elaborado pelo autor.
Tabela 8 – Farinha ou óleo de linhaça no triglicerídeos.
| Autor | Dieta | Grupo estudado | Resultado |
| PATADE et al., 2008 | Farinha de linhaça (30g/dia) | Mulheres-pós menopausa hipercolesterolêmicas | Não houve diferença significativa |
| RIEDIGER et al., 2008 | Óleo de linhaça | Camundongos machos | Menor no grupo OL |
| SAXENA et al., 2008 | Farinha de linhaça (30g/dia) | Indivíduos hipercolesterolêmicos | Redução no grupo tratado |
| FIGUEIREDO et al., 2009 | Farinha de linhaça (25%) | Ratos machos com 21 dias | Menor no grupo FL |
| CARDOZO et al., 2010 | Farinha de linhaça (25%) | Ratos machos com 170 dias | Menor no grupo FL |
| DALEPRANE et al., 2010 | Farinha de linhaça (25%) | Ratos com 180 dias | Menor no grupo FL |
| TROINA et al., 2010 | Farinha de linhaça (25%) | Ratos 21 dias de vida | Menor no grupo FL |
| TROINA et al., 2010 | Farinha de linhaça (25%) | Ratos com 150 dias | Maior no grupo FL |
| SOLTANI et al., 2013 | Farinha de linhaça (40g) | Pacientes hipercolesterolêmicos | Menor no grupo tratado |
| GUARDA et al., 2014 | Óleo de linhaça (17%) | Ratos machos e fêmeas com 21 dias | Menor no grupo OL |
| RIBEIRO et al., 2014 | Farinha de linhaça (25%) | Ratas fêmeas – 30 dias pós-desmame | Menor no grupo FL |
| CASSANI et al., 2015 | Farinha de linhaça (60g/dia) | Homens com fatores de risco para doenças cardiovasculares | Menor no grupo tratado |
| COSTA et al., 2015 | Farinha de linhaça (25%) | Ratos machos com 21 dias | Não houve diferença significativa |
| MACHADO et al., 2015 | Farinha de linhaça marrom ou dourada (28g/dia) | Humanos adolescentes | Não houve diferença significativa |
| TORKAN et al., 2015 | Farinha de linhaça (30g/dia) | Humanos com hipercolesterolemia | Menor no grupo FL |
| PEREIRA et al., 2016 | Óleo de linhaça (7%) | Ratos com 21 dias | Não houve diferença significativa |
| BABAJAFARI et al., 2018 | Óleo de linhaça | Humanos | Menor no grupo OL |
Fonte: elaborado pelo autor.
Como observado, a utilização da farinha ou óleo de linhaça influencia diretamente no perfil lipídico. O colesterol, LDL-colesterol e triglicerídeos estavam menores em estudos que utilizaram a farinha ou o óleo de linhaça e o HDL-colesterol estava maior em outros estudos.
Pelo fato de a farinha de linhaça apresentar composição diferente pois possui fibras, lignana e ácidos graxos poli-insaturados, os seus achados foram mais expressivos. Estudos evidenciam que as fibras atuam no metabolismo lipídico e, por isso, estão associadas à diminuição do risco de dislipidemia e doenças cardiovasculares (WU et al., 2003; LONDERO et al., 2008). A diminuição do colesterol ocorre, principalmente devido ao consumo de fibras solúveis (FIETZ; SALGADO, 1999; EUFRÁSIO et al., 2009). A sua ação está associada à formação de géis que se ligam aos sais biliares e são, então, eliminados nas fezes. Com essa união, há diminuição do colesterol sérico, visto que esse composto é utilizado na síntese de sais biliares (EASTWOOD, 1992; MELO et al., 2007). Em relação aos TG, as fibras solúveis diminuem a sua absorção a nível intestinal, o que promove a sua diminuição sérica. Já as insolúveis atuam diminuindo o tempo de trânsito intestinal e, com isso, há diminuição da absorção de gorduras, podendo atuar na diminuição dos níveis séricos de TG (RAUPP, 1996).
As lignanas apresentam efeitos antioxidantes devido à prevenção na formação de radicais livres (PRASAD, 1997; PRASAD, 2005). Dessa forma, há um efeito quimioprotetor relacionado ao sistema cardiovascular. A sua ação no metabolismo lipídico, é devido ao aumento da atividade de receptores de LDL, o que promove maior remoção dessa lipoproteína e da VLDL. Ademais, pode modular a atividade da enzima acil-CoA colesterol transferase, tendo ação hipocolesterolêmica, colaborando, dessa forma, com a redução dos teores de LDL e TG (BHATHENA et al., 2002). Esse achado está associado somente ao consumo da farinha de linhaça, pois a lignana se localiza na casca, parte do alimento que não é utilizado no preparo do óleo de linhaça.
Estudos evidenciam que a baixa razão de n-6/n-3 reduzem as concentrações de colesterol sérico e de triglicerídeos pela diminuição da produção hepática de lipoproteínas de densidade muito baixa ou VLDL (MORAES; COLLA, 2006; KINCHOKU, 2007; MONEGO, 2009), o que foi encontrado no presente estudo. Segundo Pirillo e Catapano (2015) e Choi & Choi-Kwon (2015) o n-3 diminui a concentração de triglicerídeos devido à inibição da enzima HMG-CoA, enzima relacionada com a síntese de colesterol. Em relação ao HDL, está bem descrito na literatura que o aumento da sua concentração sérica está diretamente relacionado à diminuição do risco de desenvolver doenças cardiovasculares, visto que ele recolhe o excesso de colesterol e leva para ser metabolizado no fígado (TAN, 1980; VAN GAAL et al., 2006; MOORADIAN et al., 2008; TABLET; RYE, 2009). No entanto, o efeito do n-3 na concentração de HDL ainda não é consistente (GOYAL et al., 2014).
3. CONSIDERAÇÕES FINAIS
Visto que a dislipidemia é classificada como uma doença crônica não transmissível e que a linhaça é um fitoterápico fonte de omega-3, ácido graxo poli-insaturado, fibras e SDG que apresentam papel na diminuição do colesterol, TG e LDL e aumento do HDL, conclui-se que a utilização desses alimentos atua de forma direta na dislipidemia, podendo ser utilizado como um potente protetor de doenças cardiovasculares. Dessa forma, a partir dos resultados apresentados, conclui-se que a farinha de linhaça atuou de forma mais expressiva no perfil lipídico, visto a presença de fibras e lignana, as quais não estão presentes no óleo de linhaça. No entanto, ainda existem poucos estudos utilizando o óleo de linhaça, pois apesar de ele ser menos expressivo, houve aumento do HDL, que é um preditor de prevenção de dislipidemia e doenças cardiovasculares. Portanto, os efeitos benéficos desta oleaginosa sobre o perfil lipídico são atingidos com um consumo entre 30g à 60g, ou seja, 2 a 4 colheres de sopa por dia da farinha.
4. REFERÊNCIAS
ACEITES; GRASAS. Lino, una oleagionosa con historia. v. 38, p. 59-72, 2000.
AKPOLAT, M., KANTER, M., TOPCU-TARLADACALISIR, Y., AYDOGDU, N. Protective effect of flaxseed oil on renal injury in hyperlipidaemic rats: the effect of flaxseed oil on hyperlipidaemia. Phytother Res, 2010.
ALMEIDA, K. C. L.; BOAVENTURA, G. T.; GUZMAN-SILVA, M. A. A linhaça (Linum usitatissimum) como fonte de ácido α-linolênico na formação da bainha de mielina. Rev Nutr, v. 22, p. 747-754, 2009.
BABAJAFARI S., HOJHABRIMANESH, A.; SOHRABI, Z.; AYAZ, M.; NOORAFSHAN, A.; AKRAMI, A. Comparing isolated soy protein with flaxseed oil vs isolated soy protein with corn oil and wheat flour with corn oil consumption on muscle catabolism, liver function, blood lipid, and sugar in burn patients: a randomized clinical trial. Trials, v. 19, 2018.
BATELLO,CF. Os poderes do óleo de linhaça. 2005. Disponível em: <HTTP://www.performancenutrition.com.br/>. Acesso em: 29 set 2018.
BHATHENA, S. J.; ALI, A. A.; MOHAMED, A. I.; HANSEN, C. T.; VELASQUEZ, M. T. Differential effects of dietary flaxseed protein and soy protein on plasma triglyceride and uric acid levels in animal models. J Nutr Bioch, v. 13, p. 684-689, 2002.
BLOEDON, LT; BALIKAI, S; CHITTAMIS, J; CUNNANE, SC; BERLIN, JA; RADER; DJ, SZAPARY, PO. Flaxseed and Cardiovascular Risk Factors:Results from a Double Blind, Randomized, Controlled Clinical Trial. J Am Coll of Nutr, v. 27, p. 65–74, 2008.
BRASIL. ANVISA. Agência Nacional de Vigilância Sanitária. Lista de alegações de propriedade funcional aprovadas. 2008. Disponível em: <http://www.anvisa.gov.br/alimentos/comissoes/tecno_lista_alega.htm >. Acesso em: 16 jan 2016.
BRASIL. Decreto nº 5.813 de 22 de junho de 2006. Aprova a Política Nacional de Plantas Medicinais e Fitoterápicos e dá outras providências. Diário Oficial da União, Brasília, DF, jun. 2006
BRASIL. PORTAL BRASIL. Consumo de frutas no Brasil está abaixo do recomendado pela OMS, mostra pesquisa. 2011. Disponível em: < http://www.brasil.gov.br/saude/2011/08/consumo-de-frutas-no-brasil-esta-abaixo-do-recomendado-pela-oms-mostra-pesquisa>. Acesso em: 25 mar 2018.
BURDGE, G. C.; WOOTTON, S. A. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in Young women. Br J Nutr, v. 88, p. 411-420, 2002.
CAMARGOS, M. C. S.; BOMFIM, W. C. Osteoporose e Expectativa de Vida Saudável: estimativas para o Brasil em 2008. Cad Saúde Colet, v. 25, p. 106-112, 2017.
CANANDIAN GRAINS COMMISION. Canada Western flaxseed an of yellow flaxseed samples. Winnipeg, MB, 2001.
CANDELA, C. G.; LÓPEZ, L. M. B.; KOHEN, V. L. Importance of a balanced omega 6/omega 3 ratio for the maintenance of health: Nutritional recommendations. Nutr Hosp, v. 26, p. 323-329, 2011.
CARDOZO, L. F. M. F.; CHAGAS, M. A.; SOARES, L. L.; TROINA, A. A.; BOAVENTURA, G. T. Exposure to flaxseed during lactation does not alter prostate area or epithelium height but changes lipid profile in rats. Nutri Hosp, v. 25, p. 250-255, 2010.
CARDOZO, L. F. M. F.; VICENTE, G. C.; BRANT, L. H.; MAFRA, D.; CHAGAS, M. A.; BOAVENTURA, G. T. Prolonged flaxseed flour intake decreased thickness of the aorta and modulates some modifiable risk factors related to cardiovascular disease in rats. Nut Hosp, v. 29, p. 376-381, 2014.
CASSANI, R. S. L.; FASSINI, P. G.; SILVAH, J. H. LIMA, C. M.; MARCHINI, J. S. Impact of weight loss diet associated with flaxseed on inflammatory markers in men with cardiovascular risk factors: a clinical study. Nutr J, v. 14, p. 5, 2015.
CHACAR, S.; ITANI, T.; HAJAL, J.; SALIBA, Y.; LOUKA, N.; FAIVRE, J. F. et al. The impact of long-term intake of phenolic compounds-rich grape pomace on rat gut microbiota. J Food Sci, v. 83, p. 246-251, 2018.
CHAÑI, E. M. M.; PACHECO, S. O. S.; MARTÍNEZ, G. A.; FREITAS, M. R.; IVONA, J. G.; IVONA, J. A. et al. Long-Term Dietary Intake of Chia Seed Is Associated with Increased Bone Mineral Content and Improved Hepatic and Intestinal Morphology in Sprague-Dawley Rats. Nutrients. 2018;10.
CHARDIGNY, J. M.; BRETILLON, L.; SÉBÉDIO, J. L. New insights in health effects of trans alpha-linolenic acid isomers in humans. Eur J Lipid Sci Technol, v. 103, p. 478-482, 2001.
CHOI, S. H.; CHOI-KWON, S. The effects of the DASH diet education program with omega-3 fatty acid supplementation on metabolic syndrome parameters in elderly women with abdominal obesity. Nutr Res Pract, v. 9, p. 150-157, 2015.
COSKUNER, Y; KARABABA, E. Some physical properties of flaxseed (Linum usitatissimum L.). J Food Eng, v. 78, p. 1067-1073, 2007.
COSTA, C. A. S.; CARLOS, A. S.; GONZALEZ, G. D.; REIS, R. P.; RIBEIRO, M. S.; SANTOS, A. S. et al. Diet containing low n-6/n-3 polyunsaturated fatty acids ratio, provided by canola oil, alters body composition and bone quality in young rats. Eur J Nutr, v. 51, p. 191-198, 2011.
COSTA, C. A.; SILVA, P. C.; RIBEIRO, D. C.; PEREIRA, A. D.; SANTOS, A. D.; MAIA, L. D. et al. Body adiposity and bone parameters of male rats from mothers fed diet containing flaxseed flour during lactation. J Dev Orig Health Dis, v. 7, p. 1-6, 2015.
DALEPRANE, J. B.; BATISTA, A.; PACHECO, J. T.; SILVA, A. F. E.; COSTA, C. A. RESENDE, A. C.; BOAVENTURA, G. T. Dietary flaxseed supplementation improves endothelial function in the mesenteric arterial bed. Food Res Int, v. 43, p. 2052-2056, 2010.
DIRIENZO, M. A.; LEMKE, S. L.; PETERSEN, B. J.; SMITH, K. M. Effect of substitution of high stearic low linolenic acid soybean oil for hydrogenated soybean oil on fatty acid intake. Lipids, v. 43, p. 451-456, 2008.
DUNCAN, B. B.; CHOR, D.; AQUINO, E. M. L.; BENSENOR, I. M.; MILL, J. G.; SCHMIDT, M. I. et al. Doenças crônicas não transmissíveis no Brasil: prioridade para enfrentamento e investigação. Rev Saúde Pública, v. 46, p. 126-134, 2012.
EASTWOOD, M.A. The fisiological effect of dietary fiber: on uptake. Ann Rev Nutr, v.12, p.19-36, 1992.
EUFRÁSIO, M. R.; BARCELOS M. F. P.; SOUSA, R. V.; ABREU W. C.; LIMA, M; A; C.; PEREIRA, M. C. A. Effect of different types of fibers on the lipid portions of wistar rat blood and liver. Ciên Agrotecnol, v. 33, p. 1608-1614, 2009.
FIETZ, V.R.; SALGADO, J.M. Efeito da pectina e da celulose nos níveis séricos de colesterol e triglicerídeos em ratos hiperlipidemicos. Ciên Tecnol Aliment, v.19, p.318-321, 1999.
FIGUEIREDO, M. S.; MOURA, E. G.; LISBOA, P. C.; TROINA, A. A.; TREVENZOLI, I. H.; OLIVEIRA, E.; BOAVENTURA, G. T.; FONSECA, M. C. Flaxseed supplementation of rats during lactation changes the adiposity and glucose homeostasis of their offspring. Life Sci, v. 26, p. 365-371, 2009
FRUCHART, J. C.; SACKS, F. M.; HERMANS, M. P.; ASSMANN, G.; BROWN, W. V.; CESKA, R et al. The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in dyslipidaemic patients. Diabetes Vasc Dis Res, v. 5, p. 319e35, 2008.
GARÓFOLO, A.; PETRILLI, A. S. Balanço entre ácidos graxos ômega-3 e 6 na resposta inflamatória em pacientes com câncer e caquexia. Rev Nutr, v. 19, p. 611-621, 2006.
GILSANZ, V.; CHALFANT, J.; MO, A. O.; DAVID, C.; LEE, D. C.; DOREY, F. J. et al. Reciprocal relations of subcutaneous and visceral fat to bone structure and strength. J Clin Endocrinol Metab, v. 94, p. 3387-3393, 2009.
GOYAL, A.; SHARMA, V.; UPADHYAY, N.; GILL, S.; SIHAG, M. Flax and flaxseed oil: an ancient medicine & modern functional food. J Food Sci Technol, v. 51, p. 1633-1653, 2014.
GUARDA, D. S.; LISBOA, P. C.; OLIVEIRA, E.; NOGUEIRA-NETO, J. F.; MOURA, E. G.; FIGUEIREDO, M. S. Flaxseed oil during lactation changes milk and body composition in male and female suckling pups rats. Food Chem Toxicol, v. 69, p. 69-75, 2014.
HALADE, G. V.; RAMAN, M.; WILLIAMS, P. J.; FERNANDES, G. High fat diet-induced animal model of age associated obesity and osteoporosis. J Nutr Biochem, v. 21, p. 1162-1169, 2010.
HALL, I. C.; TULBEK, M. C.; XU, Y. Flaxseed. In: TAYLOR, S. Advances in food and nutrition research. San Diego, CA: Academic Press, 2006. p. 1-97
INSTITUTE OF MEDICINE. 2002. Disponível em: <http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRIs/DRI_Macronutrients.pdf>. Acesso em: 07 out 2016.
KANG, J. X. Fat-1 transgenic mice: a new model for omega-3 research. Prostaglandins Leukot Essent Fatty Acids, v. 77, p. 263-267, 2007.
KINCHOKU, H. Efeitos do aconselhamento nutricional em pacientes dislipidêmicos segundo sexo, idade e tempo de tratamento. 2007. 109 f. Dissertação (Mestrado em Clínica Médica) – Faculdade de Ciências Médicas, Universidade Estadual de Campinas. Campinas, 2007.
KRIS-ETHERTON, P. M.; TAYLOR, D. S.; YU-POTH, S.; HUTH, P.; MORIARTY, K.; FISHELL, V. et al. Polyunsaturated fatty acids in the food chain in the United States. Am J Clin Nutr, v. 71, p. 179S-188S, 2000.
KRUGER, M. C.; COETZEE, M.; HAAG, M.; WEILER, H. Long-chain polyunsaturated fatty acids: Selected mechanisms of action on bone. Progr Lipid Research, v. 49, p. 438-449, 2010.
LAIRON, D.; ARNAULT, N.; BERTRAIS, S.; PLANELLS, R.; CLERO, E.; HERCBERG, S. et al. Dietary fiber intake and risk factors for cardiovascular disease in French adults. Am J Clin Nutr, v.82, p.1185-94, 2005.
LEE, K. W.; LIP, G. Y. H. The role of omega-3 fatty acids in the secondary prevention of cardiovascular disease. QJM, v. 96, p. 465-480, 2003.
LEE, S.; INGLETT, G. E.; CARRIERE, C. J. Effect of Nutrim oat bran and flaxseed on rheological properties of cakes. Cereal Chem, v. 81, p. 637-642, 2004
LESSA, I. O adulto brasileiro e as doenças da modernidade – Epidemiologia das doenças crônicas não-transmissíveis. In: Doenças crônicas não-transmissíveis. Rio de Janeiro: Hucitec/Abrasco, 1998.
LIU, D.; DENBOW, D. M. Maternal dietary lipids modify composition of bone lipids and ex vivo prostaglandin E2 production in early postnatal Japanese quail. Poult Sci, v. 80, p. 1344-1352, 2001.
LONDERO, P. M. G.; RIBEIRO, N. D.; CARGNELUTTI FILHO, A. Teores de fibra e rendimento de grãos em populações de feijão. Ciên Agrotecnol, v.32, p.167-173, jan./fev., 2008.
LUSIS, A. J. Atherosclerosis. Nature, v. 14, p. 233-241, 2000.
MACHADO, A. M.; PAULA, H.; CARDOSO, L. D.; COSTA, N. M. B. Effects of brown and golden flaxseed on the lipid profile, glycemia, inflammatory biomarkers, blood pressure and body composition in overweight adolescents. Nutrition, v. 31, p. 90-96, 2015.
MACIEL, L. M. B.; PONTES, D. F.; RODRIGUES, M. C. P. Efeito da adição de farinha de linhaça no processamento de biscoito tipo cracker. Alim Nutr, v. 19, p. 385-392, 2008.
MADHUSUDHAN, B. Potential Benefits of Flaxseed in Health and Disease – A Perspective. Agric Conspec Sci, v. 74, p. 67-72, 2009.
MAGALHÃES, L.; ADRAGÃO, T.; PIRES, A.; LUCAS, C.; BIRNE, R.; GONÇALVES, M. A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients. Nephrol Dial Transplant, v. 19, p. 1480-1488, 2006.
MALTA, D. C.; CEZÁRIO, A. C.; MOURA, L.; NETO, O. L. M.; JUNIOR, J. B. S. Construção da vigilância e prevenção das doenças crônicas não transmissíveis no contexto do sistema único de saúde. Epidemiol Serv Saúde, v. 15, p.47-65, 2006.
MARTIN, C. A.; ALMEIDA, V. V.; RUIZ, M. R.; VISENTAINER, J. E. L.; MATSHUSHITA, M.; SOUZA, N. E. Ácidos graxos poliinsaturados ômega-3 e ômega-6: importância e ocorrência em alimentos. Rev Nutr, v.19, p. 761-770, 2006.
MAZO, G. Z. Associação entre osteoporose e aptidão física de idosos praticantes de exercícios físicos. Rev Saúde Pública, v. 39, p. 131-140, 2013.
MELO, D. S. de; CORRÊA, A. D.; MARCOS, F. C. A.; SOUSA, R. V. de; ABREU, C. M. P. de; SANTOS, C. D. dos. Efeitos da farinha de folhas de mandioca sobre a peroxidação lipídica, o perfil lipídico sangüineo e o peso do fígado de ratos. Ciên Agrotecnol, v.31, p.420-428, 2007.
MONEGO, M. A. Goma da linhaça (Linum usitatissimum l.) para uso como hidrocolóide na indústria alimentícia. 2009. 89 f. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal de Santa Maria (UFSM, RS), Santa Maria, 2009.
MOORADIAN, A. D.; HAAS, M. J.; WEHMEIER, K. R.; WONG, N. C. Obesity-related changes in high-density lipoprotein metabolism. Obesity, v. 6, p. 1152-1160, 2008.
MORAES, F. P.; COLLA, L. M. Alimentos funcionais e nutracêuticos: defi nições, legislação e benefícios à saúde. Rev Eletrônica Farm, v. 3, p. 99-112, 2006.
MORRIS DH. Flax – A Health and Nutrition Primer. 2007. Canada: Flax Council of Canada.
MORRIS, D. H.; VAISEY-GENSER, M. Flaxseed. Enc Food Sci Nutr, v. 10, p. 2525-2531, 2003.
MS. MINISTÉRIO DA SAÚDE. Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Saúde da criança: nutrição infantil: aleitamento materno e alimentação complementar. Brasília: Ministério da Saúde; 2009. 112p. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/saude_crianca_nutricao_aleitamento_alimentacao.pdf. Acesso em: 12 abr 2016.
MS. MINISTÉRIO DA SAÚDE. Vigilância de Doenças Crônicas não transmissíveis (DCNT). 2018.
NCM. NORDIC COUNCIL OF MINISTERS. Nordic nutrition recommendations. Scand J Nutr, v. 40, p. 161-165, 1996.
NOVELLO, D.; POLLONIO, M. A. R. Caracterização e propriedades da linhaça (Linum usitatissimun L.) e subprodutos. Ceppa, v. 29, p. 371-330, 2011
OOMAH, B. D.; MAZZA, G. Effect of dehulling on chemical composition and the physical properties of flaxseed. Food Sci Technol, v. 30, p. 135-140, 1997.
PATADE, A.; DEVAREDDY, L.; LUCAS, E. A. et al. Flaxseed Reduces Total and LDL Cholesterol Concentrations in Native American Postmenopausal Women. J Womens Health, v. 17, p. 355-366, 2008.
PATCH, C. S.; TAPSELL, L. C.; MORI, T. A.; MEYER, B. J.; MURPHY, K. J.; MANSOUR, J. et al. The use of novel foods enriched with long-chain n-3 fatty acids to increase dietary intake: a comparison of methodologies assessing nutrient intake. J Am Diet Assoc, v. 105, p. 1918-1926, 2005.
PEREIRA, A. D.; RIBEIRO, D. C.; DOS SANTOS, A. S.; BOUERI, B. F. C.; PESSANHA, C. R.; ABREU, M. D. C., et al. Oil or flaxseed flour reduces pancreatic islet area but does not affect serum insulin, at weaning, in male Wistar rats. J Aging Res Clin Practice, v. 7, p. 17-19, 2018.
PEREIRA, A. D.; RIBEIRO, D. C.; SANTANA, F. C.; SANTOS, A. S.; MANCINI-FILHO, J.; NASCIMENTO-SABA, C. C. et al. Maternal Flaxseed Oil During Lactation Enhances Bone Development in Male Rat Pups. Lipids, v. 51, p. 923-929, 2016.
PETERSON, J.; DWYER, J.; ADLERCREUTZ, H.; SCALBERT, A.; JACQUES, P.; MCCULLOUGH, M. L. Dietary lignans: physiology and potential for cardiovascular disease risk reduction. Nutr Rev, v. 68, p. 571-603, 2010.
PIRILLO, A.; CATAPANO, A. L. Update on the management of severe hypertriglyceridemia – focus on free fatty acid forms of omega-3. Drug Des Devel Ther, v. 9, p. 2129-2137, 2015.
PRASAD, K. Hypocholesterolemic and antiatherosclerotic effect of flax lignan complex isolated from flaxseed. Atherosclerosis, v. 179, p. 296-275, 2005.
PRASAD, K. Hydroxyl radical-scavenging property of secoisolariciresinol diglucoside (SDG) isolated from flax-seed. Mol Cell Biochem, v. 168, p. 117-123, 1997.
RAUPP, D.S.; SGARBIERI, V.C. Efeito de frações fibrosas extraídas de feijão (Phaseolus vulgaris, L.) na utilização de macro e micronutrientes da dieta pelo rato. Ciênc Tecnol Aliment, v.16, n.2, p.100-107, 1996.
RIBEIRO, D. C.; SILVA, P. C. A.; PEREIRA, A. D.; BOUERI, B. F. C., PESSANHA, C. R.; ABREU, M. D. C. et al. Assessments of body composition and bone parameters of lactating rats treated with diet containing flaxseed meal (Linum usitatissinum) during post-weaning period. Nutr Hosp, v. 30, p. 366-371, 2014.
RIEDIGER, N. D.; OTHMAN, R.; FITZ, E.; PIERCE, G. N.; SUH, M.; MOGHADASIAN, M. H. Low n-6: n-3 fatty acid ratio, with fish- or flaxseed oil, in a high fat diet improves plasma lipids and beneficially alters tissue fatty acid composition in mice. Eur J Nutr, v. 47, p. 153-160, 2008.
ROY, H. J.; LUNDY, S.; ERIKSEN, C. Healthier lives through education in nutrition and preventive medicine. Flaxseed a review of health benefits. Pennington Nutr Series, v. 5, p. 1-4, 2007.
SALES, R. L.; FIALHO, C. G. O.; COSTA, N. M. B. Linhaça: nutrientes, compostos bioativos, efeitos fisiológicos. In: COSTA, N. M. B.; ROSA, C. O. B. Alimentos funcionais. Rio de Janeiro: Rubio, 2010. p. 193-208.
SARTORELLI, D. S.; FRANCO, L. J. Tendências do diabetes mellitus no Brasil: o papel da transição nutricional. Cad Saúde Pública, v. 19, p. S29:S36, 2003.
SAXENA, S.; KATARE, C. Evaluation of flaxseed formulation as a potential therapeutic agent in mitigation of dyslipidemia. Biomed J, v. 37, p. 386-390, 2014.
SBC. SOCIEDADE BRASILEIRA DE CARDIOLOGIA. Diretrizes da Sociedade Brasileira de Cardiologia. 7ª Diretriz Brasileira de Hipertensão Arteria. Arq Bras Cardiol, v. 107, p. 1-83, 2016.
SBC. SOCIEDADE BRASILEIRA DE CARDIOLOGIA. V Diretriz brasileira de dislipidemias e prevenção da aterosclerose. Arq Bras Cardiol, v. 101, 2013.
SCHAEFER, E. J. Lipoproteins, nutrition, and heart disease. Am J Clin Nutr, v. 75, p. 191-212, 2002.
SCHMIDT, M. I.; DUNCAN, B. B. AZEVEDO SILVA, G.; MENEZES, A. M.; MONTEIRO, C. A.; BARRETO, S. M. et al. Chronic noncommunicable diseases in Brazil: burden and current challenges. Lancet, v. 377, p. 1949-1961, 2011.
SCR. SCIENTIFIC REVIEW COMMITTEE. Nutrition recommendations. Ottawa: Canadian Government Publishing Centre, Supply and Services Canada; 1990.
SETCHELL, K.; ADLECREUTZ, H. Mammalian lignans and phytoestrogens: recent studies on their formation, metabolism and biological role in health and disease. In Rowland IR (eds) Role of the Gut Flora, Toxicity and Cancer, pp 315-345. London: Academic Press, 1988.
SHIM, Y. Y.; GUI, B.; ARNISON, P. G.; WANG, Y.; REANEY, M. J. T. Flaxseed (Linum usitatissimum L.) bioactive compounds and peptide nomenclature: A review. Trends Food Sci Tech, v. 38, p. 5-20, 2014.
SIMBALISTA, R. L.; SAUERBRONN, A. V.; ALDRIGHI, J. M.; ARÊAS, J. A. G. Consumption of a Flaxseed-Rich Food Is Not More Effective Than a Placebo in Alleviating the Climacteric Symptoms of Postmenopausal Women. J Nutr, v. 140, p. 293-297, 2010.
SIMOPOULOS, A. P. An Increase in the Omega-6/Omega-3 Fatty Acid Ratio Increases the Risk for Obesity. Nutrients, v. 8, p. 128, 2016.
SIMOPOULOS, A. P. Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomed Pharmacother, v. 60, p. 502-507, 2006.
SIMOPOULOS, A. P. Omega-3 fatty acids in inflammation and autoimmune diseases. J Am Coll Nutr, v. 21, p. 495-505, 2002.
SIMOPOULOS, A. P.; LEAF, A.; SALEM, N. Essentiality and recommended dietary intakes for omega-6 and omega-3 fatty acids. Ann Nutr Metabol, v. 43, p. 127-130, 1999.
SOLTANI, S. K.; JAMALUDDIN, R.; TABIBI, H.; MOHD YUSOF, B. N.; ATABAK, S.; LOH, S. P.; RAHMANI, L. Effects of flaxseed consumption on systemic inflammation and serum lipid profile in hemodialysis patients with lipid abnormalities. Hemodial Int, v. 17, p. 275-281, 2013.
TABLET, F.; RYE, K.A. High-density lipoprotein, inflammation and oxidative stress. Clin Sci, v. 116, p. 87-98, 2009.
TAN, M. H. HDL-cholesterol the negative risk factor for coronary heart disease. Ann Acad Med Singapore, v. 9, p. 491-495, 1980.
THOMPSON, L. U. Potential health benefits and problems associated with antinutrients in foods. Food Res Int, v. 26, p, 131-149, 1993.
TORKAN, M.; ENTEZARI, M. H.; SIAVASH, M. Effect of flaxseed on blood lipid level in hyperlipidemic patients. Rev Recent Clin Trials, v. 10, p. 61-67, 2015.
TROINA, A. A.; FIGUEIREDO, M. S.; MOURA, E. G.; BOAVENTURA, G. T.; SOARES, L. L.; CARDOZO, L. F. et al. Maternal flaxseed diet during lactation alters milk composition and programs the offspring body composition, lipid profile and sexual function. Food Chem Toxicol, v. 48, p. 697-703, 2010.
TRUCOM, C. A. Importância da linhaça na saúde. São Paulo: Alaúde, 2006. p. 151.
TURATTI, J. M. Óleos vegetais como fonte de alimentos funcionais. Óleos Grãos, v. 56, p. 20-27, 2000.
UNICAMP. UNIVERSIDADE ESTADUAL DE CAMPINAS. 2011. Tabela brasileira de composição de alimentos – TACO. 4. ed. rev. e ampl. Campinas: UNICAMP/NEPA, 2011. 161 p. Disponível em: <http://www.unicamp.br/nepa/taco/tabela.php?ativo=tabela>. Acesso em: 20 out 2012.
USP. UNIVERSIDADE DE SÃO PAULO. Tabela Brasileira de composição de alimentos. 2017. Disponível em: <http://www.fcf.usp.br/tbca/>. Acesso em: 01 ago 2018.
VALENZUELA, B. R.; TAPIA, G. O.; GONZÁLEZ, M. E.; Valenzuela A. B. Ácidos grasos omega-3 (epa y dha) y su aplicación en diversas situaciones clínicas. Rev chilena nutr, v. 38, n.3, p. 356-367, 2011.
VAN GAAL, L. F.; MERTENS, I. L.; BLOCK, C. E. Mechanisms linking obesity with cardiovascular disease. Nature, v. 444, p. 875-880, 2006.
VEIGA, J.V.F.D. Estudo do consumo de plantas medicinais na Região Centro-Norte do Estado do Rio de Janeiro: aceitação pelos profissionais de saúde e modo de uso pela população. Rev Bras Farmacogn, v. 18, p. 308-313, 2008.
VERHEUS, M; GILS, CHV; KEINAN-BOKER, L; GRACE, PB; BINGHAM, SA; PEETERS; PHM. Plasma Phytoestrogens and Subsequent Breast Cancer Risk. J Clin Oncol, v. 25, p. 648-655, 2007.
WATKINS, B. A.; LI, Y.; ALLEN, K. G. D.; HOFFMANN, W. E.; SEIFERT, M. F. Dietary ratio of (n-6)/(n-3) polyunsaturated fatty acids alters the fatty acid composition of bone compartments and biomarkers of bone formation in rats. J Nutr, v. 130, p. 2274-2284, 2000.
WHO. WORLD HEALTH ORGANIZATION. Global status report on non-communicable diseases 2010. Geneva: WHO, 2010.
WHO. WORLD HEALTH ORGANIZATION. Guiding principles for complementary feeding of the breastfed child. 2003.
WHO. WORLD HEALTH ORGANIZATION. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. WHO Technical Report Series 854. Geneva; 1995.
WIESENBORN, D.; DODDAPANENI, R.; TOSTENSON, K.; KANGAS, N. Kinetic characterization of cooking-induced changes in crambe seed prepared for expelling. J Food Engineering, v. 55, p. 157-163, 2002.
WU, H.; DWYER, K.M.; FAN, Z.; SHIRCORE, A.; FAN, J.; DWYER, J.H. Dietary fiber and progression of atherosclerosis: the Los Angeles Atherosclerosis Study. Am J Clin Nutr, v.78, p.1085-1091, 2003.
XAVIER, H. T.; IZAR, M. C.; FARIA NETO, J. R.; ASSAD, M. H.; ROCHA, V. Z.; SPOSITO, A. C. et al. V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose. Arq Bras Cardiol, v.101, 2013.
[1] Bacharel em Nutrição-Universidade Celso Lisboa- UCL / Pós-graduação “lato sensu” em Nutrição Clínica Avançada: Metabologia, Terapêutica Nutricional e Dietotepia- Universidade Braz Cubas –UBC/ Pós-graduação “lato sensu” em Fitoterapia Aplicada à Nutrição Clínica –Paraíso do Norte Faculdade- UNIF.
[2] Bacharel em Nutrição-Universidade Federal Fluminense (UFF); Pós-graduação “lato sensu” em Nutrição Esportiva e Estética com Ênfase em Wellness – Faculdade São Camilo, FSC; Mestrado em Ciências Médias-Universidade Federal Fluminense (UFF).
Enviado: Março, 2020.
Aprovado: Abril, 2020.
