ARTIGO ORIGINAL
FERREIRA, Sabrina Cassia Pereira [1], GAVAZZI, Regiane Mayara [2], D’AMELIO, Monica Tais Siqueira [3]
FERREIRA, Sabrina Cassia Pereira. GAVAZZI, Regiane Mayara. D’AMELIO, Monica Tais Siqueira. Adsorção de Cobre em meio líquido pela casca de banana. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 08, Vol. 04, pp. 98-118. Agosto de 2019. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/engenharia-quimica/adsorcao-de-cobre
RESUMO
A adsorção é uma das principais operações unitárias praticadas na indústria química. No tratamento de efluentes também tem demonstrado ser um método eficiente e viável. Como uma alternativa, mais rentável e ecológica aos adsorventes convencionais surgiu os bioadsorventes. A casca de banana é um bioadsorvente de fonte renovável, de baixo custo, além de apresentar afinidade por metais pesados. Uma vez que esses metais são descartados em um efluente industrial ocasionam sérios problemas ambientais e riscos à saúde humana. Em vista desta problemática, este trabalho visou avaliar o potencial adsortivo da casca de banana prata do metal cobre. As cascas de bananas foram secas e moídas para então serem utilizadas como adsorvente. Foram realizados cinco testes variando a concentração e a temperatura da solução de sulfato de cobre, com o objetivo de identificar a melhor condição do meio para melhor desempenho na adsorção deste bioadsorvedor. Posteriormente foram construídas as isotermas e avaliado seu perfil adsortivo. O melhor resultado das isotermas ocorreu à temperatura mais alta, de 40° C, e com concentração mais alta, de 0,75 mol/L. Dessa forma conclui-se que a casca de banana prata tende a ter um potencial adsortivo para este material.
Palavras-Chave: Adsorção, casca de banana, cobre.
1. INTRODUÇÃO
A poluição causada em ambientes aquáticos gerados por resíduos industriais é um grave problema ambiental. Estes contaminantes são constituídos principalmente de metais que são substâncias não biodegradáveis, altamente tóxicas, e bioacumulativas (MELO, 2012). Os íons de cobre e chumbo são encontrados com grande frequência em efluentes industriais, como indústrias de mineração, papel, fertilizantes, tintas e galvanoplastia. (MELO, 2012).
A ingestão destes compostos acima da concentração tolerada pode causar danos ao fígado, rins, irritação no sistema respiratório, vômito e dermatite de contato. Mesmo abaixo da concentração ou em períodos intermitentes de consumo, esses compostos são nocivos por serem bioacumulativos. Nos seres humanos pode gerar efeitos cancerígenos e mutagênicos (MATOS, 2015). De acordo com o Conselho Nacional do Meio Ambiente, o valor máximo permitido desses íons dissolvidos em corpos d’água, é de 1,0 mg L-1.
Dentre os diversos métodos de tratamento dos efluentes, a adsorção tem se apresentado opção viável e eficiente. A adsorção é baseada no princípio de transferência de massa para ocorrer a separação de um ou mais componentes da solução. Na adsorção dos metais, os íons, também chamados de adsorvato, migram da solução líquida para a superfície do material sólido poroso conhecido como adsorvente (MATOS, 2015). Os adsorventes mais utilizados na remoção de íons metálicos agregam impactos ambientais e/ou são de alto custo.
Os bioadsorvedores surgiram a partir da necessidade de alternativas mais baratas de adsorvedores para metais (MARTINS et. al., 2015). Os bioadsorventes são provenientes de matéria orgânica e apresentam alto potencial adsortivo, baixo custo, por serem resíduos de processos, e oriundos de fontes renováveis (VANGHETTI, 2009). A casca da banana é considerada um potencial bioadsorvente de metais devido a sua composição apresentar as macromoléculas que tendem a doar elétrons (VANGHETTI, 2009).
O processo de adsorção é uma das mais importantes operações unitárias da indústria química, utilizada para separação de misturas em petroquímica, na recuperação de produtos e solventes de alto valor agregado e é frequentemente utilizado na remoção de poluentes de efluentes líquidos e gasosos, o que torna muito importante seu estudo e interpretação de resultados (GUELFI, 2007).
Neste âmbito, este projeto utilizou a casca de banana prata como adsorvente, para investigar a eficiência de remoção de metais pesados com base em uma solução sintética de sulfato de cobre. A quantidade de metal adsorvido foi determinada em função do tempo de adsorção, da massa, da granulometria e do tipo de farinha utilizada. Através da farinha in natura e quimicamente tratada.
1.1 METAIS PESADOS
Um metal pesado pode ser definido como os átomos que possuem densidade maior que 6 g/cm3 ou quando seu número atômico é maior que 20. Há grupos de metais pesados que não possuem uma determinada função biológica e quando ingeridos em altas concentrações são tóxicos e, além disso, são bioacumulativos. Um dos principais metais que apresentam tais características são Cd, Hg, Pb, Sb e Bi (SILVA, 2014).
Os metais pesados são classificados como poluentes quando está presente em altas concentrações aos níveis normais de formação. A indústria de uma forma direta ou indireta é particularmente responsável por vários problemas ambientais. A poluição de corpos d´água é um exemplo. Quando estas lançam no meio ambiente altas concentrações de metais pesados, inicia-se um processo de degradação dos recursos naturais, e isso proporciona sérios prejuízos ambientais, como alterações das características físico-químicas da água, redução da biodiversidade e contaminação de organismos vivos. Alguns setores industriais que descartam grandes quantidades de íons metálicos em seus efluentes são: operações de mineração, eletrodeposição, processamento de metal, geração de energia, indústria nuclear e operação especiais (MELO, 2012).
O cobre é um elemento muito utilizado nas indústrias e na agricultura, por isso ele pode representar sérios problemas de contaminação, principalmente dos corpos hídricos, quando descartados de maneira inadequada. A contaminação geralmente ocorre em áreas próximas à mineração e áreas industriais. Para os seres humanos este metal não é caracterizado como tóxico, porém, em caso de toxicidade aguda, o cobre pode se alojar no cérebro, fígado, estômago e urina; os problemas podem ser úlcera gástrica, necroses no fígado e problemas renais (MELO, 2012).
1.2 PROBLEMAS CAUSADOS POR METAIS PESADOS
Embora alguns metais sejam necessários para o desenvolvimento de microorganismos, plantas e animais, em grandes concentrações tornam-se perigosos, quando introduzidos na cadeia alimentar que ocorre, geralmente, pelo consumo de organismos contaminados. Quando os metais pesados são ingeridos, mesmo que em baixas quantidades, por serem bioacumalativos, atingem as concentrações consideradas tóxicas para os seres humanos. Os efeitos são cancerígenos e mutagênicos.
O descarte inadequado dos efluentes industriais que contém metais pesados em aquíferos ocasionam também sérios problemas ambientais. Desta forma, faz-se necessária a purificação dos efluentes que contém íons metálicos, porém os tratamentos convencionais utilizados na remoção desses apresentam um elevado custo e não atingem máxima eficiência. Uma alternativa aos processos tradicionais é o uso de biomassa em processo de adsorção uma vez que estes materiais podem ser acumuladores de metais, são eficientes e de baixos custos (MELO, 2012).
1.3 ADSORÇÃO
A adsorção é uma operação unitária na qual os sólidos retêm, em sua superfície, substâncias contidas em fluidos. Na adsorção o soluto (adsorvato) se dissemina de um gás ou de um líquido (fluido) para a superfície de um sólido (adsorvente), assim forma-se uma fase adsorvida diferente (TADINI et. al., 2016).
A adsorção ocorre quando as moléculas de soluto, disseminadas em um fluido, entram em contato com o adsorvente e são retidas em sua superfície porosa por forças atrativas, geralmente interações de Van der Waals. Assim quanto maior a porosidade do sólido, melhor será o processo de adsorção (TADINI et. al., 2016).
O fenômeno de adsorção pode ser classificado de acordo com a intensidade da força atrativa, que depende da temperatura e pressão nas quais será realizada a adsorção, das características da superfície do adsorvente e do adsorvato. Desta maneira, tem-se dois tipos de adsorção: a adsorção física, ou fisissorção e a adsorção química ou quimissorção. A fisissorção ocorre a partir de forças atrativas fracas, Van der Waals, o que a torna rapidamente reversível. Além disso, em fase líquida, a quantidade de energia envolvida é pequena, o que leva a um rápido equilíbrio entre a fase fluida e o adsorvato. Outro fator importante é a energia de ativação, que normalmente na fisissorção é muito baixa ou nula. A quimissorção ocorre através do compartilhamento de elétrons, o que gera interações mais específicas entre a primeira camada de adsorvato e o adsorvente. A quimissorção ocorre apenas na primeira camada de concentração do soluto, na superfície do adsorvente. Na adsorção química a energia de ativação é mais alta, porém, é menor que a energia utilizada por uma reação (TADINI et. al., 2016).
1.4 CARVÃO ATIVADO
O carvão ativado é um dos adsorventes mais utilizados na indústria proveniente da pirólise de materiais vegetais seguido de um processo de ativação. A ativação pode ser química ou física e é realizada com a finalidade de aumentar os poros na superfície do carvão, o que promove o aumento da capacidade adsortiva (MATOS, 2015). A pirólise trata-se da queima do material em atmosfera inerte, a uma temperatura superior a 200 ºC. Nesta etapa o material perde componentes voláteis e gases leves, o que irá gerar um material poroso. No entanto, esses poros podem ser moderadamente obstruídos, o que torna o carvão ineficiente. Assim é essencial realizar a ativação do carvão, a qual pode ser química ou física (ALMEIDA, 2016).
Na ativação química proporciona-se a mistura da matéria-prima com um agente ativante e, então, realiza-se a carbonização em temperaturas entre 400 – 1000 ºC que em seguida é resfriado e lavado. Na ativação física o material é sujeito a temperaturas entre 800 – 1000 ºC em atmosfera com baixo teor de oxigênio. Após são inseridas substâncias gasosas como: ar, vapor de água ou dióxido de carbono, o que gera reações com formação de gás e, assim, é resfriado e lavado para realizar a correta separação das partículas (MATOS, 2015).
Usualmente utilizam-se, para a formação do carvão ativado, materiais orgânicos como: açúcar, carvão mineral, casca de coco, caroço de azeitonas e de frutas, madeiras e resíduos agroindustriais (MATOS, 2015).
1.5 CASCA DE BANANA COMO BIOADSORVENTE
A casca de banana corresponde a cerca de 47 a 50% do peso total da fruta madura, sendo que, sua composição é de 75% de água e 25% de matéria seca, apresenta substâncias químicas como vitaminas, glicose e sacarose, que são capazes de atuar como ligantes dos íons metálicos de efluentes líquidos. Por suas características, a casca de banana é uma opção para tratar efluentes contaminados por metais pesados (SILVA, 2014). A utilização da casca de banana como bioadsorvente diminui os impactos ambientais de duas formas; reduz a massa residual que geralmente se torna um poluente pelo o grande acúmulo e podem ser utilizadas como um método alternativo de baixo custo para tratamento de efluentes contaminados por metais pesados (BONIOLO, 2008).
1.6 ISOTERMA
As isotermas descrevem a relação de equilíbrio das concentrações na fase líquida ou gasosa e na superfície do sólido em uma dada temperatura, o que possibilita definir o melhor adsorvente para adsorção e avaliar a capacidade adsortiva do adsorvente (ALMEIDA, 2016).
Em um sistema líquido, as isotermas relacionam a quantidade de adsorvato adsorvido com a concentração (ALMEIDA, 2016). A IUPAC relata a existência de seis tipos de curvas isotermas, demonstrados na Figura 1.
Figura 1 – Tipos de Isotermas IUPAC.

- Tipo I – indica que a adsorção é em monocamadas, e que o adsorvente possui microporos, ou seja, os poros são menores ou iguais às partículas de adsorvato o que resulta em uma pequena superfície externa (ALMEIDA, 2016).
- Tipo II – demonstra uma adsorção em multicamadas, em que os adsorventes não apresentam poros ou apresentam macroporos. Esta adsorção é resultante de interações fortes entre o soluto adsorvido e o adsorvente. A primeira inflexão da curva ocorre quando a primeira camada de adsorção é saturada. A partir disso, ocorrem as formações das multicamadas (ALMEIDA, 2016).
- Tipo III – ocorre quando o soluto a ser adsorvido tem baixa afinidade com o adsorvente, o que resultará em interações muito fracas entre adsorvente e adsorvato. Os adsorventes apresentam macroporos ou não possuem poros. Com tudo ao longo do processo a interação aumenta, devido à retenção do adsorvato no adsorvente, ou seja, quanto maior a quantidade de soluto adsorvida, maior a interação (TADINI et. al., 2016).
- Tipo IV – a adsorção ocorre com histerese, que é a não sobreposição das curvas ou de partes delas. Os adsorventes são constituídos de mesosporos. Através da histerese é possível encontrar o tamanho e o volume de cada material (TADINI et. al., 2016).
- Tipo V – aproxima-se da curva IV, porém com interações muito fracas entre o adsorvato e o sólido adsorvente (TADINI et. al., 2016).
- Tipo VI – nesta curva a adsorção ocorre a partir de adsorventes não porosos, com superfície quase uniforme (ALMEIDA, 2016).
Ressalta-se que segundo a teoria de Brunauer, as curvas côncavas para baixo são favoráveis à adsorção (TADINI et. al., 2016). Há vários modelos para explicar a adsorção, porém para dados experimentais utilizam-se modelos de isotermas simples como de Langmuir e Freundlich (TADINI et. al., 2016).
1.7 ISOTERMA DE LANGMUIR
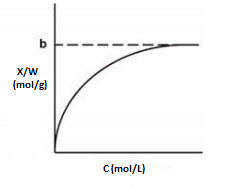
Em 1916, Langmuir expôs um modelo que se adequava melhor à adsorção de monocamada. A isoterma de Langmuir (Figura 4) considera que a energia adsortiva dos sítios são iguais. A adsorção é reversível, não ocorre interações entre as moléculas de soluto adsorvidas (ALMEIDA, 2016). O modelo de Langmuir é proposto pela equação 1:

Onde X é número de moles do soluto dissolvido, W massa do adsorvente, Nm saturação da monocamada, C concentração do adsorvato no equilíbrio e K (m3 · kg-1) é a constante do modelo (ALMEIDA, 2016).
A Equação 1 é linearizada para determinar os valores de Nm e K. A linearização é realizada a partir do método de Linewearver – Buck, como mostra a Equação 2 (NASCIMENTO et. al., 2014):

Figura 2 – Isoterma de Langmuir.
1.8 ISOTERMA DE FREUNDLICH
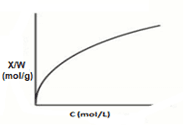
O modelo apresentado por Freundlich demonstra adsorção em multicamadas, em sólidos heterogêneos e pode ser utilizado em sistemas não ideais. A isoterma de Freundlich (Figura 3) realiza a distribuição exponencial de diferentes energias de adsorção (NASCIMENTO et. al., 2014). A Equação 3 explica o modelo de Freudlich:

Onde X é número de moles do soluto dissolvido, W massa do adsorvente, C é a concentração de equilíbrio do soluto na fase fluida, K (kg.m-3)-1/n é a constante do modelo e n é a constante referente a heterogeneidade da superfície do adsorvente, ou seja, indicará a intensidade da adsorção (TADINI et. al., 2016).
Para se encontrar as constantes lineariza-se a equação utilizando logaritmo dos dois lados da equação como demonstrado na Equação 4 (NASCIMENTO et al., 2014):

Figura 3 – Isoterma de Freundlich.
1.9 BIOADSORVENTE CASCA DE BANANA – EVOLUÇÕES
Em busca de matérias de baixo custo e alta eficiência em processos de adsorção, os bioadsorventes ganham cada vez mais espaço em pesquisas. O bagaço de cana, a casca de laranja e a casca de banana são exemplos de bioadsorventes capazes de removerem efluentes contaminados por metais pesados. Segundo Martins (2015), através do método utilizado em sua pesquisa por espectro infravermelho, para caracterização da casca de banana, foi possível detectar grupos funcionais ativos capazes de adsorver metais como celulose, hemicelulose e lignina. De acordo com seus estudos, as mesmas foram capazes de removerem chumbo em cerca de 10 minutos.
Em estudos realizados com a casca de banana do tipo nanica na biossorção de íons chumbo em solução aquosa, Silva (2014) constatou que a remoção de chumbo ocorreu com mais intensidade nos primeiros 10 minutos. O tempo ótimo de remoção para todos os pHs foi de 80 minutos. Além disso, a partir dos modelos matemáticos de Langmuir e Freundlich foi possível verificar que o modelo de Freundlich foi o que melhor descreveu o processo de adsorção, pois apresentou um coeficiente de determinação de 0,9705.
Almeida (2016) estudou o desempenho do compósito feito a partir da casca de banana para remoção de corante azul de metileno. Este compósito foi ativado com nanopartículas de ferrita de manganês (MnFe2O4) e caracterizado por difração de raios X, microscopia eletrônica de varredura e espectroscopia no ultravioleta-visível. O resultado obtido por UV-VIS indicou a diminuição da concentração do azul de metileno em meio aquoso, na presença do compósito magnético feito a partir das cascas de banana, com uma eficiência média de 80% uma vez que o mesmo mostrou maior eficácia na forma de pó.
Por apresentar em sua composição macromoléculas que tendem a doar elétrons, a casca de banana é apontada como um bioadsorvente com ótimas características de adsorção. Além disso, a utilização da casca de banana como bioadsorvente tende a diminuir os impactos ambientais de duas formas; podem ser utilizadas como um método alternativo para tratamento de efluentes contaminados por metais pesados e reduzir a massa residual que geralmente se torna um poluente pelo acúmulo (BONIOLO, 2008).
Por isso, este projeto objetivou estudar as capacidades adsortivas da casca de banana quanto a remoção do metal cobre, através da construção das Curvas de Langmuir e Freundlinch.
2. METODOLOGIA
2.1 PREPARAÇÃO DO ADSORVATO
Para a solução de sulfato de cobre 0,5 mol/L foram pesadas 224,74 g de sulfato de cobre penta hidratado, em seguida, em um béquer, o sulfato foi diluído em água destilada. A solução foi transferida para um balão volumétrico de 2 L o qual foi completado até o menisco.
Além da solução de 0,5 mol/L foram preparadas, também, soluções com concentrações de 0,25 mol/L e 0,75 mol/L.
2.2 ADSORVENTE
O material adsorvente utilizado nos experimentos foi a casca de banana prata. As cascas de banana foram recolhidas na Escola Municipal Professor Doutor Onofre Vargas, localizada em Camanducaia – MG.
As cascas de banana foram colocadas em uma estufa por 72 horas a 60 ºC, temperatura que assegurou as propriedades das cascas. Depois de secas, as cascas foram trituradas em liquidificador. Com o objetivo de retirar toda a coloração liberada pela casca da banana, de modo a não influenciar a leitura do espectrofotômetro, a farinha foi colocada em água destilada por 1 hora e filtrada em coador de pano. Este procedimento foi realizado por 20 vezes, até que a água apresentou aparência transparente. Posteriormente a farinha foi seca novamente em estufa a 60 ºC por um período de 24 horas.
A classificação da farinha obtida foi realizada em peneiras granulométricas. As aberturas utilizadas foram 15, 30, 60 e 120 MESH.
2.3 CURVA DE CALIBRAÇÃO
Para determinar a quantidade de metal adsorvido foi construída uma curva de calibração a partir de concentrações conhecidas de sulfato de cobre: 0,04 mol/L, 0,08 mol/L, 0,12 mol/L; 0,16 mol/L; 0,24 mol/L; 0,32 mol/L; 0,48 mol/L 0,64 mol/L; 0,72 mol/L e 0,80 mol/L que foram analisadas no espectrofotômetro BEL UV-M51 UV-Visível, no comprimento de onda de 650 nm.
Com os dados obtidos, foi construído um gráfico de absorbância por concentração e uma reta foi ajustada. Para a determinação das concentrações, foi utilizada a equação da reta ajustada.
2.4 ISOTERMAS
As Isotermas de Langmuir e Freudlich foram compostas por 9 pontos. Cada curva foi obtida para uma condição de meio de adsorção constante no qual variaram-se as massas do bioadsorvedor em uma solução conhecida de sulfato de cobre, e no final do processo, a concentração da solução foi medida e calculado o rendimento.
Foram elaborados 5 testes, os quais se variaram a concentração da solução padrão e a temperatura do meio, como mostra a Tabela 1. As isotermas foram realizadas em Erlenmeyers de 250 mL, os quais foram mantidos sob agitação magnética constante por duas horas. As quantidades do bioadsorvedor que foram utilizadas em cada béquer, em gramas, foram: 0,05; 0,1; 0,25; 0,5; 0,75; 1,0; 1,25; 1,50; 1,75.
Ao término do tempo de contato, as amostras foram filtradas, através de um funil com papel de filtro. O meio líquido foi analisado no espectrofotômetro BEL UV-M51 UV VISÍVEL no comprimento de onda de 650 nm, para comparar com a solução de sulfato de cobre padrão.
Tabela 1 – Variações da concentração e temperatura das isotermas
| Testes | Concentração – Solução Padrão (mol/L) | Temperatura (ºC) |
| 1 | 0,25 | Ambiente |
| 2 | 0,50 | Ambiente |
| 3 | 0,75 | Ambiente |
| 4 | 0,75 | 8-10º |
| 5 | 0,75 | 38-40º |
FONTE: Próprio Autor.
A partir destes dados foram construídas as curvas de Langmuir e Freundlich, cujo eixo y apresenta a divisão do número de moles adsorvido (X) pela quantidade de adsorvente utilizado (W), e o eixo x, a concentração da solução coletada (mg/L).
2.5 DETERMINAÇÃO DAS CONSTANTES DE LANGMUIR E FREUNDLICH
Após obtenção das isotermas foi possível plotar os respectivos gráficos de Langmuir e Freundlich em seguida foram realizadas as linearizações de ambos conforme equações 4 e 6 respectivamente. Para linearização de Langmuir determinou-se o valor de Nm que representa o coeficiente linear da reta e K a partir do coeficiente angular. O mesmo foi realizado para a linearização de Freundlich, K representa o coeficiente linear e n o coeficiente angular.
3. RESULTADOS E DISCUSSÃO
3.1 CURVA DE CALIBRAÇÃO
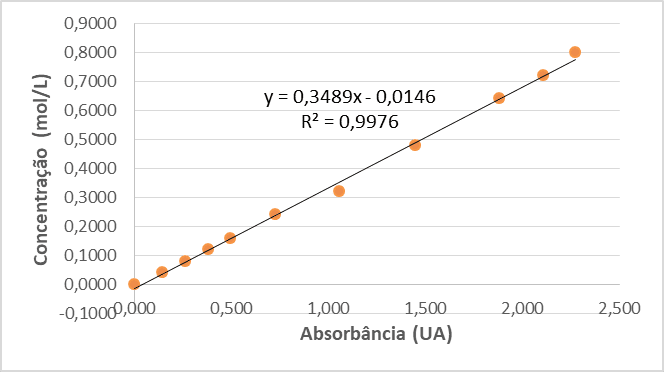
Para determinar a concentração de cobre adsorvida pela casca de banana foi construída uma curva de calibração, Figura 4, com o auxílio de um espectrofotômetro de luz visível com concentrações de 0,04 mol/L à 0,8 mol/L. A Figura 4 mostra a reta obtida.
Conforme observado, o fator de correlação R² foi próximo de 1 (R² = 0,9976), o que indica alto grau de representatividade do ajuste. A equação da reta obtida foi utilizada para obter as concentrações de Sulfato de Cobre nos experimentos realizados.
Figura 4 – Curva de Calibração.
3.2 INFLUÊNCIA DA CONCENTRAÇÃO
Para determinar a influência da concentração do soluto na capacidade de adsorção da casca de banana construíram-se três isotermas a partir de concentrações distintas: 0,25 mol/L, 0,50 mol/L e 0,75 mol/L. A Figura 5 apresenta as três curvas obtidas.
Figura 5 – Isotermas: influência da concentração do soluto.
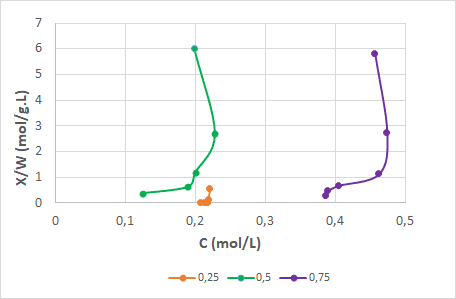
Ao observar os seus respectivos gráficos notou-se que a característica das três curvas apresentou comportamento desfavorável. De acordo com a IUPAC, as isotermas obtidas se assemelham ao Tipo III, demonstrado na Figura 1. Este tipo de isoterma significa que o soluto adsorvido, no caso o cobre, apresenta baixa afinidade com o adsorvente, casca de banana. Consequentemente, este fato resultará em interações muito fracas entre adsorvente e adsorvato.
Quando se avaliam as três curvas, nota-se que, independente da concentração, as características são as mesmas, ou seja, a quantidade de soluto não interfere na adsorção. Por isso, com o intuito de melhorar a capacidade adsortiva da casca de banana, foram realizados testes com a variação da temperatura.
3.3 INFLUÊNCIA DA TEMPERATURA
A fim de determinar a influência da temperatura no meio de adsorção com a casca de banana, três testes foram realizados, com a concentração de 0,75 mol/L. As temperaturas variaram da seguinte forma: 8-10ºC (temperatura fria), 25-26ºC (temperatura ambiente) e 38-40ºC (temperatura quente). A Figura 6 apresenta as três curvas construídas.
Figura 6 – Isotermas com variação de temperatura.
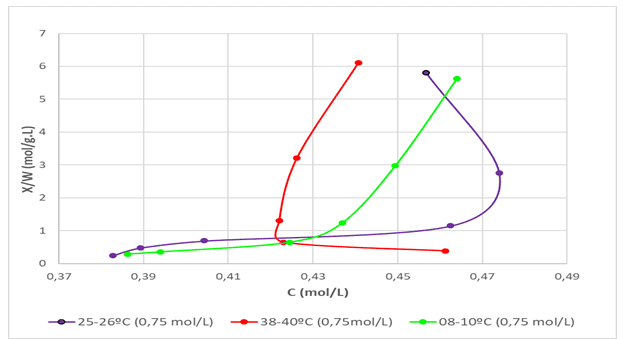
É possível observar na Figura 6 que a curva construída a uma temperatura maior obteve um comportamento diferente das isotermas de temperatura ambiente e fria. A curva obtida na temperatura maior que a ambiente apresentou características de comportamento favorável. Segundo TADINI et al. (2016), altas temperaturas favorecem a quimissorção, ou seja, a adsorção em monocamadas. Assim conclui-se que a isoterma à temperatura maior é uma isoterma de Langmuir. É possível também obter esta constatação visualmente, comparando as Figuras 2 e 3 com a Figura 5. TADINI et al. (2016), afirmam ainda que baixas temperaturas favorecem a adsorção em múltiplas camadas, fisissorção, o que explica o fato das curvas obtidas à temperatura fria e ambiente serem desfavoráveis, como mostra a Figura 1 (Tipo III).
3.4 DETERMINAÇÃO DAS CONSTANTES DE ADSORÇÃO
A curva utilizada para se realizar a linearização foi a isoterma de 0,75 mol/L com temperatura de 40°C, pois foi a única que obteve uma característica favorável. Através dos modelos matemáticos de Langmuir e Freundlich determinou-se suas constantes através das retas obtidas a partir da linearização conforme as Figuras 7 e 8.
Figura 7 – Linearização- Isoterma de Langmuir.
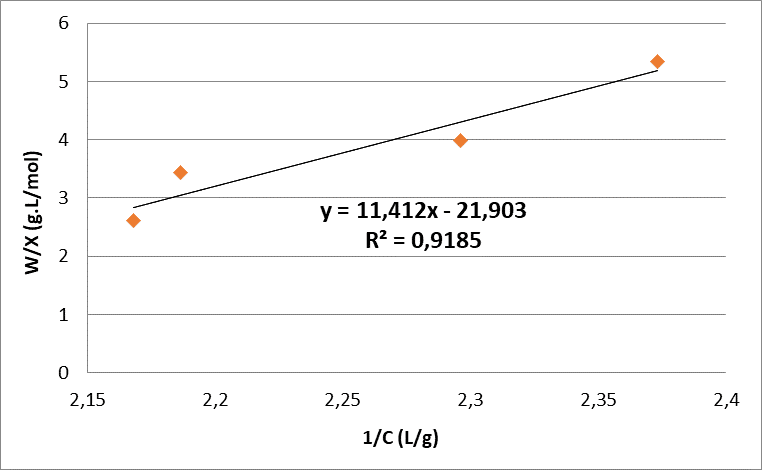
Figura 8 – Linearização- Isoterma de Freudlich.

Quando se avalia os dois modelos linearizado das isotermas, percebe-se que a isoterma se ajusta melhor ao modelo de Langmuir, uma vez que seu R² teve um valor mais próximo de 1, ou seja, a adsorção ocorre através de monocamadas, quimissorção. Além disso, determinou-se os valores das constantes de cada modelo, para verificar a capacidade adsortiva da casca de banana, conforme a Tabela 2.
Tabela 2 – Constantes dos modelos de Langmuir e Freudlich.
| Constantes de Langmuir | Constantes de Freudlich | ||||
| Nm (mol/g) | K (L/mol) | R2 | N (mol/g) | K (L/mol) | R2 |
| -0,0456 | -1,919 | 0,9185 | 0,1502 | 60,280 | 0,8978 |
FONTE: Próprio Autor.
Segundo Almeida (2016) para o modelo de Langmuir a constante Nm representa a saturação da monocamada de adsorção. O autor afirma também que o modelo Langmuir se adequa melhor à adsorção em monocamada, portanto quanto maior o valor de Nm, melhor será a adsorção. Ao observar a Tabela 2 é possível verificar que este valor foi negativo, isso significa que sua capacidade adsortiva foi baixa.
Já para o modelo de Freundlich, Nascimento et al. (2014) afirmam que, se os valores de n estiverem na faixa 1 < n < 10, indicam uma adsorção favorável. Observou-se na Tabela 2 que o valor de n é inferior a 1, o que a torna desfavorável a este modelo.
A partir dos valores encontrados é possível afirmar que, embora a isoterma com temperatura elevada tenha obtido um comportamento favorável, com o côncavo para baixo, ela não apresentou essas características nos cálculos das constantes, pois a adsorção provavelmente foi muito pequena e não atingiu as faixas esperadas além, disso, esses resultados mostraram que a casca da banana prata não possui afinidade adsortiva com o cobre. Entretanto, além do tratamento térmico outros tipos de tratamento, como tratamento ácido ou básico podem ser aplicados a casca de banana para verificar se o seu potencial adsortivo irá aumentar.
4. CONCLUSÕES
Neste trabalho avaliou-se o potencial da casca de banana prata como adsorvedor, através de isotermas, nas quais foram variadas as concentrações e as temperaturas.
Ao variar a concentração concluiu-se que as três isotermas apresentaram o mesmo comportamento desfavorável, o que indicou que a quantidade de soluto não interfere na adsorção.
Com a variação da temperatura concluiu-se que em temperatura maior a isoterma de concentração de 0,75 mol/L apresentou, visivelmente, ser favorável ao modelo de Langmuir, porém ao realizar os cálculos das constantes, os valores não foram favoráveis a nenhum dos dois modelos, pois não atingiram a faixa esperada, devido à pouca adsorção do metal.
A casca de banana prata não apresentou afinidade significativa de adsorção do metal cobre. Assim, sugere-se continuar testes modificando o método de tratamento da casca da banana, além de testar outros tipos de metais.
5. REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, T. S. Remoção de Azul de Metileno Utilizando um Compósito Magnético. Dissertação (Mestrado em Ciência dos Materiais). Rio de Janeiro, 2016. Disponível em: <www.ime.eb.mil.br/arquivos/teses/se4/cm/Dissertacao_Thais_Sousa_Almeida.pdf>. Acesso em: 17/05/2018.
ARAÚJO, N. K. C. Estudo da Eficiência dos Adsorventes de Al2O3 e Fe/ Al2O3 para a Remoção de BTX Presente em Água Contaminada por Gasolina – RN. 2016. Dissertação (Mestrado em Ciência de Engenharia do Petróleo) – UFRN. Natal, 2016. Disponível em: <https://repositorio.ufrn.br/jspui/bitstream/123456789/21100/1/NayonaraKarolynneCostaDeAraujo_DISSERT.pdf>. Acesso em: 17/05/2018.
BONIOLO, M. R. Biossorção de Urânio nas Cascas de Banana – SP. 2008. Dissertação (Mestrado em Ciências na Área de Tecnologia Nuclear – Materiais) – USP. São Paulo, 2008. Disponível em: <file:///C:/Users/Usuario/Downloads/MilenaRodriguesBoniolo.pdf>. Acesso em: 10/03/2018.
GUELFI, L. R. Estudo de Adsorção Para Purificação e Separação de Misturas na Indústria Petrolífera. Monografia; Universidade Federal do Paraná; Agência Nacional de Petróleo; 2007.
MARTINS, W. A.; OLIVEIRA, A.M.B.M.; MORAIS, C.E.P.; COELHO, L.F.O.; MEDEIROS, J.F. Reaproveitamento de Resíduos Agroindustriais de Casca Banana para Tratamento de Efluentes. Revista Verde (Pombal – PB.) vol.10 nº.1 Pombal – PB. Jan./Mar. 2015.
MATOS, S. M. Operações Unitárias. São Paulo, SP. ERICA. 2015; 1ª ed. 10.3c.
MELO, S. S. Produção de carvão ativado a partir da biomassa resudual da castanha do brasil para adsorção do cobre (II). 2012. Dissertação (Mestrado em Engenharia Química). Universidade Federal do Pará, Belém – PA.
MOREIRA, D. R. Desenvolvimento de adsorventes naturais para tratamento de efluentes de galvanoplastia. 2010, 79f. Dissertação (Mestrado em Engenharia e Tecnologia de Materiais), Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre – RS, 2010.
NAKADI, F. V. Estudo da Biodisponibilidade, Mobilidade e Distribuição de Chumbo e Cádmio em Solos, por ET AAS – SP. 2011. Dissertação (Mestrado em Química) – Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto/USP. Ribeirão Preto, 2011. Disponível em: <file:///C:/Users/Usuario/Downloads/NakadiFV_dissertacao%20(1).pdf>. Acesso em: 17/05/2018.
NASCIMENTO, R. F. et al. Adsorção: Aspectos Teóricos e Aplicações Ambientais. Fortaleza, CE. UFC. 2014; 30,35p.
SILVA, N. C. R Utilização da casca de banana como biossorvente para adsorção de chumbo (II) em solução aquosa. – PR.2014. Dissertação (Graduação em Engenharia Ambiental) – UTFPR. Campo Mourão, 2014. Disponível em: <repositorio.roca.utfpr.edu.br/jspui/bitstream/1/5168/1/CM_COEAM_2014_1_18.pdf>. Acesso em: 08/04/2018.
SOUZA, J. V. T. M. et. Al. Adsorção de Cromo (III) por Resíduos de Laranja In Natura e Quimicamente Modificados. Semin., Ciênc. Exatas Tecnol. (Londrina – PR) v. 33, n. 1, p. 03-16, 2012.
TADINI, C. et al. Operações Unitárias na Indústria de Alimentos. Rio de Janeiro, RJ. LTC. 2016; v.2. 23c.
TAKAHASHI, Yoshikazu e OSADA Takahashi. TPM/MPT: manutenção produtiva total. IMAM, 2002.
VANGHETTI, J. C.P. Utilização de Bioadsorventes para Remediação de Efluentes Aquosos Contaminados com Íons Metálicos – RS. 2009. Tese (Doutorado em Química) – UFRGS. Porto Alegre, 2009. Disponível em: <http://www.lume.ufrgs.br/bitstream/handle/10183/17482/000709030.pdf?sequence=1>. Acesso em: 15/03/2018.
VILAS BOAS, Adriano Toledo. Gestão da Manutenção Produtiva Total: Conceitos e Etapas de Implementação – MG. 2005. Dissertação (Graduação em engenharia de controle e automação) – UFOP. Ouro Preto, 2005. Disponível em: <http://www.em.ufop.br/cecau/monografias/2005/ADRIANO%20TOLEDO.pdf>. Acesso em: 17/05/ 2018.
[1] Acadêmica de Engenharia Química da Universidade São Francisco.
[2] Acadêmica de Engenharia Química da Universidade São Francisco.
[3] Professora na Universidade São Francisco (USF), Pós Doutorado em Ciências Atmosféricas pelo IAG/USP, Doutora em Materiais pelo IPEN/USP, Mestre em Materiais pelo IPEN/USP, Engenheira Química pela UFSCAR.
Enviado: Julho, 2019.
Aprovado: Agosto, 2019.
