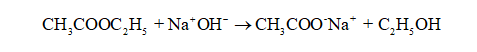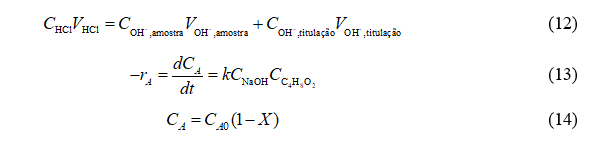ARTIGO ORIGINAL
PIRES, João Felipe de Moraes [1], MARTINS, Daiane Micaelly [2], COELHO, Filipe Alves [3]
PIRES, João Felipe de Moraes. MARTINS, Daiane Micaelly. COELHO, Filipe Alves. Construção de reatores contínuos: Tanque agitado e Reator Tubular para avaliação de desempenho na reação de saponificação do Acetato de Etila. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 10, Vol. 02, pp. 176-200. Outubro de 2019. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/engenharia-quimica/construcao-de-reatores
RESUMO
Diante da constante necessidade de aprimoramentos nos processos, reatores químicos são evidenciados como “coração” dos processos devido à sua função determinante. Assim sendo, o presente artigo sugere o estudo avaliativo e comparativo entre dois reatores: Reator tanque agitado contínuo e o reator tubular. Para obtenção dos dados avaliativos foi necessário o estudo da cinética da reação de saponificação do acetato de etila, reação com a cinética bem estabelecida. O estudo da cinética foi primordial devido a necessidade do conhecimento da velocidade da reação para posterior realização dos cálculos de conversão dos reatores. Assim, após avaliação e comparação por meio de diversos experimentos, foi possível concluir que o reator tubular apresenta uma conversão 17,3% superior a conversão do tanque agitado para uma operação com volume pré-definido, além de apresentar maior praticidade operacional.
Palavras-Chave: Cinética, reatores CSTR e PFR, saponificação.
1. INTRODUÇÃO
Os reatores químicos são equipamentos onde ocorrem transformações químicas tanto em escala laboratorial quanto industrial. Eles são utilizados tanto em indústrias químicas, como petrolíferas, alimentícias e farmacêuticas. No desenvolvimento de um reator químico, é dever do engenheiro químico considerar diversos parâmetros, dentre eles: tipo de reator, condições operacionais, funcionamento, dimensionamento a fim de obter o máximo de aproveitamento do equipamento e avaliar as adversidades impostas pela natureza das matérias e os custos envolvidos no processo (FOGLER, 2009).
Os principais e mais conhecidos reatores nas indústrias são: reator em batelada, tanque de mistura, reator tubular e reator semibatelada. Tais reatores são dimensionados por meio da velocidade de cada reação, ou seja, sua cinética.
A cinética química tem como finalidade caracterizar e analisar os aspectos que interferem na velocidade de uma determinada reação química. No estudo da cinética química é importante considerar alguns fatores como concentração, temperatura, pressão, natureza do solvente e do substrato para o desenvolvimento dos reatores químicos (FOGLER, 2009). Segundo Fogler (2009): “A cinética química e o projeto de reatores estão no coração de quase todos os produtos químicos industriais. É, principalmente, o conhecimento da cinética química e o projeto do reator que distinguem o engenheiro químico dos outros engenheiros”
A reação de saponificação do acetato de etila (CH3COOCH2CH3), é uma reação química que normalmente ocorre entre um éster e uma base inorgânica, obtendo como produtos finais, um álcool e um sal orgânico. Neste trabalho, foi escolhida esta reação, devido à grandeza de dados e informações disponíveis na literatura que auxiliam a prever seu comportamento durante sua reação. Além disso, é uma reação de fácil manuseio dos reagentes, estável a baixas temperaturas reacionais e baixo risco de manipulação, pois trata-se de uma reação de comportamento previsível (MORAIS, 2015).
No presente trabalho foram desenvolvidos dois reatores (reator tanque agitado contínuo e reator tubular), nos quais foram dimensionados para realização de uma reação de saponificação do acetato de etila. Devido ao comportamento consideravelmente conhecido dessa reação, a mesma possibilita uma comparação mais detalhada do desempenho de ambos os reatores. A saponificação do acetato de etila ocorre por meio da substituição do íon hidroxila ao grupo acetil, enquanto o íon metálico forma um sal orgânico (MORAIS, 2015).
Dessa forma, é avaliado e comparado o desempenho de ambos os reatores considerando a melhor performance e custos para realização da reação de saponificação do acetato de etila. Em meio a toda essa problemática, foram considerados e estudados diversos fatores como a cinética da reação de saponificação, conversão e aspectos operacionais.
1.1 ESTUDO DA CINÉTICA QUÍMICA DE REAÇÃO – DEFINIÇÃO DA VELOCIDADE DE REAÇÃO
A cinética química trata-se do estudo das velocidades de reação e dos métodos de reação. O projeto de reatores e a cinética química são partes fundamentais da produção de quase todos os produtos químicos industriais. Dessa forma, o fracasso ou o sucesso econômico de uma instalação química industrial está diretamente ligada à seleção de um sistema de reação que funcione de maneira mais eficiente e segura (FOGLER, 2014).
A velocidade de reação refere-se ao consumo de um dado número de mols de uma espécie química para a formação de uma outra. O termo “espécie química” refere-se a qualquer elemento ou composto químico. Assim, uma reação química ocorre quando um número detectável de moléculas de uma ou mais espécies perdem suas características e assumem uma nova forma, decorrente das alterações no tipo ou número de átomos no composto ou mesmo por mudanças na estrutura e configuração desses átomos (ATKINS, 2012).
A constante de velocidade de reação k ou taxa de reação específica de formação de produtos, depende da pressão, concentração e temperatura dos reagentes e produtos da reação. Como a concentração se modifica com o tempo em um sistema de batelada e com posição em um sistema contínuo, a velocidade da reação também depende do tempo e posição. Sabe-se que essa velocidade decresce com a posição ou mesmo o tempo quando o reagente for consumido, tendendo a zero (AHMED, 2010 e FOGLER, 2014).
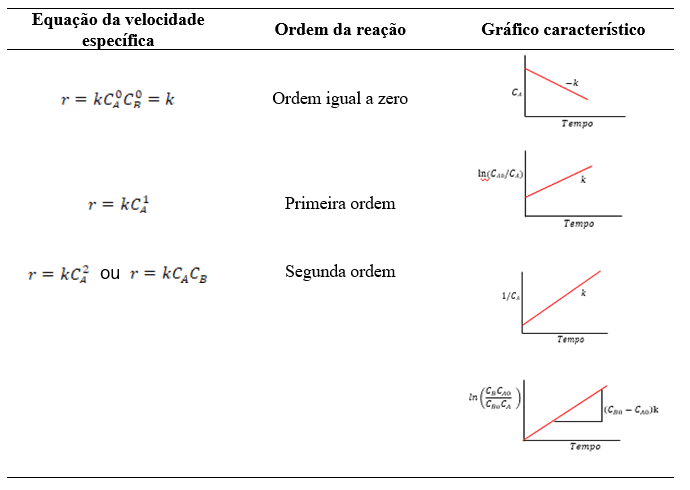
Para muitas reações, o termo dependente da temperatura, que é a constante de taxa, é claramente representado em diversos casos pela lei de Arrhenius, conforme Equação (1). Assim, sabe-se que k0 é chamado de fator de frequência e o Ea é chamado de energia de ativação da reação (LEVENSPIEL, 2000). Na Tabela 1 é possível verificar as equações de velocidade.
Tabela 1 – Equações, ordem de reação e gráficos característicos de cada tipo de ordem.
1.2 REAÇÃO DE SAPONIFICAÇÃO DO ACETATO DE ETILA
A reação de saponificação do acetato de etila foi a reação de referência para os testes do sistema de reatores a serem desenvolvidos no presente trabalho. O estudo dessa reação padrão é fundamental no dimensionamento dos reatores CSTR e PFR que foram projetados nesse artigo. Para tanto é preciso compreender suas características.
O acetato de etila (CH3COOCH2CH3), substância com alta aplicação industrial, trata-se de um éster produzido facilmente na indústria ou em laboratório. É um ótimo solvente de tintas, perfumes e removedor de esmaltes – relativamente volátil, é muito utilizado nas indústrias de fragrâncias e aromas devido ao odor característico frutal de uva doce com nuances de cereja (THE GOODS CENTS COMPANY, 2018).
A reação de saponificação do acetato de etila é uma reação química que acontece entre um éster e uma base inorgânica, obtém-se como produtos finais um álcool e um sal orgânico. O processo de saponificação do éster, ou seja, do acetato de etila ocorre por substituição do íon hidroxila ao grupo acetil, enquanto o íon metálico, no caso do trabalho em questão o sódio, forma um sal orgânico com o íon acetato, continuando ionizado na solução (ATKINS, 2012). Dessa maneira, quando o acetato de etila é saponificado, ocorre a formação do etanol e do acetato de sódio, conforme a reação.
Dessa forma, para que um processo seja robusto, é necessário a intervenção de algumas ferramentas da cinética de reações, tais como a velocidade e a ordem de reação vistas anteriormente, para consequentemente iniciar o dimensionamento dos reatores.
1.3 REATORES
São chamados de reatores químicos os aparelhos ou equipamentos cuja finalidade principal é a realização de uma reação química, por meio de condições controladas, nas quais os produtos obtidos deverão apresentar as especificações desejadas previamente. Os reatores também são recipientes de pressão que são capazes de suportar altas temperaturas e pressões durante as reações químicas, transferências de calor e de massa (SANTOS, 2002).
Os reatores podem ser classificados de acordo a forma de operação, seja contínua ou descontínua. Eles também podem ser categorizados conforme a natureza das fases participantes, ou seja, como reator heterogêneo ou homogêneo. Apontados como o coração de qualquer processo químico, os reatores precisam de atenção especial dos engenheiros químicos, profissionais responsáveis pelo desenvolvimento, controle e operação desse equipamento tão importante (SANTOS, 2002).
1.3.1 REATOR DESCONTÍNUO (BATELADA)
O reator batelada é comumente utilizado em operações de pequena escala, como por exemplo, testes de processos que ainda não foram totalmente desenvolvidos, para processos que são difíceis de se converter em operações contínuas e para fabricação de produtos de alto custo. Nesse tipo de reator, conforme pode ser verificado na Figura 1, os reagentes utilizados são inseridos no reator, sofrem a reação e saem de uma única vez (FOGLER, 2014). A Tabela 2 apresenta as principais vantagens e desvantagens de um reator batelada.
Figura 1 – Reator batelada simples homogêneo.
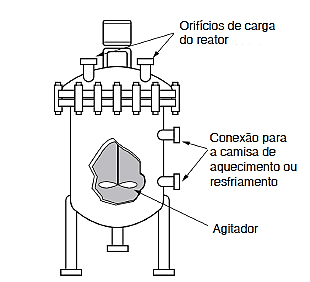
Tabela 2 – Vantagens e desvantagens reatores descontínuos.
| Vantagens | Desvantagens |
| Permite altas conversões; | Alto custo de mão de obra; |
| Possui, em geral, tempo de residência bem estabelecido; | Variação em algumas características dos produtos de batelada para batelada; |
| Flexível para variados tipos de operações; | Dificuldade de produção em grande escala; |
| Facilidade de limpeza; | Apresenta controle de temperatura limitado. |
| Apresenta resultados positivos no controle de processo de reações viscosas. |
Fonte: Adaptada de FOGLER, 2014.
Nos reatores tipo batelada, quanto maior for tempo que os reagentes permanecerem dentro do reator, maior será a conversão deles em produtos, até que os reagentes sejam totalmente consumidos ou que o equilíbrio da reação seja atingido. Assim sendo, no projeto de dimensionamento de reatores tipo batelada, conforme Equação (2), tem-se que a conversão X é uma função do tempo que os reagentes permanecem no interior no tanque (FOGLER, 2014).
Além dos reatores descontínuos existem também os semicontínuos e contínuos. A seguir serão apresentadas características dos reatores semicontínuos que são considerados intermediários entre os descontínuos e contínuos.
1.3.2 REATOR SEMICONTÍNUO
Os reatores semicontínuos, conforme exemplo na Figura 2, operam tanto em batelada como continuamente. Sabe-se também que as composições das reações variam com o decorrer do tempo nesse tipo de reator. Uma das melhores razões para o uso desse tipo de reator é o aumento na seletividade das reações em fase líquida que esse tipo de reator proporciona (FOGLER, 2014). A Tabela 3 retrata as principais vantagens e desvantagens desse tipo de reator.
Figura 2 – Reator semicontínuo.
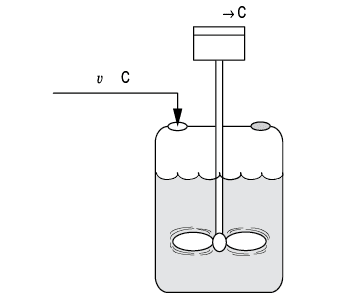
Tabela 3 – Vantagens e desvantagens reatores semicontínuos.
| Vantagens | Desvantagens |
| Fácil controle de temperatura; | Operação difícil de analisar; |
| Facilidade de limpeza; | Alto custo por unidade de produto; |
| Diminuição das reações indesejadas. | Complexidade de produção em larga escala. |
Fonte: Adaptado de LEVENSPIEL, 2000 e FOGLER, 2014.
Conforme visto, os reatores semicontínuos operam tanto descontinuamente como continuamente, ou seja, conforme a implementação da adição dos reagentes e retirada dos produtos determinam sua operação. Na sequência serão apresentados os tipos mais comuns de reatores contínuos assim como suas características.
1.3.3 REATORES CONTÍNUOS: REATOR TANQUE AGITADO (CSTR)
Os reatores de escoamento contínuo geralmente são operados em regime estacionário, sendo os mais comuns: o reator de escoamento uniforme (PFR) e o reator tanque agitado contínuo (CSTR) (FOGLER, 2014).
O reator tanque agitado contínuo (CSTR) é conhecido como reator de retromistura ou tanque de reação, é caracterizado por possuir um agitador que realiza a homogeneização dos reagentes e produtos em meio a um escoamento contínuo, no qual não existe acúmulo de reagentes. Esse tipo de reator é muito utilizado em reações que ocorrem em fase líquida (FOGLER, 2014 e MORAIS, 2015).
Normalmente o CSTR opera suas reações no estado estacionário, tal como Figura 3, onde é possível verificar os padrões de mistura do mesmo. Não existe dependência espacial ou de tempo para com a temperatura, concentração ou mesmo velocidade no interior do reator. Isto é, as medidas dessas variáveis não alteram seus pontos no interior do tanque. Dessa forma, como a concentração e temperatura são iguais em qualquer ponto no dentro do tanque de reação, elas apresentaram o mesmo valor no ponto de saída (FOGLER, 2014).
Os reatores CSTR são utilizados exclusivamente na indústria de processos químicos, tanto como tanque simples ou em bateria de tanques conectados em série. Possuem grande similaridade mecânica e de transferência de calor com os reatores do tipo batelada, porém é imprescindível que haja uma entrada para adição contínua dos reagentes e uma saída contínua para os produtos, dessa forma mantendo o volume constante do reator (FOGLER, 2014 e MORAIS, 2015).
Tal reator pode também ser operado de forma semi-batelada, dessa maneira o mesmo é parcialmente preenchido com uma parcela dos reagentes e em seguida, progressivamente, é adicionada a outra parte de reagentes até que se alcance a composição desejada. Por outro lado, todos os reagentes podem ser carregados de uma única vez e continuadamente remover os produtos (FOGLER, 2014).
Figura 3 – Padrões de mistura em um CSTR.
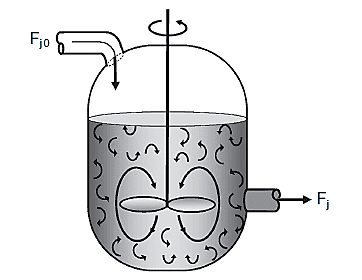
Na Tabela 4 é possível verificar as principais vantagens e desvantagens desse tipo de reator, em relação as suas características mais comuns.
Tabela 4 – Vantagens e desvantagens reatores CSTR.
| Vantagens | Desvantagens |
| Opera continuamente; | Necessita de um alto investimento para implementação da operação continua; |
| Apresenta bom controle de temperatura; | Apresenta uma menor conversão do volume para grande parte de suas reações. |
| Apresenta uma boa mistura e facilidade de limpeza. |
Fonte: Adaptado de FOGLER, 2014.
No dimensionamento dos reatores tipo CSTR, ou seja, para determinar os volumes desse tipo de reator, é necessário o conhecimento da velocidade de reação, visto anteriormente. Em teoria o reator tanque agitado é considerado “perfeitamente misturado”, portanto, a velocidade de reação é calculada nas condições de saída, pois a composição da saída do reator é igual a composição do interior do mesmo. Dessa forma o volume a ser calculado para uma conversão XA pode ser verificado na Equação (3) a seguir (FOGLER, 2014).
O projeto de reator tubular PFR também é detalhado a seguir conforme foi desenvolvido para o CSTR.
1.3.4 REATORES CONTÍNUOS: REATOR TUBULAR (PFR)
O reator Tubular (PFR) é usado comumente no estado estacionário assim como CSTR. Esse tipo de reator consiste em um tubo cilíndrico, onde os reagentes são continuamente consumidos ao decorrer do comprimento do reator. Os reatores tubulares são mais usados para reações em fase gasosa e devido a sua alimentação de reagentes e retirada de produtos ser contínua, esse tipo de reator é muito utilizado em processos que operam em grande escala (FOGLER, 2014).
No reator PFR, conforme apresentado na Figura 4 não existe variação radial de velocidade, concentração ou temperatura ou velocidade de reação dos componentes ao longo da reação. No PFR os reagentes são consumidos continuamente ao longo do reator. Durante a modelagem desse tipo de reator, assume-se que a concentração varia constantemente no sentido axial no decorrer do cumprimento do tanque, dessa forma, com exceção das reações de ordem zero, a taxa de reação irá variar axialmente nas reações de outras ordens (FOGLER, 2014).
Figura 4 – Reator tubular de escoamento uniforme (PFR).
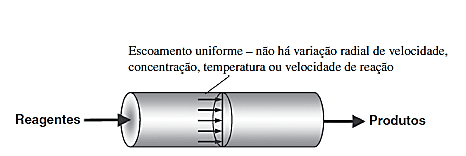
Na sequência, conforme Tabela 5, serão apresentadas as principais vantagens e desvantagens de um reator PFR.
Tabela 5 – Vantagens e desvantagens reatores PFR.
| Vantagens | Desvantagens |
| Opera continuamente; | Apresenta formação de gradientes de temperatura; |
| Possui uma maior conversão de volume em processos contínuos para maioria das reações; | Possui elevado custo de investimento para sua implementação; |
| Possui baixo custo operacional. | Facilidade em obter queda de pressão. |
Fonte: Elaborada a partir de FOGLER, 2014.
Na modelagem de um reator tubular avalia-se seu fluido como de escoamento uniforme, ou seja, sem nenhum gradiente radial de temperatura, concentração ou mesmo velocidade de reação, a conversão desse tipo reator aumenta ao longo do comprimento do mesmo, pois conforme os reagentes entram e escoam de forma axial sentido a saída do reator, os mesmos são consumidos durante esse percurso (FOGLER, 2014). Para desenvolver a equação de projeto do PFR, tomou-se como base a Equação (4) em sua forma diferencial.
Dessa forma para alcançar o volume necessário para uma conversão X, é preciso separar as variáveis por meio da integral, adotando as condições de V = 0 e X = 0 para o seu dimensionamento. Obtendo-se assim a Equação (5) abaixo (FOGLER, 2014).
Para execução bem como avaliação das equações de projeto dos reatores PFR e CSTR é preciso saber como a velocidade de reação varia com a concentração – consequentemente, com a conversão – dos tipos de reagentes. Essa relação foi estabelecida anteriormente no estudo da cinética química de reação já relatado.
2. METODOLOGIA
2.1 DEFINIÇÃO DO PROBLEMA
No presente artigo, onde é proposto através de uma reação de saponificação do acetato de etila – reação com a cinética bem estabelecida – dimensionar, comparar e avaliar o desempenho entre um protótipo de reator tanque agitado contínuo com reator tubular, foi necessário no primeiro momento realizar a determinação da cinética desta reação.
Para realização da determinação da cinética desta reação, tomou-se como base a metodologia apresentada em AHMED (2010) onde por meio da mesma foi possível desenvolver uma metodologia mais detalhada, conforme pode ser verificado nas sessões a seguir.
2.2 EXPERIMENTO PARA DETERMINAÇÃO DA CINÉTICA DA REAÇÃO DE SAPONIFICAÇÃO DO ACETATO DE ETILA
Para realização do experimento inicialmente foram preparadas soluções dos seguintes reagentes: Acetato de etila e hidróxido de sódio nas concentrações apresentadas na Tabela 6. Na sequência utilizou-se um béquer de 250 mL (simulando um reator batelada), onde simultaneamente inseriram-se 100 mL de cada reagente e manteve-se a solução constantemente agitada e verificou-se seu pH a cada 30 segundos a partir do tempo zero durante um período de 12 minutos. Dessa forma, obtiveram-se os cenários expressos na Tabela 6. Ressalta-se que o pH das soluções foi medido inicialmente antes das reações.
Tabela 6 – Cenários dos experimentos realizados pra determinação da cinética química.
| Cenário | Condições das Concentrações |
| 1 | Hidróxido de Sódio 0,1 mol/L + Acetato de Etila 0,1 mol/L |
| 2 | Hidróxido de Sódio 0,05 mol/L + Acetato de Etila 0,1 mol/L |
| 3 | Hidróxido de Sódio 0,1 mol/L + Acetato de Etila 0,05 mol/L |
Fonte: Autoria própria.
O experimento para determinação da cinética foi realizado em uma indústria privada com um pHmetro digital da marca Schott Instruments modelo Lab 850, calibrado e com qualidade assegurada certificada. Dessa forma, com os resultados obtidos, usou-se como referência o artigo de HADKAR (2018) onde, através das Equações (6), (7) e (8) foi calculado o erro de alcalinidade apresentado nas leituras de pH das soluções de Hidróxido de Sódio.
Na sequência obtiveram-se as concentrações ao longo do tempo através das Equações (9), (10) e (11).
Com as concentrações estabelecidas ao longo do tempo foi possível obter a constante cinética (k) e por meio da Equação (1) de Arrhenius obter a velocidade da reação (k0) e energia de ativação (Ea) pelo recurso Solver do Excel, além de desenvolver a cinética teórica no mesmo.
2.3 DESENVOLVIMENTO E DIMENSIONAMENTO DOS PROTÓTIPOS – REATOR TANQUE AGITADO CONTÍNUO E REATOR TUBULAR CONTÍNUO
Para dimensionar os reatores tanque agitado e reator tubular, foi preciso estabelecer como parâmetro a conversão ou volume conforme Equações (3) e (5) respectivamente, no caso optou-se por fixar o volume em 200 mL (volume do reator tubular). Em relação ao reator tanque agitado, verificou-se a necessidade de manter o seu nível constante durante toda reação, onde o somatório das vazões de entrada deve ser igual ao da vazão de saída. Para o reator tubular verificou-se a importância do comprimento e diâmetro da tubulação, para assim iniciar o processo de construção de ambos os protótipos.
Diante das dificuldades de precisão nos materiais disponíveis no mercado, houve necessidade de adaptação dos protótipos em relação à teoria desenvolvida. No caso, iniciou-se o planejamento do processo de construção dos reatores em uma estrutura em madeira MDF onde configurou-se o layout conforme Figura 6.
Figura 6 – Layout dos protótipos.
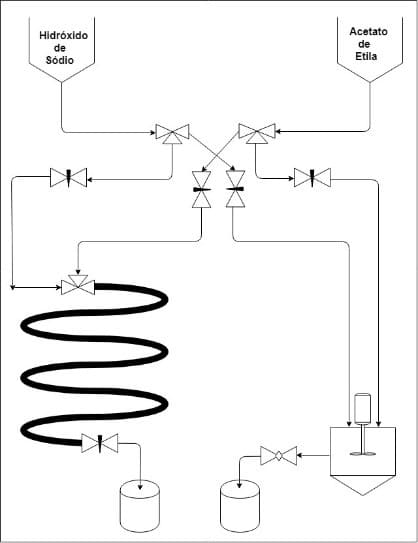
Na configuração do layout é possível observar o planejamento das disposições dos reatores, reservatórios e tubulações. Neste layout os reatores podem ser operados de forma independente ou ainda de forma simultânea, além de permitir diferentes ajustes de vazões para os reagentes e produtos, o que demonstra assim a versatilidade do layout desenvolvido.
2.4 ENSAIOS DE COMPARAÇÃO E VERIFICAÇÃO DE DESEMPENHO ENTRE REATORES CONTÍNUOS TANQUE AGITADO E TUBULAR
Os ensaios de comparação e verificação de desempenho dos reatores tanque agitado e tubular foram realizados após a construção dos protótipos bem como sua estrutura. Durante a etapa dos ensaios, inicialmente foram preenchidos os reservatórios e ajustada as vazões. Na sequência iniciou-se o experimento com os reagentes hidróxido de sódio e acetato de etila. A reação foi realizada primeiro no reator tanque agitado e em seguida no reator tubular.
A fim de realizar análises individuais do desempenho de cada reator, coletaram-se duas amostras de 10 mL de ambos os reatores a partir do momento em que atingiram o estado estacionário. Cada erlenmeyer continha 10 mL de ácido clorídrico 0,1mol/L e 3 gotas de fenolftaleína como indicador. Imediatamente ao adicionar as amostras coletadas ao erlenmeyer, iniciou-se o processo de titulação do excesso de ácido clorídrico. Ressalta-se que as concentrações de alimentação dos reagentes acetato de etila e hidróxido de sódio em ambos os reatores foram de 0,1 mol/L, já a concentração do hidróxido de sódio titulante foi 0,01 mol/L. Na Figura 7 pode ser visualizado o esquema de titulação utilizado para essa reação.
Figura 7 – Esquema de titulação para reação de saponificação do acetato de etila.
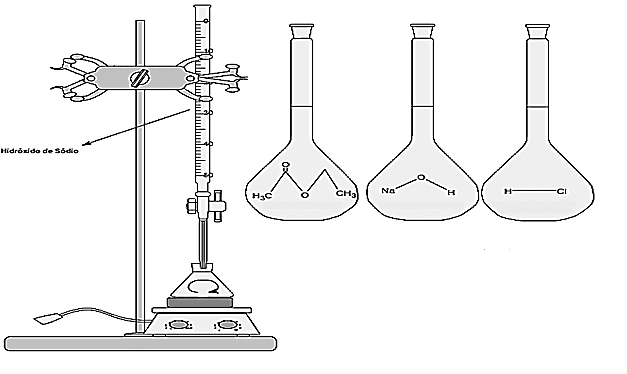
Após a realização das titulações com os dados obtidos no experimento dessa reação, foram calculadas as concentrações por meio da Equação (12) e a constante cinética através da Equação (13). Na sequência foram desenvolvidos os cálculos referentes às conversões para comparação de desempenho de ambos os reatores através da Equação.
3. RESULTADOS E DISCUSSÃO
3.1 DETERMINAÇÃO DA CINÉTICA QUÍMICA DA REAÇÃO DE SAPONIFICAÇÃO DO ACETATO DE ETILA
A determinação na cinética química experimental, conforme detalhado na metodologia, foi obtida através das análises de pH onde com os dados obtidos experimentalmente foi possível, através da Equação (1), juntamente com recurso Solver do Excel, calcular as constantes apresentadas na Tabela 7. Da mesma forma, com o mesmo recurso do Excel, determinou-se a cinética química teórica.
No artigo de KUHELI DAS (2011), foi possível verificar um roteiro para determinar os valores da constante (k0) e energia de ativação (Ea). No presente trabalho utilizou-se da mesma reação (saponificação do acetato de etila) e foi verificado que k0 apresentou um valor de 7,202 L/mol∙s enquanto o determinado no presente artigo foi de 7,051 L/mol∙s, mostrando assim, proximidade entre os valores. Já em relação à energia de ativação, no artigo de KUHELI DAS (2011), foram apresentados valores variados de outros trabalhos (valor médio de 41400 J/mol), porém todos na mesma ordem de grandeza que a energia de ativação deste trabalho, o que atribui essas variações ao desenvolvimento do experimento, visto que foram comuns variações nessa ordem de grandeza.
Na sequência apresentam-se nas Figuras 8, 9 e 10, os gráficos referentes aos experimentos realizados a diferentes concentrações onde é possível comparar as concentrações do hidróxido de sódio experimental (representada pela cor laranja) versus teórica (representada pela cor azul) ambas desenvolvidas no recurso Solver do Excel.
Tabela 7 – Tabela de constantes obtidas via recurso Solver do Excel com os dados da pHmetria.
| Constantes | Resultados |
| Velocidade de reação (k0) | 7,051 L/mol.s |
| Energia de ativação (Ea) | 9229,429 J/mol |
Figura 8 – Cenário 1 – Concentração NaOH x tempo.
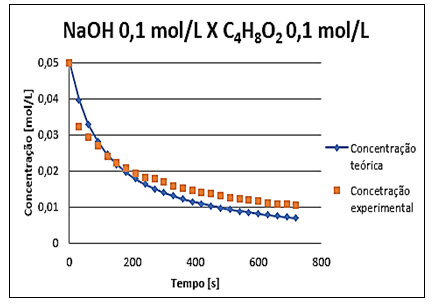
Figura 9 – Cenário 2 – Concentração NaOH x tempo.
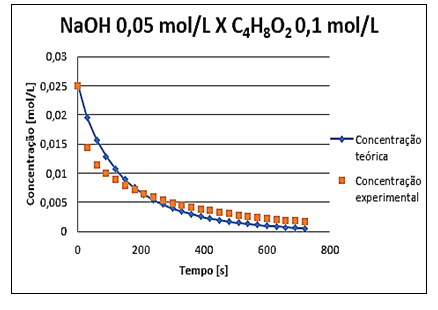
Figura 10 – Cenário 3 – Concentração NaOH x tempo.
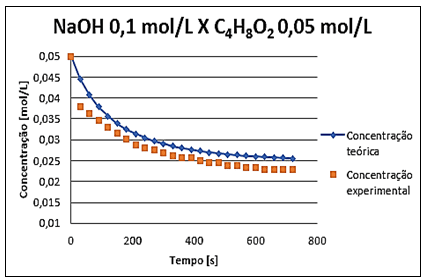
Nos gráficos foi possível observar que os valores teóricos foram próximos aos valores experimentais, o que evidencia a efetividade dos resultados experimentais obtidos. É importante ressaltar que conforme mencionado no tópico da metodologia para determinação da cinética de reação, calculou-se o erro de alcalinidade conforme artigo de HADKAR (2018), onde os erros são apresentados na Tabela 8.
Tabela 8 – Erros de alcalinidade.
| Erro de Alcalinidade | Valor do Erro |
| HADKAR (2018) | 0,3000 |
| Hidróxido de Sódio 0,1 mol/L + Acetato de Etila 0,1 mol/L | 0,3989 |
| Hidróxido de Sódio 0,05 mol/L + Acetato de Etila 0,1 mol/L | 0,2679 |
| Hidróxido de Sódio 0,1 mol/L + Acetato de Etila 0,05 mol/L | 0,4189 |
| Média dos experimentos | 0,3619 |
Na Tabela 8 foi possível verificar que a diferença entre o erro de alcalinidade de HADKAR (2018) e a média dos experimentos foi de 0,0619 o que demostra a similaridade dos experimentos, validando assim a cinética química desenvolvida. Abaixo na Tabela 9 são exemplificadas algumas leituras, considerando o erro de alcalinidade citado na Tabela 8 para o caso entre hidróxido de sódio 0,1 mol/L e acetato de etila 0,1 mol/L.
Tabela 9 – Exemplificações de leituras de pH considerando o erro de alcalinidade.
| Tempo (segundos) | Leitura pH | pH real | pOH | Concentração (mol/L) |
| 0 | 12,30 | 12,6989 | 1,3010 | 0,05 |
| 30 | 12,11 | 12,5089 | 1,4910 | 0,0323 |
| 60 | 12,07 | 12,4689 | 1,5310 | 0,0294 |
| 90 | 12,03 | 12,4289 | 1,5710 | 0,0268 |
| 120 | 11,98 | 12,3789 | 1,6210 | 0,0239 |
Conforme apresentado na Tabela 9, foi possível verificar a leitura do pH em diferentes intervalos de tempo e o pH real, que considera a leitura de pH acrescida do erro de alcalinidade. O pOH foi calculado como 14 subtraído do pH real. Já a concentração foi encontrada através da Equação (11).
3.2 DESENVOLVIMENTO E DIMENSIONAMENTO DOS PROTÓTIPOS – REATORES CONTÍNUOS TANQUE AGITADO E TUBULAR
O resultado final, foi a construção do reator tubular no material cobre, que além de ser um material prático de se trabalhar não comprometeu a efetividade da reação.
No projeto, a estrutura para os protótipos foi composta por duas placas de madeira MDF com as seguintes dimensões: uma com 1,20 m x 1,00 m e a outra 0,80 m x 1,0 m. Além disso foram utilizadas 5 válvulas 1/4 tipo agulha e 2 tês 1/4 para ligação das tubulações aos reatores, o que possibilita a operação individual ou simultânea de ambos os reatores. Para os reservatórios dos reagentes foram utilizados dois funis de separação com capacidade de um litro. Na construção dos reatores foram utilizados materiais distintos, no caso do PFR o mesmo foi construído com uma tubulação 3/8 de 2,60 metros de comprimento. Já o reator tanque agitado foi composto por um frasco mariotte com volume de 1 litro.
Na Tabela 10 verifica-se a relação de custos dos materiais utilizados para construção do projeto.
Tabela 10 – Custos dos materiais utilizados no projeto.
| Material | Custo (R$) |
| Placa de madeira MDF (2 unidades) | 120,00 |
| Funil de separação 1 L marca Laborglas (2 unidades) | 253,66 |
| Frasco Mariote 1 L marca Laborglas – Reator tanque agitado (1 unidade) | 171,05 |
| Haste magnética 8 mm x 50 mm marca Laborglas | 28,25 |
| Tubo de cobre 3/8 com 3 m de comprimento – Reator tubular | 45,00 |
| Mangueira cristal 1/4 com 3m de comprimento (Tubulação) | 6,00 |
| Válvula 1/4 tipo agulha da marca Arcdal (5 unidades) | 150,00 |
| Tês 1/4 (2 unidades) | 30,00 |
| Parafusos, pregos, porcas, arruelas, abraçadeiras, barra roscada e mão francesa | 30,00 |
| Lata de verniz incolor marca Colorgin | 32,90 |
| Total de custos | 866,86 |
Os custos em relação ao reator tanque agitado foram maiores devido a sua construção ser integralmente de vidro, como citado anteriormente, se o mesmo material fosse adotado na construção do reator tubular o seu custo seria ainda mais elevado do que o reator tanque agitado. Dessa forma, conforme desenvolvido na metodologia dos protótipos dos reatores contínuos tanque agitado e tubular, a Figura 11 apresenta o resultado final do projeto.
Figura 11 – Resultado final do projeto dos reatores contínuos tanque agitado e tubular.

De forma geral, o projeto de desenvolvimento dos protótipos de reatores contínuos tanque agitado e tubular, foi satisfatório, onde o resultado final foi de acordo com o layout planejado.
3.3 ENSAIOS DE COMPARAÇÃO E VERIFICAÇÃO DE DESEMPENHO DOS REATORES CONTÍNUOS TANQUE AGITADO E TUBULAR
Conforme relatado anteriormente sobre o ajuste das vazões, definiu-se uma vazão de 25 mL/min para cada reagente e 50 mL/min na saída de cada reator. As vazões foram medidas e posteriormente validadas com auxílio de uma proveta de 25 mL e um cronômetro de celular. É importante ressaltar que o experimento foi realizado na temperatura de 25º C. A Figura 12 retrata o momento de realização dos testes de vazões.
Figura 12 – Testes de vazões.

Na fase dos ensaios de comparação e verificação de desempenho, foi possível determinar a conversão em ambos os reatores através da fixação de um volume operacional. No presente estudo, estabeleceu-se o volume de 200 mL por se tratar do volume do reator tubular, o qual não havia possibilidade de alteração devido a sua construção. Por isso, ajustou-se o volume do reator tanque agitado para 200 mL. Após a reação de saponificação do acetato de etila atingir o estado estacionário coletaram-se duas amostras instantâneas de cada reator para que, por meio do experimento de titulometria, fosse determinada a concentração de hidróxido de sódio e, consequentemente a conversão dos reatores. Na Tabela 11 estão apresentados os consumos de hidróxido de sódio para cada reator.
Tabela 11 – Consumo de hidróxido de sódio no experimento de titulometria.
| Reator | Consumo NaOH (mL) |
| Reator tanque agitado – 1ª amostra | 83,1 |
| Reator tanque agitado – 2ª amostra | 82 |
| Média Reator tanque agitado | 82,55 |
| Reator tubular – 1ª amostra | 91,3 |
| Reator tubular – 2ª amostra | 91,1 |
| Média Reator tubular | 91,2 |
Dessa forma, obtiveram-se as conversões teóricas dos reatores contínuos tanque agitado e tubular pelas Equações (3) e (5) respectivamente. Na Tabela 12 estão apresentadas as conversões teóricas para cada reator.
Tabela 12 – Conversões teóricas para os reatores contínuos tanque agitado e tubular.
| Reator | Conversão (%) |
| Reator Tanque Agitado Contínuo (CSTR) | 70,60 |
| Reator Tubular (PFR) | 89,09 |
A partir da análise do gráfico de Levenspiel para os reatores CSTR e PFR, vistos nas Figuras 13 e 14 respectivamente, foi possível estimar a conversão em relação ao volume através de uma análise reversa: a partir de suas conversões individuais e com base na cinética já conhecida foi possível estimar o volume dos reatores e comprovar autenticidade das conversões obtidas.
Figura 13 – Gráfico Levenspiel para reator CSTR.
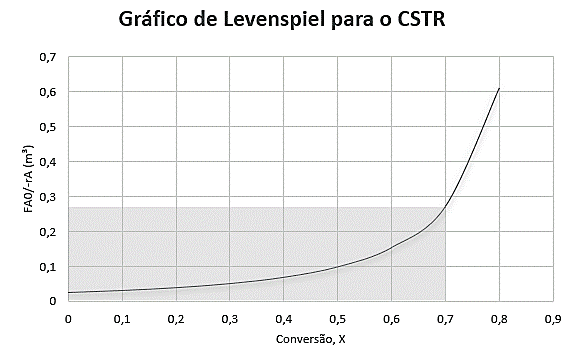
Figura 14 – Gráfico Levenspiel para reator PFR.
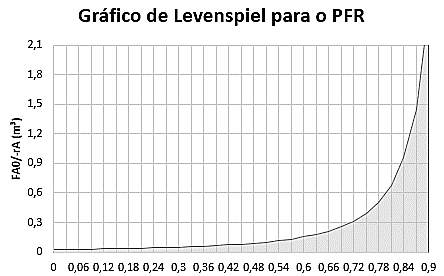
Conforme pode ser visualizado nas Figuras 13 e 14, as áreas sombreadas representam o volume estimado de cada reator de acordo com sua conversão teórica, onde o volume é definido conforme as Equações (3) e (5) para CSTR e PFR respectivamente. Ambas as áreas apresentam valor próximo de 200 mL para o volume dos reatores.
Com os dados obtidos por meio do experimento da titulometria, foi possível obter as conversões experimentais dos reatores através da Equação (14). Os dados podem ser verificados na Tabela 13.
Tabela 13 – Conversões experimentais para os reatores contínuos tanque agitado e tubular.
| Reator | Conversão (%) |
| Reator Tanque Agitado Contínuo | 65,10 |
| Reator Tubular | 82,40 |
De acordo com obtidos nas Tabelas 12 e 13 foi possível realizar uma análise comparativa entre as diferenças percentuais em relação as conversões teóricas e experimentais segundo a Tabela 14.
Tabela 14 – Diferença percentual entre as conversões teóricas e experimentais.
| Reator | Diferença (%) |
| Reator Tanque Agitado Contínuo | 5,50 |
| Reator Tubular | 6,69 |
A partir dos resultados obtidos, em relação às conversões teóricas e experimentais, foi comprovada a efetividade obtida no desenvolvimento dos protótipos. Essas diferenças podem ser atribuídas ao desvio da idealidade dos reatores, uma vez que as equações adotadas são para reatores ideias e, na prática, a idealidade prevista em teoria é algo complexo de se obter com 100% de eficácia. Esse desvio da idealidade pode ser provocado por diversas falhas que vão desde os materiais usados, medições, construção, formato, agitação entre outros fatores que causam a formação de zonas mortas ou curtos-circuitos comprometendo assim a idealidade dos reatores. Essas causas (formação de zonas mortas ou curtos-circuitos), podem ser verificadas detalhadamente através de experimentos como o da determinação do tempo de residência (DTR), sugerido para continuidade futura do trabalho desenvolvido nesse artigo.
Nos resultados das conversões, tanto teóricas como experimentais, é evidente o melhor desempenho do reator tubular. Nas Figuras 13 e 14 dos gráficos de Levenspiel foi possível verificar que a área sob a curva (volume do PFR) é igual a área retangular correspondente ao volume do CSTR, ou seja, mesmo com os volumes iguais o reator tubular apresentou um melhor resultado de conversão conforme prevista em teoria, onde de forma geral os reatores tubulares apresentam maior conversão para a maioria de suas reações.
Em relação ao estágio operacional, durante os diversos testes realizados, ficou evidente a maior praticidade operacional no reator tubular em relação ao reator tanque agitado, que por sua vez necessita de mais ajustes e controles em relação às suas vazões e manutenção do volume operacional. Por outro lado, o reator tanque agitado apresenta maior facilidade de limpeza uma vez que o mesmo pode ser desmontado facilmente e por possuir um maior espaço interno, sua higienização é executada com maior eficiência.
4. CONCLUSÕES
O desenvolvimento do presente artigo tornou possível a realização da análise de desempenho entre dois reatores distintos, o tanque agitado e o reator tubular, ambos com suas operações de forma contínua. Além disso, também permitiu um aprofundamento maior no que diz respeito à cinética química da reação de saponificação do acetato de etila. No decorrer do experimento para a determinação da cinética química, foi possível observar que a reação em si ocorre de maneira semelhante como a teoria descreve, o que evidência que a mesma foi realizada de maneira correta e eficiente.
A realização dos ensaios de pHmetria, assim como a titulometria foram eficazes, pois conforme os artigos estudados na teoria, os resultados obtidos em ambos os experimentos foram convergentes aos apresentados na teoria, evidenciando assim a efetividade do estudo realizado neste trabalho.
Em relação à execução dos ensaios nos protótipos propriamente ditos, pode-se concluir que houve dificuldades no que envolveu a vazão dos reagentes para os reatores. Isso pois, como trabalhou-se com uma vazão muito baixa, a utilização das válvulas tipo “agulha” ocasionaram certa dificuldade para se manter constante, necessitando assim de diversos testes para garantir uma vazão estável durante todo o experimento.
De modo geral no que diz respeito à conversão de cada reator, pode-se concluir que o reator PFR apresentou um melhor desempenho operacional, além de uma maior conversão para o volume de 200 mL pré-definido. Já o reator tanque agitado possui uma maior facilidade de limpeza se comparado ao reator tubular. Assim, pode-se concluir que ambos os reatores possuem aplicações específicas e a elaboração deste artigo permitiu comprovar a literatura com a prática.
5. REFERÊNCIAS
AHMED, A. M. A. Saponification: A Comparative Kinetic Study in a Batch Reactor.2010. 112 F. Thesis (M. Sc in Chemical Engineering) – University of Science and Technology – College of Engineering, Sudan, 2010.
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. Ed. – Porto Alegre: Bookman, 2012.
FOGLER, H. Scott. Elementos de Engenharia das Reações Químicas. 4a edição. Rio de Janeiro: Editora LTC, 2009.
FOGLER, H. Scott. Cálculo de reatores: o essencial da engenharia das reações químicas.1. ed. – Rio de Janeiro: LTC, 2014.
HADKAR, U. B.; HADKAR, A. S. Comparative Study of Kinetics of Saponification of Ethyl Acetate by pH Method and Titration Method. Asian Journal of Pharmaceutical Analysis, ano 2017, n.8, p. 20-24, dez/fev. 2018.
KUHELI DAS, P; SAHOO, M. SAI BABA N. MURALI, P. SWAMINATHAN. Kinetic Studies on Saponification of Ethyl Acetate Using an Innovative Conductivity-Monitoring Instrument with a Pulsating Sensor. Electronics and Instrumentation Group, Indira Gandhi Centre for Atomic Research, Kalpakkam 603 102, India, 2011.
LEVENSPIEL, O. Engenharia das reações químicas. 3. Ed. – São Paulo: Blucher, 2000.
MORAIS, G. R. Estudo teórico sobre o afastamento da idealidade de reatores ideais: reação de saponificação do acetato de etila. 2015. 51 f. Trabalho de Conclusão de Curso (Engenharia Química) – Escola de Engenharia de Lorena, Universidade de São Paulo, Lorena, 2015.
SANTOS, V. A.; VASCONCELOS E.C. Extrapolação de dados cinéticos obtidos em reatores químicos homogêneos. Revista Química & Tecnologia, Pernambuco, ano 1, n.1, p. 11-19, jul/dez. 2002.
THE GOODS CENTS COMPANY. Acetato de Etila. Disponível em: <http://www.thegoods centscompany.com/data/rw1004691.html>. Acesso em: 12 mar. 2018.
[1] Estudante de Engenharia Química pela Universidade São Francisco.
[2] Estudante de Engenharia Química pela Universidade São Francisco.
[3] Professor na Universidade São Francisco, Doutor em engenharia química pela Unicamp, Mestre em engenharia química pela Unicamp, Graduação em engenharia química pela Universidade Federal e Alagoas.
Enviado: Outubro, 2019.
Aprovado: Outubro, 2019.