ARTIGO ORIGINAL
VEDOVELLO, Marcos Paulo [1], CASANOVA, Adriana Seraphin Veiga [2]
VEDOVELLO, Marcos Paulo. CASANOVA, Adriana Seraphin Veiga. Estudo da despolimerização do Poli(Tereftalato De Etileno) via Hidrólise Alcalina. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 08, Vol. 02, pp. 181-214. Agosto de 2019. ISSN: 2448-0959
RESUMO
Dentre os resíduos descartados pelos centros urbanos nos últimos anos, ganham espaço os polímeros, mais especificamente o poli(tereftalato de etileno) (PET), polímero termoplástico que apresenta características favoráveis ao consumo doméstico, como leveza, resistência mecânica e transparência, apropriado, principalmente, para o armazenamento de bebidas gaseificadas. Diante deste cenário, a reciclagem se faz necessária, dentre elas a reciclagem química, conhecida como despolimerização, que permite obter os monômeros de origem do polímero, os quais podem ser re-polimerizados, formando polímeros e/ou produtos novos. Por esse motivo, estudar o processo de despolimerização por hidrólise alcalina do PET, bem como, a melhor condição possível para a recuperação dos monômeros do mesmo através de alterações das variáveis reacionais para reuso do ácido tereftálico (TPA) foi o tema deste trabalho de graduação. Os ensaios foram realizados com fragmentos do polímero em solução de hidróxido de sódio (NaOH) com concentrações de 5 M, 7,5 M e 10 M, em temperaturas de 60 °C, 80 °C e 100 °C, por 3 horas, 5 horas e 7 horas, a fim de verificar qual a melhor condição para a reação, em busca do maior rendimento. Os melhores resultados foram obtidos para a concentração de NaOH de 10 M, temperatura de 100 ºC e tempo de reação de 5 horas. Concomitantemente, caracterizou-se a molécula de TPA com análises de infravermelho, confirmando a obtenção do monômero.
Palavras-Chave: despolimerização, PET, reciclagem, hidrólise alcalina.
1. INTRODUÇÃO
Ao longo da história, o homem deixou suas atividades rurais e agrícolas, e organizou-se em grandes centros urbanos. Com esta nova configuração, houve um aumento considerável na geração de resíduos sólidos per capita; em 2014 no Brasil, cada habitante gerou aproximadamente 388 kg de resíduos sólidos (ABRELPE, 2014). Do total gerado, grande parte é composta por polímeros (plásticos, como embalagens, sacolas, garrafas etc.). Em relação ao poli(tereftalato de etileno) (PET), polímero alvo deste trabalho de graduação, os últimos estudos mostram que quase 60% do material pós-consumo é reciclado no Brasil, mas este valor cai para 20% quando se considera todos os plásticos pós-consumo disponíveis no mercado (ABRELPE, 2014). O PET é um dos polímeros termoplásticos mais utilizados no dia a dia, pois apresenta características favoráveis ao consumo doméstico, como leveza, resistência mecânica e transparência, apropriado para armazenamento de bebidas gaseificadas e demais produtos que demandem de embalagens transparentes e resistentes (SOUZA et al., 2008). Porém, a introdução deste polímero na manufatura de embalagens iniciou um novo problema ambiental: devido à sua facilidade de produção e praticidade no consumo, o volume de plástico descartado diariamente tomou grandes proporções (SPINACÉ e PAOLI, 2005); dessa forma, no Brasil, a reciclagem mecânica é a mais utilizada devido ao grande volume deste polímero gerado no pós-consumo. O baixo custo com mão de obra e com a instalação de uma planta de reciclagem também são fatores que contribuem para o crescimento deste método de reciclagem (SPINACÉ e PAOLI, 2005).
Em países desenvolvidos, especialmente no Japão e em países da Europa, utilizam-se, de forma majoritária, as reciclagens química e energética (SPINACÉ e PAOLI, 2005). A reciclagem química é classificada como reciclagem terciária (VANINI et al., 2013 e FONSECA et al., 2013) e, quando aplicada aos polímeros, recebe o nome de despolimerização. Este processo permite obter os monômeros de origem do polímero, que podem – caso necessário – passar por processos de purificação para serem re-polimerizados, formando polímeros e/ou produtos novos (VANINI et al., 2013). A despolimerização pode ser realizada por várias rotas de reação: as mais comuns são os processos por hidrólise, glicólise e metanólise (FONSECA et al., 2013). A primeira rota, por hidrólise, é mais vantajosa nos aspectos ambientais e econômicos, pois se pode obter o principal monômero do PET, o ácido tereftálico (TPA) com apenas uma reação (FONSECA et al., 2013).
O estudo de processos de reciclagem e recuperação de compostos é fundamental para o ser humano, para a criação de formas sustentáveis de reaproveitamento de substâncias sem agredir o meio ambiente com a extração de matéria-prima e descarte inadequado dos produtos pós-consumo. Os polímeros são grandes vilões ambientais, pois ocupam grande volume quando não compactados em aterros e podem demorar centenas de anos para que sua decomposição seja completada. O PET, por exemplo, tem um tempo de decomposição estimado em aproximadamente 400 anos (SPINACÉ e PAOLI, 2005), o que interfere negativamente em processos de estabilização microbiológica e de compostagem nos aterros (SPINACÉ e PAOLI, 2005). Portanto, encontrar processos que motivem o reuso e a reciclagem destes compostos são vantajosos em questão de economia de espaço, preservação de recursos e fontes não-renováveis de matéria-prima, aumentar o tempo de vida útil de aterros sanitários, a redução de gastos com limpeza e conservação das zonas urbanas (SPINACÉ e PAOLI, 2005).
Neste âmbito, objetivou-se estudar o processo de hidrólise alcalina para a reciclagem química (despolimerização) do PET, em busca da melhor condição possível para a recuperação dos monômeros. Com fundamentação neste objetivo macro, alguns objetivos secundários são traçados: pesquisar variáveis que possam causar interferências no processo, tais como o tempo e a temperatura da reação, bem como a concentração do meio alcalino, e verificar quais variáveis são significativas para o processo através de análises estatísticas dos resultados experimentais.
1.1 POLÍMEROS
Os polímeros são materiais formados por macromoléculas cujo tamanho, estrutura química e tipo de interação intra/intermoleculares são utilizados para suas caracterizações. Eles podem ser naturais, como a celulose, ou sintéticos, como por exemplo, o polipropileno (PP) e o poli (tereftalato de etileno) (PET) (SPINACÉ e PAOLI, 2005).
A palavra “plástico” tem origem grega e significa “aquilo que pode-se moldar”, embora estes materiais sejam conhecidos por “polímeros”, um termo técnico que nasceu da junção das palavras “poli” (muitos) e “meros” (partes), visto que os plásticos são junções de muitas moléculas iguais, formando longas cadeiras (SPINACÉ e PAOLI, 2005).
Os polímeros são classificados em termoplásticos, termofixos e elastômeros. Os termoplásticos podem ser naturais ou sintéticos, e são facilmente amolecidos e moldados com aumento da temperatura, facilitando sua reciclagem e ampliando seu uso. Os termofixos, por sua vez, não têm sua rigidez afetada pela temperatura; quando esta é consideravelmente elevada, este polímero degrada-se, impossibilitando sua reciclagem. Já os elastômeros são materiais capazes de sofrer grandes deformações antes da sua ruptura, podem ou não ser recicláveis, conforme se dão seus processos de produção e são usualmente conhecidos como “borrachas” (SPINACÉ e PAOLI, 2005).
Existe uma gama muito ampla de termoplásticos utilizados em inúmeras aplicações; apesar disso, apenas cinco deles (PE, PP, PS, PVC e PET) representam cerca de 90% de todo o consumo nacional de polímeros; entre eles, destaca-se o PET, que apresentou um crescimento aproximado de 2.200% apenas na década de 90, somente no consumo nacional (SPINACÉ e PAOLI, 2005).
1.2 PET
O PET é um polímero termoplástico sintetizado a partir de uma reação de condensação entre os monômeros do ácido tereftálico (TPA ou AT) ou dimetil tereftalato (DMT) e etilenoglicol (EG), com a eliminação de água (BENTES, 2008), conforme a Figura 1.
Figura 1 – Reação para obtenção do PET a partir dos monômeros AT e EG.
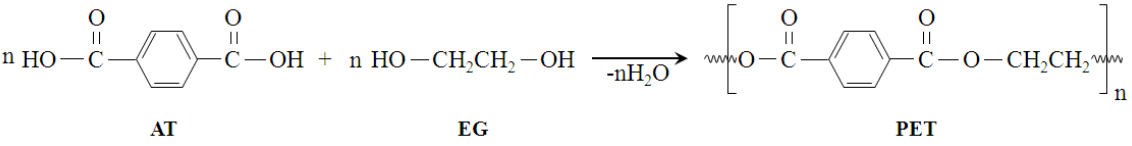
Por possuir grande resistência, tanto química quanto mecânica, e propriedades que impedem a propagação de gases, odores e ataques químicos, o PET é um dos polímeros mais utilizados para a fabricação de embalagens alimentícias, principalmente para o engarrafamento de bebidas e demais líquidos para consumo. Além destes empregos, o PET foi o primeiro polímero utilizado como fibra para indústria têxtil, para a produção de fitas de áudio e vídeo, entre outras aplicações de grande importância nas áreas da engenharia (ABRELPE, 2014 e BENTES, 2008).
1.3 PRODUÇÃO E CONSUMO DO PET
Em 1941, os ingleses Whinfild e Dickson, funcionários da empresa de produtos químicos dos Estados Unidos, a DuPont, sintetizaram o PET, com o comércio do material a partir da década de 50 na forma de fibras. Apenas a partir dos anos 70, com o desenvolvimento de técnicas de bi-orientação, iniciou-se o uso deste polímero como base para a fabricação de garrafas e embalagens alimentícias na América do Norte, expandindo-se para a Europa e, posteriormente, para o restante do mundo (BENTES, 2008). No Brasil, iniciou-se o uso do PET na indústria têxtil, contrapondo-se aos outros países na aplicabilidade.
A produção do PET ocorre em duas ou três etapas de acordo com a sua aplicação: a pré-polimerização, a policondensação e, por fim, a polimerização no estado sólido. A pré-polimerização baseia-se na formação do poliéster tereftalato de bis-hidroxietila (BHET), por meio de duas diferentes reações entre ácido tereftálico (TPA) e etileno glicol (EG), a esterificação direta e a transesterificação. Em seguida, realiza-se a policondensação, uma reação que consiste no aquecimento gradativo do BHET até a temperatura de 280 °C e queda na pressão interna inferior a 1,3 x 102 Pa para que, assim, a polimerização tenha um bom rendimento. O tempo reacional dessa etapa dura em torno de 5 a 10 horas e obtém-se como subproduto o etileno glicol (EG) (ROMÃO et al., 2009).
Apenas com essas duas etapas é possível a fabricação de fibras têxteis, já que não necessitam de alto grau de resistência mecânica e propriedades reológicas intermediárias. Diferentemente destas, as garrafas PET exigem mais uma etapa reacional conhecida como polimerização no estado sólido, para que supra a falha da etapa anterior na produção de polímeros com elevada massa molar e, consequentemente, maior resistência mecânica. Nessa última reação, a polimerização ocorre em uma temperatura em torno de 220 a 230 °C por um tempo de 10 a 30 horas, permitindo a formação de PET com alto grau de massa molar, chegando por volta de 30.000 g.mol-1, e uma alta cristalinidade, e tornando possível a utilização do polímero processamentos de injeção-sopro sem alteração das suas propriedades (ROMÃO et al., 2009).
1.4 RECICLAGEM
Os polímeros são materiais muito versáteis no dia a dia, com potencial de aplicação em diversos setores que vão desde embalagens até próteses cirúrgicas. Devido a esta versatilidade, os polímeros se encontram entre os materiais que mais representam a composição do resíduo sólido urbano (RSU), chegando em 2005 por volta de um quinto da porcentagem em massa do RSU brasileiro. A razão desse quadro deve-se, também, a sua utilização em produtos de curta vida útil, que produz grandes montantes de descartes em curtos períodos de tempo quando comparados ao polipropileno (PP) e ao poli(cloreto de vinila) (PVC), os quais tem maior usualidade na área de construção civil e de bens de consumo, e que apresentam maior vida útil. Além disso, o PET pode levar centenas de anos para degradar-se na natureza e, por esse motivo, este polímero é visto como o maior responsável pelos grandes e impactantes problemas ambientais vinculados aos lixos urbanos, ocupando o segundo lugar em 2005 dentre os polímeros no RSU, ao passo que o foco maior deveria encontrar-se na inadequação do descarte do mesmo. Essa problemática poderia ser minimizada, com a reciclagem, já que esta poderia ser uma forma de reaproveitamento, economicamente viável e que evitaria o acúmulo destes materiais no ambiente e a perda de recursos econômicos (BENTES, 2008 e ROMÃO et al., 2009).
A reciclagem de polímeros é classificada em quatro categorias: a primária (de produtos fora das especificações na indústria), e a secundária, terciária ou quaternária (de material descartado após o consumo industrial ou doméstico). Entretanto, a reciclagem primária e a secundária são classificadas como reciclagem mecânica, porém, na primária utilizam-se polímeros pré-consumo e na secundária, polímeros pós-consumo. Nesse tipo de reciclagem ocorre uma redução do resíduo plástico novamente em grânulos para que, assim, possam ser utilizados na produção de outros produtos, nos quais o polímero é o único ou um dos tipos de resina base. Dentre as etapas desse processo tem-se moagem dos plásticos (após pré-seleção), lavagem com água (com ou sem solvente), aglutinação ou aglomeração para redução do volume direcionado à extrusora e extrusão do material em forma de tiras plásticas para utilização em outros setores (PORTAL DE RESÍDUOS SÓLIDOS, 2017).
Dentre as reciclagens de polímeros realizadas no Brasil, a que se destaca é a mecânica, com uma prática de 20% em massa, ocupando o sexto lugar no quadro mundial. Em 2006, o Brasil alcançou o segundo lugar na reciclagem mundial de PET, atrás apenas do Japão. A indústria de reciclagem de polímeros no Brasil tem grandes possibilidades de crescimento, com faturamento acima de 1,2 bilhões de reais/ano, com a geração de mais de 11.000 empregos diretos. É permitido observar o grande crescimento do setor de reciclagem PET no país por meio da Figura 2, na qual avalia de 1994 até 2012 tanto o volume de reciclado quanto o índice total de reciclagem. Verifica-se crescimento nestes fatores com o passar dos anos, mas ainda abaixo da idealidade de reciclar todo o material gerado (BENTES, 2008). Para estimular a expansão da reciclagem, a carga tributária sobre a matéria-prima dessa indústria é menor para produtos reciclados do que para a resina virgem, com diferença de 5% entre eles (5% de IPI para resinas virgens e 0% para materiais reciclados).
Figura 2 – Evolução da Reciclagem PET no Brasil.
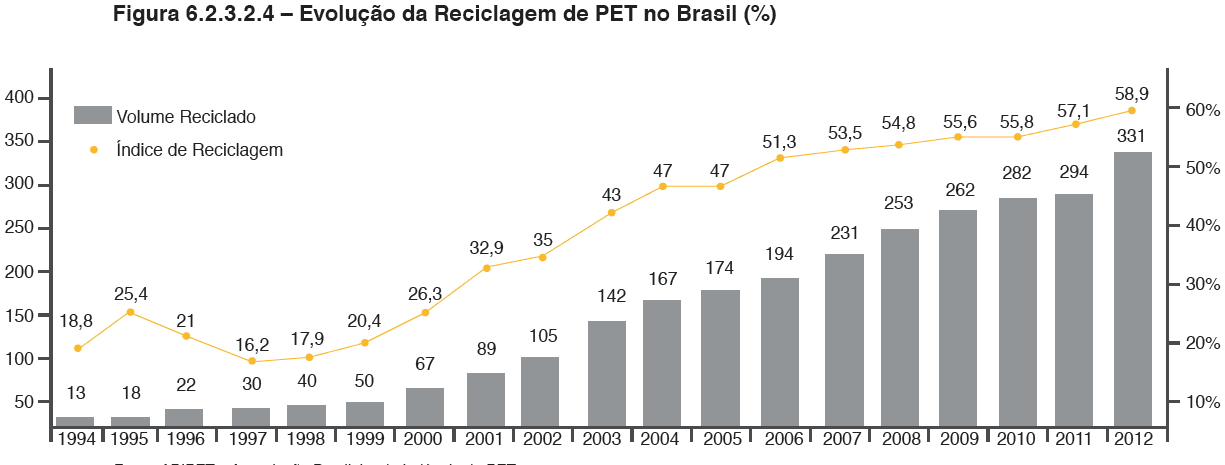
Uma das aplicações do PET após a reciclagem que impulsiona o setor é a sua utilização no setor têxtil, que representa aproximadamente metade da porcentagem em massa da reciclagem desse material, o que permite nesse caso, uma aplicação com grande abrangência, pois apresenta aspectos importantes de engenharia e é apresentado com preço de commodity. As utilidades do PET nesse setor vão desde fabricação de fios para tecelagem, forrações, tapetes, carpetes, mantas até a de cordas, cerdas de vassouras e escovas(BENTES, 2008).
Outra aplicação para o PET, que ganha cada vez mais espaço e já representa cerca de 16% em massa da reciclagem para este polímero, é a fabricação de resinas alquídicas, para a produção de tintas, e resinas insaturadas, vinculadas a síntese de adesivos e resinas poliéster. Embora transpareça ter um amplo mercado para a reciclagem do polímero, ainda há possibilidade de aumentar essa abrangência, até mesmo para ser reutilizado na fabricação de embalagens de alimentos e bebidas, mas para isto, há uma carência de novos estudos na área (BENTES, 2008).
1.5 RECICLAGEM QUÍMICA E HIDRÓLISE ALCALINA
A reciclagem química é caracterizada como o processo de despolimerização do PET, no qual se utilizam compostos químicos via hidrólise, glicólise, metanólise ou aminólise, que pode ser catalisada por ácidos, bases ou catalisadores neutros para recuperar as resinas que compõem o resíduo plástico, os monômeros tereftalato de bis-hidroxietila (BHET) e outros oligômeros, conforme Figura 3 (MORAES et al., 2006).
Figura 3 – Esquema de Reciclagem Química do PET.
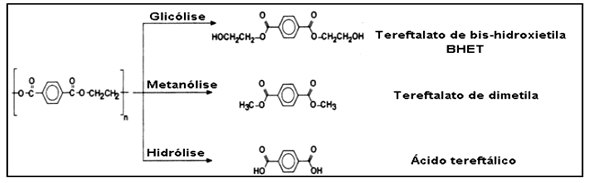
A reação é realizada em meio alcalino, com a ausência de íons hidrogênio (H+), já que para estabilizar a carbonila da reação, é requerido um reagente mais nucleófilo, como o hidróxido (OH–) ao invés da água. Nesse caso, o cátion da base é muito mais forte que os poucos íons hidrogênio liberados na ionização da água, o que permite finalizar e completar a reação. Entretanto, a quantidade de finais carboxílicos e hidroxílicos nem sempre podem ser iguais, como na hidrólise ácida e neutra, que pode produzir, no limite da degradação, um sal do ácido tereftálico. Ou seja, através da hidrólise, o PET é despolimerizado em seus monômeros, com destaque e importância comercial para o ácido tereftálico (TPA) conforme Figura 4 (FONSECA et al., 2013), o qual, após purificação, pode ser repolimerizado e gerar economia no setor de importações do mesmo, de mais de 100 milhões de dólares por ano (SOUZA et al., 2008).
Figura 4 – Esquema de Reciclagem Química do PET via hidrólise alcalina.
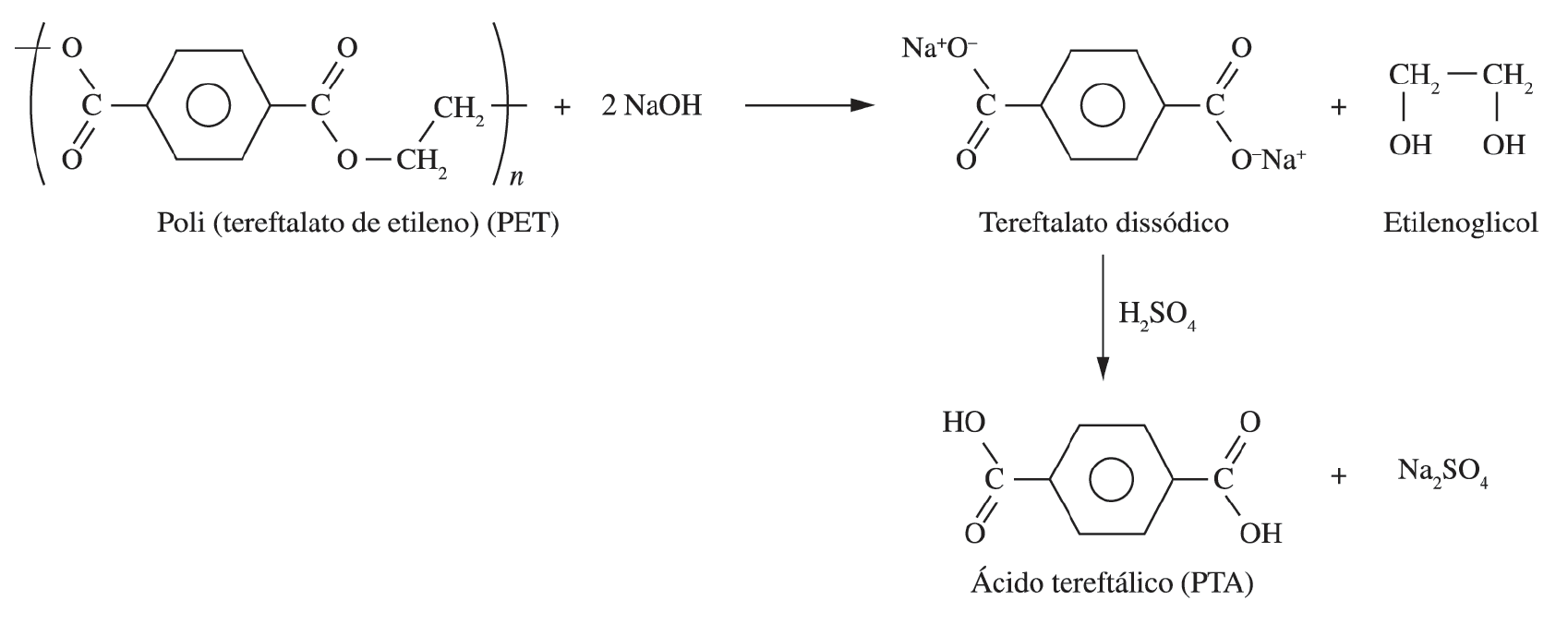
1.6 ESPECTROSCOPIA DE INFRAVERMELHO
A espectroscopia estuda a interação da radiação eletromagnética com a matéria por meio de análises dos níveis de energia de átomos ou moléculas, já que ocorrem diferentes tipos de transições, tais quais podem ser eletrônicas (situada na região do ultravioleta ou visível), vibracionais (localizada na região do infravermelho) e rotacionais (decorrer na região de micro-ondas e, raras às vezes, na região do infravermelho longínquo). As características de uma molécula, tais como simetria e sua teoria de grupo permitem predizer o número de vibrações, a descrição dos modos vibracionais e sua atividade em cada tipo de espectroscopia vibracional, como a de infravermelho (PAVIA et al., 2010).
Para que ocorra a absorção da radiação infravermelha se faz necessária a variação do momento de dipolo elétrico da molécula, o qual é definido pela diferença e distância entre dois centros de carga, decorrente de seu movimento vibracional ou rotacional. Portanto, o espectro de absorção no infravermelho origina-se a partir da radiação eletromagnética incidente, a qual tem uma componente cuja frequência corresponde a uma transição entre dois níveis vibracionais, simétricos ou assimétricos. A vibração dos átomos no interior de uma molécula apresenta energia correspondente com a região do espectro eletromagnético infravermelho (100 a 10000 cm-1) (PAVIA et al., 2010).
Entretanto, não é regra que o número de modos normais de vibração corresponda ao número de bandas observadas no espectro, pois podem ocorrer vibrações de mesma energia (degenerescência), apresentar a mesma frequência e, consequentemente, a mesma posição no espectro. Além disso, podem surgir frequências adicionais no espectro, oriundas dos sobretons (bandas cujos valores de freqüência são múltiplos inteiros daqueles das vibrações normais) ou bandas de combinação (são combinações lineares das frequências normais ou múltiplos inteiros destas), porém suas atividades têm possibilidade de previsão por meio da teoria de grupos (PAVIA et al., 2010).
O infravermelho encontra-se na região do espectro eletromagnético entre 0,75 µm até quase 1 mm, contudo o segmento mais utilizado dentre as análises localiza-se entre 2,5 e 25 µm (4000 a 400 cm-1), comumente chamada de região fundamental ou infravermelho médio. A análise de uma substância por meio do espectro infravermelho revela suas propriedades físico-químicas, que são únicas, permitindo, portanto, a identificação das mesmas por meio desse tipo de estudo, assim como realizado neste trabalho de graduação. Contudo, não é um procedimento tão fácil para quantificação de substâncias com complexidade muito grande, já que inúmeros interferentes podem surgir, necessitando-se de cálculos estatísticos mais finos que englobem a utilização de vários comprimentos de onda para a obtenção de uma única propriedade (PAVIA et al., 2010).
1.7 PLANEJAMENTO EXPERIMENTAL FATORIAL COMPLETO
Um experimento fatorial completo inclui todas as possíveis combinações entre os níveis dos fatores do experimento. Assim, em um experimento aleatório completo, todos os tratamentos possíveis devem ser utilizados no experimento, mas a ordem das execuções é aleatorizada. A aleatorização é essencial para uma boa conclusão, pois o experimentador não pode estar certo de todas as variáveis que influenciam o experimento, portanto desta maneira nos certificamos de que um maior número de variáveis externas ao experimento influencia de maneira igual. Mesmo que alguém possa identificar e controlar algumas dessas variáveis, complicações não planejadas são comuns. A aleatorização não evita complicações dentro do experimento, mas oferece alguma proteção contra o vício do experimento. Os planejamentos de experimentos devem, quando possível, incluir réplicas (PORTAL ACTION, 2017).
Os esquemas fatoriais não são considerados delineamentos experimentais, e sim delineamento de tratamentos, mas para o propósito deste trabalho, os tratamentos têm apelo de ensaios experimentais. Quando todas as combinações possíveis entre todos os níveis de cada fator estão presentes, o sistema fatorial é tido como completo (RODRIGUES E IEMMA, 2005).
1.8 ANÁLISE DE VARIÂNCIA (ANOVA)
A análise de variância (ANOVA) testa a hipótese de que as médias de duas ou mais populações são iguais. As ANOVAs avaliam a significância de um ou mais fatores, através da comparação das médias de variáveis de resposta nos diferentes níveis de cada fator. A hipótese nula afirma que todas as médias de nível dos fatores são iguais, enquanto a hipótese alternativa afirma que pelo menos uma é diferente (SUPORTE AO MINITAB 18, 2017).
Para realizar uma análise ANOVA, é necessária uma variável de resposta contínua e pelo menos um fator categórico com dois ou mais níveis. As análises exigem dados de populações normalmente distribuídas, e que as variâncias entre os fatores sejam iguais. Entretanto, procedimentos ANOVA funcionam bem mesmo quando a pressuposição de normalidade é violada, exceto quando uma ou mais distribuições são altamente assimétricas ou quando as variâncias são muito diferentes (SUPORTE AO MINITAB 18, 2017).
Se o valor de p associado à estatística for menor que o nível de significância, é possível concluir que pelo menos uma média de durabilidade é diferente. Para informações mais detalhadas sobre as diferenças entre médias específicas, um método de múltiplas comparações pode ser utilizado, como o método de Tukey (SUPORTE AO MINITAB 18, 2017).
1.9 TESTE DE TUKEY
O teste proposto por Tukey (1953), também conhecido como teste de Tukey, é um dos testes de comparação de médias mais utilizado, por ser bastante rigoroso e de fácil aplicação. É um teste exato em que, para a família de todas as comparações duas a duas, a taxa de erros do grupo de testes é exatamente α (e o intervalo de confiança da análise é exatamente 1-α). É utilizado para testar toda e qualquer diferença entre duas médias de tratamento, porém não permite comparar grupos de tratamento entre si. É aplicado quando o teste f da ANOVA for significativo (MEDEIROS, s. d.). Usado em ANOVA para criar intervalos de confiança para todas as diferenças pareadas entre as médias dos níveis dos fatores, controla a taxa de erro global para um nível de significância especificado. Para compensar essa alta taxa de erro, o método de Tukey ajusta o nível de confiança para cada intervalo individual de forma que o nível de confiança simultâneo resultante seja igual ao valor especificado (SUPORTE AO MINITAB 18, 2017).
2. METODOLOGIA
2.1 EXPERIMENTOS DE DESPOLIMERIZAÇÃO DO PET
A despolimerização do PET foi realizada com material proveniente de garrafas pós-consumo de bebidas carbonatadas (refrigerantes), com o polímero transparente (incolor) e colorido (verde). As garrafas foram lavadas com água limpa e detergente neutro até que ocorresse o desaparecimento de odores no interior dos recipientes, seguido de três lavagens com porções de água destilada para remover qualquer resíduo de detergente. Em seguida, os recipientes foram secos ao sol, com posterior fragmentação do material, na proporção de 1:1 (mesma proporção de material transparente incolor para material colorido verde). As garrafas tiveram o bico e o fundo removidos, de modo a utilizar apenas o corpo cilíndrico. Esse material foi cortado, com o auxílio de uma tesoura, em fragmentos com tamanhos médios de 9 mm² (3 mm x 3 mm).
Nas referências bibliográficas consultadas, os autores variaram as temperaturas de reação entre 50 ºC e 120 ºC; a concentração do meio alcalino entre 4 M e 10,5 M; e o tempo entre 2 e 9 horas; alguns autores trabalhavam também com a adição de catalisadores e com sistemas fechados com alta pressão – para temperaturas superiores a 100 ºC.
Para este estudo, trabalhou-se com três fatores (temperatura, tempo e concentração) com três níveis para cada um (temperaturas de 60 ºC, 80 ºC e 100 ºC; tempos de 3 horas, 5 horas e 7 horas; concentração do meio alcalino de 5 M, 7,5 M e 10 M). Portanto, o número de ensaios realizados foi de 3³ = 27, como demonstrado na Tabela 1.
Para a reação de despolimerização, foram preparadas três soluções de hidróxido de sódio com concentrações de 5 M, 7,5 M e 10 M, partindo-se do reagente P.A. disponível (Êxodo Científica®).
Para cada ensaio, foi montado um sistema de reação, com um balão de três vias conectado a um condensador de bolas com fluxo constante de água fria, para que não ocorresse perda do meio reacional por evaporação. Uma das vias foi tampada com uma rolha com termômetro acoplado e a outra, apenas com uma rolha. O balão estava montado sobre um sistema de aquecimento e agitação (banho de óleo de soja sobre placa de aquecimento com agitação) e em seu interior foram adicionados 50 mL da solução de hidróxido de sódio, aproximadamente 2,5 gramas do PET fragmentado e uma barra magnética para agitação constante do sistema. O sistema reacional completo é visto na Figura 5.
Tabela 1 – Distribuição dos ensaios por esquema fatorial completo, para a despolimerização do PET.
| Experimento | Concentração (mol.L-1) | Temperatura (ºC) | Tempo (horas) |
| 1 | 5 | 60 | 3 |
| 2 | 5 | 60 | 5 |
| 3 | 5 | 60 | 7 |
| 4 | 5 | 80 | 3 |
| 5 | 5 | 80 | 5 |
| 6 | 5 | 80 | 7 |
| 7 | 5 | 100 | 3 |
| 8 | 5 | 100 | 5 |
| 9 | 5 | 100 | 7 |
| 10 | 7,5 | 60 | 3 |
| 11 | 7,5 | 60 | 5 |
| 12 | 7,5 | 60 | 7 |
| 13 | 7,5 | 80 | 3 |
| 14 | 7,5 | 80 | 5 |
| 15 | 7,5 | 80 | 7 |
| 16 | 7,5 | 100 | 3 |
| 17 | 7,5 | 100 | 5 |
| 18 | 7,5 | 100 | 7 |
| 19 | 10 | 60 | 3 |
| 20 | 10 | 60 | 5 |
| 21 | 10 | 60 | 7 |
| 22 | 10 | 80 | 3 |
| 23 | 10 | 80 | 5 |
| 24 | 10 | 80 | 7 |
| 25 | 10 | 100 | 3 |
| 26 | 10 | 100 | 5 |
| 27 | 10 | 100 | 7 |
Fonte: Autor.
Figura 5 – Sistema reacional para a despolimerização do PET. Legenda da numeração dos componentes da foto: 1. Condensador de bolas; 2. Garras de sustentação presas ao suporte universal; 3. Balão de vidro de três vias, com o PET e solução alcalina; 4.Base de aquecimento e agitação magnética, com banho de óleo; 5. Termômetro acoplado em uma rolha; 6. Mangueira de borracha para entrada da água de resfriamento do condensador; 7. Mangueira de borracha para saída da água do condensador; 8. Rolha para vedação.

Ao término do tempo reacional para cada experimento, o sistema foi desligado e desmontado, e a mistura heterogênea (contendo etilenoglicol, teraftalato dissódico e resíduos de PET não hidrolisados) dentro do balão de três vias foi resfriada até temperatura ambiente. Com o auxílio de uma peneira, todo o PET não hidrolisado foi recolhido e colocado sobre um papel de filtro previamente pesado. Este PET foi seco em estufa a 50 ºC por 24 horas, para fins de cálculo da porcentagem de material que não foi hidrolisado. Posteriormente, a solução alcalina foi neutralizada com ácido sulfúrico P.A. (Êxodo Científica®) até pH zero (este procedimento foi realizado com a utilização de todos os equipamentos de proteção individual e coletivos necessários, pois a reação é muito exotérmica). Após a neutralização, a mistura foi deixada em repouso por 24 horas para a formação dos cristais de ácido tereftálico, que são insolúveis em água. Após 24 horas, realizou-se a filtração a vácuo do TPA com várias lavagens de água destilada, com posterior secagem em estufa a 50 ºC por 24 horas. Após este tempo, as amostras foram pesadas, e o rendimento de cada ensaio foi calculado, bem como, a porcentagem de PET que não foi hidrolisado em cada experimento (variável resposta no tratamento estatístico).
Para avaliação qualitativa do resultado experimental, foram realizadas análises por Espectroscopia de Infravermelho com Transformada de Fourier em um laboratório de análises de uma empresa multinacional localizada na cidade de Jundiaí/SP, cujos procedimentos internos não puderam ser acompanhados pelos responsáveis desse estudo. O PET hidrolisado seco em estufa foi enviado para a multinacional e, o mesmo, inserido diretamente no equipamento de espectroscopia, sem uma nova secagem em estufa.
2.2 TRATAMENTOS ESTATÍSTICOS DOS RESULTADOS
O tratamento dos dados experimentais (análises com combinação dos fatores concentração x temperatura x tempo, com a variável resposta para cada um) obtidos neste estudo foi feito através do Software Minitab®, em sua versão 18.1., desenvolvido pela Minitab Inc., instalado em um computador com Microsoft® Windows® 8.1. como sistema operacional. Para a inserção dos dados utilizados nos experimentos, um Experimento Fatorial Completo foi criado. Através das análises dos Testes de Efeitos Principais (que avaliam como diferentes valores de níveis afetam a resposta), da análise ANOVA (que analisa a significância de cada fator experimental) e dos Testes de Tukey (que compara os níveis de cada fator), encontrou-se a melhor condição para a realização do experimento.
3. RESULTADOS E DISCUSSÃO
Ao término do tempo reacional necessário para cada ensaio, foi observada a formação de uma mistura heterogênea dentro de cada um dos balões de três vias, onde ocorreram as reações. Em sistemas cuja temperatura e concentração eram mais elevadas, foi registrada uma mistura composta por uma fase líquida turva e esbranquiçada (que corresponde ao meio alcalino com etilenoglicol e sal tereftalato dissódico), e uma fase sólida composta por resíduos de PET não hidrolisado, o que condiz com os resultados obtidos Fonseca et al., (2013). Em sistemas cuja temperatura e concentração eram mais baixas, também foram observados resíduos de PET não hidrolisados, mas com a fase líquida com aspecto praticamente inalterado.
Ao adicionar ácido sulfúrico na fase líquida, o sal tereftalato dissódico foi convertido em ácido tereftálico, transformando-se em uma suspensão insolúvel logo após a acidificação do meio. Após 24 horas, para resfriamento da solução e formação dos cristais, o pó branco e fino foi filtrado a vácuo e, depois de seco, foi analisado por espectroscopia na região do infravermelho com transformada de Fourier (FTIR), com resolução de 4 cm-1, em um intervalo de comprimento de onda de 4000 a 600 cm-1, juntamente com amostras de PET bruto (provenientes das garrafas pós-consumo).
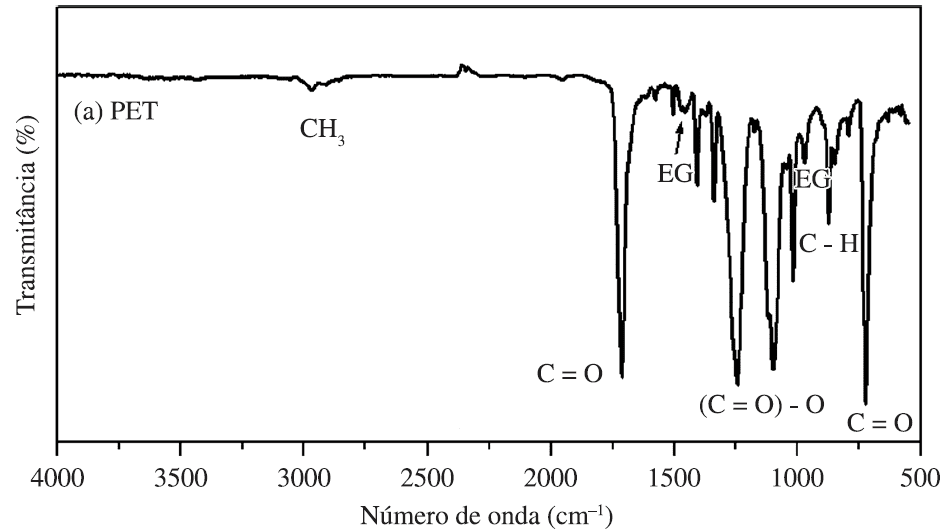
A Figura 6 apresenta o espectro de infravermelho para uma amostra de PET, obtido por Vanini et al., (2013), que apresenta deformações típicas nas regiões de 2900 cm-1 para o grupo CH3; 1715 e 730 cm-1 para o grupo C=O; 1460 e 977 cm-1 para o EG; e 1250 cm-1 para o grupo (C=O)-O.
Figura 6 – Espectro de FTIR esperado para o polímero PET.
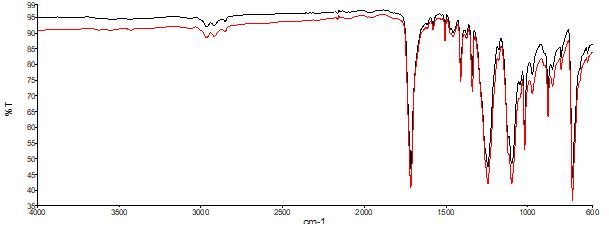
A Figura 7 apresenta o espectro de infravermelho para duas amostras de PET analisadas neste trabalho: a linha preta representa o espectro FTIR para o PET incolor e a linha vermelha representa o espectro FTIR para o PET verde. Pelos espectros obtidos, observa-se semelhança de 98% entre as duas amostras (valor fornecido pelo equipamento), o que indica que estas são quimicamente semelhantes. Na Figura 7 também é possível observar as deformações típicas nas regiões do infravermelho semelhantes à amostra de PET analisada por Vanini et al., (2013) na Figura 6.
Figura 7 – Espectro de FTIR obtido para o polímero PET incolor (linha preta) e verde (linha vermelha).
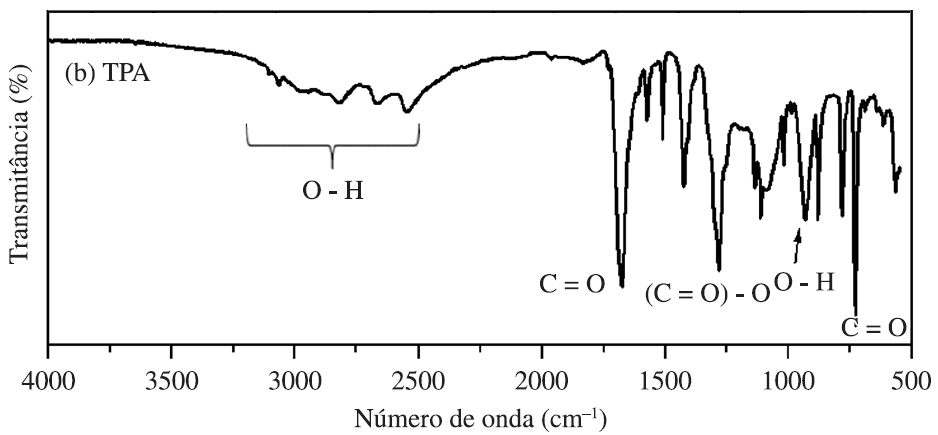
A Figura 8 apresenta o espectro de infravermelho para uma amostra de TPA, obtido pelos experimentos de Vanini et al., (2013). Em relação ao espectro obtido para o PET, observa-se o desaparecimento das deformações referentes ao grupo alifático do EG; o deslocamento de bandas de C=O para menores frequências de absorção devido a ligações de hidrogênio intermoleculares da molécula de TPA (1660 e 725 cm-1, respectivamente); e o aparecimento de bandas de absorção intensas e largas na região de 2500 a 3300 cm-1, referentes ao grupo O-H.
Figura 8 – Espectro de FTIR esperado para o TPA.
A Figura 9 apresenta o espectro de infravermelho para uma amostra de TPA obtida e analisada neste trabalho (experimento número 26: concentração do meio alcalino de 10 M, temperatura de 100 ºC e 5 horas de reação); todas as amostras de TPA obtidas experimentalmente foram submetidas à análise de infravermelho, e todas apresentaram bandas vibracionais semelhantes.
Figura 9 – Espectro de FTIR obtido para uma amostra de TPA obtida experimentalmente (linha preta), em comparação aos espectros das amostras de PET incolor (linha vermelha) e verde (linha azul).
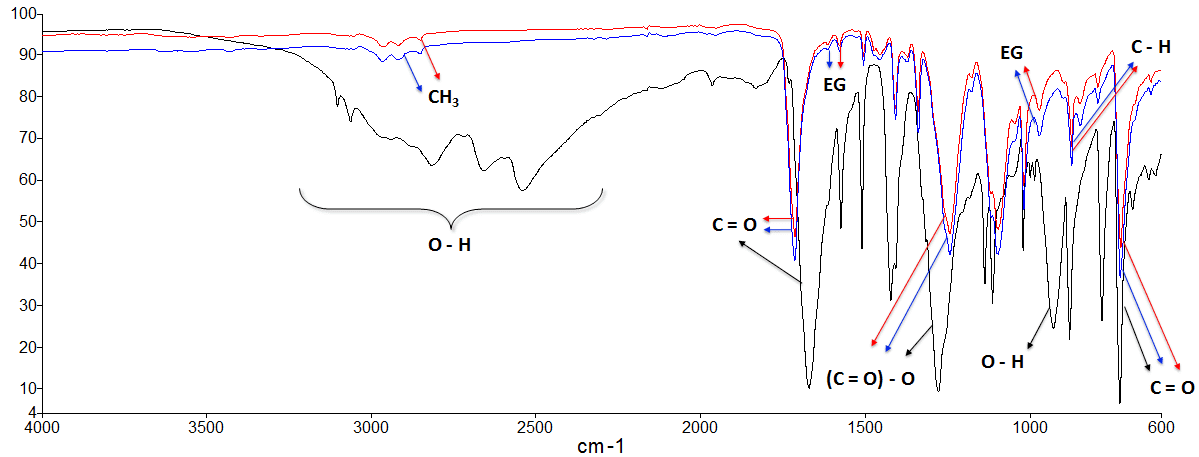
Visualmente, a mudança mais perceptível entre os espectros do PET e do TPA é o aparecimento de bandas intensas e largas na região de 2500 a 3300 cm-1, que poderia indicar também a presença de água na molécula, caso o material não seja devidamente seco antes das análises – por isso a importância do tempo e temperatura de secagem prévia da amostra em estufa. Observa-se, de maneira geral, que o espectro obtido neste estudo condiz com o obtido por Vanini et al., (2013) para o TPA. Entretanto, ao comparar o resultado apresentado na Figura 9 com o esperado, verifica-se que algumas bandas de absorção estão mais largas, principalmente na faixa entre 1000 e 500 cm-1.
Estas divergências nas faixas de absorção dos espectros podem representar impurezas na amostra de TPA. Assim como Souza et al., (2008) encontrou em seu trabalho (mais especificamente em faixas de absorção de 2800 a 2900 cm-1, com picos correspondentes a ligações C-H), descrevendo inclusive outras faixas de interferência (como picos de 3010 a 3100 cm-1, correspondentes a resíduos do processo de despolimerização), os picos de impurezas encontrados similarmente neste estudo podem ser provenientes de resíduos de catalisadores metálicos e aditivos utilizados na fabricação de garrafas PET, que são a origem do material para este estudo.
O rendimento para o TPA foi calculado para cada um dos 27 ensaios realizados. No entanto, alguns resultados apresentaram valores maiores do que 100%, devido ao fato de permanecer algum material (PET) preso nas paredes do balão de três vias durante a reação. Isto fez com que os cálculos de rendimento através da gravimetria a partir da estequiometria da reação de despolimerização fossem imprecisos, situação semelhante ao ocorrido nos experimentos de Souza et al., (2008). Por esta imprecisão nos dados relativos ao TPA, optou-se por trabalhar estatisticamente com os dados relacionados à porcentagem de PET hidrolisado, que foi calculada em relação à massa de polímero introduzida no meio reacional e sua massa que não reagiu durante o tempo de cada experimento.
3.1 TRATAMENTO ESTATÍSTICO
Os dados experimentais obtidos foram inseridos no Minitab® para a avaliação estatística dos fatores estudados. A Tabela 2 apresenta o Experimento Fatorial Completo gerado pelo programa e a Tabela 3, a distribuição dos ensaios após a inclusão da coluna dos resultados de PET Hidrolisado.
Tabela 2 – Experimento Fatorial Multinível gerado pelo Minitab®.
| Fatores: | 3 | Réplicas: | 1 |
| Ensaios base: | 27 | Total de ensaios: | 27 |
| Blocos Base: | 1 | Total de blocos: | 1 |
FONTE: Próprio Autor.
Tabela 3 – Distribuição dos ensaios por esquema fatorial completo, para a despolimerização do PET.
| Experimento | Concentração (mol.L-1) | Temperatura (ºC) | Tempo (horas) | PET Hidrolisado (%) |
| 1 | 5 | 60 | 3 | 6,52 |
| 2 | 5 | 60 | 5 | 7,84 |
| 3 | 5 | 60 | 7 | 10,42 |
| 4 | 5 | 80 | 3 | 9,55 |
| 5 | 5 | 80 | 5 | 14,24 |
| 6 | 5 | 80 | 7 | 16,14 |
| 7 | 5 | 100 | 3 | 12,09 |
| 8 | 5 | 100 | 5 | 32,69 |
| 9 | 5 | 100 | 7 | 43,76 |
| 10 | 7,5 | 60 | 3 | 8,81 |
| 11 | 7,5 | 60 | 5 | 14,61 |
| 12 | 7,5 | 60 | 7 | 22,58 |
| 13 | 7,5 | 80 | 3 | 13,67 |
| 14 | 7,5 | 80 | 5 | 33,50 |
| 15 | 7,5 | 80 | 7 | 33,20 |
| 16 | 7,5 | 100 | 3 | 33,52 |
| 17 | 7,5 | 100 | 5 | 59,81 |
| 18 | 7,5 | 100 | 7 | 88,38 |
| 19 | 10 | 60 | 3 | 19,57 |
| 20 | 10 | 60 | 5 | 64,42 |
| 21 | 10 | 60 | 7 | 42,03 |
| 22 | 10 | 80 | 3 | 29,37 |
| 23 | 10 | 80 | 5 | 70,09 |
| 24 | 10 | 80 | 7 | 93,63 |
| 25 | 10 | 100 | 3 | 78,63 |
| 26 | 10 | 100 | 5 | 96,79 |
| 27 | 10 | 100 | 7 | 91,84 |
FONTE: Próprio Autor.
De acordo com o planejamento experimental proposto, construíram-se os gráficos de efeitos principais (Figura 10) para cada fator analisado (concentração, temperatura e tempo), e colocou-se como resposta a porcentagem de PET hidrolisado experimentalmente.
Um gráfico de efeitos principais examina as diferenças entre as médias de nível para um ou mais fatores. Há um efeito principal quando diferentes níveis de um fator afetam a resposta de maneira diferente. Um gráfico de efeitos principais representa graficamente a resposta média para cada nível de fator ligado por uma linha (SUPORTE AO MINITAB 18, 2017). Quanto mais horizontal a linha se apresentar, menos efeitos principais existirão na reposta, ou seja, se a linha for paralela ao eixo X, cada nível do fator afetará a resposta do mesmo modo, e a resposta média será a mesma em todos os níveis de fator. Entretanto, quanto mais vertical a linha se apresentar, mais efeitos principais existirão na resposta, ou seja, cada nível de fator afetará a resposta de maneira diferente; quanto maior a inclinação da linha, maior será a magnitude do efeito principal.
Figura 10 – Gráfico de efeitos principais referentes aos fatores Concentração, Temperatura e Tempo, que influenciaram na taxa de consumo do PET no meio alcalino.
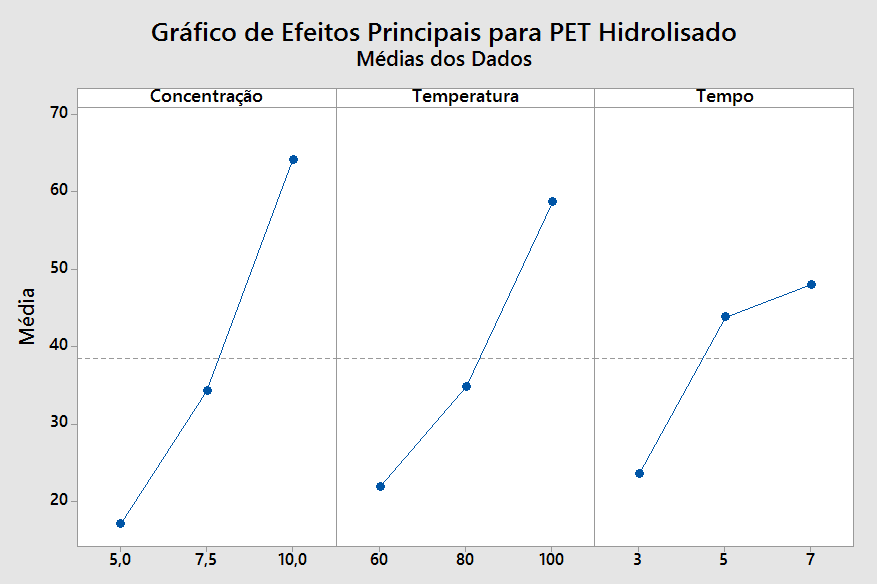
Ao analisar o gráfico obtido (Figura 10), observou-se que o fator de maior relevância na taxa de hidrólise do PET é a concentração do meio alcalino, já que sua linha apresenta a maior inclinação. Neste fator, o nível referente à concentração de 5 M apresenta menor relevância em relação ao nível de 7,5 M, ao passo que o nível de 10 M apresenta maior relevância em relação ao de 7,5 M. Ainda dentro desta análise, verificou-se também que o fator tempo é o menos relevante, pois expressa a menor inclinação, especialmente quando se compara os níveis de 5 e 7 horas, que são menos relevantes entre si.
Na Figura 11 é apresentado o gráfico de interação entre os fatores analisados, com variável de reposta a porcentagem de PET hidrolisado. Um gráfico de interação é usado para demonstrar como a relação entre um fator e uma reposta contínua depende do valor de um segundo fator categórico. Este tipo de gráfico exige as médias para os níveis de um fator no eixo X e uma linha separada para cada nível de outro fator.
Figura 11 – Gráfico de interação entre os fatores Concentração, Temperatura e Tempo, que influenciaram na taxa de hidrólise do PET no meio alcalino; (a) relação da concentração por temperatura; (b) relação da concentração pelo tempo; e (c) relação da temperatura pelo tempo.
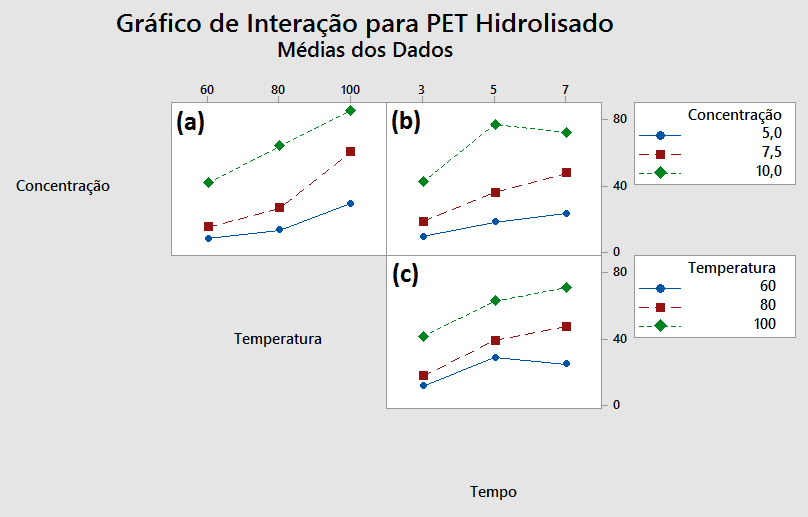
No gráfico (a) da Figura 11, que relaciona a concentração com a temperatura, observa-se que há diferenças entre as inclinações das linhas, que correspondem aos níveis da concentração, o que demonstra que há interações entre estes parâmetros. O PET apresenta maior taxa de hidrólise nas temperaturas de 80 e 100 ºC para a concentração de 10 M, bem como para a concentração de 7,5 M para a temperatura de 100 ºC.
No gráfico (b), que relaciona a concentração com o tempo, registraram-se inclinações próximas entre as curvas dos níveis de concentração de 5 M e 7,5 M, diferente do comportamento da curva de 10 M, que além de apresentar maior inclinação entre os níveis de 3 e 5 horas, evidencia que para o tempo de 5 horas obteve-se a maior média de hidrólise. Nota-se também uma influência semelhante na resposta entre os níveis de 5 e 7 horas, para a concentração de 10 M.
No gráfico (c), que relaciona a temperatura com o tempo, registraram-se comportamentos similares para as curvas de 80 e 100 ºC, o que indica interação entre estes dois níveis para a hidrólise do PET. Entretanto, as maiores médias obtidas foram registradas nos tempos de 5 e 7 horas, ambas para a temperatura 100 ºC.
Tais comparações a respeito dos gráficos de interação evidenciam que maiores taxas de hidrólise para o PET foram obtidas em concentrações mais altas (7,5 e 10 M), com maiores temperaturas (80 e 100 ºC) e também maiores tempos de reação (5 e 7 horas). Visto que a reação de despolimerização ocorre superficialmente no PET, e que para altos rendimentos são necessários (i) uso de soluções concentradas, (ii) uso de altas temperaturas e (iii) altas pressões, assim como descrito por Souza et al., (2008), os resultados obtidos até o momento estão condizentes com o esperado.
No entanto, a análise dos gráficos de efeitos principais e dos gráficos de interação não é suficiente para determinar se um dos fatores é estatisticamente significante, ou seja, se as diferenças encontradas são importantes o suficiente para não serem atribuídas ao acaso. Para esta determinação, utilizou-se a análise estatística de variância (ANOVA), comparando-se as relações entre concentração, temperatura e tempo, conforme as Tabelas 4 e 5.
Tabela 4 – Tabela de informações de fatores e níveis para o experimento ANOVA.
| Fator | Tipo | Níveis | Valores | ||||
| Concentração | Fixo | 3 | 5,0; 7,5; 10,0 | ||||
| Temperatura | Fixo | 3 | 60; 80; 100 | ||||
| Tempo | Fixo | 3 | 3; 5; 7 | ||||
FONTE: Próprio Autor.
Tabela 5 – Análise estatística de variância (ANOVA) ao se comparar a concentração, temperatura e tempo com variável de resposta a taxa de hidrólise do PET.
| Fonte | GL | SQ (Aj.) | QM (Aj.) | Valor F | Valor-P |
| Concentração | 2 | 10185 | 5092,4 | 30,76 | 0,000 |
| Temperatura | 2 | 6253 | 3126,3 | 18,88 | 0,000 |
| Tempo | 2 | 3081 | 1540,6 | 9,30 | 0,001 |
| Erro | 20 | 3311 | 165,6 | ||
| Total | 26 | 22830 |
FONTE: Próprio Autor.
O valor-p, chamado de probabilidade de significância, é uma medida da evidência em seus dados contra a hipótese nula, H0. Em geral, quanto menor for o valor-p, a evidência da amostra é mais forte para rejeitar H0. Por exemplo, em testes de hipótese, pode-se rejeitar a hipótese nula a 5% caso o valor-p seja menor que 5%; em termos gerais, um valor-p pequeno significa que a probabilidade de obter um valor da estatística de teste como o observado é muito improvável, o que leva à rejeição da hipótese nula.
De acordo com os resultados obtidos, na Tabela 5, observaram-se valores-p menores que o nível de significância de 5% (ou seja, valores-p inferiores a 0,05) nos parâmetros de concentração, temperatura e tempo, que indica rejeição da hipótese nula, pois a média de um destes fatores diferiu dos demais, com 95% de confiança.
A conclusão da ANOVA pode ser feita também com base na estatística F. Esta estatística tem distribuição F de Fisher-Snedecor com k-1 e n-k graus de liberdade, onde k é o número de grupos (k = 3) e n é o número de observações (n = 27) (ABG CONSULTORIA ESTATÍSTICA, 2016). Neste caso, verifica-se valor de Ftabelado = 3,40 (RODRIGUES E IEMMA, 2005). Como os valores de F para concentração, temperatura e tempo são maiores que o tabelado, conclui-se que todos os fatores são significativos em relação à reposta.
Para melhor compreensão destes resultados e avaliação da análise estatística ANOVA, foram gerados os gráficos para análises dos resíduos da análise de variância, como mostra a Figura 12. Um gráfico de resíduos é um gráfico que é usado para examinar a qualidade de ajuste em regressão e ANOVA. A análise dos gráficos de resíduos ajuda a determinar se as suposições de mínimos quadrados comuns estão sendo atendidas. Se essas suposições forem satisfeitas, a regressão de mínimos quadrados comum produzirá estimativas de coeficientes não viciadas com variância mínima e, portanto, confiáveis. (SUPORTE AO MINITAB 18, 2017).
Figura 12 – Gráficos de resíduos da ANOVA ao se comparar concentração, temperatura e tempo com variável de resposta a taxa de hidrólise do PET.
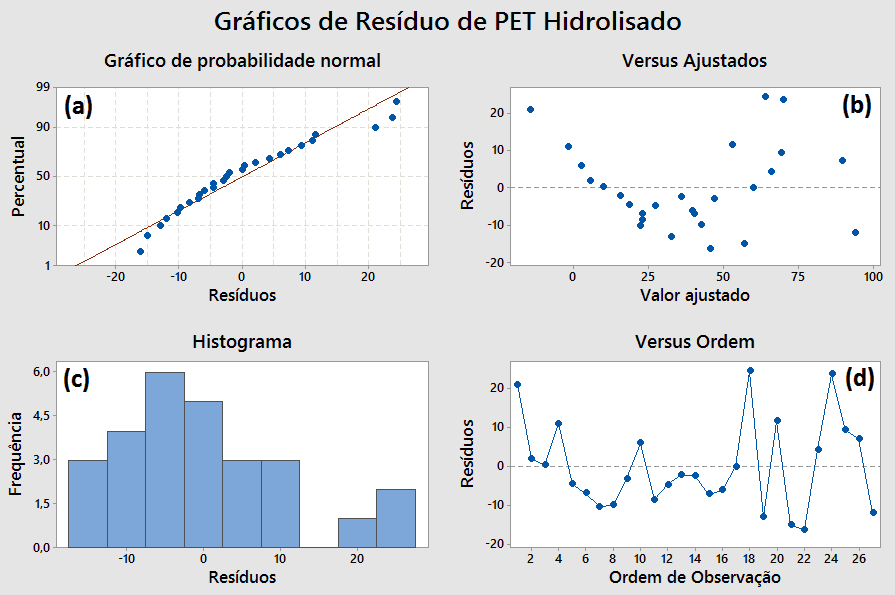
O gráfico de probabilidade normal (Figura 12 – a) é usualmente utilizado como um meio de informação para avaliar a não normalidade de um conjunto de dados (SUPORTE AO MINITAB 18, 2017). No caso acima, os resíduos da ANOVA seguiram aproximadamente uma linha reta (distribuição normal), o que indica que os resultados não foram substancialmente afetados por desvios da normalidade.
O gráfico “resíduos versus ajustados” (Figura 12 – b) auxilia na verificação da pressuposição de que os resíduos são aleatoriamente distribuídos e têm variância constante (SUPORTE AO MINITAB 18, 2017). De maneira ideal e, assim como ocorre neste experimento, os pontos devem cair aleatoriamente em ambos os lados de zero, sem padrões reconhecíveis nos pontos.
O histograma (Figura 12 – c) examina a forma e dispersão dos dados. Ele divide os valores em muitos intervalos e representa a frequência dos valores de dados em cada intervalo como uma barra (SUPORTE AO MINITAB 18, 2017). Por fim, o gráfico “resíduos versus ordem” (Figura 12 – d) verifica o pressuposto de que os resíduos da análise de variância são independentes um do outro. Resíduos independentes não mostram tendências nem padrões quando exibidos em uma ordem temporal, e padrões nos pontos podem indicar que os resíduos próximos uns dos outros podem ser correlacionados e, portanto, não ser independentes (SUPORTE AO MINITAB 18, 2017). Desta maneira, como os resíduos caem aleatoriamente em torno da linha central, sem seguir um padrão, e o histograma que sugere um formato de sino, especialmente se comparado em torno do ponto zero, entende-se que a ANOVA é válida. Com isso, todos os fatores analisados (concentração, temperatura e tempo) são significativos para a resposta.
Este resultado evidencia que a distribuição de pelo menos um dos níveis dos fatores se difere dos demais, mas não deixa evidente em qual a diferença é mais significativa. Assim, fez-se necessário a utilização de um teste de comparações múltiplas, como o teste de Tukey.
No teste de Tukey para a concentração (Figura 13), quando um intervalo não inclui o zero, ou seja, quando a linha do gráfico não passa pelo zero, os intervalos correspondentes a este ponto diferem estatisticamente, o que quer dizer que dois números diferem estatisticamente na resposta quando a diferença entre eles não é zero, sendo que esta diferença contém o intervalo de variabilidade e não contém o zero.
Figura 13 – Teste de Tukey para os níveis do fator Concentração, para confiança de 95%, com variável de resposta a taxa de hidrólise do PET.
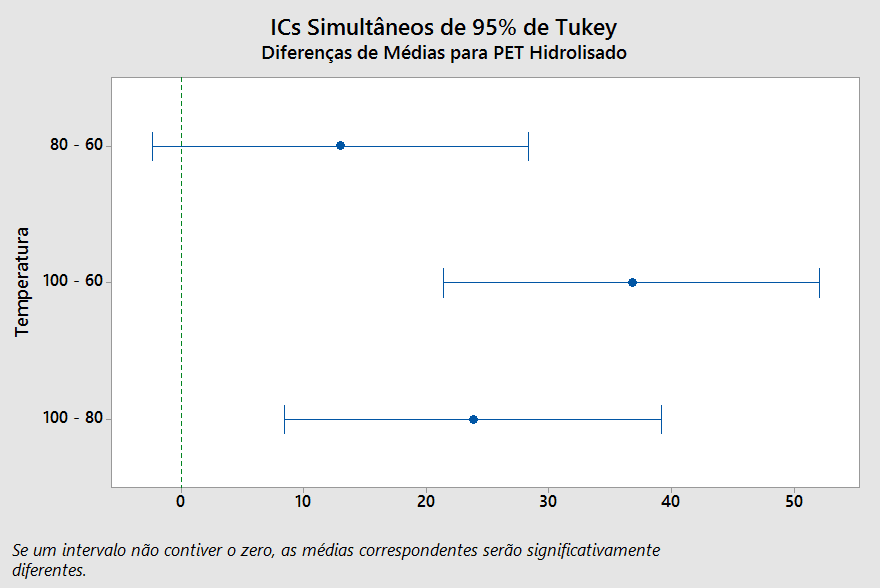
Tabela 6 – Teste de Tukey para avaliar o fator Concentração com variável de resposta a taxa de hidrólise do PET, com confiança de 95%.
| Concentração (M) | N | Média | Agrupamento | ||
| 10,0 | 9 | 64,0410 | A | ||
| 7,5 | 9 | 34,2315 | B | ||
| 5,0 | 9 | 17,0271 | C | ||
FONTE: Próprio Autor.
Do mesmo modo, na Tabela 6, o software agrupa os fatores em grupos com o uso de letras (A, B e C), e médias que não compartilham de uma mesma letra são significativamente diferentes. Analogamente ao gráfico da Figura 13, qualquer que seja o intervalo de concentração trabalhado no processo de despolimerização do PET, esta variável terá interferência significativa na resposta.
Para o fator Temperatura, a análise de Tukey na Figura 14 mostra o agrupamento dos níveis de 60-80 ºC contendo o valor zero, o que sugere que este intervalo não interfere significativamente na resposta. Por outro lado, os agrupamentos de 60-100 ºC e 80-100 ºC interferem consideravelmente na resposta, com 95% de confiança.
Figura 14 – Teste de Tukey para os níveis do fator Temperatura, para confiança de 95%, com variável de resposta a taxa de hidrólise do PET.
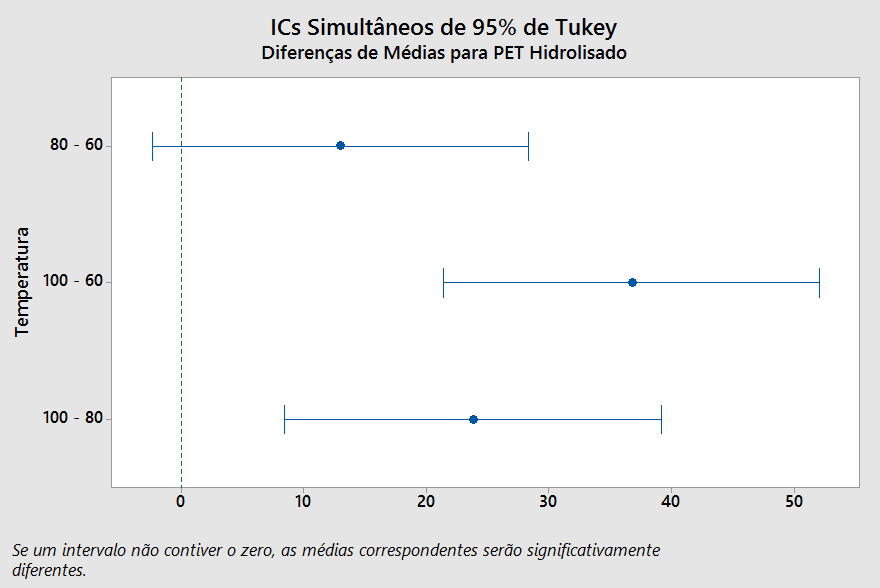
Da mesma forma, a Tabela 7 traz os agrupamentos para o fator temperatura, ou seja, médias que não compartilham de uma mesma letra são significativamente diferentes. De modo semelhante ao visto na Figura 14, utilizar temperaturas de 60 ou 80 ºC no processo de despolimerização do PET resulta em taxas de hidrólise estatisticamente semelhantes, porém inferiores aos processos que utilizam temperatura de 100 ºC; quando se trabalha com esta temperatura, e compara-se com os resultados obtidos a 60 ou 80 ºC, a resposta obtida será consideravelmente superior.
Tabela 7 – Teste de Tukey para avaliar o fator Temperatura com variável de resposta a taxa de hidrólise do PET, com confiança de 95%.
| Temperatura (ºC) | N | Média | Agrupamento | |
| 100,0 | 9 | 58,6125 | A | |
| 80 | 9 | 34,8214 | B | |
| 60 | 9 | 21,8657 | B | |
FONTE: Próprio Autor.
Para o fator Tempo, a análise de Tukey mostra, na Figura 15, o agrupamento dos níveis de 5-7 horas contendo o valor zero, o que sugere que este intervalo não interfere significativamente na resposta. Por outro lado, os agrupamentos de 3-5 horas e 3-7 horas interferem substancialmente na resposta, com 95% de confiança.
Figura 15 – Teste de Tukey para os níveis do fator Tempo, para confiança de 95%, com variável de resposta a taxa de hidrólise do PET.
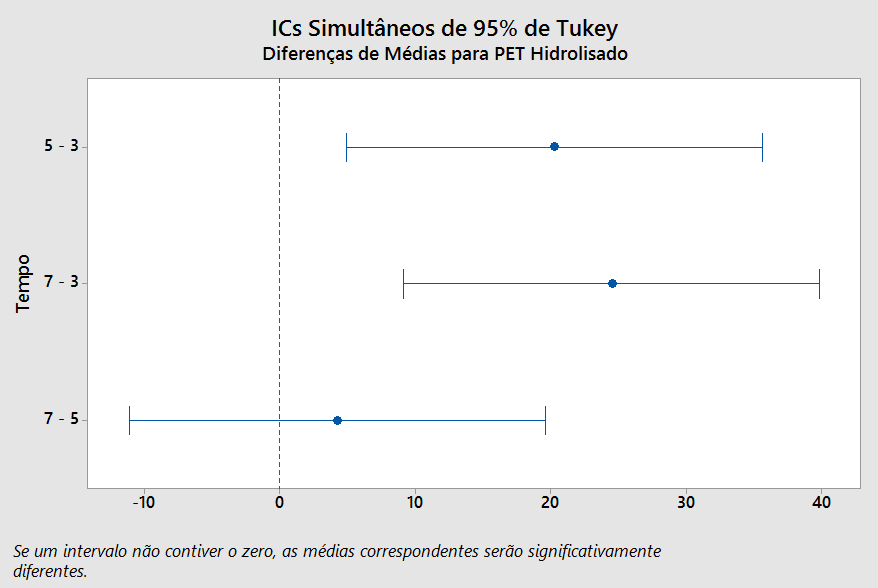
Da mesma forma, a Tabela 8 traz os agrupamentos para o fator tempo, ou seja, médias que não compartilham de uma mesma letra são significativamente diferentes. De modo semelhante ao visto na Figura 15, utilizar tempos de 5 ou 7 horas para o processo de despolimerização do PET resulta em taxas de hidrólise semelhantes.
Tabela 8 – Teste de Tukey para avaliar o fator Tempo com variável de resposta a taxa de hidrólise do PET, com confiança de 95%.
| Tempo (h) | N | Média | Agrupamento | |
| 7 | 9 | 47,9985 | A | |
| 5 | 9 | 43,7774 | A | |
| 3 | 9 | 23,5236 | B | |
FONTE: Próprio Autor.
Entretanto, quando se trabalha com tempos de 3 horas, em comparação com resultados obtidos a 5 ou 7 horas, a resposta obtida será consideravelmente diferente. Nesse caso, ao trabalhar com tempo de 5 horas, ao invés de 7 horas, promove uma redução no tempo reacional de 29% e, consequentemente, no custo reacional e no impacto ambiental, com um processo mais sustentável. Além disso, esse resultado obtido colabora para as demais pesquisas na área, já que em grande parte dos estudos os maiores rendimentos estão correlacionados com maiores tempos reacionais, o que permite promover, portanto, estímulos a novas e contínuas pesquisas de despolimerização do PET via hidrólise alcalina.
3.2 TRATAMENTO DE RESÍDUOS
Ao analisar o experimento em geral, se faz necessário atentar-se ao resíduo ácido produzido após a cristalização do ácido tereftálico por ácido sulfúrico, cujo pH final encontrava-se em torno de zero. Uma das possibilidades de utilização desse rejeito experimental seria em determinadas estações de tratamento de efluentes industriais, principalmente para a neutralização de grupos hidroxilas (OH–) liberados em excesso com a exposição do peróxido de hidrogênio aos raios ultravioleta (UV) em processos que trabalham com métodos de oxidação avançados. Entretanto, além do mordente, há outros contaminantes no resíduo como sulfato de sódio, etilenoglicol e, possivelmente, uma baixa quantidade de ácido tereftálico não-cristalizado, que poderiam interferir na neutralização dos radicais OH–. Por isso, é fundamental um estudo posterior para avaliação da relevância de um pré-tratamento para eliminação dessas substâncias, para a utilização apenas do ácido sulfúrico nessa etapa de tamponamento no tratamento de efluentes.
4. CONCLUSÕES
Com este estudo, foi possível comprovar que a despolimerização do PET é uma rota de reciclagem quimicamente viável, e que os fatores analisados (concentração da solução alcalina de NaOH, temperatura de reação e tempo de reação) são parâmetros que influenciam significativamente na taxa de hidrólise do polímero, em uma relação diretamente dependente destes parâmetros. Portanto, a melhor condição para efetuar este procedimento é com a maior concentração de NaOH (10 M), com a maior temperatura (100 ºC) e com o tempo de reação de 5 horas, visto que nos testes estatísticos de Tukey, as análises de 5 e 7 horas apresentaram resultados semelhantes e, com o emprego do menor período dentre estes, gera-se uma economia de tempo de até 29%, inclusive com maior economia energética para manter a reação em funcionamento.
No espectro infravermelho, foi confirmada a estrutura do ácido tereftálico obtido, com grandes semelhanças entre as bandas vibracionais de uma amostra padrão e das moléculas obtidas experimentalmente pela despolimerização. No entanto, para a reutilização do TPA obtido pela despolimerização, estudos complementares relativos à pureza do material são necessários.
5. REFERÊNCIAS BIBLIOGRÁFICAS
ABG Consultoria Estatística. Como interpretar uma análise de variância? 2016. Disponível em: <http://bit.ly/ABG-ANOVA>. Acesso em 20 de Setembro de 2017.
ABRELPE (ASSOCIAÇÃO BRASILEIRA DE LIMPEZA PÚBLICA E RESÍDUOS ESPECIAIS). Panorama dos Resíduos Sólidos no Brasil, 2014. São Paulo, 2015. 120 p. Disponível em: <http://bit.ly/Panorama-ABRELPE>. Acesso em 02 de Abril de 2017.
BENTES, V. L. I. Hidrólise Básica de Resíduos Poliméricos de PET Pós-consumo e Degradação Catalítica dos Monômeros de Partida. 2008, 100 p. Dissertação (Mestrado em Química). Dissertação apresentada à Coordenação de Pós-Graduação em Química da Universidade Federal do Amazonas. Manaus, 2008. Disponível em: <http://bit.ly/Dissertacao-PET>. Acesso em 07 de Maio de 2017.
FONSECA, T. G.; ALMEIDA, Y. M. B.; VINHAS, G. A. M. Reciclagem Química do PET Pós-consumo: Caracterização Estrutural do Ácido Tereftálico e Efeito da Hidrólise Alcalina em Baixa Temperatura. Departamento de Química da Universidade Federal de Pernambuco. Disponível em: <http://bit.ly/Caracterizacao-Estrutural>. Acesso em 04 de Março de 2017.
MEDEIROS, L. Modelos de Probabilidade e Interferência Estatística: Análise de Variância – Parte 2, s. d. Departamento de Estatística da Universidade Federal da Paraíba. Disponível em: <http://bit.ly/EstatisticaUFPB>. Acesso em 16 de Setembro de 2017.
MORAES, T. T.; MÄHLMANN, C. M.; RODRIGUEZ, A. L. Avaliação da utilização de etileno glicol e dietileno glicol na reciclagem do poli(tereftalato de etileno) – PET. In: XXVI Congresso Brasileiro de Engenharia Sanitária e Ambiental. Santa Cruz do Sul, 2006. 1-15p. Disponível em: <http://bit.ly/CBESA-Avaliacao>. Acesso em 09 de Maio de 2017.
PAVIA, D. L.; LAMPMAN, G. M.; KRIZ, G. L.; VYVYAN, J. R. Introdução à Espectroscopia. 4. ed. São Paulo: Cengage Learning, 2010. 716 p.
PORTAL ACTION. Planejamentos Experimentais Fatoriais Completos. 2017. Disponível em: <http://bit.ly/ExperimentosFatoriais>. Acesso em 16 de Setembro de 2017.
PORTAL DE RESÍDUOS SÓLIDOS. Cadernos de Educação Ambiental – Resíduos Sólidos – Governo do Estado de São Paulo. Disponível em: <http://bit.ly/Portal-RS>. Acesso em 09 de Maio de 2017.
RODRIGUES, M. I.; IEMMA, A. F. Planejamento de Experimentos e Otimização de Processos – uma estratégia sequencial de experimentos. 1. ed. Campinas: Casa do Pão Editora, 2005. 325 p.
ROMÃO, W.; SPINACÉ, M. A. S.; DE PAOLI, M. A. Poli(tereftalato de etileno), PET: Uma Revisão Sobre os Processos de Síntese, Mecanismos de Degradação e sua Reciclagem. Instituto de Química da Universidade Estadual de Campinas, 2009. Disponível em: <http://bit.ly/PET-Revisao-Processos>. Acesso em 16 de Maio de 2017.
SOUZA, L.; TORRES, M. C. M.; FILHO, A. C. R. D. Despolimerização do Poli (Tereftalato de Etileno) – PET: Efeitos de Tensoativos e Excesso de Solução Alcalina. Departamento de Química da Universidade Federal de São Carlos. 2008. Disponível em: <http://bit.ly/Despolim-Tensoativos>. Acesso em 03 de Março de 2017.
SPINACÉ, M. A. S.; PAOLI, M. A. A Tecnologia da Reciclagem de Polímeros. Instituto de Química da Universidade Estadual de Campinas. Revista Química Nova, vol. 28, Nº. 1, p. 65-72, 2005. Disponível em: <http://bit.ly/Tecnologias-Reciclagem>. Acesso em 03 de Março de 2017.
SUPORTE AO MINITAB 18. Biblioteca de conjunto de dados para pesquisa e suporte ao Minitab 18. Minitab Incorporation, 2017. Disponível em: <http://bit.ly/Suporte-Minitab-18>. Acesso em 07 de Outubro de 2017.
VANINI, G.; CASTRO, E. V. R.; FILHO, E. A. S.; ROMÃO, W. Despolimerização Química de PET Grau Garrafa Pós-consumo na Presença de um Catalisador Catiônico, o Brometo de Hexadecil-trimetrilamônio (CTAB). Departamento de Química da Universidade Federal do Espírito Santo. Revista Polímeros, vol. 23, Nº. 3, p. 425-431, 2013. Disponível em: <http://bit.ly/Despolim-CatCat>. Acesso em 04 de Março de 2017.
[1] Bacharel em Engenharia Química pela Universidade São Francisco; Técnico em Química.
[2] Bacharel em Engenharia Química pela Universidade São Francisco.
Enviado: Julho, 2019.
Aprovado: Agosto, 2019.

Uma resposta
Muito bom seu trabalho.
Pode me enviar seu cv?
meu email é *********@univap.br