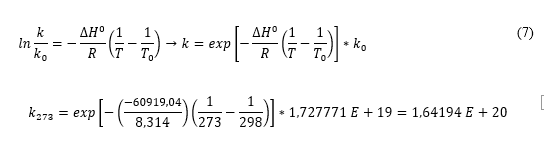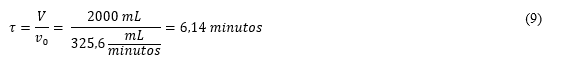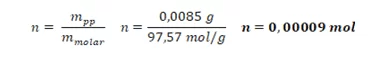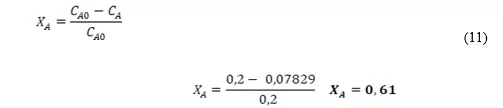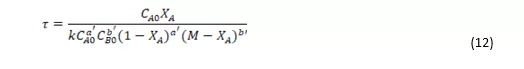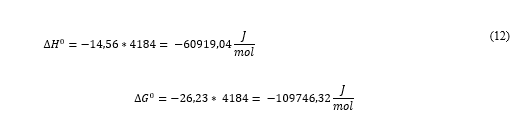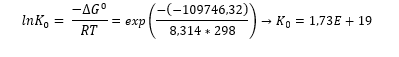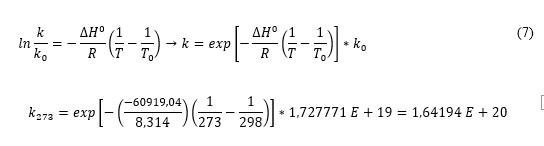ARTIGO ORIGINAL
OLIVEIRA, Caio Custódio de [1], ALMEIDA, Andressa Silva Campos [2], RODRIGUES, Thamiris Veloso [3], FERREIRA, Sabrina Cassia Pereira [4], GAVAZZI, Regiane Mayara [5], D’AMELIO, Monica Tais Siqueira [6]
OLIVEIRA, Caio Custódio de. Et al. Estudo de um reator com reciclo. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 10, Vol. 05, pp. 104-133. Outubro de 2019. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/engenharia-quimica/reator-com-reciclo
RESUMO
Os reatores são amplamente utilizados nas indústrias químicas, os quais suportam temperaturas elevadas e altas pressões para proporcionar reações químicas e consequentemente novos produtos. Desta forma o objetivo deste projeto foi integrar três conceitos distintos tais como; determinação do tempo de residência, constante de equilíbrio e conversão da reação, através da construção de um protótipo de reator CSTR com reciclo. A partir do estudo do tempo de residência foi possível verificar que o mesmo se afastava da idealidade, com um tempo médio de residência de 9,78 minutos superior ao tempo esperado de 6,14 minutos. Para o estudo da conversão da reação no protótipo foi escolhido uma reação de precipitação a partir dos reagentes sulfato de cobre e hidróxido de sódio. A conversão experimental obtida, apesar de não ter sido levado em conta o reciclo, foi satisfatória de 61%, quando comparada com a conversão teórica de 69%. Avaliou-se também, a constante de equilíbrio (K), através das energias livres de Gibbs e das entalpias dos reagentes e dos produtos. Constatou-se que a reação apresentava característica exotérmica e os valores de K diminuem com o aumento da temperatura. Além disso, foram apresentadas sugestões para melhoria e continuidade desse projeto.
Palavras-Chave: CSTR com reciclo, DTR, constante de equilíbrio, conversão.
1. INTRODUÇÃO
Uma reação química ocorre comumente em equipamentos designados reatores. Estes são dimensionados de maneira a suportar elevadas temperaturas e pressões, uma vez que as transferências de massa e calor ocorrem nestes equipamentos (GONÇALVES, 2016).
Os reatores descontínuos (batelada) ou semibatelada e contínuos são os tipos de reatores químicos utilizados em processos com reação química. Os reatores batelada são aplicados em processos de pequena escala. Já os reatores contínuos, são geralmente utilizados em processo de grande escala em que a demanda de produção é maior (FELIPPE, 2018). Cada reator opera de uma forma característica, os reatores de batelada, por exemplo, não são alimentados continuamente, os reagentes são adicionados, e só após um determinado tempo, em que a conversão é atingida, que o produto é retirado. Entretanto, nos reatores contínuos como o próprio nome já diz, os reagentes são alimentados e os produtos retirados do reator continuamente sem realizar pausa. Os reatores semibateladas, são utilizados em processos que há variação da composição com o tempo (GONÇALVES, 2016).
Todo reator CSTR necessita de um agitador. A finalidade do agitador é dimensionada de modo que a mistura ocorra de forma ideal, sem acúmulo de reagente. O tempo de residência é determinado através da razão entre o volume do reator pela sua vazão volumétrica. No interior do reator agitado, a alimentação e o descarregamento são feitas de forma contínua para que, o volume do tanque permaneça sempre constante (FELIPPE, 2018).
Os reatores são utilizados para promoverem reações químicas e operar um processo de forma eficiente. O reator tanque agitado contínuo, é um exemplo; eles são capazes de obter uma mistura perfeita, sem acúmulo de reagentes ou produtos, além disso, é considerado um processo economicamente viável.
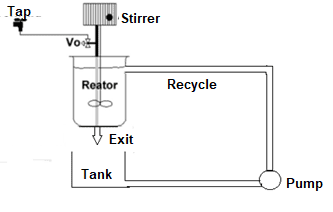
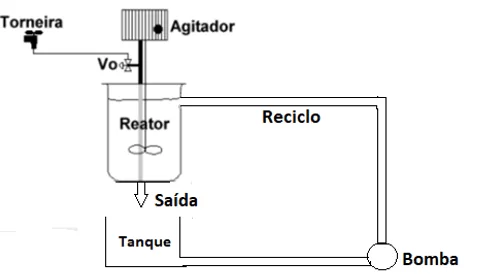
Neste âmbito, este projeto objetivou construir o protótipo de um reator CSTR com reciclo e volume constante, a partir de materiais acessíveis, para determinação da reação, concentração dos reagentes, conversão prática, separação do produto e determinação da constante de equilíbrio da reação de formação do precipitado (Cu(OH)2(s)). O projeto foi realizado através de cálculos baseados no protótipo construído, como mostra a Figura 1:
Figura 1- Reator CSTR.
1.1 REATOR TANQUE CONTÍNUO IDEAL – CSTR
O Reator Tanque Agitado Contínuo (CSTR) é comumente utilizado em processos industriais, principalmente para reações em fase líquida. É operado em regime estacionário e obtêm-se uma mistura perfeita. Não há dependência espacial ou de tempo para concentração, temperatura e velocidade de reação no seu interior. Então, as variáveis não mudam em qualquer ponto no lado interno do reator, por este motivo, a temperatura e concentração tem o mesmo valor no ponto de saída e são modeladas para serem as mesmas no processo inteiro (FOGLER, 2014). Quando a equação geral do balanço molar é aplicada a um CSTR que opera em regime estacionário, as condições não variam com o tempo e é uma mistura perfeita, obtêm-se a Equação de projeto (1) para um CSTR:

A equação de projeto do CSTR fornece o volume de reação V necessário para reduzir a vazão molar de entrada da espécie j, Fj0, à vazão molar de saída Fj, quando a espécie j está desaparecendo à velocidade −rj. O CSTR é modelado de forma que as condições na corrente de saída, como concentração e temperatura, sejam idênticas como no interior do tanque (FOGLER, 2014). A vazão molar Fj é dada pelo produto da concentração da espécie j e a vazão volumétrica v, como na Equação (2) :
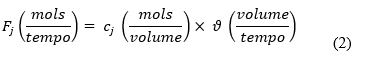
Substitui-se Fj0 e Fj na Equação (1) para obter um balanço para a espécie A, como mostra a Equação (3):

A equação do balanço molar para o CSTR ideal é uma equação algébrica, e não uma equação diferencial (FOGLER, 2014).
1.2 CORRENTE DE RECICLO
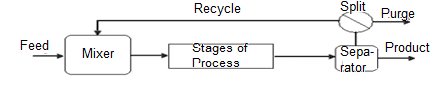
O reciclo é muito utilizado em reatores CSTR assim como, em vários outros tipos de reatores. Pois, não é comum uma reação ter 100% de conversão, ou seja, todo o reagente virar produto. Sempre existe uma quantidade de reagente, mesmo que pequena, na corrente de saída do meio reacional (MOURA, 2013). Essa quantidade de reagente não consumida é vista como desperdício de recursos. Uma saída viável para este problema é tentar reciclar esta quantidade de reagente não consumida, realimentando-a no reator, conforme ilustrado na Figura 2:
Figura 2- Reator de reciclo CSTR.
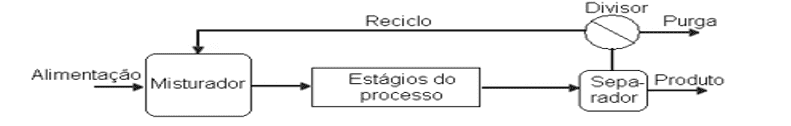
O princípio de um reator de reciclo é dividir a corrente de saída de um reator, o que faz com que, uma parte dela retorne para corrente de entrada do reator e consumir o reagente que passou por um processo de separação, conforme ilustrado na Figura 2. A razão de reciclo R pode ser definida como: a razão entre o volume do fluído que retorna no reator (v3) e a vazão que entra do sistema (vf), conforme Equação 4 (LUCCA, 2007):

Esta razão de reciclo pode variar de zero a infinito. À medida que a razão de reciclo for aumentada, o comportamento do sistema varia de tubular (R=0) para reator de mistura perfeita (R=∞). O reciclo proporciona um meio de obter vários graus de mistura dos reagentes (FOGLER, 2014).
1.3 REATOR TUBULAR IDEAL – PFR
Os reatores tubulares são geralmente utilizados para gases, devido seu escoamento. A forma de escoamento é um fator importante, pois afeta diretamente a reação química, causando difusão radial e longitudinal, o que gera gradiente de temperatura e concentração. No reator tubular o escoamento deve ser empistonado na secção transversal do tubo, ou seja, com velocidade uniforme. Assim a concentração também é uniforme (FELIPPE, 2018).
Ele é frequentemente utilizado em processos de grande escala, pois atuam continuamente produzindo grande quantidade de produtos, com paradas intermediárias, com tempo de carga, descarga e limpeza praticamente zero. Fatores com concentração, temperatura, vazão e pressão devem ser sempre controlados com aparelhos de alta precisão, exigindo assim mão de obra especializada (FELIPPE, 2018).
1.4 REATOR BATELADA
É um processo no qual dispende um tempo para carga, descarga e limpeza, esse tempo pode ser maior que o tempo de operação. É realizado em pequenas escalas, como medicamentos, cosméticos, alimentícios e química fina em geral (FELIPPE, 2018). O reator batelada deve apresentar uma agitação homogênea, para que não ocorra o acúmulo e volumes mortos. Para que assim as moléculas apresentem o mesmo tempo de residência médio dentro do tanque (FELIPPE, 2018).
1.5 REATOR SEMIBATELADA
Qualquer reator que não se encaixe como contínuo ou batelada. No processo semibatelada acrescenta se aos poucos o reagente A ao tanque já contendo reagente B, onde A é rapidamente consumido e a concentração de B é praticamente constante. É possível minimizar os caminhos preferenciais, através do controle das concentrações (FELIPPE, 2018).
1.6 DISTRIBUIÇÃO DE TEMPOS DE RESIDÊNCIA EM REATORES – DTR
A Distribuição de Tempo de Residência (DTR) é importante para descrever o escoamento contínuo de um equipamento. As análises geralmente se baseiam na idealidade do reator, porém na maioria dos casos o que se obtêm é o escoamento real. Para determinar o comportamento do fluido em casos não ideais se faz necessário a medição da DTR (FONSECA, 2011).
As funções que determinam a DTR são: a função E (t), o tempo de residência médio ™ e a variância (σ2)(LIMA, et al., 2005).
1.7 REAÇÃO ESCOLHIDA
A reação escolhida para utilização no reator de reciclo foi uma reação de dupla troca com a formação do precipitado hidróxido de cobre (II), como reagentes o sulfato de cobre penta hidratado e hidróxido de sódio:
CuSO4.5H2O (aq)+NaOH (aq)→Cu(OH)2 + NaSO4 (aq)
O sulfato de cobre (II) ou sulfato cúprico é um composto químico com fórmula molecular CuSO4. Este sal existe sob algumas formas, que se diferem por seu grau de hidratação. Na sua forma anidra ele se apresenta como um pó de coloração verde opaca ou cinzento, enquanto na sua forma penta-hidratada, CuSO4.5H2O, na qual é mais encontrado, ele é azul brilhante. Utilizado como herbicida e pesticida (BACON, 1975).
O hidróxido de sódio é um composto químico com fórmula molecular NaOH, amplamente utilizado na indústria, principalmente como base química, na fabricação de papel, tecidos, detergentes, alimentos e biodiesel. Trata-se de uma base forte. Apresenta ocasionalmente uso doméstico para a desobstrução de encanamentos e sumidouros, pois dissolve gorduras. Reage de forma exotérmica com a água, e é produzido por eletrólise de uma solução aquosa de cloreto de sódio, que é produzido junto com o cloro. Solubilidade em água 1.090 g/L a 20 °C (LOPES, 1995).
O hidróxido de cobre (II) é um composto químico inorgânico de fórmula Cu(OH)2 é um sólido azulado verde pálido, é uma base fraca e possui a interessante capacidade de dissolver a celulose, esta propriedade levou-o a ser utilizado na produção de rayon, uma fibra de celulose sintética (BACON, 1975). Também é utilizado como opção de fungicida em plantas e pode ser utilizado como corante cerâmico (BACON, 1975). O hidróxido de cobre (II) é insolúvel em água, solúvel em NH4OH e KCN, possui massa molar 97,56 g/mol, densidade 3,368 g/cm3 e ponto de fusão 80 °C (decomposição para CuO e H2O) (LOPES, 1995).
O sulfato de sódio é um composto inorgânico com fórmula Na2SO4. Todas as suas formas são sólidos brancos que são altamente solúveis em água. É usado principalmente para a fabricação de detergentes e no processo kraft de polpação de papel (LOPES, 1995).
Uma reação química está em equilíbrio quando as concentrações de reagentes e produtos não variam mais ao longo do tempo, ou seja, são constantes. A variação do K demostra o deslocamento da reação para formação de produto ou reagente (SMITH, et al., 2013). K ≥ 1 favorece a formação de produtos; se K < 1 a reação é reversível, consequentemente favorece os reagentes e se K = 0 a reação encontra-se no equilíbrio. Quando a temperatura (T) é constante a 298 K a constante de equilíbrio é definida pela Equação 5 (SMITH et al., 2013):

Onde é a somatória das energias livres de Gibbs de cada componente da reação. Para uma reação exotérmica o é negativo, sendo assim com o aumento da temperatura K diminui, para uma reação endotérmica, positivo, ocorre o inverso, K aumenta com o aumento da temperatura. Portanto para temperaturas variadas utiliza-se a Equação 6 (SMITH; VAN NESS; ABBOTT, 2013):
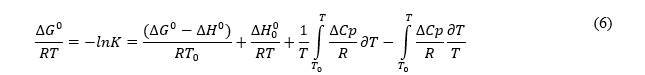
Onde são a somatória das entalpias e entropias respectivamente.
Porém, por motivo de simplificação dos cálculos, no trabalho apresentado utilizou-se a Equação 7, a qual apresenta um valor aproximado de K. Se for necessário um valor mais preciso recomenda-se fazer o uso da Equação 6.
Os valores de entalpias e das energias livres de Gibbs, para as Equações 5-7, são tabelados. Para espécies químicas com valores não tabelados, um dos métodos a ser utilizado é o Método de Benson (SMITH et al., 2013).
1.8 MÉTODO DE BENSON
O método de Benson é uma ferramenta utilizada para determinar a constante de equilíbrio químico em temperaturas variadas. Quando a constante de equilíbrio não é determinada experimentalmente, este método é capaz de predizer o valor desta constante. (NASCIMENTO, 2009).
Através deste método são estimadas as entalpias de formação, entropias e calor específico de cada composto a partir das energias envolvidas em cada ligação química presente no composto. O método de Benson considera que as moléculas são formadas por grupos de átomos. Assim, este grupo é representado por um “átomo chave”, com número de valência maior do que a unidade, seguido por outros átomos ligados a ele. (NASCIMENTO, 2009).
2. METODOLOGIA
2.1 CONSTRUÇÃO DO PROTÓTIPO DO REATOR CSTR COM RECICLO
Com as cinco peças de madeira e com quatorze pregos construiu-se um suporte para o reator, duas peças de madeira foram utilizadas como base para a construção, com outras três peças, três prateleiras horizontais.
A primeira prateleira foi utilizada para acoplar as duas garrafas pet, as quais foram cortadas, de maneira que o fundo foi retirado. As garrafas pet foram utilizadas como tanque de abastecimento de reagentes. Na tampa de cada garrafa foi colocado um cano 10 x 20 cm, uma curva de 20 mm e um registro de esfera de 20 mm sucessivamente. Estes encanamentos foram conectados ao recipiente plástico de 3 L, o qual serviu como tanque de agitação. O tanque de agitação recebeu uma tampa de madeira removível, onde na parte superior foi parafusado o motor responsável pela agitação e na parte inferior foi colada a haste de madeira. Na haste foi colada, com cola PVC, a placa de plástico. No fundo do tanque de agitação foi colado um anel de vedação, que fixou o recipiente na segunda prateleira. O anel também foi utilizado como receptor do conjunto de conexões que formaram o sistema de escoamento. O sistema de escoamento foi formado por um T de conexão 50 mm, duas curvas de 50 mm, duas buchas de redução 50 mm para 20 mm e dois registros de esfera de 20 mm sucessivamente, resultando em saídas para o mesmo recipiente de armazenamento. A alimentação do motor foi realizada através de uma fonte de alimentação de computador, que foi conectado, por de fios, ao motor e a uma chave seletora L/D. Na parede interna da terceira prateleira acoplaram-se dois aros laminados de ¼, os quais foram feitos como suporte para os dois para filtro de café.
Na parte interna da terceira prateleira foi parafusado o recipiente de 3, 5 L, que foi utilizado como tanque de armazenamento. No tanque de armazenamento foi colada uma torneira de filtro de água, para esvaziar o tanque quando necessário. A bomba, utilizada no reciclo, foi colocada no tanque de armazenamento. Foi conectada à bomba uma mangueira de nível de 10 mm e um registro de espera de 10 mm, o qual tem a função de controlar a vasão de reciclo. O reciclo só deve ser ligado após a submersão da bomba. Ainda na terceira prateleira, na parte exterior foram colocadas duas alças de mangueira, pregadas com prego, onde foi colocada a fonte de alimentação do motor.
2.2 MÉTODO DETERMINAÇÃO DO TEMPO DE RESIDÊNCIA
Primeiro foi necessário fazer o juste da pá do agitador do reator utilizado na metade da altura do líquido (água) e ligou-se o agitador. Ajustaram-se as vazões do reator para que o volume do tanque ficasse constante. Depois de feitos todos os ajustes, completou-se o volume do tanque com água, e então, fecharam as torneiras de entrada e saída para determinar o volume de líquido do tanque. Depois de determinar o volume, esvaziou-se o reator encheu-se o tanque com o traçador (solução de corante de 500 mol/L). Então, abriram-se as válvulas de alimentação para a entrada de água e as válvulas de saída, em seguida acionou-se o cronômetro. O reciclo foi acionado após o reservatório ter quantidade suficiente de líquido para retornar no reator, em seguida foi necessário aguardar o volume reacional estabilizar para coletar as amostras em copos descartáveis de 50 mL nos respectivos tempos de 0, 20’’, 40’’, 1’, 1’30’’, 2’00’’, 2’30’’, 3’00’’, 4’00’’, 5’00’’, 6’00’’, 8’00’’, 10’00’’, 12’00’’, 15’00’’, 20’00’’, 25’00’’, 30’00’’, 35’00’’, 40’00’’, 45’00’’, 50’00’’, 55’00’’. Analisaram-se as amostras coletadas em um espectrofotômetro BEL UV-M51 UV-Visível (110 V) com comprimento de onda de 430 nm e anotaram-se os valores obtidos.
2.3 DETERMINAÇÃO DA VELOCIDADE DA REAÇÃO
Primeiramente foram plotados e traçadas as tangentes de três gráficos referentes a 3 ensaios realizados com concentrações diferentes dos reagentes sufato de cobre pentahidratado e hidróxido de sódio, obtendo-se gráficos de concentração limitante (mol/L) versus tempo (s). Calculou-se a velocidade para os três e em seguida, foi calculado o log, dessa forma foi possível encontrar a ordem global e velocidade da reação.
2.4 DETERMINAÇÃO DA CONVERSÃO EXPERIMENTAL
Inicialmente foram preparadas as soluções de 0,1 mol/ mL de sulfato de cobre pentahidratado e 0,2 mol/ mL de hidróxido de sódio.
Em uma balança analítica (Bioprecisa) pesaram-se 12,47 g de sulfato de cobre pentahidratado, as quais foram dissolvidas e transferidas para um balão volumétrico de 500 mL. Em seguida o balão volumétrico foi completado com água destilada até o menisco. Agitou-se o balão. Este procedimento foi realizado por mais duas vezes para que se adquirisse 1,5 L da solução. O mesmo foi feito para a solução de hidróxido de sódio, o qual a massa pesada foi de 4,07 g. Com as soluções prontas, pesaram-se os papeis de filtro e anotaram-se as massas. Posteriormente, foi colocado água no tanque do reator até completar o volume operacional, no reator em questão 2 L. Foram colocadas as soluções, cada uma em um tanque de abastecimento do reator. Após acionaram-se as válvulas que liberaram os reagentes. O reciclo foi ligado após a submersão total da bomba.
A partir disso, coletaram-se 25 amostras. As amostrar foram coletas em provetas de 10 mL; as 6 primeiras amostras foram coletadas de 30 em 30 segundos, as outras 19 foram coletas a cada 1 minuto. Foi anotado o tempo em cada amostra colhida assim como seu respectivo volume.
As amostras coletadas foram filtradas pelo sistema de filtração à vácuo composto por: 1 bomba a vácuo; 1 kitassato; 1 funil de Buchner e 1 trompa de vácuo. Após realizar a filtração as amostras foram levadas para secar em estufa (Tecnal) à 30 ºC por 10 minutos. Depois de secas, as mostras forma pesadas, e suas massas anotadas.
2.5 CÁLCULO DA CONSTANTE DE EQUILÍBRIO (K)
Primeiramente foram encontrados os dados de G e H, para cada componente da reação, e foram realizadas as somatórias a fim de encontrar os valores de . Logo após, através da Equação 5 calculou-se K0, na qual foi utilizada a temperatura padrão de 25 0C. Desta forma foi possível calcular a constante de equilíbrio para as temperaturas: 0, 5, 10, 15, 25, 30, 127 0C. Foi utilizada a Equação 7. Por fim foi calculada a constante de equilíbrio para a temperatura na qual foi realizada a reação; de 21 0C.
3. RESULTADOS E DISCUSSÕES
A partir do protótipo do reator CSTR com reciclo construído conforme observado na Figura 3 foram analisados os três métodos estudados; o tempo de residência – DTR, a conversão da reação experimental e por último, a constante de equilíbrio K.
Figura 3 – Protótipo do reator CSTR com reciclo.

3.1 DISTRIBUIÇÃO DO TEMPO DE RESIDÊNCIA – DTR
Para iniciar o estudo do tempo de residência e coletar as amostras foi necessário aguardar cerca de 10 minutos após início do experimento, para que houvesse a estabilização do reator e o volume não variasse mais. Todas as amostras foram analisadas no espectrofotômetro visível no comprimento de onda de 430 nm para determinar qual era a concentração de solução de corante que saía do reator.
A partir do método de degrau negativo foi possível plotar seu respectivo gráfico conforme Figura 4 que representa a concentração de solução corante pela sua concentração inicial ao longo do tempo. Dado que, a concentração de corante diminui ao longo do tempo, esta curva necessariamente deve apresentar características decrescentes. Entretanto é notório observar como a Figura 4 apresenta alguns pontos dispersos. Estes pontos mostram que quanto mais dispersos, mais o reator se afasta da idealidade.
Figura 4 – Concentração por concentração inicial ao longo do tempo.
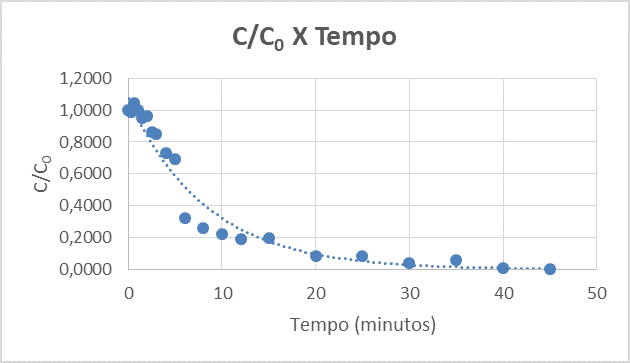
De acordo com a Figura 4 é possível observar uma aglomeração de pontos nos primeiros minutos de coleta, provavelmente isso ocorreu porque houve problemas para manter o volume reacional constante e consequentemente essa variação de vazões na entrada do reator prejudicou a obtenção de dados coerentes, além disso, o tempo de estabilização do reator no início também fez com que houvesse esse acúmulo de pontos nos primeiros minutos.
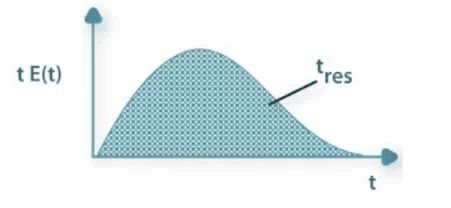
Este problema mostra o quanto o reator está longe da idealidade, pois apesar da sua concentração diminuir ao longo do tempo, há problemas na homogeneização do meio reacional, possivelmente o agitador utilizado também influenciou nestes dados fora do esperado. Na Figura 5 a seguir tem-se o exemplo de como se comporta o tempo de residência de um reator CSTR ideal.
Figura 5 – Tempo de residência em um reator ideal CSTR.
Para determinar o tempo de residência experimental do protótipo e construir o seu respectivo gráfico foi necessário realizar o cálculo conforme abaixo para cada intervalo de tempo, após a última coleta realizou o somatório e encontrou o valor da DTR conforme Equação 8.
Cálculo do tempo de residência:
Somatório de todos os tempos – DTR:

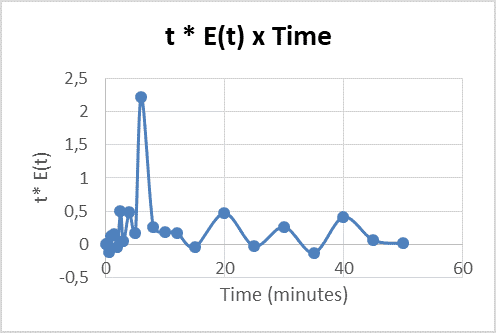
Desta forma foi possível plotar o gráfico do tempo de residência do reator. Na Figura 6 é possível observar que o gráfico não possui o mesmo comportamento do tempo de residência de um reator CSTR ideal (Figura 5), entretanto a projeção da curva do tempo de residência do protótipo apresenta características semelhantes a de um CSTR ideal.
Figura 6 – Tempo de residência do protótipo.
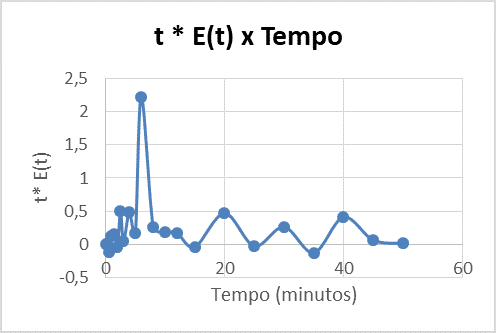
Ao observar o gráfico nota-se que o mesmo atinge seu ponto máximo, entretanto existem muitos pontos disperso o que proporcionou uma curva distante da qual se esperava. A área do gráfico descreve o tempo de residência. Esta área representa 9,78 minutos, conforme calculado anteriormente pela Equação 8, porém pelo fato da curva obtida apresentar características desregulares não foi possível calcular a sua área do gráfico manualmente, pois o valor obtido iria ser muito grosseiro e consequentemente iria interferir negativamente no resultado do tempo de residência. Alguns fatores podem ter sido responsáveis pela curva apresentar este comportamento como, por exemplo, a ocorrência de zonas de escoamento preferencial, o que faz com que algumas partículas atravessem o sistema muito mais rápido do que as outras, registando-se assim um curto-circuito. Por outro lado, também pode ter ocorrido a formação de zonas mortas ou estagnação.
A comparação do tempo de residência teórico com o tempo real permite verificar se o escoamento é ideal (quando![]() ) ou identificar o tipo de desvio ao escoamento ideal. Se
) ou identificar o tipo de desvio ao escoamento ideal. Se ![]() existe predominância de curto-circuito, se
existe predominância de curto-circuito, se ![]() acontece a formação de zonas mortas. Através da Equação 9 foi possível calcular o valor do tempo espacial. Sendo que,
acontece a formação de zonas mortas. Através da Equação 9 foi possível calcular o valor do tempo espacial. Sendo que, ![]() corresponde a vazão de saída do reator, ou seja é a somatória das vazões de alimentação de
corresponde a vazão de saída do reator, ou seja é a somatória das vazões de alimentação de 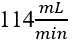 e
e 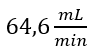 mais a vazão de reciclo de
mais a vazão de reciclo de 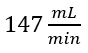 . Estas vazões foram ajustadas antes de iniciar o experimento. Desta forma, a vazão de saída correspondeu à
. Estas vazões foram ajustadas antes de iniciar o experimento. Desta forma, a vazão de saída correspondeu à 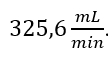 .
.
Com o valor do tempo espacial e do tempo médio foi possível concluir que houve predominância de curto-circuito no meio reacional, pois o tempo espacial foi menor 6,14 minutos do que o tempo médio de 9,78 minutos, ou seja, as partículas não tiveram tempo suficiente de permanência no reator. Este problema pode estar relacionado também com as vazões de entrada, pois houve problemas ao longo do experimento com o volume reacional, uma vez que foi necessário ajustá-las várias vezes para que o volume permanecesse constante. O recipiente utilizado para ocorrer a reação também pode ter sido um fator que fez com que o protótipo fugisse da idealidade, por se tratar de um material polimérico a rugosidade do material deve ser levada em conta bem como o formato do recipiente, pois o mesmo apresentava arestas visto que, o fundo era plano e não abaloado.
3.2 DETERMINAÇÃO DA VELOCIDADE E CINÉTICA DA REAÇÃO
A determinação da ordem de reação e o estudo de sua cinética foram necessários para obtenção da velocidade de reação. Através da construção do gráfico (Concentração limitante x tempo) dos 3 ensaios com diferentes concentrações dos reagentes, foram traçados a tangente no primeiro ponto e determinou a velocidade para cada situação, conforme as Figuras 7, 8 e 9 a seguir.
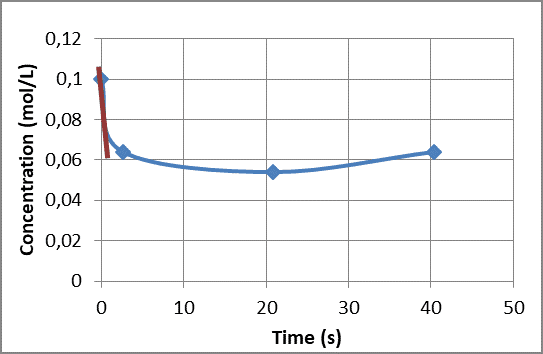
Figura 7 – Gráfico da C limitante x tempo da reação 0,1 mol/L de CuSO4 com 0,1 mol/L de NaOH.
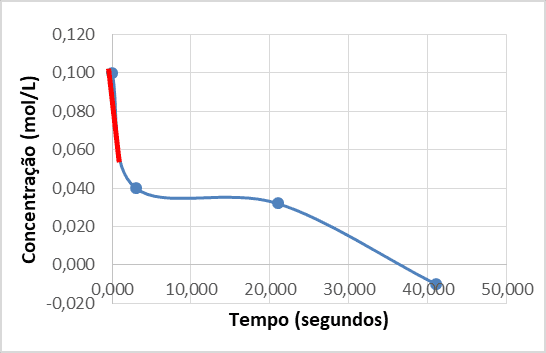
Figura 8 – Gráfico da C limitante x tempo da reação 0,1 mol/L de CuSO4 com 0,05 mol/L de NaOH.
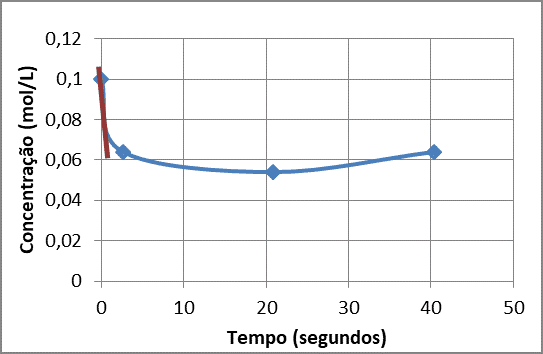
Figura 9 – Gráfico da C limitante x tempo da reação 0,05 mol/L de CuSO4 com 0,1 mol/L de NaOH.
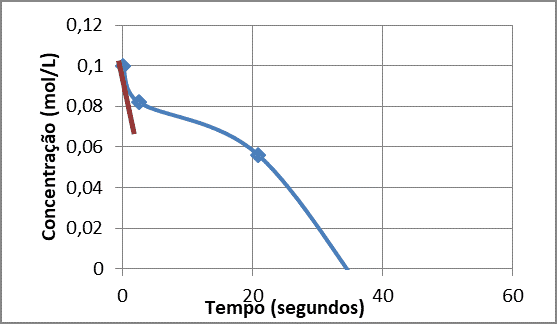
Organizaram-se as concentrações e as velocidades em módulo encontradas no gráfico de cada ensaio conforme apresentado na Tabela 1.
Tabela 1 – Velocidades das Reações
| Ensaios | Reagente CuSO4 (mol/L) | Reagente NaOH (mol/L) | r (mol/L.s) |
| 1 | 0,1 | 0,1 | 0,04 |
| 2 | 0,1 | 0,05 | 0,024 |
| 3 | 0,05 | 0,1 | 0,01 |
FONTE: Próprio Autor.
Assim, foi encontrada a ordem da reação e obtiveram-se os coeficientes a’ e b’ conforme os cálculos a seguir:
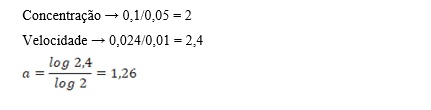 O mesmo foi realizado para o coeficiente b’, que obteve seu valor de 0,74. Para o cálculo da velocidade usou-se a Equação 10.
O mesmo foi realizado para o coeficiente b’, que obteve seu valor de 0,74. Para o cálculo da velocidade usou-se a Equação 10.
 Onde: = velocidade (mol/L*min); k = velocidade da reação (mol/L*min); Ca = concentração do reagente CuSO4; Cb = concentração do reagente NaOH.
Onde: = velocidade (mol/L*min); k = velocidade da reação (mol/L*min); Ca = concentração do reagente CuSO4; Cb = concentração do reagente NaOH.
3.3 CONVERSÃO DA REAÇÃO ESTUDADA
Para determinar a conversão da reação experimental foi necessário coletar em intervalos de tempo, a massa de precipitado obtida. A Tabela 2 mostra todos os dados obtidos e os cálculos realizados, respectivamente:
Tabela 2 – Dados experimentais obtidos.
| Tempo
[minutos] |
Massa papel [g] | Massa papel+pp*
[g] |
Volume [L] | Massa pp* [g] | Mol do precipitado [Mol] | Concentração do pp* [mol/L] | Concentração de NaOH (não reagido) |
| 0,3 | 0,5415 | 0,5500 | 0,0031 | 0,0085 | 0,00009 | 0,0281 | 0,14380 |
| 1,0 | 0,5225 | 0,5200 | 0,0031 | -0,0025 | -0,00003 | -0,0083 | 0,21653 |
| 1,5 | 0,5320 | 0,5400 | 0,0023 | 0,0080 | 0,00008 | 0,0356 | 0,12870 |
| 2,0 | 0,5130 | 0,5400 | 0,0029 | 0,0270 | 0,00028 | 0,0954 | 0,00916 |
| 3,0 | 0,5225 | 0,5400 | 0,0022 | 0,0175 | 0,00018 | 0,0815 | 0,03695 |
| 4,0 | 0,5320 | 0,5400 | 0,0035 | 0,0080 | 0,00008 | 0,0234 | 0,15315 |
| 5,0 | 0,5035 | 0,5100 | 0,0023 | 0,0065 | 0,00007 | 0,0290 | 0,14207 |
| 6,0 | 0,5510 | 0,5700 | 0,0032 | 0,0190 | 0,00019 | 0,0609 | 0,07829 |
| 7,0 | 0,5320 | 0,5600 | 0,0021 | 0,0280 | 0,00029 | 0,1367 | -0,07331 |
| 8,0 | 0,5415 | 0,5600 | 0,002 | 0,0185 | 0,00019 | 0,0948 | 0,01039 |
| 9,0 | 0,5320 | 0,5700 | 0,0021 | 0,0380 | 0,00039 | 0,1855 | -0,17092 |
| 10,0 | 0,5225 | 0,5400 | 0,0022 | 0,0175 | 0,00018 | 0,0815 | 0,03695 |
| 11,0 | 0,5225 | 0,5500 | 0,0032 | 0,0275 | 0,00028 | 0,0881 | 0,02384 |
| 11,5 | 0,5320 | 0,5400 | 0,002 | 0,0080 | 0,00008 | 0,0410 | 0,11801 |
| 12,0 | 0,5130 | 0,5100 | 0,0023 | -0,0030 | -0,00003 | -0,0134 | 0,22674 |
| 12,5 | 0,5225 | 0,5400 | 0,0019 | 0,0175 | 0,00018 | 0,0944 | 0,01120 |
| 13,0 | 0,5130 | 0,5200 | 0,0022 | 0,0070 | 0,00007 | 0,0326 | 0,13478 |
| 13,5 | 0,5130 | 0,5700 | 0,0023 | 0,0570 | 0,00058 | 0,2540 | -0,30800 |
| 14,0 | 0,5605 | 0,5500 | 0,0023 | -0,0105 | -0,00011 | -0,0468 | 0,29358 |
| 14,5 | 0,6080 | 0,6500 | 0,0024 | 0,0420 | 0,00043 | 0,1794 | -0,15872 |
| 15,0 | 0,6080 | 0,6900 | 0,0027 | 0,0820 | 0,00084 | 0,3113 | -0,42254 |
| 15,5 | 0,5320 | 0,5400 | 0,002 | 0,0080 | 0,00008 | 0,0410 | 0,11801 |
| 16,0 | 0,5605 | 0,6000 | 0,0018 | 0,0395 | 0,00040 | 0,2249 | -0,24982 |
| 16,5 | 0,5700 | 0,6000 | 0,0021 | 0,0300 | 0,00031 | 0,1464 | -0,09283 |
| 17,0 | 0,5795 | 0,6400 | 0,0021 | 0,0605 | 0,00062 | 0,2953 | -0,39054 |
*pp: precipitado.
FONTE: Próprio Autor.
Para determinar a massa do papel foi necessário (mpapel), após a pesagem descontar 5% da massa inicial, devido à umidade do papel. A massa de precipitado formado (mpp) foi calculado para todas as medidas da mesma maneira, conforme segue abaixo:
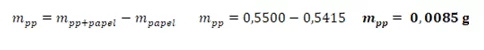 Para calcular a quantidade de mols de precipitado (n) dividiu-se a massa de precipitado formado (mpp), pela massa molar do Cu(OH)2 (mmolar).
Para calcular a quantidade de mols de precipitado (n) dividiu-se a massa de precipitado formado (mpp), pela massa molar do Cu(OH)2 (mmolar).
Sendo que, para determinar a concentração do precipitado (c) dividiu-se pelo volume coletado (V), conforme abaixo:
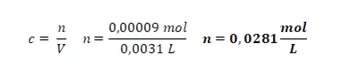 Em seguida foi necessário determinar a quantidade de reagente limitante que não reagiu. Este cálculo foi feito em relação à estequiometria da reação. Como as concentrações iniciais de sulfato de cobre e hidróxido de sódio estavam na mesma proporção estequiométrica, não existia reagente limitante, por isso optou-se por utilizar o reagente hidróxido de sódio nos cálculos:
Em seguida foi necessário determinar a quantidade de reagente limitante que não reagiu. Este cálculo foi feito em relação à estequiometria da reação. Como as concentrações iniciais de sulfato de cobre e hidróxido de sódio estavam na mesma proporção estequiométrica, não existia reagente limitante, por isso optou-se por utilizar o reagente hidróxido de sódio nos cálculos: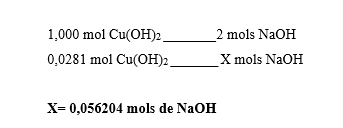
O valor determinado foi a quantidade de reagente que reagiu, ou seja, formou produto. Como o objetivo era descobrir a concentração de reagente limitante que não reagiu (CA), então foi necessário realizar a diferença entre a concentração inicial de hidróxido de sódio (Cinicial) e a concentração final (Cfinal):
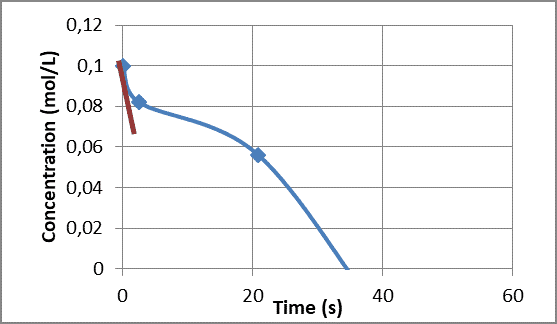
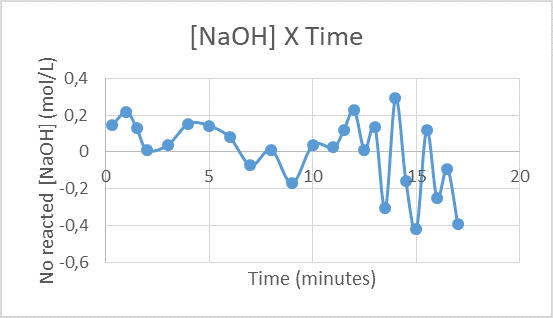
Após efetuar todos os cálculos para obtenção da concentração do reagente NaOH que não reagiu, foi plotado o seu respectivo gráfico em função do tempo, para determinar a conversão experimental, conforme Figura 10. Para determinar esta conversão é necessário utilizar como referência, o último ponto do gráfico, que representa a concentração final (CA) e substituir na Equação 10, a seguir.
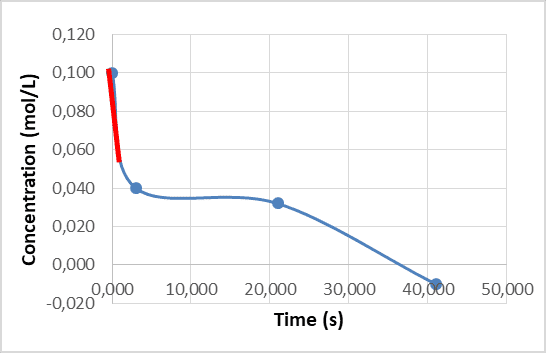
Figura 10 – Concentração não reagida do NAOH, ao longo do tempo.
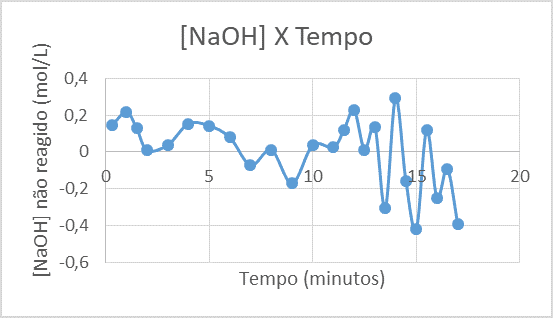
Como observado no gráfico 10 o último ponto foi negativo, ou seja, não é possível calcular sua conversão com este dado. Ao analisar o gráfico de forma mais criteriosa nota-se que a partir do tempo de 6 minutos o gráfico passa a ter um comportamento completamente desregular com picos de concentrações de NaOH negativos e positivos. O gráfico assumiu este perfil, pois exatamente aos 6 minutos de reação ligou-se o reciclo do reator.
Quando o reciclo foi acionado, este fez com que o sistema saísse do seu estado de permanência e assumisse características desregulares uma vez que, além dos reagentes, o produto também estava retornando ao reator, pois não houve um processo de separação entre reagente e produto. Provavelmente se existisse um sistema de filtração, o gráfico não iria atingir este comportamento desregular. Em consequência disso para calcular a conversão foi necessário utilizar o último ponto antes de ligar o reciclo, no caso, a concentração de 0,07829 mol/L:
A conversão do reagente no protótipo do reator CSTR foi de 61%. Na teoria os reatores CSTR não possuem uma alta conversão, desta forma a conversão obtida pode ser considerada como satisfatória. Porém se o reciclo tivesse sido considerado na realização dos cálculos, a conversão experimental teria sido maior, uma vez que o objetivo do reciclo era aumentar a sua conversão.
A Equação 12 foi utilizada para determinara a conversão teórica sendo que, se fez necessário utilizar a ferramenta Solver do Microsoft Excel versão 2010:
Para as concentrações de 0,1 e 0,2 dos respectivos reagentes; sulfato de cobre e hidróxido de sódio a conversão teórica obtida foi de 69%.
3.4 CÁLCULO DA CONSTANTE DE EQUILÍBRIO (K)
Foram pesquisados os dados de H e G e realizada a somatória de cada um, como mostra a Tabela 3 e converteram-se os valores para unidade J/mol conforme a Equação 12.
Tabela 3 – Entalpia e energia livre de Gibbs.
| Composto | ∆H (kcal/mol) | ∆G (kcal/mol) |
| CuSO4 | -200,780 | -160,190 |
| NaOH | -112,19 | -100,180 |
| Na2 SO4 | -330,820 | -301,280 |
| Cu(OH)2 | -108,900 | -85,500 |
| ∑ | -14,56 | -26,23 |
Com foi negativo conclui-se que a reação é exotérmica, assim se a temperatura aumentar a constante de equilíbrio diminuirá, portanto a formação do hidróxido de cobre será favorecida em temperaturas mais baixas.
Para verificar esta afirmação variou-se a temperatura para observar o comportamento da reação. Através da Equação 5 foi calculado K0, com o valor da constante dos gases de 8,314 J (mol K)-1:
Através da Equação 7 calculou-se K paras as outras temperaturas demonstradas na Tabela 4:
Tabela 4 – Valores de K e suas respectivas temperaturas.
| T (K) | K |
| 273 | 1,64194E+20 |
| 278 | 1,01324E+20 |
| 283 | 6,3602E+19 |
| 288 | 4,05745E+19 |
| 294 | 2,41411E+19 |
| 298 | 1,72771E+19 |
| 303 | 1,15149E+19 |
| 400 | 3,26926E+16 |
FONTE: Próprio Autor.
Com os dados apresentados na Tabela 3 foi construído o gráfico de K x T (Figura 11):
Figura 11 – K x T.
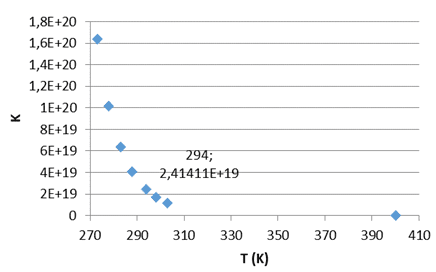
Ao observar a Figura 11, constatou-se que realmente a formação de hidróxido de cobre será favorecida em temperaturas menores, devido ao fato de que quanto menor a temperatura maior o K, ou seja, quanto menor a temperatura, mais o equilíbrio da reação se deslocará para direita, e consequentemente irá aumentar a concentração dos produtos.
Assim conclui-se que a temperatura de 294 K, na qual se realizou a reação, foi adequada para a reação de estudo.
4. CONCLUSÃO
O reator CSTR com reciclo foi construído com finalidade de desenvolver e realizar cálculos para medição de sua eficiência e análise da idealidade. A distribuição do tempo de residência (DTR) foi medida para demonstrar o funcionamento do reator, verificou-se que o tempo espacial foi menor que o tempo médio, os possíveis erros nas vazões fizeram com que os reagentes formassem zonas de escoamento preferenciais, ou seja, as moléculas não ficaram tempo suficiente no reator. A partir disso, foi possível concluir que o reator apresentou um comportamento distante da idealidade devido ao material utilizado não ser o adequado, o tipo de agitador e as vazões que foram difíceis de controlar para manter o volume constante.
O estudo da cinética e velocidade da reação foi calculado para obter a conversão da reação experimental, bem como a conversão teórica do reagente. Foi satisfatória, mesmo sem considerar o reciclo, por se tratar de um protótipo construído com materiais de baixos custos e erros experimentais cometidos durante o processo como um todo. E por último, a constante de equilíbrio K foi calculada, a fim de se verificar a temperatura de reação, quanto menor for, haverá o aumento das concentrações dos produtos.
Concluiu-se que mesmo com a existência de erros na construção do protótipo e na execução dos experimentos, o reator foi eficiente para realização da reação, junto com o reciclo. Possíveis mudanças e correções são necessárias para melhores resultados, mas como estudo e desenvolvimento de um reator CSTR foi adequado.
5. REFERÊNCIAS
BACON, G. E.; Titterton, D. H. Neutron-diffraction studies of CuSO4 · 5H2O and CuSO4 · 5D2O. Z. Kristallogr., v. 141, n. 5–6, p.330–341, 1975. Disponível em: <http://www.aquaquimica.com.br/produtos/sulfato_cobre.pdf>. Acesso 08 de abril de 2018.
FELIPPE, M. Introdução aos reatores. Disponível em: Sala virtual – Universidade São Francisco, Reatores Químicos. Acesso em: 09 de abril de 2018.
FELIPPE, M. Reatores específicos. Disponível em: Sala virtual– Universidade São Francisco, Reatores Químicos. Acesso em: 09 de abril de 2018.
FOGLER, H. Scott. Cálculo de Reatores – O Essencial da Engenharia das Reações Químicas. LTC, 05/2014. Disponível em: Minha Biblioteca. Acesso em: 08 de abril de 2018.
LIMA, O. A.; FILHO, L. S. L.; SILVA, A. L.; MOURA, A. J. Distribuição de tempos de residência da polpa em células mecânicas de flotação. R. Esc. Minas. Ouro Preto, jul.-set. 2005. Disponível em: <http://www.scielo.br/pdf/rem/v58n3/v58n3a06.pdf>.Acesso em: 13 de maio de 2018.
LOPES, A. R. C. Reações Químicas, fenômeno, transformação e representação. Disponível em: < encurtador.com.br/vGH27>. Acesso em: 07 de abril de 2018.
LUCCA, E. A. Modelagem e simulação de reatores industriais em fase líquida do tipo Loop para polimerização de propileno. Disponível em: <repositorio.unicamp.br/jspui/ bitstream/REPOSIP/…/Lucca_EneidaAparecidade_M.pdf>. Acesso 07 de abril de 2018.
NASCIMENTO, S. M. Caracterização do sistema reativo de síntese do MTBE para aplicação em destilação reativa. Disponível em: < http://www.cobeqic2009.feq.ufu.br /uploads/media/93220781.pdf>. Acesso em: 10/04/2018.
RODRIGUES, A. F. Como elaborar referência bibliográfica. 7. ed. São Paulo: Humanitas, 2008. 99 p.
SMITH, J. M.; VAN NESS, H. C.; ABBOTT, M. M. Introdução à Termodinâmica da Engenharia Química. Rio de Janeiro. LTC, 2013. 7ºed. 13c.
ANEXO
Figuras Em Inglês
Figura 4.
Figura 6.
Figura 7.
Figura 8.
Figura 9.
Figura 10.
[1] Estudante de Engenharia Química pela Universidade São Francisco.
[2] Estudante de Engenharia Química da Universidade São Francisco.
[3] Engenheira Química pela Universidade São Francisco.
[4] Aluna de Engenharia Química da Universidade São Francisco.
[5] Graduada em Engenharia Química pela Universidade São Francisco.
[6] Professora na Universidade São Francisco (USF), Pós Doutorado em Ciências Atmosféricas pelo IAG/USP, Doutora em Materiais pelo IPEN/USP, Mestre em Materiais pelo IPEN/USP, Engenheira Química pela UFSCAR.
Enviado: Setembro, 2019.
Aprovado: Outubro, 2019.