ARTÍCULO ORIGINAL
CASALOTI, Laís Guadalupe [1], SANTOS, Jorge Alexandre Nogueira [2]
CASALOTI, Laís Guadalupe. SANTOS, Jorge Alexandre Nogueira. Inhibición de la elastasa por extracto foliar acuoso y etanólico de Sedum Dendroideum: Un estudio in vitro. Revista Científica Multidisciplinar Núcleo do Conhecimento. año 04, Ed. 07, Vol. 04, págs. 140-147. Julio de 2019. ISSN: 2448-0959
RESUMEN
La actividad no regulada de las proteasas en los seres humanos está relacionada con una serie de enfermedades. La neutrófila elastasa es una proteasa controlada por el inhibidor de la antitripsina n.o 1 (AAT) que es producida naturalmente por el hígado. Las mutaciones en el gen SERPINA 1 causan deficiencia de este inhibidor y la consecuencia de esto es la aparición de varias patologías en humanos. Dado que las especies vegetales son fuentes prometedoras para el descubrimiento de nuevos fármacos, el presente estudio tenía como objetivo evaluar el efecto inhibitorio de los extractos sobre elastasa, donde se encontraron valores IC50 de 8.1 a 1.4 µg/ml (extracto acuoso) y 3.3 ± 0.6. µg/ml (extracto etanólico). Estos resultados sugieren que los extractos de Sedum dendroideum pueden ser una fuente potencial de compuestos bioactivos para el descubrimiento de nuevos inhibidores para la elastasa.
Palabras clave: Bálsamo, IC50, inhibidores.
INTRODUCCIÓN
Las proteasas son enzimas esenciales para un gran número de procesos fisiológicos como la digestión de proteínas, la reproducción, la coagulación de la sangre, el sistema Kallikrein-Kinin y la fibrinólisis (Otín & Bonde, 2008). En los seres humanos, la actividad no regulada de las proteasas está relacionada con diversas condiciones patológicas como cáncer, procesos inflamatorios, trombosis, artritis, enfermedades de la piel y enfisema pulmonar. Por esta razón, la actividad proteases debe ser controlada y regulada (Rawlings et al., 2004). Investigaciones recientes han revelado que las proteasas se han convertido en objetivos importantes para el desarrollo de fármacos. La elastasa es una proteasa producida principalmente por el páncreas y los neutrófilos, y tiene la propiedad de componentes hidrolizantes de la matriz extracelular, como colágeno, elastina, Laminin y Proteoglilianos (Thomson & Kapadia, 1979). La actividad proteolítica de la elastasa neutrófila está estrictamente regulada por el inhibidor de la proteína endógena llamado -1-antitripsina (AAT). Las mutaciones en el gen SERPINA 1, Locus Pi, ubicado en el cromosoma 14 (14q31-32) causan deficiencia de AAT (Siedle, et al., 2003). Sin la presencia de su inhibidor natural, la elastasa en abundancia genera lesiones tisulares, ya que esta enzima es la principal proteasa liberada por los neutrófilos en procesos inflamatorios.
La acción de la elastasa está relacionada con una serie de enfermedades como insuficiencia hepática, artritis reumatoide, psoriasis, cáncer de piel, arteriosclerosis y varias patologías pulmonares (Johansson, 2002). En un pulmón normal, los alvéolos están expuestos a niveles bajos de elastasa de neutrófilos. Esta proteasa puede destruir la elastina en la pared alveolar si no está contenida por la acción del inhibidor de la antitripsina -1. Después de la lesión, el tejido pulmonar no puede regenerarse y se puede desencadenar un proceso de enfisema, asma, lesión pulmonar aguda o fibrosis quística (Abboud & Vimalanathan, 2008).
La prospección de compuestos bioactivos de productos naturales encuentra en las especies vegetales la principal y más prometedora fuente de nuevos compuestos que pueden actuar como inhibidores de la proteasa. Para protegerse contra animales e insectos herbívoros, las plantas suelen producir metabolitos secundarios que incluyen terpenos, polifenoles, taninos, péptidos y proteínas (Ibanez et al., 2012). Muchos de estos metabolitos son inhibidores de las proteasas y causan una disminución en el proceso de absorción de aminoácidos esenciales para el desarrollo de insectos (Cuccilioni et al., 2009).
La especie Sedum Dendroideum, conocida popularmente como Balsam es una planta perteneciente al orden Saxifrales, Moc. Et Sessé ex DC, familia Crasulaceae es una especie perenne, suculenta, sublenhosa y xerófito, originaria de Sudáfrica, del clima tropical seco (Epagri, 1998). En Brasil, es ampliamente adaptado y se llama popularmente Balsam (Milaneze & Gonalves, 2001). El jugo de sus hojas se ha utilizado para el tratamiento de la inflamación cutánea y hematomas, e internamente para alteraciones gástricas, debido a actividades emolientes y curativas (Epagri, 1998; Milaneze & Gonalvez, 2001).
Los estudios indican que el género Sedum presenta compuestos de diferentes grupos químicos como polisacáridos (Sendl et al.,1993), taninos (Stevens et al., 1995), Triterpenoides con actividad hepatoprotectora (Aimin, et al.,1998), alcaloides piperidinic (Halin et al., 1985) y Pyrrolidyic (Harth et al., 1996). Y a través de un análisis fitoquímico con la especie Sedum dendroideum fue posible identificar la presencia de Kaempferol, una molécula importante con propiedades farmacológicas (Coutinho, Muzitano & Costa, 2009). Teniendo en cuenta la existencia de metabolitos secundarios encontrados en la especie, y en vista de su uso potencial como planta medicinal, el presente estudio tenía como objetivo verificar si los extractos acuosos y etanólicos de la planta tienen potencial para Inhibición de la actividad proteolítica de la enzima elastasa.
MATERIALES Y MÉTODOS
Los extractos fueron preparados a partir de las hojas de Sedum Dendroideum siguiendo la metodología de Heidari-Sureshjani (2015), en la que se recogieron hojas frescas y saludables de la verdura en el barrio Furnas (latitud 22° 26′ 27″ y longitud 46° 21′ 03″), ubicadas en Municipio de Bueno Brando.
Alrededor de 10 g de las hojas de la planta se secaron durante 72 horas en un invernadero a 40°C y posteriormente se molieron hasta obtener un polvo de aspecto uniforme. A continuación, el material obtenido se transfirió a un vial de vidrio y se mezcló con 50 ml de agua destilada, permaneciendo en reposo durante 12 horas. Después de este procedimiento, la mezcla se filtró en el papel De Whatman n° 1 y se obtuvo un líquido transparente y libre de partículas. El mismo procedimiento se utilizó para la preparación de extracto etanólico, sin embargo, en el lugar de agua destilada se utilizó etanol 95%.
Para los ensayos de inhibición, se utilizaron la enzima elastasa del páncreas de cerdo (E.C 3.4.21.36, ≥4 U/mg) y su sustrato cromogénico N-succinyl-AlaAla-Ala-P-nitroanilida (Thomson & Kapadia, 1979) que se adquirieron de la empresa Sigma Aldrich. La enzima (a la concentración final de 10 μg/ml) se incubaen en tampón de fosfato sódico (50 mM, pH= 8) con los extractos vegetales a diferentes concentraciones (rango de 1 a 20 μg/ml para extracto acuoso y variación de 1 a 8 μg/ml para extracto etanólico) a 25º C para Un volumen final total de 990 oL. Después de 30 minutos, se añadieron 10 µL de sustrato para una concentración final de 10 m a la mezcla y la hidrólisis del sustrato cromogénico fue monitoreada durante 5 minutos utilizando un espectrofotómetro v-m5 Bel Fotónicoa a una longitud de onda de 410 nm. Como control negativo, se utilizaron tampón de fosfato 50 mM, pH 8 y como control positivo Epigalocatequina-3-galate.
Todos los experimentos se realizaron por triplicado y los datos se presentaron como media de desviación estándar. Los valores del parámetro de inhibición IC50, que es la concentración de extracto que inhibe el 50% de la actividad enzimática, fueron determinados por el porcentaje de inhibición restante frente a la concentración de extracto y calculados por regresión no lineal utilizando el Programa GraFit 5.0 (Leatherbarrow, 1992). El porcentaje de inhibición se calculó mediante la ecuación:
% de inhibición = |Control de Abs – Extracto de Abs| / Abs control x 100%
DISCUSIONES DE RESULTADOS
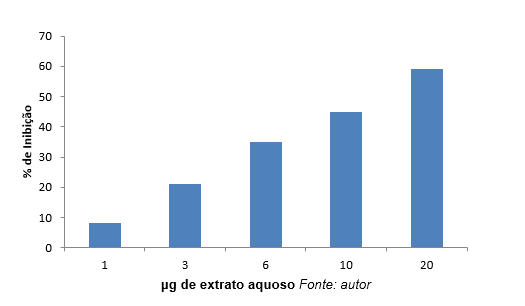
Los gráficos 1 y 2 muestran el porcentaje de inhibición debido a diferentes concentraciones de extractos acuosos y alcohólicos. Estos extractos inhibidos elastasa con diferentes intensidades. Como se muestra en el gráfico 1, se observó la inhibición más alta (59%) en la concentración de 20 μg/ml de extracto acuoso de la enzima.
Gráfico 1: porcentaje (%) Inhibición de la elastasa en función de diferentes concentraciones de extractos acuosos.
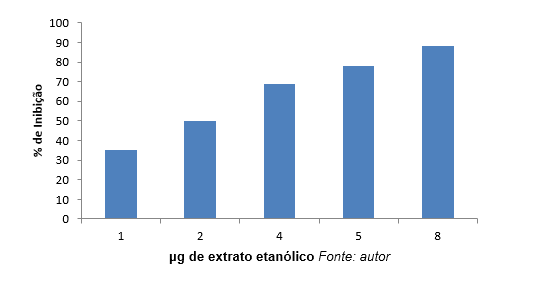
En el gráfico 2, podemos observar que la inhibición más alta (88%) La concentración fue de 8 μg/ml.
Gráfico 2: porcentaje (%) Inhibición de la elastasa en función de la concentración de extractos etanólicos.
A partir de los resultados generados por los gráficos 1 y 2, se calcularon los valores de IC50 (tabla 1) para los dos extractos, 8,1 a 1,4 μg/ml (extracto acuoso) y 3,31 a 0,6 μg/ml (extracto etanólico). Estos resultados indican que el extracto etanólico presentó mejor poder de inhibición sobre la elastasa que el extracto acuoso.
Tabla 1: Valores IC50 de extractos acuosos y etanólicos en elastasa. Valores expresados como media – desviación estándar.
| IC 50 (μg/ml) | |
| Elastasa | |
| Extracto acuoso | 8.1 ± 1.4 |
| Extracto etanólico | 3.3 ± 0.6 |
Fuente: Autor
Los extractos vegetales proporcionan oportunidades ilimitadas para descubrir nuevos inhibidores de enzimas, dado que producen una amplia variedad de metabolitos secundarios. Estos compuestos químicos son utilizados por las plantas para protegerse contra la acción de animales e insectos herbívoros y muchos de estos compuestos son inhibidores de varias clases de proteasas, incluyendo Elastasa (Sin & Kim, 2005; Middleton et al., 2000).
Como se describió anteriormente, la especie Sedum Dendroideum produce una amplia variedad de metabolitos secundarios y estos compuestos pueden estar involucrados en la inhibición de la elastasa.
Conclusiones
Los resultados del presente estudio indicaron que los extractos acuosos y etanólicos de Sedum Dendroideum tenían una actividad inhibitoria significativa en la actividad proteolítica de la elastasa. Se necesitan estudios más específicos para identificar y aislar compuestos bioactivos en los extractos de Sedum dendroideum.
REFERENCIAS BIBLIOGRÁFICAS
ABBOUD, R.T.; VIMALANATHAN S. Pathogenesis of COPD. Part I: The role of protease-antiprotease imbalance in emphysema. International Journal of Tuberculosis and Lung Diseases. v.12, n.4, p.361–367, 2008.
AIMIN, H.; MINGSHI, W.; HONGYAN, H.; DECHENG, Z.; LEE, K. H. Hepatoprotective triterpenes from Sedum sarmentosum. Phytochemistry, Oxford, v. 49, n. 8, p. 2607-10, 1998.
COUTINHO, M. A. S., MUZITANO, M. F., COSTA, S. S., 2009. Flavonóides: Potenciais agentes terapêuticos para o processo inflamatório. Revista Virtual de Química 1, 241-256.
CUCCIOLONI, M., MOZZICAFREDDO, M., ONFILI, L., CECARINI, V., ELEUTERI, A.M., ANGELETTI, M., (2009): Natural occurring polyphenols as template for drug design. Focus on serine proteases. Chem Biol Drug Des., 74: 1–15.
EPAGRI − Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina. S. A. CD Plantas Medicinais. Versão 1.0. Itajaí, 1998. 1 CD-ROM.
HALIN, F.; SLOSSE, P.; HOOTELÉ, C. Sedum alkaloides – VII – Structure and synthesis of (+)-4- hydroxysedamine and (+)-4-hydroxyallosedamine. Tetrahedron, Oxford, v. 41, n. 14, p. 2891-7, 1985.
HART, H. T.; STEVENS, J. F.; JEONG, H. K. Alkaloids of some Asian Sedum species. Phytochemistry, Oxford, v. 41, n. 5, p. 1319-24, 1996.
HEIDARI-SURESHJANI M.; YAZDI F. T.; MORTAZAVI, S.A.; BEHBAHANI, B.A.; SHAHID F. Antimicrobial effects of Kelussia odoratissima extracts against food borne and food spoilage bacteria “in vitro”. Journal of Paramedical Sciences, v. 5, n.2, 2015.
IBANEZ, S., GALLET, C., DESPRÉS, L., (2012): Plant Insecticidal Toxins in Ecological Networks. Toxins., 4: 228-243.
JOHANSSON, S. U., Neutrophil multitarget functional bioassay to detect anti-inflammatory natural products. J. Nat. Prod., v. 65, p. 32-41, 2002..
LEATHERBARROW, R.J. GraFit Version 5.0, Erithacus Software Ltd, Staines, U.K.,1992.
MIDDLETON, E., Kandaswami, C., Theoharides, T.C., (2000): The Effects of Plant Flavonoids on Mammalian Cells: Implications for Inflammation, Heart Disease andCancer. Pharmacol Rev., 52:673-751.
MILANEZE, M. A.; GONÇALVES, E. Caracterização morfo-anatômica das folhas de Sedum dendroideum DC, CRASSULACEAE In: Simpósio Brasileiro De Farmacognosia, 3., 2001, Curitiba. Anais. Curitiba: Universidade Federal do Paraná, Departamento de Farmácia, Laboratório de Farmacognosia, 2001. p. FB-23.
OTÍN, C. L; BOND, J. S. Proteases: Multifunctional Enzymes in Life and Disease. Journal of Biological chemistry, v.283, 30433-30437, 2008.
RAWLINGS, N.D.; MORTON, F.R. The MEROPS batch BLAST: A tool to detect peptidases and their non-peptidase homologues in a genome. Biochimie, v. 90, p. 243-259, 2008.
SENDL, A.; MULINACCI, N.; VINCIERI, F. F.; WAGNER, H. Anti-inflammatory and immunologically active polysaccharides of Sedum telephium. Phytochemistry, Oxford, v. 34, n. 5, p. 1357-62, 1993.
SIEDLE, L.G., GUSTAVSSON, L., JOHANSSON, S., MURILLO, R., BOHLIN, L., The effect of sesquiterpene lactonas on the release of human neutrophil elastase. Biochem. Pharmacol, v. 7559, p. 1-7, 2003.
SIN, B.Y., KIM, H.P., (2005): Inhibition of collagenase by naturally-occurring flavonoids. Archives of Pharmacal Research., 28(10): 1152-1155.
STEVENS, J. F.; HART, H. T.; VAN HAM, R. C. H. J.; ELEMA, E. T.; VAN EN ENT, M. M.V.X.; WILDEBOER, M.; ZWAVING, J. H. Distribution of alkaloids and tannins in the Crassulaceae. Biochem. Syst. Ecol., Oxford, v. 23, n. 2, p. 157-65, 1995.
STUART, L.M; EZEKOWITZ, R.A. Phagocytosis: elegant complexity. Immunity, v. 5, p. 539-550, 2005.
THOMSON, A., KAPADIA, S.K., The Specificity of the S1 and S2 Subsites of Elastase, Eur.J.Biochem, v.102, p. 311-116, 1979.
[1] Estudiante graduado en Ciencias Biológicas en IFSULDEMINAS-Campus Inconfidentes.
[2] Doctor en bioquímica por UNIFESP; Profesor Efectivo en IFSULDEMINAS-Campus Inconfidentes, e investigador adjunto al Laboratorio de Bioquímica del Centro de Procedimientos Ambientales.
Enviado: Mayo de 2019.
Aprobado: Julio de 2019.