ARTIGO ORIGINAL
CASALOTI, Laís Guadalupe [1], SANTOS, Jorge Alexandre Nogueira [2]
CASALOTI, Laís Guadalupe. SANTOS, Jorge Alexandre Nogueira. Inibição de elastase por extrato foliar aquoso e etanólico de Sedum Dendroideum: Um estudo in vitro. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 07, Vol. 04, pp. 140-147. Julho de 2019. ISSN: 2448-0959
RESUMO
A atividade desregulada de proteases em seres humanos está relacionada com uma série de doenças. A elastase de neutrófilos é uma protease controlada pelo inibidor α1-antitripsina (AAT) que é produzido naturalmente pelo fígado. Mutações no gene SERPINA 1 causam deficiência desse inibidor e a consequência disso é o aparecimento de diversas patologias em humanos. Dado que espécies vegetais são fontes promissoras para a descoberta de novos fármacos, o presente estudo teve como objetivo avaliar o efeito inibitório dos extratos sobre a elastase, onde foram encontrados valores de IC50 de 8.1 ± 1.4 µg/ml (extrato aquoso) e 3.3 ± 0.6 µg/ml (extrato etanólico). Estes resultados sugerem que os extratos de Sedum dendroideum podem ser uma fonte potencial de compostos bioativos para a descoberta de novos inibidores para a elastase.
Palavras chave: Bálsamo, IC50, inibidores.
INTRODUÇÃO
Proteases são enzimas fundamentais para um grande número de processos fisiológicos como a digestão proteica, reprodução, coagulação sanguínea, sistema Kallikrein-Kinin e fibrinólise (Otín & Bonde, 2008). Em humanos, a atividade desregulada de proteases está relacionada com diversas condições patológicas como câncer, processos inflamatórios, trombose, artrite, doenças de pele e enfisema pulmonar. Por essa razão a atividade de proteases precisa ser controlada e regulada (Rawlings et al., 2004). Pesquisas recentes têm revelado que proteases se tornaram alvos importantes para o desenvolvimento de fármacos. A elastase é uma protease produzida principalmente pelo pâncreas e neutrófilos, e possui a propriedade de hidrolisar componentes da matriz extracelular, como colágeno, elastina, laminina e proteoglicanos (Thomson & Kapadia, 1979). A atividade proteolítica da elastase neutrofílica é estritamente regulada pelo inibidor proteico endógeno denominado α-1-antitripsina (AAT). Mutações no gene SERPINA 1, lócus Pi, localizado no cromossomo 14 (14q31-32) causam deficiência da AAT (Siedle, et al., 2003). Sem a presença do seu inibidor natural, a elastase em abundância gera lesões teciduais, já que esta enzima é a principal protease liberada pelos neutrófilos em processos inflamatórios.
A ação da elastase está relacionada com uma série de doenças como falência hepática, artrite reumatoide, psoríase, câncer de pele, arteriosclerose e diversas patologias pulmonares (Johansson, 2002). Em um pulmão normal, os alvéolos são expostos a baixos níveis de elastase de neutrófilos. Essa protease pode destruir a elastina na parede alveolar se não for contida pela ação do inibidor α-1-antitripsina. Depois de lesionado, o tecido pulmonar não pode se regenerar e um processo de enfisema, asma, lesão pulmonar aguda ou fibrose cística podem ser desencadeados (Abboud & Vimalanathan, 2008).
A prospecção de compostos bioativos a partir de produtos naturais encontra nas espécies vegetais a principal e mais promissora fonte de novos compostos que possam agir como inibidores de proteases. Para se proteger contra animais e insetos herbívoros, as plantas geralmente produzem metabólitos secundários que incluem terpenos, polifenóis, taninos, peptídeos e proteínas (Ibanez et al., 2012). Muitos desses compostos metabólitos são de inibidores de proteases e provocam uma diminuição do processo de absorção dos aminoácidos essenciais para o desenvolvimento dos insetos (Cuccilioni et al., 2009).
A espécie Sedum dendroideum, popularmente conhecida como bálsamo é uma planta pertencente a ordem Saxifrales, Moc. et Sessé ex DC, família Crassulaceae é uma espécie perene, suculenta, sublenhosa e xerófita, originária da África do Sul, de clima tropical seco (Epagri,1998). No Brasil, está amplamente adaptada e é denominada popularmente de bálsamo (Milaneze & Gonçalves, 2001). O sumo de suas folhas tem sido utilizado para tratamento de inflamações cutâneas e contusões, e internamente para distúrbios gástricos, em razão das atividades emoliente e cicatrizante (Epagri, 1998; Milaneze & Gonçalvez, 2001).
Estudos apontam que o gênero Sedum apresenta compostos de distintos grupos químicos como polissacarídeos (Sendl et al.,1993), taninos (Stevens et al., 1995), triterpenóides com atividade hepatoprotetora (Aimin, et al.,1998), alcalóides piperidínicos (Halin et al., 1985) e pirrolidínicos (Harth et al., 1996). E através de uma análise fitoquímica com a espécie Sedum dendroideum foi possível identificar a presença de Kaempferol, uma importante molécula com propriedades farmacológicas (Coutinho, Muzitano & Costa, 2009). Levando em consideração a existência de metabólitos secundários encontrados na espécie, e tendo em vista o seu potencial uso como planta medicinal, o presente trabalho teve como objetivo verificar se os extratos aquosos e etanólicos da planta possuem potencial de inibição sobre a atividade proteolítica da enzima elastase.
MATERIAIS E MÉTODOS
Os extratos foram preparados a partir das folhas de Sedum dendroideum seguindo a metodologia de Heidari-Sureshjani (2015), em que folhas frescas e sadias do vegetal foram coletadas no bairro Furnas (latitude 22° 26′ 27″ e longitude 46° 21′ 03″), localizadas no município de Bueno Brandão.
Cerca de 10 g das folhas da planta foram secas por 72 horas em uma estufa a 40°C e, posteriormente, moídas até a obtenção de um pó de aspecto uniforme. Em seguida, o material obtido foi transferido para um frasco de vidro e misturado com 50 ml de água destilada, permanecendo em repouso por 12 horas. Após esse procedimento a mistura foi filtrada em papel Whatman n° 1 e um líquido transparente e livre de partículas foram obtidos. O mesmo procedimento foi utilizado para a preparação do extrato etanólico, entretanto no lugar de água destilada foi utilizado etanol 95%.
Para os ensaios de inibição foram utilizados a enzima elastase de pâncreas de porco (E.C 3.4.21.36, ≥4 U/mg) e seu substrato cromogênico N-Succinil-AlaAla-Ala-p-nitroanilida (Thomson & Kapadia, 1979) que foram adquiridos da empresa Sigma Aldrich. A enzima (na concentração final de 10 µg/ml) foi incubada em tampão fosfato de sódio (50 mM, pH= 8) com os extratos da planta em diferentes concentrações (variação de 1 para 20 µg/ml para o extrato aquoso e variação de 1 para 8 µg/ml para o extrato etanólico) à 25º C para um volume total final de 990 µl. Após 30 minutos, 10 µL de substrato para uma concentração final de 10 µM foi adicionado na mistura e a hidrólise do substrato cromogênico foi monitorada por 5 minutos utilizando-se um espectrofotômetro V-M5 Bel Photonics no comprimento de onda de 410 nm. Como controle negativo foi utilizado tampão fosfato 50 mM, pH 8, e como controle positivo epigalocatequina-3-galato.
Todos os experimentos foram realizados em triplicata e os dados foram apresentados como média ± desvio padrão. Os valores do parâmetro de inibição IC50, que é a concentração de extrato que inibe 50% da atividade enzimática, foram determinados pela porcentagem de inibição remanescente versus a concentração de extrato e calculados por regressão não linear utilizando o programa GraFit 5.0 (Leatherbarrow, 1992). A porcentagem de inibição foi calculada pela equação:
% inibição = |Abs controle – Abs extrato| / Abs controle x 100%
RESULTADOS DISCUSSÕES
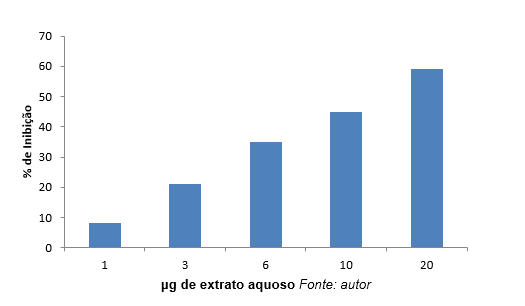
Os gráficos 1 e 2 apresentam a porcentagem de inibição em função de diferentes concentrações de extratos aquoso e alcoólicos. Esses extratos inibiram a elastase com diferentes intensidades. Conforme é mostrado no gráfico 1, na concentração de 20 μg/ml de extrato aquoso ocorreu a maior inibição (59%) da enzima.
Gráfico 1: Porcentagem (%) de inibição da elastase em função de diferentes concentrações de extratos aquosos.
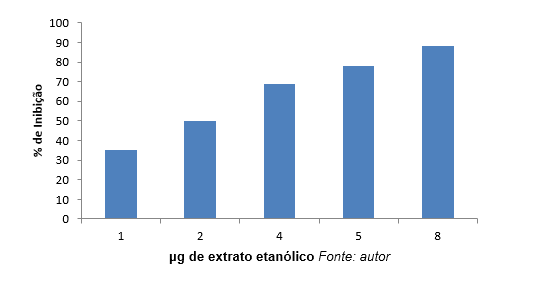
Já no gráfico 2 podemos observar que a maior inibição (88%) ocorreu na concentração 8 μg/ml.
Gráfico 2: Porcentagem (%) de inibição da elastase em função da concentração de extratos etanólicos.
Dos resultados gerados pelos gráficos 1 e 2 foram calculados os valores de IC50 (tabela 1) para os dois extratos, 8.1 ± 1.4 μg/ml (extrato aquoso) e 3.31 ± 0.6 μg/ml (extrato etanólico). Esses resultados indicam que o extrato etanólico apresentou melhor poder de inibição sobre a elastase que o extrato aquoso.
Tabela 1: Valores de IC50 do extrato aquoso e etanólico sobre a elastase. Valores expressos como média ± desvio padrão.
| IC 50(μg/ml) | |
| Elastase | |
| Extrato aquoso | 8.1 ± 1.4 |
| Extrato etanólico | 3.3 ± 0.6 |
Fonte: autor
Extratos vegetais fornecem oportunidades ilimitadas para descoberta de novos inibidores de enzimas, dado que produzem uma grande variedade de metabólitos secundários. Esses compostos químicos são utilizados pelas plantas para se protegerem contra a ação de animais e insetos herbívoros e muitos destes compostos são inibidores de diversas classes de proteases, incluindo a elastase (Sin & Kim, 2005; Middleton et al., 2000).
Como descrito anteriormente, a espécie Sedum dendroideum produz uma grande variedade de metabólitos secundários e esses compostos podem estar envolvidos na inibição da elastase.
CONCLUSÕES
Os resultados do presente estudo indicaram que os extratos aquosos e etanólicos de Sedum dendroideum tiveram uma atividade inibitória significativa sobre a atividade proteolítica da elastase. É necessário estudos mais específicos para identificar e isolar os compostos bioativos nos extratos da Sedum dendroideum.
REFERENCIAS BIBLIOGRÁFICAS
ABBOUD, R.T.; VIMALANATHAN S. Pathogenesis of COPD. Part I: The role of protease-antiprotease imbalance in emphysema. International Journal of Tuberculosis and Lung Diseases. v.12, n.4, p.361–367, 2008.
AIMIN, H.; MINGSHI, W.; HONGYAN, H.; DECHENG, Z.; LEE, K. H. Hepatoprotective triterpenes from Sedum sarmentosum. Phytochemistry, Oxford, v. 49, n. 8, p. 2607-10, 1998.
COUTINHO, M. A. S., MUZITANO, M. F., COSTA, S. S., 2009. Flavonóides: Potenciais agentes terapêuticos para o processo inflamatório. Revista Virtual de Química 1, 241-256.
CUCCIOLONI, M., MOZZICAFREDDO, M., ONFILI, L., CECARINI, V., ELEUTERI, A.M., ANGELETTI, M., (2009): Natural occurring polyphenols as template for drug design. Focus on serine proteases. Chem Biol Drug Des., 74: 1–15.
EPAGRI − Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina. S. A. CD Plantas Medicinais. Versão 1.0. Itajaí, 1998. 1 CD-ROM.
HALIN, F.; SLOSSE, P.; HOOTELÉ, C. Sedum alkaloides – VII – Structure and synthesis of (+)-4- hydroxysedamine and (+)-4-hydroxyallosedamine. Tetrahedron, Oxford, v. 41, n. 14, p. 2891-7, 1985.
HART, H. T.; STEVENS, J. F.; JEONG, H. K. Alkaloids of some Asian Sedum species. Phytochemistry, Oxford, v. 41, n. 5, p. 1319-24, 1996.
HEIDARI-SURESHJANI M.; YAZDI F. T.; MORTAZAVI, S.A.; BEHBAHANI, B.A.; SHAHID F. Antimicrobial effects of Kelussia odoratissima extracts against food borne and food spoilage bacteria “in vitro”. Journal of Paramedical Sciences, v. 5, n.2, 2015.
IBANEZ, S., GALLET, C., DESPRÉS, L., (2012): Plant Insecticidal Toxins in Ecological Networks. Toxins., 4: 228-243.
JOHANSSON, S. U., Neutrophil multitarget functional bioassay to detect anti-inflammatory natural products. J. Nat. Prod., v. 65, p. 32-41, 2002..
LEATHERBARROW, R.J. GraFit Version 5.0, Erithacus Software Ltd, Staines, U.K.,1992.
MIDDLETON, E., Kandaswami, C., Theoharides, T.C., (2000): The Effects of Plant Flavonoids on Mammalian Cells: Implications for Inflammation, Heart Disease andCancer. Pharmacol Rev., 52:673-751.
MILANEZE, M. A.; GONÇALVES, E. Caracterização morfo-anatômica das folhas de Sedum dendroideum DC, CRASSULACEAE In: Simpósio Brasileiro De Farmacognosia, 3., 2001, Curitiba. Anais. Curitiba: Universidade Federal do Paraná, Departamento de Farmácia, Laboratório de Farmacognosia, 2001. p. FB-23.
OTÍN, C. L; BOND, J. S. Proteases: Multifunctional Enzymes in Life and Disease. Journal of Biological chemistry, v.283, 30433-30437, 2008.
RAWLINGS, N.D.; MORTON, F.R. The MEROPS batch BLAST: A tool to detect peptidases and their non-peptidase homologues in a genome. Biochimie, v.90, p.243-259, 2008.
SENDL, A.; MULINACCI, N.; VINCIERI, F. F.; WAGNER, H. Anti-inflammatory and immunologically active polysaccharides of Sedum telephium. Phytochemistry, Oxford, v. 34, n. 5, p. 1357-62, 1993.
SIEDLE, L.G., GUSTAVSSON, L., JOHANSSON, S., MURILLO, R., BOHLIN, L., The effect of sesquiterpene lactonas on the release of human neutrophil elastase. Biochem. Pharmacol, v. 7559, p. 1-7, 2003.
SIN, B.Y., KIM, H.P., (2005): Inhibition of collagenase by naturally-occurring flavonoids. Archives of Pharmacal Research., 28(10): 1152-1155.
STEVENS, J. F.; HART, H. T.; VAN HAM, R. C. H. J.; ELEMA, E. T.; VAN EN ENT, M. M.V.X.; WILDEBOER, M.; ZWAVING, J. H. Distribution of alkaloids and tannins in the Crassulaceae. Biochem. Syst. Ecol., Oxford, v. 23, n. 2, p. 157-65, 1995.
STUART, L.M; EZEKOWITZ, R.A. Phagocytosis: elegant complexity. Immunity, v. 5, p. 539-550, 2005.
THOMSON, A., KAPADIA, S.K., The Specificity of the S1 and S2 Subsites of Elastase, Eur.J.Biochem, v.102, p. 311-116, 1979.
[1] Estudante de Licenciatura em Ciências Biológicas do IFSULDEMINAS- Campus Inconfidentes.
[2] Doutor em Bioquímica pela UNIFESP; Professor efetivo no IFSULDEMINAS- Campus Inconfidentes, e pesquisador adjunto ao laboratório de Bioquímica do Centro de Procedimentos Ambientais.
Enviado: Maio, 2019.
Aprovado: Julho, 2019.