ARTICLE ORIGINAL
CASALOTI, Laís Guadalupe [1], SANTOS, Jorge Alexandre Nogueira [2]
CASALOTI, Laís Guadalupe. SANTOS, Jorge Alexandre Nogueira. Inhibition de l’élastase par extrait foliar aqueux et éthanolique de Sedum Dendroideum: Une étude in vitro. Revista Científica Multidisciplinar Núcleo do Conhecimento. 04 année, Ed. 07, vol. 04, p. 140-147. juillet 2019. ISSN: 2448-0959
RÉSUMÉ
L’activité non réglementée des protéases chez l’homme est liée à un certain nombre de maladies. Neutrophil Elastase est une protéase contrôlée par l’inhibiteur de l’antitrypsine 1 (AAT) qui est produite naturellement par le foie. Les mutations dans le gène SERPINA 1 causent l’insuffisance de cet inhibiteur et la conséquence de ceci est l’émergence de plusieurs pathologies chez l’homme. Étant donné que les espèces végétales sont des sources prometteuses pour la découverte de nouveaux médicaments, la présente étude visait à évaluer l’effet inhibiteur des extraits sur l’élastase, où des valeurs IC50 de 8.1 ± 1.4 µg/ml (extrait aqueux) et de 3.3 ± 0.6 µg/ml (extrait d’éthanol). Ces résultats suggèrent que les extraits de Sedum dendroideum puissent être une source potentielle de composés bioactifs pour la découverte de nouveaux inhibiteurs pour l’élastase.
Mots-clés: baume, IC50, inhibiteurs.
INTRODUCTION
Les protéases sont des enzymes essentielles pour un grand nombre de processus physiologiques tels que la digestion des protéines, la reproduction, la coagulation sanguine, le système Kallikrein-Kinin et la fibrinolyse (Oton et Bonde, 2008). Chez l’homme, l’activité non réglementée des protéases est liée à diverses conditions pathologiques telles que le cancer, les processus inflammatoires, la thrombose, l’arthrite, les maladies de la peau et l’emphysème pulmonaire. Pour cette raison, l’activité des protéases doit être contrôlée et réglementée (Rawlings et coll., 2004). Des recherches récentes ont révélé que les protéases sont devenues des cibles importantes pour le développement de médicaments. Elastase est une protéase produite principalement par le pancréas et les neutrophiles, et elle a la propriété des composants hydrolysants de la matrice extracellulaire, tels que le collagène, l’élastine, la lamininin et les protéoglyliens (Thomson et Kapadia, 1979). L’activité protéolytique de l’élastase neutrophique est strictement réglementée par l’inhibiteur des protéines endogènes appelé ‘-1-antitrypsine (AAT). Les mutations dans le gène SERPINA 1, Locus Pi, situé sur le chromosome 14 (14q31-32) causent l’insuffisance d’AAT (Siedle, et autres, 2003). Sans la présence de son inhibiteur naturel, l’élastase en abondance génère des lésions tissulaires, puisque cette enzyme est la principale protéase libérée par les neutrophiles dans les processus inflammatoires.
L’action d’Elastase est liée à une série de maladies telles que l’échec de foie, la polyarthrite rhumatoïde, le psoriasis, le cancer de peau, l’artériosclérose et plusieurs pathologies pulmonaires (Johansson, 2002). Dans un poumon normal, les alvéoles sont exposées à de faibles niveaux d’élastase de neutrophile. Cette protéase peut détruire l’élastine dans la paroi alvéolifère si elle n’est pas contenue par l’action de l’inhibiteur de l’antitrypsine.1. Après une blessure, le tissu pulmonaire ne peut pas se régénérer et un processus d’emphysème, d’asthme, de lésions pulmonaires aigues ou de fibrose kystique peut être déclenché (Abboud et Vimalanathan, 2008).
La prospection de composés bioactifs à partir de produits naturels trouve chez les espèces végétales la principale et la plus prometteuse source de nouveaux composés qui peuvent agir comme inhibiteurs de la protéase. Pour se protéger contre les animaux et les insectes herbivores, les plantes produisent habituellement des métabolites secondaires qui incluent des terpènes, des polyphénols, des tanins, des peptides et des protéines (Ibanez et autres, 2012). Beaucoup de ces métabolites sont des inhibiteurs des protéases et causent une diminution du processus d’absorption des acides aminés essentiels pour le développement des insectes (Cuccilioni et autres, 2009).
L’espèce Sedum Dendroideum, populairement connue sous le nom de Balsam est une plante appartenant à l’ordre Saxifrales, Moc. Et Sessé ex DC, la famille Crasulaceae est une espèce vivace, succulente, sublenhosa et xérophyte, originaire d’Afrique du Sud, du climat tropical sec (Epagri, 1998). Au Brésil, il est largement adapté et est populairement appelé Balsam (Milaneze gonçalves, 2001). Le jus de ses feuilles a été employé pour le traitement de l’inflammation et des ecchymoses cutanées, et intérieurement pour des perturbations gastriques, dues aux activités émolliente sémollientes et curatives (Epagri, 1998 ; Milaneze et Gonçalvez, 2001).
Des études indiquent que le genre Sedum présente des composés de différents groupes chimiques tels que les polysaccharides (Sendl et coll.,1993), les tanins (Stevens et al., 1995), les tritépénoïdes à l’activité hépatoprotectrice (Aimin, et al.,1998), les alcaloïdes piperidiniques (Halin et coll., 1985) et Pyrrolidyic (Harth et coll., 1996). Et grâce à une analyse phytochimique avec l’espèce Sedum dendroideum, il a été possible d’identifier la présence de Kaempferol, une molécule importante aux propriétés pharmacologiques (Coutinho, Muzitano et Costa, 2009). Compte tenu de l’existence de métabolites secondaires présents dans l’espèce, et compte tenu de son utilisation potentielle comme plante médicinale, la présente étude visait à vérifier si les extraits aqueux et éthanoliques de la plante ont un potentiel pour Inhibition sur l’activité protéolytique de l’enzyme d’élastase.
MATÉRIAUX ET MÉTHODES
Les extraits ont été préparés à partir des feuilles de Sedum Dendroideum selon la méthodologie de Heidari-Sureshjani (2015), dans lequel des feuilles fraîches et saines du légume ont été récoltées dans le quartier Furnas (latitude 22° 26′ 27″ et longitude 46° 21′ 03″), situé dans Municipalité de Bueno Brando.
Environ 10 g des feuilles de la plante ont été séchées pendant 72 heures dans une serre à 40°C et broyées par la suite jusqu’à ce qu’elles obtiennent une poudre uniforme. Ensuite, le matériau obtenu a été transféré dans une fiole de verre et mélangé à 50 ml d’eau distillée, restant au repos pendant 12 heures. Après cette procédure, le mélange a été filtré sur le papier Whatman no 1 et un liquide clair et sans particules a été obtenu. La même procédure a été utilisée pour la préparation de l’extrait d’éthanol, mais à la place de l’eau distillée a été utilisé éthanol 95%.
Pour les essais d’inhibition, l’élastase enzymatique du pancréas de porc (E.C 3.4.21.36, ≥4 U/mg) et son substrat chromogénique N-succinyl-AlaAla-Ala-P-nitroanilide (Thomson et Kapadia, 1979) qui ont été acquis de la société Sigma Aldrich ont été utilisés. L’enzyme (à la concentration finale de 10 g/ml) a été incubée dans un tampon de phosphate de sodium (50 mm, pH et 8) avec les extraits végétaux à différentes concentrations (allant de 1 à 20 g/ml pour l’extrait aqueux et variation de 1 à 8 µg/ml pour l’extrait d’éthanol) à 25º C pour l’extrait d’éthanol) Un volume final total de 990 µl. Après 30 minutes, 10 µg/ml de substrat pour une concentration finale de 10 µg/ml ont été ajoutés au mélange et l’hydrolyse du substrat chromogénique a été surveillée pendant 5 minutes à l’aide d’un spectrophotomètre V-M5 Bel Photonics à une longueur d’onde de 410 nm. Comme contrôle négatif, tampon de phosphate 50 mM, pH 8, et comme contrôle positif Epigalocatequina-3-galate ont été utilisés.
Toutes les expériences ont été réalisées en triple et les données ont été présentées comme une déviation moyenne et standard. Les valeurs du paramètre d’inhibition IC50, qui est la concentration d’extrait qui inhibe 50% de l’activité enzymatique, ont été déterminées par le pourcentage d’inhibition restante par rapport à la concentration d’extrait et calculées par régression non linéaire utilisant le GraFit 5.0 Program (Leatherbarrow, 1992). Le pourcentage d’inhibition a été calculé par l’équation :
% d’inhibition = |ABS Control – Extrait d’Abs| /Abs contrôle x 100%
DISCUSSIONS SUR LES RÉSULTATS
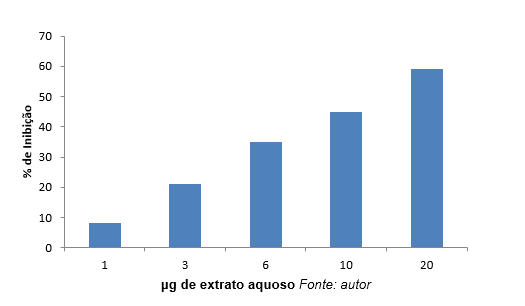
Les graphiques 1 et 2 montrent le pourcentage d’inhibition dû à différentes concentrations d’extraits aqueux et alcooliques. Ces extraits ont inhibé l’élastase avec différentes intensités. Comme le montre le graphique 1, l’inhibition la plus élevée (59 %) a été observée dans la concentration de 20 µg/ml d’extrait aqueuse de l’enzyme.
Graphique 1: pourcentage (%) Inhibition de l’élastase en fonction de différentes concentrations d’extraits aqueux.
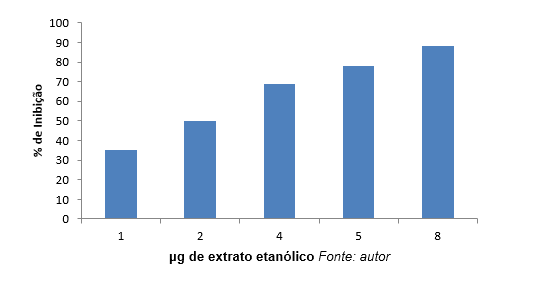
Dans le graphique 2, nous pouvons observer que l’inhibition la plus élevée (88%) La concentration était de 8 µg/ml.
Graphique 2: pourcentage (%) Inhibition de l’élastase en fonction de la concentration d’extraits d’éthanol.
À partir des résultats générés par les graphiques 1 et 2, les valeurs de l’IC50 (tableau 1) ont été calculées pour les deux extraits, 8,1 à 1,4 µg/ml (extrait aqueux) et 3.31 ± 0.6 μg/ml (extrait d’éthanol). Ces résultats indiquent que l’extrait éthanolique a présenté un meilleur pouvoir d’inhibition au-dessus de l’élastase que l’extrait aqueux.
Tableau 1: Valeurs IC50 d’extraits aqueux et éthanolifs sur l’élastase. Valeurs exprimées comme moyen ± déviation standard.
| IC 50 (µg/ml) | |
| Élastase | |
| Extrait aqueux | 8.1 ± 1.4 |
| Extrait éthanolique | 3.3 ± 0.6 |
Source: Auteur
Les extraits de plantes offrent des possibilités illimitées pour découvrir de nouveaux inhibiteurs d’enzymes, étant donné qu’ils produisent une grande variété de métabolites secondaires. Ces composés chimiques sont utilisés par les plantes pour se protéger contre l’action des animaux herbivores et des insectes et beaucoup de ces composés sont des inhibiteurs de plusieurs classes de protéases, y compris L’élastase (Sin – Kim, 2005; Middleton et coll., 2000).
Comme décrit précédemment, l’espèce Sedum Dendroideum produit une grande variété de métabolites secondaires et ces composés peuvent être impliqués dans l’inhibition de l’élastase.
Conclusions
Les résultats de la présente étude ont indiqué que les extraits aqueux et éthanoliques de Sedum Dendroideum avaient une activité inhibitrice significative sur l’activité protéolytique de l’élastase. Des études plus spécifiques sont nécessaires pour identifier et isoler les composés bioactifs dans les extraits de Sedum dendroideum.
RÉFÉRENCES BIBLIOGRAPHIQUES
ABBOUD, R.T.; VIMALANATHAN S. Pathogenesis of COPD. Part I: The role of protease-antiprotease imbalance in emphysema. International Journal of Tuberculosis and Lung Diseases. v.12, n.4, p.361–367, 2008.
AIMIN, H.; MINGSHI, W.; HONGYAN, H.; DECHENG, Z.; LEE, K. H. Hepatoprotective triterpenes from Sedum sarmentosum. Phytochemistry, Oxford, v. 49, n. 8, p. 2607-10, 1998.
COUTINHO, M. A. S., MUZITANO, M. F., COSTA, S. S., 2009. Flavonóides: Potenciais agentes terapêuticos para o processo inflamatório. Revista Virtual de Química 1, 241-256.
CUCCIOLONI, M., MOZZICAFREDDO, M., ONFILI, L., CECARINI, V., ELEUTERI, A.M., ANGELETTI, M., (2009): Natural occurring polyphenols as template for drug design. Focus on serine proteases. Chem Biol Drug Des., 74: 1–15.
EPAGRI − Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina. S. A. CD Plantas Medicinais. Versão 1.0. Itajaí, 1998. 1 CD-ROM.
HALIN, F.; SLOSSE, P.; HOOTELÉ, C. Sedum alkaloides – VII – Structure and synthesis of (+)-4- hydroxysedamine and (+)-4-hydroxyallosedamine. Tetrahedron, Oxford, v. 41, n. 14, p. 2891-7, 1985.
HART, H. T.; STEVENS, J. F.; JEONG, H. K. Alkaloids of some Asian Sedum species. Phytochemistry, Oxford, v. 41, n. 5, p. 1319-24, 1996.
HEIDARI-SURESHJANI M.; YAZDI F. T.; MORTAZAVI, S.A.; BEHBAHANI, B.A.; SHAHID F. Antimicrobial effects of Kelussia odoratissima extracts against food borne and food spoilage bacteria “in vitro”. Journal of Paramedical Sciences, v. 5, n.2, 2015.
IBANEZ, S., GALLET, C., DESPRÉS, L., (2012): Plant Insecticidal Toxins in Ecological Networks. Toxins., 4: 228-243.
JOHANSSON, S. U., Neutrophil multitarget functional bioassay to detect anti-inflammatory natural products. J. Nat. Prod., v. 65, p. 32-41, 2002..
LEATHERBARROW, R.J. GraFit Version 5.0, Erithacus Software Ltd, Staines, U.K.,1992.
MIDDLETON, E., Kandaswami, C., Theoharides, T.C., (2000): The Effects of Plant Flavonoids on Mammalian Cells: Implications for Inflammation, Heart Disease andCancer. Pharmacol Rev., 52:673-751.
MILANEZE, M. A.; GONÇALVES, E. Caracterização morfo-anatômica das folhas de Sedum dendroideum DC, CRASSULACEAE In: Simpósio Brasileiro De Farmacognosia, 3., 2001, Curitiba. Anais. Curitiba: Universidade Federal do Paraná, Departamento de Farmácia, Laboratório de Farmacognosia, 2001. p. FB-23.
OTÍN, C. L; BOND, J. S. Proteases: Multifunctional Enzymes in Life and Disease. Journal of Biological chemistry, v.283, 30433-30437, 2008.
RAWLINGS, N.D.; MORTON, F.R. The MEROPS batch BLAST: A tool to detect peptidases and their non-peptidase homologues in a genome. Biochimie, c. 90, p. 243-259, 2008.
SENDL, A.; MULINACCI, N.; VINCIERI, F. F.; WAGNER, H. Anti-inflammatory and immunologically active polysaccharides of Sedum telephium. Phytochemistry, Oxford, v. 34, n. 5, p. 1357-62, 1993.
SIEDLE, L.G., GUSTAVSSON, L., JOHANSSON, S., MURILLO, R., BOHLIN, L., The effect of sesquiterpene lactonas on the release of human neutrophil elastase. Biochem. Pharmacol, v. 7559, p. 1-7, 2003.
SIN, B.Y., KIM, H.P., (2005): Inhibition of collagenase by naturally-occurring flavonoids. Archives of Pharmacal Research., 28(10): 1152-1155.
STEVENS, J. F.; HART, H. T.; VAN HAM, R. C. H. J.; ELEMA, E. T.; VAN EN ENT, M. M.V.X.; WILDEBOER, M.; ZWAVING, J. H. Distribution of alkaloids and tannins in the Crassulaceae. Biochem. Syst. Ecol., Oxford, v. 23, n. 2, p. 157-65, 1995.
STUART, L.M; EZEKOWITZ, R.A. Phagocytosis: elegant complexity. Immunity, v. 5, p. 539-550, 2005.
THOMSON, A., KAPADIA, S.K., The Specificity of the S1 and S2 Subsites of Elastase, Eur.J.Biochem, v.102, p. 311-116, 1979.
[1] Étudiant diplômé en sciences biologiques à IFSULDEMINAS – Campus Inconfidentes.
[2] Doctorat en biochimie de l’UNIFESP; Professeur efficace à IFSULDEMINAS-Campus Inconfidentes, et chercheur auxiliaire au Laboratoire de biochimie du Centre de procédures environnementales.
Soumis: Mai 2019.
Approuvé: Juillet 2019.