MEIRELES, Bárbara Cristina da Silva [1], MIGUEL, Sandra Helena Gomes [2], MATTOS JUNIOR, Dalton Garcia de [3], BARROS, Luciano Antunes [4], MAGALHÃES, Bárbara Souza Neil [5]
MEIRELES, Bárbara Cristina da Silva; et.al. Levantamento Coproparasitológico de Jabutis (Testudinidae) Da Fundação Rio-Zoo, RJ. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 03, Ed. 04, Vol. 01, pp. 144-149, Abril de 2018. ISSN:2448-0959
RESUMO
As informações sobre os parasitas de répteis são bastante escassas, portanto, em alguns casos, não é possível saber qual é a extensão da participação dos mesmos como agentes causadores das doenças, seja em sistemas confinados ou na natureza. Com o intuito de minimizar e monitorar essas infecções, foi necessário identificar a ocorrência de helmintos e protozoários, através dos exames coproparasitológicos, com a finalidade de traçar medidas preventivas, visando o controle dessas parasitoses dos quelônios da Fundação Rio-Zoo. Em uma criação conjunta de Geochelone carbonaria e G. denticulata 27 amostras de fezes foram coletadas e examinadas por diferentes técnicas. Dentre os ovos e cistos de parasitos, foram identificados ovos de Strongyloides, Strongyloidea, Oxyuridae, Ascaridae, larvas de Labiduris spp, ovos de Trematoda e Pentastomidae, assim como cistos de Balantidium spp. A maior frequência na população examinada foi de Strongyloides sp., seguidos de ovos de nematóides da família Strongyloidea.
INTRODUÇÃO
Os jabutis são animais pertencentes à ordem Chelonia, família Testudinidae, sendo as espécies Geochelone denticulata e Geochelone carbonaria encontradas no Brasil. São animais essencialmente terrestres e muito procurados como animais de estimação. No cativeiro devido às condições ambientais e de higiene, estão propensos a surtos de doenças infecciosas e parasitárias (1).
Chelonoidis denticulata, chamada anteriormente de Geochelone denticulata, é conhecida como «tortugamotelo» na língua espanhola. Essa espécie é uma das quatro espécies de Testudíneos que se encontram distribuídos na América do Sul. São consideradas como hospedeiras de alguns agentes potencialmente patogênicos, dentre eles, os helmintos gastrointestinais com prevalência de 94 a 100% em tartarugas terrestres (2).
Existem 166 espécies de testudíneos estão em perigo de extinção por causa da degradação de seus hábitats, invasões do homem na natureza, coleta para alimentação, medicamentos e comércio de animais de estimação (3).
Os animais em cativeiro estão mais propensos a adquirir uma parasitose do que um animal de vida livre, uma vez que seu espaço é limitado e o contato com dejetos próprios e de outros membros do grupo é frequente, favorecendo a reinfestação dos animais tratados (4).
Em C. denticulata forma registrados 11 espécies de nematóides: Labiduris gulosa, L. zschokkei, L. irineuta, Atractis impura, A. thapari, Klossinemella travassosi, Sauricola sauricola, Chapiniella variabilis, C. larensis, C. diazi e Angusticaecumholopterum (5,6,7,8,9) duas espécies de trematódeos: Halltremavitellina e Helicotremaspirale (9,10) e uma espécie de cestóide: Ophiotaenialopesi (9). Da mesma forma, são registradas também, lesões gastrointestinais por nematóides nos jabutis G. carbonaria, G. pardalis e Apalone spinifera pallida (11,12).
No Brasil foram descritas duas espécies de estrongilídeos em G. denticulata: Chapiniella variabilis e Sauricola sauricola, pertencentes à família Cyathostomidae e um ascaridídeo da família Heterocheilidae, Angustiocaecum brevispiculum em Testudo denticulata (13).
Diante da escassez de dados sobre os helmintos de jabutis mantidos em cativeiro, o objetivo do presente levantamento é identificar e determinar as ocorrências de ovos de helmintos e protozoários em amostras de fezes de Geochelone denticulata e Geochelone carbonaria, visando contribuir com os profissionais desta área, para conhecimento das doenças relacionados ao parasitismo e na tomada de medidas de controle, profilaxia e tratamento.
MATERIAIS E MÉTODOS
Foram analisadas 27 amostras de fezes frescas colhidas de duas espécies de jabutis – Chelonoidis denticulata e Chelonoidis carbonaria. Os animais residem em um recinto coletivo típico para quelônios terrestres, com abrigos, cobertura arbórea e sombreado com área externa e com acesso a terra.
A alimentação ministrada foi baseada em legumes, verduras e frutas higienizadas previamente com água corrente. O recinto em que os animais se encontram possui de largura 8,9 m² e de comprimento total 17,5 m², sendo destes 16,5 m² composto por terra e 11 m² por água. Encontram-se uma fonte de água e lago artificial com troncos e plataformas de cimento. No recinto são encontradas árvores e plantas como jabuticabeiras (Plinia cauliflora), ráfia (Rhapis excelsa), trapoeraba roxa (Tradescantia pallida purpurea), jamelão (Syzygium cumini) e costela de Adão (Monstera deliciosa). Os animais do estudo, até então, não passaram por nenhum procedimento de vermifugação prévia. Para coleta das fezes, os animais foram previamente separados em caixas limpas e higienizadas e receberam uma numeração em seus cascos. Quando defecaram, as fezes foram coletadas e mantidas refrigeradas até a análise em um período máximo de três dias desde a coleta e os animais devolvidos ao recinto. A análise foi realizada no laboratório da disciplina de Doenças Parasitárias do Curso de Medicina Veterinária da UFF. As técnicas coproparasitológicas utilizadas foram: flutuação (Willis-Mollay) e sedimentação para a pesquisa de ovos de helmintos e cistos de protozoários (14).
Os ovos de helmintos encontrados foram medidos com o auxílio do microscópio e micrometro ocular e identificados de acordo com os seguintes investigadores (6,8,15,16).
RESULTADOS E DISCUSSÃO
Das 27 amostras analisadas antes do tratamento 25 foram positivas (92,59%) para algum helminto, sendo a maior porcentagem de ocorrência para nematóides [fig 1. (1-2), fig 2. (3) e fig.4 (5-6)], sendo detectadas ovos por trematódeos [fig 2 (4)], pentastomídeos e protozoários Balantidium de acordo com o quadro 1.
Quadro 1 – Frequência de infecções parasitárias em 27 amostras de fezes de quelônios criados na Fundação Rio-Zoo do Rio de Janeiro, Brasil, 2016.
| Parasita | Frequência | Infecções | ||
| Única | Dupla | Tripla ou mais | ||
| Strongyloides sp. | 74,07% | 55,55% | 18,51% | 7,4% |
| Strongylidae * | 14,81% | 3,7% | 7,4% | 7,4% |
| Oxyuroidea* | 3,7% | 7,4% | 0% | 0% |
| Ascaroidea* | 3,7% | 0% | 3,7% | 0% |
| Larvas de Labiduris sp. | 11,11% | 3,7% | 3,5% | 3,7% |
| Trematoda** | 22,22% | 0% | 11,11% | 11,11% |
| Pentastoma** | 7,4% | 0% | 3,7% | 3,7% |
| Balantidium sp. | 7,4% | 0% | 0% | 3,7% |
| Negativo | 7,4% | – | – | – |
*Família, ** Classe
Exames coproparasitológicos são utilizados para obtenção do diagnóstico de parasitoses em quelônios, com diversas técnicas são empregadas com sucesso (17,18,19). Diante da facilidade da técnica de flutuação e de sedimentação, as mesmas demonstraram-se eficazes como no presente trabalho. Outros investigadores também as empregaram, mas a técnica de Ritchie é mencionada e considerada estatisticamente como a mais eficaz (16).
No presente estudo, a ocorrência de parasitos se assemelha aos registros provenientes de um criadouro conservacionista no Estado de São Paulo, quando foram encontrados cistos de Balantidium sp e ovos de nematoides (18). Da mesma forma, no Estado do Espírito Santo, foram registrados 76,84 % de parasitos em amostras de fezes, sendo que o grupo mais frequente foram os nematóides (16). De forma diversa, foram registrados em animais na Fundação Zoo de São Paulo, maiores ocorrências para os protozoários e baixas ocorrências para os helmintos (19).
Cabe ressaltar que a alta ocorrência de parasitos nos quelônios da Fundação Rio-Zoo do RJ e de outros sistemas confinados está relacionada à alta taxa de reinfecção, pois as condições ambientais em cativeiro, a forma de infecção do tipo fecal-oral, a presença de terra, a coprofagia são fatores que potencializam a disseminação de doenças entre os animais, fenômeno esse observado por outros investigadores (20, 21).
Apesar dos parasitos causarem diversas alterações fisiológicas nos animais, em todo o período de estudo, não foram observados sinais clínicos que comprometessem a saúde dos animais. Diversas pesquisas apontam para fatores associados às parasitoses que interferem nesse quadro e que devem ser minimizados, aplicando-se um bom manejo ambiental, alimentação controlada e diminuição do stress (22, 23).
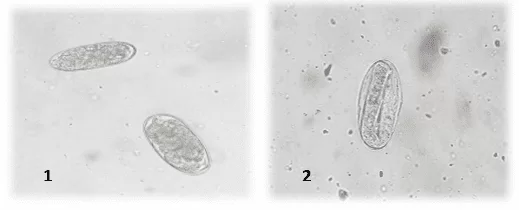
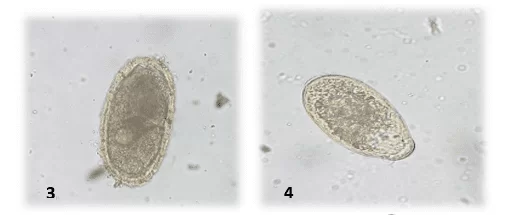
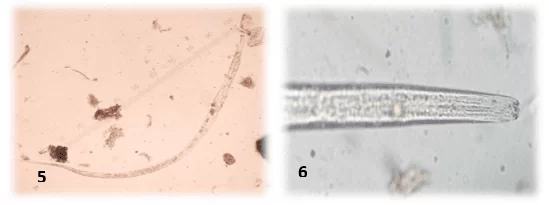
A presente nota tem sua relevância baseada no levantamento parasitário de Chelonoidis cativos devido aos poucos dados com o tema disponíveis no Brasil. Seu levantamento auxilia no monitoramento sanitário do plantel e serve de parâmetro para futuras pesquisas.
O tratamento dos animais analisados foi realizado administrando Fenbendazole (Panacur® Pó) em pó misturado na alimentação animal na dose de 25 – 50 mg/kg por 5 dias consecutivos, repetindo – o após 10 dias. No recinto foi realizada limpeza e higienização com vassoura de fogo e será mantido o monitoramento parasitológico a cada 3 meses.
REFERÊNCIAS BIBLIOGRÁFICAS:
1. FOWLER, M. E. Zoo and Wild Animal Medicine. 2 ed. Philadelphia: W. B. Saunders. 1127p., 1986.
2. MARTÍNEZ A. Parásitos digestivos en reptiles. Argos, Informativo Veterinario 88: 48. [Internet], [15 febrero 2009]. Disponível em: http://www.ucm.es/ B U C M / c o m p l u d o c / S / 1 0 7 0 5 / B17820765_1.htm. Acessado em 23/03/2017.
3. RAPHAEL, B. Zoo and wild animal medicine. 5th ed. Philadelphia: WB Saunders. p. 48–58, 2003.
4. MENEZES, S. Patologias induzidas por erros de manejo animal. Animal Pet.; 2(6):16, 2000.
5. PETTER, A. J. Equilibre des especes dans lês populations the nematodes parasites du colon dês tortues terrestres. Mus. Nat. Hist. Ser A Zool. 39: 1- 252, 1966.
6. DÍAZ-HUNGRIA, C; GALLARDO M. Nematodes de reptiles venezoelanos com descripción de varias especies nuevas. Soc.Venez.Cienc.Nat: 550-570, 1968.
7. SARMIENTO, L.; TANTALEÁN, M.; HUIZA, A. Nematodos parasitos Del hombre y de los animales em el Perú. Per.Parasitol. 14: 9-65, 1999.
8. SALIZAR P, SÁNCHEZ L. Nuevos registros de nematodos en dos especies de tortugas (Reptilia: Testudines) em el Perú. Helmintol. 1: 43-45. 26, 2007.
9. MUNIZ-PEREIRA, L.C; VIEIRA, F.M; LUQUE, J. L. Checklist of helminth parasites of threatened vertebrate species from Brazil. Zootaxa 2123: 1-45, 2009.
10. VEJA, J. Identificación de helmintos em tortuga motelo (Geochelone denticulata), mediante estúdios coproparasitológicos, provenientes de la comercialización en el Mercado de Belén-Iquitos. Tesis de Médico Veterinario. Lima, Perú. Univ. Nacional Mayor de San Marcos. 54 p., 2008.
11. RIDEOUT, B. A.; MONTALI, R. J; PHILLIPS, L. G.; GARDINER, C. H. Mortality of captive tortoises due to viviparous nematodes of the genus Proatractis (Family Atractidae). Wildlife Dis. 23: 103-108, 1987.
12. MCALLISTER, C. T.; GOLDBERG, S. R.; Holshuh, H. J. Spiroxyscontorta (Nematoda: Spirurida) in gastric granulomas of Apalonespinifera pallid (Reptilia: Testudines). Wildlife Dis. 29: 509-511, 1993.
13. CHAPIN, E. A. Nematode parasites of the Brazilian land-tortoise, Testudo denticulata. Proceedings of the United States National Museum, v. 65, n. 13, p. 1-6, 1924.
14. HOFFMANN, R. P. Diagnóstico de Parasitismo Veterinário. Sulina, 156 p, 1987.
15. VICENTE, J. J.; RODRIGUES, H. O.; GOMES, D. C.; PINTO, R. M. Nematóides do Brasil. Parte 310 III. Nematóides de répteis. Brasil. Zool. 10: 19-168, 1993.
16. RODRIGUES, S. S. Avaliação coproparasitológica de Chelonoidis carbonaria (Spix,1824) (Reptilia, Testudinidae) em cativeiro no Espírito Santo. / Dissertação (Mestrado em Ciência Animal) – Centro Universitário Vila Velha, 61 p, 2011.
17. JACOBSON, E. P. Parasitic Diseases of Reptiles. In: FOWLER, M. E. Zoo and wild Animals Medicine. 2 ed. Philadelphia: W. B. Saunders, p. 162-181., 1986.
18. SILVA, A. E. P.; PEREIRA, D. M.; CAMPOS VELHO, N. M. R. Análises parasitológicas em quelônios de cativeiro. In: XII Encontro Latino Americano de Iniciação Científica e VIII Encontro Latino Americano de Pós-Graduação – Universidade do Vale do Paraíba, 2008. Disponível em: http://www.inicepg.univap.br/cd/INIC_2008/anais/arquivosINIC/INIC0628_01_A.pdf.Acessado em 23/03/2017.
19-FERRAZ, R. R. N.; CORREIO, J. V. F.; RODRIGUES, F. S. M.; ERRANTE, P. R.; BARNABÉ, A. S. Levantamento de enteroparasitas de jabutis (Família Testudinidae) da Fundação Parque Zoológico de São Paulo. Revista UNILUS Ensino e Pesquisa. 11 nº. 24,10-15, 2014.
20. KEIMER, I. Diseases of Reptilia. London: Academic Press. p. 235–86., 1981.
21. RUNDQUIST, E. M. (1999). Reptile and Amphibian Parasites. Chelsea House Publishers. 68 p, 1999.
22. GREINER, C; MADER, D. R. In: Mader, D. R. Reptile Medicine and Surgery. Sauders Elsevier. 2 ed, cap. 21, p. 343-345, 2006.
23. JOHNSON, C. Reptile Zoonoses and Threats to Public Health. Reptile Medicine and Surgery. 2nd ed. Philadelphia: Saunders. p. 1017–29., 2006.
[1] Médicas veterinárias, Universidade Federal Fluminense, Niterói, Rio de Janeiro/RJ, Brasil.
[2] Médicas veterinárias, Universidade Federal Fluminense, Niterói, Rio de Janeiro/RJ, Brasil.
[3] Professore do Departamento de Saúde Coletiva Veterinária e Saúde Pública (MSV) da Faculdade de Veterinária da Universidade Federal Fluminense – UFF, Niterói/RJ Brasil
[4] Professore do Departamento de Saúde Coletiva Veterinária e Saúde Pública (MSV) da Faculdade de Veterinária da Universidade Federal Fluminense – UFF, Niterói/RJ Brasil
[5] Médicas veterinárias, Universidade Federal Fluminense, Niterói, Rio de Janeiro/RJ, Brasil.

