ARTIGO DE REVISÃO
FILHO, Mauro Roberto Veras Bezerra [1]
FILHO, Mauro Roberto Veras Bezerra. Síndrome Cardiorenal tipo III: Definição, epidemiologia e fisiopatologia. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 12, Vol. 01, pp. 131-151. Dezembro de 2019. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/sindrome-cardiorenal
RESUMO
O acometimento simultâneo dos sistemas cardíaco e renal é conhecido, hoje, como síndrome cardiorrenal. A mais recente definição inclui uma variedade de condições (agudas ou crônicas) cujo principal órgão acometido pode ser tanto o coração como o rim. As síndromes cardiorrenais são, portanto, distúrbios cuja disfunção aguda ou crônica em um órgão é capaz de acometer de igual forma os outros órgãos em razão das complexas interações cardiorrenais. Tais avanços no reconhecimento, classificação e fisiopatologia desta síndrome são importantes para a prática médica devido aos desfechos positivos que a precoce identificação e tratamentos corretos podem exercer sobre a mortalidade e morbidade.
Palavras-chave: Síndrome cardiorrenal, Insuficiência renal, Insuficiência cardíaca.
1. INTRODUÇÃO
As funções cardíacas e renais estão intimamente interligadas. Esta conexão fisiológica é necessária de modo a se manter a homeostase regular e o funcionamento normal do corpo humano. No entanto, durante certas situações patológicas, o órgão acometido pode induzir danos estruturais e/ou distúrbios funcionais no outro órgão. Patologias cardíacas agudas ou crônicas podem, de fato, contribuir para uma concomitante piora aguda ou crônica da função renal e vice-versa. O termo síndrome cardiorrenal (SCR) é frequentemente usado para descrever essas condições clínicas. A classificação em cinco subtipos é baseada no acometimento primário do órgão bem como se a mesma é aguda ou crônica. Neste artigo, será abordado um pouco do histórico da síndrome cardiorrenal e os fatores fisiopatológicos implicados da SCR tipo 3.
2. MÉTODOS
Para este estudo a metodologia utilizada foi a pesquisa bibliográfica, visto que abrange toda bibliografia já tornada pública em relação ao tema, desde publicações avulsas até meios de comunicação oral e audiovisuais. Artigos científicos foram utilizados para elaboração deste estudo. Para seleção destes, procedeu-se à pesquisa nas seguintes bases de dados eletrônicas: Sientific Eletronic Library Online (SciELO); Literatura Latino Americana (LILACS); PubMed e UpToDate. Tal pesquisa foi realizada entre fevereiro e setembro de 2018, utilizando os descritores: “Cardiorenal Syndrome”, “Renal Failure”, “Cardiac Failure” e cruzou-se estes termos com palavras como “definition”, “classification”, “epidemiology”.
Os referidos descritores foram utilizados em separado e, posteriormente, combinados, de maneira que o termo “Cardiorenal Syndrome” estivesse sempre presente. Os artigos selecionados foram procurados por meio eletrônico. A seleção dos mesmos divulgados entre 1993 e 2018 foi baseada nos títulos e resumos utilizando os seguintes critérios de inclusão: artigos publicados em periódicos nacionais e internacionais; escritos na língua inglesa ou portuguesa; acessados na íntegra e que continham informações relevantes sobre a síndrome cardiorrenal. A partir das referências e citações dos mesmos foi possível encontrar artigos adicionais de igual importância.
3. REVISÃO BIBLIOGRÁFICA
3.1 HISTÓRICO, DEFINIÇÃO E CLASSIFICAÇÃO DA SCR
A sobreposição de doença cardíaca e renal envolve desde variáveis hemodinâmicas e biomarcadores até mudanças estruturais cardíacas e renais (RONCO et al, 2008). Tais interações representam a base fisiopatológica da entidade clínica denominada síndrome cardiorrenal (SCR) (RONCO, 2008). A primeira tentativa de definição formal da SCR veio em 2004 pelo National Heart, Lung and Blood Institute que a definiu como uma patologia decorrente da conexão entre os rins e outros compartimentos circulatórios, resultando, então, no aumento do volume circulante capaz de exarcebar tanto os sintomas da insuficiência cardíaca como acelerar sua progressão (NHBLI working group, 2004).
Depois veio Heywood (2004) que descreveu a SCR como sendo uma disfunção renal que se inicia/agrava em um paciente com Insuficiência Cardíaca (IC) descompensada. Entretanto, em uma conferência de consenso no âmbito da Acute Dialysis Quality Initiative (ADQI), em setembro de 2008, a SCR foi definida como uma desordem cuja disfunção aguda ou crônica em um órgão é capaz de levar à disfunção aguda ou crônica no outro órgão (conceito este mais utilizado atualmente) (RONCO et al, 2010). Nesta mesma conferência, a SCR foi subclassificada em cinco tipos (Tabela 1).
Tabela 1 – Subclassificação SCR
| Tipo | Nome | Mecanismo | Clínica |
| Tipo 1 | SCR aguda | Falência renal aguda induzida por disfunção cardíaca aguda | Choque cardiogênico
Insuficiência cardíaca aguda descompensada |
| Tipo 2 | SCR crônica | Falência renal crónica progressiva secundária a disfunção cardíaca crónica |
IC Congestiva Crônica |
| Tipo 3 | Síndrome Renocardíaca Aguda | Disfunção cardíaca aguda precipitada por falência renal aguda; | Isquemia Renal Aguda; Glomerulonefrite; |
| Tipo 4 | Síndrome Renocardíaca Crônica | Disfunção cardíaca crónica secundária a doença renal crónica; |
Doença renal crônica |
| Tipo 5 | SCR Secundária | Disfunção cardíaca e renal secundária a patologia sistémica. | Diabetes Mellitus; Sepse; Amiloidose |
Fonte: Adaptada de Ronco (2010)
3.1.1 SÍNDROME CARDIORRENAL AGUDA TIPO 3 (SCR-3)
A SCR tipo 3 (ou síndrome renocardíaca aguda) é uma subclassificação SCR na qual um episódio de LRA precipita o desenvolvimento de uma injúria cardíaca aguda (RONCO et al, 2008). Existem vários fatores capazes de desencadear uma LRA, predispondo, portanto, ao desenvolvimento da SCR tipo 3 (MAKRIS e SPANOU, 2016), estando estes esquematizados na tabela 2.
Tabela 2 – Causa de LRA
| Nefropatia por contraste | Nefrotoxicidade medicamentosa | Cirurgias de grande porte |
| Glomerulopatias | Rabdomiólise | Pielonefrite |
| Hipovolemia | Endocardite infecciosa | Isquemia renal |
Fonte: Makris e Spanou (2016)
A LRA é muito comum em pacientes hospitalizados. A maioria dos episódios de LRA grave ocorrem em associação com uma patologia crítica, sendo tratadas em ambiente de terapia intensiva. Esta maior suscetibilidade para o desenvolvimento de LRA decorre de inúmeros fatores, incluindo a predisposição genética (FRANK et al, 2012; LU et al, 2009) e comorbidades como idade avançada (COCA et al, 2011), doença cardiovascular, diabetes mellitus (DM) e doença renal crônica (DRC), juntamente com eventos clínicos e/ou exposições iatrogênicas.
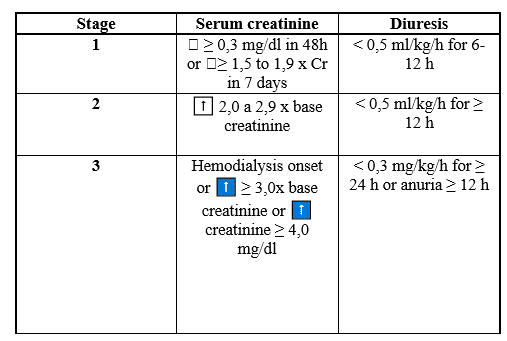
Além disso, a gravidade e duração da LRA apresentaram relação com o risco subsequente de complicações (BROWN et al, 2010; CHAWLA et al, 2011). Para se definir LRA, utilizam-se os critérios do Kidney Disease: Improving Global Outcomes (KDIGO) (LI et al, 2013), demonstrados na tabela 3. De forma resumida, o aumento da creatinina sérica ≥ 0,3 mg/ dl em 48 horas ou um incremento da creatinina sérica ≥ 1,5 vezes o valor basal (conhecido ou presumido) como tendo ocorrido nos últimos 7 dias ou, ainda, um volume urinário < 0,5 ml/kg/h por 6 horas já definem LRA.
Tabela 3 – Critérios KDIGO para LRA

3.2 FISIOPATOLOGIA DA SCR
A fisiopatologia da SCR é complexa e envolve 4 mecanismos principais: (1) Ativação neuro-hormonal; (2) Inflamação e sinalização celular; (3) Hemodinâmica e (4) Ativação hipotálamo-hipofisária. Todos esses fatores atuam em conjunto e a interação bidirecional entre os sistemas cardíaco e renal demonstrou ser fundamental na fisiopatologia da SCR (Figura 1).
Figura 1 – Fisiopatologia da SCR [2]
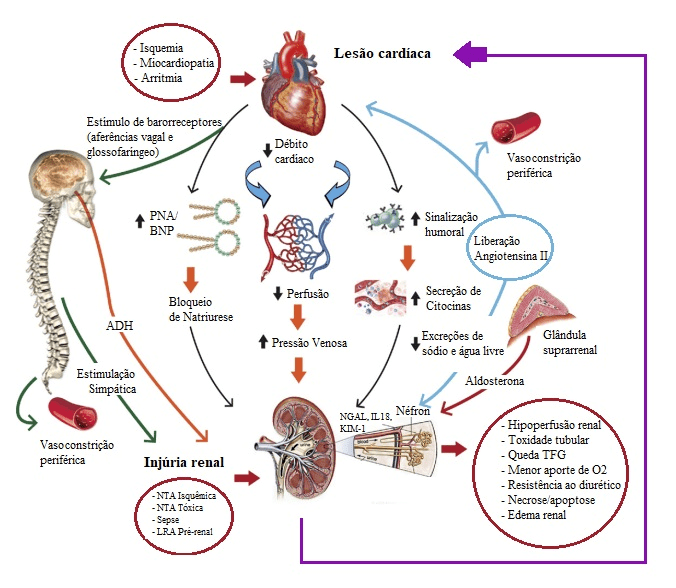
3.2.1 ATIVAÇÃO NEURO-HORMONAL
A ativação do Sistema nervoso simpático (SNS) ocorre tanto em uma situação de LRA quanto de injúria cardíaca aguda (KOBUCHI et al, 2011). No entanto, a exacerbação da atividade do SNS leva a uma maior liberação de noradrenalina (HERING et al, 2015), prejudicando a função miocárdica por meio de vários mecanismos, os quais incluem: (1) efeitos diretos da noradrenalina, (2) distúrbios do Ca+2 intracelular, (3) maior consumo de oxigênio pelo miocárdio, podendo acarretar isquemia endocárdica, (4) apoptose de cardiomiócitos devido estimulação dos receptores adrenérgicos (SINGH et al, 2011), (5) hipertrofia secundária a estimulação dos receptores α1-adrenérgicos e (6) ativação do sistema renina-angiotensina-aldosterona (SRAA).
Os estímulos adrenérgicos estimulam as células do aparelho justa-glomerular renal, contribuindo, assim, para a redução do fluxo sanguíneo bem como para uma maior liberação de renina e, consequentemente, para a ativação do SRAA. Esta ativação contribui para a liberação da angiotensina II (AT-II), vasoconstrição e elevação excessiva da resistência vascular periférica. A AT-II parece desempenhar, também, um papel direto na modificação da estrutura e da função miocárdica (KIM e IWAO, 2000) bem como contribui para a hipertrofia celular e apoptose em culturas de cardiomiócitos (KAJSTURA et al, 1997).
3.2.2 INFLAMAÇÃO E SINALIZAÇÃO CELULAR
Muitas citocinas apresentam uma atividade miocárdica depressora, incluindo o fator necrose tumoral alfa (TNF-α), interleucina (IL)-1β, IL-6, IL-2 e interferon-gama (IFN-α). Demonstrou-se que níveis elevados de TNF-α e IL-6 têm efeitos diretos nos miocárdio-depressores, caracterizados pela redução da fração de ejeção do ventrículo esquerdo (VE) e pelas dimensões diastólicas e sistólicas finais elevadas do VE (YAP; LEE, 2012). Em geral, a disfunção mediada por citocinas é reversível após um certo tempo de exposição (PRABHU, 2004). Níveis elevados de citocinas pró-inflamatórias foram demonstrados em pacientes com insuficiência cardíaca (IC) crônica e estão associados a remodelação ventricular desordenada, mau estado funcional, caquexia crônica e morte (RAUCHHAUS et al, 2000).
3.2.3 HEMODINÂMICA
É a congestão pulmonar e/ou sistêmica que leva o paciente a procurar assistência hospitalar, devido aos sinais e sintomas extremamente desconfortáveis que o acometem. No registro ADHERE (Acute Decompensated Heart Failure National Registry), 50% dos pacientes admitidos no hospital tinham uma pressão arterial sistólica com valor igual ou superior a 140 mmHg. No entanto, apenas 2% apresentavam hipotensão (HEYWOOD, 2004). O aumento da pressão arterial sistólica é um reflexo da retenção de sódio e água e da ativação do sistema nervoso simpático. O comprometimento do VE associado a um aumento da pressão arterial sistólica submete este à altas pressões de pós-carga, levando a congestão pulmonar independentemente do status volêmico do paciente (seja hipervolemia, seja hipovolemia).
A partir de então, surge um ciclo vicioso em que o remodelamento cardíaco desencadeia insuficiência mitral funcional secundária, aumento atrial esquerdo e hipertensão pulmonar (BONGARTZ et al, 2004). A congestão venosa renal crônica também tem efeitos deletérios, particularmente devido a uma atenuação dos reflexos vasculares. Assim como no coração, a congestão venosa é um dos parâmetros hemodinâmicos mais importantes da SCR, sendo implicada no desenvolvimento de disfunção renal secundária a uma cardiopatia aguda (NOHRIA et al, 2008). É comum observar-se que a coexistência de disfunção renal é um fator complicador para o tratamento de IC, uma vez que o uso de diuréticos de alça alivia os sintomas congestivos à custa da piora da função renal dias, sendo um forte preditor de resultados adversos (LIANG et al, 2008). Embora os diuréticos de alça forneçam diurese imediata e alívio dos sintomas congestivos, provocam uma acentuada ativação do sistema nervoso simpático e SRAA (Sistema renina-angiotensina-aldosterona), resultando, então, em reflexos renovasculares e retenção hidrossalina.
Isso coloca o paciente com IC descompensada em risco de SCR em uma estreita janela de manejo terapêutico em relação a equilíbrio hídroeletrolítico e pressão arterial. A oligúria pode levar à sobrecarga de volume e retenção de sódio e água, contribuindo para o desenvolvimento edema generalizado, sobrecarga cardíaca, hipertensão, edema pulmonar e disfunção miocárdica (RIMMELÉ; KELLUM, 2010). Este excesso de líquido acumulado está associado a resultados menos favoráveis em pacientes críticos (BOUCHARD; MEHTA, 2010), pois além de piorar a função cardíaca, também piorou a função renal devido à congestão venosa e à hipertensão intra-abdominal. Além disso, a remoção de fluidos em pacientes gravemente enfermos com uso de diuréticos de alça (GRAMS et al, 2011) ou ultrafiltração (BELLOMO et al, 2012) demonstrou aumentar a sobrevivência dos pacientes.
3.2.4 ATIVAÇÃO HIPOTÁLAMO-HIPOFISÁRIA
Um dos principais hormônios liberados pelo hipotálamo é o ADH, seja por meio estímulos osmóticos como não-osmóticos. Este hormônio é armazenado na neuro-hipófise e liberado na circulação sistêmica frente a um estresse metabólico ou hemodinâmico (VINOD et al, 2017). O ADH estimula receptores V1a dos vasos sanguíneos e aumenta a resistência vascular periférica, enquanto a estimulação dos receptores V2 das células principais do ducto coletor aumentam a reabsorção de água livre e leva à hiponatremia. As consequências clínicas dessas alterações incluem retenção hídrica, congestão pulmonar e hiponatremia (VINOD et al, 2017).
3.3 A CONEXÃO CARDIORRENAL
Segundo Bongartz et al (2004), existem quatro fatores responsáveis pela progressão da SCR: SRAA, Sistema nervoso simpático (SNS), Inflamação e o desequilíbrio Óxido Nítrico/Espécies Reativas de Oxigénio (ON/ERO). Esta interação (conhecida por Conexão Cardiorrenal) explica como a IR e a IC conduzem à SCR a partir de uma fisiopatologia comum (figura 2).
Figura 2 – Conexão Cardiorrenal
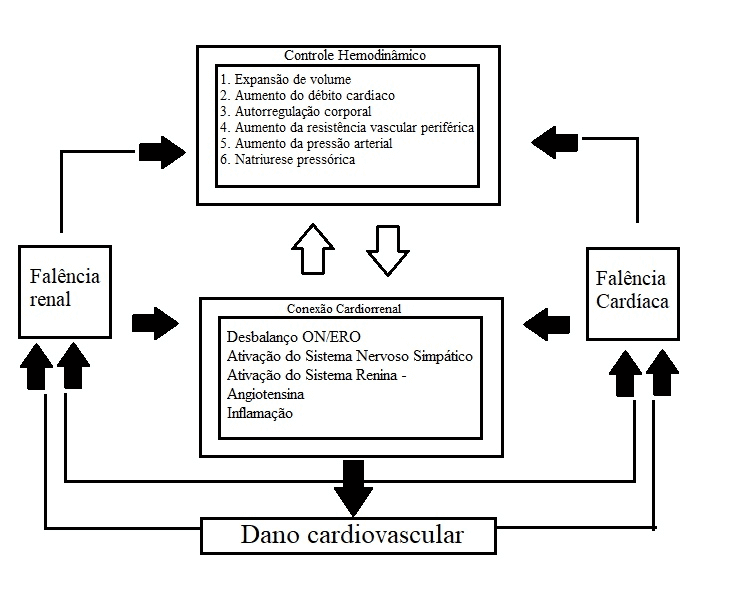
3.3.1 ATIVAÇÃO DO SRAA
A ATII ativa o NADPH-oxidase nas células endoteliais, nas células da musculatura vascular lisa, nos tubulares renais e nos cardiomiócitos. Desenvolve-se, então, fibrose tecidual com a formação de ERO (basicamente superóxidos) responsável pela senescência, inflamação e disfunção orgânica progressiva. O SRAA causa, diretamente, uma inflamação vascular via FN-κB (que induz a produção de quimiocinas e moléculas de adesão) além de aumentar a atividade simpática (MAHAPATRA et al, 2009).
3.3.2 ATIVAÇÃO DO SISTEMA NERVOSO SIMPÁTICO
Os rins possuem uma rica inervação simpática. Assim, quando o simpático é estimulado por hipovolemia (devido ao menor estiramento dos barorreceptores do seio carotídeo e do arco aórtico), tem-se no nível renal: (1) vasoconstrição das arteríolas renais, com diminuição da TFG; (2) maior reabsorção tubular de sódio e água; (3) maior liberação de renina e (4) aumento da formação de ATII e de aldosterona (SATA et al, 1997).
3.3.3 INFLAMAÇÃO
A cronicidade do processo inflamatório (presente tanto na doença renal como na doença cardíaca) é capaz de induzir ativação leucocitária, levando, igualmente, à produção de ERRO com liberação de conteúdos oxidativos (SHAH et al, 2011).
3.4 DESEQUILÍBRIO ON/ERO
A maior produção de ERO associada a menor disponibilidade de ON ocasiona no aumento da atividade simpática e em um maior estímulo ao SRAA (ou por lesão direta às células tubulares e intersticiais renais, ou por vasoconstrição aferente). A ocorrência inapropriada de uma das situações acima expostas conduz a um ciclo vicioso, atuando, para tanto, em sinergia e amplificando o dano cardíaco e o dano renal (SHAH et al, 2011).
3.5 FATORES PREDISPONENTES
3.5.1 TOXINAS URÊMICAS
O acúmulo de toxinas urêmicas pode levar à isquemia do miocárdio e a outras disfunções orgânicas A uremia pode interferir com a homeostase intra-celular do cálcio, acarretando na disfunção miocárdica (PERIYAAMY et al, 2001). Além disso, as toxinas urêmicas contribuem, diretamente, para a fibrose acelerada do miocárdico e em mudanças no remodelamento cardíaco após um evento isquêmico (DIKOW et al, 2010).
3.5.2 OBESIDADE
Demonstrou-se que o número de adipócitos no corpo humano pode aumentar em até 10x os pacientes obesos. Estas células secretam citocinas (IL-6 e TNF-alfa) capazes de causar lesão cardíaca e renal (OUWENS et al, 2010). O índice de massa corporal (IMC), uma medida global de excesso de adiposidade, está associado às anormalidades na ecocardiografia, incluindo dilatação atrial esquerda, hipertrofia ventricular esquerda e dilatação e relaxamento ventriculares prejudicados (MOVAHED et al, 2008). Já está bem estabelecida a relação entre glomerulopatia relacionada à obesidade (condição de hiperfiltração em indivíduos obesos sem DM) e DRC (HUNLEY et al, 2010). A presença de síndrome metabólica sem DM esteve associada a um risco até 7x maior em desenvolver SCR (GLANCE et al, 2010). Logo, a obesidade por si só é um fator de risco independente que aumenta tanto o risco de cardiopatia quanto de nefropatias bem como de síndrome cardiorrenal.
3.5.3 PROTEINÚRIA
A lesão de células endoteliais, mesangiais e podocitárias em pacientes portadores de hipertensão arterial e DM resulta em grandes concentrações de albumina no espaço de Bowman. As células do túbulo contorcido proximal, por serem responsáveis pela maior porcentagem de reabsorção de proteínas, são submetidas a uma maior carga de trabalho. Este fenômeno acarreta na apoptose de células tubulares, na perda de néfrons, na sobrecarga dos néfrons remanescentes e na progressão da doença renal (WARNOCK et al, 2010). De fato, albuminúria e proteinúria têm sido consideradas fatores prognósticos no que diz respeito à uma evolução mais rápida da DRC. A albuminúria, na população geral, é preditiva do desenvolvimento de IC e, naqueles com IC, está associada a maiores índices de hospitalização e mortalidade (BLECKER et al, 2011). A microalbuminúria é, portanto, um marcador de risco de fácil mensuração para doenças cardiovasculares e DRC, tanto na população normal como nas portadoras de nefropatia e cardiopatia (BLECKER et al, 2011).
3.5.4 HIPERTENSÃO E DM
A hipertensão e o DM tipo 2 são responsáveis pela maioria dos casos de DRC no mundo (McCULLOUGH et al, 2008). A não manutenção de níveis pressóricos adequados está diretamente ligada à perda acelerada de néfrons e quedas na TFG. O diabetes acarreta na disfunção e em danos glomerulares, levando a perda permanente dos néfrons remanescentes (HART; BAKRIS, 2010). Há uma relação bastante frequente entre hipertensão arterial e pacientes com IC descompensada dentro do contexto clínico da SCR tipo 1, devido, provavelmente, a ativação do sistema neuro-hormonal e retenção hidrossalina (FORMAN et al, 2004). Por outro lado, em casos pacientes com hipotensão e choque, há uma elevação de catecolaminas e uma falha do coração em responder com o aumento de seu débito cardíaco. Este último cenário é responsável por 2% dos casos de Scr tipo 1 (FORMAN et al, 2004).
3.5.5 ANEMIA
A anemia é comum na IC e está associada a maiores índices de mortalidade, morbidade e piora da função renal (SILVERBERG, 2011). A patogênese da anemia, nesta condição clínica, é multifatorial, envolvendo os seguintes mecanismos: (1) retenção hidrossalina com consequente hemodiluição, (2) bloqueio do transporte ferro, (3) indução de inflamação e liberação de citocinas pró-inflamatórias secundária a deficiência de eritropoietina e (4) resistência tecidual, desnutrição, caquexia, deficiência vitamínica, sendo todas estes fatores amplificados na presença de DRC (PALAZZUOLI et al, 2011). A menor resposta a eritropoietina em pacientes com IC e DRC deve-se aos altos níveis de hepcidina-25, uma substância que controla a absorção e o manejo dos estoques corporais de ferro (KATO, 2010).
Níveis elevados de citocinas aumentam a produção hepática de hepcidina-25, e, dessa forma, prejudicam tanto a absorção de ferro como a liberação deste dos estoques de macrófagos e hepatócitos. A hepcidina-25 parece ser útil para predizer a resposta de pacientes com IC crônica estável à administração de eritropoietina (VAN DER PUTTEN et al, 2010). Portanto, tentativas de controlar a anemia dentro do contexto clínico de IC terão que considerar dois fatores: o bloqueio do transporte de ferro corporal e o uso ferro suplementar bem como agentes estimuladores da eritropoiese (eritropoietina e darbepoetina). No entanto, a exposição a longo prazo aos agentes estimulantes da eritropoiese em doses altas está associada a maiores taxas de eventos cardiovasculares (PARFREY, 2011).
3.5.6 EPISÓDIOS REPETIDOS DE LRA
Muitos indivíduos passam por episódios recorrentes de LRA, sejam estes subclínicos ou não reconhecidos. Em cada episódio de LRA, há lesão de néfrons em que alguns recuperam, parcialmente, sua função e outros evoluem para necrose/apoptose celular. Devido à capacidade renal de auto-ajuste da TFG e da pressão de perfusão renal, o clínico não seria capaz de detectar esses eventos com a medida da creatinina (HAASE et al, 2011a). Estes eventos podem ocorrer no contexto de desidratação (por exemplo, com doenças gastrointestinais autolimitadas ou síndromes virais) após cirurgias eletivas, com terapias para outras doenças (por exemplo, quimioterapia, antibióticos) e com o uso de contraste iodados utilizados em uma variedade de estudos radiológicos (HAASE et al, 2011b). Assim, repetidos episódios de LRA podem explicar como alguns indivíduos com aparentemente nenhuma DRC podem desenvolver SCR dentro do contexto de IC descompensada.
3.6 EPIDEMIOLOGIA
Até o momento, a incidência e prevalência da SCR tipo 3 é desconhecida. Em um estudo feito na Escócia, a incidência de LRA foi de 2.147 casos a cada um milhão de habitantes (ALI et al, 2007). Comparativamente, o infarto agudo do miocárdio (IAM) nos Estados Unidos é de cerca de 2.667 casos a cada um milhão de habitantes. Um estudo multicêntrico prospectivo publicado no ano de 1998 relatou a associação entre LRA e falência de múltiplos órgãos, mostrando aumento na taxa de mortalidade tanto em pacientes internados em leito de terapia intensiva quanto naqueles em leito de enfermaria. A taxa de mortalidade de pacientes com LRA na UTI (Unidade de terapia intensiva) correlacionou-se com o número de órgãos acometidos: 53% com 2 órgãos, 80% com 3 órgãos, 91% com 4 órgãos e 100% em mais de 5 órgãos acometidos. Os principais acometimentos envolviam os sistemas respiratório (82%), cardiovascular (60%) e hepático (28%) (LIANO et al, 1998).
CONSIDERAÇÕES FINAIS
A SCR tipo 3 é uma condição clínica pouco compreendida, mas, provavelmente, comum em pacientes críticos. Existem poucos dados na literatura acerca desta patologia, porém a concomitante disfunção cardíaca e renal está associada a piores resultados quando comparada ao acometimento isolado de cada órgão. A LRA vem primeiro, seguida por injúria cardíaca acuda. O mecanismo pelo qual a LRA causa disfunção cardíaca não é completamente compreendido. Porém, distúrbios hidroeletrolíticos e ácido-base, uremia, ativação do sistema neuro-hormonal e inflamação parecem estar envolvidos. Estes, por sua vez, podem induzir uma perda irreversível de função bem como danos estruturais permanentes.
REFERÊNCIAS
Ali, T. et al. Incidence and outcomes in acute kidney injury: a comprehensive population-based study. J Am Soc Nephrol, v. 18, p. 1292-1298, 2007.
Bellomo, R. et al. An observational study fluid balance and patient outcomes in the randomized evaluation of normal vs. Augmented level of replacement therapy trial. Critical Care Medicine, v. 40, p. 1753–1760, 2012.
Blecker, S. et al. High-normal albuminuria and risk of heart failure in the community. Am J Kidney Dis, v. 58, n. 1, p. 47-55, 2011.
Bongartz, L. G. et al. The severe cardiorenal syndrome: ‘Guyton revisited’. Eur Heart J, v. 26, n. 1, p. 11-17, 2005.
Bouchard, J.; Mehta, R. L. Fluid balance issues in the critically III patient. Contributions to Nephrology, v. 164, p. 69-78, 2010.
Brown, J. R. et al: Duration of acute kidney injury impacts long-term survival after cardiac surgery. Ann Thorac Surg, v. 90, n. 4, p. 1142-1148, 2010.
Chawla, L. S. et al: The severity of acute kidney injury predicts progression to chronic kidney disease. Kidney Int, v. 79, n. 12, p. 1361-1369, 2011.
Coca, S. G.; Cho, K. C.; Hsu, C. Y. Acute kidney injury in the elderly: predisposition to chronic kidney disease and vice versa. Nephron Clin Pract, v. 119, p:c19-c24, 2011.
Dikow, R. et al. Uremia aggravates left ventricular remodeling after myocardial infarction. Am J Nephrol, v. 32, p. 13-22, 2010.
Forman, D. E. et al. Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure. J Am Coll Cardiol, v. 43, n. 1, p. 61-67, 2004.
Frank, A. J. et al. BCL2 genetic variants are associated with acute kidney injury in septic shock. Crit Care Med, v. 40, n. 7, p. 2116-2123, 2012.
Glance, L. G. et al. Perioperative outcomes among patients with the modified metabolic syndrome who are undergoing noncardiac surgery. Anesthesiology, v. 113, p. 859-872, 2010.
Grams, M. E. et al. Fluid balance, diuretic use, and mortality in acute kidney injury. Clinical Journal of the American Society of Nephrology, v. 6, n. 5, p. 966-973, 2011.
Haase, M.; Bellomo, R.; Haase-Fielitz, A. Neutrophil gelatinaseassociated lipocalin: a superior biomarker for detection of subclinical acute kidney injury and poor prognosis. Biomark Med, v. 5, n. 4, p. 415-417, 2011.
Haase, M. et al. The outcome of neutrophil gelatinase-associated lipocalin-positive subclinical acute kidney injury: a multicenter pooled analysis of prospective studies. J Am Coll Cardiol, v. 57, n. 17, p. 1752-1761, 2011.
Hart, P. D.; Bakris, G. L. Hypertensive nephropathy: prevention and treatment recommendations. Expert Opin Pharmacother, v. 11, n. 16, p. 2675-2686, 2010.
Hering, D.; Lachowska, K.; Schlaich, M. Role of the Sympathetic Nervous System in Stress-Mediated Cardiovascular Disease. Curr Hypertens Rep, v. 17, n. 10, 2015.
Heywood, J. T. The Cardiorenal syndrome: lessons from the ADHERE database and treatment options. Heart Fail Rev, v. 9, n. 3, p. 195-201, 2004.
Hunley, T. E.; Ma, L. J.; Kon, V. Scope and mechanisms of obesity-related renal disease. Curr Opin Nephrol Hypertens, v. 19, n. 3, p. 227-234, 2010.
Ismail, Y. et al. Cardio-renal syndrome type 1: epidemiology, pathophysiology, and treatment. Semin Nephrol, v. 32, n. 1, p. 18-25, 2012.
Kajstura, J. et al: Angiotensin II induces apoptosis of adult ventricular myocytes in vitro. J Mol Cell Cardiol, v. 29, n. 3, p. 859-870, 1997
Kato, A. Increased hepcidin-25 and erythropoietin responsiveness in patients with cardio-renal anemia syndrome. Future Cardiol, v. 6, n. 6, p. 769-771, 2010.
Kim, S.; Iwao, H. Molecular and cellular mechanisms of angiotensin II-mediated cardiovascular and renal diseases. Pharmacol Rev, v. 52, n. 1, p. 11-34, 2000.
Kobuchi, S. et al. Mechanisms underlying the renoprotective effect of GABA against ischemia/reperfusioninduced renal injury in rats. J Pharmacol Exp Ther, v. 338, n. 3, p. 767-774, 2011.
Li, P. K. T.; Burdmann, E. A.; Mehta, R. L. Injúria Renal Aguda: um alerta global. Braz. J. Nephrol, v. 35, n. 1, p. 1-5, 2013.
Liang, K. V. et al. Acute decompensated heart failure and the cardiorenal syndrome. Crit Care Med, v. 36, n. 1, p. 75-88, 2008.
Liano, F. et al. The spectrum of acute renal failure in the intensive care unit compared with that seen in other setting. Kidney Int, v. 53, p. 16-24, 1998.
Lu, J. C. et al. Searching for genes that matter in acute kidney injury: a systematic review. Clin J Am Soc Nephrol, v. 4, n. 6, p. 1020-1031, 2009.
Mahapatra, H. S. et al. Cardiorenal Syndrome. Iran J Kidney Dis, v. 3, n. 2, p. 61-70, 2009.
Makris, K.; Spanou, L. Acute Kidney Injury: Definition, Pathophysiology and Clinical Phenotypes. Clin Biochem Rev, v. 37, n. 2, p. 85-98, 2016.
McCullough, P. A. et al. CKD and cardiovascular disease in screened high-risk volunteer and general populations: the Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES) 1999–2004. Am J Kidney Dis, v. 51, n. 2, p. 38-45, 2008.
Movahed, M. R.; Saito, Y. Obesity is associated with left atrial enlargement, E/A reversal and left ventricular hypertrophy. Exp Clin Cardiol, v. 11, n. 1, p. 89-91, 2018.
NHLBI Working Group. Cardio-Renal Connections in Heart Failure and Cardiovascular Disease. Disponível em: http://www.nhlbi.nih.gov/meetings/workshops/cardiorenal-hf-hd.html. Acesso em: 10 out. 2019.
Nohria, A. et al. Cardiorenal interactions: insights from the ESCAPE trial. J Am Coll Cardiol, v. 51, n. 13, p. 1268-1274, 2008.
Ouwens, D. M. et al. The role of epicardial and perivascular adipose tissue in the pathophysiology of cardiovascular disease. J Cell Mol Med, v. 14, p. 2223-2234, 2010.
Palazzuoli, A.; Antonelli, G.; Nuti, R. Anemia in cardio-renal syndrome: clinical impact and pathophysiologic mechanisms. Heart Fail Rev, v. 16, n. 6, p. 603-607, 2011.
Parfrey, P. S. Critical appraisal of randomized controlled trials of anemia correction in patients with renal failure. Curr Opin Nephrol Hypertens, v. 20, n. 2, p. 177-181, 2011.
Periyasamy, S. M. et al. Effects of uremic serum on isolated cardiac myocyte calcium cycling and contractile function. Kidney Int, v. 60, n. 6, p. 2367-2376, 2001.
Prabhu, S. D. Cytokine-induced modulation of cardiac function. Circ Res, v. 95, n. 12, p. 1140-1153, 2004.
Rauchhaus, M. et al: Plasma cytokine parameters and mortality in patients with chronic heart failure. Circulation, v. 102, n. 25, p. 3060-3067, 2000.
Rimmele, T.; Kellum, J. A. Oliguria and fluid overload. Contributions to Nephrology, v. 164, p. 39-45, 2010.
Ronco, C. et al. Cardiorenal syndrome. J Am Coll Cardiol, v. 52, n. 19, p. 1527-1539, 2008.
Ronco, C. et al. Acute Dialysis Quality Initiative (ADQI) consensus group. Cardio-renal syndromes: report from the consensus conference of the acute dialysis quality initiative. Eur Heart J, v. 31, n. 6, p. 703-711, 2010.
Ronco C. Cardiorenal and renocardiac syndromes: clinical disorders in search of a systematic definition. Int J Artif Organs, v. 31, n. 1, p. 1-2, 2008.
Sata, Y.; Head, G. A.; Denton, K. Role of the Sympathetic Nervous System and Its Modulation in Renal Hypertension. Front Med (Lausanne), v. 5, n. 82, 2018.
Shah, B. N.; Greaves, K. The Cardiorenal Syndrome: A Review. Int J Nephrol, v. 2011, p. 1-11, 2011.
Silverberg, D. S. The role of erythropoiesis stimulating agents and intravenous (IV) iron in the cardio renal anemia syndrome. Heart Fail Rev, v. 16, n. 6, p. 609-614, 2011.
Singh, K. et al. Adrenergic regulation of cardiac myocyte apoptosis. J Cell Physiol, v. 189, n. 2, p. 257-265, 2001.
van der Putten, K. et al. Hepcidin-25 is a marker of the response rather than resistance to exogenous erythropoietin in chronic kidney disease/chronic heart failure patients. Eur J Heart Fail, v. 12, n. 9, p. 943-950.
Vinod, P. et al. Cardiorenal Syndrome: Role of Arginine Vasopressin and Vaptans in Heart Failure. Cardiol Res, v. 8, n. 3, p. 87-95, 2017.
Warnock, D. G. et al. Kidney function, albuminuria, and all-cause mortality in the REGARDS (Reasons for Geographic and Racial Differences in Stroke) study. Am J Kidney Dis, v. 56, n. 5, p. 861-871, 2010.
Yap, S. C.; Lee H. T. Acute kidney injury and extrarenal organ dysfunction: new concepts and experimental evidence. Anesthesiology, v. 116, p. 1139-1148, 2012.
ANEXOS
Figure 1 – Pathophysiology of CRS[3]
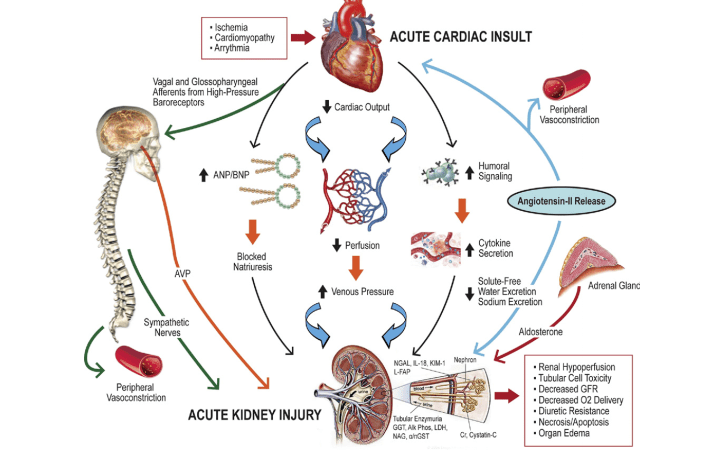
Figure 2 – The cardiorenal connection
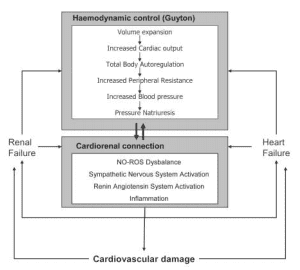
Table 1 – SCR Subclassification
| Type | Name | Mecanism | Clinic |
| Type 1 | Acute cardio-renal | Acute worsening of heart function (AHF) leading to kidney injury and / or dysfunction | Acute heart failure (AHF) or acute coronary syndrome (ACS) or cardiogenic shock |
| Type 2 | Chronic cardio-renal | Chronic abnormalities in heart function (CHF-CHD) leading to kidney injury or dysfunction | Chronic heart disease |
| Type 3 | Acute reno-cardiac | Acute worsening of kidney function (AKI) leading to heart injury and/or dysfunction | Renal Acute Ischemia; Glomerulonaphrite. |
| Type 4 | Chronic reno-cardiac | Chronic kidney disease (CKD) leading to heart injury, disease and/or dysfunction | CKD |
| Type 5 | Secondary CRS | Systemic conditions leading to simultaneous injury and/or dysfunction of heart and kidney | Diabetes mellitus; Sepsis; Amyloidosis |
Fonte: Adaptada de Ronco (2010).
Table 2 – Causes of AKI
| Contrast
Nephropathy |
Drug
nephrotoxicity |
Major
surgery |
| Glomerulopathies | Rhabdomyolysis | Pyelonephritis |
| Hypovolemia | Infectious
endocarditis |
Renal
ischemia |
Fonte: Makris e Spanou (2016)
Table 3 – KDIGO Criteria for LRA
2. ADH: Hormônio Anti-diurético; BNP: Peptídeo natriurético cerebral; IL-18: Interleucina-18; NGAL: N-acetil-B-(D) Glucosaminidase; NTA: Necrose tubular aguda; KIM-1: Kidney Injury Molecule-1 (Molécula-1 de injúria renal); PNA: Peptídeo natriturético atrial
3. ANP, atrial natriuretic peptide; AVP, arginine vasopressin; BNP: brain natriuretic peptide; NAG, N-acetyl-7-D-glucosaminidase; KIM-1, kidney injury molecule-1.
[1] Médico Residente Clínica Médica Hospital Evangélico Goiano/ UniEvangélica; Graduação em medicina pela Universidade Federal do Amazonas – AM. Anápolis, Goiás.
Enviado: Outubro, 2019.
Aprovado: Dezembro, 2019.

