MACHADO, Luciana De Olivera [1]
MACHADO, Luciana De Olivera. Risco do Aparecimento do Câncer de Mama em Mulheres Menopausadas com Síndrome Metabólica e o Papel da Dieta na Prevenção da Doença. Revista Científica Multidisciplinar Núcleo do Conhecimento. Edição 02, Ano 02, Vol. 01. pp 67-100, Maio de 2017. ISSN:2448-0959. Link de Acesso: https://www.nucleodoconhecimento.com.br/nutricao/cancer-mama-mulheres-menopausadas, DOI: 10.32749/nucleodoconhecimento.com.br/nutricao/cancer-mama-mulheres-menopausadas
RESUMO
As maiores causas de morte no Brasil são as neoplasias, o câncer de mama (CM) é a neoplasia mais comum em mulheres com idade abaixo de 60 anos. Estudos revelam que uma dieta rica em carboidratos refinados quando associada ao uso da terapia de reposição hormonal (TRH) contribui para o desenvolvimento do CM em mulheres e este alto consumo também pode estar associado com o desenvolvimento da síndrome metabólica (SM) que parece ser corresponsável pelo risco de CM. Portanto, o conhecimento de tais fatores de risco para a doença se faz necessário já que está bem estabelecido que a dieta rica em carboidratos refinados pode influenciar na progressão do câncer. Desta forma, este trabalho tem como objetivo identificar como o consumo de carboidratos refinados pode interferir na progressão do CM em mulheres menopáusicas. Será realizada uma revisão sistemática da literatura, com busca de artigos indexados dos últimos 10 anos nas bases de dados Pubmed, Scielo , sites governamentais, bibliotecas virtuais e Google Acadêmico.
Palavras-chave: Câncer de Mama, Síndrome Metabólica, Carboidratos Refinados, Menopausa, Alimentos Funcionais.
1. INTRODUÇÃO
O Câncer de Mama (CM) é considerado uma patologia multifatorial, cujos fatores de risco incluem a genética individual, fatores hormonais e ambientais (GABRIEL; DOMCHEK, 2010). Em relação ao seu aparecimento estima-se que 10% a 70% dos cânceres estão relacionados a fatores alimentares como a ingestão aumentada de aditivos químicos, dietas ricas em gorduras saturadas, carboidratos refinados e baixo consumo de frutas e vegetais (PADILHA; PINHEIRO, 2011).
O câncer vem se tornando uma enfermidade importante na carga global de doenças em todo o mundo e o número de novos casos poderá aumentar para 20 milhões no ano 2000 para 30 milhões em 2020 sendo 60% desses casos em todos os países em desenvolvimento (GARÓFOLO, 2013). A importância do câncer como causa de morte também aumenta com o passar dos anos e segundo a Organização Mundial de Saúde (OMS), esta doença atualmente é responsável por sete milhões de mortes anualmente (INCA, 2013).
Contudo, a maioria dos casos de CM se deve a interação de diversos fatores de risco modificáveis, tais como a dieta e não modificáveis como os genéticos (PAIVA et al., 2009). De acordo com o Instituto Nacional do Câncer (INCA, 2004) existem cerca de 33% dos casos de CM no Brasil que poderiam ser prevenidos com uma dieta saudável e com mudanças na dieta e no estilo de vida fatores estes que podem modular os efeitos deletérios de polimorfismos genéticos (LIMA et al., 2011).
A relação da dieta com o CM e os possíveis fatores causadores e propagadores desse tipo de neoplasia são amplamente reconhecidos pela literatura, portanto a alimentação, surge como um importante instrumento na prevenção do CM (GARÓFOLO, 2013).
O câncer de mama é o segundo tipo de câncer com maior incidência entre as mulheres e o segundo tipo de câncer que mais causa morte entre elas, ficando atrás apenas do câncer de pulmão (BAPTISTA et al., 2010). Apesar da incidência do câncer estar aumentando com o tempo, nos últimos dez a quinze anos, a mortalidade declinou em 2,3%, devido aos avanços na triagem do câncer e novas estratégias de tratamento (STEWART et al., 2004).
O consumo de alimentos industrializados, bebidas com alto teor calórico do tipo fast-food e industrializados, agrotóxicos, alimentos com excesso de sal e com a presença de conservantes, podem ser de risco para o aparecimento do câncer (CIBEIRA; GUARAGNA, 2010).
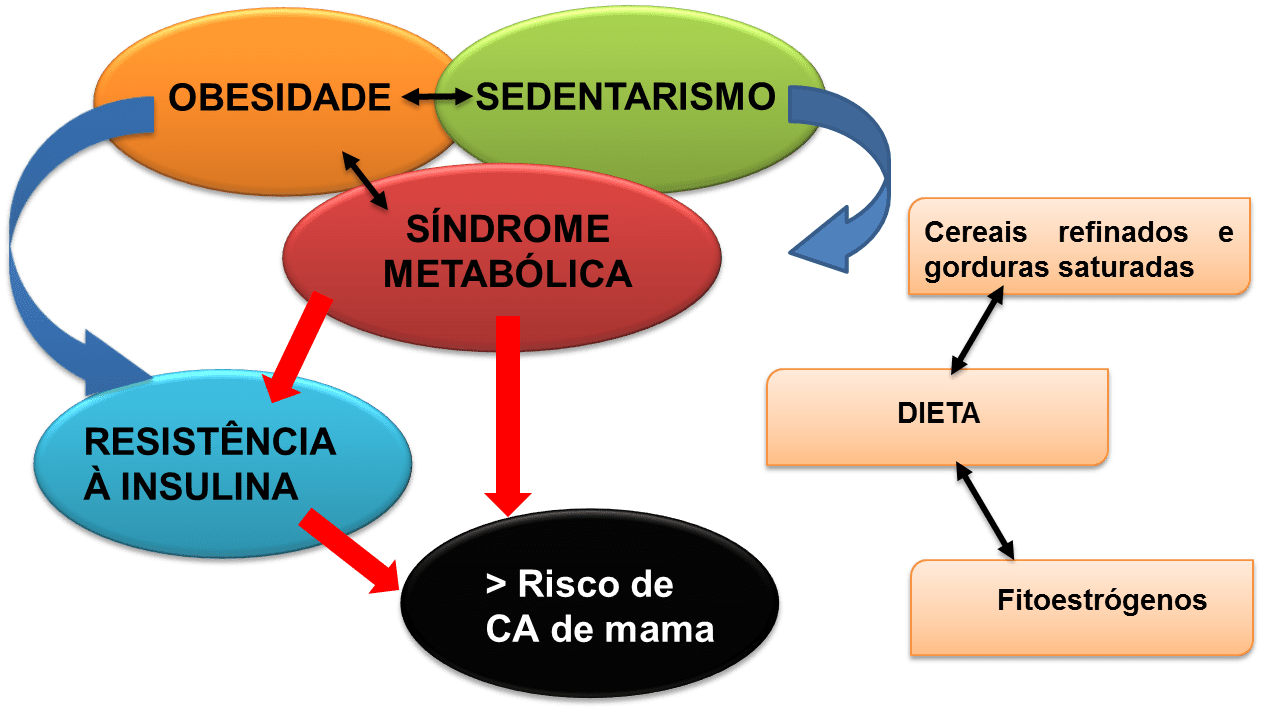
Uma dieta excessiva em carboidratos refinados e lipídeos podem levar a Síndrome Metabólica (SM) que está relacionada ao aumento do risco de CM em mulheres menopáusicas (KLEMENT, KAMMERER, 2011). A SM se dá quando um indivíduo apresenta alterações da pressão arterial, do perfil lipídico, com alterações no metabolismo da insulina e obesidade visceral (LARGENT, 2010). Os mecanismos da interação entre a SM e o CM envolvem o fator de crescimento semelhante a insulina e a obesidade, presente na SM, responsável pelo aumento dos níveis circulantes de insulina (FEITOSA et al., 2012). Portanto, fatores de risco ambientais e metabólicos podem contribuir para o aparecimento do CM, incluindo fatores genéticos causais, polimorfismos e ambientais, como a dieta rica em cereais refinados. Na figura 1 observa-se que uma dieta rica em carboidratos, lipídeos e o sedentarismo são fatores que podem levar a SM e ao risco de CM (LARGENT, 2010).
2. OBJETIVOS
2.1 OBJETIVO GERAL
Demonstrar a influência da Síndrome Metabólica (SM) na progressão do câncer de mama (CM) em mulheres menopáusicas.
2.2 OBJETIVOS ESPECÍFICOS
Revisar estudos sobre o papel da alimentação inadequada no aparecimento da SM e CM em mulheres menopáusicas.
Estudar as repercussões clínicas da SM e do CM na mulher e a relação com o consumo de carboidratos de alto índice glicêmico.
Abordar o risco da Terapia de Reposição Hormonal (TRH) no aparecimento do CM.
Avaliar a relação do consumo de carboidratos refinados no aparecimento do CM e sua relação com a SM e a TRH.
Destacar o papel da dieta funcional no controle do aparecimento do CM.
Segundo INCA 2015, o CM é considerado o segundo tipo mais frequente entre as mulheres e a dieta é um dos fatores responsáveis pelo aumento no número de casos em mulheres menopáusicas. Por outro lado, a TRH parece ter aumentado a incidência da doença nos últimos anos, devido sua maior utilização e prescrição pelos médicos. Ademais, a The Association of Metabolic Syndrome vem correlacionando o alto consumo de carboidratos refinados, de alto índice glicêmico com a SM, que parece ser responsável pelo risco de aparecimento do CM, já que muitos fatores citados anteriormente podem estar associados diretamente com o aparecimento da doença.
Portanto, o conhecimento dos fatores de risco para a enfermidade se faz necessário, já que está bem estabelecido que a dieta rica em gorduras saturadas e trans, associada a um alto consumo de carboidratos refinados de alto índice glicêmico influenciarem no aparecimento e na progressão do câncer.
Portanto, o presente estudo pode contribuir com informações relevantes para estudantes e profissionais de saúde sobre o papel da dieta saudável no controle da doença e sobre os aspectos metabólicos e fisiopatológicos da SM, do CM e suas repercussões nas mulheres menopausadas, com vistas a avaliar o risco do consumo de carboidratos, de alto índice glicêmico, como os cereais refinados, no aparecimento da doença e o papel de alimentos funcionais para seu controle.
4. REVISÃO DE LITERATURA
4.1 CÂNCER: CONCEITO E EPIDEMIOLOGIA
O câncer vem atingindo progressivamente um número maior de mulheres, em faixas etárias mais baixas, com taxas de mortalidade também crescente no Brasil (CESTARI; ZAGO, 2001).
A carcinogênese é um processo biológico de múltiplos estágios e se constitui em três fases distintas tais como a iniciação que envolve a transformação da célula produzida pela interação de substâncias químicas, radiação ou vírus, sendo esta fase o início do dano celular, ou seja, as células normais passam a ser um câncer detectável (WUNSCH, 2010).
Na fase de promoção as células iniciadas se multiplicam e escapam dos mecanismos para proteger o corpo de seu crescimento e disseminação e na terceira fase denominada progressão as células tumorais se agregam e crescem em um tumor (OLIVEIRA et al., 2011). Entre 1979 e 1999, houve um aumento de 69% na taxa bruta de mortalidade por CM no Brasil (5,77 para 9,75 óbitos por 100 mil mulheres/ano) e dessa maneira, foi considerada a principal neoplasia maligna feminina também em mortalidade, com taxa bruta de mortalidade estimada, para 2003, aproximadamente de 10 a 40 óbitos por 100 mil mulheres (INCA, 2005).
A incidência anual estimada de câncer de mama em todo o mundo corresponde a um milhão de casos. Países como os estados unidos, Reino Unido, Suécia, Itália e Uruguai, apresentam taxas de incidência de CM superiores a 100 casos por 100 mil mulheres/ano (ALBUQUERQUE; ALMEIDA, 2008).
Consequentemente as taxas de mortalidade também são bastante elevadas, ficando ao redor de 40 óbitos por 100 mil mulheres/ano e de acordo com a estimativa de incidência de câncer no Brasil, realizado pelo INCA, o câncer de mama foi o segundo em maior incidência, com 48.930 casos, com um risco estimado de 52 casos a cada 100 mil mulheres e a primeira causa de morte entre as mulheres (INCA, 2009).
Na região Sudeste, o câncer de mama é o mais incidente entre as mulheres, com um risco estimado de 71 casos novos por 100 mil e com uma estimativa de incidência de 30.740 casos novos para os próximos anos. A estimativa de incidência de câncer de mama na região Centro Oeste no ano de 2014 foi de 3.800 novos casos, no Nordeste foram 10.490 e na região Sul foram 10.370 de acordo com o Ministério da Saúde (MS) e o INCA (INCA, 2013).
Em função das estatísticas acima mencionadas o CM é hoje uma doença de destaque em importância para a saúde pública em nível mundial, motivando ampla discussão em torno de medidas que promovam a prevenção, o diagnóstico precoce e consequentemente a redução da mortalidade pela doença.
4.2 CÂNCER DE MAMA: INCIDÊNCIA E FATORES DE RISCO ASSOCIADOS
O CM é o segundo tipo de câncer mais frequente no mundo e o mais comum entre as mulheres no Brasil e acomete principalmente mulheres entre 40 e 60 anos sendo raro antes dos 35 anos, é um câncer que cresce progressivamente com o avanço da idade (INCA, 2015).
É um dos tipos de câncer mais temidos pelas mulheres por causar efeitos psicológicos tais como: a baixa auto-estima, alterações da imagem corporal e da sexualidade além de dor e ansiedade (CANTINELI et al., 2009).
O desenvolvimento do câncer de mama pode estar relacionado com alguns fatores de risco como a idade avançada, história familiar e pessoal, características reprodutivas, hábitos de vida e influências ambientais (LIMA, 2011). Contudo São necessários mais estudos para afirmar que a amamentação, o uso de contraceptivos e da terapia de reposição hormonal (TRH) após a menopausa podem contribuir para o aparecimento do CM (KUBA et al., 2012). Os cancêres de mama localizam-se principalmente no quadrante externo, geralmente as lesões são indolores, fixas e com bordas irregulares e quando se encontram em estágio avançado apresentam alterações da pele (NASCIMENTO; SILVA; MACHADO, 2009).
Os principais sinais e sintomas do câncer são nódulo na mama, dor mamária e alterações da pele que recobre a mama, como abaulamentos ou retrações com aspecto semelhante à casca de laranja (INCA, 2006). Muitas evidências comprovam que a alimentação está diretamente relacionada ao aparecimento do CM quando associada a outros fatores, como a resistência insulínica (RI), TRH e SM (CARVALHO et al., 2009).
4.3 ANATOMIA E FISIOPATOLOGIA DO CÂNCER DE MAMA
Para que haja uma melhor compreensão da formação e atuação da célula tumoral nas mamas serão descritos seus aspectos anatômicos e fisiológicos. As mamas estão situadas na parede anterior do tórax, sobre o músculo grande peitoral e são considerados órgãos pares (ARAÚJO; FERNANDES, 2008).
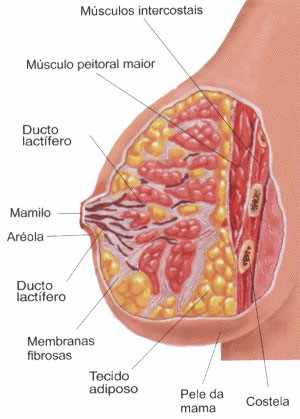
Cada mama, em sua região central possui uma auréola e uma papila. A mama é dividida em quinze a vinte lobos mamários independentes que são separados por tecido fibroso, onde cada um tem a sua via de drenagem, que converge para a papila através do sistema ductal (ARAÚJO; FERNANDES, 2008).
As mamas têm como função principal a produção do leite para a amamentação além de apresentar grande importância psicológica para a mulher em relação a sua auto-estima (AMENDOLA; VIEIRA, 2005).
Na vida adulta ocorre um estimulo cíclico de estrógeno e progesterona que faz com que as mamas fiquem mais inchadas no período pré-menstrual devido à retenção de líquidos no organismo que acaba causando aumento de volume, endurecimento e dor e depois da menopausa, devido a carência hormonal ocorre atrofia glandular e tendência à substituição do tecido parenquimatoso por gordura (ARAÚJO; CORDEIRO; ATHANAZIO, 2007).
A plenitude funcional das mamas ocorre na amamentação com a produção e saída do leite, ou seja, a mulher que não amenta, jamais atinge a maturidade funcional da mama (SILVA; HORTALE, 2012).
4.4 CONCEITO DO CÂNCER DE MAMA
O CM é o resultado da multiplicação desordenada de determinadas células
que se reproduzem em grande velocidade, desencadeando o aparecimento de tumores ou neoplasias malignas, que podem vir a afetar os tecidos vizinhos e provocar metástases (TESSARO et al., 2001). Esse tipo de câncer apresenta-se como uma massa dura e irregular que quando palpada, se diferencia do resto da mama devido a sua consistência (DUARTE; ANDRADE 2006).
A origem ou o desenvolvimento do câncer, se dá pela carcinogênese, acredita-se que mudanças na função de um gene levam as células normais a se transformarem em células cancerosas (JUNIOR, 2004). O gene denominado oncogênese promove o crescimento do tumor, que é causado por um carcinógeno caracterizado como um agente viral, químico ou físico que induz ao câncer (CARVALHO et al., 2009).
4.5 CARCINOGÊNESE
Este processo ocorre lentamente, podendo levar vários anos para que uma célula prolifere e de origem a um tumor visível, sendo um processo celular de pelo menos três etapas: iniciação, promoção, progressão (SILVA, 2006). A iniciação é a primeira etapa, os carcinógenos que são as substancias químicas, fatores físicos e agentes biológicos, fogem dos mecanismos enzimáticos normais e alteram a estrutura genética do DNA celular e nesta fase as células se encontram geneticamente alteradas (GARÓFOLO et al., 2007).
Durante a promoção, que é o segundo estágio da doença, a exposição repetida dos agentes promotores (co-carcinógenos) provocam a expressão das informações genéticas anormais ou mutantes, mesmo depois de longos períodos de latência, esses períodos variam de acordo com o tipo de agente e a dosagem do promotor, bem como as características inatas das células alvo (SILVA, 2006).
O agente promotor altera a expressão da informação genética da célula, potencializando, assim a transformação celular, incluindo hormônios, produtos vegetais e fármacos que por sua vez não causam câncer, mas podem provocar efeitos que são temporários e ou reversíveis (FREITAS et al., 2006). A suspensão do contato com os agentes promotores muitas vezes interrompe o processo neste estágio (CARVALHO et al., 2009)
A progressão é a terceira etapa da carcinogênese celular, cujas alterações celulares que são formadas durante a iniciação e promoção exibem um maior comportamento maligno (ARAÚJO; CORDEIRO; ATHANAZIO, 2007). Essas células demonstram propensão para invadir os tecidos adjacentes e gerar metástase (DUARTE; ANDRADE, 2006), conforme demonstrado na Figura 3, de forma esquemática, as etapas da carcinogênese.
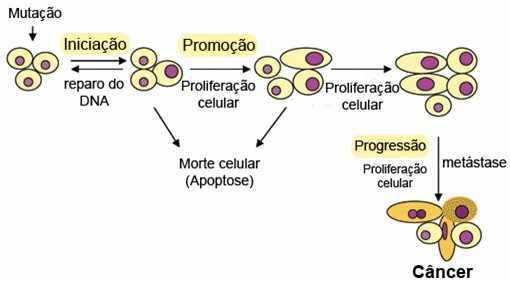
Conforme observado na Figura 3, carcinogênese pode iniciar-se de forma espontânea ou ser provocada pela ação de agentes carcinogênicos (químicos, físicos e biológicos) (FREITAS et al., 2006). O tempo para que a carcinogênese seja completada é indeterminável, podendo ser necessário muitos anos para que se verifique o aparecimento do tumor (BANDERA, 2007).
O câncer é um processo patológico que se inicia quando uma célula anormal é transformada pela mutação genética do DNA celular (BORGES et al., 2008), onde a célula anormal forma um clone e começa a se proliferar, infiltram-se nos tecidos próximos e acessando vasos sanguíneos e linfáticos, os quais são transportados até outras regiões do corpo, sendo este fenômeno chamado de metástase (disseminação do câncer para outras partes do corpo) (BRUNNER; SUDDARTH, 2006).
4.6 MENOPAUSA E RISCO PARA CÂNCER DE MAMA
O termo meia-idade para o sexo feminino é definido entre os 45 e 65 anos próximo ao início da menopausa. Nesta fase ocorrem inúmeras transformações tanto no corpo quanto na mentalidade da mulher é neste momento que se inicia o processo de envelhecimento com o declínio da quantidade circulante de hormônios que são responsáveis por regular o metabolismo (VIGETA; BRETAS, 2007).
A diminuição dos níveis hormonais no decorrer da vida é, portanto, fisiológica, tanto em homens quanto em mulheres, fazendo parte do processo natural de envelhecimento. Entretanto nas mulheres, isto ocorre devido à progressiva diminuição da atividade ovariana, visto que o ovário é o responsável pela secreção dos hormônios femininos (MORI; COELHO; ESTRELLA, 2006).
Alguns sintomas clínicos podem ser observados devido ao hipoestrogenismo, que são quadros considerados patológicos como: alterações tróficas da pele e da mucosa vaginal, caracterizadas principalmente pela atrofia dos grandes lábios e pela alteração do padrão de pelos da vulva, além da diminuição da espessura do epitélio vaginal e ressecamento da mucosa vaginal (ALMEIDA, 2005). A mulher também fica mais suscetível a fraturas, distúrbios psicológicos como perda da libido e insônia, modificação do perfil lipídico como o aumento dos níveis de triglicerídeos e colesterol LDL e diminuição do colesterol HDL, fogachos, que são ondas de calor repentinas que passam pelo corpo (PARDINI, 2007).
O climatério que é o conjunto formado por todas estas mudanças biológicas é conceituado como a fase de transição que fica entre a fase reprodutiva e não reprodutiva nas mulheres, devido ao esgotamento dos folículos ovarianos e por consequência o declínio na produção de estrógenos, que irá ocasionar a menopausa, com o encerramento da menstruação (ALMEIDA, 2005).
A menopausa é dividida em duas etapas: A perimenopausa que é caracterizada pelo surgimento e continuidade de ciclos menstruais irregulares e na pós-menopausa quando ocorre a cessação total dos ciclos menstruais (GODINHO; KOCH, 2007).
Devido as alterações causadas pela menopausa, a mulher é vista de uma forma geral como alguém que perdeu a juventude e a vitalidade, devendo buscar alternativas na medicina como a terapia de reposição hormonal, para a melhora dos sintomas e promoção da saúde (VERAS; RASSI; VALENÇA, 2006).
4.7 TERAPIA DE REPOSIÇÃO HORMONAL: TIPOS E RISCOS PARA O CÂNCER DE MAMA
Atualmente TRH é um tema controverso por dividir opiniões da comunidade científica entre defensores e críticos em proporções iguais, visto que a terapia com estrógenos pode apresentar tanto benefícios quanto riscos para a mulher menopáusica (PEREIRA, 2006).
A substituição adequada de estrógeno em mulheres na pós-menopausa representa uma parte significativa da medicina preventiva, no alívio oportuno de sintomas vasomotores, transtornos do sono, secura vaginal, redução e perda da massa óssea com uma diminuição significativa do risco de fraturas (ZAHAR; CONDE; NETO, 2005). Segundo Pardini (2007), a utilização dos estrogênios e progestogênios poderiam reduzir em torno de 50% o risco de doença cardiovascular e infarto do miocárdio devido a modificação do perfil lipídico.
Apesar dos benefícios da TRH, a aceitação ainda não está suficientemente difundida para assegurar seus efeitos preventivos a longo prazo, especialmente nas mulheres assintomáticas (PARDINI, 2007).
Em relação aos riscos alguns tem sido evidenciado com o uso da TRH, devido ao fato de algumas neoplasias mamárias responderem aos antiestrógenos na pós menopausa. A síntese de estrógeno dentro do tecido mamário continua elevada depois da menopausa, suficiente para estimular a proliferação de células malignas com receptores que são positivos para estrógenos (FINATO; NAKAZONE; FRANÇA, 2005).
Na maioria dos estudos sobre o assunto, não se tem consenso sobre o seu uso com o risco de aumento da incidência do CM durante ou após a dose recomendada para reposição estrogênica, embora alguns estudos tenham mostrado a relação do uso prolongado da TRH com doses altas desnecessárias no aparecimento do CM (RÉZIO; SOUZA; TOLOI, 2007).
Embora o estrógeno esteja disponível a mais de seis décadas, ainda permanecem muitas dúvidas quanto aos riscos e aos benefícios da TRH. De acordo com a Sociedade Brasileira de Endocrinologia (SBEM) milhares de mulheres são tratadas com TRH para o alivio dos sintomas menopáusicos (ARANHA; AZEVEDO; WERNECK, 2008).
O grau de associação entre o CM e a TRH ainda é muito discutido, entretanto alguns estudos com grau de evidencia A, diz que a administração de estrógeno isolado ou associado à progesterona de aumentar a Percentagem de Densidade Mamaria (PMD) em 3% a 5% (KONGNYUY; NORMAM, 2010). Os riscos entre as usuárias de TRH para o desenvolvimento do CM torna-se aumentado quando a duração do tratamento se estende após os 5 anos de terapia, período este considerado máximo pelo Food and Drug Administration (FDA, 2012). Para as pacientes com histórico familiar de CM é necessário adotar uma cautela maior quanto a decisão de realizar a TRH (HINDS; PRICE, 2010).
Diante do exposto a TRH é um tratamento importante para mulheres que sofrem de sintomas mais graves oriundo da fase do climatério, portanto deve ser feito o acompanhamento médico rigoroso durante todo o período devido aos vários efeitos colaterais severos (ROZENFELD, 2007).
A escolha do tratamento para as pacientes no climatério varia com base em inúmeros fatores, devendo-se levar em conta a individualidade de cada mulher, como cultura, grau e conhecimento, nível de vida, sedentarismo e nível de atividade física (NAHAS et al., 2012).
Uma avaliação completa deve ser realizada, em relação a antecedentes pessoais decorrentes do climatério e o período em que a mulher se encontra, ou seja, se está na peri-menopausa ou pós-menopausa (ROZAS, 2005). A escolha da melhor forma e via de administração hormonal irá assegurar que muitas mulheres venham a viver mais e de uma forma melhor (PEDRO; PINTO; COSTA, 2004). A administração hormonal poderá ser feita pela a via oral, ou parenteral que pode ser cutânea (sob a forma de adesivos ou gel), implante subcutâneo, injetável, vaginal, retal ou sublingual (COSTA; HOROVITZ; SANTOS, 2006).
Qualquer que seja a via utilizada, objetiva-se atingir níveis sanguíneos hormonais fisiológicos, correspondendo à quantidade de estrogênios produzidos pelos ovários no início de um ciclo menstrual normal, para exercer a proteção cardiovascular, a manutenção da massa óssea, melhorar os sintomas relacionados à função cerebral e aliviar a maioria dos sintomas climatéricos (COSTA; HOROVITZ; SANTOS, 2006).
Existem vários tipos de terapia de reposição hormonal onde a terapia com estrogênio isoladamente é ideal porque é o hormônio que deixou de ser produzido pelo ovário, sendo responsável por todos os sintomas climatéricos, porém ele só deverá ser utilizado nos casos em que a paciente já teve seu útero retirado (pacientes histerectomizadas) (ROZAS, 2005).
O uso deste tipo de terapia em pacientes com útero, levará a um estímulo constante do endométrio, induzindo um crescimento anormal desta camada, denominada hiperplasia endometrial, que poderá causar depois de um certo tempo riscos para hemorragia, necessitando de internação e num caso mais grave pode se tornar um carcinoma do endométrio (PINHO; COUTINHO, 2007).
Outra forma de terapia é a combinação entre estrogênio e progestogênio, cuja a associação destes dois hormônios é a forma clássica da reposição hormonal, sendo utilizados na maioria das pacientes (SBEM, 2014). Estes podem ser administrados de duas maneiras diferentes: de forma combinada sequencial, quando os estrogênios são administrados por via oral ou transdérmica, durante 20, 21 ou 25 dias, intercalados, por uma semana de descanso ou ininterruptamente, sendo o progestogênio, acrescentado nos últimos 10, 12 ou 14 dias do estrogênio (LEÃO; DUARTE; FARIAS, 2005).
Na forma combinada contínua os estrogênios e o progestogênio são administrados simultaneamente, de forma ininterrupta, com a característica de suspender a menstruação da paciente, o que torna aparentemente ideal, devido ao sangramento menstrual que é um incômodo onde a maioria das pacientes gostariam de ficar livres do mesmo (PINHO; COUTINHO, 2007). Este método não é o melhor, é sem dúvida o mais cômodo, porém não traz todos os benefícios que os estrogênios isolados ou combinados oferecem a mulher (URDINOLA, 2008).
A terapia com androgênio também é bastante utilizada, onde esteroides com ação virilizante, sendo o mais importante representante, a testosterona, principal hormônio masculino e produzido pelo testículo, por se precursor do estradiol, um hormônio feminino potente (ROZENFELD, 2007).
A testosterona possui importante papel na libido e também é responsável pelo bem-estar e disposição geral e quando a mulher entra na menopausa, seu ovário para de produzir estrogênios porque não possui mais folículos (onde a testosterona é transformada em estradiol, contudo, todo ovário na pós-menopausa continua produzindo testosterona e neste sentido se assemelha ao testículo (VEERKOOIJEN, et al., 2009).
A testosterona ovariana é de suma importância neste período climatérico, pois contribuirá para a disposição geral e na manutenção do desejo sexual por isso diante do exposto, pode se destacar a necessidade de se acrescentar pequenas doses de testosterona em mulheres que tiveram seus ovários retirados (CRANNEY; WELLS, 2005). Vale ressaltar que antes de se iniciar qualquer tratamento hormonal, é obrigatório fazer um exame clínico e ginecológico afim de se afastar doenças preexistentes além disso, deverá ser avaliada a pressão arterial, peso, colesterol total e suas frações, triglicerídeos, glicemia e eventualmente a função tireoidiana (T4 e TSH) (ROZENFELD, 2011).
4.8 SÍNDROME METABÓLICA: RELAÇÃO DO CONSUMO DE CARBOIDRATOS REFINADOS E RISCO PARA O CÂNCER DE MAMA
4.8.1 SÍNDROME METABÓLICA – CONCEITO
A SM é um conjunto de doenças que associadas, vão levar ao aumento de risco de problemas cardiovasculares, alterações de colesterol, triglicerídeos e glicemia (GALLUS; BOSETTI; FRANCESCHI, 2006).
A hipersensibilidade aos glicocorticoides induz hiperglicemia e ou hiperinsulinemia, que a longo prazo resulta em resistência à insulina e diabetes mellitus tipo II, com o aumento da secreção de angiotensina II, que induz hipertensão, aumento da secreção de Interleucina-6 (IL-6) e elevação dos triglicerídeos (TG) podem aumentar o risco de arteroesclerose aumentando o risco cardiovascular (YUSUF; HAWKEN; OUNPUU, 2010).
Não há consenso sobre a melhor definição de SM a ser utilizada, porém, a mais empregada pelos nutricionistas é a International Diabets Association (IDA, 2005), cujos critérios de classificação são obesidade visceral, associada à pelo menos, dois outros fatores de risco, como pressão arterial elevada e dislipidemias (MAITI; KUNDRANDA; SPIRO, 2010). Algumas definições além da IDA foram propostas para SM, a primeira delas da Organização Mundial de Saúde (OMS), considera a resistência insulínica como fator indispensável a seu diagnóstico. Uma segunda definição foi elaborada posteriormente pelo National Cholesterol Education Program – Adult Treatment Panel III (NCEP-ATP III), por apresentar maior aplicabilidade clínica, mais recentemente a Federação Internacional de Diabetes (IDF) propôs nova definição, na qual a presença de gordura visceral se torna o principal fator para o diagnóstico da SM (National Cholesterol Education Program – NCEP-ATP III,2001). No quadro 1 estão descritos os critérios mais utilizados para definição de SM de acordo com as Diretrizes da OMS, IDF e NCEP.
Tabela 1: Critérios para diagnosticar síndrome metabólica
| OMS | IDF | NCEP*** | |
| Obesidade | Relação cintura/quadril > 0,9 em homens e > 0,85 em mulheres e/ou IMC >30 kg/m² | Cintura abdominal > 94cm em homens asiáticos e > 80 cm em mulheres**** | Cintura abdominal> 102cm em homens e 88cm em mulheres. |
| Glicose plasmática | Diabetes, intolerância glicídica ou resistência à insulina comprovada pelo clamp* | ≥ 100 mg/dl ou diagnóstico prévio de diabetes. | ≥ 110 mg/dl |
| Triglicerídeos | ≥ 150mg/dl** | ≥ 150mg/dl ou tratamento para dislipidemia. | ≥ 150mg/dl. |
| HDL | < 35 mg/dl em homens e < 39mg/dl em mulheres | < 40 mg/dl em homens ou < 50 mg/dl em mulheres ou tratamento para dislipidemia. | < 40 mg/dl em homens e < 50 mg/dl em mulheres. |
| Pressão arterial | Pressão sistólica ≥ 140 mmHg ou diastólica ≥ 90 mmHg, ou tratamento para hipertensão arterial. | Pressão sistólica ≥ 130 mmHg ou diastólica ≥ 85 mmHg, ou tratamento para hipertensão arterial. | Pressão sistólica ≥ 130 mmHg ou diastólica ≥ 85 mmHg. |
| Outros | Excreção urinária de albumina ≥ 20 mcg/ ou relação albumina/creatina ≥ 30mg/g. |
Adaptada de fonte: Federação Internacional de Diabetes (IDF), 2005.
*Dois fatores e obrigatoriamente o componente assinalado; **Tanto triglicerídeos elevados ou HDL baixo constituem apenas 1 fator pela OMS; *** Componente obrigatório; **** Presença de três ou mais componentes citados; IDF: International Diabetes Federation; NCEP: National Cholesterol Eduaction Program; OMS: Organização Mundial da Saúde.
4.8.2 RELAÇÃO ENTRE CÂNCER DE MAMA E SÍNDROME METABÓLICA
A relação entre CM e SM são mais prevalentes em mulheres na pós menopausa e sua cito patogenia ainda não está esclarecida, mas sabe-se que está relacionada ao aumento de produção e ao tempo de exposição a níveis elevados de hormônios específicos como o estrogênio, a insulina e IGF-1, associado à proliferação das células mamárias e possivelmente a sua transformação em células malignas (PIERCE et al., 2009).
De acordo com os autores, mesmo que muitos fatores envolvidos tenham denominações complicadas pode-se afirmar que a elevada taxa de insulina tem como consequência a SM, e se faz presente na participação das etapas fisiopatológicas do CM (BRAUN; WORMS; LEROITH, 2011). A Figura 4 mostra a relação de risco metabólico associado a RI no CM.
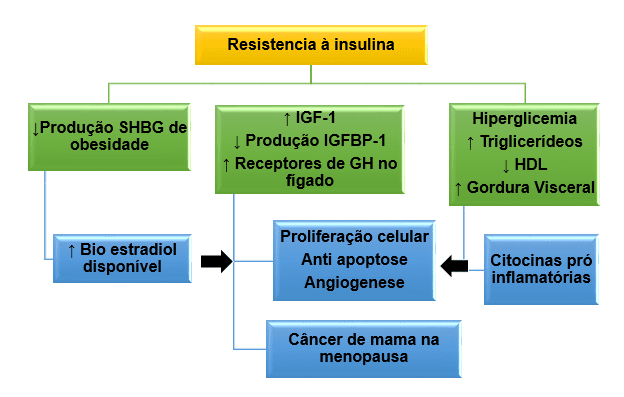
O risco metabólico aumenta a RI na indução do CM conforme descrito na figura 4, devido ao aumento dos casos de obesidade ocorre o acúmulo do tecido adiposo, fazendo com que eleve os níveis de aromatase, aumentando a síntese de estrogênio (CAMERON; BOYKO; SICREE, 2008). Além disso, a obesidade, a hiperinsulinemia e os níveis elevados de IGF-1 são capazes de reduzir a produção de globulina ligadora de hormônios sexuais (SHBG), o que também eleva a biodisponibilidade de estrogênios (MORTILO; FILION; GENEST, 2010).
Os caminhos do receptor de IGF-1 (IGF-1R) e receptor de estrogênio (ER) sinergizam na ativação da proteína quinase que é ativada por mitogênio (MAPK). Demonstrou-se que o estrogênio é capaz de induzir a expressão do IGF-1R, bem como os substratos dos receptores de insulina (IRS-1 e IRS-2) (ROSENBAUM, 2003).
Os efeitos do estrogênio conduzem a uma fosforilação do IRS-1 e, portanto, aumentam a da MAPK que irá estimular o IGF-1 nas células de tumor das mamas (ESPOSITO; CERIELLO; GIULIANO, 2007). A leptina, a insulina, o fator de necrose tumoral alfa (TNF-α) e a Interleucina 6 (IL-6) são conhecidos como indutores da aromatase e, consequentemente irão estimular a biossíntese de estrogênio e diante do exposto, pode-se explicar a interrelação do câncer de mama em pacientes com SM.
4.8.3 TIPOS DE CARBOIDRATOS E RISCO PARA O CÂNCER DE MAMA
Os carboidratos são divididos em carboidratos simples e carboidratos complexos, sendo os carboidratos simples, açúcares encontrados naturalmente em alimentos tais como sacarose, frutose e glicose que podem ser encontrados em frutas e sucos de frutas, refrigerantes, alguns legumes, pão branco, arroz branco, massas, leite e produtos lácteos, a maioria dos salgadinhos, doces, entre outros da mesma classe (PADILHA, 2011).
De acordo com pesquisadores da Universidade da Califórnia, San Francisco, o açúcar representa grande risco para a saúde de aproximadamente 35 milhões de pessoas no mundo (VICTOR et al., 2011) e atualmente o açúcar está sendo considerado uma substancia potencialmente tóxica, assim como álcool, o sal e o tabaco capazes de contribuírem para o aparecimento de doenças, assim como diabetes, SM, hiperglicemia e hipoglicemia, hipertensão, refluxo gastresofágico (RGE), doenças cardíacas e câncer (VICTOR et al., 2011)
Os carboidratos refinados estão fortemente ligados ao câncer, não apenas como uma causa indutora do mesmo, mas também como fonte de combustível para células cancerosas (FOWKE; LONGCOP; HEBERT, 2004).
A relação da alta ingestão de carboidratos refinados com o CM pode elevar os níveis de insulina, que pode aumentar o tecido adiposo, que produz citocinas pró inflamatórias, promotoras da proliferação de células tumorais, através da via de sinalização de insulina (IGF-1), fazendo com que as células do tecido mamário se dividam rapidamente o que aumenta o risco de CM (MANTOVANI et al., 2008).
Uma célula cancerosa necessita de glicose para se proliferar, portanto, qualquer indivíduo que pretenda minimizar o risco de aparecimento do câncer precisa reduzir o consumo de açúcares em sua dieta (KLEMENT; KAMMERER, 2011).
4.9 ALIMENTOS FUNCIONAIS NA PREVENÇÃO DO CÂNCER DE MAMA
A dieta representa um novo paradigma no estudo dos alimentos, nesse contexto compreende-se que a alimentação adequada exerce um papel importante na prevenção de doenças, além de fornecer energia e nutrientes essenciais para o bom funcionamento do organismo (KUCUK, 2002). Ademais deve se enfatizar a importância dos alimentos funcionais que se identificam pela promoção de efeitos fisiológicos benéficos que podem prevenir ou retardar doenças tais como as cardiovasculares, câncer, obesidade, dentre outras (HERBET; EBBELING; OLENDZKI, 2005).
O conceito de alimentos funcionais é amplo e defende a sua posição de que a dieta pode controlar e modular as variadas funções orgânicas, contribuindo para manutenção da saúde e reduzindo o risco de acometimentos por morbidades, vale ressaltar que os alimentos funcionais não são destinados ao tratamento ou cura de doenças e sim na prevenção (WYNDER; COHEN; MUSCAT 2006). As resoluções da ANVISA 16, 17, 18, 19 definem estes alimentos como “aquele semelhante em aparência ao alimento convencional, consumido como parte da dieta usual, capaz de produzir efeitos metabólicos e/ou fisiológicos demonstráveis, úteis na manutenção de uma boa saúde física e mental, podendo auxiliar na redução do risco de DCNT, além de funções nutricionais básicas”.
Os alimentos e ingredientes funcionais podem ser classificados de dois modos: quanto à fonte, de origem vegetal ou animal, ou quanto aos benefícios que oferecem, atuando em seis áreas do organismo: no sistema gastrointestinal; no sistema cardiovascular; no metabolismo de substratos; no crescimento, no desenvolvimento e diferenciação celular; no comportamento das funções fisiológicas e como antioxidantes (COHEN, 2007).
Uma grande variedade de produtos tem sido caracterizada como alimentos funcionais, incluindo componentes que podem afetar inúmeras funções corpóreas, relevantes tanto para o estado de bem-estar e saúde como para a redução do risco de doenças (PADILHA; PINHEIRO, 2004). Estes alimentos ou compostos não se incluem na categoria de suplementos alimentares, mais exercem seu papel benéfico, em relação as doenças e na redução dos riscos delas, atuando na prevenção (ROSENBERG; VANDORME; ANTOINE, 2013).
Recentemente atenção maior vem sendo dada à prevenção do CM utilizando alimentos funcionais como compostos quimiopreventivos, visando reduzir a incidência de morte (TERRY; JAIN; MILLER, 2008). Entretanto, a quimioprevenção com suplementos dietéticos, vitaminas e minerais e fitoquímicos atuam potencialmente com mecanismos de ação anticarcinogêncos, como os antioxidantes, antiinflamatórios, anti-hormonais, antiangiogênicos, entre outras (HANKINSON; SPEIZER et al.,2009).
4.9.1 LEGISLAÇÃO ALIMENTOS FUNCIONAIS
O termo “alimentos funcionais” foi primeiramente introduzido no Japão como ingredientes que auxiliam em funções especificas do corpo, além de serem nutritivos, sendo estes alimentos definidos como “Alimentos para uso específico de saúde” (Foods for Specified Health Use-FOSHU) (GARÓFOLO, 2013).
A definição de que alimento funcional pode ser classificado como alimento é aceita nos EUA, Europa e também no Brasil, nessa perspectiva, o alimento funcional deve apresentar primeiramente as funções nutricional e sensorial, sendo a funcionalidade, a função terciária do alimento (TERRY et al., 2002).
No Brasil, o Ministério da Saúde (1999), através da Agência Nacional de Vigilância Sanitária (ANVISA), regulamentou os Alimentos Funcionais através das seguintes resoluções: ANVISA/MS 16/99; ANVISA/MS 17/99; ANVISA/MS 19/99, cuja essência é:
a) Resolução da ANVISA/MS 16/99 – Trata de procedimentos para registro de alimentos e ou novos ingredientes, sem necessitar de um Padrão de Identidade e Qualidade (PIQ) para registrar um alimento (BRASIL, 1999);
b) Resolução da ANVISA/MS 17/99 – Aprova o regulamento técnico que estabelece as diretrizes básicas para avaliação de risco e segurança de alimentos que prova, baseado em estudos e evidências científicas, se o produto é seguro sem oferecer risco à saúde (BRASIL, 1999);
c) Resolução ANVISA/MS 18/99 – Estabelece as diretrizes básicas para a análise e comprovação de propriedades funcionais e/ou de saúde, alegadas em rotulagem de alimentos (BRASIL, 1999);
d) Resolução ANVISA/MS 19/99 – Aprova os procedimentos para registro de alimentos com alegação de propriedades funcionais e ou de saúde em sua rotulagem (BRASIL, 1999).
Com base na legislação o registro de um alimento funcional só pode ser realizado após comprovada a alegação de propriedades funcionais ou de saúde com base no consumo previsto ou recomendado pelo fabricante, na finalidade, condições de uso e valor nutricional, quando for o caso ou na(s) evidência(s) científica(s) tais como, composição química ou caracterização molecular, quando for o caso, e ou formulação do produto; ensaios bioquímicos; ensaios nutricionais e ou fisiológicos e ou toxicológicos em animais de experimentação; estudos epidemiológicos; ensaios clínicos; evidências abrangentes da literatura científica, organismos internacionais de saúde e legislação internacionalmente reconhecidas sob propriedades e características do produto e comprovação de uso tradicional, observado na população, sem associação de danos à saúde (BRASIL, 1999). Na tabela 2 estão relacionados os alimentos funcionais e suas propriedades nutricionais e sua atuação no organismo de acordo com a ANVISA.
Tabela 2: Alimentos funcionais e suas propriedades
| ALIMENTOS | COMPOSTO | AÇÃO NO ORGANISMO |
| Abóbora, cenoura, mamão, manga, damasco, espinafre, couve, entre outros. |
Betacaroteno |
Antioxidante ↓ rico de doenças cardiovasculares e câncer. |
|
Tomate, melancia, goiaba e mamão. Geralmente alimentos de cor avermelhada |
Licopeno (se ingerido regularmente) |
↓o risco de câncer de próstata e pulmão, e ajuda a impedir e reparar os danos às células causados pelos radicais livres. |
| Frutas, legumes, verduras e alimentos integrais. |
Fibras |
↓do risco de câncer intestinal e dos níveis de colesterol |
| Suco natural de uva, maracujá e vinhos tintos. |
Flavonóides |
Antioxidantes que ↓ risco de câncer e de doenças cardiovasculares |
|
Soja |
Isoflavonas |
↓ níveis de colesterol e o risco de doenças cardiovasculares |
| Peixes e óleo de peixe |
Ácido graxo e ômega 3 |
↓níveis de colesterol e doenças cardiovasculares |
| Iogurte e leite fermentado. |
Pró-bióticos |
Auxiliam no equilíbrio da flora intestinal e inibem o crescimento de microrganismos patogênicos |
Fonte adaptada de: http://www.anvisa.gov.br/alimentos/comissoes/tecno_lista_alega.htmAgência. Acesso em 11/12/2016.
5. METODOLOGIA
O estudo foi elaborado a partir de uma revisão sistemática da Literatura, com busca de artigos indexados dos últimos 10 anos nas línguas portuguesa e inglesa, cuja busca foi realizada nas bases de dados Pubmed, Scielo, Lilacs e Google Acadêmico, bibliotecas virtuais além de sites governamentais sobre câncer. As palavras-chave utilizadas para a busca de artigos serão “Câncer”, “Câncer de Mama”, “Síndrome Metabólica”, “Carboidratos Refinados e risco de Câncer de Mama”, “Terapia Hormonal”, “Menopausa”, “Dieta e risco de Câncer”, “Alimentos funcionais e CM”.
Dentre os 109 artigos pesquisados, 22 artigos (n=22) se tratavam de CM, 14 sobre TRH (n=14), 16 artigos sobre SM (n=16), 17 artigos sobre dieta e câncer (n=17), 20 artigos sobre menopausa (n=20) e 6 tratavam-se de carboidratos refinados e câncer de mama (n=6). Destes, 96 foram lidos integralmente com alguns dados relevantes utilizados (n=96), 8 tiveram todos os dados utilizados na pesquisa (n=8), uma dissertação de mestrado teve seus dados utilizados (n=1) e 12 artigos não estavam disponíveis para pesquisa (n=12). O fluxograma da pesquisa está descrito abaixo.
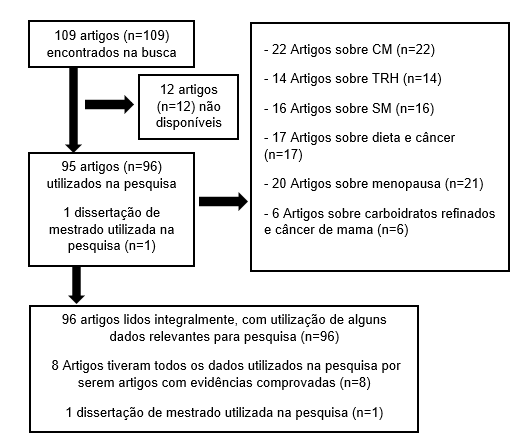
Figura 5 – Fluxograma da pesquisa, de acordo com os critérios de inclusão.
6. RESULTADOS E DISCUSSÃO
Foram identificados 109 artigos (n=109) a partir do ano de 2006, publicados nas Bases de dados Lilacs, Pubmed, Scielo, Google Acadêmico e sites governamentais. Sendo 95 artigos (n=95) e uma dissertação de mestrado (n=1) da seleção de 95 artigos (n=95), oito artigos (n=8) foram utilizados na pesquisa integralmente e 1 dissertação de mestrado (n=1).
Desses oito estudos selecionados, seis (n=6) falaram sobre a relação do câncer de mama com a síndrome metabólica, câncer de mama e dieta, e terapia de reposição hormonal, sendo todos revisões de literatura. O restante (n=2) foram estudos clínicos sobre câncer de mama e terapia de reposição hormonal. No quadro abaixo estão relacionados os estudos realizados respectivamente.
Quadro 1. Estudos selecionados para a pesquisa de Revisão Sistemática, em língua portuguesa.
| Autor (es) | Revista/ Ano da publicação | Amostra estudada/tipo de estudo | Principais resultados |
| Feitosa et al., 2012. | Rev. Bras. Clínica Médica. | Revisão de literatura
58 artigos científicos |
Pouco conhecimento sobre interação etiopatogênica entre CM e SM
Evidências apontam para correlação de risco entre as afecções, com piores prognósticos para mulheres com SM=rastreamento precoce de mulheres para CM. |
| Buttros et al, 2013. | Rev. Bras. de Mastologia. | Revisão de literatura | SM=↑ risco de câncer de mama na pós-menopausa;
Mulheres com CM na pós-menopausa tem mais riscos de desenvolver SM; Mulheres com SM e CM= piores prognósticos oncológicos; |
| Nahas et al., 2012 | Rev. Bras. Ginecol. Obstet. | Estudo clínico
♀ n= 158 na pós-menopausa em tratamento de câncer de mama |
A obesidade abdominal foi relacionada ao surgimento da SM e com risco para CM;
Promoção do estilo de vida saudável e inclusão de atividade física ↓ dois principais marcadores da síndrome metabólica (insulina e gordura abdominal). |
| Deus et al., 2009. | Rev. Elet. Ext.
Mat. Carmela Dutra RJ |
Estudo clínico
♀ n=20 recém-diagnosticadas com câncer de mama |
Relação do IMC médio do grupo foi de (28,6 kg/m²=sobrepeso)
60% das amostras dos autoresestavam acima do peso ideal. |
| Garófalo et al, 2004. | Rev. Nutr.
Campinas. |
Revisão de literatura | Benefícios da mudança de estilo de vida, incluindo hábitos alimentares e prática de atividade física ↓ a redução da incidência e mortalidade por câncer;
Alimentos funcionais= responsáveis por mecanismos anticarcinogênicos. |
| Padilha e Pinheiro, 2004 | Rev. Bras. de Cancerologia. | Revisão de literatura | Relação entre dieta e CM, porém carece de esclarecimentos;
Quimioprevenção por meio de alimentos funcionais surge como ferramenta de controle e prevenção do CM; |
| Pardini, 2014 | Arquiv. Bras. de Endocrinologia Metabólica. | Revisão de literatura | Estudos observacionais de efeitos metabólicos e vasculares da TRH com estrógenos= potenciais benefícios na redução de riscos de doenças vasculares;
Estudos randomizados e controlados não demonstram evidências de que a TRH seja benéfica às mulheres com doença vascular; ↑ de risco de desenvolver CM e doença tromboembólica; Riscos são cumulativos em relação ao tempo de uso da TRH. |
| Albuquerque e Tocci, 2000 | Rev. Enf. UNISA. | Revisão de literatura
Não informado |
Resultados biológicos e epidemiológicos inconclusivos sobre a TRH ↑ do risco de desenvolvimento do CM |
Em relação aos estudos consultados, ficou demonstrado que o câncer de mama foi considerado, a principal causa de morte entre as mulheres, representando um grande problema de saúde pública no Brasil, onde os principais fatores de risco para o seu desenvolvimento estão relacionados com a idade avançada, características reprodutivas, história familiar e social, hábitos de vida e influências ambientais (TERRY et al., 2008)
Em relação a síndrome metabólica a maioria dos estudos demonstrou elevada frequência de síndrome metabólica entre mulheres na pós menopausa com câncer de mama. Em um estudo prévio feito por Nahas et al., (2012) foi observado que 48,1% destas mulheres apresentavam risco de desenvolver SM, superior ao observado em mulheres sem câncer de mama e de mesma faixa etária que foi de 39,6%.
Deus et al. (2009) detectaram SM em mulheres na pós menopausa com CM, sendo a obesidade abdominal o critério mais frequente (TERRY et al., 2008). Em um estudo anterior no Brasil (SILVA, 2012) que avaliaram 81 mulheres (n=81, idade entre 40-80 anos) com diagnóstico recente de câncer de mama comparadas a Grupo Controle de mulheres sem a doença, observaram que houve ocorrência e relação de CM em 59,2% e 37% com SM nos grupos, respectivamente. Adicionalmente outro estudo anterior mostrou prevalência de 39% de SM entre 105 mulheres na pós menopausa com diagnóstico recente de CM (RIDKER, 2003).
A obesidade abdominal e redução do HDL colesterol estão entre os principais contribuintes para o aumento da SM em mulheres, principalmente com 45 anos ou mais idade, revelando o possível efeito da menopausa no estabelecimento da SM (HEALY et al., 2010).
Conforme demonstrado nestes trabalhos, pacientes na pós menopausa com SM apresentam elevado risco de desenvolver CM, portanto, o rastreamento e seguimento dessas mulheres deveria incluir a monitorização do peso, com incentivo a dieta e exercício físico, controle da pressão arterial e do perfil lipídico e glicídico, para promover intervenção precoce e melhorar a qualidade e a sobrevida de mulheres na pós menopausa com CM (HEALY et al., 2010).
Em relação a TRH, não houve consistência de seu uso ou não, pois a associação do CM com a TRH continua controverso (ANDERSON et al.,2004). Entretanto como grau de evidencia A, foi a administração de estrógeno isolado ou associado a progesterona aumenta o risco de CM.
No estudo controlado realizado pela Women’s Health Initiative (WHI), não foi observado nenhum risco de CM em mulheres que fizeram uso de estrógeno isolado por até sete anos, levando-se em conta que a maioria das participantes do estudo WHI possuíam sobrepeso ou obesidade (ROSSOUW et al.,2002). Dados do WHI sugerem que a administração exclusiva de estrógeno por longo período, por sete e quinze anos respectivamente, não aumentou o risco de CM em mulheres (ANDERSON et al.,2004).
Uma observação atual é que o uso de estrógeno isolado por menos de cinco anos pode reduzir o risco de CM em pacientes que iniciaram a TRH muitos anos após a menopausa e informações oriundas do estudo Surveillance Epidemioly and End Results (SEER) mostraram que mulheres com idade entre 50 e 54 anos tinham 13/1.000 de chance de desenvolver câncer após cinco anos de menopausa, enquanto aquelas que iniciaram a estrogenioterapia após cinco anos apresentaram 2,59/1.000 (SANTEN et al., 2010). Uma possível explicação para o fato seria o estrógeno induzindo a apoptose, ou seja, as células cancerígenas da mama em deprivação estrogênica, por longo tempo em meio de cultura se adaptariam a estas condições e tornariam-se sensíveis aos efeitos pró-apoptóticos do estradiol, em mulheres esse efeito pró-apoptóticos paradoxal poderia encolher o tamanho de tumores ocultos, já existentes, e reduzir a taxa de detecção clínica tardia dos cânceres (ROSENBERG; VANDROMME; ANTOINE, 2013).
Segundo o Consenso Brasileiro de Terapêutica Hormonal da Menopausa, (2014), não existem dados suficientes para avaliar as possíveis diferenças na incidência de CM e a genética individual identificará as pacientes que possui risco real para o CM, contudo, a TRH continua sendo a terapêutica de escolha para os sintomas da menopausa e sua segurança depende da boa indicação, monitorização e individualização, pelo médico.
Diante do que foi discutido, a gênese e a progressão do CM parecem estar extremamente relacionadas a hábitos alimentares e estilo de vida e como constatado anteriormente, a dieta interfere de uma forma benéfica para a prevenção do câncer (ROSENBERG; VANDORMME; ANTOINE, 2013).
Estudo anterior evidenciou que há relação entre nutrição equilibrada e a sobrevida, após o diagnóstico de CM, onde enfatizam os efeitos benéficos dos fitoquímicos presentes em alguns alimentos, pela atividade antioxidante que exercem nas gônadas, diminuindo o risco de progressão do CM (ROCK; DEMARK, 2006).
Os agentes quimiopreventivos encontrados nos alimentos funcionais podem ser utilizados, pelo potente efeito preventivo, com diversos mecanismos de ação, entre eles o bloqueio da carcinogênese (VICTOR, 2011). O papel da gordura dietética no desenvolvimento do CM também se correlaciona com o consumo excessivo de gorduras de baixa qualidade, com o aumento dos índices de CM (GARÓFOLO, et al.,2013). Portanto, a quimioprevenção através dos alimentos funcionais pode ser um importante instrumento na prevenção e controle do CM, sugerindo mecanismos de ação anticarcinogenicos, antioxidante, anti-inflamatório, anti-hormonais, antiangiogenicos, entre outros (CARVALHO, 2009).
Há estudos epidemiológicos inconclusivos e/ ou insuficientes na identificação do papel dos alimentos funcionais na prevenção e controle do CM, portanto os guias alimentares podem ser interessantes, pois sugerem a adoção de uma dieta saudável e variada, rica em vegetais, frutas, grãos integrais e sem excesso de consumo de gordura saturada, ademais, ofereçam componentes alimentares com possível efeito benéfico na prevenção e na redução do risco de recorrência de CM. (PADILHA; PINHEIRO, 2011).
Os alimentos funcionais foram citados por autores como fatores preventivos, com ação antioxidante e antinfalamtória para a doença. No quadro 2 abaixo estão descritos algumas ações de alguns alimentos na quimioprevenção para o CM.
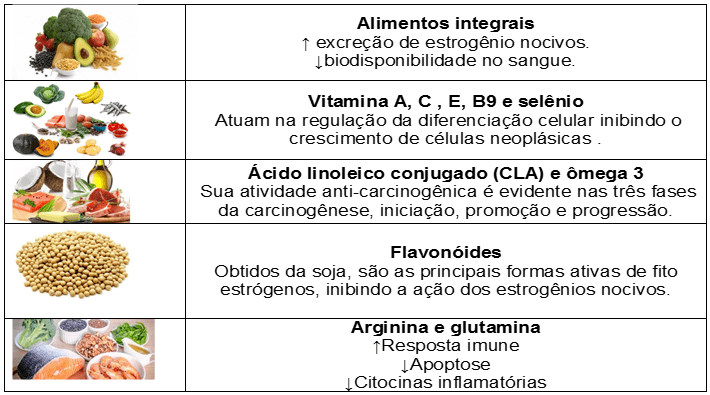
Diante do exposto, é possível observar o quanto é importante para saúde ter uma alimentação saudável, a ingestão de alimentos funcionais é só mais uma estratégia para prevenir e controlar o CM (KUCUK, 2002), lembrando que esses alimentos não impedem o aparecimento da doença, mas atuam ajudando na prevenção e no fortalecimento do organismo, caso a doença surja (HANKINSON; SPEIZER et al., 2009).
CONSIDERAÇÕES FINAIS
A presente revisão demonstrou o CM afeta inúmeras mulheres no país, especialmente aquelas na menopausa, apesar de alguns estudos inconclusivos sobre a relação do câncer no corpo humano ainda não serem totalmente esclarecidas, mesmo com fatores de risco genéticos e ambientais estarem associados ao aparecimento da doença.
Por outro lado, foi verificado na presente revisão que a SM, o consumo de carboidratos de alto índice glicêmico e gorduras saturadas estiveram relacionados ao aparecimento do CM, sendo a dieta equilibrada e funcional de extrema importância na prevenção e controle da doença e que a TRH, sem acompanhamento médico e por longa data de uso pode aumentar o risco de desenvolvimento do CM.
Deve se ressaltar que outros dados também são fundamentais de continuarem a ser investigados para se aprofundar o conhecimento da doença com o consumo de carboidratos de alto índice glicêmico, em mulheres com SM, bem como o papel da TRH na menopausa, como forma de se ampliar o conhecimento de profissionais de saúde que trabalham com doentes oncológicos, especialmente em portadoras de CM.
Os resultados da presente revisão foram fundamentais para ampliar o conhecimento sobre o CM, sendo útil para consulta de profissionais de saúde e principalmente, para nutricionistas, já que esclareceu a necessidade de serem traçadas condutas e estratégias clínicas, para uma assistência clínico-nutricional moderna e eficaz na prevenção, controle e tratamento da doença.
Contudo, mais estudos são necessários para analisar fatores de risco para a doença, como o papel do estresse psicológico e dos agroquímicos que também podem estar envolvidos no aparecimento do câncer.
REFERÊNCIAS
ALBUQUERQUE, A. M.; TOCCI, H. A. A polêmica associação entre a terapia de reposição hormonal e o risco de câncer de mama no climatério. Rev. Bras. Enferm. v.1, n.4, p. 90- 94, 2000.
ALBUQUERQUE, W. F.; ALMEIDA, S. C. C. Por uma história das mulheres: historiografias e fontes na colônia. Anais do II encontro internacional de história colonial. Rev de human. São Paulo. v.9, n. 24, p. 1518-3394, 2008.
ALMEIDA, S. Relação entre variantes de genes envolvidos na ação e metabolismo de hormônios sexuais e o perfil lipídico em mulheres com diferentes status hormonais. Rev Bras Ginecol Obstret. v. 27, n.6, p.367-370, 2005
ANDERSON, G.L. et al., S.A. Women’s Health Iniciative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the women’s Health Iniciative Randomized controlled trial. Gender Medicine, New Jersey. v.6, n.291, p.1701-1712, 2004.
ARANHA, R.N.; AZEVEDO, G.M.; WERNECK, G. Análise de correspondência para avaliação do perfil de mulheres na pós-menopausa e o uso da terapia de reposição hormonal. Cad Saúde Pública. v. 20, n.1, p.100-108, 2008.
ARAÚJO, J.; CORDEIRO, N. L.; ATHANAZIO, D. A. Terapia de reposição hormonal e o câncer do endométrio. Cad. Saúde. Pública. São Paulo. v.23, n.11, p.167-177, 2007.
ARAÚJO, L. M. A.; FERNANDES, A. F. C. O significado do diagnóstico do câncer de mama para a mulher. Esc Anna Nery. v. 12, n.4, p. 664-671, 2008.
BAPTISTA, M. Z. et al., Tobacco smoking and breast cancer. Breast Journal. v.12, n.4, p. 396-397, 2006.
BANDERA, E.V. Association between dietary fiber ysis. Am J Clin Nutr. v.86, n. 6, p.1730-1737, 2007.
BORGES, J.B.R. et al., Perfil das mulheres no Município de Jundiaí quanto ao hábito do auto exame de mamas. Rev Bras de cancerol. v. 54, n. 2 , p.113-122, 2008.
BUTTROS, D.; et al. Relação da síndrome metabólica com o câncer de mama. Rev Bras Mastologia. v.4, n.23, p.99-101, 2013.
Brasil. Ministério da Saúde. Instituto Nacional do Câncer. Estimativas da incidência e mortalidade por câncer. Rio de Janeiro: INCA; 2004.
BRAUN, S.; BITTON-WORMS, K.; LEROITH, D.The Link between the Metabolic Syndrome and Cancer. Int J Biol Sci. v.7, n.7, p.1003-1015, 2011.
BRUNNER, L. S.; SUDDARTH, D.S. Tratado de enfermagem médico-cirúrgica. 9. ed. Rio de Janeiro: Guanabara Koogan, 2006.
CANTINELLI, F.S. et al., A oncopsiquiatria no câncer de mama: considerações a respeito de questões do feminino. Rev Psiquiatr Clín. v.33, n.3, p.124-133, 2006.
CARVALHO, C.M.R.G. et al., Prevenção de câncer de mama em mulheres idosas: uma revisão. Rev Bras Enferm. v. 62, n. 4, p. 579-582, 2009.
CAMERON, A.J. et al. Cental obesity as a precursor to the metabolic syndrome in the AusDiab Study and Mauritius. J Nutr Biochem. v. 19, n. 8, p. 491-504, 2008.
CESTARI, M. E. W.; ZAGO, M.F. A atuação da enfermagem na prevenção do câncer na mulher: Questões culturais e de gênero. Cienc Cuid Saude. v.11, n.2, p.176-182, 2011.
CARVALHO, C.M.R.G.; BRITO, C.M.S.; NERY, I.S.; FIGUEIREDO, M.L.F.; Prevenção de câncer de mama em mulheres idosas: Uma revisão. Rev Bras enferm. v.62, n.4, p. 579-582, 2009.
CRANNEY, A.; WELLS, GA. Hormone replacement therapy for postmenopausal osteoporosis. Clin Geriatr Med. v. 19, n.2, p.295-300, 2005.
CIBEIRA, G. H.; GUARAGNA, R. M. Lipídio: fator de risco e prevenção do câncer de mama. Rev. Nutr, camp. v.19, n.1, p. 65-75, 2006.
COHEN, L.A. Dietary fiber and breast cancer. Anticancer Res. v.19, n3, p.3685-3688, 2007.
COSTA P.L.; HOROVITZ, A.P.; SANTOS, A.O. Prevalência de osteoporose em mulheres na pós menopausa e associação com fatores clínicos e reprodutivos. Rev Bras Ginecol Obst. v. 25, n.7, p.507-512, 2006.
DEUS, T. M.; et al. Avaliação nutricional de mulheres com câncer de mama atendidas na maternidade Carmela Dutra. EXTENSIO: Rev. Eletrônica de Extensão. v. 6, n. 7, p.109-120, 2009.
DUARTE, T.P; ANDRADE, A. N. Enfrentando a mastectomia: análise dos relatos de mulheres mastectomizadas sobre questões ligadas à sexualidade. 2006. Disponível em:
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1413294X2003000100017&lng=pt&nrm=iso>. Acesso em: 01 de Jun. 2016.
ESPOSITO, K.; CERIELLO, A.; GIULIANO, D. Diet and the metabolic syndrome. Metab Syndr Relat Disord. v.4, n.5, p.291-296, 2007.
FEITOSA, F. S et al., Síndrome Metabólica e Câncer de Mama: Revisão sistemática. Rev Bras Clim Med. v.10, n.6, p.513 – 520, 2012.
FINATO, V.M.I.; NAKAZONE, S.; FRANÇA, H.H. Aspectos típicos de cardiopatia isquêmica no sexo feminino. Rev Faculd Ciênc Médic. v.7, n.4, p.6-9, 2005.
FOWKE, J.H.; LONGCOPE, C.; HEBERT, J.R. Macronutrients intake and estrogen metabolism in healthy postmenopausal women. Breast Cancer Res Treat. v.65, n.1, p.1-10, 2004.
FREITAS, J.R. et al., Conhecimento e prática do autoexame de mama. Rev Assoc Med Bras. v.52, n. 5, p.337-341, 2006.
GABRIEL, C.A; DOMECHEK, S.M. Brest cancer in Young womem. Rev.Brest Cancer. v 12, n. 5, p. 212, 2010.
GARÓFOLO, A. et al., Avaliação da eficiência da nutrição parenteral quanto à oferta de energia em pacientes oncológicos pediátricos. Rev Nutr. Camp. v.20, n.2, p.181-190, 2007.
GARÓFOLO, A.; et al. Dieta e câncer: um enfoque epidemiológico. Rev. Nutr. Campinas. v. 17, n. 4, p. 491-505, 2004.
GARÓFOLO, A et al., Dieta e câncer: um enfoque epidemiológico. Rev. Nutr. Camp. v.25, n.1, p.492-505, 2013.
GODINHO, E.R.; KOCH, H.A. Rastreamento do câncer de mama: Aspectos relacionados ao médico. Radiol Bras. v. 37, n.2, p.91-99, 2007.
HANKINSON, S.E.; SPEIZER, F.E. Association of dietary intake of fat and fatty acids with risk of breast cancer. Jama. v.28, n.10, p.914-920, 2009.
HEALY, L.A. et al., Metabolic syndrome, central obesity and insulin resistance are associated with adverse pathological features in postmenopausal breast cancer. Clin Oncol. v.4, n.22, p.281-288, 2010.
HERBERT, J.R.; EBBELING, C.B.; OLENDZKI, B.C. Change in women’s diet and body mass following intensive intervention for early-stage breast cancer. J Am Diet Assoc. v.4, n. 101, p. 421-428, 2005.
HINDS, L.; PRICE, J. Menopause, hormone replacement and gynecological cancers. Menopause int. v.16, n.2, p.89-93, 2010.
INCA, 2013. Consenso Nacional de Nutrição Oncológica, Coordenação Geral de Gestão Assistencial, Hospital do Câncer I, Serviço de Nutrição e Dietética – 2°ed. Rio de Janeiro: Inca, 2013.182p.
Intenational Diabetes Federation. The IDF worldwide definition of the metabolic syndrome. Disponível em: www.idf.org/home/index.cfm?unode=1120071E-AACE-41D2-9FA0-BAB6E25BA072. Acesso em: 03/04/2016.
JUNIOR, W.J.A. TRH e câncer de mama. Rev Brasileira de Mastologia. v. 14, n.2, p.49-50, 2004.
KUBA, V.M. et al., Dydrogesterone does not reverse the cardiovascular benefits of percutaneous estradiol. Climateric. v.2, n.16, p.54-61, 2012.
KUCUK, V.C. New opportunities in chemoprevention. Cancer Invest. v. 20, n.2, p.237-245, 2002.
KLEMENT, J.; KAMMERER, U. Existe um papel para a restrição de carboidratos no tratamento e prevenção do câncer? Nutr Metab (Lond). v.8, n.2, p., 2011.
KONGNYUY E, NORMAN R.J. Oestrogen and progestogen hormone replacemen ttherapy for perimenopausal and post-menopausal women: Weight and body fat distribution. Interv Revi: Issue 11, p.410-417, 2010.
LARGENT, J.A, et al., Hipertensyon, antihupertensive medicacion use, and brest cancer risk in the California. Rev. Cancer Cases. v.21, n. 10, p. 1615-1624, 2010.
LIMA, A.L.P et al. Rastreamento oportunístico do câncer de mama entre mulheres jovens no Estado do Maranhão. Rev Saúde Sública. v.27, n. 7, p. 1433-1439, 2011.
LEÃO, L.M.C.S.M.; DUARTE, M.P.C.; FARIAS, M.L.F.; Insuficiência androgênica na mulher e potenciais riscos da reposição hormonal. Arq Bras Endocrinol Metab. v.49, n.2, p. 205-216, 2005.
MAIA, Y. C. P. Fatores clínicos, comportamentais, nutricionais, polimorfismo C677t do gene da enzima metilenoteraidrofolato redutase (MTHFR) e risco de câncer de mama. Ouro Preto/MG: UFOP, 2007. (Dissertação de mestrado).
MAITI, B.; KUNDRANDA, M. N,; SPIRO, T.P.The association of metabolic syndrome with triple negative breast cancer. Breast Cancer Res Treat. v.12, n.2, p. 479-483, 2010.
MAILLARD, V.; BOUGNOUX, P.; FERRARI, P.; JOURDAN, M.; PINAULT, M.; LAVILLONNIERE, F. N-3 an N-6 fatty acids in breast cancer adipose tissue relative risk of breast cancer in a case-control study in Tours, France. Int J Cancer. v.98, n.4, p.78-83, 2002.
MANTOVANI, A.; et al., A inflamação relacionada ao câncer. Nature. v.24, p.436-444, 2008.
MILLEN, B.E.; PENCINA, M.J.; KIMOKOTI, R.W.; ZHU. L.; MEIGS, J.B.; ORDOVAS, J.M. Nutritional risk and the metabolic syndrome in women: opportunities for preventive intervention from the Framingham Nutrition Study. AmJ Clin Nutr. v.84, n.2, p.434-441, 2006.
MORI, M.A.; COELHO, V.L.D.; ESTRELLA, R.C.N. Sistema Único de saúde e Políticas Públicas: atendimento pscológico à mulher na menopausa no Distrito Federal, Brasil. Cad Saúde Pública. v. 22, n.9, p.1825-1833, 2006.
MORTILLO, S.; FILION, K.B.; GENEST, J. The metabolic syndrome and cardiovascular risk a systematic review and meta-analysis. J Am Coll Cardiol. v.14, n. 11, p. 1113-1132, 2010.
NAHAS, E. A. P.; et al. Síndrome metabólica em mulheres na pós-menopausa tratadas de câncer de mama. Rev Bras Ginecol Obstet. v. 34, n.12, p.555-562, 2012.
NASCIMENTO, T.G.; SILVA, S.R.; MACHADO, A.R.M. Autoexame de mama: significado para pacientes em tratamento quimioterápico. Rev Bras Enferm. v.62, n.4, p.557-561, 2009.
NAVES, M.M.V.; QUINTANILHA, M.I.G.D.; INUMARU, L.E. Nutrição e prevenção de câncer: evidências, metas de saúde pública e recomendações individuais. Nutrição em pauta. v. 16, n.1, p. 40-45, 2008.
NICHOLAS, A.G. et al., Glucose deprivation activates a metabolic and signaling amplification loop leading to cell death. Molecular Systems Biology. v.8, n.589, p.1-16, 2012.
OLIVEIRA, E.X.V. et al., Condicionantes sócio econômicos e geográficos do acesso à mamografia no Brasil. Ciência saúde coletiva. v.16, n.9, p.3649-3664, 2011.
PAIVA, C. E et al., A case-controlstudy. Rev Bras de Cancerol. v.48, n.3, p. 231-237, 2009.
PARDINI, D. Terapia de reposição hormonal na menopausa. Arq Bras Endocrinol Metab. v.58, n.2, p.172-181, 2007.
PARKIN, D. M., FERLAY, J.,PISANI, P. Global Cancer Statistics. A Cancer Journ for Clinic. v.55,74-108. 2002.
PADILHA, P. C.; PINHEIRO, R. L. Alimentos funcionais no câncer de mama. Rev Bras de cancerol. v.50, n. 3, p. 251-260, 2011.
PEDRO, A.O.; PINTO, A.M.; COSTA-PAIVA, L. Procura de serviço médico por mulheres climatéricas brasileiras. Rev saúde Pública. v.36, n.4, p.484-490, 2004.
PEREIRA, D.H. Reposição hormonal masculina e feminina. Tratado de medicina estética. São Paulo: Roca. p. 1789-817, 2006.
PIERCE, B.L. et al., Correlates ofcirculating C-reactive protein and serumamyloid A concentrations in breast cancer survivors. Breast Cancer. Res Treat. v.114, n.1, p.155-167, 2009.
PINHO, V.F.S.; COUTINHO, E.S.F. Variáveis associadas ao câncer de mama em usuárias de unidades básicas de saúde. Cad de Saúde Pública. v. 23, n.5, p. 1061-1069, 2007.
PETRI, N.E.A.; PADOANI, N.P.; NAHAS NETO, J.; ORSALTI, F.L.; TARDIVO, A.P.; DIAS, R. Metabolic syndrome and its associated risk factors in Brasilian postmenopausal women. Climacteric. v.12, n.5, p.431-438, 2009.
PRADONI, Paolo. Venous thromboembolism risk and management in women with cancer and thrombophilia. Gender Medicine, New Jersey. v.2, n.4, p.528-534, 2005.
RÉZIO, M.P.Z.; SOUZA, A.M.; TOLOI, M.R.T. Efeito da terapia de reposição hormonal sobre o estado férrico. J. Bras Patol Med Lab. v.39, n.4, p. 295-300, 2007.
RIDCKER, P.M. Clinical application of C-reative protein for cardiovascular disease detection and prevention. Circulation. v.3, n.107, p.363-369, 2003.
ROSENBAUM, P.; FERREIRA, S.R.G. An update on cardiovascular risk of metabolic syndrome. Arq Bras Endocrinol Metab. v.10, n.47, p.220-227, 2003.
ROSSOUW, J.E. et al., writing Group for the Women’s Health Iniciative Investigators. Risks and beneficts of estrogen plus progestin in healthy postmenopausal women: principal results From the women’s Health Iniciative randomized controlled trial. Jama. v.3, n.7, p.321-333, 2002.
ROZAS, A. Indicações atuais da terapia de reposição hormonal (TRH). Rev Fac Ciênc Méd. v.7, n.1, p.27-32, 2005.
ROSENBERG, S.; VAMMDROME, J.; ANTOINE, C. Postmenopausal hormone therapy: Risks and benefits. Nat Rev Endocrinol. v.9, n.1, p.216-227, 2013.
ROZENFELD, S. Terapia hormonal para a menopausa (TH): Múltiplos interesses a considerar. Ciênc Saúde Coletiva. v. 12, n.2, p.437-442, 2007.
SANTEN, R.J. et al., Postemenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab. v.95, n.7, p.1-66, 2010.
SILVA, R. C. F.; HORTALE, V. A. Rastreamento do Câncer de Mama no Brasil: Quem, Como e Por quê? Rev Bras de cancerol, v.58, n.1, p.67-71, 2012.
SILVA, M.P.N. Síndrome da anorexia-caquexia em portadores de câncer. Rev Bras Cancerol. v.52, n.1, p.59-77, 2006.
SMELTZER, S.C.; BARE, B.G. Tratado de enfermagem médico-cirúrgica. 10° Ed. Vol 3. Rio de Janeiro: Guanabara Koogan; 2006.
STEWART, S. L. et al., Cancer mortal itysurveillance. United States. v.53, n.3, p.1-108, 2004.
TESSARO, S. et al., Contraceptivos orais e câncer de mama: estudo de casos e controles. Rev saúde pública. v.35, n.1, p. 32-38, 2001.
TERRY, P. et al., Dietary carotenoids and risk of breast cancer. Am J Clin Nutr. v.76, p.883-888, 2008.
THOMSOM, C.A.; THOMPSON, P.A.; WRIGHT-BEA, J.; NARDI, E.; FREY, G.R.; STOPECK, A. Metabolic syndrome and elevated C-reative protein in breats cancer survivars on adjuvant hormone therapy. J womens Health. EUA. v.18, n.12, p.2041-2047, 2009
URDINOLA, J. Terapia de reemplazo hormonal (THS) y cancer de seno. Rev colomb menopaus. v. 6, n.1, p.89-92, 2008.
VERAS, A,B.; RASSI, A.; VALENÇA, A.M. Prevalência de transtornos depressivos e ansiosos em uma maostra ambulatorial brasileira de mulheres na menopausa. Rev Psiquiatr. v.28. n.2, p.130-134, 2006.
VERKOOIJEN, H.M.; BOUCHARDY, C.; VINH-HUNG, V.; RAPITI, E.; HARTMAN, M.M. The incidence of breast cancer and changes in the use of hormone replacement therapy: Areview of the evidence. Maturitas. v.14, n.2, p.49-50, 2009.
VICTOR, W.H.O. et al., A Low Carbohydrate, High Protein Diet Slows Tumor Growth and Prevents Cancer Initiation. Cancer Res. v.71, n.13, p. 4484-4492, 2011.
VIGETA, S.M.G.; BRETAS, A.C.P. A experiência da perimenopausa e pós-menopausa com mulheres que fazem uso ou não da terapia de reposição hormonal. Cad Saúde Pública. v.20, n.6, p.1682-1689, 2007.
WINDER, E.L.; COHEN, L.; MUSCAT, J.E. Breast cancer: weighing the evidence for a promoting role of dietary fat. J Natl Cancer Inst. v.89, n.11, p.766-775, 2006.
WÜNSCH, S. Tabagismo e câncer no Brasil: evidências e perspectivas. Rev Bras Epidemiol. v.13, n.2, p.175-187, 2010.
YUSUF, S.; HAWQEN, S.; OUNPUU, S. Effect of otentially modifiable risk factors associated with myocardial infarction in 52 coutries (the interheart study): case control study. Lancet. v.9438, n.364, p.937-952, 2010.
YANCIK, R.; WESLEY, M.N.; RIES, L.A.; Effect of age and comorbidity in postmenopausal breast cancer patients aged 55 years and older. Jama. v. 285, n.7, p. 636-643, 2004.
ZAHAR, S.E.V. et al., Qualidade de vida em usuárias e não usuárias de terapia de reposição hormonal. Rev Assoc Med Bras. v.51,n.3, p.133-138, 2005.
[1] Bacharel em Nutrição – Universidade Castelo Branco.


2 respostas
MUUUUUUUITOOOOOOOOOOO BOM!!!!! PARABENS
Ótimo artigo!!
Muitas informações importantes e fundamentais para quem está atravessando esse difícil período da menopausa!!
Obrigada por compartilhar