ARTIGO ORIGINAL
SILVA, Jamile De Oliveira [1] , MIGUES, Vitor Hugo [2]
SILVA, Jamile De Oliveira. MIGUES, Vitor Hugo. Prospecção fitoquímica e atividade biológica de Syagrus Coronata e Vanilla Palmarum. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 07, Vol. 09, pp. 20-42. Julho de 2019. ISSN: 2448-0959
RESUMO
Introdução: Syagrus coronata conhecida regionalmente como licuri, licurizeiro, ouricuri, é considerada uma das mais importantes espécies de palmeiras, apresenta grande importância sócio-econômica nas áreas de ocorrência natural, especialmente naquelas situadas em regiões semi-áridas do nordeste brasileiro, uma vez que, desta planta podem ser aproveitados praticamente todos os seus componentes, em algumas cidades do interior são relatados popularmente seu uso para fins medicinais, em estudo realizado 15% dos entrevistados conhecem uso medicinal para o ouricuri. A Vanilla palmarum é uma espécie de orquídea de hábito escandente e crescimento reptante que existe de Cuba ao sul do Brasil, geralmente são encontradas vivendo epífitas em palmeiras, popularmente são usadas para tratar Pitiríase Versicolor (pano branco). Objetivo: fornecer o perfil dos compostos químicos presentes nas espécies estudadas, bem como a atividade biológica do extrato etanólico. Metodologia: As amostras foram tratadas e submetidas a testes de prospecção fitoquimica, determinação de fenólicos totais, atividade antioxidante in vitro, e ensaio toxicológico. Resultados e discussão: V. palmarum apresentou alcaloides, saponinas, cumarinas, taninos, chalconas e leucoantocianinas em sua composição, enquanto a espécie S. coronata apresentou apenas esteroides e compostos fenólicos. As frações do extrato da V. palmarum e S. coronata não possuem toxicidade frente ao teste realizado. Constatou-se que a amostra de V. palmarum possui 89,1% de atividade antioxidante na concentração de 200 µg/ml. A menor atividade antioxidante foi evidenciada para a amostra de licuri, na concentração de 1 µg/ml, porém foi observado significativo percentual para esta mesma amostra nas outras concentrações. Considerações finais: foram detectados diversos metabólitos nos extratos de folhas de V. palmarum e sementes de S. coronata, responsáveis por conferir atividades biológicas. Foi possível observar atividade antioxidante para os extratos da espécie V. palmarum e S. coronata. Além disso, estudos mais aprofundados devem ser realizados para a utilização desses extratos pela população e desenvolvimento de formas farmacêuticas.
Palavras-chave: Palmarum, coronata, fitoquimica, antioxidante, espécie.
INTRODUÇÃO
A família Arecaceae, única representante da Ordem Arecales, é considerada um dos grupos de vegetais mais antigos da terra, uma vez que os seus vestígios remontam a mais de 120 milhões de anos (LORENZI et al., 2004).
Essa família é referida por Ribeiro et al. (1999) como uma das maiores do mundo, e que devido à sua forma e aspecto é a mais característica da flora tropical. Está amplamente distribuída nos trópicos com diversos hábitos e habitats.
Algumas espécies do gênero são muito valorizadas localmente, em vista dos produtos extraídos como: palmito, amêndoas, polpa dos frutos e folhas para o artesanato; é o caso da guariroba (Syagrus oleracea (Mart.) Becc.), do ouricuri (Syagrus coronata (Mart.) Becc.) e do gerivá (Syagrus romanzoffiana (Cham.) Glassman) (BONDAR, 1964; NOBLICK, 2010); outras espécies vêm sendo recentemente introduzidas com sucesso no paisagismo (NOBLICK, 2010). No entanto, a maioria das espécies encontra-se bastante ameaçada pela expansão da agricultura, especialmente as de pequeno porte, comuns nos cerrados e caatingas.
Conhecida regionalmente como licuri, licurizeiro, ouricuri, aricuri, alicuri, nicuri, dicorí, urucuri, coqueiro dicori e coqueiro cabeçudo. Syagrus coronata é considerada uma das mais importantes espécies de palmeiras da região semi-árida do nordeste brasileiro (DRUMOND, 2007). É uma espécie nativa de grande importância social e econômica e de exemplar importância ecológica nas áreas de ocorrência (NOBLICK, 1986).
O licuri apresenta porte mediano, atingindo cerca de dez metros de altura e 25 cm de diâmetro à altura do peito, sempre apresentando estipe único. Suas folhas de coloração verde clara atingem comprimento de até três metros, e se distribuem sempre em cinco fileiras arranjadas geralmente numa sequência de espiral ao longo do estipe; são pinadas e as pinas se dispõem em vários planos. A porção superior do estipe se apresenta recoberta pela base persistente das bainhas das folhas mais velhas (MEDEIROS-COSTA, 1982; LORENZI et al., 2004).
É uma espécie monóica, com inflorescência do tipo panícula, ramificada, interfoliar, pendente, protegida por espata coriácea (LORENZI et al., 2004). As flores, apresentam coloração amarelo-clara, são unissexuadas e ambos os sexos estão presentes numa mesma inflorescência sendo as flores pistiladas sempre dispostas em meio a duas estaminadas, num arranjo denominado de tríade (MEDEIROS-COSTA, 1982; LORENZI et al., 2004).
O fruto é uma drupa, oval-elipsóide, monospermo, apiculado que apresenta endocarpo duro, mesocarpo fibroso-mucilaginoso e exocarpo fibroso-tênue (MEDEIROS-COSTA, 1982). Ao passo que verde possui o endosperma líquido, mas que se torna sólido no processo de amadurecimento (CREPALDI et al., 2001); devido a maturação a sua coloração altera-se para amarelo ou laranja (BONDAR, 1938).
Syagrus coronata ocorre tanto no bioma Caatinga como na Mata Atlântica, em virtude de sua distribuição geográfica relativamente ampla. Conforme Noblick (1986) apresenta nítida preferência pelas regiões secas e áridas da Caatinga, distribuindo-se desde o norte de Minas Gerais até o sul de Pernambuco, abrangendo as porções central e oriental do estado da Bahia, assim como, os estados de Sergipe e de Alagoas, desde o litoral até as zonas secas.
Para Bondar (1942), é considerada como a palmeira de maior dispersão na Bahia, com ocorrência de povoamentos naturais em boa parte de seu território, nesse estado se encontravam as maiores concentrações de licurizais, especialmente nos municípios de Itiúba, Maracás, Milagres, Monte Santo, Santa Terezinha e Senhor do Bonfim.
.sta espécie apresenta grande importância sócio-econômica nas áreas de ocorrência natural, especialmente naquelas situadas em regiões semi-áridas, uma vez que, desta planta podem ser aproveitados praticamente todos os seus componentes (DRUMOND, 2007; LOPES, 2007; RAMALHO, 2008).
Segundo Rufino et al. (2008), em estudo realizado 15% dos entrevistados conhecem uso medicinal para o ouricuri. Dentre as partes usadas estão a “água do coco” (endosperma), indicada como colírio para tratamento de inflamação ocular, micoses (pano preto e pano branco) e cicatrização de feridas; o chá da raiz do ouricuri é indicado para o tratamento de dores na coluna vertebral. O uso medicinal de uma lagarta não identificada que se desenvolve no fruto do Ouricuri foi relatado por um dos informantes, sendo empregado na comunidade estudada para tirar manchas da pele decorrentes de feridas cicatrizadas.
O extrato de inflorescência aquosa foi o único entre todos os extratos aquosos testados por difusão em ágar para mostrar atividade antimicrobiana, particularmente contra B. cereus e três cepas de S. aureus. O extrato de inflorescência de metanol foi o único a mostrar atividade antibacteriana contra B. cereus com halos de 10 e 8 mm para as concentrações de 1000 e 500 μg / disco, respectivamente. (HUGHES et al., 2013).
Em um estudo experimental, foram demonstradas as fortes propriedades antiestafilococos dos óleos de sementes de S. coronata. Estes são resultados promissores que incentivam novas pesquisas sobre os aspectos toxicológicos e farmacológicos desta espécie, bem como a determinação dos mecanismos de ação envolvidos. Essa pesquisa esclareceria a adequação dessas substâncias em qualquer aplicação potencial como agentes antimicrobianos para terapia, práticas alimentares e / ou indústria de cosméticos. (BESSA et al., 2016).
A espécie Syagrus coronata, possui estipe recoberto por pecíolos foliares e persistem após a queda das folhas mais velhas. Essas estruturas formam micros sítios capazes de armazenar matéria orgânica e umidade (DRUMOND, 2007), o que se supõe favorecer a germinação de sementes e recrutamento de plântulas de epífitas (OLIVEIRA et al., 2015).
Os epífitos possuem elevada importância ecológica e grande diversidade de táxons, sendo particularmente mais diversos nas florestas tropicais e subtropicais úmidas da região neotropical (KRESS, 1986; GENTRY; DODSON, 1987a,b; WAECHTER, 1992; NIEDER et al., 2000). De acordo com Benzing (1990) e Kersten e Silva (2001), plantas epífitas podem agrupar até 50% de toda a flora de florestas tropicais úmidas. Este grupo está distribuído em 83 famílias e possui aproximadamente 29.000 espécies, o que representa cerca de 10% de toda a flora vascular mundial (GENTRY; DODSON; 1987).
A Vanilla palmarum é uma espécie de orquídea de hábito escandente e crescimento reptante que existe de Cuba ao sul do Brasil. São plantas clorofiladas de raízes aéreas; sementes crustosas, sem asas; e inflorescências de flores de cores pálidas que nascem em sucessão, de racemos laterais (BREIER, 2005). Esta espécie pode ser reconhecida entre as Vanillas por apresentar caules comparativamente mais delicados, labelo claramente trilobado, mais curto ou do mesmo comprimento que as sépalas; grandes folhas levemente membranáceas e reticuladas, ovaladas; e flores comparativamente menores, porém bem abertas; ovário trigonado com calículo na extremidade (BORGO et al., 2002). Geralmente são encontradas vivendo epífitas em palmeiras. Popularmente em algumas cidades do interior a V. palmarum é usada para tratamento de Pitiríase Versicolor (pano branco) (BLITZ et al., 1995; BROWN, 1990).
A resistência de microorganismos patogênicos a antibióticos e antifúngicos convencionais vem sendo uma grande preocupação para a saúde pública. Os microorganismos possuem mecanismos de defesa que os tornam resistentes e adaptados a ação das convencionais armas de ataque já criadas, por estarem sempre em contato com estas armas acabam deixando-as ineficazes no combate aos patógenos que acometem homem, animais e vegetais. Por essa razão é de suma importância a criação de novos moldes de uso terapêutico e profilático, para auxiliar em novas pesquisas (BORGO et al., 2002).
Em virtude das utilidades dessas plantas e poucas referências de suas propriedades para a população, este trabalho teve como objetivo: fornecer o perfil dos compostos químicos presentes nas espécies estudadas, bem como a atividade biológica do extrato etanólico.
METODOLOGIA
PREPARO DE EXTRATOS
Foram coletadas amostras das folhas de Vanilla palmarum e sementes de Syagrus coronata em Senhor do Bonfim/Ba e foram trazidas para Salvador/Ba e tratadas no Centro Universitário UniRuy Barbosa | Wyden, onde foram secadas em estufa com circulação de ar a 40 ºC por 48 horas. Logo após, as amostras foram fragmentadas em moinho de facas. O material foi submetido ao processo de maceração, em frascos de vidro de boca larga com 1000 mL, utilizando metanol como solvente extrator. Os extratos permaneceram em maceração por sete dias, com agitação diária. Finalizando o período de extração, os mesmos foram filtrados através de gaze e papel filtro e concentrados em rotaevapor (Laborota 4000 eco) para redução de volume (MATOS, 1997). Os extratos foram transferidos para recipientes limpos e identificados. Em seguida, as amostras foram secas a temperatura ambiente.
PROSPECÇÃO FITOQUÍMICA
A metodologia que foi utilizada para a detecção dos grupos de metabólitos secundários foi proposta por Costa (1982) e adaptada por Paula e Bara (2007). Todas as análises foram realizadas em duplicata.
PESQUISA DE ALCALÓIDES
Para a extração dos possíveis alcalóides, foram pesados em balança semianalítica 2g da amostra pulverizada. Foram adicionados 30 mL de ácido sulfúrico a 5% (v/v). A mistura foi levada à fervura por 3 minutos, e, em seguida, filtrada em papel de filtro e resfriada. A solução extrativa foi distribuída igualmente em 3 tubos de ensaio, sendo que em cada tubo, respectivamente, foram acrescentadas 3 a 9 gotas dos reativos gerais: Reativo de Mayer, Reativo de Dragendorff e Reativo de Bouchardat. Foi observado se ocorreria o aparecimento dos precipitados branco, vermelho-tijolo e marrom-avermelhado, respectivamente, para indicação de reação positiva para alcalóides.
PESQUISA DE TANINOS
Para a extração dos possíveis taninos, foram pesados em balança semi-analítica, 2g da amostra pulverizada e adicionados 30 mL de água destilada. A mistura foi levada à fervura durante 5 minutos. Em seguida procedeu- se a filtração da mistura ainda quente, utilizando papel de filtro. Foi montada uma bateria contendo 3 tubos de ensaio. A cada tubo foram adicionados 5 mL da solução extrativa e foram adicionadas 5 gotas dos reagentes para taninos, como: FeCl3 SR 2%, Acetato de Cobre SR 10%, Solução de Gelatina a 2,5% (em solução de NaCl a 5%). Foi visualizado se ocorreria à formação de precipitados.
PESQUISA DE HETEROSÍDEOS FLAVONÓIDES
Para a extração dos possíveis heterosídeos flavonóides presentes na amostra pulverizada foram pesados, em balança semi-analítica, 2g da amostra e foram acrescentados 30 mL de etanol a 70% (v/v). Essa mistura foi fervida durante 5 minutos e filtrada em papel de filtro umedecido com etanol a 70% (v/v). A caracterização foi realizada a partir do filtrado obtido, onde se procederam as seguintes reações: Reação de Shinoda, onde, foram transferidos 3 mL do filtrado para um tubo de ensaio. Adicionou-se cerca de 1 cm de fita de magnésio fina e acrescentou-se cuidadosamente 5 gotas de ácido clorídrico concentrado. Foi observado se ocorria o aparecimento de coloração vermelha para heterosídeos flavonóides. Reação com Hidróxido: foram transferidos 3 mL da solução extrativa para um tubo de ensaio. Adicionou-se 1 mL de hidróxido de sódio a 20% (p/v) e agitou-se o tubo. O desenvolvimento de coloração amarela indicaria reação positiva para heterosídeos flavonóides. Reação Oxalo-Bórica realizada em uma cápsula de porcelana: evaporou-se 5 mL de solução extrativa em uma cápsula de porcelana. Juntou-se ao resíduo semi-seco 3 mL de solução de ácido bórico a 3% (p/v) e 1 mL de solução de ácido oxálico a 10% (p/v). Evaporou-se até secura e adicionou-se, ao resíduo seco, 7 mL de éter etílico P.A. Observou-se sob luz ultravioleta à ocorrência ou não de fluorescência.
PESQUISA DE ESTERÓIDES E TRITERPENÓIDES
Para a extração dos possíveis esteróides e triterpenóides presentes na amostra pulverizada pesou-se, em balança semi-analítica, 2g da amostra, acrescentou- se 30 mL de solução hidroalcoólica a 50% (v/v) e 10 mL de solução de acetato de chumbo a 10% (p/v) e ferveu-se por 4 minutos. Filtrou-se e adicionou-se 10 mL de clorofórmio. Para a caracterização desta classe de metabólitos secundários utilizou-se a Reação de Liebermann-Burchard. Foi observado o desenvolvimento de coloração azul evanescente seguida de verde ou parda a vermelha, para esteróides e triterpenos, respectivamente.
PESQUISA DE HETEROSÍDEOS SAPONÍNICOS
Para a extração dos possíveis heterosídeos saponínicos, pesou-se em balança semianalítica, 2g da amostra em pó que foi transferida para um béquer contendo 100 mL de água destilada. Essa mistura foi levada à fervura em chapa aquecedora por 5 minutos, adicionando-se durante a decocção, carbonato de sódio em solução até a neutralização, que foi observada utilizando-se papel de tornassol como indicador. Logo em seguida, a mistura foi filtrada em algodão e ao filtrado acrescentou-se água destilada até completar um volume de 100 mL. Para a caracterização de heterosídeos saponínicos, transferiu-se 5 mL para o tubo de ensaio 5 e agitou-se vigorosamente por 20 segundos. Observou-se presença persistente de espuma por quinze minutos.
PESQUISA DE CUMARINAS
Para extração das possíveis cumarinas, foram pesadas 2g da amostra pulverizada em balança semi-analítica e adicionados a 30 mL de água quente. Essa mistura foi filtrada, e ao filtrado adicionou-se 1 mL de ácido clorídrico 1N (pH1). Em seguida, extraiu-se com 10 mL de éter etílico P.A. A fase etérea foi concentrada até a metade de seu volume. Para caracterização dessa classe de metabólitos secundários foram aplicadas gotas da fase etérea sobre duas regiões de um papel de filtro. Em uma das manchas formadas adicionou-se 1 gota de NaOH 1N. O papel foi observado sob luz ultravioleta a 365nm para caracterização de fluorescência.
PESQUISA DE HETERÓSIDEOS ANTRAQUINÔNICOS
Para a extração dos possíveis heterosídeos antraquinônicos, presentes na amostra pulverizada, pesou-se, em balança semi-analítica, 2g da amostra e acrescentou-se 30 mL de etanol a 70% (v/v), aqueceu- se durante 3 minutos em chapa aquecedora, e, filtrou-se em papel de filtro. Para a caracterização dessa classe de metabólitos secundários adicionou-se 10 mL de éter, homogeneizou-se. Separou-se 5 mL de fase etérea e adicionou-se 3 mL de hidróxido de amônio SR (1:1). Observou-se se ocorria o aparecimento de coloração vermelha na fase amoniacal.
PREPARAÇÃO DAS AMOSTRAS E ENSAIO TOXICOLÓGICO
O bioensaio com Artemia salina foi baseado na técnica descrita por Meyer et al. (1982). Foram utilizados 10 mg do extrato bruto de todas as amostras, nos quais foram adicionados 100 µL de Cremophor® e 1 mL de Tween 80 a 5% para ajudar a solubilização deles. As soluções foram homogeneizadas e o volume completado para 5 mL com água salinizada filtrada (água do mar e água destilada 1:1) a pH = 8,0. Destas soluções foram retiradas alíquotas de 2500, 1875, 1250, 625, 250 e 125 µL que foram transferidas para outros balões de 5 mL e os volumes completados com o mesmo solvente, obtendo-se concentrações de 1000, 750, 500, 250, 100 e 50 µg/mL para cada extrato. Os ovos de A. salina (20 mg) foram incubados sob iluminação artificial por 48 horas para que houvesse a eclosão das larvas (metanáuplios), e estas, separadas em sete grupos com 10 a 13 indivíduos cada. O primeiro grupo recebeu a solução controle (solvente e tensoativos) e os seis seguintes receberam as soluções dos extratos em diferentes concentrações. As amostras foram submetidas à iluminação artificial durante 24 horas, após este período foram contabilizadas as larvas vivas e mortas. O experimento foi realizado em triplicata para cada extrato. Para obtenção dos valores de CL50 (concentração média letal) foi utilizada a análise PROBIT, através do software STATPLUS® 2005, com 95% de confiança. Para comparação dos valores de CL50 entre as espécies, nos diferentes locais de coleta, foi utilizado o intervalo de confiança obtido pela análise PROBIT
DETERMINAÇÃO DE FENÓLICOS TOTAIS
A determinação dos fenólicos totais seguiu a metodologia descrita por Swain e Hills (1959). Tomou-se uma alíquota de 0,5 mL em tubo de ensaio e adicionaram-se 8 mL de água destilada e 0,5 mL do reagente Folin Ciocalteau. A solução foi homogeneizada e, após 3 min, acrescentou-se 1 mL de solução saturada de carbonato de sódio (Na2CO3). Decorrida 1 hora de repouso, foram realizadas as leituras em triplicata das absorbâncias em espectrofotômetro (Varian, Modelo Cary 50,) a 720 nm. Utilizou-se como padrão o ácido gálico, nas concentrações de 2; 5; 10; 15 e 20 µg/ mL, para construir uma curva de calibração. A partir da equação da reta obtida, realizou-se o cálculo teor de fenólicos totais, expresso em mg de ácido gálico/100 g de amostra.
ATIVIDADE ANTIOXIDANTE IN VITRO
Método de captura de radicais DPPH• (2,2 difenil-1-picril-hidrazil) este método tem por base a redução do radical DPPH•, que ao fixar um H• (removido do antioxidante em estudo), leva a uma diminuição da absorbância. Para a análise das amostras, adicionou-se a 1,5 mL da solução metanólica de DPPH• (6×10–5M) uma alíquota de 0,5 mL das amostras contendo diferentes concentrações de cada extrato. As leituras foram realizadas em espectrofotômetro (Coleman 33 D) a 517 nm, após 2; 5; 10 e 20 minutos do início da reação. Todas as determinações foram realizadas em triplicata e acompanhadas de um controle (sem antioxidante). A queda na leitura da absorbância das amostras foi correlacionada com o controle, estabelecendo-se a porcentagem de descoloração do radical DPPH•, conforme a fórmula abaixo:
Para o cálculo dos valores de EC50 (concentração do extrato necessário para reduzir 50 % do radical DPPH) dos distintos extratos, foi calculada a atividade antioxidante em diferentes concentrações, de forma a traçar uma curva linear entre a capacidade antioxidante do respectivo extrato e sua concentração. Esses dados foram submetidos a uma regressão linear e obtida uma equação da reta para o cálculo do EC50 (BRAND-WYLLIANS et al., 1995)
RESULTADOS E DISCUSSÃO
PROSPECÇÃO FITOQUIMICA
Os constituintes químicos encontrados na triagem fitoquímica da Vanilla palmarum e Syagrus coronata estão descritos na Tabela 1. Pode-se observar que v. palmarum apresenta alcaloides, saponinas, cumarinas, taninos, chalconas e leucoantocianinas em sua composição, enquanto a espécie Syagrus coronata apresenta apenas esteroides e compostos fenólicos.
Tabela 1 – Classes de metabólitos secundários presentes no extrato obtido a partir da Vanilla palmarum e Syagrus coronata.
| Classes de metabólitos secundários | Vanilla palmarum | Syagrus coronata |
| Alcalóides | + | – |
| Triterpenóides | – | – |
| Esteróides | – | + |
| Saponinas | + | – |
| Cumarinas | + | – |
| Compostos Fenólicos | + | + |
| Taninos | + | – |
| Flavonóides | + | – |
| Antraquinonas | – | – |
| Antocianidinas | – | – |
| Chalconas | + | – |
| Leucoantocianidina | + | – |
| Catequinas | – | – |
| Flavonas | – | – |
+: resultado positivo, -: resultado negativo Fonte: Autor.
A fitoquímica é a área responsável pelo estudo dos princípios ativos de drogas vegetais. Esses são chamados de metabólitos secundários ou metabólitos especiais, os quais fazem parte do metabolismo dos vegetais, conferindo proteção para as plantas. Além disso, os metabólitos secundários possuem atividade biológica, oferecendo benefícios também à saúde humana.
Portanto, é importante destacar suas principais propriedades biológicas e farmacológicas, sendo: alcalóides, conhecido devido a atividades farmacológicas marcantes como a morfina e a tubocurarina, sendo princípio ativo de importante anestésico atual. Saponinas, com atividade hemolítica, molusquicida, antiinflamatória, antimicrobiana, antiparasitária, citotóxica e antitumoral, antiviral entre outras. Cumarinas, utilizadas no tratamento de doenças de pele, como psoríase, dermatoses, vitiligo e alguns compostos possuem efeito anticoagulante assim como os compostos antraquinônicos, usados devido a importante ação laxativa. Taninos, caracterizados como compostos fenólicos, apresentam atividade antioxidante e antinfecciosa, ação antibacteriana, antiprotozoária e antifungicida, na reparação de tecidos, regulação enzimática e protéica, estimulação das células fagocíticas e ação tumoral. (BESSA et al., 2013)
Alguns estudos já foram conduzidos à cerca dos constituintes químicos de S. coronata, porém todos no sertão baiano e mineiro (CREPALDI et al., 2001, SEGALL et al., 2004, BELVISO et al., 2013). Os lipídios, proteínas, carboidratos, nitrogênio e vitaminas são componentes químicos encontrados em amêndoas e frutos de S. coronata. As amêndoas contêm maior teor de lipídios e proteínas, já na polpa há maior presença de carboidratos.
Estudo realizado para analisar a composição fenólica de sementes de S. coronata constatou a presença de 13 compostos fenólicos, entre eles Procianidina B1, Catequinas, Procianidina B2, Epicatequinas, Quercetina-3-O-glicosídeo, Rutinas, Miricetinas, Quercetina3-O-raminosídeo (BELVISO et al., 2013).
Em relação à composição dos ácidos graxos do óleo extraído das sementes de S. coronata, estudo comprovou a presença de ácido láurico, mirístico, palmítico, esteárico e linoleico (SEGALL et al, 2004). BELVISO e colaboradores (2009) relataram que o óleo de S. coronata apresenta capacidade antioxidante.
Há escassos trabalhos na literatura que abordam os óleos essenciais da família Arecaceae. Apenas um único trabalho estudou os compostos voláteis dos frutos de S. coronata (BELVISO et al. 2013). De fato, as atividades biológicas registradas para as espécies de Syagrus são escassas, (SILVEIRA et al., 2005; HUGHES et al., 2013).
ANÁLISE TOXICOLÓGICA
Um dos métodos alternativos amplamente utilizados em triagem de substâncias de origem vegetal é o método que utiliza o microcrustáceo Artemia salina. A Artemia salina é um microcustáceo da ordem Anostraca utilizado na alimentação de peixes e camarões por seu alto valor nutritivo. Dependendo da alimentação ingerida esse microcrustáceo pode adquirir diversas colorações, sua característica é de nadar com a parte ventral do corpo voltada para cima, ou seja, para a luz, e de estarem sempre em locomoção, por serem animais filtradores e dependem disso para alimentar-se e respirar (ASEM, 2008).
A utilização da A. salina em estudos toxicológicos preliminares deve-se a simplicidade com que pode ser manuseado. A rapidez e o baixo custo favorecem a utilização em diversos estudos. Ensaios de letalidade são muito utilizados em análises preliminares de toxicidade geral podendo estimar a concentração média letal (CL50) (LUNA et al., 2005; BEDNARCZUK et al., 2010).
Segundo Meyer et al. (1982) foi estabelecido uma relação entre o grau de toxicidade e a dose letal média, CL50, de extratos de plantas sobre os microcrustáceos Artemia Salina, considerando que quando verificados valores acima de 1000 µg/mL e não havendo morte acima de 50%, estes, são considerados atóxicos. Diversos trabalhos vêm tentando correlacionar a toxicidade sobre Artemia Salina com atividades antifúngica, viruscida, antimicrobiana, tripanossomicida e parasiticida.
Para o cálculo da DL50 os resultados das amostras testadas foram submetidos ao teste estatístico Probitos, e estão apresentados na Tabela 2.
Tabela 2 – Mortalidade de Artemia Salina e DL50.
| Amostra | Amostra/concentração (%) | DL50
(µg/mL) |
||
| 10 (µg/mL) | 100(µg/mL) | 1000(µg/mL) | ||
| Vanilla palmarum | 6 | 13 | 15 | >1000 |
| Syagrus coronata | 5 | 15 | 10 | >1000 |
Fonte: Autor.
Observando os dados é possível perceber que nenhuma das amostras se mostrou ativa contra o micro crustáceo Artemia salina, pois todas apresentaram um resultado de DL50 superior a 1000 µg/mL, concentração máxima para uma amostra ser considerada ativa segundo Meyer et al. (1982). Os controles feitos com o solvente metanol não apresentaram influência sobre os resultados, pois nenhuma larva morreu na presença dos mesmos, do mesmo modo que o controle realizado com água salgada. Dessa maneira pode-se dizer que as frações do extrato da Vanilla palmarum e Syagrus coronata não possuem toxicidade frente ao teste realizado.
ATIVIDADE ANTIOXIDANTE
Os compostos fenólicos apresentam, em sua estrutura, vários grupos benzênicos característicos, tendo como substituintes grupamentos hidroxilas (HERNÁNDEZ; PRIETO GONZÁLES,1999). Esta classe de compostos apresenta uma grande diversidade e divide-se em flavonóides (polifenóis) e não-flavonóides (fenóis simples ou ácidos). Os átomos de hidrogênio dos grupos hidroxila adjacentes (orto-difenóis), localizados em várias posições dos anéis A, B e C, as duplas ligações dos anéis benzênicos e a dupla ligação da função carbonila (-C=O) de algumas moléculas de flavonóides garantem a esses compostos sua alta atividade antioxidante (HRAZDINA; BORZEL; ROBINSON, 1970; RICE-EVANS; MILLER; PAGANGA, 1996).
Os flavonóides compreendem um grupo de compostos fenólicos amplamente distribuídos nas frutas e nos vegetais, apresentando-se sob muitas variações como flavonóis, flavonas, flavanonas, catequinas antocianinas, isoflavonas e chalconas. Suas principais fontes são: café, cebola, maçã, uva cerveja, vinho tinto e especialmente chá, que contém sobretudo catequinas em sua composição (GRAHAM, 1992; VAN ACQUIRE, 1996).
Na classe dos não-flavonóides estão os derivados dos ácidos hidroxicinâmico e hidroxibenzóico. Sua atividade antioxidante está relacionada com a posição dos grupos hidroxilas e também com a proximidade do grupo –CO2H em relação ao grupo fenil. Quanto mais próximo esse grupo estiver do grupo fenil, maior será a capacidade antioxidante do grupo hidroxila na posição meta (HRAZDINA; BORZEL; ROBINSON, 1970).
Antioxidantes são agentes que retardam ou previnem as lesões causadas pelos radicais livres nas células, é qualquer substância que, presente em baixas concentrações quando comparada ao substrato oxidável, atrasa ou inibe a oxidação deste substrato de maneira eficaz. Os radicais formados a partir de antioxidantes não são reativos para propagar a reação em cadeia que seria prejudicial à célula, eles são neutralizados por reação com outro radical, formando produtos estáveis ou podem ser reciclados por outro antioxidante (SOUZA et al., 2007). Dentre as diversas classes de substâncias antioxidantes de ocorrência natural, os compostos fenólicos têm recebido muita atenção nos últimos anos, sobretudo por inibirem a peroxidação lipídica e a lipooxigenase in vitro (BORGES et al., 2001).
Na Tabela 3, está apresentada a quantificação dos flavonoides, fenóis e ácidos fenólicos do extrato etanólico de V. palmarum e S. coronata.
Tabela 3 – Teores de flavonoides, fenóis e ácidos fenólicos totais do extrato etanólico de V. palmarum e S. coronata obtidos por maceração.
| Amostra | Flavonóides (%)a,b | Fenóis (%)a,c | Ácidos fenólicos (%)a |
| V. palmarum | 15,7 ± 0,02 | 29,6 ± 0,5 | 13,9 ± 0,5 |
| S. coronata | 2,6 ± 0,3 | 3,3 ± 0,2 | 0,6 ± 0,1 |
aResultados representam médias ± desvio padrão (n=3), bExpressos como equivalente de quercetina. c Expressos como equivalente de ácido gálico.
Considerando que substâncias naturais podem ser responsáveis pelo efeito de proteção contra os riscos de muitos processos patológicos, os resultados descritos neste trabalho estimulam a continuidade dos estudos para avaliar a ação antioxidante de V. palmarum e S. coronata.
DETERMINAÇÃO DA ATIVIDADE ANTIOXIDANTE TOTAL PELA CAPTURA DO RADICAL LIVRE DPPH
O gráfico (Figura 1) refere-se à curva de calibração empregada para o experimento de DPPH. Esta curva também foi avaliada quanto à linearidade. Com a finalidade de avaliar a capacidade dos constituintes do extrato etanólico de V. palmarum e S. coronata em capturar radicais livres (DPPH) foi feita análise de soluções deste extrato com DPPH. Os resultados foram expressos em percentagem de inibição de oxidação, ou seja, a porcentagem de atividade antioxidante é correspondente à quantidade de DPPH consumida pelo antioxidante (Figura 2).
Figura 1: Curva padrão empregada no experimento de DPPH
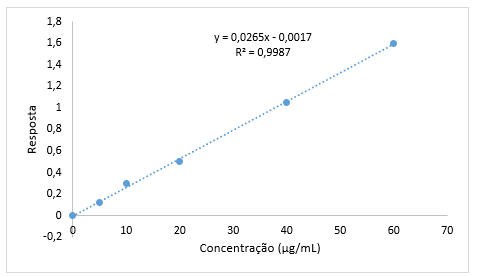
Figura 2: Percentual de Atividade Antioxidante de V. palmarum e S. coronata.
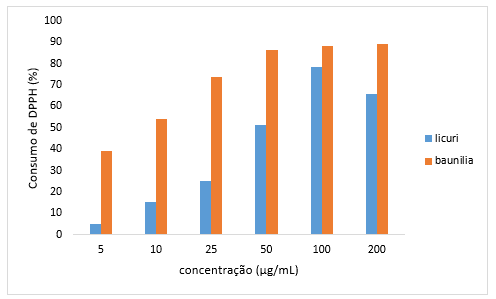
Quanto maior o consumo de DPPH pela amostra, maior é sua atividade antioxidante (AA) (ALVES et al., 2007). Sendo assim, quanto maior a concentração da amostra e menor a absorbância, maior o consumo de DPPH. Constatou-se que a amostra de V. palmarum possui 89,1% de atividade antioxidante na concentração de 200 µg/mL. Todas as amostras apresentaram capacidade de consumo de DPPH, visto que as absorbâncias após reação de DPPH com as diferentes concentrações das amostras testadas foram significativamente menores em se comparando com as absorbâncias obtidas para o controle negativo (DPPH + solvente), o que pode demonstrar preliminarmente a atividade antioxidante para o extrato testado. A menor atividade antioxidante foi evidenciada para a amostra de licuri, na concentração de 1 µg/mL, porém foi observado significativo percentual para esta mesma amostra nas outras concentrações.
Geralmente esta atividade tem sido correlacionada com a presença de flavonoides, classe presente em todas as amostradas analisadas, isto em diferentes teores de acordo com a época do ano. Rajani e Ashok (2009) em estudo semelhante para caule e raiz de B. variegata também evidenciaram atividade antioxidante pelo mesmo método de DPPH e comparação com outros.
Atualmente o interesse no estudo dos compostos fenólicos tem aumentado muito, devido principalmente à habilidade antioxidante destas substâncias em sequestrar radicais livres, os quais são prejudiciais à saúde humana (ALVES et al., 2007; NEVES et al., 2008). Alguns estudos in vitro demonstram que a atividade antioxidante dos flavonóides é maior que a das vitaminas E e C (RICE-EVANS et al., 1996 apud NEVES et al., 2008).
Diferentes autores vêm empregando o mesmo método para avaliação da capacidade antioxidante de espécies vegetais, tendo-se observado resultados semelhantes e significativos (LIMA et al., 2006; SOUSA et al., 2007; ROESLER et al., 2007; IHA et al., 2008; NUNES et al., 2008; AYRES, CHAVES, 2010).
CONSIDERAÇÕES FINAIS
Foram detectados diversos metabólitos nos extratos de folhas de V. palmarum e nas sementes de S. coronata responsáveis por conferir proteção para as plantas além de possuírem atividade biológica, oferecendo benefícios também à saúde humana. Foi possível observar atividade antioxidante para os extratos da espécie V. palmarum e S. coronata. Geralmente esta atividade tem sido correlacionada com a presença de flavonóides, classe que foi evidenciada para todas as amostras. A linearidade das curvas padrão de doseamento de flavonóides e DPPH foi confirmado através de métodos de tratamentos estatísticos (Método dos mínimos quadrados ordinários). Além disso, estudos mais aprofundados devem ser realizados para a utilização desses extratos pela população e desenvolvimento de formas farmacêuticas.
REFERÊNCIAS
ALVES CQ, Brandão HN, David JM, David JP, Lima LS. Avaliação da atividade antioxidante de flavonóides. Diálogos e ciência – Revista da rede ensino FTC, 5(12): 7- 8, 2007.
ASEM, A. Historical record on brine shrimp Artemia more than one thousand years ago from Urmia Lake, Iran. Journal of Biological Research-Thessaloniki., 2008. p. 113 – 114.
AYRES, M.C.C. et al. Constituintes químicos e atividade antioxidante de extratos as folhas de Terminalia fagifolia Mart. et Zucc. Química Nova, 33(1): 141-145, 2010.
BEDNARCZUK, V. O. et al. Testes in vitro e in vivo utilizados na triagem toxicológica de produtos naturais. Visão Acadêmica, v.11, n.2, p.44, 2010.
BELVISO, S., GHIRARDELLO, D., GIORDANO, M., RIBEIRO, G. S., ALVES, J. S., PARODI, S., RISSO, S., ZEPPA, G. Phenolic composition, antioxidant capacity and volatile compounds of licuri (Syagrus coronata (Martius) Beccari) fruits as affected by the traditional roasting process. Food Research International, v. 51, p. 39-45, 2013.
BENZING, D. H. 1990. Vascular epiphytes: general biology and related biota. Cambridge University Press Cambridge.
BESSA, C. M. A. D. S. et al. Syagrus coronata seed oils have antimicrobial action. Journal of Medicinal Plants Research, v. 10, p. 310-317, June 2016. ISSN 23.
BESSA, N.G.F. et al. Prospecção fitoquímica preliminar de plantas nativas do cerrado de uso popular medicinal pela comunidade rural do assentamento vale verde – Tocantins. Rev. Bras. Pl. Med., Campinas, v.15, n.4, supl.I, p.692-707, 2013.
BONDAR, G. As ceras no Brasil e o licuri Cocos coronata Mart. na Bahia. Salvador: Instituto Central de Fomento Econômico da Bahia, 1942, 86p.
BONDAR, G. O licurizeiro Cocos coronata Mart. e suas potencialidades na economia brasileira. Salvador: Instituto Central de Fomento Econômico da Bahia. 1938, 18p.
BORGO M., PETEAN, M. & SILVA, S.M., 2002. Epífitos vasculares em um remanescente de floresta estacional semidecidual, município de Fênix, PR, Brasil. Acta Biologica Leopoldinense 24: 121-130.
BRAND-WILLIAMS, W.; CUVELIER, M.E.; BERSET, C. Use of a free radical method to evaluate antioxidant activity. Lebensmittel-Wissenschaft und-Technologie, London, v.28, n.1, p. 25-30, 1995.
BREIER, T.B. 2005. O epifitismo vascular em florestas do sudeste do Brasil. Tese de Doutorado, Universidade Estadual de Campinas, Campinas.
BRITEZ, R.M., SILVA, S.M., SOUSA, W.S & MOTTA, J.T.W. 1995. Levantamento florístico em floresta ombrófila mista, São Mateus do Sul, Paraná, Brasil. Arquivos de Biologia e Tecnologia 38: 1147-1161.
BROWN, D.A., 1990. El epifitismo en las selvas montanas del Parque Nacional “El Rey” Argentina: Composición florística y patrón de distribución. Revista de Biologia Tropical 38: 155-166.
COSTA, A. F. Farmacognosia. 2 ed. Lisboa: Fundação Calouste Gulbenkian. v. 3. 1982.
CREPALDI, I. C.; ALMEIDA-MURADIAN, L. B.; RIOS, M. D. G.; PENTEADO, M. V. C.; SALATINO, A. Composição Nutricional do fruto de licuri (Syagrus coronata (Martius) Beccari). Revista Brasileira de Botânica, São Paulo, v.24, n.2, p.155159, 2001.
DRUMOND, M. A. Licuri Syagrus coronata (Mart.) Becc. Petrolina: Embrapa SemiÁrido, 2007, 16 p.
GENTRY, A.H. & DODSON C.H. 1987a. Contribution of non trees to species richness of a tropical rain forest. Biotropica 19: 149-156.
GENTRY, A.H. & DODSON C.H. 1987b. Diversity and biogeography of neotropical vascular epiphytes. Annals of the Missouri Botanical Garden 74: 205-223.
GRAHAM, H. D. Stabilization of the Prussian blue color in the determination of polyphenols. J. Agric. Food Chem., Columbus, v. 40, n. 5, p. 801-805, 1992.
HERNÁNDEZ, A. M.; PRIETO GONZÁLES, E. A. Plantas que contienen polifenoles. Revista Cubana de Investigaciones Biomedica, Ciudad de La Habana, v.18, n. 1, p. 12-14, 1999
HRAZDINA, G.; BORZEL, A. J.; ROBINSON, W. B. Studies on the stability of the anthocyanidin-3,5- diglucosides. Am. J. Enol. Vitic., v. 21, n. 4, p. 201-204, 1970.
HÖRNER, M. et al. Triazenos e atividade antibacteriana. Revista Brasileira de Ciências Farmacêuticas, v. 44, n. 3, p. 441-449, 2008.
HUGHES, A. F. D. S. et al. Antimicrobial Activity of Syagrus coronata (Martius). Brazilian Archives of Biology and Technology, Curitiba, v. 56, p. 269-274, March-April 2013.
IHA, S.M. et al. Estudo fitoquímico de goiaba (Psidium guajava L.) com potencial antioxidante para o desenvolvimento de formulação fitocosmética. Rev. Bras. Farmacogn., 18(3): 387-393, 2008.
KRESS, J.W. 1986. The systematic distribution of vascular epiphytes: an update. Selbyana 9: 2-22.
LIMA, A.R. et al. In vitro evaluation of the antioxidant activity of the hydroalcoholic extract of leaves of bardana. Rev. Bras. Farmacogn., 16(4): 531-536, 2006.
LOPES, V. da S. Morfologia e Fenologia Reprodutiva do Ariri (Syagrus vagans (Bondar) Hawkes) -Arecaceae- numa área de caatinga do Município de Senhor do Bonfim-BA. 2007. 70f. Dissertação (Mestrado em Agronomia) –
LORENZI, H.; SOUZA, H. M.; CERQUEIRA, L. S. C.; COSTA, J. T. M.; FERREIRA, E. Palmeiras Brasileiras e Exóticas Cultivadas. Nova Odessa: Instituto Plantarum, 2004, 416p.
LUNA, J.S. et al. A study of the larvicidal and molluscicidal activities of some medicinal plants from northeast Brazil. Journal of Ethnopharmacology. 2005. p. 199 – 206.
MEDEIROS-COSTA, J. T. As palmeiras (Palmae) nativas em Pernambuco, Brasil. 1982. 140f. Dissertação (Mestrado em Botânica) – Universidade Federal Rural de Pernambuco, Recife, 1982.
MEYER, N. et al. Brine shrimp: a convenient general bioassay for active plant constutints. Planta Médica, v. 45, [s.n.], p.31, 1982.
NEVES LC, ALENCAR SM, CARPES ST. Determinação da atividade antioxidante e do teor de compostos fenólicos e flavonóides totais em amostras de pólen apícola de Apis mellifera. Braz. J. Food Technol., 2(15), 2008.
NIEDER, J., ENGWALD, S., KLAWU, M.; BARTHLOTT, W. 2000. Spatial distribution of vascular epiphytes (including hemiepiphytes) in a lowland Amazonian rain forest (Surumoni crane plot) of southern Venezuela. Biotropica 32: 385- 396.
NOBLICK, L. R. Palmeiras das caatingas da Bahia e suas potencialidades econômicas. In: SIMPÓSIO SOBRE A CAATINGA E SUA EXPLORAÇÃO RACIONAL. 1986, Feira de Santana. Anais… Feira de Santana: UEFS, 1986, p.99-115.
NUNES, X.P. et al. Constituintes químicos, avaliação das atividades citotóxica e antioxidante de Mimosa paraibana Barneby (Mimosaceae). Rev. Bras. Farmacogn., 18: 718-723, 2008.
PAULA, J. R.; BARA, M.T.F. Farmacognosia 2. Universidade Federal de Goiás, Faculdade de Farmácia: Apostila de aulas práticas. 2007.
RAJANI GP, ASHOK P. In vitro antioxidant and antihyperlipidemic activities of Bauhinia variegata Linn. Indian J Pharmacol., 41(5):227–232, 2009.
RAMALHO, C. I. Estrutura da Vegetação e distribuição espacial do licuri (Syagrus coronata (Mart.) Becc.) em dois municípios do Centro Norte da Bahia, Brasil. 2008. 131 fl. Tese (Doutorado em Agronomia) – Centro de Ciências Agrárias – Universidade Federal da Paraíba, Areia, 2008.
RIBEIRO, J. E. L. S. et al. Flora da Reserva Ducke. Guia de identificação das plantas vasculares de uma floresta de terra firme na Amazônia Central. Manaus: INPA, 1999, 816p.
RICE-EVANS, C. A.; MILLER, N. J.; PAGANGA, G. Structure-antioxidant activity relationships of flavonoids and phenolic acids. Free Radical Biology and Medicine, New York, v. 20, n. 7, p. 933-956, 1996
ROCHA, K. M. R. D. Biologia reprodutiva da palmeira licuri (Syagrus coronata (Mart.) becc.) (arecaceae) na ecorregião do Raso da Catarina, Bahia. Maio – 2009. Dissertação (Programa de Pós-graduação em Ciências Florestais) – Universidade Federal Rural de Pernambuco.
ROESLER, R. et al. Atividade antioxidante de frutas do cerrado. Ciênc. Tecnol. Aliment., 27(1): 53-60, 2007.
RUFINO, M. U. D. L. et al. Conhecimento e uso do ouricuri (Syagrus coronata) e do babaçu. Acta Botanica Brasilica, Buíque, v. 22, p. 1141-1149, julho 2008. ISSN 4.
SEGALL, S. D., ARTZ, W. E., RASLAN, D. S., FERRAZ, V. P., TAKAHASHI, J. A. Ouricuri (Syagrus coronata) triacylglycerol analysis using HPLC and positive ion electrospray tandem MS. Journal of the American Oil Chemists’ Society, v. 81, n. 2, p. 143- 149, 2004.
SILVEIRA, E.R. Contribuição ao conhecimento químico de plantas nativas do Nordeste – Croton sonderianus Muell. Arg. 1979. Tese apresentada ao Departamento de Química Orgânica – Universidade Federal do Ceará. Fortaleza
SOUSA, C. M. M.; ROCHA E SILVA, H.; VIEIRA-JR, G. M.; AYRES, M. C. C.; COSTA, C. L. S.; ARAÚJO, D. S.; CAVALCANTE, L. C. D.; BARROS, E. D. S.; ARAÚJO, P. B. M.; BRANDAO, M. S.; CHAVES, M. H. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quim. Nova, v. 30, n. 2, p. 351-355, 2007
SWAIN, T.; HILLS, W.E. The phenolic constituents of Punnus domestica. The quantitative analysis of phenolic constituents. Journal of the Science of Food and Agriculture, London, v.19, p. 63-68, 1959.
VAN ACQUIRE, S. A. Structural aspects of antioxidant activity of flavonoids. Free Radic Biol Med., v. 20, n. 3, p. 331-342, 1996.
WAECHTER, J.L. 1992. O epifitismo vascular na planície costeira do Rio Grande do Sul. São Carlos, Tese de Doutorado, Universidade Federal de São Carlos, São Carlos.
[1] Graduando do Curso de Farmácia – Centro Universitário UniRuy Barbosa | Wyden – Salvador / BA.
[2] Professor Doutor do Curso de Farmácia – Centro Universitário UniRuy | Wyden – Salvador / BA.
Enviado: Março, 2019.
Aprovado: Julho, 2019.

