ARTIGO DE REVISÃO
FARIA, Raquel Vieira [1], FRANCO, Gabriela de Freitas [2], FAIDIGA, Leonardo [3]
FARIA, Raquel Vieira. FRANCO, Gabriela de Freitas. FAIDIGA, Leonardo. Abordagem perioperatória em transplante cardíaco: Diretriz 2018. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 07, Vol. 14, pp. 39-55. Julho de 2019. ISSN: 2448-0959
RESUMO
Objetivo: O presente estudo tem como objetivo descrever e divulgar as recomendações da 3ª Diretriz Brasileira de Transplante Cardíaco sobre abordagem perioperatória no transplante cardíaco. Metodologia: Para desenvolver a base teórica dessa pesquisa foi utilizado o método científico denominado de revisão bibliográfica. A fonte consultada foi a 3ª Diretriz Brasileira de Transplante Cardíaco realizado pelo Departamento de Estudos em Insuficiência Cardíaca (DEIC) da Sociedade Brasileira de Cardiologia (SBC) e Sociedade Brasileira de Cirurgia Cardiovascular (SBCCV), sendo publicado no Arquivo Brasileiro de Cardiologia em 2018. Conclusão: As diretrizes são atualizadas constantemente de acordo com as pesquisas mais recentes disponíveis. Conclui-se que é muito importante ampliar a divulgação da atualização da Diretriz Brasileira sobre Transplante Cardíaco, podendo ser mais um instrumento de consulta e apoio científico para equipes multiprofissionais e hospitais que oferecem o serviço de transplante cardíaco.
Palavras-chave: Diretriz Brasileira, transplante cardíaco, abordagem perioperatória.
1. INTRODUÇÃO
O 1º Transplante Cardíaco (TxC) aconteceu em 1967 em Cabo na África do Sul, sendo feita pelo Cirurgião Christiaan Neethlin.
O Sistema Nacional de Transplantes (SNT) no Brasil é responsável pelo monitoramento e controle dos transplantes de órgãos realizados dentro do país, gerenciando desde a regulamentação, as equipes e hospitais capacitados a efetuar os procedimentos até a logística de captação de órgãos e também o seguimento dos pacientes(1-3).
O programa de transplante de brasileiro é reconhecido em nível mundial por ter um sistema de transplantes 95% financiado com recursos públicos e também por ser o 2º país que mais efetua transplantes em números absolutos(4).
No Brasil, a lista nacional de espera para cada órgão é gerenciada pelo SNT, onde a ordem é individualizada. O coração, a distribuição necessita de duas regras: a numeração na lista de espera dos receptores, que é realizada pela idade, relação do peso doador-receptor, gravidade, compatibilidade sanguínea e tempo na lista única; e a regionalização, que dá prioridade aos receptores do mesmo estado do doador, seguido dos estados mais próximos, em consequência do tempo de isquemia do coração (4 horas) e questões logísticas(5,6).
O transplante cardíaco e a doação são atividades complementares, sendo somente executável através da doação de um órgão de doador falecido em morte encefálica. Esse tipo de transplante é considerado melhor tratamento para inúmeras doenças coronarianas crônicas e incapacitantes, principalmente a insuficiência cardíaca refratária, com o intuito de reabilitar o paciente e aprimorar a qualidade de vida, levando-o voltar às atividades realizadas antes da instalação da doença(7,8).
Nos últimos anos, importantes avanços têm ocorrido no diagnóstico, monitorização e tratamento da Insuficiência Cardíaca (IC), com verdadeiros impactos na qualidade de vida e na sobrevida desses pacientes. Ainda ocorrem altas taxas de mortalidade, hospitalizações e re-hospitalizações em estágios mais tardios da doença e com isso agrava o prognóstico dos pacientes. O TxC ainda é o tratamento preferencial para a insuficiência cardíaca no estágio D, sendo realizados mais de cento e dez mil procedimentos no mundo. Os desafios diários vivenciados pelas equipes de TxC são a espera pelo procedimento, reduzida disponibilidade de órgãos, na logística de captação, complicações devido à imunossupressão, ampliação de pacientes sensibilizados e em suporte circulatório mecânico(9).
A 3ª Diretriz Brasileira de Transplante Cardíaco, compõem recomendações atuais dos avanços obtidos nos últimos anos e que foram adicionados na rotina prática. Nesse documento teve a participação de profissionais atuantes na área, com experiência assistencial e de pesquisa validada, cujo colaboração foram decisivas para que o documento fosse atualizado e prático, se tornando um apoio para médicos e profissionais de saúde interessados em TxC(9).
O presente estudo tem como objetivo descrever e divulgar as recomendações da 3ª Diretriz Brasileira de Transplante Cardíaco sobre abordagem perioperatória no transplante cardíaco.
2. METODOLOGIA
Para desenvolver a base teórica dessa pesquisa foi utilizado o método científico denominado de revisão bibliográfica. A fonte consultada foi a 3ª Diretriz Brasileira de Transplante Cardíaco realizado pelo Departamento de Estudos em Insuficiência Cardíaca (DEIC) da Sociedade Brasileira de Cardiologia (SBC) e Sociedade Brasileira de Cirurgia Cardiovascular (SBCCV), sendo publicado no Arquivo Brasileiro de Cardiologia em 2018. Essa diretriz teve como apoio científico 274 estudos.
3. RESULTADOS
3.1 CAPTAÇÃO DE ÓRGÃOS
3.1.1 ORGANIZAÇÕES DE PROCURA DE ÓRGÃOS E ALOCAÇÃO DE ÓRGÃOS
São de responsabilidade da Central de Notificação, Captação e Distribuição de Órgãos (CNCDO) o gerenciamento dalogística e a distribuição de órgãos e tecidos para transplantes, sendo efetuadas nacionalmente pela Central Nacional de Transplantes (CNT) e, em nível estadual, pelas Secretarias de Saúde dos Estados/Secretaria Estadual de Transplantes(10).
As Organizações de Procura de Órgãos (OPO) constitui o processo de gerenciamento, e sua criação é depende das CNCDO. A criação das organizações de procura de órgãos ocorreu devido a desproporção entre o suprimento e a demanda de órgãos transplantados dentro do Brasil, que pode ser manejada através do aperfeiçoamento da qualidade do controle clínico de potenciais doadores(11).
As Comissões Intra-hospitalares de Doação de Órgãos e Tecidos para Transplante (CIHDOTT) agem em conjunto com as OPO e têm como objetivo a educação continuada na área da doação de órgãos, a ajuda no processo de diagnóstico de morte encefálica, a ajuda aos hospitais para a identificação dos potencias doadores e no fechamento do processo de doação e transplante, sendo formadas por um ou mais hospitais de sua região de atuação. A maioria das OPO no Brasil estão associadas a hospitais-escola e recebe auxílio financeiro do Ministério da Saúde(9).
3.1.2 CAPTAÇÃO DE ÓRGÃOS À DISTÂNCIA
No transplante de coração deve existir uma sincronia entre a preparação do doador e do receptor, sendo que na parte cientifica sugere que o tempo de isquemia fria não ultrapasse quatro horas, pois existe uma relação da disfunção dos enxertos com o tempo de isquemia fria do órgão utilizado(12,13).
Ainda não possui um critério preciso de captação à distância, porém define-se que a captação à distância é aquela efetuada em outra região sem ser a metropolitana que possui o centro transplantador, que o tempo de isquemia possa atingir ou ultrapassar duas horas e cidades com mais de 100 km entre o doador e o receptor(9).
Figura 1: Recomendações para captação de órgãos

3.1.3 TÉCNICA DA RETIRADA DO ENXERTO
Essa técnica permite que a anticoagulação plena com heparina, a aorta seja clampeada na transição diafragmática e continua coma descompressão do coração, fazendo uma abertura da veia pulmonar superior d esquerda ou direita, e após realizando a secção da cava superior ou inferior. No seguimento a aorta ascendente é clampeada, e uma solução cardioplégica, é administrada. Segue com a cardiectomia realizando a secção dos vasos. Quando é necessário a retirada dos pulmões, o remanescente de átrio esquerdo e artéria pulmonar são diminuídos. Nesta situação, precisa ter cuidado na opção das técnicas de implante(14).
3.1.4 TÉCNICAS DE PRESERVAÇÃO DE ÓRGÃOS
Para preservar os órgãos é necessário a diminuição da atividade metabólica através da hipotermia, manter as condições físicas e bioquímicas do meio de preservação, e modular a resposta de reperfusão. As soluções utilizadas são cardioplégicas e divididas em extracelulares ou intracelulares, dependendo da concentração de sódio, maior ou menor que 70 mEq/L, respectivamente. Não existe evidências científicas que tragam a superioridade de um ou outro tipo de solução cardioplégica, no TxC(15-17).
Figura 2: Recomendações para o uso de soluções de preservação
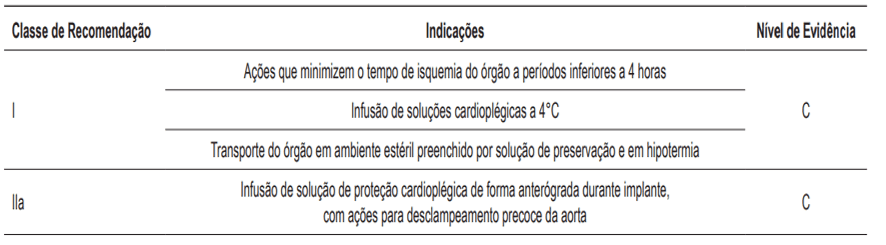
Até o momento as técnicas existentes não conseguiram provar a eficácia em proteger um órgão por tempo superior a 4 a 6 horas, mas possui situações em que a isquemia é tolerada acima deste tempo, por exemplo, dependente da idade do doador, utilização de baixa dose de droga inotrópica para manter a hemodinâmica, função cardíaca preservada e exames laboratoriais apresentando valores dentro da referencia de normalidade(9).
3.2 ASPECTOS DA CIRURGIA
A principal técnica abrange a efetuação de 4 anastomoses: átrio esquerdo e direito, artéria pulmonar e aorta(18-20). Devido a ocorrência de arritmias atriais e insuficiência tricúspide, a técnica bicaval hoje é a mais utilizada(19,20). A sequência das anastomoses pode diferir, pois depende do tempo de isquemia(9).
As técnicas de abordagens bipulmonar e de podem ser efetuadas quando há trombose ou calcificação do átrio esquerdo e neoplasia cardíaca. Nestas técnicas, ocorre o mínimo remanescente do coração doente(9). Os corações provindos de doadores pequenos e receptores com hipertensão pulmonar importante, tem indicação de transplante heterotópico(19,20).
3.3 ANESTESIA E MONITORAÇÃO
3.3.1 HEMODINÂMICA
A hemodinâmica pode ser avaliada através da monitoração de: ECG com 5 derivações, pressão arterial invasiva, oxímetro de pulso, capnógrafo, PVC, débito urinário e temperatura nasofaríngea(21).
São considerados desafios do perioperatório o manejo volêmico quanto o diagnóstico preciso do status hemodinâmico do paciente submetido ao TxC. O risco de hipovolemia quanto a hipervolemia podem causar à queda do débito cardíaco e à redução da perfusão sistêmica. A monitorização de variáveis dinâmicas (Delta PP e variação de volume sistólico) são melhores às estáticas (Pressão Venosa Centra – PVC, Débito Cardíaco – DC e Pressão de Oclusão na Artéria Pulmonar – POAP). É necessária uma monitorização mais refinada e uma cautelosa infusão de fluidos durante a cirurgia quando o paciente possuir aspectos de gravidade(9).
As flutuações glicêmicas ocorrem com maior frequência nos pacientes que fazem a cirurgia cardíaca, mesmo na inexistência de diabetes previamente. Para redução da morbimortalidade é esperado como meta glicêmica o valor de < 180 mg/dL (22).
O lactato é outra variável que deve ser medida e ser utilizada como meta no perioperatório. Nas cirurgias cardíacas, a grande maioria dos pacientes apresentam hiperlactatemia, sendo que é necessário de seis a doze horas para conseguir redução dos seus níveis. Caso o lactato seja mantido acima de 4,4 mmol/L e que permanecendo por mais de 30 horas no pós-operatório estão relacionados à aumento da mortalidade(23-26).
No pós-operatório imediato é colocado como meta hemodinâmica: PAM ≥ 65 mmHg; índice cardíaco > 2,8 L/minuto/m2; PVC ≤ 12 mmHg; Pressão Capilar Pulmonar (PCP) de 12 mmHg; Saturação Venosa Central (SVO2) > 65%; frequência cardíaca > 100 bpm; e diurese ≥ 0,5 mL/kg/hora(9).
3.3.2 VENTILAÇÃO MECÂNICA
Para aumentar a reserva de oxigênio e reduzir o risco de hipoxemia é realizado a pré-oxigenação com Fração Inspirada de Oxigênio (FiO2) em torno de 100%(27).
Em pacientes com diminuição da complacência abdominal e naqueles em que é preciso a utilização de FiO2 de 100% para pré-oxigenação a utilização da Ventilação Mecânica Não Invasiva (VNI) durante a indução anestésica é recomendada, sendo efetiva na prevenção da formação de atelectasias em pacientes com redução da complacência abdominal(28,29).
Não existe ainda nenhuma evidência científica com comprovação do benefício de um modo ventilatório em detrimento de outro no intraoperatório. Existe a recomendação da utilização de ventilação mecânica com volume corrente de 6 mL/kg de peso predito. Vários estudos em diversos cenários (cirurgia abdominal, torácica e cardíaca) relatam o benefício de se utilizar baixo volume corrente durante cirurgia. As manobras de recrutamento alveolar podem ser utilizadas após o tempo cirúrgico principal para amenizar colapso alveolar e otimizar a oxigenação(30-35).
Quando o paciente estiver hemodinamicamente estável, é necessário tentar a retirada da ventilação mecânica no pós-operatório de modo precoce, preferencialmente nas primeiras 12 a 24 horas pós-operatórias(9).
3.3.3 HEMODERIVADOS
Devido o uso frequente de antiagregantes plaquetários e quanto pelo uso da Circulação Extracorpórea (CEC) os pacientes que realizam a cirurgia cardíaca com CEC são suscetíveis a grandes perdas sanguíneas. No cuidado perioperatório é necessário ter atenção na utilização de drogas e técnicas que reduzam as perdas sanguíneas, sendo que essas podem ser os gatilhos para transfusão de sanguínea e leucorredução de hemoderivados com o intuito de diminuir a sensibilização do receptor(9).
Figura 3: Critérios de transfusão perioperatória

3.4 DISFUNÇÃO PRIMÁRIA DO ENXERTO
3.4.1 DEFINIÇÃO E IMPORTÂNCIA
A definição de disfunção primária do enxerto (DPE) são: fração de ejeção ≤ 40% evidenciada nas primeiras 24 horas após o TxC, uso de doses progressivas de drogas vasoativas, e implantação de dispositivos de assistência ventricular mecânica para suporte circulatório. A presença de ruídos hidroaéreos (RHA), sepse, Disfunção Ventricular Direita (DVD) associada à hipertensão pulmonar e sangramento são critérios para excluir a disfunção primária do enxerto(36-38).
A International Society for Heart and Lung Transplantation (ISHLT) tem registrado que nos primeiros 30 dias pós-TxC são registrados 66% dos óbitos devido a “falência do enxerto” e “disfunção multiorgânica”, sendo que a provável causa desses episódios são atribuídos a DPE(39).
3.4.2 PATOGENIA E FATORES DE RISCO
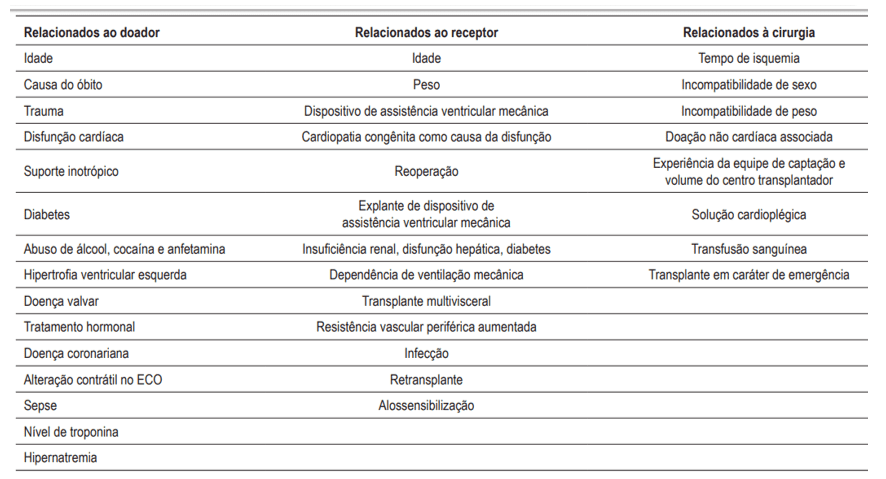
A patogenia da DPE é considerada multifatorial e engloba fatores da enxertia, do procedimento e do receptor(40). Na figura 4 abaixo estão descritos os fatores de risco mais conhecidos(41).
Figura 4: Fatores de risco para falência primária do enxerto
3.4.3 GRAVIDADE
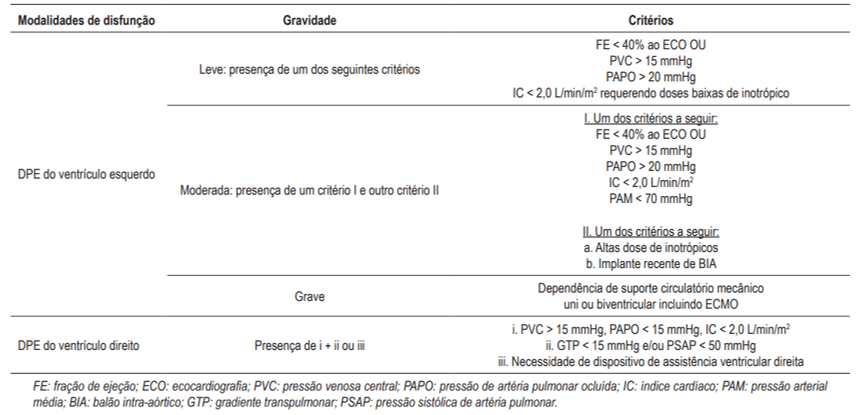
A gravidade da DPE é estabelecida através de parâmetros ecocardiográficos, hemodinâmicos e terapêuticos (42).
Figura 5: Definição da gravidade da disfunção primária do enxerto (DPE)
3.4.4 BIOMARCADORES
A Switich/Sucrose (SWI/SFN) não fermentável, matriz que possui relação dependente da actina reguladora da subfamília a-like 1 da cromatina (SMARCAL1), uma proteína intracelular que se comporta como uma adenosinatrifosfatases (DNA-ATPase) no reparo da cromatina, que monstrou uma maior relação no desenvlvimento de DPE. A troponina I, o BNP, troponina T e a pró-calcitonina, estão sendo testadas também com resultados promissores(43-45).
3.4.5 PREVENÇÃO E TRATAMENTO
Doses escalonadas de vasodilatadores, vasopressores, inotrópicos e óxido nítrico é considerado o tratamento padrão (Figura 6)(36).
Figura 6: Diagnóstico e tratamento da DPE

BIA: Balão intra-aórtico
A Oxigenação por Membrana Extracorpórea (ECMO) é utilizada como o suporte circulatório temporário mais estudado no cenário de DPE nos casos mais refratários de tratamento(9). No estudo de D’Alessandro et al. (46) foram estudados noventa pacientes com DPE grave, sendo que, destes, 54 fizeram a utilização da ECMO. Os pacientes que utilizaram a ECMO obtiveram uma sobrevida em 1 ano maior do que o grupo que utilizou outro tipo de dispositivo. Nos pacientes de menor gravidade foram submetidos com terapêutica inotrópica e atingiram sobrevida de 46%(46,47). O uso de CentriMag VAS® foi relatado em trinta e oito pacientes com DPE grave que obtiveram uma sobrevida de cinquenta porcento em 30 dias e trinta e dois em 1 ano(48).
4. CONCLUSÃO
Conclui-se que é muito importante ampliar a divulgação da atualização da Diretriz Brasileira sobre Transplante Cardíaco, podendo ser mais um instrumento de consulta e apoio científico para equipes multiprofissionais e hospitais que oferecem o serviço de transplante cardíaco.
REFERÊNCIAS
- Mangini, S.; Alves, B. R.; Silvestre, O. M. et al. Transplante Cardíaco: Revisão. Einstein, v. 13, n. 2, p. 310-318. São Paulo: 2015.
- Silva, P. R. Transplante cardíaco e cardiopulmonar: 100 anos de história e 40 de existência. Rev Bras Cir Cardiovasc, v. 23, n. 1, 145-152. São José do Rio Preto: 2008.
- Brasil. Incor atinge marca de mil transplantes de coração e de pulmão. Ministério da Saúde, Portal Brasil, São Paulo: 2016.
- Associação Brasileira de Transplante de Órgãos. Dimensionamento dos transplantes no Brasil e em cada estado (2009-2016). RBT. 2016;XXII(4).
- Ministério da Saúde(BR). Gabinete do Ministro. Portaria nº 2.600, de 21 de outubro de 2009. Aprova o Regulamento Técnico do Sistema Nacional de Transplantes. Brasília; 2009.
- Central Estadual de Transplantes do Paraná (BR). Secretaria Estadual da Saúde. Manual de transplantes. 3. ed. Borges HF, Telles LMP, organizadores. Curitiba; 2014.
- Bacal F, Souza Neto JD, Fiorelli AI, Mejia J, Marcondes-Braga FG, Mangini S, et al. II Diretriz Brasileira de Transplante Cardíaco. Arq Bras Cardiol. 2010;94(1Suppl1):e16-e73.
- Mantovani VM, Silveira CB, Lima LL, Orlandin L, Rabelo-Silva ER, Moraes MA. Comparison of quality of life between patients on the waiting list and heart transplant recipients. Rev Gaúcha Enferm. 2016;37(4):e53280.
- Bacal F, Marcondes-Braga FG, Rohde LEP, Xavier Júnior JL, de Souza Brito F, Moura LZ, et al. 3ª Diretriz Brasileira de Transplante Cardíaco. Arq Bras Cardiol. 2018; 111(2):230-289
- Brasil. Ministério da Saúde. Saúde Legis. [Internet]. [Acesso em 2019 mar 14]. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/gm/2009/prt2600_21_10_2009.html.
- Westphal GA. A simple bedside approach to therapeutic goals achievement during the management of deceased organ donors–An adapted version of the “VIP” approach. Clin Transplant. 2016;30(2):138- 44.
- Ackemann J, Gross W, Mory M, Schaefer M, Gebhard MM. Celsior versus custodiol: early postischemic recovery after cardioplegia and ischemia at 5 degrees C. Ann Thorac Surg. 2002;74(2):522-9.
- Pickering JG, Boughner DR. Fibrosis in the transplanted heart and its relation to donor ischemic time. Assessment with polarized light microscopy and digital image analysis. Circulation. 1990;81(3):949-58.
- Camp PC Jr. Heart transplantation: donor operation for heart and lung transplantation. Operative Techniques in Thoracic and Cardiovascular Surgery. 2010;15(2):125-37.
- Latchana N, Peck JR, Whitson B, Black SM. Preservation solutions for cardiac and pulmonary donor grafts: a review of the current literature. J Thorac Dis. 2014;6(8):1143-9. doi: 10.3978/j.issn.2072- 1439.2014.05.14. Erratum in: J Thorac Dis. 2014;6(9):E207-8.
- Wildhirt SM, Weis M, Schulze C, Conrad N, Rieder G, Enders G, et al. Effects of Celsior and University of Wisconsin preservation solutions on hemodynamics and endothelial function after cardiac transplantation in humans: a single-center, prospective, randomized trial. Transpl Int. 2000;13 Suppl 1:S203-11.
- Michel P, Vial R, Rodriguez C, Ferrera R. A comparative study of the most widely used solutions for cardiac graft preservation during hypothermia. J Heart Lung Transplant. 2002;21(9):1030-9.
- Ranjit J, Liao K. Orthotopic heart transplantation. Operative Techniques in Thoracic and Cardiovascular Surgery. 2010;15(2):138-46.
- Barnard CN. The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town. S Afr Med J. 1967;41(48):1271-4.
- Hunt SA. Taking heart–cardiac transplantation past, present and future. N Engl J Med. 2006;355(3):231-5. doi: 10.1056/NEJMp068048. Erratum in: N Engl J Med. 2006;355(9):967
- Smith JA, Dunning JJ, McNeil K, Cave M, Large SR, Wallwork J. Postoperative management of the heart transplant patient. Clin Intensive Care.1994;5(4):180-5.
- Jacobi J, Bircher N, Krinsley J, Agus M, Braithwaite SS, Deutschman C, et al. Guidelines for the use of an insulin infusion for the management of hyperglycemia in critically ill patients. Crit Care Med. 2012;40(12):3251- 76.
- Kogan A, Preisman S, Bar A, Sternik L, Lavee J, Malachy A, et al. The Impact of hyperlactatemia on postoperative outcome after adult cardiac surgery. J Anesth. 2012;26(2):174-8.
- Longrois D, Hoeft A, De Hert S. 2014 European Society of Cardiology/ European Society of Anaesthesiology guidelines on non-cardiac surgery: cardiovascular assessment and management: a short explanatory statement from the European Society of Anaesthesiology members who participated in the European Task Force. Eur J Anaesthesiol. 2014;31(10):513-6.
- Cecconi M, Corredor C, Arulkumaran N, Abuella G, Ball J, Grounds RM, et al. Clinical review: Goal-directed therapy-what is the evidence in surgical patients? The effect on different risk groups. Crit Care. 2013;17(2):209.
- Grocott MP, Dushianthan A, Hamilton MA, Mythen MG, Harrison D, Rowan K; Optimisation Systematic Review Steering Group. Perioperative increase in global blood flow to explicit defined goals and outcomes after surgery: a Cochrane Systematic Review. Br J Anaesth. 2013;111(4):535- 48.
- Smetana GW, Lawrence VA, Cornell JE; American College of Physicians. Preoperative pulmonary risk stratification for noncardiothoracic surgery: Systematic review for the American College of Physicians. Ann Intern Med. 2006;144(8):581-95.
- Canet J, Gallart L. Predicting postoperative pulmonary complications in the general population. Curr Opin Anaesthesiol. 2013;26(2):107-15.
- Hedenstierna G. Oxygen and anesthesia: what lung do we deliver to the post-operative ward? Acta Anaesthesiol Scand. 2012;56(6):675-85.
- Heimberg C, Winterhalter M, Strüber M, Piepenbrock S, Bund M. Pressure-controlled versus volume-controlled one-lung ventilation for MIDCAB. Thorac Cardiovasc Surg. 2006;54(8):516-20.
- Hemmes SN, Serpa Neto A, Schultz MJ. Intraoperative ventilatory strategies to prevent postoperative pulmonary complications: a metaanalysis. Curr Opin Anaesthesiol. 2013;26(2):126-33.
- Serpa Neto A, Cardoso SO, Manetta JA, Pereira VG, Espósito DC, Pasqualucci Mde O, et al. Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA. 2012;308(16):1651-9.
- Futier E, Constantin JM, Paugam-Burtz C, Pascal J, Eurin M, Neuschwander A, et al; IMPROVE Study Group. A trial of intraoperative low-tidal-volume ventilation in abdominal surgery. N Engl J Med. 2013;369(5):428-37.
- Unzueta C, Tusman G, Suarez-Sipmann F, Böhm S, Moral V. Alveolar recruitment improves ventilation during thoracic surgery: a randomized controlled trial. Br J Anaesth. 2012;108(3):517-24.
- Neligan PJ. Postoperative noninvasive ventilation. Anesthesiol Clin. 2012;30(3):495-511.
- Kobashigawa J, Zuckermann A, Macdonald P, Leprince P, Esmailian F, Luu M, et al; Consensus Conference participants. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 2014;33(4):327-40.
- Christie JD, Carby M, Bag R, Corris P, Hertz M, Weill D; ISHLT Working Group on Primary Lung Graft Dysfunction. Report of the ISHLT Working Group on Primary Lung Graft Dysfunction part II: definition. A consensus statement of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2005;24(10):1454-9.
- Iyer A, Kumarasinghe G, Hicks M, Watson A, Gao L, Doyle A, et al. Primary graft failure after heart transplantation. J Transplant. 2011;2011:175768.
- Wever-Pinzon O, Edwards LB, Taylor DO, Kfoury AG, Drakos SG, Selzman CH, et al. Association of recipient age and causes of heart transplant mortality: Implications for personalization of post-transplant managementAn analysis of the International Society for Heart and Lung Transplantation Registry. J Heart Lung Transplant. 2017;36(4):407-17.
- Russo MJ, Iribarne A, Hong KN, Ramlawi B, Chen JM, Takayama H, et al. Factors associated with primary graft failure after heart transplantation. Transplantation. 2010;90(4):444-50.
- Hong KN, Iribarne A, Worku B, Takayama H, Gelijns AC, Naka Y, et al. Who is the high-risk recipient? Predicting mortality after heart transplant using pretransplant donor and recipient risk factors. Ann Thorac Surg. 2011;92(2):520-7.
- Boccheciampe N, Audibert G, Rangeard O, Charpentier C, Perrier JF, Lalot JM, et al. Serum troponin Ic values in organ donors are related to donor myocardial dysfunction but not to graft dysfunction or rejection in the recipients. Int J Cardiol. 2009;133(1):80-6.
- Aharinejad S, Andrukhova O, Gmeiner M, Thomas A, Aliabadi A, Zuckermann A, et al. Donor serum SMARCAL1 concentrations predict primary graft dysfunction in cardiac transplantation. Circulation. 2009;120(11 Suppl):S198-205.
- Nicolas-Robin A, Salvi N, Medimagh S, Amour J, Le Manach Y, Coriat P, et al. Combined measurements of N-terminal pro-brain natriuretic peptide and cardiac troponins in potential organ donors. Intensive Care Med. 2007;33(6):986-92.
- Potapov EV, Wagner FD, Loebe M, Ivanitskaia EA, Müller C, Sodian R, et al. Elevated donor cardiac troponin T and procalcitonin indicate two independent mechanisms of early graft failure after heart transplantation. Int J Cardiol. 2003;92(2-3):163-7.
- D’Alessandro C, Golmard JL, Barreda E, Laali M, Makris R, Luyt CE, et al. Predictive risk factors for primary graft failure requiring temporary extracorporeal membrane oxygenation support after cardiac transplantation in adults. Eur J Cardiothorac Surg. 2011;40(4):962-9.
- Taghavi S, Zuckermann A, Ankersmit J, Wieselthaler G, Rajek A, Laufer G, et al. Extracorporeal membrane oxygenation is superior to right ventricular assist device for acute right ventricular failure after heart transplantation. Ann Thorac Surg. 2004;78(5):1644-9.
- Thomas HL, Dronavalli VB, Parameshwar J, Bonser RS, Banner NR; Steering Group of the UK Cardiothoracic Transplant Audit. Incidence and outcome of Levitronix CentriMag support as rescue therapy for early cardiac allograft failure: a United Kingdom national study. Eur J Cardiothorac Surg. 2011;40(6):1348-54.
[1] Graduanda em Medicina pela Universidade Brasil – Fernandópolis, Brasil.
[2] Graduanda em Medicina pela Universidade Brasil – Fernandópolis, Brasil.
[3] Médico Especialista em Cirurgia Geral pelo Hospital de Ensino Santa Casa de Misericórdia de Fernandópolis – Fernandópolis, Brasil. Graduado em Medicina pela Universidade Camilo Castelo Branco – Fernandópolis, Brasil. Professor e Preceptor do Curso de Medicina da Universidade Brasil – Fernandópolis, Brasil.
Enviado: Março, 2019.
Aprovado: Julho, 2019.
