ARTIGO DE REVISÃO
QUEIROZ, Kamyla Oliveira de [1]
QUEIROZ, Kamyla Oliveira de. Potencial de novos sistemas de liberação de drogas no manejo tópico da candidíase recorrente na mucosa vaginal. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 06, Ed. 07, Vol.08, pp.194-211. Julho de 2021. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/mucosa-vaginal
RESUMO
A candidíase é uma infecção oportunista causada por fungos do gênero Candida, cujo patógeno mais identificado nos pacientes é candida albicans. Episódios recorrentes podem afetar partes superficiais do corpo, incluindo tecidos mucocutâneos e atingir órgãos mais profundos e a corrente sanguínea, tornando-se uma infecção invasiva. Embora infecções recorrentes relacionadas à candidíase invasiva sejam a condição mais grave, a candidíase superficial recorrente (CSR) é notavelmente comum, ocorrendo em diferentes populações, imunocompetentes e imunocomprometidos. Tentando fornecer um panorama completo para as novas perspectivas no manejo tópico da candidíase recorrente na mucosa vaginal, este trabalho busca saber quais as estratégias mais promissoras de combate à CSR diante de uma perspectiva da tecnologia farmacêutica? Assim, o objetivo geral deste trabalho é apresentar novos sistemas de liberação de drogas no manejo tópico da candidíase recorrente na mucosa vaginal. Trata-se de um estudo de revisão de literatura narrativa de abordagem qualitativa, fundamentado pelas bases de dados SciELO, Pubmed e Medline, priorizando apenas artigos, não esgotando as fontes de informações sujeitas à subjetividade dos autores. Os resultados mostraram que estudos recentes apontam para o uso promissor da terapia fotodinâmica e de ferramentas da tecnologia farmacêutica no combate às infecções por candidíase. O uso de ferramentas de tecnologia farmacêutica parece ser a forma mais rápida e econômica de se obter resultados promissores contra candidíase recorrente na mucosa vaginal.
Palavras-chave: Tratamento Tópico, Candidíase Recorrente, Mucosa Vaginal.
INTRODUÇÃO
A candidíase é uma infecção oportunista causada por fungos do gênero Candida. Candida albicans é o patógeno identificado na maioria dos pacientes com candidíase, mas outros possíveis patógenos também incluem espécies não-albicans de Candida (NACS) como Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Candida dubliniensis, Candida lusitaniae e Candida auris (OLIVEIRA, 2018; CORTEGIANI, 2018). Embora Candidaspp. fazem parte da microbiota humana média, alterações na imunidade do hospedeiro, estresse, desequilíbrio na microbiota residente e uso indiscriminado de antibióticos podem levar ao crescimento excessivo de fungos, desencadeando mais de um episódio de candidíase (SALAZAR, 2020).
Episódios recorrentes podem afetar partes superficiais do corpo, incluindo tecidos mucocutâneos (por exemplo, vaginal, oral, mamário), e atingir órgãos mais profundos e a corrente sanguínea, tornando-se uma infecção invasiva (PAPPAS, 2016). Embora infecções recorrentes relacionadas à candidíase invasiva sejam a condição mais grave, a candidíase superficial recorrente (CSR) é notavelmente comum, ocorrendo em diferentes populações, imunocompetentes e imunocomprometidos (OLIVEIRA, 2018). RSC é um desafio cada vez maior na prática clínica, principalmente pela presença de um biofilme fúngico e pela alta resistência aos antifúngicos.
Biofilmes são estruturas muito complexas e difíceis de destruir por agentes químicos e físicos, contribuindo para uma das maiores preocupações médicas em RSC: a resistência antifúngica (SILVA, 2017).
Tentando fornecer um panorama completo para as novas perspectivas no manejo tópico da candidíase recorrente, este trabalho busca saber quais as estratégias mais promissoras de combate à CSR diante de uma perspectiva da tecnologia farmacêutica? Em hipótese, pode-se dizer que as estratégias mais promissoras de combate à CSR são correlacionadas aos requisitos e desafios para o sucesso da terapia tópica conforme os principais sítios dessa afecção. Além disso, é possível dizer ainda que a relação entre biofilmes e resistência antifúngica na recorrência da candidíase, possui foco nas infecções superficiais.
Esta revisão discute o entendimento atual da CSR e o uso de ferramentas de tecnologia farmacêutica na obtenção de melhores resultados. Vale salientar também que a pesquisa mostrará possíveis terapias medicamentosas tópica e antimicrobiana a fim de correlacionar os resultados. Assim, o objetivo geral deste trabalho é apresentar novos sistemas de liberação de drogas no manejo tópico da candidíase recorrente na mucosa vaginal. Em específico, os objetivos que norteiam a pesquisa são: (1) apresentar as estratégias promissoras de combate à CSR com os requisitos e desafios para o sucesso da terapia tópica de acordo com os principais sítios dessa afecção; (2) discutir a relação entre biofilmes e resistência antifúngica na recorrência da candidíase, com foco nas infecções superficiais; (3) Enfatizar as aplicações de várias novas abordagens de drogas antifúngicas, demonstrando vantagens e limitações; e (4) Correlacionar os resultados das terapias medicamentosas tópica e antimicrobiana para a CSR.
A candidíase é uma infecção oportunista comum causada por fungos da espécie Candida gênero que afeta principalmente os tecidos mucocutâneos (por exemplo, vaginal, oral e mamário). Essa condição é conhecida há muito tempo; assim, inúmeros tratamentos tópicos e sistêmicos já estão disponíveis no mercado mundial (RÉ, 2021).
No entanto, a candidíase superficial recorrente (CSR) é um desfecho esperado, ainda sem tratamentos eficazes e convenientes. Embora várias condições individuais possam contribuir para a recorrência da doença, a presença de biofilmes parece ser o principal fator etiológico que contribui para a resistência antifúngica (GENOVESE, 2019).
Este estudo possui relevância para a comunidade acadêmica e científica, uma vez que se concentra em melhorar os aspectos da tecnologia farmacêutica. Isso inclui estender e melhorar o contato íntimo dos sistemas de distribuição de drogas com os tecidos mucocutâneos, aumentando a dose de carga da droga, e aumentar a permeação de medicamentos tópicos.
CANDIDÍASE SUPERFICIAL RECORRENTE: UMA VISÃO GERAL
A candidíase vulvovaginal (CVV) é uma infecção comum causada por espécies de Candida que produz sintomas como prurido, queimação, dor na vulva, dispareunia, disúria e uma secreção característica de “queijo cottage” (ROSATI, 2020; WILLEMS, 2020). A candidíase recorrente é caracterizada por pelo menos três episódios de infecção por cândida em 12 meses (ROSATI, 2020; WILLEMS, 2020). A prevalência, de acordo com Foxman (2013) é de até 9% para candidíase recorrente para aquelas que já tiveram CVV. É estimado que a candidíase recorrente afeta cerca de 138 milhões de mulheres em todo o mundo anualmente e quase 500 milhões durante sua vida (DENNING, 2018).
Embora C. albicansé o principal agente patológico de CVV, espécies NACS (C. tropicalis , C. krusei , C. parapsilosis , especialmente C. glabrata ) foram mais comumente isoladas entre pacientes com episódios de recorrência do que em mulheres com infecções esporádicas por Cândida (GONÇALVES, 2016). Os episódios de recorrência possuem natureza multifatorial, que incluem alterações no sistema imunológico, genéticas (exemplo, mutação de genes), biológicas (alteração do macroambiente) ou fatores comportamentais (uso de antibióticos, contraceptivos orais ou dispositivos intrauterinos) (ROSATI, 2020; DENNING, 2018; SOBEL, 2016).
Outro fator decisivo ligado aos casos de recorrência é a resistência à terapia antifúngica devido à formação de biofilme, conforme discutido na Seção. 3
PRINCIPAIS CAUSAS DE RECORRÊNCIA
RESISTÊNCIA ANTIFÚNGICA
Semelhante aos antibióticos para infecção bacteriana, o surgimento de resistência antifúngica entre as espécies de Cândida é uma séria ameaça à saúde pública em todo o mundo (BATTACHARYA, 2020). No entanto, os patógenos fúngicos possuem um desafio particularmente interessante: como o hospedeiro humano, os fungos também são eucariotos e, portanto, compartilham muitos dos mesmos processos bioquímicos de seu hospedeiro (BUTTS, 2016).
As classes de antifúngicos disponíveis incluem azóis (por exemplo, fluconazol, clotrimazol, itraconazol), polienos (por exemplo, anfotericina B e nistatina) e equinocandinas (por exemplo, caspofungina, anidulafungina e micafungina), que têm como alvo a biossíntese de ergosterol ou, duas características celulares ausentes em células de mamíferos (Tabela 1) (SALAZAR, 2020).
Os compostos de fluoropirimidina como 5-fluorocitosina são um pró-fármaco também usado como agente antifúngico (MCEVOY, 2020). Porém, devido aos seus efeitos tóxicos, esse agente é administrado aos pacientes em baixa concentração e em combinação com outros antifúngicos.
Tabela 1 – Classes de antifúngicos e seus mecanismos de ação contra espécies de cândida com maior potencial de resistência.
| Agentes antifúngicos | Alvo | Resultado | Candida spp. resistente |
| Azoles | Lanosterol 14-α-esterol desmetilase | Acúmulo de esteróis tóxicos na membrana plasmática, afetando sua permeabilidade | C. glabrata , C. krusei e alguns casos C. albicans (BHATTACHARYA, 2020; SALAZAR, 2020) |
| Polienos | Ergosterol | Formação de poros transmembrana e perturba o equilíbrio hidroeletrolítico | C. glabrata e C. krusei (o uso de doses máximas é recomendado) (EFIMOVA, 2014). |
| Echinocandins | β- (1 → 3) -d-Glucan sintase | Nenhum alongamento de β- (1 → 3) -d-glucanos nas paredes das células fúngicas, favorecendo a lise | Constatou-se que C. parapsilosis é intrinsecamente menos suscetível (SALAZAR, 2020; PERLIN, 2011). |
| Fluoropirimidinas | Timidilato sintase | Inibição da biossíntese de ácido nucleico e síntese de proteínas | C. krusei (BHATTACHARYA, 2020; SALAZAR, 2020). |
Fonte: adaptado de Ré, 2021.
O número limitado de alvos distintos sendo explorados pelos antifúngicos atuais é uma preocupação séria, pois aumenta a probabilidade de desenvolver resistência clínica, especialmente em casos de RSC (BUTTS, 2016). O desenvolvimento de resistência clínica é um processo complexo e envolve três fatores principais (Fig. 1): a suscetibilidade do hospedeiro, a falta de eficácia do medicamento e a resistência microbiana. Juntos, todos os três fatores contribuem coletivamente para o fracasso terapêutico (PERLIN, 2015).
Figura 1 – Os três fatores que levam à resistência clínica dos antifúngicos no tratamento da candidíase superficial
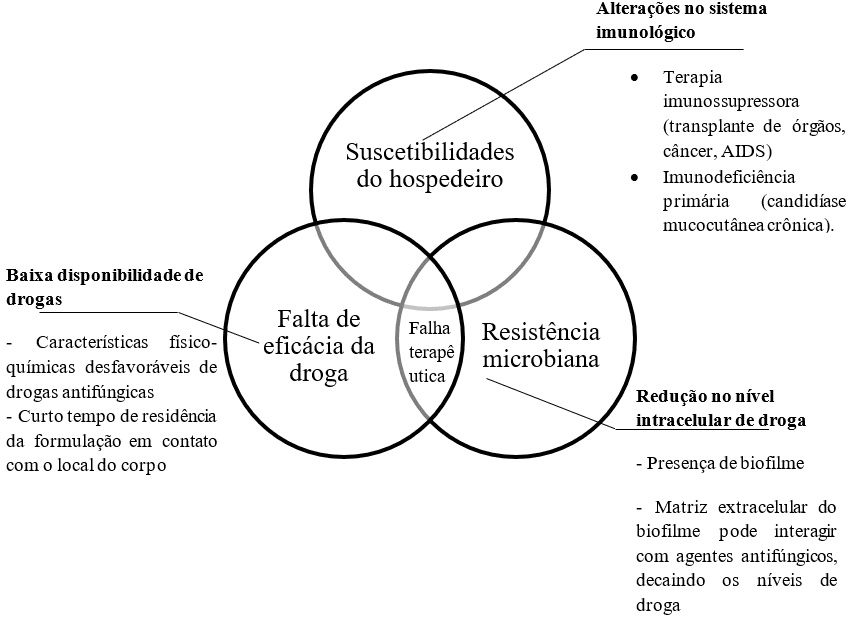
O primeiro fator engloba várias situações que levam a suscetibilidades do hospedeiro, envolvendo principalmente alterações do sistema imunológico (CIUREA, 2020; COWEN, 2015). Pacientes com sistema imunológico comprometido têm maior probabilidade de reduzir o sucesso da terapia, pois alguns medicamentos antifúngicos precisam da assistência de uma resposta imunológica robusta (PERLIN, 2017).
O segundo fator está relacionado a fatores que afetam a eficácia do medicamento, em que uma terapia apropriada requer que o medicamento atinja o local da infecção em concentração suficiente para uma ação antifúngica (COWEN, 2015). As diferenças na biodisponibilidade do medicamento, dependendo dos tecidos-alvo, podem explicar resultados diferentes dos mesmos regimes de terapia (BHATTACHARYA, 2020). Na verdade, a biodisponibilidade do fluconazol demonstrou ser 12 vezes menor na cavidade vaginal do que em outros tecidos, o que pode causar a exposição de microrganismos a drogas em níveis subótimos, levando à seleção de espécies resistentes (COWEN, 2015; FELTON, 2017; SOBEL, 2014). Para isso, o uso generalizado e inadequado de tratamentos antifúngicos, principalmente por automedicação, pode levar à seleção de espécies de NACS (principalmente C. glabrata), que têm sido frequentemente isoladas em casos de episódios recorrentes de candidíase na mucosa vaginal (GONÇALVES, 2016; SOBEL, 1998; SPINILLO, 1994).
Portanto, a resistência microbiana está diretamente relacionada à falta de eficácia do medicamento, o que pode levar a células infectantes persistentes que podem formar reservatórios semeando novas infecções (COWEN, 2015). A resistência microbiana pode ser definida como a não suscetibilidade de um patógeno fúngico a um agente antifúngico, determinada por testes de suscetibilidade in vitro em comparação com outros isolados da mesma espécie (SANGUINETTI, 2015). O patógeno pode ser uma cepa resistente primária, que é resistente sem exposição prévia a drogas (também chamada de resistência intrínseca) ou, alternativamente, o micróbio pode adquirir um atributo de resistência ou característica em uma cepa de outra forma suscetível após a exposição à droga (resistência adquirida) (COWEN, 2015; SANGUINETTI, 2015). Os mecanismos de resistência responsáveis por ambas as condições estão bem caracterizados, principalmente aqueles relacionados à redução do nível intracelular do fármaco, o que inclui a presença de biofilme (PERLIN, 2015). A produção de biofilmes fúngicos fornece um santuário seguro para fungos e resulta em um alto nível de resistência à maioria dos agentes antifúngicos (WU, 2017).
FORMAÇÃO DE BIOFILME
Biofilmes microbianos são responsáveis por mais de 60% de todas as infecções microbianas em humanos, incluindo casos de RSC (INIGO, 2018). Biofilmes causam infecções recorrentes que são difíceis de erradicar devido à sua alta resistência a tratamentos antimicrobianos e sua excelente capacidade de aderir a biomateriais (INIGO, 2018; MUZNY, 2015). Em RSC, C. albicans é o modelo de formação de biofilme mais estudado, e seu biofilme apresenta características semelhantes às dos biofilmes bacterianos (COSTA-ORLANDI, 2018).
Um biofilme pode ser definido como uma comunidade séssil derivada de micróbios caracterizada por células que são irreversivelmente ligadas a um substrato ou interface ou entre si, incorporadas em uma matriz de substâncias poliméricas extracelulares exibindo um fenótipo alterado em relação à taxa de crescimento e transcrição do gene (DONLAN, 2002). A formação de biofilmes de C. albicans envolve quatro estágios: aderência, iniciação (também conhecida como proliferação), maturação e dispersão (Fig. 2)
Fig. 2 – Quatro estágios da formação de biofilme de C.albicans
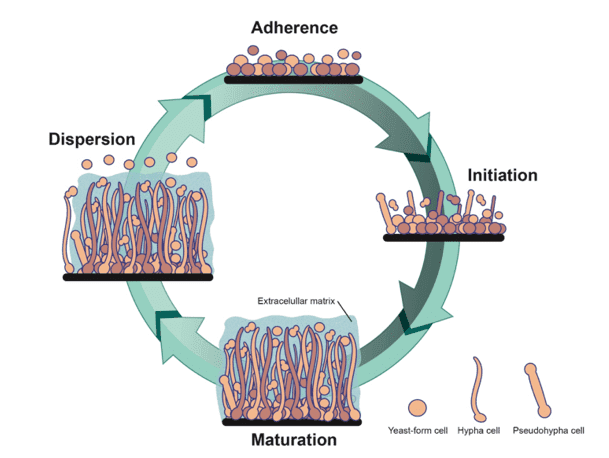
Resumidamente, no estágio de aderência, as células em forma de levedura aderem a uma superfície sólida, formando uma camada basal que ancora o biofilme (LOHSE, 2018). Posteriormente, no estágio de iniciação, as células pseudo-hifais e hifais começam a se formar e se alongar, proliferando ao longo da conclusão da formação do biofilme (COSTA-ORLANDI, 2018). Durante o processo de maturação, as células fúngicas produzem maiores quantidades de substâncias poliméricas extracelulares, que formam a matriz do biofilme. Para fungos, um biofilme maduro é caracterizado por uma mistura estruturada de células em forma de levedura, pseudo-hifas e hifas circundadas por esta matriz, juntamente com a presença de canais de água que permitem a circulação de nutrientes (LOHSE, 2018; COSTA-ORLANDI, 2018).
A matriz extracelular é um biomaterial viscoso e funciona como uma barreira física protetora do meio ambiente, proporcionando integridade estrutural ao biofilme e sendo crítica na resistência de biofilmes maduros à ruptura mecânica e distribuição de drogas (WU, 2017). No estágio final, o biofilme dispersa lentamente as células em forma de levedura predominantemente, disseminando a infecção (COSTA-ORLANDI, 2018).
Várias razões foram propostas para a alta resistência dos biofilmes aos agentes antifúngicos, incluindo um estado metabólico reduzido ou fisiologia específica das células do biofilme (WUYTS, 2018). Mesmo assim, a matriz extracelular tem sido identificada como um dos principais fatores de resistência, sendo uma barreira física que impede o contato droga-célula (BORGHI, 2016). Polissacarídeos presentes na matriz do biofilme de C. albicans parecem desempenhar um papel importante no sequestro de agentes antifúngicos (LOHSE, 2018). Por exemplo, β-1,3-glucano, o principal polissacarídeo produzido pelo biofilme C. albicans , pode interagir com o fluconazol e anfotericina B, reduzindo a eficácia do tratamento (VEDIYAPPAN, 2010).
Atualmente, não há nenhuma droga que almeje especificamente a formação de biofilme para tratar candidíase, tornando o tratamento de infecções baseadas em biofilme particularmente problemático (NOBILE, 2015). Além disso, informações sobre episódios recorrentes de candidíase relacionados a outras Candida sp. modelos de biofilme em humanos ainda são muito limitados. Compreender os mecanismos subjacentes à formação e manutenção do biofilme pode levar ao desenvolvimento de novos antifúngicos, visando especificamente o estado do biofilme, o que pode ajudar a evitar episódios recorrentes de infecções fúngicas superficiais.
ESTRATÉGIAS DE TRATAMENTO TÓPICO
CANDIDÍASE VULVOVAGINAL RECORRENTE: TRATAMENTOS CONVENCIONAIS
Embora não haja um protocolo padrão definido para CVVR, a prática usual é prescrever antifúngicos locais e orais, seguido por um longo período de terapia de manutenção (MATHESON, 2017). Diferentemente da CVV não complicada que pode ser tratada com sucesso com uma dose única de 150 mg de fluconazol oral, os casos de CVV requerem um tratamento prolongado (DOVNIK, 2015). O regime de indução da CVV consiste na administração de três doses de fluconazol oral, uma vez a cada 72 h, associado a antifúngicos tópicos que são, tipicamente, azólicos em formulações em creme ou supositório. Outras estratégias disponíveis incluem nistatina e ácido bórico para espécies refratárias ao tratamento com azol, como C. glabrata (DENNING, 2018; SOBEL, 2016) A Tabela 2 resume as terapias convencionais e as informações físico-químicas dos medicamentos mais utilizados nos casos de episódios de CVVR.
Tabela 2 – opções de regime de candidíase vulvovaginal recorrente (CVVR)
| Agente | Peso molecular | Solubilidade da droga | Log P | Formulação | Dose |
| Fluconazol | 306.271 | 1.39 | 0.58 | 150mg cápsula oral | 150mg a cada 72h por 3 dias. |
| Itraconazol | 705.633 | 0.00964 | 5.48 | 200mg cápsula oral | 400mg x 3 dias. |
| Clotrimazol | 344.837 | 0.00147 | 5.48 | 1% creme vaginal
2% creme vaginal 100mg tablete vaginal 100mg tablete vaginal 500mg tablete vaginal |
5g x 7 dias
5g x 3 dias 100mg x 7 dias 200mg x 3 dias 500 mg x 1 dia |
| Miconazol | 416.129 | 0.000763 | 5.86 | 2% de creme vaginal | 5g x 7 dias |
| 4% de creme vaginal | 5g x 3 dias | ||||
| 100mg supositório vaginal | 100mg x 7 dias | ||||
| 200mg supositório vaginal | 200mg x 3 dias | ||||
| 1200mg supositório vaginal | 1200mg x 1 dia | ||||
| Tioconazol | 387.711 | 0.0165 | 4.86 | 2% creme vaginal | 5g x 3 dias |
| 6.5% pomada | 5g x 1 dia | ||||
| Butoconazol | 411.776 | 0.000818 | 6.7 | 2% creme vaginal | 5g x 1 dia |
| Nistatina | 926.107 | 0.086 | -3.1 | 100,000 IU tablete vaginal | 100,000 IU x 14 dias |
| Ácido bórico | 61.833 | 0.0057 | -0.51 | 600mg supositório vaginal | 600mg x 14 dias. |
Fonte: Adaptado de Ré, 2021.
Embora a terapia convencional seja eficaz no alívio dos sintomas, ela não promove a cura dos casos de CVVR. A evidência atual sugere que, no caso da indução com fluconazol e da terapia de manutenção, mais da metade dos pacientes apresenta recidiva após 6 meses (DENNING, 2018; SOBEL, 2016). Uma possível explicação para uma taxa de recorrência tão elevada está nas próprias limitações das formulações utilizadas. O primeiro desafio é a solubilidade dos antifúngicos em uso atualmente. Para que um medicamento seja ativo no trato vaginal, ele deve ser minimamente solúvel em fluidos locais para ser liberado da formulação e, conforme descrito na Tabela 1, a maioria deles é pouco solúvel em água (OLIVEIRA, 2015). Após a liberação do medicamento, a absorção vaginal pode ser retomada em duas etapas principais; primeiro, a droga é dissolvida no lúmen vaginal; em segundo lugar, ele penetra na membrana e é absorvido (JOHAL, 2017). Portanto, a solubilidade e a dissolução são importantes para a liberação do fármaco, e a lipofilicidade moderada ajudaria na permeabilidade da membrana, juntamente com o peso molecular moderado (<500 Da) (MARWHA, 2017).
Portanto, para uma terapia bem-sucedida, a formulação deve manter contato prolongado com a mucosa vaginal, o que é um desafio para os sistemas convencionais de entrega vaginal (ou seja, cremes vaginais, pomadas, supositórios e comprimidos). A secreção de fluido vaginal produzida pelo colo do útero, endométrio e trompas de falópio representa um impedimento ao contato prolongado entre a droga ativa e o local-alvo. Mulheres em idade reprodutiva produzem 2 a 5 mL de fluido vaginal por dia (SOBEL, 2019). Embora uma certa quantidade de fluido ajude a solubilidade de drogas mais hidrofílicas, uma produção mais alta pode lavar a formulação do local de ação / absorção antes do tempo necessário para que a formulação seja eficaz (HUSSAIN, 2005).
Além disso, os casos de CVVR requerem terapias de longo prazo, o que torna mais significativas outras desvantagens dos sistemas convencionais de administração de drogas vaginais, especialmente a confusão e o desconforto durante e após a aplicação, vazamentos, aderência subótima ao epitélio da vagina, necessidade de administração frequente e não -doses uniformes (JOHAL, 2014). Todos esses fatores podem contribuir para a baixa adesão do paciente e favorecer o fracasso terapêutico, levando à recorrência. Portanto, novas abordagens para estender e melhorar o contato íntimo dos sistemas de administração de drogas com a mucosa vaginal são um foco da pesquisa atual e, de fato, são extremamente necessárias para tornar o tratamento de CVVR mais eficaz (SOBEL, 2016).
CANDIDÍASE VULVOVAGINAL RECORRENTE: NOVAS ABORDAGENS
Em resumo, os dois principais desafios para o desenvolvimento de uma formulação tópica eficaz são (i) contornar as características físico-químicas desfavoráveis dos antifúngicos e (ii) prolongar o tempo de residência da formulação no lúmen vaginal. O primeiro desafio pode ser evitado com o uso de técnicas de micro ou nanoencapsulação e complexação de medicamentos. Algumas dessas técnicas também apresentam desempenho positivo no que diz respeito ao tempo de residência, principalmente pelo emprego de excipientes mucoadesivos, que podem promover maior permanência da formulação no trato vaginal. Outras abordagens incluem sistemas líquidos de termogelização, que passam por uma transição sol-gel após a administração vaginal (RÉ, 2021).
Excipientes mucoadesivos são polímeros adesivos (naturais ou sintéticos) que podem formar ligações com tecidos biológicos, especialmente se o tecido for um muco (BRAHMBATT, 2017). Esses excipientes promovem longos períodos de contato do medicamento com o local de absorção, reduzindo a necessidade de re-administração e aumentando a eficácia do tratamento. Dependendo do arranjo do polímero dentro da formulação, uma liberação controlada do medicamento pode ser obtida (JOHAL, 2014). Alguns dos polímeros mucoadesivos mais frequentemente usados em formulações vaginais são poliacrilatos (por exemplo, carbômeros e policarbófilos), derivados de celulose (por exemplo, hidroxietilcelulose e hidroxipropilmetilcelulose) e quitosana (OLIVEIRA, 2015).
Os polímeros mucoadesivos também podem ser combinados com sistemas de termogelização, que se caracterizam por sua baixa viscosidade, favorecendo a aplicação e espalhabilidade na mucosa vaginal, uma vez que o processo de gelificação ocorre em resposta à temperatura fisiológica (CARAMELLA, 2015). Para isso, os copolímeros de poli (óxido de etileno-óxido de propileno-óxido de etileno) (EOa-POb-EOa; poloxâmero) têm sido amplamente usados em novos sistemas de entrega de drogas vaginais (ROSSI, 2014).
Um dos primeiros estudos sobre novas formulações para controlar infecções por Candida mostrou a maior eficácia da anfotericina-B e cetoconazol carregados em nanopartículas em comparação com micropartículas contendo as mesmas drogas contra leveduras C. albicans e biofilme de Candida. A atividade antifúngica in vitro das nanopartículas foi de 8 a 10 vezes maior contra células planctônicas de Candida do que contra biofilmes de Candida. Além disso, as formas nanoparticuladas foram 2 a 4 vezes mais eficazes do que suas micro-contrapartes, demonstrando que as nanopartículas produzem melhores resultados, provavelmente porque poderiam ser melhor espalhadas proporcionando maior biodisponibilidade (RANDHAWA, 2015).
Micro e nanopartículas também podem ser combinadas com polímeros bioadesivos, o que foi proposto para uma nova formulação contendo miconazol aprisionado em microesponjas vaginais, com Carbopol como polímero bioadesivo. Foi formulado para aumentar a retenção vaginal, prolongar a permanência do medicamento no trato vaginal e ter liberação controlada do medicamento, além de minimizar a irritação local. A formulação de microsponge foi comparada com a formulação de miconazol convencional comercializada. Os testes de atividade antifúngica in vitro contra C. albicans não demonstraram diferença significativa entre as micro-esponjas e a formulação tradicional, enquanto a atividade antifúngica in vivo em ratos infectados com C. Albicans mostrou um efeito antifúngico significativo aprimorado da nova formulação. Na verdade, o gel de micro-esponja mostrou melhor aderência à parede da vagina e liberação prolongada do medicamento, afetando a eficácia (SALAH, 2018).
O miconazol também foi estudado em micropartículas com base em matrizes lipídicas biocompatíveis e polietilenoglicol (PEG) em comparação com uma loção de miconazol comercializada (Fungusol ®). O PEG é um potencializador de penetração na membrana, que é uma qualidade desejável para tratar RVVC, uma vez que o fármaco atingiria o local da infecção mais facilmente, enquanto a matriz lipídica melhoraria a solubilidade do fármaco. Os transportadores à base de lipídios PEGuilados aumentariam a distribuição da droga e o contato com uma camada mais profunda da mucosa vaginal, melhorando assim os níveis locais da droga ativa e proporcionando uma administração mais eficiente da droga (KENECHUKWU, 2018).
Sem dúvida, um desafio adicional no desenvolvimento de formulações inovadoras com desempenho melhorado é a necessidade de avaliar tais formulações in vivo, já que os métodos in vitro comumente usados que empregam tecido animal excisado não fornecem as características fisiológicas responsáveis por desafiar a permanência da formulação no local de aplicação. Para isso, protocolos ex vivo usando vagina suína podem ser extremamente úteis. Um protocolo proposto recentemente que mantém o tecido vaginal em pé verticalmente poderia mimetizar uma condição mais próxima da fisiologia normal, considerando o possível vazamento da formulação quando aplicada na vagina, e evidenciou a mucoadesão e resistência à drenagem de novas formulações (PEREIRA, 2017).
A complexação de drogas também foi aplicada para aumentar a solubilidade. Um gel termogelante mucoadesivo contendo cetoconazol complexado com β-ciclodextrina mostrou melhor atividade antifúngica in vitro do que o produto comercializado em um ensaio piloto randomizado e controlado conduzido no Egito com 100 pacientes com CVV. As mulheres foram divididas em dois grupos, um recebeu gel termogelante de cetoconazol (50 mg KTZ / dia / 3 dias) e o outro recebeu creme vaginal de terconazol, Gynoconazol ® (80 mg terconazol / dia / 3 dias). Os resultados indicam o sucesso da ciclodextrina em melhorar a solubilidade do fármaco, e as propriedades da formulação também possibilitaram uma ótima resposta com o uso de doses menores de cetoconazol, reduzindo a chance de manifestação de efeitos adversos (ABD ELLAH, 2019).
Um estudo mais recente avaliou a eficácia in vivo e o potencial clínico de polimetacrilatos derivados de RAFT como um melhor tratamento para CVVR do que as formulações convencionais de nistatina em um supositório vaginal e clotrimazol em creme. Dois polimetacrilatos, KL706 e KL708, preparados na forma de hidrogel bioadesivo foram eficazes em matar biofilmes associados ao epitélio in vivo em concentrações 50 vezes abaixo das formulações convencionais de nistatina e clotrimazol e com baixa toxicidade local e também foram eficazes em matar células persistentes após o tratamento com o formulação convencional de anfotericina B, que apresenta uma opção viável no tratamento de CVVR: usar antifúngicos pós-convencionais de polimetacrilato para evitar recorrência. Os polimetacrilatos são uma nova classe de agentes antimicrobianos que têm demonstrado atividade in vitro contra Biofilmes de C. albicans. As formulações bioadesivas mostraram contato prolongado com o lúmen vaginal, com uma boa quantidade de formulação presente no local de administração mesmo após 48 h em modelos de camundongos infectados com isolados de C. albicans de pacientes com CVV e CVVR (WU, 2019).
CONSIDERAÇÕES FINAIS
A candidíase recorrente pode afetar várias partes do corpo, principalmente as partes superficiais, como a mucosa oral e vaginal. O tratamento comumente envolve um regime de uso prolongado de antifúngicos tópicos e, em casos graves, a associação com antifúngicos orais. Infelizmente, o número de classes de antifúngicos é menor em comparação com os antibióticos, e apenas quatro classes principais de antifúngicos são usados atualmente para tratar a candidíase. Nesse cenário, a busca por novos antifúngicos tem sido alvo de diversos estudos. Embora o grande potencial dos produtos naturais seja extensivamente investigado, ainda há necessidade de se buscar novos compostos e elucidar mais detalhes sobre o mecanismo de ação dos antifúngicos existentes nas infecções por candidíase.
Este estudo teve por objetivo apresentar novos sistemas de liberação de drogas no manejo tópico da candidíase recorrente na mucosa vaginal, buscando conhecer as estratégias mais promissoras de combate à CSR diante de uma perspectiva da tecnologia farmacêutica. Assim, os resultados demonstraram que os estudos mais recentes apontaram para o uso promissor da terapia fotodinâmica e de ferramentas da tecnologia farmacêutica no combate às infecções por candidíase. O uso de ferramentas de tecnologia farmacêutica parece ser a forma mais rápida e econômica de se obter resultados mais promissores. A nanotecnologia, por exemplo, pode fornecer melhores resultados ao aumentar a dose de carga do medicamento e favorecer o processo de internalização do medicamento, principalmente em biofilmes. Embora várias desvantagens das formulações convencionais tenham sido contornadas com o uso de técnicas de nano ou microencapsulação e com a ajuda de excipientes de formulação mucoadesiva.
Além disso, a maioria das pesquisas visa apenas cepas de C. albicans e usa apenas ensaios com culturas de células em forma de levedura. Embora C. albicans ainda seja o patógeno de maior interesse, modelos biológicos envolvendo outras espécies de Candida, NACS, devem ser desenvolvidos e estudados. Ademais, pesquisas envolvendo biofilmes podem contribuir para resultados mais precisos, principalmente se forem biofilmes polimicrobianos, com a presença de espécies fúngicas e bactérias, simulando o mais próximo possível a condição microbiana existente nos locais de infecção. Esses modelos podem ser valiosos em estudos pré-clínicos e podem reduzir as chances de falha das formulações potenciais nos estágios iniciais de desenvolvimento, especialmente antes de conduzir testes clínicos caros.
REFERÊNCIAS
ABD ELLAH NH, ABDEL-ALEEM JA, ABDO MN, ABOU-GHADIR OF, ZAHRAN KM, HETTA HF. Eficácia dos flocos em gel de cetoconazol no tratamento da candidíase vaginal: formulação, avaliação in vitro e clínica. Int J Pharm. 2019.
BHATTACHARYA S, SAE-TIA S, FRIES BC. Candidíase e mecanismos de resistência antifúngica. Antibióticos (Basel) [Internet]. 2020 [citado em 13 de julho de 2020]; 9. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7345657/
BORGHI E, BORGO F, MORACE G. Biofilmes fúngicos: atualização na resistência. Adv Exp Med Biol. 2016.
BRAHMBHATT D. Sistemas de entrega de drogas bioadesivas: visão geral e avanços recentes. Jornal Internacional de Química e Ciências da Vida. 2017.
BRUSCHI ML, DE FRANCISCO LMB, DE TOLEDO L DE AS, BORGHI FB. Uma visão geral das patentes recentes sobre sistemas de distribuição de medicamentos oftálmicos baseados em nanocarreadores. Pat Drug Deliv Formul. 2015.
BUTTS A, PALMER GE, ROGERS PD. Adjuvantes antifúngicos: preservando e ampliando o arsenal antifúngico. Virulência. 2016; 8: 198–210.
CARAMELLA CM, ROSSI S, FERRARI F, BONFERONI MC, SANDRI G. Sistemas mucoadesivos e termogelantes para entrega vaginal de drogas. Adv Drug Deliv Rev. Elsevier BV; 2015; 92: 39–52.
CORTEGIANI A, MISSERI G, FASCIANA T, GIAMMANCO A, GIARRATANO A, CHOWDHARY A. Epidemiologia, características clínicas, resistência e tratamento de infecções por Candida auris. J Intensive Care [Internet]. 2018.
COSTA-ORLANDI CB, SARDI JCO, PITANGUI NS, DE OLIVEIRA HC, SCORZONI L, GALEANE MC, et al. Biofilmes fúngicos e doenças polimicrobianas. J Fungi (Basel) [Internet]. 2017.
COWEN LE, SANGLARD D., HOWARD SJ, ROGERS PD, PERLIN DS. Mecanismos de resistência aos antifúngicos. Cold Spring Harb Perspect Med [Internet]. 2015.
DENNING DW, KNEALE M, SOBEL JD, RAUTEMAA-RICHARDSON R. Carga global de candidíase vulvovaginal recorrente: uma revisão sistemática. Lancet Infect Dis Elsevier Ltd. 2018; 18: e339–47.
EFIMOVA SS, SCHAGINA LV, OSTROUMOVA OS. Investigação da atividade formadora de canais de antibióticos macrólidos de polieno em bicamadas lipídicas planas na presença de modificadores de dipolo. Acta Naturae. 2014.
GONÇALVES B, FERREIRA C, ALVES CT, HENRIQUES M, AZEREDO J, SILVA S. Candidíase vulvovaginal: epidemiologia, microbiologia e fatores de risco. Crit Rev Microbiol. Taylor e Francis; 2016.
ÍÑIGO M, POZO JLD. Biofilmes fúngicos: da bancada à cabeceira. Rev Esp Quimioter. 2018; 31: 35–8.
JOHAL HS, GARG T, RATH G, GOYAL AK. Sistema avançado de administração de medicamentos tópicos para o controle da candidíase vaginal. Drug Deliv. 2014.
LOHSE MB, GULATI M, JOHNSON AD, NOBILE CJ. Desenvolvimento e regulação de biofilmes mono e multiespécies de Candida albicans. Nat Rev Microbiol. 2018.
MARWAH H, GARG T, GOYAL AK, RATH G. Permeation enhancer strategy in transdérmico drug delivery. Drug Deliv. 2016.
MATHESON A, MAZZA D. Candidíase vulvovaginal recorrente: uma revisão das recomendações das diretrizes. Aust NZJ Obstet Gynaecol. 2017
MCEVOY K, NORMILE TG, POETA MD. Desenvolvimento de drogas antifúngicas: visando a via fúngica dos esfingolipídios. J Fungi (Basileia). 2020.
MUZNY CA, SCHWEBKE JR. Biofilmes: um mecanismo subestimado de falha de tratamento e recorrência em infecções vaginais. Clin Infect Dis. 2015.
NOBILE CJ, JOHNSON AD. Biofilmes de Candida albicans e doenças humanas. Annu Rev Microbiol. 2015.
OLIVEIRA R, PALMEIRA-DE-OLIVEIRA A, MARTINEZ-DE-OLIVEIRA J. Novas estratégias para o tratamento local de infecções vaginais. Adv Drug Del Rev. Elsevier BV; 2015.
OLIVEIRA SANTOS GC, VASCONCELOS CC, LOPES AJO, DE SOUSA CARTÁGENES M DO S, FILHO AKDB, DO NASCIMENTO FRF, et al. Infecções por Candida e estratégias terapêuticas: mecanismos de ação de agentes tradicionais e alternativos. Microbiol frontal [Internet]. 2018.
PAPPAS PG, KAUFFMAN CA, ANDES DR, CLANCY CJ, MARR KA, OSTROSKY-ZEICHNER L, et al. Diretriz de prática clínica para o manejo da candidíase: atualização de 2016 pela Infectious Diseases Society of America. Clin Infect Dis. 2016.
PEREIRA MN, REIS TA, MATOS BN, CUNHA-FILHO M, GRATIERI T, GELFUSO GM. Novo protocolo ex vivo usando vagina suína para avaliar a permeação de drogas de sistemas farmacêuticos mucoadesivos e coloidais. Colloids Surf, B. 2017.
PERLIN DS, RAUTEMAA-RICHARDSON R, ALASTRUEY-IZQUIERDO A. O problema global da resistência antifúngica: prevalência, mecanismos e gestão. Lancet Infect Dis. 2017.
PERLIN DS, SHOR E, ZHAO Y. Atualização sobre resistência a drogas antifúngicas. Curr Clin Microbiol Rep. 2015.
RANDHAWA MA, GONDAL MA, AL-ZAHRANI AHJ, RASHID SG, ALI A. Síntese, morfologia e atividade antifúngica de anfotericina B nanoparticulada, cetoconazol e timoquinona contra leveduras Candida albicans e biofilme de Candida. Jornal de Ciência e Saúde Ambiental – Parte A Substâncias Tóxicas / Perigosas e Engenharia Ambiental. 2015.
ROSATI D, BRUNO M, JAEGER M, DEZ OEVER J, NETEA MG. Candidíase vulvovaginal recorrente: uma perspectiva imunológica. Microorganismos [Internet]. 2020.
ROSSI S, FERRARI F, BONFERONI MC, SANDRI G, FACCENDINI A, PUCCIO A, et al. Comparação de géis termicamente sensíveis à base de poloxâmero e quitosana para o tratamento de mucosite vaginal. Drug Dev Ind Pharm. 2014.
SALAZAR SB, SIMÕES RS, PEDRO NA, PINHEIRO MJ, CARVALHO MFNN, MIRA NP. Uma visão geral sobre as abordagens terapêuticas convencionais e não convencionais para o tratamento da candidíase e mecanismos de resistência subjacentes em cepas clínicas. J Fungi (Basileia). 2020.
SANGUINETTI M, POSTERARO B, LASS-FLÖRL C. Resistência a antifúngicos entre espécies de Candida: mecanismos e impacto clínico. Mycoses. 2015.
SILVA S, RODRIGUES CF, ARAÚJO D, RODRIGUES ME, resistência antifúngica de biofilmes de espécies de Henriques M. Candida. J Fungi (Basel) [Internet]. 2017.
SOBEL JD. Candidíase vulvovaginal recorrente. Am J Obstet Gynecol. Elsevier Inc .; 2016; 214: 15–21.
SOBEL, JACK D., BARBIERI, ROBERT L, ECKLER, KRISTEN. Educação do paciente: corrimento vaginal em mulheres adultas (além do básico). Atualizado. 2019.
VEDIYAPPAN G, ROSSIGNOL T, D’ENFERT C. Interação de biofilmes Candida albicans com antifúngicos: resposta transcricional e ligação de antifúngicos a beta-glucanos. Antimicrob Agents Chemother. 2010.
WILLEMS HME, AHMED SS, LIU J, XU Z, PETERS BM. Candidíase vulvovaginal: uma compreensão atual e questões candentes. J Fungi (Basel) [Internet]. 2020.
WU S, WANG Y, LIU N, DONG G, SHENG C. Combatendo a resistência a fungos por inibidores de biofilme. J Med Chem. Am Chem Soc. 2017.
WU X, ZHANG S, XU X, SHEN L, XU B, QU W, et al. Polimetacrilatos derivados de RAFT como um tratamento superior para candidíase vulvovaginal recorrente, visando biofilmes bióticos e células persistentes. Front Microbiol. 2019.
WUYTS J, VAN DIJCK P. Células persistentes de Holtappels M. Fungal: a base para infecções recalcitrantes? PLoS Pathog [Internet]. 2018.
[1] Graduanda em Farmácia pela Universidade Nilton Lins
Enviado: Junho, 2021.
Aprovado: Julho, 2021.


Uma resposta
Muito bom seu artigo Parabéns pelas informação