BARRETO, Genesson [1]
BARRETO, Genesson. Litíase Renal. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 2, Ed. 01, Vol 1. pp 192-219, Abril de 2017. ISSN 2448-0959
1. INTRODUÇÃO
1.1 CONTEXTO HISTÓRICO
A existência de pedras nos rins foi primeiro relatado há milhares de anos, e a litotomiaé um dos primeiros procedimentos cirúrgicos conhecidos para a remoção de pedras. Sabe-se, por exemplo, da existência de relatos de 1901 sobre uma pedra descoberta na bacia de uma múmia egípcia antiga que foi datada de 4.800 aC.; e textos médicos da antiga Mesopotâmia, Índia, China, Pérsia, Grécia e Roma já mencionavam doença calculosa. Tanto que parte do juramento de Hipócrates sugere que cirurgiões já utilizavam de tal prática na Grécia antiga: “Não praticarei a talha, mesmo sobre um calculoso confirmado; deixarei essa operação aos práticos que disso cuidam”. Percebe-se assim que o tratado médico romano de Medicina por Aulus Cornelius Celsus continha uma descrição de litotomia, e este trabalho serviu de base para este procedimento até o século XVIII. (JUNIOR, et al., 2010)
Novas técnicas de litotomia começaram a surgir a partir de 1520, mas a operação permaneceu arriscada. Mais tarde Henry Jacob Bigelow popularizou a técnica de litholapaxy em 1878 e a taxa de mortalidade caiu de cerca de 24% para 2,4%. No entanto, outras técnicas de tratamento continuavam a produzir um alto nível de mortalidade, especialmente entre os pacientes de urologistas inexperientes. A litíase era um grande problema de saúde pública uma vez que a única opção terapêutica a ser utilizada era a cirurgia, e esta podia ter como consequencia para os doentes a destruição renal. Em 1980, Dornier MedTech introduziu as ondas de choque extracorpóreas (litotrícia extracorpórea) para quebrar as pedras através de impulsos acústicos e esta técnica tem vindo desde então em uso generalizado. Somado a isto, o desenvolvimento da endoscopia urológica simplificaram a abordagem terapêutica da litíase, tornando-a menos agressiva e com morbilidade e mortalidade menores. (GOMES, et al., 2005)
Pessoas famosas que tiveram pedra nos rins incluem Napoleão I, Napoleão III, Pedro o grande, Louis XIV, George IV, Oliver Cromwell, Lyndon, Benjamin Franklin, Michel de Montaigne, Francis Bacon, Isaac Newton, Samuel Pepys, William Harvey, Herman Boerhaave e Antonio Scarpa. (JUNIOR, et al., 2010)
1.2 EPIDEMIOLOGIA
A prevalência e a incidência de pedra nos rins tem sido relatada como crescente por todo o mundo. O conjunto de evidências sugerem que a prevalência e a incidência de pedras nos rins está crescendo globalmente. Esse crescimento é perceptível entre sexo, raça e idade. Mudanças nas práticas alimentares e o aumento da temperatura global podem ser classificados como os principais agentes indutores da nefrolitíase. (PETROIANU et al., 2001)
1.2.1 PREVALÊNCIA
Globalmente, sua presença é estimada de 2% a 3% da população geral, podendo-se afirmar que, aos 70 anos de idade, 12% das pessoas apresentaram pelo menos um episódio de litíase. (ROMERO, et al., 2010)
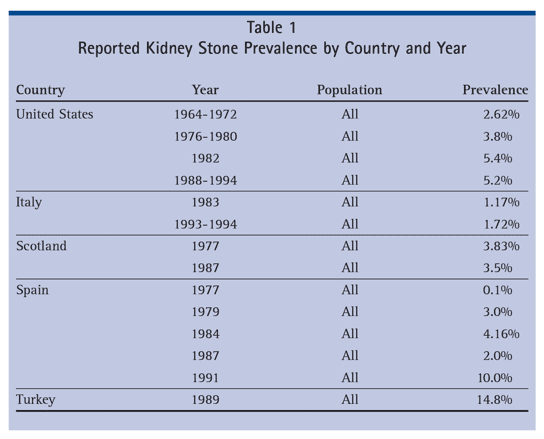
Nos Estados Unidos, o total de prevalência de pedras nos rins foi analisado de 1964 a 1972 e se estabilizou a partir da década de 1980. Outros países com crescimento na prevalência e incidência dessa doença incluem Alemanha, Espanha e Itália. Dados regionais de Milão documentam um aumento na prevalência de pedras nos rins. Somente na Escócia houve um considerável decréscimo na prevalência de 3,83% e 1977 para 3,5% em 1987. (ROMERO, et al., 2010).
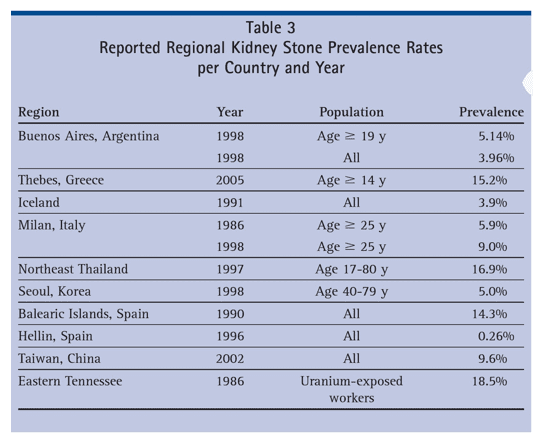
Os países que datam os dados de prevalência nas décadas de 1980 e 1990 mostram dados de prevalência de 3,25% em 1980 e 5,64% na década de 1990. A mais alta prevalência diante de todos estes dados foi observada em trabalhadores que tem contato com urânio (18,5%) e em adultos na Tailândia (16,9%). (ROMERO, et al., 2010)
1.2.2 INCIDÊNCIA
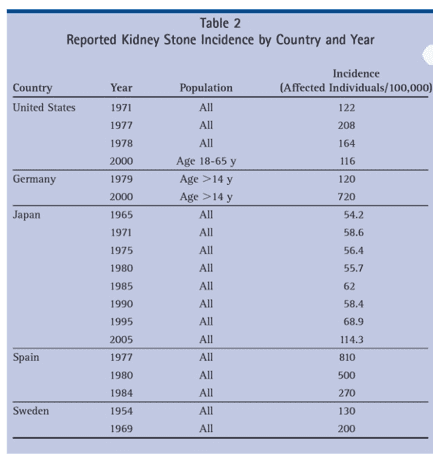
Nos Estados Unidos, o total de incidência cresceu de 1971 até 1978. No ano de 2000, a incidência de 1116/100.000 foi datada entre 18 a 64 anos de idade em dois grandes grupos. Esta incidência é significativamente alta, maior que a de outros períodos. Alguns estudos feitos em Manchester mostraram uma alta incidência de 1950 a 1990 com estabilização em 2000. No Japão, a incidência de pedra nos rins dobrou num período de 40 anos em ambos os sexos. Esse crescimento foi proeminente nos últimos 10 a 20 anos com taxas crescendo muito desde 1990 em homens e em mulheres, desde 1980. (ROMERO, et al., 2010)
1.2.3 SEXO E IDADE
Irã, Japão e os Estados Unidos tem incidência de pedras nos rins datadas e divididas por idade. As taxas de incidência datadas num grupo por idade o crescimento e a queda dos padrões de idade da população. (ROMERO, et al., 2010)
A idade do pico de incidência foi semelhante entre estes países (entre 40 e 49 anos), exceto pra mulheres japonesas, cujo pico de incidência acontece entre 50 e 59 anos. A taxa de incidência atual é semelhante pra homens entre 40 e 49 anos nos Estados Unidos e Japão mas é menor no Irã. (ROMERO, et al., 2010)
A prevalência de pedra nos rins tem crescido com o crescimento da idade no Irã, Islândia, Alemanha, Itália, Grécia, Turquia e Estados Unidos. Contudo, tem uma queda na prevalência nos italianos com idades menores que 60 anos. Na Coreia, a taxa de prevalência caiu com o envelhecimento dos homens mas cresceu em mulheres no pico de idade de 60 a 69 anos. Nos Estados Unidos, um estudo que aconteceu em 1976 até 1980, mostrou que a taxa de prevalência caiu das mulheres acima da idade de 59 anos e nos homens acima de 69, mas a partir das taxas de prevalência de 1991 continuo a crescer incluindo todas as faixas etárias. (ROMERO, et al., 2010)
Mais homens têm pedras nos rins que as mulheres. As proporções de sexo observadas foram de 2,5:1 no Japão e 1.15:1 no Irã. Porém existem faixas etárias em alguns países que essa proporção é reversa, como observado na alemanha na idade de 14 a 24 anos, em Milão na idade de 21 a 30 anos, de 60 a 79 na Coreia e de 20 a 29 nos Estados Unidos. Embora as mulheres demonstrem alta prevalência nestes casos, a diferença entre homens e mulheres ainda assim é muita. (ROMERO, et al., 2010)
1.2.4 RAÇA
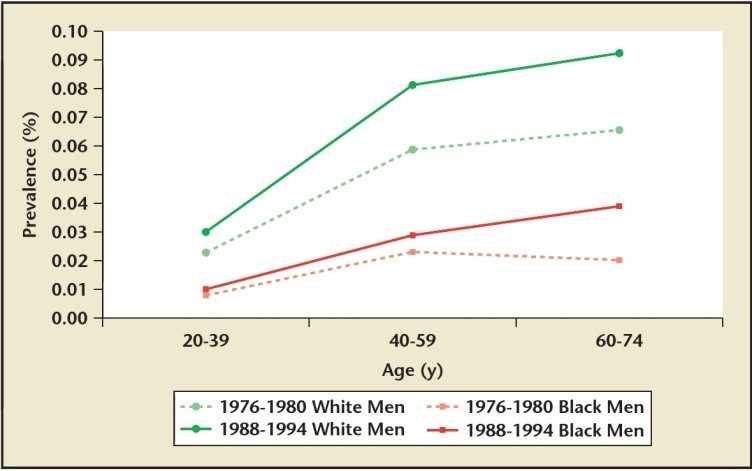
Os dados comparando comparando as diferenças entre as raças só foi possível nos EUA. A prevalência e incidência é mais alta em pessoas brancas, seguida de hispânicos, pessoas negras e asiáticos. Interessantemente, as pedras nos rins tiveram sua incidência dobrada em pessoas negras nos Estados Unidos em pessoas de 60 a 74 anos quando se compara o período de tempo de 1976 a 1980 e 1988 a 1994. Os homens brancos tiveram um crescimento na incidência da doença enquanto as mulheres tiveram uma queda nesta taxa. Independentemente da raça, o homem tem mais desta doença quando comparado a qualquer mulher da mesma raça. (ROMERO, et al., 2010)
Três estudos publicados entre 1991 e 2003 examinaram a taxa de prevalência de pedra nos rins assintomáticos utilizando ultrassonografia e optando por objetos de estudo selecionados aleatoriamente. A taxa de pedras nos rins assintomáticas nos objetos de estudo foram de 3%, 2,1% e 2% respectivamente no Paquistão , Dinamarca e no Japão. (ROMERO, et al., 2010)
A relação entre cálculo renal e cor da pele é um dos pontos interessantes que foram pouco estudados. A literatura mostra que a epidemiologia da nefrolitíase está relacionada à cor da pele e também a fatores genéticos e dietéticos. Os brasileiros são uma mistura de várias raças. Existem brancos provenientes de diferentes países europeus, a maioria deles de Portugal, Itália e Alemanha. Há ainda negros, descendentes de países da África Ocidental, principalmente de Angola, Moçambique e Nigéria. Um pequeno número de índios aborígines também podem ser encontrados em diversas regiões. Mais de um terço da população brasileira é composta de uma mistura de várias raças e, por isso, é classificada como mestiça. Essa origem mesclada de nossa população dificulta uma análise por raça. Entretanto, uma classificação de acordo com a cor da pele é possível. (PETROIANU et al., 2001)
1.3 DISCUSSÃO E CONCLUSÕES
Está havendo um aumento da prevalência e incidência de pedra nos rins nos EUA e em outras partes do mundo. A causa destas mudanças ainda não são tão claras. A formação de pedras nos rins tem por causa fatores genéticos e ambientais. Embora neste período tenha havido melhoras na produção de alimentos e o milho tenha se tornado alimento popular, o aumento no consumo de alimentos a base de amido e derivados do milho tem causado obesidade que é um dos fatores de risco pra formação de pedras nos rins. (ROMERO, et al., 2010)
O impacto da modernização da agricultura bem observado atualmente, é refletido na epidemia de obesidade, especialmente nos EUA desde 1960. A obesidade nos adultos cresceu de 14,6% em 1971-1974 para 35,2% em 2005-2006. Uma tendência semelhante vista em crianças, foi o crescimento de 11% para 17,8% da categoria de sobrepeso no período de 2005 a 2006. O consumo de fastfoods e a alta quantidade frutose na composição do milho foram os responsáveis por esta epidemia. Nos Estados Unidos, a porcentagem de alimentos fastfoods consumidos foi de 9.6% to 23.5% entre o período entre 1977 e 1996. Essas mudanças na dieta foram observadas em outros países também, como China, Rússia e filipinas. O alto consumo de frutose é apontado como um dos fatores de risco desta doença. (ROMERO, et al., 2010)
Outros fatores de risco são a diminuição do consumo de fluidos e de cálcio, o crescimento do consumo de oxalatos. O crescimento do consumo de sódio e de proteína animal são fatores de riscos equivocados. Porém, a redução de sódio e de proteína animal associado a uma dieta normal de cálcio atenua a produção de pedras nos rins. (ROMERO, et al., 2010)
As mudanças globais são outro fato de risco altera as taxas de produção de pedras nos rins. O aquecimento global é um fenômeno legítimo e existem estudos que comprovaram a associação entre altas temperaturas e aumento da taxa de formação de pedras nos rins. Dois estudos recentes mostraram que o relacionamento temporal a altas temperaturas e as pedras nos rins. Eles compararam o tempo de soldados norte americanos no Kuwaiti e o tempo que desenvolveram cólicas renais no hospital militar. Estes estudos reportam o tempo de exposição e as manifestações clínicas dos sintomas em um dado tempo. (ROMERO, et al., 2010)
Dito isto, este seminário visa apurar a visão de todos à cerca da litíase renal em seus mais amplos aspectos, visto que o corpo de evidências sugere que a incidência e prevalência de pedras nos rins está a aumentar globalmente. Estes aumentos são vistos por sexo, raça e idade. Mudanças nas práticas alimentares pode ser um elemento fundamental de condução. Além disso, o aquecimento global pode influenciar estas tendências.
2. ETIOLOGIA
2.1 MECANISMOS DE INFORMAÇÃO
Os mecanismos de formação de cálculos incluem nucleação de pedra, seu crescimento ou agregação para um tamanho que interaja com outra estrutura renal, sua retenção no interior do rim ou no sistema coletor renal e isso promova ainda mais agregação ou nucleação secundária para formar uma pedra clínica. (KLEINMAN & RATKALKAR, 2011)
Os cristais se formam no túbulo renal ou no fluido intersticial que é supersaturada com estes constituintes, que por sua vez pode ser uma consequência de um aumento da excreção de moléculas constituintes de pedra, volume urinário reduzido, alteração do pH urinário ou uma combinação desses fatores. (KLEINMAN & RATKALKAR, 2011)
A urina e, presumivelmente, o fluido tubular dos formadores de pedra é muitas vezes mais altamente supersaturada do que a de adultos saudáveis e normais, fator que favorece a nucleação e crescimento de cristais. A excreção em longo prazo de elementos adicionais, cristalinos como orgânicos, produzem a pedra clínica. (HARRISON,2013)
Os mecanismos responsáveis pelo maior grau de supersaturação dos constituintes químicos na formação de pedras diferem de acordo com o tipo de pedra; ademais, apesar da compreensão físico-química da formação de pedra, nenhuma única anormalidade serviu para distinguir formadores de pedra para indivíduos normais, e muitos formadores não possuem nenhuma anormalidade identificável que explique a propensão para sua urina nuclear constituintes de pedra em níveis menores de supersaturação, suportar crescimento acelerado de cristais formados, ou permitir que cristais se agrupem entre si e com estruturas intrarrenais. (HARRISON,2013)
2.2 MODOS DE CRESCIMENTO DA PEDRA
- Nucleação: é o processo pelo qual íons livres se associam em partículas microscópicas. A cristalização pode ocorrer na solução em microambientes, tais como em determinados pontos no néfron, seja na superfície das células ou na matriz extracelular. (KLEINMAN & RATKALKAR,2011)
- Agregação: é um processo na qual há aglomeração de cristais que se forma em solução livre e se transformam em partículas com multicomponentes. Também podem englobar o fenômeno da nucleação secundária de novos cristais na superfície daqueles já formados. A estrutura das pedras sugere que um ou outro desses processos deve ocorrer para que a pedra cresce para um tamanho clinicamente significativo. Pedras renais podem ser comparados como um concreto, a mistura de um agente ligante (cimento), e partículas como areia ou vidro. Pedras são um agregado de cristais uma matriz orgânica, este último servindo como agente ligante. A matriz orgânica contém proteínas, lipídios, polissacarídeos e outros materiais de derivados celulares. . (KLEINMAN & RATKALKAR,2011)
- Crescimento de cristal: o crescimento de cristais é realizado pelo movimento de íons da solução para o cristal crescente. Enquanto algum crescimento de cristais nucleares deve ocorrer pelo movimento de íons a partir da solução, este é claramente um processo limitado, na forma de cristais individuais gigantes de constituintes de pedras não são geralmente observadas. É mais provável que o crescimento de pedra é realizado através de agregação de cristais pré-formados ou nucleação secundária de cristais na matriz que reveste outro cristal. (KLEINMAN & RATKALKAR,2011)
2.3 COMPOSIÇÃO DOS CÁLCULOS
Pode-se admitir que a formação de cálculos aconteça pelo desequilíbrio entre a solubilidade e a precipitação de sais na urina. Os rins têm como função conservar água e excretar elementos de baixa solubilidade.
2.3.1 HIPERURICOSÚRIA E OS CÁLCULOS DE ÁCIDO ÚRICO
Os cálculos de ácido úrico constituem aproximadamente 10-15% dos casos. Caracteristicamente são radio transparentes, não visíveis, portanto, à radiografia simples de rins, ureter e bexiga e aparecem na urografia excretora como falhas de enchimento. (RIELLA,2010)
Hiperuricosúria é a excreção de ácido úrico superior a 750mg (mulheres) e 800mg (homens) em urina de 24h. O ácido úrico é o principal produto do metabolismo das purinas no homem, sendo excretado na urina por filtração glomerular e transporte tubular, envolvendo reabsorção, secreção e reabsorção pós-secreção. A saturação da urina em relação ao ácido úrico e aos sais de urato é o fator determinante da cristalização urinária e mesmo valores como 600mg/24h podem aumentar o risco de litogênese de forma significativa, especialmente nos pacientes com baixo volume urinário. (BARROS, 2006)
A solubilidade limitada do ácido úrico, especialmente em pH urinário ácido, faz da hiperuricosúria uma causa relativamente comum de litíase urinária. O ácido úrico urinário pode apresentar-se na forma de ácido úrico livre, não-dissociado e pouco solúvel, e na forma dissociada, urato, mais solúvel. No pH sanguíneo de 7,4, o ácido úrico encontra-se predominantemente na forma de um sal monovalente e bastante solúvel, o urato de sódio. (BARROS,2006)
Na urina ácida, o ácido úrico predomina na forma não-dissociada, menos solúvel. Então, a precipitação de cristais de ácido úrico na urina não é função exclusiva de sua concentração urinária, sendo o pH urinário um fator determinante da solubilidade do ácido úrico. (BARROS,2006)
A associação entre hiperexcreção urinária de ácido úrico e litíase do cálcio vem sendo observada a anos. Aproximadamente 20% dos pacientes formadores de cálculos de cálcio apresentam também hiperuricosúria. Deve-se, dessa maneira, agrupar paciente portadores de cálculos de cálcio associados à hiperexcreção urinária de ácido úrico em um subgrupo distintos de litiásicos. (BARROS,2006)
Têm-se notado aumento na frequência de cálculos de ácido úrico entre portadores de diabetes mellitus do tipo 2. Nesses grupos, o fator causal mais importante é o pH urinário persistentemente baixo. Esse achado parece estar relacionado à maior secreção urinária e a defeito na excreção de amônia, que acarretaria diminuição da capacidade tampão da urina. Resistência à ação da insulina e lipotoxidade renal são citadas como possíveis mecanismo. (Figura 1) (RIELLA,2010)

Por outro, o pH urinário constantemente baixo parece ser necessário, mas não suficiente, já que apenas uma fração dos indivíduos com síndrome metabólica e urina ácida desenvolvem nefrolitíase. A presença de outros fatores promotores ou a deficiência de inibidores da cristalização talvez sejam também necessárias para a formação do cálculo. (RIELLA,2010)
Níveis elevados de ácido úrico na urina podem contribuir para a formação de cálculos de oxalato de cálcio. Várias teorias têm sido propostas para explicar o fato. Postula-se que cristais de ácido úrico formariam um núcleo inicial para deposição de oxalato de cálcio ou que absorveriam inibidores da cristalização urinária. (RIELLA,2010)
Cálculos de ácido úrico puro são mais raros e costumam ocorrer em 5 a 10% dos pacientes litiásicos. (BARROS,2006)
2.3.2 CISTINÚRIA E OS CÁLCULOS DE CISTINA
Os cálculos de cistina constituem aproximadamente 1% do total. São radiopacos, com aspecto de vidro moído (ground-glass) em radiografias. (RIELLA,2010)
A cistinúria é uma doença hereditária autossômica recessiva, caracterizada por inabilidade no manuseio dos aminoácidos dibásicos (cistina, ornitina, lisina e arginina). O distúrbio primário é uma anormalidade no transporte de membrana, envolvendo o epitélio tubular renal e a mucosa intestinal. (BARROS,2006)
A excreção urinária normal de cistina situa-se ao redor de 20mg/dia, e a formação de cálculos deve-se exclusivamente à sua baixa solubilidade em pH urinário normal. O teste do Nitroprussiato de sódio é um teste colorido de rastreamento, que detecta a presença de cistina a partir de 75mg/l, útil para homozigotos, que apresentam excreções maiores que esse valor, e para alguns heterozigotos. (RIELLA,2010)
A cistinúria é responsável por aproximadamente 10% dos casos de nefrolitíase na infância. Na segunda década de vida, 50% dos pacientes já apresentaram pelo menos um episódio de colícanefrética. Três tipos de herança são descritos: cistinúria tipo A, causada por mutações em gene localizado no cromossomo 2, responsável pela síntese da proteína transportadora denominada carreadora de soluto 3 A1. Na forma homozigótica, apresenta excreção de cistina de até 1g/dia; cistinúria do tipo B, associada a outro gene, localizado no braço curto do cromossomo 19, que codifica a proteína transportadora SLC7A9 e cistinúria AB, com mutações em um alelo de ambos os cromossomos. (RIELLA,2010)
A cistina é pouco solúvel na urina e, quando excede a concentração de 200mg em 24h, pode levar à formação de cálculos. Em geral, manifesta-se na infância e apresenta-se como uma calculose renal severa, de grande ocorrência. (BARROS,2006)]
O diagnóstico é suspeitado em pacientes com uma história familiar de cálculos urinários e aspecto radiográfico de um cálculo fracamente opaco, em vidro moído, com bordas lisas. O sumário de urina frequentemente revela cristais hexagonais. Os cálculos têm cor âmbar. A análise do cálculo confirma o diagnóstico. A avaliação quantitativa de cistina urinária ajuda a confirmar o diagnóstico e a diferenciar o estado homozigótico do heterozigótico. (MCANINCH,2014)
2.3.3 CÁLCULOS DE CÁLCIO
- Hiperoxalúria:
O oxalato é um ácido orgânico dicarboxílico, de baixa solubilidade, cujo interesse biológico é praticamente limitado à sua participação na formação de cálculos renais. Em indivíduos normais, a maioria do oxalato urinário provém do metabolismo endógeno (da glicina, glioxilato e ácido ascórbico), e apenas 10 a 20% são derivados da dieta. Três a 5% do oxalato ingerido são absorvidos, principalmente no cólon. (RIELLA,2010)
A hiperoxalúria primária é uma doença autossômica recessiva rara que causa uma hiperoxalúria grave. Os pacientes se apresentam habitualmente com cálculos recorrentes de oxalato de cálcio durante a infância. A hiperoxalúria primária tipo 1 é decorrente de uma deficiência na enzima peroxissomal alanina-glioxilato-aminotransferase. O tipo 2 é decorrente de uma deficiência de D-glicerato-desidrogenase. A hiperoxalúria grave de qualquer causa pode levar à formação de cálculos e produzir nefropatiatubulointersticial. (HARRISON, 2013)
Hiperoxalúria é definida pela excreção de oxalato maior que 40 mg/dia. Porém, a maioria dos portadores de nefrolitíase possui níveis normais de oxalato na urina. Entretanto, aumentos na excreção de oxalato elevam mais a supersaturação urinária do que aumentos proporcionais na excreção de cálcio. Provavelmente, a ligação do cálcio a outros íons (além do oxalato) o torna mais solúvel. Didaticamente, podemos dividir as causas de hiperoxalúria de acordo com o nível de excreção em: (RIELLA, 2010)
- Dietética – Geralmente apresenta 40 a 60 mg/dia de oxalato na urina. Excesso de consumo de oxalato e baixa ingestão de cálcio são fatores de risco;
- Entérica – Oxalúria de 60 a 120 mg/dia. Pode ocorrer após ressecção intestinal, doença de Crohn, derivação intestinal para tratamento de obesidade e síndromes má-absortivas. Nestas situações clínicas acontece formação de complexos de cálcio com a gordura intestinal (saponificação) e hiperabsorção do oxalato livre (não conjugado com cálcio) através da mucosa colônica com permeabilidade alterada pelos ácidos graxos e sais biliares não absorvidos;
- Primária – Níveis de oxalato na urina acima de 120 mg/ dia. Acontece nas hiperoxalúrias hereditárias tipo I — deficiência e/ou localização extraperoxissomal da enzima hepática alanina/glioxilatoaminotransferase, e tipo II — deficiência da desidrogenase d-glicerato/glioxilatoredutase, doenças raras, de herança autossômica recessiva. (RIELLA, 2010)
- Hipercalciúria
A hipercalciúria pode ser observada em associação a uma dieta muito rica em Na, terapia com diuréticos de alça, acidose tubular renal (ATR) distal (tipo 1), sarcoidose, síndrome de Cushing, excesso de aldosterona ou distúrbios associados a hipercalcemia (p.ex., hiperparatireoidismo primário, excesso de vitamina D, síndrome de leite-álcali), ou pode ser idiopática. (HARRINSON, 2013)
Na dieta ocidental a quantidade média de cálcio ingerida é de 400 a 2000 mg/dia. Cerca de 1/3 é absorvido pelo intestino delgado. 95% do cálcio circulante é filtrado no glomérulo e reabsorvido a nível tubular, sendo apenas excretado na urina cerca de 2%. De referir que o osso é um reservatório importante de cálcio que pode em determinadas circunstâncias ser mobilizado para a circulação num processo metabolicamente controlado pela vitamina D e PTH. A hipercalciúria definida com oexcreção do cálcio urinário superior 200mg em 24 horas ou 4mg/kg/24h., pode ter três origens: absortiva, renal e reabsortiva. (GOMES et al., 2005)
- Hipercalciúria absortiva – o principal defeito é um aumento da absorção do cálcio intestinal, normalmente ao nível do intestino delgado. O resultante aumento do cálcio circulante determina um aumento do cálcio filtrado e uma supressão da hormona paratireoide. Esta supressão origina uma menor reabsorção tubular do cálcio. A combinação do aumento do filtrado de cálcio e a diminuição da reabsorção tubular de cálcio conduz inevitavelmente a hipercalciúria. A hipercalciúria compensa a absorção intestinal aumentada mantendo os valores séricos de cálcio dentro de valores normais. A hipercalciúria absortiva pode ser subdividida em 3 tipos: tipo I que é independente da dieta, isto é, mesmo nas dietas restritivas em cálcio mantém-se a hipercalciúria. Tipo II que é dependente da dieta, portanto com valores de cálcio urinário normais em regimes dietéticos restritivos em cálcio. Tipo III possui um comportamento semelhante ao tipo I, no entanto, o defeito primordial consiste numa fuga renal anormal de fosfato. A hipofosfatemia resultante determina a estimulação do metabolismo da vitamina D que por sua vez aumenta a absorção intestinal de cálcio e origina hipercalciúria
- Hipercalciúria renal – na hipercalciúria renal, a alteração principal é a perda urinária de cálcio que resulta do comprometimento da reabsorção tubular renal de cálcio. A diminuição do cálcio sérico determina uma estimulação compensadora de hormona paratireoide e secundariamente do metabolismo da vitamina D. Como consequência ocorre um aumento da absorção intestinal de cálcio e a mobilização óssea de cálcio, restabelecendo as calcemias. O hiperparatireoidismo é assim uma situação secundária podendo, no entanto, contribuir para uma diminuição da densidade óssea e osteopenia em alguns doentes.
- Hipercalciúriareabsortiva – o hiperparatireoidismo primário é considerado o paradigma da hipercalciúriareabsortiva. A alteração principal é a hipersecreção de hormona paratireoide. Esse evento desencadeia vários eventos. A nível renal verifica-se um aumento da reabsorção tubular de cálcio e diminuição do fosfato. No osso ocorre um aumento da reabsorção do cálcio. E a nível intestinal também mediado pela estimulação do metabolismo da vitamina D aumenta a absorção do cálcio. A consequência é a hipercalcemia e hipofosfatemia com hipercalciúria devido à sobrecarga renal de cálcio. (GOMES et al., 2005)
2.3.4 CÁLCULO DE ESTRUVITA
Estruvita é um mineral caracterizado por ser um fosfato hidratado de amônio e magnésio. Esse tipo de cálculo formase na presença de algumas classes de bactérias dentre elas Ureaplasma, Proteus, Haemophilus e Corynebacterium, todas produtoras de uma enzima chamada urease (BOSE et al. 2015). Essa enzima cliva a ureia liberando amônio, o qual se junta ao fosfato e magnésio formando esse tipo de cálculo. A formação de cristais de estruvita leva a agregação de oxalato de cálcio a esses cristais, isso acaba por agravar a situação, uma vez que a estruvita em condições normais apresenta baixa presença na urina e, portanto, com o fim da infecção acaba por se dissolver naturalmente, no entanto o novo cálculo formado por oxalato de cálcio necessita de procedimento próprio. Apesar de representar algo entre 10 e 15% dos casos de nefrolitíase, o cálculo de estruvita é de extrema importância por sua associação a infecções do trato urinário (RODMAM, 1999). Rápido crescimento, e possibilidade de agravamento e até mesmo morte são fatores que evidenciam essa importância, faz-se necessário lembrarmos que o cálculo de estruvita é um efeito secundário de um problema muito maior que é a infecção associada, e por se tratar de infecção do trato urinário costuma aparecer com maior frequência em mulheres, ou pessoas que por vários motivos necessitam da utilização de sondas do trato urinário, ou então que tem dificuldade para urinar.
Outro fator interessante de se destacar é a classificação de cálculo coraliforme na qual esse tipo de pedra se encaixa. Essa classificação é dada aos cálculos que se formam na pelve renal e assumem seu formato, eles costumam ser muito grandes e causar grande obstrução dessa região, necessitando, em muitos casos, de intervenção cirúrgica. Isso se deve ao rápido crescimento do cálculo de estruvita, acima citado (SAKHAEE e MOE, 2011).
2.4 FATORES PROMOTORES DA FORMAÇÃO DE CÁLCULOS
O pH é fator promotor da formação de pedras por três motivos, sendo dois relacionados a baixos níveis de pH e um relacionado ao alto valor do pH. O primeiro fator é o aumento do urato monossódico, o que pode causar a precipitação dessa substância com consequente formação de cristais. Ocorre que cristais de ácido úrico diminuem o limiar de agregação do oxalato de cálcio dando origem a uma pedra heterogênea formada por oxalato de cálcio e urato (GRASES et al. 2010). O segundo fator é a precipitação do fosfato de cálcio, o alto pH propicia a precipitação dessa substância a qual também influencia o oxalato de cálcio promovendo sua agregação facilitada. Quanto ao último é possível encontrar certa discordância na literatura. WAGNER e MOHEBBI (2010), por exemplo, afirmam que o baixo pH leva a formação de cristais de cistina, enquanto RATKALKAR e KLEINNMAN (2011) afirmam que isso ainda não está certo, mas que tem-se certeza que o alto pH aumenta a solubilidade dessa substância.
2.5 INIBIDORES NA FORMAÇÃO DE CÁLCULOS
Há no mínimo de 4 tipos de inibidores na urina: ânions orgânicos (citrato), ânions inorgânicos (piroposfato), cátions multivalentes metálicos (magnésio) ou macromoléculas como as Osteopontina e a proteína Tamm-Horsfall. O citrato é um dos principais inibidores da formação de cálculos. A baixa saturação de oxalato de cálcio. É inibida a agregação de cristais pré-formados no epitélio urinário. (KLEINMAN & RATKALKAR,2011)
3. SINAIS E SINTOMAS
A nefrolitíase é caracterizada, fundamentalmente, pela cólica renal. Usualmente, inicia-se com dor na região lombar, flanco ou fossa ilíaca, intensa, súbita, unilateral, em cólica, que não é aliviada com repouso ou com mudança posicional – pode ser irradiada para o trajeto ureteral, região de bexiga e genitália externa. A hematúria macroscópica juntamente com a disúria pode estar presente. Náuseas e vômitos, também, são comuns. Além disso, palidez, taquicardia, sudorese, dor à palpação em região de ângulo costovertebral e leve distensão abdominal, sem sinais de irritação peritoneal, também, se dão em pacientes com a referida patologia. Outro aspecto é a diminuição (em casos mais graves, a suspenção) do fluxo urinário, fruto da obstrução física que o cálculo pode realizar na extensão do trato nefrítico. A febre não faz parte do quadro clínico e a sua presença sugere Infecção do Trato Urinário (ITU) associada, devendo ser prontamente diagnosticada e tratada pelo médico, devido ao seu potencial de gravidade. (RIELLA, 2010)
4. DIAGNÓSTICO: DA ANAMNESE AO ACOMPANHAMENTO METABÓLICO
O diagnóstico da nefrolitíase (litíase renal) parte da caracterização do episódio agudo de dor (cólica renal), dos dados da história mórbida pregressa e de certas condições e hábitos importantes. Deve ser pesquisado se existe baixa ingestão de líquidos, restrição de leite ou derivados, uso de medicação sem prescrição médica, hábitos alimentares inadequados e hematúria macroscópica. Além disso, ocorrências prévias, idade da primeira e última crise, consequências e intervenções (hidronefrose, hospitalização, remoção de cálculos por litotripsia, endoscopia ou cirurgia) e passagem espontânea de cálculos devem ser questionados pelo médico. (AJZEN & SCHOR, 2010) Por fim, afecções como bexiga neurogênica, infecções urinárias de repetição, diarreia crônica ou gota têm importância ao se considerar a patogênese da doença litiástica. (RIELLA, 2010) Todavia, o exame físico e a anamnese apenas em raras ocasiões levam ao diagnóstico. Conquanto, fornece indícios determinantes para o direcionamento da avaliação. (GOLDMAN & AUSIELLO, 2005)
O exame laboratorial de urina, por sua vez, analisa a presença de hematúria microscópica – recorrente nos casos de nefrolitíase. Leucócitos podem ser encontrados na urina tipo I, porém a presença de bactérias no exame do sedimento deve levantar suspeita de infecção associada (realização da urocultura). A creatinina plasmática é normal, exceto em situações de obstrução em rim único, obstrução ureteral bilateral, cálculos gigantes de bexiga ou cálculos uretrais impactados. Cristais de cistina (hexagonais) e de estruvita (em forma de tampa de caixão) são diagnósticos. Enquanto a presença de cristais de oxalato de cálcio ou de ácido úrico em grande quantidade é sugestiva de doença litiástica. (RIELLA, 2010)
A confirmação da presença do cálculo e sua localização se dá através de exames de imagem. Dentre os quais, os mais indicados são: radiografia simples, ultrassonografia e tomografia computadorizada helicoidal. (PORTO, 2009) A radiografia simples de abdome (rins, ureteres e bexiga) é viável quando o cálculo apresenta diâmetro maior que 2 mm e é radiopaco. Sua maior limitação é a baixa sensibilidade para cálculos ureterais (chega a ser menor que 50%). (RIELLA, 2010) Não obstante, a ultrassonografia, que indica a posição e o tamanho do cálculo e auxilia a verificar se está ocorrendo obstrução das vias urinárias, não visualiza cálculos ureterais. (PORTO, 2009) Já a tomografia computadorizada, é o exame de escolha por apresentar alta sensibilidade e especificidade (96% e 100%, respectivamente) para o diagnóstico de litíase urinária. Na maioria das vezes, não é necessário o uso de contraste intravenoso, podendo detectar não apenas o cálculo como o ponto e o grau de obstrução. Detecta, praticamente, todos os tipos de cálculos renais, radiopacos ou não (exceto os do tipo indinavir). Além disso, permite usar a densidade, medida em unidades Hounsfield, para estimar a composição do cálculo (em escala crescente de densidade – ácido úrico, estruvita, cistina, oxalato de cálcio mono-hidratado e hidroxiapatita). (RIELLA, 2010)
Após o episódio de cólica renal ou da passagem do cálculo, a avaliação metabólica dos fatores de risco deve ser postergada por pelo menos 4 semanas, o que permite a retomada da dieta e da atividade física habitual do paciente, e também proporciona retorno da função renal à normalidade. Quando possível, o cálculo expelido deve ser recuperado e submetido a análise. Esta pode ser feita por métodos químicos ou, preferencialmente, por espectrofotmetria infravermelha ou por difração de raios X. (RIELLA, 2010) A abordagem diagnóstica do paciente que formou o primeiro cálculo (único) é controversa. Recomenda-se que, em adultos, a investigação consista ao menos em dosagens séricas de cálcio, fósforo, ácido úrico, creatinina, sódio, cloro, potássio e bicarbonato. Pacientes com atividades profissionais de risco, portadores de cálculo de grande diâmetro e idosos com cólica renal associada a dor intensa são mais vulneráveis aos efeitos adversos da crise aguda e necessitam de investigação adicional. A avaliação de pacientes com doença recorrente e calculose múltipla é feita de modo mais extenso. Nessa categoria incluem-se também as crianças e portadores de litíase em rim único. (BARROS et al, 2006)
A avaliação metabólica mais detalhada do paciente se dá, na maioria das vezes, através da urina de 24 horas. Esse processo permite tipificar os cálculos renais e direcionar o tratamento – principalmente no que tange a prevenção. (LONGO et al, 2013)
| Tipo de cálculo renal | Condição metabólica característica da litíase presente na avaliação de urina de 24 horas |
| Cálculo de cálcio | Hipercalciúria: cálcio urinário maior do que 4 mg/kg/24 horas para ambos os sexos e idades ou maior do que 250 mg/24 horas ou maior do que 300 mg/24 horas, para mulheres e homens, respectivamente;
Hiperparatireoidismo primário: hipercalcemia e PTH; Acidose tubular renal distal: pH urinário de jejum de 12 horas maior do que 5,5 e acidose metabólica espontânea ou induzida pelo teste com cloreto de amônia (prova de acidificação) – vale ressaltar que essa verificação não é realizada através do exame de urina de 24 horas como acontece no restante da tabela; Hiperoxalúria: oxalato urinário maior do que 44 mg/24 horas; Hipocitrarúria: citrato urinário menor do que 320 mg/ 24 horas. |
| Cálculo de ácido úrico | Hiperexcreção de ácido úrico: ácido úrico maior do que 750 mg/24 horas (para mulheres) ou maior do que 800 mg/24 horas (para homens). |
| Cálculo de cistina | Cistinúria: cistina urinária maior do que 100 mg/24 horas ou homozigoto maior do que 750 mg/ 24 boras; também pode ser realizado o teste nitroprussiato (positivo). |
| Cálculo de estruvita | Identificado por diagnóstico diferencial e pela concentração do cálculo. |
Relação entre as concentrações de metabólitos e os diversos tipos de cálculo nefrítico.
5. DIAGNÓSTICO DIFERENCIAL
O quadro clínico é bem sugestivo, porém o diagnóstico diferencial pode e deve ser realizado (RIELLA, 2010). Esse deve incluir patologias gastrointestinais (apendicite aguda, diverticulite, colecistite), ginecológicas (cisto ovariano, anexite, gravidez ectópica), urológicas (orquite, epididimite, prostatite), afecções vasculares (infarto intestinal, aneurisma de aorta abdominal) e, por fim, causas médicas (cetoacidose diabética, infarto agudo do miocárdio). (BARROS, 2006)
6. TRATAMENTO
O tratamento adequado da nefrolitíase pode ser dividido em três partes: tratamento da cólica renal, tratamento do cálculo e terapêutica da doença litiásica. (RIELLA et al., 2010).
Com relação à dor renal, sabe-se que ela é de alta intensidade e deve ser tratada com analgésicos. (SCHOR & AJZEN, 2011) As duas principais classes de medicações utilizadas para a cólica renal são os anti-inflamatórios não hormonais (AINH), que têm ação direta na patogenia da dor ao inibirem a síntese de prostaglandinas e reduzirem vasodilatação, pressão intrarrenal e inflamação; e e os opioides que têm como representante clássico a morfina, e que apesar de não atuarem na fisiopatologia da cólica nefrética, apresentam ação analgésica rápida e potente, mas sujeita o paciente a efeitos colaterais como náuseas, depressão respiratória, obstipação intestinal e retenção urinária. (RIELLA et al., 2010).
Contudo, milhares de pessoas possuem pedras nos rins e desconhecem o problema, uma vez que os cálculos podem permanecer no organismo durante meses ou até mesmo anos sem causar nenhuma dor. (TORTORA et al., 2010).
A eliminação espontânea ocorre em até 80% dos cálculos menores que 5mm. Para cálculos maiores que 7mm a chance é bem menor, em torno de 25% para os localizados em ureter proximal, de 45% para aqueles em ureter médio e de até 70% para os cálculos em ureter distal; sendo que consultas urológicas urgentes são indicadas em casos de dor intensa. (RIELLA et al., 2010).
Sabe se que recentemente várias medicações tem sido utilizadas como facilitadoras para a passagem de cálculos ureterais, principalmente os localizados no ureter distal e menores que 1cm. Os principais são os bloqueadores alfa adrenérgicos orais, bloqueadores dos canais de cálcio, inibidores de prostaglandinas e corticoides, (RIELLA et al., 2010) que relaxam o músculo ureteral e foi demonstrado que reduzem o período de tempo necessário até a eliminação do cálculo assim como a necessidade de remoção cirúrgica para os cálculos pequenos. (HARISSON et al., 2013) Entretanto são necessários mais estudos randomizados, de alta qualidade e com maior número de pacientes, para confirmar esses achados. (RIELLA et al., 2010).
Independentemente da etiologia do cálculo, cada paciente deve ser aconselhado a evitar a desidratação e a beber grandes quantidades de água. A eficácia da alta ingestão de liquido foi confirmada em um estudo prospectivo dos individuas que haviam formado cálculos pela primeira vez. O aumento do volume urinário para 2,5L/dia resultou em uma redução de 50% na recidiva dos cálculos, em comparação com o grupo de controle. (HARISSON et al., 2013).
A conduta para os cálculos já presentes no rim ou no trato urinário requer uma abordagem clínica e cirúrgica combinada. O tratamento específico depende da localização do cálculo, da extensão da obstrução, da natureza do cálculo, da função dos rins afetados e não afetados, da presença ou ausência de infecção do trato urinário, da progressão da passagem do cálculo e dos riscos cirúrgicos ou da anestesia tendo em vista o estado clínico do paciente. (HARISSON et al., 2013)
A obstrução grave, a infecção, a dor refratária e o sangramento significativo são indicações para a remoção de um cálculo. Os avanços na tecnologia urológica tornaram a cirurgia convencional para os cálculos em um evento raro. Existem agora três alternativas para a remoção do cálculo: a litotripsia extracorpórea, nefrolitotomia percutânea e a ureteroscopia (HARISSON et al., 2013).
A litotripsiaextracorpórea (LECO) método mais utilizado pelos urologistas para eliminação de cálculos renais e ureterais, utiliza ondas de choque geradas fora do corpo humano, concentrando-as no trato urinário diretamente sobre o cálculo. Após múltiplas ondas de choque, a maioria dos cálculos terá sido reduzida a um pó que se desloca através do ureter e penetra na bexiga, sendo facilmente eliminados pela urina. (SCHOR & AJZEN, 2011) Os primeiros litotriptores surgiram no início da década de 1980 e consistem basicamente em uma fonte geradora de ondas (eletroidráulica, eletromagnética ou piezelétrica) e de um sistema de acoplamento e de localização de imagens (ultrassônico ou radiográfico). (RIELLA et al., 2010).
O segundo método mais utilizado pelos urologistas é a cirurgia renal percutânea ou nefrolitotomia percutânea (NLP) que pode ser indicada isoladamente para cálculos de grande volume ou sequencialmente à LECO. Essa alternativa tornou-se uma técnica bastante comum para tratamento dos cálculos pois permite grande sucesso com menor trauma ao paciente quando comparada com a cirurgia convencional. -Vários estudos têm demonstrado sua eficácia com taxa de resolução completa do cálculo em mais de 90% dos casos. (PEDRANORIM.COM) A nefrolitotomia percutânea torna necessária a introdução de um nefroscópio dentro da pelve renal através de uma pequena incisão feita no flanco. A seguir os cálculos são rompidos por um pequeno transdutor ultrassônico ou laser de hólmio. (HARISSON et al., 2013).
O terceiro método é a ureteroscopia com ruptura do cálculo utilizando um laser de hólmio. Em geral, a ureteroscopia é usada para os cálculos localizados no ureter, porém alguns cirurgiões estão usando essa modalidade também para os cálculos localizados na pelve renal. (HARISSON et al., 2013).
Em caso de cálculos de estrutiva a remoção completa do cálculo com subsequente esterilização do trato urinário constitui o tratamento de escolha para os pacientes que conseguem tolerar os procedimentos. A nefrolitotomiapercutânea é a abordagem cirúrgica preferida para a maioria dos pacientes. Às vezes, a litotripsia extracorpórea pode ser usada em combinação com uma abordagem percutânea. A cirurgia convencional é necessária apenas raramente.
Para os pacientes que não são candidatos à remoção cirúrgica do cálculo, pode ser usado o ácido acetoidroxâmico, que é um inibidor da urease. Lamentavelmente, esse ácido exerce muitos efeitos colaterais, como cefaleia, tremores e tromboflebite, que limitam sua utilização. (HARISSON et al., 2013).
Os cálculos de cistina ocorrem geralmente associados à cistinúria, caracterizada pela insolubilidade da cistina, e como tratamento deve-se aumentar a ingestão de líquidos a fim de que o volume de urina diário supere 3L. Como os efeitos colaterais são comuns, fármacos como penicilamina e tiopronina, que formam complexos solúveis mistos de dissulfeto de cisteína-medicamento, devem ser usados somente quando a sobrecarga de líquidos, a redução de sal e a terapia com álcalis se revelam inefetivos. (HARISSON et al., 2013).
As duas metas do tratamento consistem em elevar o pH da urina e em baixar a excreção urinária excessiva de ácido úrico para menos que 1g/dia. Vale ressaltar que um aumento do pH urinário acima de 6,5 não proporcionará qualquer benefício adicional na prevenção da cristalização do ácido úrico, porém aumenta o risco da formação de cálculos de fosfato de cálcio. Uma dieta pobre em purinas deve ser instituída nos indivíduos que formam cálculos de ácido úrico e com hiperuricosúria. Os pacientes que continuam formando cálculos de ácido úrico apesar do tratamento com líquidos, álcalis e uma dieta pobre em purinas deverão ter o alopurinol acrescentado ao seu esquema de tratamento. (HARISSON et al., 2013).
Já os cálculos de cálcio normalmente acontecem associados a algumas condições. As principais são hipocitraturia e hipercalciúria. As situações de hipocitraturias devem ser tratadas primeiro com hidratação adequada, redução e sal (sódio) na dieta e orientação do uso de limão na rotina diária que comprovadamente mostra a elevação na concentração de citrato urinário. A reposição é classicamente realizada com citrato de potássio. (NETTO JR. et al., 2008)
Os cálculos de associados à hipercalciúria podem ser tratados com o uso de diuréticos tiazídicos, que reduzem o cálcio na urina e são efetivos na prevenção da formação dos cálculos. Três ensaios randomizados com duração de 3 anos mostraram uma redução de 50% na formação dos cálculos nos grupos tratados com tiazídicos em comparação aos controles tratados com placebo. O efeito do medicamento requer uma ligeira contração do volume líquido extracelular e uma alta ingestão dietética de cloreto de sódio reduz seu efeito terapêutico. A hipopotassemia induzida pelas tiazidas deve ser tratada agressivamente, pois essa condição reduzirá o citrato na urina, que é um importante inibidor da cristalização do cálcio. (HARISSON et al., 2013)
Além da ingestão de água, algumas terapias alternativas são conhecidas, dentre elas, existem inúmeras receitas que tem se propagado ao longo dos anos para tratamento de pedra no rim. Por exemplo, o chá de quebra pedra. Na verdade, oPhyllantusniruri ajuda a evitar que os cálculos se formem, uma vez que impede a agregação dos cristais de oxalato de cálcio. Sob sua ação, os cristais acabam não aderindo uns aos outros, evitando assim a formação de cálculos de maior dimensão, aqueles que provocam dor na região do rim e são difíceis de ser expelidos sem o auxílio de algum remédio ou tratamento. Mas não quebra e nem dissolve pedra nos rins como difundido pelo imaginário popular. Isso foi comprovado no estudo realizado pelo departamento de Nefrologia da Universidade Federal de São Paulo (Unifesp). (FAPESP 2001).
7. PROGNÓSTICO
Após a realização de diagnóstico e tratamento os pacientes podem ser classificados em grupos de baixo ou alto grau de recorrência. Essa classificação leva em conta fatores como recorrência da litíase, histórico familiar e outras patologias associadas que podem influenciar no reaparecimento da litíase ou não. É relatado um índice de recidiva de 10% em um ano, 35% em cinco anos e 50% em dez anos. (Guia Prático de Urologia, 1999).
Visando evitar o reaparecimento do cálculo, ou até mesmo como uma forma de prevenção o paciente deve seguir algumas recomendações gerais. Aumentar a ingesta de água com consequente aumento do volume urinário para que a taxa de precipitação de sais diminua; aumentar a ingestão de citratos (presente em frutas cítricas), pois é uma substancia capaz de combater a agregação de oxalatos de cálcio; reduzir o consumo de proteínas, uma vez que, a alta ingestão de proteína de origem animal leva à hipercalciúria por promover aumento da reabsorção óssea e diminuir a reabsorção tubular renal de cálcio, pela maior excreção de ácidos; diminuir a ingestão de sódio já que é um dos fatores responsáveis pelo o aumento de cálcio na urina, e também o consumo de oxalato (Idec, 2011).
Assim, com o tratamento médico profiláctico geral e específico das alterações metabólicas da litíase, são possíveis taxas de remissão de 80 %, levando a ausência de sintomas, o que o torna um elemento chave nas medidas gerais de prevenção da doença. (Profilaxia da litíase renal – Gomes, 2005).
CONCLUSÃO
Durante o trabalho foi visto que a litíase possui incidência mundial, assim como sua elevada recorrência e possível cronicidade. Além disso, possui forte impacto sobre os índices socioeconômicos dos pacientes, uma vez que se ausentam muitos dias do trabalho devido aos sintomas de dor elevados causados pela doença. Assim o conhecimento dessa patologia, suas causas, tratamento e profilaxia são de extrema importância, não só para propiciar um bem-estar ao paciente litiásico, mas também, alertar acerca de mudanças básicas habituais que podem reduzir drasticamente a incidência e reincidência da litíase.
REFERÊNCIAS
AJZEN, Horácio; SCHOR, Nestor. Guia de Nefrologia. 3.ed. São Paulo: Manole, 2010.
AUSIELLO, D.; GOLDMAN, L. Tratado de Medicina Interna: clínica médica. 23.ed. Elsevier, 2009.
BARROS, Elvino et al. Nefrologia – Rotinas, Diagnóstico e Tratamento. 3. ed. São Paulo: Artmed, 2006.
BENDHACK, DONARD AUGUSTO; DAMIÃO, RONALDO. Guia prático de urologia. 1. ed., Rio de Janeiro : SBU – Sociedade Brasileira de Urologia ; São Paulo : BG Cultural, 1999.
BRASILEIRO FILHO, G. Bogliolo Patologia. 8.ed.Rio de Janeiro: Gen Guanabara Koogan, 2011.
GOLDMAN, Lee; AUSIELLO, Dennis. Cecil – Tratado de Medicina Interna. 22. ed. Rio de Janeiro: Elsevier, 2005.
GOMES, PEDRO NETO; et al. Profilaxia da litíase renal. Acta. Urológica, 22; 3: 47-56. 2005.
HARRISON, Tinsley Randolph; FAUCI, Anthony S. Harrison medicinainterna. 15ed. Rio de Janeiro: McGraw-Hill, 2002.
JUNIOR, A.N.; FILHO, M.Z.; REIS, R.B. Urologia fundamental – Sociedade Brasileira de Urologia. 1ª edição. São Paulo: Planark, 2010. 422 p.
KUMAR, V.; ABBAS, A. K.; FAUSTO, N.; MITCHELL, R. N. Robbins – Patologia básica. 8. ed. Rio de Janeiro: Elsevier, 2008.
LONGO, Dan L. et al. Medicina interna de Harrison. 18.ed. Porto Alegre: AMGH, 2013. 2 v.
LOPES, Antonio Carlos. Tratado de Clínica Médica. 2.ed. Roca, 2009.
MCANINCH, JACK W. Urologia geral de Smith e Tanagho. 18°ed. – Porto Alegre: AMGH, 2014.
PETROIANU, A.; NETO, J. E. O.; ALBERTI, L. Dados epidemiológicos da renal em hospital de referência de Belo Horizonte, Minas Gerais. Medicina, Ribeirão Preto, 34: 85-88, jan./mar. 2001.
PORTO, C.C.. Semiologia Médica. 6.ed. Rio de Janeiro: Guanabara Koogan, 2009.
RIELLA, M.C.. Princípios de Nefrologia e Distúrbios Hidroeletrolíticos. 5.ed. Rio de Janeiro: Guanabara Koogan,2010.
[1] Mestre em Farmacologia pela Faculdade de Medicina de Ribeirão Preto (FMRP) da Universidade de São Paulo, USP (1993); Doutor em Saúde E Ambiente, área de concentração Farmacologia de Produtos Naturais, no Instituto de Saúde Coletiva (ISC) da UFMT (2001). Bacharel em Direito pela UFMT (2001). Advogado. Tem experiência na área de Direito Sanitário, Biodireito, Direito médico e hospitalar, Atenção Primária em Saúde, Políticas de Saúde Pública, Epidemiologia, Farmacologia (com ênfase em farmacologia do processo inflamatório e farmacologia do músculo liso), Farmacoeconomia, Farmacoepidemiologia.

