ARTIGO DE REVISÃO
CAVALCANTE, Rômulo Coelho [1], MATOS, Luís Carlos Vieira [2], LIMA, Rodrigo Guimarães [3], PASSOS, Raphael Lanza e [4]
CAVALCANTE, Rômulo Coelho. et al. Hipertensão pulmonar tromboembólica cronica: revisão de literatura. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 08, Vol. 01, pp. 180-198. Agosto de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/tromboembolica-cronica, DOI: 10.32749/nucleodoconhecimento.com.br/saude/tromboembolica-cronica
RESUMO
A Hipertensão Pulmonar Tromboembólica Crônica (HPTEC) é uma enfermidade grave e debilitante, a qual gera sequelas que impactam diretamente na qualidade e sobrevida de seus portadores. Causada por oclusão parcial do leito arterial da vasculatura pulmonar, êmbolos hemáticos e travas fibróticas geram um aumento progressivo da Resistência Vascular Pulmonar (RVP) e Pressão Média de Artéria Pulmonar (PmAP). Ademais, acredita-se que o hiperfluxo dessas regiões possam desencadear uma disfunção endotelial, com consequente remodelamento vascular. Como resultante dessas alterações hemodinâmicas, surge a Hipertensão pulmonar e insuficiência de Ventrículo Direito, sendo esta a principal causa de morbimortalidade associada a doença. Desde que diagnosticados precocemente e referenciados a centros especializados, seus portadores estão sujeitos a cura através da Tromboendarterectomia Pulmonar. Aos pacientes com risco proibitivo a cirurgia, outras alternativas como a Angioplastia Pulmonar por Balão estão disponíveis, além do seu tratamento farmacológico. Novos estudos são necessários para solidificar as evidencias e refinar o tratamento de portadores de HPTEC. Esta revisão de literatura tem por objetivo discutir acerca da fisiopatogenia, aspectos clínicos, propedêutica e modalidades terapêuticas disponíveis para HPTEC.
Palavras-chaves: Hipertensão Pulmonar tromboembólica crônica, tromboendarterectomia da artéria pulmonar, Angioplastia Pulmonar por Balão, Riociguat, Hipertensão Pulmonar.
1. INTRODUÇÃO
A Hipertensão Pulmonar Tromboembólica Crônica (HPTEC) é uma condição em que a Hipertensão Pulmonar (HP) ocorre devido a presença de obstruções em leito da vasculatura pulmonar por doença tromboembólica não resolvida. Essa oclusão crônica leva a um remodelamento da microvasculatura pulmonar, induzido por potencialização da angiogênese imperfeita, fibrinólise endógena e consequente elevação da resistência vascular e Pressão Média da Artéria Pulmonar. Tais alterações hemodinâmicas, ao final de todo o processo de remodelamento pode gerar um aumento importante de pós carga do ventrículo direito e progressiva insuficiência ventricular direita, sendo esta a principal causa de morbimortalidade associado a esta doença (GALIÈ et al., 2015).
A HPTEC é uma complicação tardia da embolia pulmonar aguda e é classificada como HP grupo 4 (isto é, HP devido à obstrução da artéria pulmonar). A identificação da HPTEC como causa de HP é importante, pois possui uma estratégia terapêutica diferente em comparação com outras classes de HP (SIMONNEAU et al., 2019).
Quadro 1: Classificação de Hipertensão Pulmonar
| 1. Hipertensão arterial pulmonar |
| 1.1 Hipertensão arterial pulmonar idiopática |
| 1.2 Hipertensão arterial pulmonar hereditária |
| 1.3 Induzida por drogas ou toxinas |
| 1.4 Associada a: |
| 1.4.1 Doenças do tecido conectivo |
| 1.4.2 Infeção por HIV |
| 1.4.3 Hipertensão portal |
| 1.4.4 Doenças cardíacas congênitas |
| 1.4.5 Esquistossomose |
| 1.5 Respondedores aos bloqueadores do Canal de Cálcio |
| 1.6 Doença Pulmonar veno-oclusiva e/ou hemangiomatose capilar pulmonar |
| 1.7 Hipertensão pulmonar persistente do recém-nascido |
| 2. Hipertensão pulmonar por doença cardíaca esquerda |
| 2.1 insuficiência cardíaca com FE preservada |
| 2.2 insuficiência cardíaca com FE reduzida |
| 2.3 Doença Valvar |
| 2.4 Cardiopatias congênitas ou adquiridas que levam a hipertensão pulmonar pós-capilar |
| 3. Hipertensão pulmonar por doença pulmonar e/ou hipoxia |
| 3.1 Doença pulmonar obstrutiva |
| 3.2 Doença pulmonar restritiva |
| 3.3 Outras doenças pulmonares com distúrbio misto |
| 3.4 Hipoxia sem doença estrutural pulmonar |
| 3.5 Doenças do desenvolvimento pulmonar |
| 4. Hipertensão Pulmonar por Obstruções da artéria pulmonar |
| 4.1 Hipertensão pulmonar por tromboembolismo pulmonar cronico |
| 4.2 Outras obstruções de artéria pulmonar: sarcoma ou angiossarcoma, outros tumores malignos (renal, uterino, testicular tipo germinativo), tumores não malignos (leiomiomas), arterites sem doença do tecido conectivo, estenose congénita da artéria pulmonar, parasitose (hidatidose) |
| 5. Hipertensão pulmonar por mecanismos multifatoriais e/ou desconhecidas |
| 5.1 Doenças hematológicas: anemia hemolítica crônica, doenças mieloproliferativas |
| 5.2 Doenças sistémicas e metabólicas: histiocitose pulmonar de células de Langerhans, doença de Gaucher, doenças de depósito do glicogénio, neurofibromatose e sarcoidose. |
| 5.3 Outras: mediastinite fibrosante, insuficiência renal crônica com ou sem hemodiálise |
| 5.4 Cardiopatias congênitas complexas. |
Fonte: Adaptado de Simonneau et al., (2019).
Define-se HPTEC por meio de alguns critérios objetivos conforme o quadro abaixo.
QUADRO 1.1 – Critérios diagnósticos para HPTEC – Todos são necessários
| Confirmação invasiva de hipertensão pulmonar: Pressão média de artéria pulmonar >. 20mmHg; |
| Confirmação de tromboembolismo pulmonar crônico por Angiotomografia de artérias pulmonares, cintilografia pulmonar de inalação/perfusão ou arteriografia pulmonar’ |
| Diagnóstico somente pode ser confirmado após pelo menos três meses de anticoagulação plena; |
Fonte: Simonneau et al., (2019).
Houve uma mudança importante acerca de sua definição, realizada em 2019, onde convencionou-se HPTEC como pressão média de artéria pulmonar >. 20mmHg com resistência vascular pulmonar ≥ 3WU. Anteriormente a esse ano, a definição baseava-se em uma Pressão Média da Artéria Pulmonar >. 25mmHg (SIMONNEAU et al., 2019).
A incidência da HPTEC é desconhecida ou incerta. Segundo algumas series de casos, estima-se que entre 1% e 5% entre os sobreviventes de Embolia Pulmonar aguda (EP) evoluam com HPTEC (HOEPER et al., 2006). Uma revisão sistemática com 16 estudos sugeriu uma prevalência de 0,5% na população geral e 3% em sobreviventes de EP (ENDE-VERHAAR et al., 2017). A incidência em relação a população global é de 5 casos novos/milhão de habitantes por ano, com média de idade ao diagnostico de 63 anos, sendo ambos os sexos igualmente afetados (MORRIS et al., 2006). O tempo para diagnostico é elevado, tendo sido descrito como, em média, de 14 meses em uma coorte europeia (HOEPER et al., 2006).
2. FISIOPATOGÊNESE
A patogênese da Doença ainda é incerta, sendo advogada diversas hipóteses para a mesma. Tais incertezas advêm da dificuldade de reprodutibilidade em modelos animais devido a embolização repetida do material trombótico e que a maioria dos estados de hipercoagulabilidade não parecem conferir risco a HPTEC (SIMONNEAU et al., 2019).
HPTEC parece ser uma manifestação final da EP não resolvida. Porém não é sabido o motivo pelo qual alguns pacientes com EP aguda não desenvolvam HPTEC. São algumas teorias advogadas pelos estudos mais recentes: Estado de hipercoagulabilidade subjacente, sendo essa a mais amplamente difundida. Outra hipótese propõe que pacientes com HPTEC apresentem variantes de fibrina resistentes à lise mediada por plasmina (MORRIS et al., 2006).
Estudos observacionais encontraram níveis elevados de fator VIII em pacientes com HPTEC em comparação com controles saudáveis (BONDERMAN et al., 2003). Em outro estudo, foi identificado resistência à Proteína C ativada ou atividade fibrinolítica anormal (WOLF et al., 2000).
Fisiopatologicamente, os mecanismos descritos são: aumento da pressão hidrostática do sistema vascular pulmonar, como na estenose mitral; perda do leito vascular associado a vasoconstrição hipóxica, como nas doenças do parênquima pulmonar, remodelamento vascular pulmonar com proliferação endotelial e da camada média (BONDERMAN et al., 2003).
A presença de um embolo de forma aguda na vasculatura pulmonar leva a três possíveis desfechos clínicos: 1) Insuficiência ventricular direita por elevação aguda da pós-carga do Ventrículo Direito (VD); 2) Reperfusão completa da circulação pulmonar a médio prazo, que pode ser espontânea (decorrente da ação de trombolíticos endógenos) ou secundária ao tratamento com anticoagulantes ou 3) Reperfusão parcial da circulação pulmonar, com oclusão residual de parte da circulação pulmonar (KYRLE et al., 2000). Acredita-se que cerca de 1/3 dos pacientes com Tromboembolismo Pulmonar (TEP) agudo em tratamento com anticoagulantes evolua com oclusão residual de parte da circulação pulmonar (DIAS et al., 2008).
Pacientes com HPTEC apresentam, consequentemente a essa oclusão residual, uma disfunção hemodinâmica acentuada e padecem não apenas ao território vascular hipoperfundido, mas também pelas regiões pulmonares livres de coágulos, submetidas a hiperfluxo relativo, frente ao fluxo sanguíneo desviado das regiões obstruídas. Ademais, acredita-se que o hiperfluxo dessas regiões possa desencadear uma disfunção endotelial, com consequente remodelamento vascular. Tais disfunções endoteliais não são encontradas apenas em território arterial, mas também no território venoso. (SIMONNEAU et al., 2019).
Como resultante dessas alterações hemodinâmicas de Hipoperfusão/Hiperfluxo regional, surge a HP e insuficiência de VD (DIAS et al., 2008).
3. SINAIS E SINTOMAS
Clinicamente, os pacientes com HPTEC apresentam-se com sintomas de dispneia progressiva e intolerância ao exercício. Ocasionalmente, surgem sinais e sintomas decorrentes a insuficiência de VD como edemas de membros inferiores, dor abdominal, ascite, dor torácica ao esforço, sincope e pré-sincope (DIAS et al., 2008).
Inicialmente, os sintomas são desencadeados aos esforços e com a progressão da doença para estágios avançados, os mesmos surgem ao repouso (GALIÈ et al., 2015).
Em relação ao exame físico, é comum o aparecimento, pela ausculta pulmonar, de sopros de fluxo sobre os campos pulmonares (GALIÈ et al., 2015). Esses sopros sutis parecem originar-se secundariamente ao turbilhonamento através de artérias pulmonares parcialmente obstruídas ou recanalizadas e estão presentes em aproximadamente 30% dos pacientes com HPTEC. Eles são agudos, ouvidos mais comumente nos campos pulmonares posteriores em vez do precórdio, acentuados durante a inspiração e frequentemente auscultados apenas durante os períodos de apneia. Esses achados não foram descritos em pacientes com outros tipos de HP. Hemoptise é um sintoma mais frequente na HPTEC, comparada a outras formas de HP, dada a consequente ruptura de artérias brônquicas hipertrofiadas (SIMONNEAU et al., 2019).
Outros sinais comuns ao exame físico incluem componente pulmonar acentuado da segunda bulha cardíaca – B2; aparecimento de terceira bulha – B3, sopro pansistólico de regurgitação tricúspide e sopro diastólico de regurgitação pulmonar. Edema de Membros inferiores, hepatoesplenomegalia, ascite, elevação da pressão venosa jugular aparecem conforme progressão da doença (GALIÈ et al., 2015).
4. DIAGNÓSTICO POR IMAGEM
A maioria dos grandes centros utilizam métodos de imagem as quais incluem Cintilografia pulmonar (SIMONNEAU et al., 2019), Angiografia Pulmonar por Tomografia Computadorizada e angiografia pulmonar invasiva de alta qualidade (ENDE-VERHAAR et al., 2017).
A Cintilografia pulmonar de Inalação/perfusão (V/Q) permanece como a primeira escolha para investigação de casos suspeitos de HPTEC devido a sua alta sensibilidade (96-97%) e especificidade (90-95%) (GALIÈ et al., 2015). No entanto, em pacientes com HPTEC, são algumas limitações a este exame: A varredura V/Q pode subestimar a extensão da obstrução vascular pulmonar central. Além disso, qualquer processo de doença que obstrua o fluxo vascular pulmonar sem uma obstrução correspondente da ventilação pode resultar em defeitos incompatíveis (TUNARIU et al., 2007). Outros distúrbios hipertensivos pulmonares além da HPTEC que também podem estar associados a defeitos segmentares ou de grande perfusão na cintilografia pulmonar V/Q são: sarcoma de artéria pulmonar, doença pulmonar veno-oclusiva, mediastinite fibrosante, vasculite pulmonar de grandes vasos e compressão vascular. Ou seja, é um método bastante sensível, porém pouco específico (WOLF et al., 2016).
Já a Angiotomografia de tórax apresenta um papel mais relevante ao realizar o diagnostico de TEP agudo. Na HPTEC, sua principal função é determinar o diagnostico diferencial de outras causas de obstrução vascular, assim como outras alterações de parênquima pulmonar que possam sugerir a presença de heterogeneidade de perfusão (NAGAYOSHI et al., 2018). Alem disso, a angiotomografia de tórax tem importância prognóstica, principalmente para definição da melhor estratégia terapêutica assim como a acessibilidade cirúrgica das lesões trombóticas obstrutivas (MADANI et al., 2012).
Exames invasivos como o Cateterismo Cardíaco Direito (CCD) e a Arteriografia Digital por Subtração dos Pulmões (ADSP), são indicados para a avaliação pré-operatória e estratificação de risco clínico e cirúrgica dos pacientes com HPTEC. Devido a sua complexidade, o CCD tem importância para definição terapêutica, devendo ser realizado em centros de referência para HPTEC (GALIÈ et al., 2015).
Cinco padrões angiográficos estão associados à presença de HPTEC com material tromboembólico organizado, sendo eles: 1) defeitos de enchimento intravasculares, 2) redes ou bandas da artéria pulmonar (estruturas fibróticas finas, semelhantes a fitas que atravessam a artéria), 3) irregularidades intimais, 4) estreitamento abrupto das principais artérias pulmonares, 5) obstrução de vasos lobares ou segmentares em sua origem, com completa ausência de fluxo sanguíneo para os segmentos pulmonares que normalmente são perfundidos por esses vasos (MADANI et al., 2012).
Figura 1 – Algoritmo de investigação de Hipertensão Pulmonar Tromboembólica Crônica (HPTEC). CCD: Cateterismo Cardíaco Direito, HP: Hipertensão Pulmonar
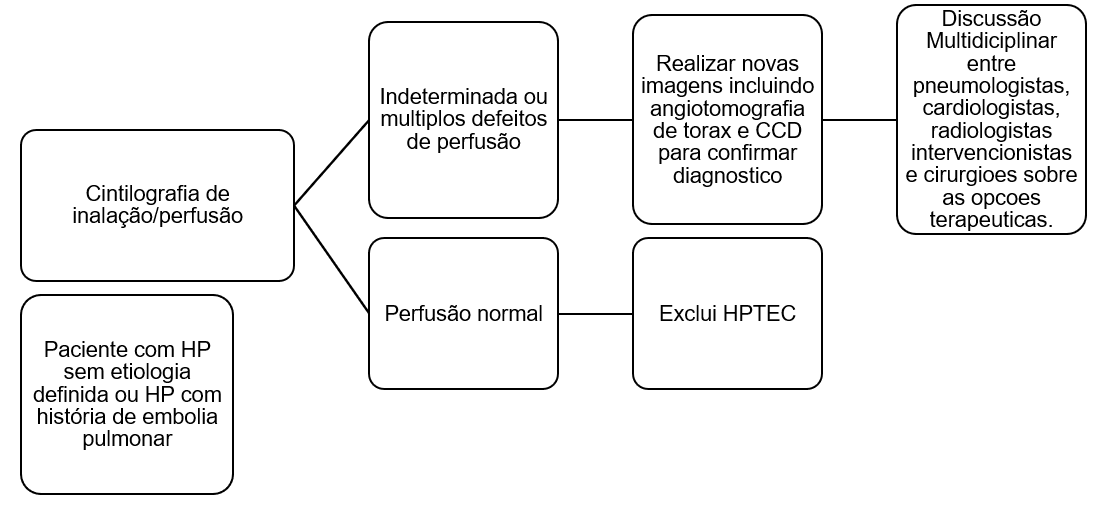
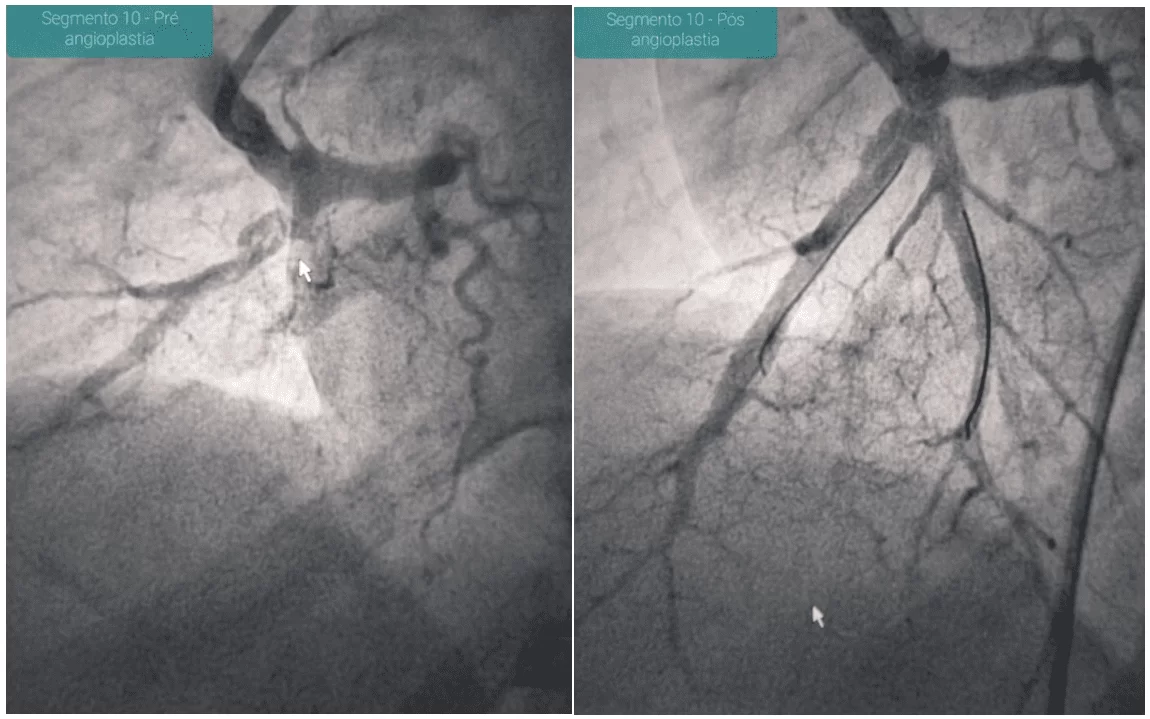
Figura 2 – Imagem evidenciando defeito de perfusão do segmento 10 do pulmão esquerdo, à angiografia pulmonar, achados compatíveis com doença tromboembólica crônica. Imagem realizada após angioplastia com balão do segmento
Ademais, alguns outros métodos são utilizados para avaliar o local em que será feita a intervenção. O Ultrassom Intravascular (IVUS) é um recurso utilizado para dimensionar com maior precisão os vasos a serem tratados (KOPEC’G et al., 2015; INOHARA et al., 2015). Outro recurso frequentemente utilizado é a Tomografia de Coerência Óptica (OCT) (MADANI et al., 2012). Esse último, fornece informações como dimensões, presença de rede de fibrina e de trombos reepitelizados de forma ainda mais precisa. Ambos os procedimentos, são de alta complexidade, aumentando de forma expressiva a dificuldade do tratamento (INOHARA et al., 2015).
A história natural da HPTEC é progressiva e leva a insuficiência cardíaca direita e morte. Pacientes com suspeita clínica de HPTEC devem ser encaminhados de forma precoce e rotineira aos centros especializados nesta doença. O encaminhamento não deve ser adiado mesmo que os sintomas, anormalidades hemodinâmicas ou comprometimento ventilatório pareçam leves (KIM et al., 2019). Caso este encaminhamento seja protelado, o desenvolvimento e a progressão de uma vasculopatia secundária podem levar a um resultado hemodinâmico abaixo do ideal da Tromboendarterectomia da Artéria Pulmonar (TEAP) e podem aumentar o risco de mortalidade associado ao procedimento (ENDE-VERHAAR et al., 2017).
Segundo os últimos registros internacionais, pacientes com HPTEC apresentam mortalidade em torno de 5%, apesar de ter sido reportado mortalidade de 2,2% em grandes centros especializados (MADANI et al., 2012). Sobrevida media de 89% em paciente operados versus 70% no grupo sem nenhuma intervenção cirúrgica (DELCROIX et al., 2016).
Define-se como centro especializado em atendimento ao paciente com HPTEC aquele com experiência na avaliação e tratamento de pacientes com tal comorbidade. Sua avaliação é feita por uma equipe multidisciplinar que normalmente é composta por cirurgiões com experiência na realização de TEAP (idealmente >. 50 casos/ano com taxa de mortalidade < 5 por cento), especialistas em Hipertensão Pulmonar (HP) com experiência no tratamento de HP, radiologistas experientes em imagens de HPTEC e intensivistas adeptos ao manejo desses pacientes no pós-operatório crítico. Atualmente, estes centros vêm ganhando experiência na realização de Angioplastia Pulmonar por Balão (APB), realizadas por cardiologistas intervencionistas, embora a experiência em ABP ainda não seja um pré-requisito para definir a experiência do centro (FERNANDES et al., 2021).
5. MANEJO E OPÇÕES DE TRATAMENTO
Todos os pacientes devem ser anticoagulados plenamente, por período indefinido, a partir da suspeita diagnóstica. O diagnóstico de HPTEC, por definição, deve ser confirmado somente após, pelo menos, três meses de anticoagulação. A mesma deve ser mantida, inclusive no pós-operatório caso paciente seja submetido a TEAP, independente de sucesso e durante todo o período de tratamento clínico (FERNANDES et al., 2021).
6. TROMBOENDARTERECTOMIA DA ARTÉRIA PULMONAR
A Tromboendarterectomia da Artéria Pulmonar (TEAP), é a única terapia definitiva e potencialmente curativa para HPTEC. No entanto, o TEAP permanece como uma modalidade de cirurgia torácica de grande porte e a seleção de candidatos ideais é fundamental para o seu sucesso. A terapia medicamentosa não é curativa e geralmente é reservada para aqueles que não são candidatos à cirurgia ou pacientes que falham ou recusam a TEAP (GALIÈ et al., 2015).
Durante a avaliação da indicação da TEAP, leva-se em consideração fatores associados a resultados favoráveis da cirurgia como a avaliação do comprometimento hemodinâmico ou de exercício significativo, presença de tromboêmbolos crônicos acessíveis cirurgicamente, avaliação do resultado hemodinâmico pós-operatório previsto, presença de comorbidades que interfiram a candidatura a cirurgia e se as preferências do paciente afetam a decisão médica a cirurgia (TUNARIU et al., 2007).
O foco principal da avaliação é determinar se a remoção do material tromboembólico reduziria suficientemente a Resistência Vascular da Artéria Pulmonar (RVP). A última avaliação é crítica, pois os resultados dependem do efeito da TEAP na RVP. Os resultados são favoráveis quando a RVP diminui. Em contraste, a ausência de queda da RVP após o procedimento está associada a piores resultados a curto prazo (incapacidade de desmame da circulação extracorpórea, instabilidade hemodinâmica pós-operatória precoce, morte pós-operatória precoce) e resultados ruins a longo prazo (por exemplo, hipertensão pulmonar residual) (FERNANDES et al., 2021).
7. ANGIOPLASTIA PULMONAR POR BALÃO
A Angioplastia Pulmonar por Balão (APB), no passado, foi relacionada a altas taxas de mortalidade, porém atualmente vem ganhando espaço nos centros especializados. As primeiras menções a realização de APB surgiram em 1988 (VOOBURG et al., 1998), e apenas em meados de 2001 que as primeiras series de casos foram publicados. Desde então, novas técnicas vêm sendo aprimoradas e difundidas por todo o mundo (MAHMUD et al., 2018).
A APB é realizada por via femoral ou jugular e cateteres-guia passados para as artérias pulmonares. O objetivo da APB é restaurar o fluxo normal do vaso (MAHMUD et al., 2018).
Os alvos de tratamento dependem, particularmente, das características das lesões em áreas com perfusão reduzida (MAHMUD et al., 2018). Sendo assim, áreas onde há redução da perfusão são consideradas de maior importância quando comparadas as áreas com lesões visualizadas angiograficamente (KAWAKAMI et al., 2016).
Prioriza-se os vasos dos lobos inferiores e do pulmão direito sobre o pulmão esquerdo, ao se realizar a APB devido ao maior impacto fisiológico (HOOLE et al., 2020)
Esta, é indicada para pacientes com HPTEC inoperável ou aqueles que permanecem com HP residual pós cirúrgico (MAHMUD et al., 2018). O procedimento, semelhante a angioplastia de artérias coronárias, consiste na inserção de cateter em leito de artérias pulmonares e posterior dilatação com balão no vaso escolhido, sem necessidade de próteses, como stents. A insuflação do balão leva a distorção das moléculas de fibrina e mobilização de trombos, levando a uma melhora do fluxo sanguíneo e consequentemente redução da RVP (DELCROIX et al., 2016).
As taxas de complicações variam de 2% a 17% e são provavelmente dependentes do paciente, da lesão e do operador. O risco de edema pulmonar de reperfusão associado ao BPA percutâneo aumenta com a elevação da pressão arterial pulmonar. Outras complicações incluem perfuração da artéria pulmonar, dissecção da artéria pulmonar e hemoptise (OGO et al., 2017).
O tratamento com APB, geralmente é repetido em cada paciente, cerca de 6 a 8 vezes (sessões), pois a abordagem de mais de 4 segmentos em uma mesma sessão pode levar a complicações como edema de reperfusão ou ruptura de vasos, causando hemorragia alveolar (GALIÈ et al., 2015).
O principal objetivo da APB é a redução da PmAP (Pressão Média de Artéria Pulmonar) e da Resistencia Vascular Pulmonar (RVP) (GALIÈ et al., 2015; COGHLAN et al., 2021).
Uma última abordagem terapêutica para HPTEC é o transplante duplo – cardiopulmonar. Esse recurso é indicado aos pacientes os quais não são candidatos a TEAP por risco proibitivo ou com falha pós cirúrgica – pós TEAP e/ou pós realização de APB (FERNANDES et al., 2021; COGHLAN et al., 2021).
A terapia específica para Hipertensão Pulmonar (HP) somente deve ser iniciada em centros especializados em HP (FERNANDES et al., 2021). Pequenos ensaios randomizados e estudos observacionais sugerem que a terapia específica para HP em pacientes com HPTEC inoperável ou persistente mostram benefícios hemodinâmicos e sintomáticos (COGHLAN et al., 2021). No entanto, esses benefícios são modestos em comparação com aqueles que podem ser alcançados com a tromboendarterectomia pulmonar (DELCROIX et al., 2016). Para avaliação inicial desses pacientes, é realizado cateterismo da artéria pulmonar sem teste de vasorreatividade, como parte da investigação diagnóstica inicial para HPTEC. O mesmo pode ser realizado novamente caso haja progressão de sintomas desde o diagnóstico inicial (NAGAYOSHI et al., 2015).
8. TERAPIA MEDICAMENTOSA
Em relação a seleção do melhor fármaco, é levado em consideração diversos fatores: preferência do paciente, custo, disponibilidade, segurança, via de administração e classe funcional (BOSWORTH et al., 2019). Atualmente, estão disponíveis no Brasil, a Bosentana, como um representante da classe dos antagonistas dos receptores de endotelina, o Sildenafil e Tadalafila (FERNANDES et al., 2021), como inibidores da fosfodiesterase-5 e o Riociguat, como estimulante solúvel da guanilato ciclase (GALIÈ et al., 2015).
A decisão de iniciar a terapia específica para HP deve ser baseada em parâmetros hemodinâmicos objetivos para evitar a progressão contínua da HP. Para aqueles que não recebem ou recusam a terapia, observamos clinicamente a progressão da HP. Raramente os pacientes com HPTEC se encontram em Classe funcional I, sendo a maioria classificado como Classe II ou III. Geralmente, inicia-se em monoterapia com Riociguat, nesses pacientes em classe funcional II e III. Essa abordagem é baseada em pequenos ensaios randomizados e estudos observacionais que demonstraram melhora na capacidade de exercício, classe funcional e hemodinâmica pulmonar em pacientes com HPTEC, entre os quais o Riociguat tem melhor evidência quanto ao seu benefício. Nenhuma evidência robusta sugeriu um benefício de sobrevivência. Como alternativa, Bosentana ou Sildenafil são apropriados como agentes orais com perfis hemodinâmicos e de segurança favoráveis em pacientes com HPTEC (BOSWORTH et al., 2019)
A terapia oral raramente é administrada como ponte para a cirurgia, pois a maioria dos pacientes com essa indicação está gravemente doente (BOSWORTH et al., 2019).
A melhor ilustração disso é um estudo multicêntrico, randomizado e controlado por placebo que estudou 261 pacientes com HPTEC inoperável (189 pacientes) ou HP persistente após TEP (72 pacientes). Em 16 semanas, em comparação com placebo, os pacientes em uso de Riociguat (0,5 a 2,5 mg três vezes ao dia) tiveram uma melhora na distância de caminhada de seis minutos (DTC6; aumento de 39 m versus diminuição de 6 m) e resistência vascular pulmonar (diminuição em 226 dinas-seg./cm -5 [2,8 woods] versus aumentado em 23 dinas-seg./cm -5[0,28 woods]). Riociguat teve um perfil de segurança favorável sem diferença entre os dois eventos adversos mais comuns, que foram insuficiência ventricular direita e síncope (BOSWORTH et al., 2019).
Normalmente é iniciado tratamento em monoterapia (mais frequentemente Riociguat) e posteriormente ampliada para terapia combinada (terapia dupla ou tripla), caso haja resposta limitada ou inexistente a um único agente. Quando da terapia combinada, deve-se tomar o cuidado para não coadministrar agentes de mesma classe assim como realizar uso concomitante de Riociguat e Sildenafila, a fim de evitar hipotensão grave (GHOFRANI et al., 2013).
Comparando-se a ABP vs Riociguat, um estudo randomizado, controlado e multicêntrico, recentemente evidenciou em pacientes não elegíveis para TEAP, um cenário positivo para a intervenção ABP. Dos 124 paciente randomizados, após 6 meses de follow up, houve uma queda da resistência vascular pulmonar em 60% no grupo ABP vs 32% no grupo Riociguat (p<0,001). Ainda houve benefício para o grupo ABP como queda da Pressão Média da Artéria Pulmonar, Pressão média em átrio direito, pró-peptídeo natriurético cerebral N-Terminal (NT-Pro-BNP) e da classe funcional (WANG et al., 2019).
Tratamento de suporte, incluindo diuréticos, fisioterapia respiratória e oxigenoterapia domiciliar prolongada, devem ser instituídos a depender da necessidade individual de cada paciente (GALIÈ et al., 2015).
9. CONCLUSÃO
Apesar do amplo arsenal terapêutico utilizado na HPTEC, seu diagnóstico e manejo ainda é considerado um desafio. Muitas vezes há o atraso em seu diagnostico inicial elevando de forma considerável sua morbimortalidade. Seus portadores ainda encontram múltiplas dificuldades para acesso aos centros especializados e a profissionais especialistas capacitados para adequado manejo.
As opções de tratamento validados, atualmente, para pacientes com HPTEC incluem a Tromboendarterectomia Pulmonar, Angioplastia Pulmonar por Balão e a terapia medicamentosa com Riociguat. Ensaios controlados e randomizados com poder adequado são necessários para melhorar suas evidências assim como para abrir novos horizontes acerca do tema.
REFERÊNCIASBIBLIOGRÁFICAS
BONDERMAN, D. et al. High prevalence of elevated clotting factor VIII in chronic thromboembolic pulmonary hypertension. ThrombHaemost. 2003 Sep;90(3):372-6. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/12958604/>. Acesso em: 27 mar. 2023.
BOSWORTH, T. Balloon pulmonary angioplasty beats riociguat in randomized CTEPH trial. MDedge News. October 18th 2019. Disponível em: <https://www.mdedge.com/chestphysician/article/210403/cardiology/balloon-pulmonary-angioplasty-beats-riociguat-randomized>. Acesso em: 23 mar. 2023.
COGHLAN, John G., et al. Balloon Pulmonary Angioplasty: State of the Art. Interventional Cardiology Review. 2021;16:e02. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7903587/>. Acesso em: 27 mar. 2023.
DELCROIX, M, et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry. Circulation. 2016;133:859–71. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26826181/>. Acesso em: 27 set. 2022.
DIAS, Bruno Arantes, et al. Chronic thromboembolic pulmonar hypertension: diagnostic limitations. J Bras Pneumol. 2008;34(7):532-536. PMID: 18695799 Disponível em: <https://pubmed.ncbi.nlm.nih.gov/18695799/>. Acesso em: 27 mar. 2023.
ENDE-VERHAAR, Yvonne, et al. Incidence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: a contemporary view of the published literature. Eur Respir J. 2017; 49. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/28232411/>. Acesso em: 25 mar. 2023.
FEINSTEIN, JA, Goldhaber SZ, Lock JE, et al. Angioplastia pulmonar com balão para tratamento da hipertensão pulmonar tromboembólica crônica. Circulation. 2001;103:10–13. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8118630/>. Acesso em: 25 mar. 2023.
FERNANDES, Caio Julio et al. Brazilian Thoracic society recommendations for the diagnosis and treatment of chronic thromboembolic pulmonary hypertension. J Bras Pneumol. 2021. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/35766678/>. Acesso em: 25 mar. 2023.
GALIÈ, Nazzareno, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The joint task force for diagnosis and treatment of pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endosed by: Association for European Peadriatric and Congenital Cardiology (AEPC), Internation Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2015;46(4):903-975. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26320113/>. Acesso em: 4 abr. 2023.
GHOFRANI, Hossein-Ardeschir , et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med.2013;369:319–29. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/23883377/>. Acesso em: 4 abr. 2023.
HOEPER, Marius M, et al. Chronic thromboembolic pulmonary hypertension. Circulation. 2006;113(16):2011-2020. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/16636189/>. Acesso em: 4 abr. 2023.
HOOLE S, Coghlan J, Cannon J, et al. Balloon pulmonary angioplasty for chronic thromboembolic disease – the UK experience. Open Heart. 2020;7:e001144. Disponível em: <https://openheart.bmj.com/content/openhrt/7/1/e001144.full.pdf>. Acesso em: 4 Abr 2023.
INOHARA Taku, et al. Lesion morphological classification by OCT to predict therapeutic efficacy after balloon pulmonary angioplasty in CTEPH. Int J Cardiol. 2015;197:23–25. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26142960/>. Acesso em: 4 abr. 2023.
KAWAKAMI, Takashi., et al. Novel angiographic classification of each vascular lesion in chronic thromboembolic pulmonary hypertension based on selective angiogram and results of balloon pulmonary angioplasty. Circ Cardiovasc Interv. 2016;9:e003318. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/27729418/>. Acesso em: 4 abr. 2023.
KIM, Nick H, et al. Chronic thromboembolic pulmonary hypertension. Eur Respir J. 2019 Jan 24;53(1):1801915. PMID: 30545969; PMCID: PMC6351341. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6351341/pdf/ERJ-01915-2018.pdf>. Acesso em: 4 abr. 2023.
KOPEC, Grzegorz., et al. In vivo characterization of changes in composition of organized thrombus in patient with chronic thromboembolic pulmonary hypertension treated with balloon pulmonary angioplasty. Int J Cardiol. 2015; 186:279–81. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/25828135/>. Acesso em: 6 abr. 2023.
KYRLE, PA, et al. High plasma levels of factor VIII and the risk of recurrent venous thromboembolism. N Engl J Med. 2000; 343:457. . Disponível em: <https://pubmed.ncbi.nlm.nih.gov/10950667/>. Acesso em: 6 abr. 2023.
MADANI, Michael M, et al. Pulmonary endarter-ectomy: recent changes in a single institution’s experience of more than 2,700 patients. Ann Thorac Surg. 2012;94:97–103. . Disponível em: <https://pubmed.ncbi.nlm.nih.gov/22626752/>. Acesso em: 6 abr. 2023.
MAHMUD, Ehtisham et al. Chronic thromboembolic pulmonary hypertension: evolving therapeutic approaches for operable and inoperable disease. J Am Coll Cardiol. 2018:71:2468–86. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/29793636/>. Acesso em: 6 abr. 2023.
MORRIS, Timothy A, et al. Fibrin derived from patients with chronic thromboembolic pulmonary hypertension is resistant to lysis. Am J Respir Crit Care Med. 2006; 173:1270. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2662971/>. Acesso em: 6 abr. 2023.
NAGAYOSHI, Shinya, et al. Intravenous ultrasound- guided balloon pulmonary angioplasty in the treatment of totally occluded chronic thromboembolic pulmonary hypertension. Euro Intervention. 2018;14:234–5. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/29061549/>. Acesso em: 8 abr. 2023.
OGO, Takeshi, et al. Efficacy and safety of balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension guided by cone-beam computed tomography and electrocardiogram-gated area detector computed tomography. Eur J Radiol. 2017;89:270–6. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/28034568/>. Acesso em: 8 abr. 2023.
SIMONNEAU, Gérald, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. Eur Respir J. 2019;53:1801913. Disponível em: < https://pubmed.ncbi.nlm.nih.gov/30545968/>. Acesso em: 8 abr. 2023.
TUNARIU, Nina, et al. Ventilation-perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension. J Nucl Med. 2007; 48:680. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/17475953/>. Acesso em: 8 abr. 2023.
VOORBURG JA, Cats VM, Buis B, et al. Balloon angioplasty in the treatment of pulmonary hypertension caused by pulmonary embolism. Chest. 1988;94:1249–53. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/2973404/>. Acesso em: 8 abr. 2023.
WANG, Wuwam, et al. Balloon pulmonary angioplasty vs riociguat in patients with inoperable chronic thromboembolic pulmonary hypertension: a systematic review and meta-analysis. Clin Cardiol. 2019;42:741–52. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/31188483/>. Acesso em: 8 abr. 2023.
WOLF, M, et al. Thrombotic risk factors in pulmonary hypertension. Eur Respir J. 2000; 15:395. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/10706510/>. Acesso em: 8 abr. 2023.
[1] Médico especialista em Cardiologia e em Clínica Médica. ORCID: https://orcid.org/0000-0002-5840-7642. Currículo Lattes: http://lattes.cnpq.br/8343325111098554.
[2] Orientador. Doutorado em Ciencias Médicas, Mestrado em Ciencias Médicas, especialista em Cardiologia e Cardiologia Intervencionista. ORCID: https://orcid.org/0000-0001-9835-1906. Currículo Lattes: http://lattes.cnpq.br/3029173882526121.
[3] Médico especialista em Cardiologia, Hemodinamica e Cardiologia Intervencionista e em Clínica Médica. ORCID: 0009-0008-1369-4458. Currículo lattes: http://lattes.cnpq.br/5132847930391432.
[4] Médico especialista em Cardiologia, Hemodinâmica e Cardiologia Intervencionista e em Clínica Médica. ORCID: 0009-0004-3289-9396. Currículo lattes: http://lattes.cnpq.br/9152831851097186.
Enviado: 15 de maio, 2023
Aprovado: 22 de junho, 2023.

