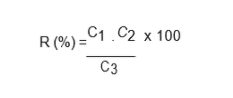ARTÍCULO ORIGINAL
MAZZEI, João Roberto Fortes [1], FREIRE, Estevão [2], SERRA, Eduardo Gonçalves [3], MACEDO, José Ronaldo de [4], OLIVEIRA, Angélica Castanheira de [5], BASTOS, Lucia Helena Pinto [6], CARDOSO, Maria Helena Wohlers Morelli [7]
MAZZEI, João Roberto Fortes. Et al. Método de residuos múltiples para el análisis de 240 plaguicidas en suelos de plantación de tomate por cromatografía líquida de ultra rendimiento acoplada a espectrometría de masas. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 06, Ed. 01, Vol. 08, págs. 34-67. Enero de 2021. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/ingenieria-ambiental-es/metodo-de-residuos, DOI: 10.32749/nucleodoconhecimento.com.br/ingenieria-ambiental-es/metodo-de-residuos
RESUMEN
En este trabajo, se optimizó un método analítico para la determinación de residuos para el enfoque de plaguicidas: Azoxistrobina, Boscalida, Carbendazim, Cloranthranilprole, Clotianidina, Diafentiuron, Difenoconazol, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenilenozida, Methoxifilurox. , Thiametoxan en suelo derivado de la siembra de tomate, con el fin de comparar los niveles de contaminación de estos compuestos en muestras de suelo. Se utilizó el método de extracción QuEChERS modificado y Cromatografía Líquida Ultra Performance acoplada a Espectrometría de Masas Secuencial, con fuente de ionización por Electronebulización en modo ESI (+/-). El método consistió en extraer 15,0 g de suelo con 15 ml de solución saturada de hidróxido cálcico pH 12,3 y 15 ml de acetonitrilo, con la consiguiente partición en el efecto de “salificación” a través de 6,0 g de sulfato de magnesio anhidro y 1,5 g de cloruro de sodio. . Las fases se separaron por centrifugación a 3700 rpm durante 7 min. Los extractos se diluyeron con MeOH licrossolv® grado y se inyectaron en un cromatógrafo. El método fue validado en base a los parámetros de linealidad, LOD, LOQ, precisión y exactitud. Linealidad entre 0,2 y 20,0 µg L-1, coeficientes de determinación superiores a 0,99. Los valores de LOQ para el método fueron 13 µg kg-1 para Spinosad y 7,0 µg kg-1 para los otros plaguicidas. El método mostró buena precisión, con valores de RSD <20%, y exactitud, con recuperaciones entre 70 y 120% para la gran mayoría de los compuestos analizados. Las curvas analíticas se prepararon con extractos de suelo blanco de referencia, con el fin de minimizar el Efecto Matriz. El método se consideró adecuado para el análisis de residuos de plaguicidas en el suelo, ya que satisface los parámetros de validación de los métodos cromatográficos (Comisión Europea, 2018). Después de la validación, el método se utilizó para analizar los residuos de estos plaguicidas en muestras de suelo de plantaciones de tomates convencionales, orgánicos y sostenibles. Permitiendo comparar los niveles de impactos ambientales generados. Además de validar el método analítico para los plaguicidas-foco del estudio, también fue posible validar 240 compuestos más, entre autorizados y no autorizados para su uso en la siembra de tomate.
Palabras clave: Contaminantes en suelos, residuos de plaguicidas, QuEChERS, UPLC-MS / MS.
INTRODUCCIÓN
El cultivo de tomate es susceptible a la aparición de plagas y enfermedades de insectos. Datos de la investigación de Carvalho (2017) citan que el cultivo de tomate es vulnerable al ataque de enfermedades provocadas por plagas de insectos, siendo la mosca blanca (Bemisia), una de las principales plagas que afectan al tomate. Bemisia argentifolii y Bemisia tabaci, son las dos principales especies de mosca blanca responsables de causar daños al cultivo del fruto. En el trabajo del autor se entrevistó a productores de tomate del municipio de Cambuci (Río de Janeiro), en el cual se observó que alrededor del 60% de los cultivadores realizan hasta dos aplicaciones de plaguicidas semanales. En un 2% de los casos, los plantadores describieron que, dependiendo de la situación, como: si surgen enfermedades o el tiempo es lluvioso, hay necesidad de un mayor número de aplicaciones, que puede llegar a tres veces por semana.
Morfológicamente, no hay diferencia entre las dos especies. Sin embargo, el primero es más agresivo, ya que, además de ser más resistente a condiciones ambientales adversas y a algunos plaguicidas convencionales, tiene una mayor tasa de reproducción, afecta a un mayor número de plantas hospedantes y logra completar todo su ciclo de vida en el tomate. Por ello, es necesario utilizar diversos plaguicidas para controlar estas y otras plagas que afectan a las plantaciones de tomate (ESALQ, 2017).
En este trabajo se decidió utilizar la terminología guiada por la legislación brasileña – plaguicidas – considerando que este término, a pesar de no abarcar en esencia todos los productos utilizados, engloba la mayor cantidad de atributos necesarios para describir las sustancias que componen este universo y agrega más transparencia y ética para el lector, el usuario y el consumidor de los productos en los que se utilizan dichos compuestos (SOBER, 2018).
Según la revisión de la legislación brasileña sobre plaguicidas publicada el 28/06/2018 (MAPA, 2018):
El término plaguicida no es utilizado por ningún otro país u organización internacional que se ocupe del tema. La Comisión del Codex Alimentarius, la organización internacional de referencia para los alimentos en el Acuerdo de la Organización Mundial del Comercio (OMC) sobre la Aplicación de Medidas Sanitarias y Fitosanitarias, utiliza el término inglés y francés “agrotóxico” y el español “plaguicida”. Por lo tanto, es necesario cambiar el término plaguicida por plaguicida, con el fin de alinear la legislación brasileña con las prácticas internacionales.
El tomate fue elegido como objeto de este estudio por sus características específicas, es decir, plantaciones como el tomate (Solanum lycopersicum L. = Lycopersicon esculentum Mill), requieren una atención frecuente en cuanto a la infestación de plagas y malezas, lo que implica la necesidad de aplicar pesticidas con gran frecuencia.
Al entrar en contacto con el suelo, los plaguicidas son sometidos a procesos físico-químicos que empeoran su acción en el medio ambiente. Debido a la necesidad de un uso racional de los insumos agrícolas para minimizar los impactos ambientales de la agricultura, se han realizado numerosos estudios con el objetivo de comprender el comportamiento de estos productos en el suelo. Sin embargo, se sabe poco sobre el comportamiento de estos plaguicidas en suelos tropicales.
CONTAMINACIÓN DE SUELOS POR AGROTOXICOS
Según los estudios de Azevedo (2018), aún con un mayor control de la aplicación de plaguicidas, el suelo es el destino final de los químicos utilizados en la agricultura, ya sea que se apliquen directamente al suelo, a la parte aérea de las plantas o incluso a las frutas en bolsas. En contacto con el suelo, los pesticidas y herbicidas están sujetos a procesos físico-químicos que aumentan su acción en el medio ambiente. Según el autor, debido a la necesidad de un uso racional de los insumos agrícolas para minimizar los impactos ambientales de la agricultura, se han realizado numerosos estudios con el objetivo de comprender el comportamiento de estos productos en el suelo.
El suelo actúa como filtro, reteniendo muchas de las impurezas que se vierten en él. De esta forma, su calidad puede verse alterada por la acumulación de contaminantes atmosféricos, uso de pesticidas / fertilizantes, residuos sólidos, materiales tóxicos e incluso radiactivos. Cuando el contaminante llega a la superficie del suelo, puede adsorberse; transportados por el viento o las aguas de escorrentía, o incluso lixiviados por las aguas de infiltración, alcanzando los horizontes inferiores y alcanzando el nivel freático. Una vez que se alcanza el agua subterránea, estos contaminantes se pueden llevar a otras regiones (CETESB, 2020).
La disposición de CONAMA (2009) informa que las propiedades químicas del suelo, como pH, contenido de nutrientes, capacidad de intercambio iónico, conductividad eléctrica y materia orgánica, junto con las actividades biológicas, son responsables de la adsorción, fijación química, oxidación y neutralización de estos. contaminantes.
PLAGUICIDAS Y CULTURA DEL TOMATE
El tomate es una fruta originaria de América del Sur, los datos históricos indican que desde hace más de 100 años el tomate ya era cultivado por los incas y aztecas en las regiones altas de Perú y México. Los primeros países en cultivar el producto fueron Perú, México, Bolivia, Ecuador y Chile, según (CURRENCE, 2013). Los mayores productores de tomate del mundo en la actualidad son: China, Brasil, Estados Unidos, India, Turquía, Egipto, Italia, Irán, España y México, según el informe FAOSTAT (2018).
Los datos del IBGE (EPAG, 2019), muestran que Brasil produjo 4.084.910 toneladas en 2018 y que, en enero de 2019, la producción fue de 4.333.609 toneladas de la fruta. Las regiones de mayor producción en 2018 fueron: sureste con 1.689.558 toneladas (São Paulo produjo 811.100 toneladas) y centro-oeste, con 1.369.014 toneladas (Goiás produjo 1.334.500 toneladas).
Para Junior (2019), no hay tomate resistente a la mayoría de plagas y enfermedades. Por tal motivo, la forma más común de controlar estas infestaciones sigue siendo la aplicación de fungicidas e insecticidas, lo que ocasiona riesgo de contaminación de los trabajadores involucrados, residuos de plaguicidas en las frutas, impactos al medio ambiente y mayores costos.
En Brasil, las referencias de ANVISA (2018) autorizan alrededor de 500 ingredientes activos para fines agrícolas, limpieza del hogar, no agrícolas, ambientes acuáticos y conservantes de madera. De esta cantidad, 119 plaguicidas están autorizados para su aplicación en la plantación de tomate. El mismo ingrediente activo puede comercializarse bajo el etiquetado de muchas formulaciones y nombres comerciales, y es común una mezcla que contenga más de un ingrediente en el mismo producto.
Carvalho (2017), en su investigación, menciona que los pesticidas se utilizan en la siembra de tomates con el objetivo de combatir principalmente la mosca blanca, hongos del tizón tardío [8], tallo hueco, marchitez bacteriana, minador de hojas, barrenador grande de frutos, mancha negra , mancha bacteriana y pequeño barrenador de la fruta. Según esta investigación, para combatir tales plagas y enfermedades, son necesarias varias aplicaciones de plaguicidas. El autor menciona que los productores se refirieron a 53 marcas comerciales diferentes y un promedio de 12 tipos de plaguicidas por cultivo. Los insecticidas y fungicidas son los productos más utilizados por el agricultor en la siembra de tomates, debido a una enfermedad llamada tizón tardío, según esta investigación.
DESTINO DE PLAGUICIDAS EN EL MEDIO AMBIENTE
El uso de pesticidas en el cultivo convencional de tomate suscita una preocupación constante por los daños que ocasiona al medio ambiente, especialmente en ambientes bióticos y abióticos. Además, se observan una serie de efectos entre los trabajadores de campo: debilidad, náuseas, mareos, cánceres, daño hepático, alergias, entre otros. Así, es muy importante analizar los frutos, suelo y agua con el propósito de cuantificarlos para verificar si se encuentran dentro de los límites máximos de residuos (LMRs[9]) autorizados por Anvisa, según (RIBAS y MATSUMURA, 2009).
DESARROLLO
METODOLOGÍA – LOCALES, HIPÓTESIS Y ETAPAS DE TRABAJO
LOCAL
Este trabajo partió de las siguientes premisas:
- No hay tomate resistente a la mayoría de plagas y enfermedades;
- El suelo es el destino final de gran parte de los residuos de la aplicación de plaguicidas en los métodos de siembra en los que se aplican;
- Es probable que exista contaminación del suelo por la aplicación de plaguicidas en plantaciones agrícolas que pueden generar impactos ambientales en ambientes bióticos y abióticos;
HIPÓTESIS
- Los pesticidas que se utilizan en la agricultura brasileña no son amigables con el medio ambiente en lo que respecta a la contaminación de frutas y suelos;
- La siembra convencional con uso intensivo de plaguicidas puede no ser respetuosa con el medio ambiente;
- Existe una brecha en la agricultura, que es la ausencia de un método validado y confiable para la determinación y cuantificación de plaguicidas en el suelo, de acuerdo con los límites máximos de residuos (LMR) especificados por Anvisa;
- Es posible utilizar plaguicidas para la siembra y mantener la fruta en niveles de concentración que cumplan con los requisitos de la legislación vigente en el país;
El conocimiento de los residuos y contaminantes en el suelo es importante para el desarrollo de acciones que mejoren el manejo y control en la producción agrícola para reducir dichos contaminantes.
ETAPAS DE TRABAJO
a) Realización de investigación: aplicación de un cuestionario mixto de respuestas abiertas y múltiples opciones. Esta investigación se aplicó a los plantadores en las áreas donde se recolectarían las muestras y permitió relevar los principales productos utilizados en sus plantaciones. Estos plaguicidas fueron identificados como “Plaguicidas-Foco” del trabajo.
b) Recolección de muestras de suelo en áreas de tres tipos de cultivo: convencional; orgánico y sustentable;
c) Recolección de muestras de ensayo de referencia en blanco – Muestras de suelos que no han sido sometidos a ningún tratamiento con los plaguicidas de interés en este trabajo;
d) Caracterización del suelo en cuanto a textura, fertilidad y composición química – Etapa realizada en conjunto en los laboratorios EMBRAPA SOLOS-RJ;
e) Preparación de muestras para extracción – las muestras deben tener una granulometría de malla 30 (tierra fina), apta para extracción química – paso realizado en los laboratorios EMBRAPA SOLOS-RJ;
f) Análisis de muestras reales de suelo recolectadas en campo.
Esta etapa se dividió en:
- Caracterización de suelos – Realizada en Laboratorios EMBRAPA SOLOS;
- Determinación de materia orgánica – Etapa realizada en Laboratorios EMBRAPA SOLOS;
- Análisis químico para la determinación de micronutrientes del suelo – Etapa realizada en el Laboratorio FERTIMOVEL (EMBRAPA SOLOS);
- Extracción, Clean-up, adecuación y optimización del Método QuEChERS para la determinación de residuos de plaguicidas en muestras de suelo, mediante Cromatografía Líquida de Ultra Resolución acoplada a Espectrometría de Masas Secuencial – Paso Realizado en los laboratorios INCQS – FIOCRUZ.
g) Cálculos, evaluación estadística y graficación de los resultados obtenidos.
PLAGUICIDAS SELECCIONADOS PARA EL ESTUDIO
En la investigación realizada con los plantadores se observó que los principales productos utilizados en sus plantaciones fueron: Abamectin, Acibenzolar-S-Methyl, Azoxystrobin, Ciromazine, Diafentiuron, Mandipropamida, Pimetrozina, Tiametoxan. Así, se decidió adecuar el método analítico, inicialmente, para la determinación de residuos de estos “pesticidas-foco” en suelo proveniente del cultivo de tomate. La investigación se realizó con jardineras de la región norte fluminense (Río de Janeiro), gran productora de tomates distribuidos entre los tres sistemas de cultivo estudiados en este trabajo (convencional, orgánico y sustentable).
EL MÉTODO DE EXTRACCIÓN (QUECHERS)
El método de extracción QuEChERS (de l’anglais Quick, Easy, Cheap, Efectivo, Effective Rugged , and Seguro) investigado y llevado a la comunidad científica por ANASTASSIADES et al. (2003), tiene como objetivo eliminar las limitaciones prácticas de los métodos de extracción multirresiduos que existían hasta entonces. El método tiene como principales diferenciales, el hecho de ser rápido, fácil, económico, eficaz, robusto y seguro, como lo abrevia el nombre QuEChERS. Diéz et al. (2006) señalan que este método fue desarrollado para muestras que contienen más del 75% de agua.
ENCUESTA BIBLIOGRÁFICA SOBRE EL MÉTODO QUECHERS ALIADO A LA CROMATOGRAFÍA PARA LA DETERMINACIÓN DE PLAGUICIDAS – EVOLUCIÓN CRONOLÓGICA
Lesueur et al. (2008) investigaron cambios en QuEChERS en el análisis de 105 plaguicidas por cromatografía de gases acoplada a espectrómetro de masas (CG-EM) y 46 plaguicidas por cromatografía líquida de ultra rendimiento acoplada a espectrometría de masas secuencial (CLUE-EM / EM) después de la extracción por el método QuECheRS en cuatro matrices (uva, limón, cebolla y tomate).
Drożdżyński et al. (2009) investigaron 3 insecticidas ecológicos (azadiractina, espinosad y rotenona) en muestras de suelo, repollo y tomate utilizando el método QuEChERS modificado, con posterior determinación de los niveles por CLUE-EM / EM.
Chen et al. (2010) realizaron una modificación del método QuEChERS para determinar procimidona en muestras de suelo y puerro, complementando el trabajo mediante cuantificación por GC-MS.
Rashid et al. (2010) analizaron 19 plaguicidas del grupo de organoclorados en suelos, aplicando un método QuEChERS modificado y de clean-up consistente en partición líquido-líquido con n-hexano. El procedimiento fue validado para la determinación de 19 plaguicidas organoclorados, hexaclorobenceno (HCB), α-HCH, β-HCH, γ-HCH, heptacloro, epóxido de heptacloro (trans), aldrina, dieldrina, clordano (trans), clordano (cis) , oxiclordano, α-endosulfán, β-endosulfán, sulfato de endosulfán, endrina, p, p’-DDT, o, p’-DDT, p, p’-DDD ep, p’-DDE.
Shi et al. (2010) propuso un método QuEChERS modificado para el análisis de residuos de oxadiargilo en muestras de suelo, agua, arroz y paja de arroz, con cuantificación por GC-ECD.
Pinto et al., (2010) investigaron una versión aún más simplificada del método QuEChERS para analizar tres compuestos organoclorados (hexaclorobenceno; 1,2-diclorobenceno y cloroformo) en muestras de suelo, seguido de cuantificación por GC-µECD. En el trabajo, los autores utilizaron tres tipos diferentes de suelos: suelo de jardín, con un alto grado de materia orgánica; un Vertisol, con alto contenido de arcilla; y un material sedimentario de referencia certificado (suelo arcilloso).
Martins (2010) utilizó el método QuEChERS – determinación de residuos de plaguicidas en suelo de cultivo de arroz irrigado, utilizando quechers modificados con solución saturada de hisdróxido de calcio y LC-MS / MS para la determinación de residuos de Clomazona, Fipronil, Imazapique, Imazetapyr, Propiconazole, Thiametoxam y Trifloxystrobin.
Ramos et al. (2010) desarrollaron un método QuEChERS modificado para la determinación de 11 plaguicidas en tres tipos de suelo (forestal, ornamental y agrícola). Se desarrolló una versión modificada del método QuEChERS para la determinación de plaguicidas organofosforados (etoprofos, dimetoato, diazinón, malaoxón, clorpirifos-metil, fenitrión, malación, clorpirifos, fenamifos y fosmet) y un plaguicida de la clase tiadiazina (buprofezina). por GC-NPD.
Drożdżyński et al. (2011), determinaron 160 plaguicidas en vinos mediante extracción en fase sólida dispersa en modo mixto y CG-EM.
Costa (2012) realizó un estudio del método QuEChERS para la determinación multirresiduo de plaguicidas en melocotones en almíbar. Los LOQ de los pesticidas en este estudio variaron entre 1.0 y 10.0 μg.kg-1 y se basaron en la curva para monitorear el desempeño del método y la linealidad. Según el autor, las curvas analíticas arrojaron valores de r superiores a 0,99; con valores de recuperación para melocotones escurridos entre 83,4% y 120,4% con RSD inferior al 14,9% para la mayoría de los analitos y 68,6% a 124,6% con RSD inferior al 19,8%.
Los estudios de Tsipi et al., (2015) abordan la cuantificación de residuos de los metabolitos 2,4-D, mediante cromatografías líquidas y de gases acopladas al espectrómetro de masas.
Ramos et al. (2016) citan que el método QuEChERS se utilizó solo 8 veces en la extracción de plaguicidas en suelos, y que en la mayoría de los casos se aplicó cromatografía de gases con detección de Espectrometría de Masas (CG-EM), excepto en tres casos, donde la cromatografía de gases con Se aplicaron detectores de captura de electrones (CG-DCE); Detección de captura de nitrógeno y fósforo (CG-DNF) y microelectrones (CG-DμCE).
Dong et al. (2017) determinaron residuos de metaflumizona en muestras de suelo y repollo, aplicando el método QuEChERS. Los autores informan que se obtuvieron valores de recuperación entre 77,6 y 87,9% para metaflumizona en suelos y repollo, con una desviación estándar relativa (RSD) de 3,5 y 7,9%. Los valores LOD y LOQ del método para las mismas muestras fueron 0.001 mg.kg-1 y 0.004 mg.kg-1 respectivamente.
Según Iglesias (2016), el proceso de acoplamiento de la cromatografía líquida a la espectrometría de masas se produjo muy lentamente, debido a la incompatibilidad entre los altos caudales utilizados en la parte de HPLC, lo que dificultaba el transporte del eluyente de la columna cromatográfica directamente a la fuente de el espectrómetro., que trabaja en alto vacío. Habiendo resuelto estas dificultades, la cromatografía líquida con una interfaz de acoplamiento de espectrometría de masas (LC-MS) se ha utilizado cada vez más como una técnica excelente para la determinación de diversos residuos de analitos.
Ogihara (2018), empleó el método QuEChERS y la cromatografía líquida ultraeficiente junto con la espectrometría de masas secuencial en la determinación de plaguicidas multirresiduos en el suelo. En su trabajo, las tres versiones del método QuEChERS, tampón “Original”, “Acetato” y tampón “Citrato”, fueron evaluadas en ausencia y presencia del paso de limpieza en la extracción de plaguicidas del suelo y el UHPLC- MS / MS con adición de patrón interno de Trifenilfosfato en su cuantificación y confirmación. El método desarrollado tuvo como objetivo correlacionar ciertas propiedades físicas y químicas de 20 plaguicidas seleccionados por el autor con su respectivo tiempo para disiparlos en el ambiente en presencia y ausencia de luz.
Todas estas investigaciones terminaron en la conclusión de que los métodos clásicos para la determinación de plaguicidas en suelos no son rentables, ya que son procedimientos que requieren muchos pasos, generalmente basados en la extracción exhaustiva de la matriz, con etapas posteriores de clean-up -up para la eliminación de materiales coextraídos, antes del análisis instrumental.
ELECCIÓN DE MUESTRAS PARA EL PASO DE VALIDACIÓN
Las muestras utilizadas para la etapa de validación fueron aquellas de suelo blanco que no fueron sometidas a ningún tratamiento con pesticidas antes y durante la siembra. Después de la determinación cromatográfica, estas muestras estaban libres de pesticidas, sin mostrar señal cromatográfica en tiempos de retención similares a los de los compuestos de interés analítico.
El suelo utilizado en los estudios fue clasificado como Planossolo Eutrófico Arenico Hidromórfico, perteneciente a la unidad cartográfica en el municipio de Tanguá, en el municipio de Rio de Janeiro. La región presenta un relieve llano a suavemente ondulado con un sustrato de sedimentos aluviales recientes.
Las propiedades físicas y químicas de este suelo son: pH del agua (1: 1) = 4.8; P = 6,0 mg L-1; K = 120 mg L-1; arcilla = 26%; M.O. = 2,3%; Ca = 5,0 cmolc L-1; Mg = 2,0 cmol L-1; Al = 1,7 cmolc L-1 e índice SMP 5,1
REACTIVOS, DISOLVENTES Y GASES
Acetone P.A.; Acetonitrilo – UHPLC; Sulfato de magnesio anhidro; Cloruro de sodio P.A.; PSA: UHPLC; Agua destilada; Agua ultrapura, purificada en el sistema Milli-Q-Plus; Aire sintético 99,9% puro; C18 – Cartuchos para SPE; Cloruro de sodio; Diclorometano – ultra resi-analizado; Etanol-UV-IR-HPLC; Extran neutral; ace argón, analítico, utilizado como gas de colisión en el sistema CLUE-MS / MS; Gas nitrógeno, utilizado como gas de desolvatación en la fuente de electrospray; Metanol – UV-IR-HPLC; Absorbente Bondesil PSA, con un tamaño de partícula de 50 μm;
EQUIPOS
Agitador Marconi Modelo M227; Invernadero Fanem Modelo F 330; Agitador Vortex IKA Modelo MS 3 Digital; Balanza analítica de precisión; Metler Toledo; Modelo XP205; número de serie B018030980; Balanza analítica de precisión; SARTORIUS Modelo SARTORIUS – número de serie 71205517; Centrífugo; Eppendorf, modelo 5810R; Micropipetizadores automáticos Eppendorf de capacidad variable; medidor de pH Metler Toledo S 220; Sistema de purificación de agua Milli-Q fabricado por MilliPore; Cromatógrafo de líquidos Waters Acquity Ultraperformance LC; Espectrómetro de masas secuencial Four Premier Model XE.
OPTIMIZACIÓN DEL MÉTODO – CONDICIONES CROMATOGRÁFICAS Y DEL ESPECTRÓMETRO DE MASAS
El análisis se realizó utilizando un sistema Acquity UPLC® acoplado a Quattro Premier XE® (Waters Corp., Ma, EE. UU.).
Sistema Acquity UPLC® compuesto por bomba binaria, muestreador automático y horno de columna.
La separación cromatográfica se realizó en la columna Waters Acquity BEH UPLC® C18 (100 x 2,1 mm DI, 1,7 µm). Composiciones de la fase móvil A (formato de amonio 5 mM + ácido fórmico al 0,01%, pH 4,00) y la fase móvil B (acetonitrilo: fase móvil A, 95: 5), gradiente: 0-1 min (10% B); 1 a 5,5 min (55% B); 5,5 a 10,5 min (100% B); 12 min (10% B). El caudal utilizado fue de 0,3 mL min-1, la temperatura del horno de la columna fue de 30 ° C, la temperatura del muestreador automático fue de 25 ° C.El inyector se ajustó para una inyección de circuito completo de 10 µL y el tiempo total de ejecución fue de 12 min.
El espectrómetro de masas Quattro Premier XE® se hizo funcionar con una fuente de ionización por electropulverización en modo positivo (ESI +). Los parámetros operativos se ajustaron para las siguientes condiciones: voltaje capilar: 3,5 kV; temperatura de la fuente de iones: 120 ° C, temperatura de desolvatación: 450 ° C; flujo de gas de cono (N2): 20 L.h-1; flujo de gas de desolvatación (N2): 500 L.h-1; flujo de gas de colisión (Ar): 0,15 mL.min-1. Las tensiones cónicas, las energías de colisión y las transiciones de cuantificación y confirmación para cada analito se establecieron a partir de la infusión directa de una solución de 1 µg.mL-1. La infusión de analitos se realizó con las fases móviles A y B (1: 1), con un caudal de 0,1 mL.min-1 en modo full scan. Después de ajustar estos parámetros, se utilizó el método de seguimiento de reacciones múltiples (MRM), utilizado para identificar y cuantificar los analitos.
La elección de la fase móvil, el modo de ionización (ESI positivo), las transiciones de cuantificación y confirmación se realizaron de acuerdo con la literatura (Aguilera-Luiz et al., 2011; Rubensam et al., 2011) y las características químicas de los analitos. Algunos de los parámetros utilizados en el sistema Quattro Premier XE®, como la tensión capilar; temperatura de la fuente de iones; La temperatura de desolvatación, entre otras, se estableció durante la calibración del instrumento por parte del fabricante. Los iones precursores de cada analito se observaron mediante infusión directa. En la mayoría de los casos, se observó el ion protonado [M+ H]+.
ESTÁNDARES ANALÍTICOS
Los estándares analíticos de los plaguicidas estudiados y preparación de soluciones de trabajo (soluciones madre de fortificación)
Los estándares analíticos para los pesticidas utilizados fueron adquiridos de AccuStandart Company. La Tabla 1 muestra el grado de pureza (%) y la clase de estándares analíticos sólidos utilizados para el desarrollo de este trabajo.
Tabla 1 – Patrones analíticos sólidos utilizados en el trabajo
| PLAGUICIDAS | PUREZA (%) |
| Azoxistrobina | 99,4 |
| Boscalida | 95,5 |
| Carbendazim | 98,7 |
| Clorantraniliprol | 98,4 |
| Clotianidina | 96,5 |
| Diafentiurón | 99,9 |
| Difenoconazol | 100 |
| Dimetomorfe | 98 |
| Espinetoram | 96,8 |
| Spinosad | 96,6 |
| Fenurón | 98 |
| Imidacloprid | 99,5 |
| Indoxacarb | 97,3 |
| Metalaxyl M | 98 |
| Metoxifenozida | 99,5 |
| Tiametoxam | 100 |
Fuente: AccuStandart en New Haven, Connecticut, EE. UU. – 2018
Con estos estándares, se preparó la solución madre de fortificación que contenía los analitos. Esta solución tiene una validez de solo un mes y debe haber sido cuidadosamente almacenada en un frasco de color ámbar, con tapón y tapón de teflón a -18ºC, en ultrafrío.
Todo el material de vidrio utilizado en la preparación de soluciones y análisis, como pipetas, matraces aforados, vasos de precipitados, etc., fue debidamente calibrado e identificado para evitar errores volumétricos en las determinaciones.
Inicialmente se prepararon 10 mL de solución analítica stock de 1000 mg.L-1 de cada plaguicida. Los estándares se disolvieron en Metanol al 0.02% en ácido acético glacial que son los mismos componentes de la fase móvil adoptada en la cromatografía líquida que analizará los compuestos y las soluciones madre se almacenaron en matraces ámbar a una temperatura de -18 ºC.
Mediante el método de diluciones sucesivas, se prepararon soluciones analíticas individuales para cada plaguicida en estudio, a una concentración de 100 mg.L-1, con los mismos disolventes. A partir de estas soluciones, se preparó una mezcla a una concentración de 10 mg.L-1 que contenía todos los pesticidas. Finalmente, a partir de la solución estándar 10 mg.L-1, se preparó una mezcla a una concentración de 0.200 mg.L-1 conteniendo todos los pesticidas.
A partir de la mezcla intermedia de 1,0 mg L-1, se prepararon soluciones de trabajo analíticas en concentraciones de 0,4; 2,0; 4.0; 10,0; 20.0 y 40.0 µg.L-1 conteniendo todos los plaguicidas en cada concentración para la preparación de la curva de calibración del cromatógrafo de líquidos. Para inyección en el sistema UHPLC-MS / MS, se realizaron diluciones en la proporción 1: 1 (v / v) de estas soluciones en fase móvil Metanol / agua, de manera que las concentraciones finales de las soluciones de trabajo evaluadas fueron 0.2; 1,0; 2,0; 5,0; 10.0 y 20.0 µg L-1 para todos los pesticidas que componen la solución madre de fortificación. Las diluciones de las soluciones analíticas en la fase móvil acidificada tienen como objetivo mejorar la eficiencia de ionización de los analitos, mejorando la señal cromatográfica, la forma y simetría de los picos. Estas soluciones de trabajo se utilizaron para estudiar la linealidad del método. Todas las soluciones se almacenaron en botellas de color ámbar y se almacenaron a -18 ºC.
VALIDACIÓN DEL MÉTODO
La parametrización adoptada para la validación del método analítico consistió en la verificación del desempeño. Así, parámetros como: curva analítica y linealidad, límite de detección, límite de cuantificación, exactitud (recuperación) y precisión (repetibilidad y precisión intermedia) se han convertido en un referente para la obtención de resultados fiables.
DETERMINACIÓN DEL SUELO BLANCO DE REFERENCIA
Debido a la complejidad de la matriz y los bajos niveles de concentración en los que se encuentran los plaguicidas en el suelo (orden de ppm a ppb), la preparación de la muestra fue fundamental para obtener resultados confiables.
El paso más difícil fue obtener una muestra de suelo blanco, libre de pesticidas y que pudiera servir como referencia cero para los estudios. Este suelo estaba destinado a contaminar con pesticidas para seguir la optimización mediante el método QuEChERS.
Para la verificación de suelo blanco, se utilizó la muestra de suelo codificada como A1BR05 en dos tratamientos:
TRATAMIENTO 01
En 5 tubos de centrífuga Falcon de 50 mL, se pesaron 15g de suelo y se realizó el tratamiento 01, con base en el Método QuEChERS original: 15g de suelo + 5 mL H2O; agitar con vórtex 30 segundos, 1 ml de sustituto (Propoxur 1,0 µg / ml); agitar en vórtice 30 segundos; Espera de 15 min; 15 ml de ACN de grado UHPLC; Agitar en el vórtex 30 segundos; 6 g de MgSO4 + 1,5 g de NaCl; Centrifugación (7 min); extracción del sobrenadante y dilución con metanol RP 1: 1 para inyección en el cromatógrafo de líquidos.
Se utilizó como marcador la solución de Propoxur 1,0 µg.mL-1 (sustituto). Si el cromatograma blanco aparecía sin picos, era necesario asegurarse de que el sistema mostraba sensibilidad a los compuestos, y el propoxur era el compuesto que traía esa certeza.
TRATAMIENTO 02
También se probó un tratamiento con el método modificado con solución de Hidróxido de Calcio con pH = 12.6, con el fin de obtener un mejor fondo de las muestras con respecto a la matriz del suelo de la siguiente manera:
En 5 tubos de centrífuga Falcon de 50 mL, se pesaron 15 g de suelo y se realizó el tratamiento 02 – 15 g de suelo + 5 ml H2O; agitar en vórtice 30 segundos; 1 ml de sustituto; agitar en vórtice 30 segundos; 5 ml de solución de Ca(OH)2 pH 12,6; Espera de 5 min; 15 ml de ACN de grado UHPLC; agitar en vórtice 30 segundos; 6 g de MgSO4 + 1,5 g de NaCl; centrifugación (7 min); extracción del sobrenadante y dilución con metanol RP 1; 1 para inyección en el cromatógrafo de líquidos.
Se demostró que las muestras de suelo A1BR05 estaban libres de pesticidas en ambos tratamientos. A partir de esta etapa, la muestra A1BR05 se convirtió en el suelo blanco de referencia de este trabajo.
Los dos tratamientos anteriores se utilizaron para muestras de suelo nombradas con la solución de enriquecimiento que contiene los analitos de interés.
El método fue inicialmente optimizado para la extracción de los pesticidas-foco: Azoxystrobin, Boscalide, Carbendazim, Cloranthranilprole, Clothianidin, Diafentiuron, Difenoconazol, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenuron, Imidacloprido de cultivo de tomate, seguido de muestras de cultivo de tomate, Methoxy por determinación por UHPLC-MS / MS (Cromatografía líquida de ultra rendimiento), que requiere que la matriz esté limpia, minimizando las interferencias de fondo (efecto de matriz – backgroud). Así, los tratamientos 1 y 2 fueron los puntos de partida para la extracción de estos plaguicidas de la matriz del suelo.
En ambos tratamientos los extractos fueron muy claros. Aun así, las fracciones de cada una de las pruebas mencionadas anteriormente se probaron en un paso de limpieza dispersiva. En esta etapa se probó una extracción dispersiva en la fase sólida de la limpieza del PSA, generando 4 tratamientos más, totalizando 8 pruebas diferentes.
El extracto se filtró a través de una membrana de PTFE y luego se transfirió 1 ml de extracto a un matraz aforado, se disolvió con 1 ml de Metanol y esta solución final se transfirió a un matraz cromatográfico. A partir de este momento, se inyectaron 5 microlitros de cada muestra por duplicado en el cromatógrafo de líquidos de ultra rendimiento acoplado al espectrómetro de masas. Las pruebas se realizaron por duplicado y los resultados se representan en la tabla 2.
Tabla 2 – Resultados de los tratamientos 1 y 2 del análisis de plaguicidas-foco por cromatografía líquida de ultra-rendimiento
| Principio activo | Factor de recuperación sin clean-up (%) | Factor de recuperación después de la clean-up (%) | ||
| Tratamiento 01 | Tratamiento 02 | Tratamiento 01 | Tratamiento 02 | |
| Abamectina | 88/115 | 65/70 | 97,5 | 115 |
| Diafentiurón | 43/37 | 67/72 | 53 | 81,2 |
| Azoxistrobina | 101/100 | 93/94 | 162,5 | 160 |
| Pimetrozina | 30/28 | 81/75 | 30 | 120 |
| Acibenzolar-S-Metil | 138/131 | 36/38 | 162 | 47,5 |
| Mandipropamida | 108/109 | 110/102 | 180 | 162 |
| Ciromazina | 60/61 | 81/80 | 95 | 125 |
| Metomilo | 108/116 | 107/105 | 177 | 225 |
| Pimetrozina | 30/28 | 81/75 | 45 | 120 |
| Acetamiprido | 103/104 | 99/103 | 167 | 155 |
| Buprofezina | 98/97 | 96/96 | 167 | 166 |
| Lucifenurón | 68/67 | 64/63 | – | – |
| Tiametoxam | 104/98 | 70/69 | 165 | 112 |
Fuente: elaboración de los autores
El tratamiento con solución de hidróxido de calcio (pH = 12,3) mostró mejores factores de recuperación para la mayoría de los analitos, excepto para Acibenzolar-S-Metil, que no se recuperó bien en ninguno de los tratamientos. Esto posiblemente se deba a la metilación de la estructura del compuesto de azufre, lo que dificulta su extracción en acetonitrilo. Por lo tanto, la validación continuó con base en el tratamiento 02.
PRUEBAS DE FORTIFICACIÓN PARA EVALUAR LA EXACTITUD DEL MÉTODO
Para el estudio de la precisión de este método analítico se realizaron ensayos de fortificación con el objetivo de verificar el factor de recuperación de los compuestos en estudio. Así, se llevaron a cabo cinco fortificaciones de las muestras “blancas de referencia” a dos niveles diferentes de concentración, totalizando 10 pruebas.
Cada nivel de fortificación se inyectó dos veces, totalizando un n = 10 (5 extracciones x 2 inyecciones).
Para el procedimiento de extracción del método QuEChERS modificado, se pesaron 15,00 g de suelo homogéneo en tubos de polipropileno (tipo Falcon), con tapón de rosca (50 mL de capacidad). Luego, cada muestra se humedeció con 5 ml de agua Milli-Q y se agitó vigorosamente durante 30 segundos en Vortex. La fortificación se agregó a ambos niveles, utilizando pipetas calibradas de 0.5 mL y 1.0 mL, en concentraciones: 0.200 µg.mL-1 para todos los plaguicidas contenidos en la solución de fortificación.
Después de la fortificación, las muestras se homogeneizaron agitando en vórtex durante 30 segundos y se mantuvieron a 20 ºC durante 15 minutos. La investigación de PINTO et al. (2010), señalan que es fundamental que exista tiempo suficiente para que la muestra con los analitos se evapore el solvente y, por lo tanto, exista una mayor interacción entre los compuestos y la matriz. Según el autor, este paso acerca la prueba a la realidad de la interacción que se da con las muestras en el campo.
Luego, con la ayuda de una pipeta volumétrica, 5 mL de solución saturada de hidróxido de calcio pH 12,3, en cada tubo, y luego de cerrarlos, se realizó un vórtex durante 30 segundos. Dejándolo reaccionar durante 10 minutos, en reposo. A continuación, se añadieron a cada tubo 15 ml de acetonitrilo de grado Lichrosolv (para análisis de residuos) y se agitó de nuevo durante 30 segundos.
Se añadieron 1,5 cloruro de sodio (NaCl) y 6,0 g de MgSO4 (sulfato de magnesio anhidro) a cada tubo y se agitaron durante 30 segundos más, con el fin de obtener la mayor interacción posible entre el extracto líquido y los reactivos sólidos. Finalmente, los tubos se llevaron a centrifugación durante 7 minutos a 3000 rpm.
En un vial con capacidad de 2 mL se realizó una dilución 1: 1 (v / v), en la cual se adicionó 1.0 mL del extracto obtenido luego de la extracción y 1.0 mL de la fase móvil, seguido de análisis por LC-MS / SRA.
Finalmente, se realizaron diluciones de los extractos finales en la proporción 1: 1 (v / v) en fase móvil (agua ultrapura). La recuperación del compuesto se evaluó a concentraciones de 1 y 2 µg.kg-1 de suelo para todos los pesticidas en la solución de fortificación.
Los resultados de la recuperación fueron interesantes en ambos tratamientos. Sin embargo, el tratamiento 02 demostró ser más efectivo en la extracción de un mayor número de plaguicidas, con recuperaciones en el rango de 64 a 110%, a excepción del Acibenzolar-S-Metil, cuyas recuperaciones fueron más expresivas en el tratamiento 1.
Los resultados de los experimentos para evaluar el mejor método de extracción y limpieza se muestran en la Tabla 1 – Pruebas realizadas para optimizar el paso de extracción.
La etapa de limpieza no mostró ninguna mejora significativa en los resultados. Por lo tanto, se decidió pasar a la etapa de validación utilizando el tratamiento 02 sin la etapa de clean-up.
OPTIMIZACIÓN DEL MÉTODO
El método de extracción se optimizó de acuerdo con la Guía de garantía de calidad analítica. Los valores establecidos en este manual cumplen con los requisitos de la Decisión 2018/657 (European Comission/SANTE, 2018).
Se evaluaron los siguientes parámetros: selectividad; efecto de matriz; linealidad; recuperación; límite de detección (LOD); límite de cuantificación (LOQ) y repetibilidad. Los cálculos se realizaron utilizando el software MassLynx® y Microsoft Excel®. En el método propuesto, la selectividad se evaluó mediante el análisis de cinco réplicas de los extractos de muestreo de suelos de tomate. La evaluación de la linealidad implicó trazar una curva de disolvente analítico de la solución de trabajo MIX 1 que contiene los 295 analitos, con cinco puntos correspondientes a 0, 0,5, 1,0, 1,5 y 2,0 veces el LMR establecido para cada analito. Se utilizó la prueba de Cochran para evaluar la homogeneidad de las variaciones obtenidas para cada nivel de concentración. Los datos de calibración se evaluaron mediante regresión lineal común en caso de homocedasticidad o regresión lineal ponderada en caso de heterocedasticidad.
Para la extracción de las muestras se utilizó el mismo suelo de referencia de las pruebas iniciales. En el método propuesto, la selectividad se evaluó analizando cinco réplicas de los extractos de muestreo del suelo de la plantación de tomate. En 10 tubos de centrífuga, tipo Falcon, se pesaron 15 gy se añadió 1 mL de la solución de trabajo. En los tubos numerados 1 y 5, se añadió 1 mL de la solución de fortificación con soluciones de trabajo de nivel 1 en cada tubo, y en los tubos numerados de 6 a 10, se agregó 1 mL de la solución de fortificación con soluciones de trabajo de nivel 2 en cada tubo, además a un tubo de ensayo en blanco, sin fortificar, con control de calidad de propoxur. Los 11 tubos recibieron todos los pasos que se utilizaron en el tratamiento 2, y posteriormente, se transfirió 1 ml del extracto a un matraz y se aplicó 1 ml de MeOH (componente de la fase móvil). Luego, se inyectaron 5µL en el Cromatógrafo Líquido Ultra Performance acoplado al espectrómetro de masas secuencial, en las mismas condiciones adoptadas para las pruebas 3 y 4 del tratamiento 2. Cada muestra se inyectó por quintuplicado, según lo recomendado en Guia Sante (2018) para la validación de métodos cromatográficos.
El efecto de la matriz se evaluó comparando la pendiente de la curva analítica en el extracto de matriz con la pendiente de la curva analítica en el solvente, utilizando la prueba F (Fisher Snedecor). Luego, se aplicó la prueba t de Student para determinar la equivalencia estadística entre las pendientes de las curvas analíticas en el solvente y en la matriz.
El LOD y LOQ se calcularon utilizando la relación señal / ruido del equipo. LOD fue la concentración equivalente a tres veces el ruido y LOQ fue la concentración equivalente a seis veces el ruido. La recuperación y repetibilidad del método se realizó con muestras de suelo con picos de dos niveles: 0.5 a 1.0 equivalente a 5 veces el LMR de cada analito, con cinco repeticiones para cada nivel. Se calcularon la recuperación media y la desviación estándar relativa (RSD) para cada nivel. Análisis de muestras. Las muestras de campo fueron amablemente proporcionadas por productores del estado de Río de Janeiro, Brasil, y fueron analizadas mediante el método validado.
El método QuEChERS modificado con hidróxido de calcio mostró mejores resultados de recuperación que el método QuEChERS original para la mayoría de los analitos, principalmente para Abamectin, Acetamipride, Azoxystrobin, Buprofezina, Diafentiuron, Mandipropamide, Pymetrozine, Cyromazine, Metomil, Pimetrozine, Luciamenuron y. Con el método modificado (método QuEChERS con Ca (OH)2), los valores de recuperación obtenidos estuvieron dentro del rango aceptable de 70-120% (ANVISA, 2018). El tratamiento 2 tuvo solo un resultado de recuperación fuera del rango aceptable de 80-110%, Acibenzolar-S-Metil (37%). El paso de clean up con SPE dispersivo no promovió mejoras significativas en las recuperaciones. La etapa de limpieza SPE terminó no siendo necesaria porque el primer extracto obtenido fue claro y presentó recuperaciones aceptables para los compuestos de interés, como se muestra en la Tabla 2.
Por tanto, el método de extracción elegido para seguir el proceso de validación fue el método basado en el tratamiento 2 (QuEChERS con hidróxido de calcio) sin el paso de limpieza SPE, utilizando MgSO4, PSA y C18.
La precisión se calculó utilizando la siguiente ecuación y se expresó como un porcentaje de recuperación (INMETRO, 2007):
Dónde:
C1 = Concentración determinada en la muestra enriquecida;
C2 = Concentración determinada en la muestra no enriquecida;
C3 = Concentración utilizada para la fortificación.
No hubo interferencia en la misma m / z y tiempo de retención de los analitos en las cinco repeticiones realizadas con el extracto de matriz. Así, fue posible obtener la selectividad del método. La hoja de trabajo para la evaluación de la curva analítica – Validación del método multirresiduos por CLUE-EM / EM se muestra en la Figura 1.
Figura 3 – Datos sobre la evaluación de la curva analítica – Validación del método multirresiduos por CLUE-EM / EM

Las características de desempeño del método optimizado, el rango de trabajo, los valores de los Coeficientes de correlación (r) y determinación (R2) para las curvas analíticas obtenidas para cada analito se muestran en la Tabla 3.
Tabla 3 – Resumen de los resultados de la evaluación – Coeficientes de correlación (r) y determinación (R2)
| Sustancia | VALIDACIÓN DE LA CURVA ANALÍTICA | |
| r | R2 | |
| Azoxistrobina | 0,9995 | 0,9989 |
| Boscalida | 0,9982 | 0,9964 |
| Carbendazim | 0,9996 | 0,9993 |
| Clorantraniliprol | 0,9996 | 0,9991 |
| Clotianidina | 0,9963 | 0,9925 |
| Diafentiurón | 0,9993 | 0,9986 |
| Difenoconazol | 0,9988 | 0,9975 |
| Dimetomorfe | 0,9991 | 0,9982 |
| Espinetoram | 0,9973 | 0,9947 |
| Spinosad | 0,9987 | 0,9974 |
| Fenurón | 0,9986 | 0,9973 |
| Imidacloprid | 0,9995 | 0,9990 |
| Indoxacarb | 0,9981 | 0,9961 |
| Metalaxyl M | 0,9998 | 0,9997 |
| Metoxifenozida | 0,9969 | 0,9939 |
Fuente: elaboración de los autores
El efecto matriz no fue evaluado para la validación del suelo, considerándose significativo para todos los plaguicidas estudiados.
Todas las sustancias analizadas presentaron un comportamiento homocedástico en el rango de trabajo de 0,0032 a 0,0500 µg / mL.
Se observa que para la mayoría de los analitos, los coeficientes de determinación (r2) fueron cercanos a uno, mostrando buena linealidad, indicando un perfil de dispersión homocedástica (variación constante de errores experimentales para diferentes observaciones) para la mayoría de los analitos, permitiendo que las curvas estándar fueran evaluadas por regresión lineal utilizando el método de mínimos cuadrados ordinarios. Los ajustes lineales ponderados (1 / x) se realizaron utilizando el software MassLynx®. Los valores de t de Student calculados para el efecto de la matriz estuvieron dentro de los valores requeridos por la Guía SANTE para la mayoría de los analitos. Así, la curva en el extracto de la matriz se utilizó para cuantificar las muestras, incluidos los analitos en los que no se observó el efecto de la matriz. Os valores obtidos para LOD e LOQ, bem como a razão sinal/ruído (Tabela 4) satisfizeram aos critérios estabelecidos pela Agência Nacional de Vigilância Sanitária (ANVISA, 2018) para esses analitos, confirmando que o método otimizado é adequado para atender à legislação vigente en Brasil. Sin embargo, para cumplir con la legislación europea, es necesario revisar los LOD y LOQ obtenidos, ya que se encuentran muy próximos al nivel máximo establecido (EUROPEAN COMISSION, 2018).
Tabla 4 – Sustancias validadas en la matriz del suelo, con los respectivos límites de cuantificación y la correspondiente relación señal / ruido
| Sustancia | VALIDACIÓN DE LA CURVA ANALÍTICA | |
| LOQ (mg/kg) | Razão Sinal/Ruído | |
| Azoxistrobina | 0,0066 | 538,39 |
| Boscalida | 0,0076 | 30,11 |
| Carbendazim | 0,0055 | 166,53 |
| Clorantraniliprol | 0,0075 | 276,84 |
| Clotianidina | 0,0064 | 496.4 |
| Diafentiurón | 0,0038 | 72,37 |
| Difenoconazol | 0,0077 | 38,83 |
| Dimetomorfe | 0,0072 | 27,62 |
| Espinetoram | 0,0074 | 10729,08 |
| Spinosad | 0,0078 | 1757,72 |
| Fenurón | 0,0080 | 1630,64 |
| Imidacloprid | 0,0132 | 207,19 |
| Indoxacarb | 0,0062 | 171,61 |
| Metalaxil M | 0,0072 | 1104,23 |
| Metoxifenozida | 0,0074 | 327,56 |
Fuente: elaboración de los autores
Fue posible establecer el LOQ para sustancias en el nivel de fortificación validado, ya que tenían una relación señal / ruido superior a 10.
PRECISIÓN (TASA DE RECUPERACIÓN) Y PRECISIÓN (REPETIBILIDAD)
Para el estudio de la tasa de recuperación y repetibilidad se fortificó la muestra de suelo A1BR05 con diferentes volúmenes de la solución madre de fortificación, componiendo una mezcla de los plaguicidas de interés, en cinco repeticiones, luego de la extracción se retiró el volumen de 1 mL y se diluyó 1: 1 con metanol (MeOH) para análisis cromatográfico adicional por UHPLC-MS / MS. Esta concentración de fortificación corresponde a la concentración teórica de LQ. Cada réplica se inyectó dos veces.
Concentraciones de inyección:
– Nivel 1: 0,00323 µg / mL, que corresponde a 0,0067 mg / kg,
– Nivel 2: 0,00625 µg / mL, que corresponde a 0,0133 mg / kg,
Los resultados obtenidos de la precisión – recuperación se describen en la Tabla 5.
Tabla 5 – Resultados obtenidos de precisión – Recuperación
| Sustancia | VALIDACIÓN DE LA CURVA ANALÍTICA | ||||
| Nivel 1 | Nivel 2 | ||||
| Conclusión. (mg kg-1) | Rec. (%) | Conclusión. mg kg-1) | Rec. (%) | ||
| Azoxistrobina | 0,0066 | 95,4 | 0,0142 | 106,3 | |
| Boscalida | 0,0076 | 111,5 | 0,0149 | 110,5 | |
| Carbendazim | 0,0055 | 80,4 | 0,0125 | 94,2 | |
| Clorantraniliprol | 0,0075 | 109 | 0,0153 | 114 | |
| Clotianidina | 0,0062 | 92,1 | 0,0146 | 109,9 | |
| Diafentiurón | 0,0038 | 53,7 | 0,0042 | 32,5 | |
| Difenoconazol | 0,0077 | 112,2 | 0,0148 | 111 | |
| Dimetomorfe | 0,0072 | 105,4 | 0,015 | 111,5 | |
| Espinetoram | 0,0074 | 103,5 | 0,0149 | 111,5 | |
| Spinosad | 0,0078 | 114,4 | 0,0159 | 118,9 | |
| Fenurón | 0,008 | 115,9 | 0,016 | 119,4 | |
| Imidacloprid | 0,0063 | 92,1 | 0,0143 | 106,4 | |
| Indoxacarb | 0,0062 | 90,3 | 0,0135 | 101 | |
| Metalaxyl M | 0,0072 | 105,1 | 0,0155 | 116,6 | |
| Metoxifenozida | 0,006 | 88,1 | 0,0146 | 109,6 | |
Fuente: elaboración de los autores
Los resultados de recuperación están dentro del rango aceptable (70-120%). El método mostró una buena repetibilidad para la mayoría de los compuestos estudiados, con valores de RSD por debajo del 20%.
Todos los compuestos estudiados cumplieron con los criterios recomendados por la European Comission (2018), excepto el plaguicida Diafentiuron, porque no proporcionó una recuperación en el rango aceptable (70% a 120%) en ninguno de los niveles, lo que imposibilitó su validación.
Después de la validación, el método se utilizó para la determinación cuantitativa del contenido de plaguicida en muestras de suelo recolectadas en las regiones donde se plantan los tomates. Los resultados obtenidos se grafican en la Tabla 6 a continuación:
Tabla 6 – Resumen de los resultados de las muestras reales de suelo recolectadas en las áreas de plantación de tomate (mg / kg de suelo)
| Pesticida | P1 | P2 | P3 | P4 | P5 | P6 | P7 |
| 1. Azoxistrobina | 0,003 | 0,0025 | 0,009 | 0,06 | |||
| 3. Boscalida | Huellas | ||||||
| 4. Carbendazim | 0,0065 | 0,0085 | |||||
| 5. Clomazona * | |||||||
| 6. Cloranthraniliprol | 0,036 | X | 0,071 | 0,223 | |||
| 7. Clotianidina | 0,027 | X | 0,0185 | ||||
| 8. Diafentiurón | 0,0255 | X | |||||
| 9. Difenoconazol | 0,003 | 0,038 | 0,0285 | ||||
| 10. Dimetomorfe | 0,0105 | 0,48 | 0,096 | 0,0275 | |||
| 11. Espinetoram | X | X | |||||
| 12. Spinosad A | 0,002 | ||||||
| 13. Spinosad D | X | X | |||||
| 14. Fenurón | X | Huellas | X | Huellas | X | X | |
| 15. Imidacloprid | X | Huellas | 0,008 | 0,006 | |||
| 16. Indoxacarb | 0,0235 | 0,0015 | |||||
| 17. Metalaxyl M | Huellas | Huellas | 0,0085 | 0,024 | 0,001 | ||
| 18. Metoxifenozida | 0,1415 | 0,0105 | |||||
| 19. Tiametoxam | 0,0315 | 0,0225 | 0,0255 |
Nota: P1 a P6 (Áreas de plantación de tomate) Fuente: Elaboración propia.
Los residuos de plaguicidas se encontraron en la Tabla 6. El plaguicida fenuron se encontró en todas las muestras de suelo, excepto en las áreas P1 y P2. Este plaguicida es uno de los excluidos o no registrados en Brasil, como se muestra en la tabla 7. Sin embargo, las concentraciones de este compuesto encontradas en las muestras se clasificaron como rasgos, es decir, por debajo del límite de detección por el método analítico.
En cuanto a los plaguicidas azoxitrobin y carbendazim, la situación en las áreas 6 y 7 es preocupante, especialmente porque estos plaguicidas no están autorizados por ANVISA para su aplicación en la siembra de tomate, como se muestra en el Cuadro 7.
Tabla 7 – Concentraciones de plaguicidas NO AUTORIZADOS para aplicación a tomates encontrados en los suelos analizados
| Pesticida | P6 | P7 | ||||
| 5-10 | 10-20 | 10-20 | 0-5 | 5-10 | 10-20 | |
| 1. Azoxistrobina | 0,0090 | 0,0035 | 0,006 | 0,060 | 0,012 | 0,003 |
| 2. Carbendazim | 0,0065 | 0,0065 | 0,0045 | 0,0085 | 0,003 | 0,002 |
Fuente: elaboración de los autores
El método multirresiduo optimizado demostró ser selectivo y preciso en el rango estudiado, permitiendo el análisis simultáneo de las sustancias: Azoxistrobina, Boscalida, Carbendazima, Clorantraniliprol, Clotianidina, Difenoconazol, Dimetomorfe, Espinetoram, Espinosada A, Espinosada D, Fenurón, Inidaclopróxido , Indalaxide M, Methoxyfenozide, Tiametoxan, con sus respectivos límites de cuantificación (LOQ), incluidos en el programa oficial de monitoreo de tomate brasileño, como se muestra en la Tabla 8
Tabla 8 – LOQS para plaguicidas-enfoque: µg kg-1
| Pesticida | LOQ (µg kg-1) |
| Azoxistrobina | 7,0 |
| Boscalida | 7,0 |
| Carbendazim | 5,0 |
| Clorantraniliprol | 7,0 |
| Clotianidina | 7,0 |
| Diafentiurón | 7,0 |
| Difenoconazol | 7,0 |
| Dimetomorfe | 7,0 |
| Espinetoram | 7,0 |
| Spinosad | 7,0 |
| Fenurón | 7,0 |
| Imidacloprid | 13,0 |
| Indoxacarb | 7,0 |
| Metalaxyl M | 7,0 |
| Metoxifenozida | 7,0 |
Fuente: elaboración de los autoresPesticida
CONSIDERACIONES FINALES
El método QuEChERS, con alteraciones menores, fue adecuado para la extracción multirresiduo de los analitos en suelos de la siembra de, con extractos claros y libres de interferencias. La cromatografía líquida de ultra resolución acoplada a la espectrometría de masas secuencial (UPLC-MS / MS) fue adecuada para la detección y cuantificación de estos analitos en la matriz, con valores de recuperación entre 70 y 120% de desviación estándar inferior al 20%, límites de cuantificación entre 7 y 13 µg.L-1 y límites de cuantificación entre 2 y 4 µg.L-1, adecuados para cumplir con la legislación vigente. Los resultados de la prueba de campo mostraron que el método es adecuado para el análisis cuantitativo de plaguicidas evaluados en suelos derivados de la siembra de tomate dentro del rango de trabajo.
El método validado está de acuerdo con los valores sugeridos en la literatura para el análisis de residuos de plaguicidas por métodos cromatográficos (EUROPEAN COMISSION, 2018). La determinación de los plaguicidas en estudio por UHPLC-MS / MS fue satisfactoria, permitiendo la realización de un análisis cualitativo, obtenido a partir de fragmentos de masa característicos de cada analito, y cuantitativo, a través del modo de adquisición MRM. Las condiciones cromatográficas optimizadas para la determinación por UHPLC-MS / MS permitieron la identificación y cuantificación de los compuestos en estudio, en un tiempo de análisis menor a 15 min, lo que aporta una gran ganancia como herramienta analítica y para la sociedad en su conjunto.
En general, todas las muestras mostraron concentraciones de plaguicidas permitidas por las monografías de ANVISA. Sin embargo, los resultados obtenidos para la siembra convencional, a pesar de estar dentro de las conformidades requeridas, son superiores a los valores obtenidos para las plantaciones del sistema sustentable y orgánico. Sin embargo, sirve como alerta de la presencia de pesticidas en la mesa de la sociedad.
El uso de pesticidas Azoxystrobin y Carbendazim (pesticidas no autorizados) para su aplicación en tomates genera una preocupación concreta con algo que normalmente se esperaba, el uso deliberado de pesticidas para aumentar la producción, independientemente de lo que recomienden las leyes.
Si por un lado es preocupante encontrar plaguicidas no autorizados en las muestras, por otro lado, esto demuestra que el método validado por este trabajo es altamente efectivo, debido a la capacidad de cuantificar incluso plaguicidas no autorizados para su uso.
Además de lograr resultados bastante satisfactorios para el enfoque de plaguicidas, este trabajo demostró ser capaz de determinar residuos de 240 plaguicidas, entre autorizados y no autorizados por ANVISA en Brasil, con valores de coeficiente de determinación superiores a 0,99; Valores de LOQ de 13 µg kg-1 para Spinosad y 7,0 µg kg-1 para los demás plaguicidas. El método mostró buena precisión, con valores de RSD <20%, y exactitud, con recuperaciones entre 70 y 120% para la gran mayoría de los compuestos analizados.
REFERENCIAS
AZEVEDO, E. de – Alimentos Orgânicos: ampliando conceitos de saúde humana, ambiental e social, Livros G.Play, 2018.
ANASTASSIADES M, Lehothay S.J, Stajnbaher D, Schenck F.J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residue in produce. J. AOAC Int. 86: 412-431, 2003.
ANVISA – Agência Nacional de Vigilância Sanitária. Disponível em: <http://portal.anvisa.gov.br> 2014. Acesso em: 11 de outubro de 2018.
ANVISA – NOTA TÉCNICA 02/2017 – Posicionamento da Anvisa referente à Recomendação 028/2016 aprovada em Reunião Plenária do Conselho, 2017
CARDOSO, Maria Helena Wohlers Morelli; GOUVÊA, Adherlene Vieira; NÓBREGA, Armi Wanderley da; ABRANTES, Shirley de Mello Pereira – Validação de método para determinação de resíduos de agrotóxicos em tomate: uma experiência laboratorial – Ciência e Tecnologia de Alimentos, Campinas, 30 (Supl.1): 63-72, maio 2010.
CARVALHO, C.R.F., PONCIANO N.J.; SOUZA P.M. de. – Viabilidade econômica e de risco da produção de tomate no município de Cambuci/RJ, – Ciência Rural, Brasil, 2014.
CETESB (Companhia Ambiental do Estado de São Paulo) – Qualidade do solo, 2020. Disponível em: https://cetesb.sp.gov.br/solo/poluicao/ – Acessado em 09/2020.
COMMISSION DECISION No. 657/2002. Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. Off. J. Eur. Commun. L 221: 8-36.
COMMISSION REGULATION (E.C). No. 1881/2006. Setting maximum levels for certain contaminants in foodstuffs. Off. J. Eur. Commun. L364: 5-24.
CONAMA – Resolução nº 420/2009 – Disposição sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e suas providências. Disponível em: < http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=620> Acesso em: 02 jan. 2019.
CURRENCE, T.M. Tomato breeding. I. Species, origin and botanical characters. Handbuch der Pflanzenzuchtung, p. 351-369, 2013.
DIEZ, C.; TRAAG, W. A.; ZOMMER, P.; MARINERO, P.; ATIENZA, J.; J. – Extraction and chromatographic analysis of the cadusafós nematicide, chromatography, 1131, 1135 – 2006.
DONG, H.; XIAO, K. – Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce – Food Chemistry, Volume 229, Pages 502-508 – Elsevier, 2017.
DROŻDŻYŃSKI, D.; KOWALSKA, J. – Rapid analysis of organic farming insecticides in soil and produce using ultra-performance liquid chromatography/tandem mass spectrometry, Springer, Talanta, 2009.
DROŻDŻYŃSKI , D.; WALORCZYK, S.; GNUSOWSKI , B – Multiresidue determination of 160 pesticides in wines employing mixed-mode dispersive-solid phase extraction and gas chromatography–tandem mass spectrometry, Volume 85, Issue 4, Talanta – Elsevier, Pages 1856-1870, 2011.
ESALQ – Simpósio de defensivos agrícolas: tópicos relevantes e principais desafios, ESALQ / 2017
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2017.
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2018.
EMBRAPA – Manual de Procedimentos de Coleta de Amostras em Áreas Agrícolas para Análise da Qualidade Ambiental: Solo, Água e Sedimentos, 2016.
EPA (Environmental Protection Agency) – Pesticide safety for farmworkers, 2017.
FAOSTAT – Food and Agriculture Organization of the United Nations – Produtividade Mundial, 2018. Disponível em: <http://faostat.fao.org/site/340/default.aspx>. Acesso em. 28 de novembro de 2019.
FERNANDES V.C, LEHOTAY S.J, GEIS-ASTEGGIANTE L, KWON H, Mol H.G.J, van der Kamp H, MATEUS N, DOMINGUES V.F, DELERUE-Matos, C. Analysis of pesticides residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two dimensional GC-time-of-flight MS comparing organic and integrated pest management farming. Food Addit Contam. 31: 262-270, 2014.
IARC. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. WHO. World Health Organization. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 82: 183-193, 2002.
IBAMA-Ministério do Meio Ambiente: Avaliação do Potencial de Periculosidade Ambiental (PPA) de Agrotóxicos e Afins. Disponível em: Acesso em: abr. 2020.
IBGE – Indicadores / Estatística da Produção Agrícola Levantamento Sistemático da Produção Agrícola 2017-2018, 2019.
IGLESIAS, Hoshi A. – Introdução ao Acoplamento Cromatografia Líquida – Espectrometria de Massas Waters Technologies do Brasil, Barueri, SP, 2016.
INMETRO. Instituto Nacional de Metrologia, Qualidade e Tecnologia. Orientação sobre Validação de Métodos Analíticos – DOQ-CGCRE-008. Rev. 07, 28 f, jul 2018.
JUNIOR, J.C.L, – Manejo integrado de pragas na cultura do tomate: uma estratégia para a redução do uso de agrotóxicos – Extensão em Foco (ISSN: 2317-9791), 2019.
LESUEUR, A. B; KNITTL P. A ; GARTNER, M. A; MENTLER A. C, FUERHACKER M.B.- Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuECheRS method – Science Direct, 2008.
MALDANER L, JARDIM ICSF. O estado da arte da cromatografia líquida de ultraeficiência [The art state of ultra performance liquid chromatography]. Quim Nova. 32: 214-222. Portuguese, 2009.
OGIHARA, Camila Honda – Desenvolvimento e validação de método para a determinação de multirresíduos de agrotóxicos em solo empregando o método quechers e a cromatografia líquida de ultra alta eficiência acoplada à espectrometria de massas sequencial – UNICAMP, 2018.
ORTELLI, D; COGNARD, E; JAN, P; EDDER, P. Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry and Chromatography. 877: 2363–2374, 2009.
PINTO, C.G., Martín, S.H., PAVÓN, J.L.P., CORDERO, B.M., A simplified Quick, Easy, Cheap, Effective, Rugged and Safe approach for the determination of trihalomethanes and benzene, toluene, ethylbenzene and xylenes in soil matrices by fast gas chromatography with mass spectrometry detection. Anal. Chim. Acta, 689, 129-136, 2011.
PRESTES, O.D. ; Friggi, C.A.; ADAIME M.B, ZANELLA, R. QuECheRS – QuEChERS-a modern method of sample preparation for multiresidue determination of pesticides in food by chromatographic methods coupled to mass spectrometry]. Quim Nova. 32: 1620-1634. Portuguese, 2009.
RAMOS, A. M. et al. Evaluation of a modified QuEChERS method for the extraction of pesticides from agricultural, ornamental and forestal soils. Analytical and Bioanalytical Chemistry, v. 396, p. 2307-2319, 2016.
RASHID A., NAWAZ S., BARKER H., AHMAD I., AND ASHRAF M., Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry. J. Chromatogr. A, 2010, 1217, 2933-2939
RIBAS, P. P.; MATSUMURA, A. T. S. A química dos agrotóxicos: impacto sobre a saúde e meio ambiente. Revista Liberato, 2009, 10, 14, 149-158.
RUBENSAM G, Barreto F, HOFF RB, KIST TL, PIZZOLATTO, TM. A liquid–liquid extraction procedure followed by a low temperature purification step for the analysis of macrocyclic lactones in milk by liquid chromatography–tandem mass spectrometry and fluorescence detection. Anal Chim Acta. 705:24-29, 2011.
SOBER – Revista de Economia e Sociologia Rural (RESR) – Relatório – 1º Trimestre 2019, MAPA, Brasil, 2019
TSIPI, D.; BOTITSI, H.; ECONOMOU, A. Mass Spectrometry for the Analysis of Pesticide Residues and their Metabolites. New Jersey: John Wiley & Sons, 2015.
VEIGA, Denise Piccirillo – O impacto do uso do solo na contaminação por agrotóxicos das águas superficiais de abastecimento público – USP, São Paulo, 2017
APÉNDICE – REFERENCIAS DE LAS NOTAS AL PIE
8. El tizón tardío, causado por Phytophthora infestans, es una enfermedad muy agresiva en el cultivo del tomate, capaz de diezmar cultivos enteros en un corto período de tiempo.
9. Parámetro agronómico establecido por ANVISA respecto a la recomendación 028/2016 aprobada por el Consejo Nacional de Seguridad Alimentaria y Nutricional (CONSEA) – constituye uno de los componentes para el cálculo de exposición y evaluación de riesgo, requisito previo para el registro o autorización de un plaguicida en nuevos cultivos.
[1] Doctorado en Ciencias e Ingeniería Ambiental por la Universidad Federal de Rio de Janeiro/Escuela Politécnica de Química/Programa de Ingeniería Ambiental (UFRJ/POLI/PEA); Maestría en Ciencias e Ingeniería Ambiental de la Universidad Federal de Rio de Janeiro/Escuela Politécnica de Química/Programa de Ingeniería Ambiental (UFRJ/POLI/PEA); Especialización en Enseñanza de la Química (FIJ); Licenciado en Química por la Universidad del Estado de Río de Janeiro (UERJ).
[2] Tutor. Doctor en Ingeniería por el Programa de Ingeniería de Minas, Metalúrgicas y Materiales de la Universidad Federal de Rio Grande do Sul.
[3] Tutor. Doctorado en Ingeniería Oceánica por Coppe / UFRJ; Profesor Asociado de la Escuela Politécnica de la Universidad Federal de Río de Janeiro y Pro-Rector de Estudios de Grado de la UFRJ.
[4] Tutor. Doctorado en Ciencias por el Centro de Energía Nuclear en Agricultura / CENA – de la Universidad de São Paulo.
[5] Máster en vigilancia de la salud en salud (FIOCRUZ / INCQS).
[6] Doctorado en vigilancia de la salud en salud (FIOCRUZ / INCQS).
[7] Doctorado en vigilancia de la salud en salud (FIOCRUZ / INCQS).
Recibido: Diciembre de 2020.
Aprobado: Enero de 2021.