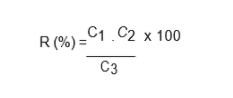ARTICOLO ORIGINALE
MAZZEI, João Roberto Fortes [1], FREIRE, Estevão [2], SERRA, Eduardo Gonçalves [3], MACEDO, José Ronaldo de [4], OLIVEIRA, Angélica Castanheira de [5], BASTOS, Lucia Helena Pinto [6], CARDOSO, Maria Helena Wohlers Morelli [7]
MAZZEI, João Roberto Fortes. Et al. Metodo multiresiduo per l’analisi di 240 pesticidi nei terreni di piantagioni di pomodori mediante cromatografia liquida ad alte prestazioni accoppiata alla spettrometria di massa. Revista Científica Multidisciplinar Núcleo do Conhecimento. Anno 06, Ed. 01, Vol.08, pagg. 34-67. Gennaio 2021. ISSN: 2448-0959, Link di accesso: https://www.nucleodoconhecimento.com.br/ingegneria-ambientale-it/metodo-multiresiduo, DOI: 10.32749/nucleodoconhecimento.com.br/ingegneria-ambientale-it/metodo-multiresiduo
ASTRATTO
In questo lavoro è stato ottimizzato un metodo analitico per la determinazione dei residui per il focus dei pesticidi: Azoxystrobin, Boscalide, Carbendazim, Chloranthranilprole, Clothianidin, Diafentiuron, Difenoconazole, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenylurozenoide, Metalaxy , Tiametossano nel terreno derivato dalla piantagione di pomodori, al fine di confrontare i livelli di contaminazione di questi composti nei campioni di terreno. Sono stati utilizzati il metodo di estrazione QuEChERS modificato e la cromatografia liquida Ultra Performance accoppiata con la spettrometria di massa sequenziale, con sorgente di ionizzazione mediante elettronebulizzazione in modalità ESI (+/-). Il metodo consisteva nell’estrazione di 15,0 g di terreno con 15 ml di soluzione satura di idrossido di calcio pH 12,3 e 15 ml di acetonitrile, con conseguente ripartizione dell’effetto “salatura” attraverso 6,0 g di solfato di magnesio anidro e 1,5 g di cloruro di sodio . Le fasi sono state separate mediante centrifugazione a 3700 rpm per 7 min. Gli estratti sono stati diluiti con MeOH grado licrossolv® e iniettati in un cromatografo. Il metodo è stato convalidato in base ai parametri di linearità, LOD, LOQ, precisione e accuratezza. Linearità tra 0,2 e 20,0 µg L-1, coefficienti di determinazione maggiori di 0,99. I valori LOQ per il metodo erano 13 µg kg-1 per Spinosad e 7,0 µg kg-1 per gli altri pesticidi. Il metodo ha mostrato una buona precisione, con valori RSD <20%, e accuratezza, con recuperi tra il 70 e il 120% per la stragrande maggioranza dei composti analizzati. Le curve analitiche sono state preparate con estratti di terra bianca di riferimento, al fine di minimizzare l’effetto Matrix. Il metodo è stato ritenuto idoneo per l’analisi dei residui di pesticidi nel suolo, poiché soddisfa i parametri di validazione dei metodi cromatografici (European Comission, 2018). Dopo la convalida, il metodo è stato utilizzato per analizzare i residui di questi pesticidi in campioni di suolo provenienti da piantagioni di pomodori convenzionali, organiche e sostenibili. Rendere possibile confrontare i livelli di impatti ambientali generati. Oltre a convalidare il metodo analitico per i pesticidi-focus dello studio, è stato anche possibile convalidare 240 composti in più, tra autorizzati e non autorizzati per l’uso nella piantagione di pomodori.
Parole chiave: contaminanti nel suolo, residui di pesticidi, QuEChERS, UPLC-MS / MS.
INTRODUZIONE
La coltivazione del pomodoro è suscettibile alla comparsa di insetti nocivi e malattie. I dati della ricerca di Carvalho (2017) citano che la coltivazione del pomodoro è vulnerabile all’attacco di malattie causate da insetti nocivi, essendo la mosca bianca (Bemisia), uno dei principali parassiti che colpiscono i pomodori. Bemisia argentifolii e Bemisia tabaci, sono le due principali specie di mosca bianca responsabili dei danni alla coltivazione del frutto. Nel lavoro dell’autore sono stati intervistati i coltivatori di pomodori del comune di Cambuci (Rio de Janeiro), in cui è stato osservato che circa il 60% dei piantatori esegue fino a due applicazioni di pesticidi a settimana. Nel 2% dei casi i piantatori hanno descritto che, a seconda della situazione, come ad esempio: se insorgono malattie o il tempo è piovoso, c’è bisogno di un numero maggiore di applicazioni, che può arrivare a tre volte a settimana.
Morfologicamente, non c’è differenza tra le due specie. Il primo è però più aggressivo, poiché, oltre ad essere più resistente alle condizioni ambientali avverse e ad alcuni pesticidi convenzionali, ha un più alto tasso di riproduzione, colpisce un maggior numero di piante ospiti e riesce a completare il suo intero ciclo di vita nel pomodoro. Per questo motivo, è necessario utilizzare vari pesticidi per controllare questi e altri parassiti che colpiscono le piantagioni di pomodori (ESALQ, 2017).
In questo lavoro si è deciso di utilizzare la terminologia guidata dalla legislazione brasiliana – pesticidi – considerando che questo termine, pur non coprendo essenzialmente tutti i prodotti utiliz
zati, racchiude il maggior numero di attributi necessari per descrivere le sostanze che compongono questo universo e aggiunge più trasparenza ed etica per il lettore, l’utente e il consumatore dei prodotti in cui vengono utilizzati tali composti (SOBER, 2018).
Secondo la revisione della legislazione brasiliana sui pesticidi pubblicata il 28/06/2018 (MAPA, 2018):
Il termine pesticida non viene utilizzato da nessun altro paese o organizzazione internazionale che si occupa dell’argomento. La Commissione del Codex Alimentarius, l’organizzazione internazionale di riferimento per gli alimenti nell’accordo dell’Organizzazione mondiale del commercio (OMC) sull’applicazione di misure sanitarie e fitosanitarie, utilizza il termine inglese e francese “agrotossico” e lo spagnolo “plaguicida”. Pertanto, è necessario cambiare il termine pesticida in pesticida, al fine di allineare la legislazione brasiliana con le pratiche internazionali.
Il pomodoro è stato scelto come oggetto di questo studio per le sue caratteristiche specifiche, ovvero piantagioni come il pomodoro (Solanum lycopersicum L. = Lycopersicon esculentum Mill), richiedono frequenti attenzioni per quanto riguarda l’infestazione di parassiti ed erbe infestanti, il che implica la necessità di applicare pesticidi con grande frequenza.
A contatto con il suolo, i pesticidi sono soggetti a processi chimico-fisici che ne peggiorano l’azione nell’ambiente. A causa della necessità di un uso razionale degli input agricoli per ridurre al minimo gli impatti ambientali dell’agricoltura, sono stati effettuati molti studi con l’obiettivo di comprendere il comportamento di questi prodotti nel suolo. Tuttavia, si sa poco sul comportamento di questi pesticidi nei terreni tropicali.
CONTAMINAZIONE DEI SUOLI DA AGROTOXIC
Secondo gli studi di Azevedo (2018), anche con un maggior controllo dell’applicazione dei pesticidi, il suolo è la destinazione finale dei prodotti chimici utilizzati in agricoltura, siano essi applicati direttamente al suolo, alla parte aerea delle piante o anche ai frutti insaccati. A contatto con il suolo, i pesticidi e gli erbicidi sono soggetti a processi chimico-fisici che ne aumentano l’azione nell’ambiente. Secondo l’autore, a causa della necessità di un uso razionale degli input agricoli per ridurre al minimo gli impatti ambientali dell’agricoltura, molti studi sono stati effettuati con l’obiettivo di comprendere il comportamento di questi prodotti nel suolo.
Il terreno funge da filtro, trattenendo molte delle impurità che vi vengono versate. In questo modo la sua qualità può essere alterata dall’accumulo di inquinanti atmosferici, dall’uso di pesticidi / fertilizzanti, rifiuti solidi, materiali tossici e anche radioattivi. Quando l’inquinante raggiunge la superficie del suolo, può essere adsorbito; trasportate dal vento o dalle acque di ruscellamento, o anche lisciviate da acque di infiltrazione, raggiungendo gli orizzonti inferiori e raggiungendo la falda freatica. Una volta raggiunta la falda acquifera, questi contaminanti possono essere portati in altre regioni (CETESB, 2020).
Il provvedimento CONAMA (2009) informa che le proprietà chimiche del suolo, come il pH, il contenuto di nutrienti, la capacità di scambio ionico, la conduttività elettrica e la materia organica, insieme alle attività biologiche, sono responsabili dell’adsorbimento, della fissazione chimica, dell’ossidazione e della neutralizzazione di questi inquinanti.
PESTICIDI E COLTURA DEL POMODORO
Il pomodoro è un frutto originario dell’America del Sud. I dati storici indicano che per più di 100 anni il pomodoro era già coltivato dagli Incas e dagli Aztechi nelle alte regioni del Perù e del Messico. I primi paesi a coltivare il prodotto sono stati Perù, Messico, Bolivia, Ecuador e Cile, secondo (CURRENCE, 2013). I maggiori produttori mondiali di pomodori oggi sono: Cina, Brasile, Stati Uniti, India, Turchia, Egitto, Italia, Iran, Spagna e Messico, secondo il rapporto FAOSTAT (2018).
I dati IBGE (EPAG, 2019), mostrano che il Brasile ha prodotto 4.084.910 tonnellate nel 2018 e che, a gennaio 2019, la produzione è stata di 4.333.609 tonnellate di frutta. Le regioni di maggiore produzione nel 2018 sono state: sud-est con 1.689.558 tonnellate (San Paolo ha prodotto 811.100 tonnellate) e centro-ovest, con 1.369.014 tonnellate (Goiás ha prodotto 1.334.500 tonnellate).
Per Junior (2019), non esiste un pomodoro resistente alla maggior parte dei parassiti e delle malattie. Per questo motivo, il modo più comune per controllare queste infestazioni continua ad essere l’applicazione di fungicidi e insetticidi, che provocano un rischio di contaminazione dei lavoratori coinvolti, residui di pesticidi nei frutti, impatti sull’ambiente e maggiori costi.
In Brasile, i riferimenti ANVISA (2018) autorizzano circa 500 principi attivi per l’agricoltura, la pulizia della casa, scopi non agricoli, ambienti acquatici e conservanti del legno. Di questa quantità, 119 pesticidi sono autorizzati per l’applicazione nella piantagione di pomodori. Lo stesso ingrediente attivo può essere commercializzato con l’etichettatura di molte formulazioni e nomi commerciali ed è comune una miscela contenente più di un ingrediente nello stesso prodotto.
Carvalho (2017), nella sua ricerca, menziona che i pesticidi vengono utilizzati nella piantagione di pomodori con l’obiettivo di combattere principalmente la mosca bianca, i funghi della peronospora [8], il gambo cavo, l’appassimento batterico, il minatore delle foglie, la trivellatrice della frutta di grandi dimensioni, la macchia nera , macchia batterica e piccola trivellatrice della frutta. Secondo questa ricerca, per combattere tali parassiti e malattie, sono necessarie diverse applicazioni di pesticidi. L’autore afferma che i produttori hanno fatto riferimento a 53 diversi marchi commerciali e una media di 12 tipi di pesticidi per coltura. Insetticidi e fungicidi sono i prodotti più utilizzati dall’agricoltore nella piantagione di pomodori, a causa di una malattia chiamata peronospora, secondo questa ricerca.
DESTINAZIONE DEI PESTICIDI NELL’AMBIENTE
L’utilizzo di pesticidi nella coltivazione convenzionale del pomodoro desta costanti preoccupazioni a causa dei danni causati all’ambiente, soprattutto negli ambienti biotici e abiotici. Inoltre, si osservano numerosi effetti tra i lavoratori sul campo: debolezza, nausea, vertigini, tumori, danni al fegato, allergie, tra gli altri. Pertanto, è molto importante analizzare i frutti, il suolo e l’acqua ai fini della quantificazione per verificare se sono entro i limiti massimi di residui (LMR[9]) autorizzati da Anvisa, secondo (RIBAS e MATSUMURA, 2009).
SVILUPPO
METODOLOGIA – LOCALI, IPOTESI E FASI DI LAVORO
PREMESSE
Questo lavoro è iniziato dalle seguenti premesse:
- Non esiste pomodoro resistente alla maggior parte dei parassiti e delle malattie;
- Il suolo è la destinazione finale di gran parte dei residui dall’applicazione dei pesticidi nei metodi di impianto in cui vengono applicati;
- È probabile la contaminazione del suolo dovuta all’applicazione di pesticidi nelle piantagioni agricole che possono generare impatti ambientali in ambienti biotici e abiotici;
IPOTESI
- I pesticidi in uso nell’agricoltura brasiliana non sono rispettosi dell’ambiente per quanto riguarda la contaminazione di frutta e suolo;
- L’impianto convenzionale con uso intensivo di pesticidi potrebbe non essere rispettoso dell’ambiente;
- C’è una lacuna in agricoltura, che è l’assenza di un metodo validato e affidabile per determinare e quantificare i pesticidi nel suolo, secondo i limiti massimi di residui (LMR) specificati da Anvisa;
- È possibile utilizzare pesticidi per la semina e mantenere il frutto a livelli di concentrazione che soddisfano i requisiti della legislazione in vigore nel paese;
La conoscenza dei residui e dei contaminanti nel suolo è importante per lo sviluppo di azioni volte a migliorare la manipolazione e il controllo nella produzione agricola per ridurre tali contaminanti.
FASI DI LAVORO
a) Conduzione della ricerca: applicazione di un questionario misto di risposte aperte e scelte multiple. Questa ricerca è stata applicata ai piantatori nelle aree dove sarebbero stati raccolti i campioni e ha permesso di rilevare i principali prodotti utilizzati nelle loro piantagioni. Questi pesticidi sono stati identificati come “Pesticides-Focus” del lavoro.
b) Raccolta di campioni di suolo in aree di tre tipi di coltivazione: convenzionale; biologico e sostenibile;
c) Raccolta di campioni di prova di riferimento in bianco – Campioni di terreni che non sono stati sottoposti ad alcun trattamento con i pesticidi di interesse in questo lavoro;
d) Caratterizzazione del suolo in termini di tessitura, fertilità e composizione chimica – Fase svolta in partnership nei laboratori EMBRAPA SOLOS-RJ;
e) Preparazione dei campioni per l’estrazione – i campioni devono avere una granulometria di 30 mesh (terra fine), adatta per l’estrazione chimica – fase eseguita nei laboratori EMBRAPA SOLOS-RJ;
f) Analisi di campioni di terreno reali raccolti in campo.
Questa fase è stata suddivisa in:
- Caratterizzazione del suolo – eseguita presso i laboratori EMBRAPA SOLOS;
- Determinazione della materia organica – Fase eseguita presso i Laboratori EMBRAPA SOLOS;
- Analisi chimica per la determinazione dei microelementi del suolo – Fase eseguita presso il Laboratorio FERTIMOVEL (EMBRAPA SOLOS);
- Estrazione, Clean-up, adeguatezza e ottimizzazione del Metodo QuEChERS per la determinazione dei residui di pesticidi in campioni di terreno, attraverso la Cromatografia Liquida Ultra-Risoluzione accoppiata alla Spettrometria di Massa Sequenziale – Fase eseguita presso i laboratori INCQS – FIOCRUZ.
g) Calcoli, valutazioni statistiche e plottaggio dei risultati ottenuti.
PESTICIDI SELEZIONATI PER LO STUDIO
Nella ricerca effettuata con le fioriere è stato osservato che i principali prodotti utilizzati nelle loro piantagioni erano: Abamectin, Acibenzolar-S-Methyl, Azoxystrobin, Ciromazine, Diafentiuron, Mandipropamida, Pimetrozina, Tiametoxan. Si è quindi deciso di adattare il metodo analitico, inizialmente, per la determinazione dei residui di questi “pesticidi-focus” nel suolo della coltivazione del pomodoro. La ricerca è stata condotta con piantatrici della regione fluminense settentrionale (Rio de Janeiro), grande produttore di pomodori distribuito tra i tre sistemi di coltivazione studiati in questo lavoro (convenzionale, biologico e sostenibile).
IL METODO DI ESTRAZIONE (QUECHERS)
Il metodo di estrazione QuEChERS (dall’inglese Quick, Easy, Cheap, Effective, Rugged and Safe) studiato e presentato alla comunità scientifica da ANASTASSIADES et al. (2003), mira ad eliminare i limiti pratici dei metodi di estrazione multi-rifiuti che esistevano fino ad allora. Il metodo ha come principali differenziali, il fatto di essere veloce, facile, economico, efficace, robusto e sicuro, come abbrevia il nome QuEChERS. Diéz et al. (2006) sottolineano che questo metodo è stato sviluppato per campioni che contengono più del 75% di acqua.
INDAGINE BIBLIOGRAFICA SUL METODO QUECHERS ALLEATO ALLA CROMATOGRAFIA PER LA DETERMINAZIONE DEI PESTICIDI – EVOLUZIONE CRONOLOGICA
Lesueur et al. (2008) hanno studiato le modifiche a QuEChERS nell’analisi di 105 pesticidi mediante gascromatografia accoppiata a spettrometro di massa (CG-EM) e 46 pesticidi mediante cromatografia liquida ultra performante accoppiata alla spettrometria di massa sequenziale (CLUE-EM / EM) dopo l’estrazione con il metodo QuECheRS in quattro matrici (uva, limone, cipolla e pomodoro).
Drożdżyński et al. (2009) hanno ricercato 3 insetticidi ecologici (azadiractina, spinosad e rotenone) in campioni di terreno, cavoli e pomodori utilizzando il metodo QuEChERS modificato, con successiva determinazione dei livelli mediante CLUE-EM / EM.
Chen et al. (2010) hanno eseguito una modifica del metodo QuEChERS per determinare il procimidone in campioni di terreno e porro, completando il lavoro attraverso la quantificazione mediante GC-MS.
Rashid et al. (2010) hanno analizzato 19 pesticidi del gruppo degli organoclorurati nel suolo, applicando un metodo QuEChERS modificato e di pulizia consistente in una partizione liquido-liquido con n-esano. La procedura è stata convalidata per la determinazione di 19 pesticidi organoclorurati, esaclorobenzene (HCB), α-HCH, β-HCH, γ-HCH, eptaclor, eptacloro epossido (trans), aldrin, dieldrin, clordano (trans), clordano (cis) , ossiclordano, α-endosulfan, β-endosulfan, endosulfan solfato, endrin, p, p’-DDT, o, p’-DDT, p, p’-DDD ep, p’-DDE.
Shi et al. (2010) hanno proposto un metodo QuEChERS modificato per l’analisi dei residui di oxadiargil in campioni di suolo, acqua, riso e paglia di riso, con quantificazione mediante GC-ECD.
Pinto et al., (2010) hanno ricercato una versione ancora più semplificata del metodo QuEChERS per analizzare tre composti organo-clorurati (esaclorobenzene; 1,2-diclorobenzene e cloroformio) in campioni di terreno, seguita dalla quantificazione mediante GC-µECD. Nel lavoro, gli autori hanno utilizzato tre diversi tipi di terreno: terreno da giardino, con un alto grado di sostanza organica; un Vertisol, con un alto contenuto di argilla; e un materiale sedimentario di riferimento certificato (terreno argilloso).
Martins (2010) ha utilizzato il metodo QuEChERS – determinazione dei residui di pesticidi nel terreno coltivato a riso irrigato, utilizzando quecher modificati con soluzione satura di idrossido di calcio e LC-MS / MS per la determinazione dei residui di Clomazona, Fipronil, Imazapique, Imazetapyr, Propiconazolo, Thiametoxam e Trifloxystrobin.
Ramos et al. (2010) hanno sviluppato un metodo QuEChERS modificato per la determinazione di 11 pesticidi in tre tipi di suolo (forestale, ornamentale e agricolo). È stata sviluppata una versione modificata del metodo QuEChERS per la determinazione dei pesticidi organofosfati (etoprofos, dimetoato, diazinon, malaoxon, clorpirifos-metile, fenitrion, malation, clorpirifos, fenamifos e fosmet) e un pesticida della classe dei tiadiazina (buprofezina) di GC-NPD.
Drożdżyński et al. (2011), hanno determinato 160 pesticidi nei vini utilizzando l’estrazione in fase solida dispersa in modalità mista e CG-EM.
Costa (2012) ha condotto uno studio del metodo QuEChERS per la determinazione multiresiduo di pesticidi nelle pesche sciroppate. I LOQ dei pesticidi in questo studio variavano tra 1,0 e 10,0 μg.kg-1 e si basavano sulla curva per monitorare le prestazioni del metodo e la linearità. Secondo l’autore, le curve analitiche hanno mostrato valori di r maggiori di 0,99; con valori di recupero per le pesche sgocciolate compresi tra 83,4 e 120,4% con RSD inferiore al 14,9% per la maggior parte degli analiti e tra 68,6 e 124,6% con RSD inferiore al 19,8%.
Studi di Tsipi et al., (2015) affrontano la quantificazione dei residui dei metaboliti 2,4-D, mediante cromatografie liquide e gassose accoppiate allo spettrometro di massa.
Ramos et al. (2016) citano che il metodo QuEChERS è stato utilizzato solo 8 volte nell’estrazione di pesticidi nel suolo e che nella maggior parte dei casi è stata applicata la gascromatografia con spettrometria di massa (CG-EM), tranne in tre casi, in cui la gascromatografia con Sono stati applicati rivelatori a cattura di elettroni (CG-DCE); Azoto e fosforo (CG-DNF) e Micro Electron Capture Detection (CG-DμCE).
Dong et al. (2017) hanno determinato i residui di metaflumizone in campioni di terreno e cavolo, applicando il metodo QuEChERS. Gli autori riferiscono che sono stati ottenuti valori di recupero compresi tra il 77,6 e l’87,9% per metaflumizone nel suolo e nel cavolo cappuccio, con una deviazione standard relativa (RSD) del 3,5 e del 7,9%. I valori LOD e LOQ del metodo per gli stessi campioni erano rispettivamente 0,001 mg.kg-1 e 0,004 mg.kg-1.
Secondo Iglesias (2016), il processo di accoppiamento della cromatografia liquida alla spettrometria di massa è avvenuto molto lentamente, a causa dell’incompatibilità tra le elevate velocità di flusso utilizzate nella parte HPLC, che ha reso difficile trasportare l’eluente della colonna cromatografica direttamente nella sorgente di lo spettrometro., che funziona in alto vuoto. Dopo aver risolto queste difficoltà, la cromatografia liquida con interfaccia di accoppiamento per spettrometria di massa (LC-MS) è stata sempre più utilizzata come tecnica eccellente per la determinazione di vari residui di analiti.
Ogihara (2018), ha utilizzato il metodo QuEChERS e la cromatografia liquida ultra efficiente abbinata alla spettrometria di massa sequenziale nella determinazione di pesticidi multiresidui nel suolo. Nel loro lavoro, le tre versioni del metodo QuEChERS, “Original”, “Acetate” buffer e “Citrate” buffer, sono state valutate in assenza e presenza della fase di clean up nell’estrazione di pesticidi dal suolo e UHPLC- MS / MS con aggiunta di standard interno di trifenilfosfato nella loro quantificazione e conferma. Il metodo sviluppato mirava a correlare alcune proprietà fisiche e chimiche di 20 pesticidi selezionati dall’autore con il rispettivo tempo per dissiparli nell’ambiente in presenza e in assenza di luce.
Tutte queste ricerche sono finite nella conclusione che i metodi classici per la determinazione dei pesticidi nei suoli non sono economici, in quanto sono procedure che richiedono molti passaggi, generalmente basati sull’estrazione esaustiva della matrice, con successive fasi di pulizia -up per la rimozione dei materiali coestratti, prima dell’analisi strumentale.
SCELTA DEI CAMPIONI PER LA FASE DI CONVALIDA
I campioni utilizzati per la fase di validazione erano quelli di terra bianca che non erano stati sottoposti ad alcun trattamento con pesticidi prima e durante la semina. Dopo la determinazione cromatografica, questi campioni erano privi di pesticidi, non mostrando alcun segnale cromatografico a tempi di ritenzione simili a quelli dei composti di interesse analitico.
Il suolo utilizzato negli studi è stato classificato come Eutrofico Arenico Idromorfo Planossolo, appartenente all’unità cartografica del comune di Tanguá, nel comune di Rio de Janeiro. La regione presenta un rilievo da pianeggiante a leggermente ondulato con un substrato di sedimenti alluvionali recenti.
Le proprietà fisiche e chimiche di questo terreno sono: pH dell’acqua (1: 1) = 4,8; P = 6,0 mg L-1; K = 120 mg L-1; argilla = 26%; M.O. = 2,3%; Ca = 5,0 cmolc L-1; Mg = 2,0 cmol L-1; Al = 1,7 cmolc L-1 e indice SMP 5.1
REAGENTI, SOLVENTI E GAS
Acetone P.A.; Acetonitrile – UHPLC; Solfato di magnesio anidro; Cloruro di sodio P.A .; PSA – UHPLC; Acqua distillata; Acqua ultrapura, purificata nel sistema Milli-Q-Plus; Aria sintetica pura al 99,9%; C18 – Cartucce per SPE; Cloruro di sodio; Diclorometano – Ultra Resi-Analizzato; Etanolo-UV-IR-HPLC; Extran neutro; ace argon, analitico, utilizzato come gas di collisione nel sistema CLUE-MS / MS; Gas azoto, utilizzato come gas di desolvatazione nella sorgente di electrospray; Metanolo– UV-IR-HPLC; Adsorbente Bondesil PSA, con dimensione delle particelle di 50 μm;
ATTREZZATURE
Marconi Shaker Modello M227; Serra Fanem Modello F 330; Agitatore Vortex IKA Modello MS 3 Digital; Bilancia analitica di precisione; Metler Toledo; Modello XP205; numero di serie B018030980; Bilancia analitica di precisione; SARTORIUS Modello SARTORIUS – numero di serie 71205517; Centrifuga; Eppendorf, modello 5810R; Micropipetizzatori automatici Eppendorf a capacità variabile; pHmetro Metler Toledo S 220; Sistema di purificazione dell’acqua Milli-Q prodotto da MilliPore; Cromatografo liquido Waters Acquity Ultraperformance LC; Quattro spettrometri di massa sequenziali Premier Model XE.
OTTIMIZZAZIONE DEL METODO – CONDIZIONI CROMATOGRAFICHE E SPETTRO DI MASSA
L’analisi è stata eseguita utilizzando un sistema Acquity UPLC® accoppiato a Quattro Premier XE® (Waters Corp., Ma, USA).
Sistema Acquity UPLC® composto da pompa binaria, campionatore automatico e forno a colonna.
La separazione cromatografica è stata eseguita sulla colonna Waters Acquity BEH UPLC® C18 (ID 100 x 2,1 mm, 1,7 µm). Composizioni della fase mobile A (formato di ammonio 5 mM + 0,01% di acido formico, pH 4,00) e della fase mobile B (acetonitrile: fase mobile A, 95: 5), gradiente: 0-1 min (10% B); Da 1 a 5,5 min (55% B); Da 5,5 a 10,5 min (100% B); 12 min (10% B). La velocità di flusso utilizzata era 0,3 mL min-1, la temperatura del forno della colonna era 30 ° C, la temperatura dell’autocampionatore era 25 ° C.L’iniettore è stato regolato per l’iniezione a ciclo completo di 10 µL e il tempo di esecuzione totale era 12 min.
Lo spettrometro di massa Quattro Premier XE® è stato utilizzato con una sorgente di ionizzazione elettrospray in modalità positiva (ESI+). I parametri operativi sono stati regolati per le seguenti condizioni: tensione capillare: 3,5 kV; temperatura della sorgente ionica: 120 ° C, temperatura di desolvatazione: 450 ° C; flusso gas cono (N2): 20 L.h-1; flusso di gas di desolvatazione (N2): 500 L.h-1; flusso di gas di collisione (Ar): 0,15 mL. min-1. Le sollecitazioni del cono, le energie di collisione e le transizioni di quantificazione e conferma per ciascun analita sono state stabilite dall’infusione diretta di una soluzione di 1 µg.mL-1. L’infusione degli analiti è stata eseguita con le fasi mobili A e B (1: 1), con una velocità di flusso di 0,1 mL. Min-1 in modalità di scansione completa. Dopo aver regolato questi parametri, è stato utilizzato il metodo per il monitoraggio di reazioni multiple (MRM), utilizzato per identificare e quantificare gli analiti.
La scelta della fase mobile, la modalità di ionizzazione (ESI positivo), la quantificazione e le transizioni di conferma sono state effettuate in base alla letteratura (Aguilera-Luiz et al., 2011; Rubensam et al., 2011) e alle caratteristiche chimiche degli analiti. Alcuni dei parametri utilizzati nel sistema Quattro Premier XE®, come la tensione capillare; temperatura della sorgente ionica; La temperatura di desolvatazione, tra le altre, è stata stabilita durante la calibrazione dello strumento dal produttore. Gli ioni precursori di ciascun analita sono stati osservati mediante infusione diretta. Nella maggior parte dei casi, è stato osservato lo ione protonato [M+ H]+.
STANDARD ANALITICI
Gli standard analitici dei pesticidi studiati e la preparazione delle soluzioni di lavoro (soluzioni stock di fortificazione)
Gli standard analitici per i pesticidi utilizzati sono stati acquisiti dalla AccuStandart Company. La tabella 1 mostra il grado di purezza (%) e la classe di standard analitici solidi utilizzati per lo sviluppo di questo lavoro.
Tabella 1 – Standard analitici solidi utilizzati al lavoro
| AGROTOSSICO | PUREZZA (%) |
| Azoxystrobin | 99,4 |
| Boscalida | 95,5 |
| Carbendazim | 98,7 |
| Clorantraniliprolo | 98,4 |
| Clothianidin | 96,5 |
| Diafentiuron | 99,9 |
| Difenoconazolo | 100 |
| Dimetomorfe | 98 |
| Espinetoram | 96,8 |
| Spinosad | 96,6 |
| Fenuron | 98 |
| Imidacloprid | 99,5 |
| Indoxacarb | 97,3 |
| Metalaxyl M | 98 |
| Metossifenozide | 99,5 |
| Thiamethoxam | 100 |
Fonte: AccuStandart a New Haven, Connecticut, USA – 2018
Con questi standard, è stata preparata la soluzione di fortificazione stock contenente gli analiti. Questa soluzione è valida per un solo mese e deve essere stata conservata con cura in una beuta color ambra, con tappo e tappo in teflon a -18 ° C, a temperature molto basse.
Tutta la vetreria utilizzata nella preparazione di soluzioni e analisi, come pipette, matracci volumetrici, becher, ecc., È stata debitamente calibrata e identificata per evitare errori volumetrici nelle determinazioni.
Inizialmente, sono stati preparati 10 mL di 1000 mg di soluzione analitica stock di 1000 mg.L-1 di ciascun pesticida. Gli standard sono stati sciolti in metanolo allo 0,02% in acido acetico glaciale, che sono gli stessi componenti della fase mobile adottata nella cromatografia liquida che analizzerà i composti e le soluzioni stock sono state conservate in beute ambrate a una temperatura di -18 ºC.
Utilizzando il metodo delle diluizioni successive, sono state preparate soluzioni analitiche individuali per ogni pesticida in studio, alla concentrazione di 100 mg L-1, con gli stessi solventi. Da queste soluzioni è stata preparata una miscela alla concentrazione di 10 mg di L-1 contenente tutti i pesticidi. Infine, dalla soluzione standard 10 mg L-1, è stata preparata una miscela alla concentrazione di 0,200 mg L-1 contenente tutti i pesticidi.
A partire dalla miscela intermedia L-1 1,0 mg, sono state preparate soluzioni di lavoro analitiche in concentrazioni di 0,4; 2.0; 4.0; 10.0; 20,0 e 40,0 µg.L-1 contenenti tutti i pesticidi in ciascuna concentrazione per la preparazione della curva di calibrazione del cromatografo liquido. Per l’iniezione nel sistema UHPLC-MS / MS, sono state effettuate diluizioni nella proporzione 1: 1 (v / v) di queste soluzioni in fase mobile Metanolo / acqua, in modo che le concentrazioni finali delle soluzioni di lavoro valutate fossero 0,2; 1.0; 2.0; 5.0; 10,0 e 20,0 µg L-1 per tutti i pesticidi che costituiscono la soluzione madre di fortificazione. Le diluizioni delle soluzioni analitiche nella fase mobile acidificata mirano a migliorare l’efficienza di ionizzazione degli analiti, migliorando il segnale cromatografico, la forma e la simmetria dei picchi. Queste soluzioni di lavoro sono state utilizzate per studiare la linearità del metodo. Tutte le soluzioni sono state conservate in flaconi color ambra e conservate a -18 ºC.
CONVALIDA DEL METODO
La parametrizzazione adottata per la validazione del metodo analitico è consistita nella verifica delle prestazioni. Pertanto, parametri quali: curva analitica e linearità, limite di rilevamento, limite di quantificazione, accuratezza (recupero) e precisione (ripetibilità e precisione intermedia) sono diventati un riferimento per ottenere risultati affidabili.
DETERMINAZIONE DEL SUOLO BIANCO DI RIFERIMENTO
A causa della complessità della matrice e dei bassi livelli di concentrazione in cui si trovano i pesticidi nel terreno (ordine da ppm a ppb), la preparazione del campione è stata essenziale per ottenere risultati affidabili.
Il passaggio più difficile è stato ottenere un campione di terra bianca, privo di pesticidi e che potesse servire come riferimento zero per gli studi. Questo terreno era destinato a effettuare contaminazioni con pesticidi per seguirne l’ottimizzazione attraverso il metodo QuEChERS.
Per la verifica del terreno bianco, il campione di terreno codificato come A1BR05 è stato utilizzato in due trattamenti:
TRATTAMENTO 01
In 5 provette da 50 ml di centrifuga Falcon, sono stati pesati 15 g di terreno ed è stato eseguito il trattamento 01, basato sul metodo QuEChERS originale: 15 g di terreno + 5 ml di H2O; vortex 30 sec, 1 mL di surrogato (Propoxur 1.0 µg / mL); vortice 30 sec; 15 minuti di attesa; 15 mL di ACN di grado UHPLC; Vortex 30 sec; 6 g MgSO4 + 1,5 g NaCl; Centrifugazione (7 min); estrazione del surnatante e diluizione con metanolo RP 1: 1 per iniezione nel cromatografo liquido.
La soluzione Propoxur 1.0 µg.mL-1 (Surrogate) è stata utilizzata come marker. Se il cromatogramma bianco appariva senza picchi, era necessario assicurarsi che il sistema mostrasse sensibilità ai composti e il propoxur era il composto che portava quella certezza.
TRATTAMENTO 02
È stato anche testato un trattamento con il metodo modificato con soluzione di idrossido di calcio con pH = 12,6, al fine di ottenere un migliore sfondo dei campioni rispetto alla matrice del terreno come segue:
In 5 provette da 50 mL di centrifuga Falcon, sono stati pesati 15 g di terreno ed è stato effettuato il trattamento 02 – 15 g di terreno + 5 ml di H2O; vortice 30 sec; 1 mL di surrogato; vortice 30 sec; 5 mL di soluzione di Ca(OH)2 pH 12,6; 5 minuti di attesa; 15 mL di ACN di grado UHPLC; vortice 30 sec; 6 g MgSO4 + 1,5 g NaCl; centrifugazione (7 min); estrazione del surnatante e diluizione con metanolo RP 1; 1 per iniezione nel cromatografo liquido.
I campioni di terreno A1BR05 hanno dimostrato di essere privi di pesticidi in entrambi i trattamenti. Da questa fase, il campione A1BR05 è diventato il terreno bianco di riferimento di questo lavoro.
I due trattamenti precedenti sono stati utilizzati per campioni di terreno denominati con la soluzione di fortificazione contenente gli analiti di interesse.
Il metodo è stato inizialmente ottimizzato per l’estrazione del focus dei pesticidi: Azoxystrobin, Boscalide, Carbendazim, Chloranthranilprole, Clothianidin, Diafentiuron, Diphenoconazole, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenuron, Imidacloprido cultivation mediante determinazione mediante UHPLC-MS / MS (Cromatografia liquida ad altissime prestazioni), che richiede che la matrice sia pulita, riducendo al minimo le interferenze di fondo (effetto matrice – backgroud). Pertanto, i trattamenti 1 e 2 sono stati i punti di partenza per l’estrazione di questi pesticidi dalla matrice del suolo.
In entrambi i trattamenti gli estratti erano molto chiari. Anche così, le frazioni di ciascuno dei suddetti test sono state testate in una fase di purificazione dispersiva. In questa fase è stata testata un’estrazione dispersiva nella fase solida della pulitura del PSA, generando altri 4 trattamenti, per un totale di 8 test differenti.
L’estratto è stato filtrato attraverso una membrana di PTFE e quindi 1 ml di estratto è stato trasferito in un matraccio tarato, sciolto con 1 ml di metanolo e questa soluzione finale è stata trasferita in un pallone cromatografico. Da questo punto in poi, 5 microlitri di ciascun campione sono stati iniettati in duplicato nel cromatografo liquido ad ultra prestazioni accoppiato allo spettrometro di massa. I test sono stati eseguiti in duplicato ei risultati sono riportati nella tabella 2
Tabella 2 – Risultati dei trattamenti 1 e 2 dell’analisi dei pesticidi-focus mediante cromatografia liquida ultra-performante
| Principio attivo | Fattore di recupero senza clean-up (%) | Fattore di recupero dopo la clean-up (%) | ||
| Trattamento 01 | Trattamento 02 | Trattamento 01 | Trattamento 02 | |
| Abamectina | 88/115 | 65/70 | 97,5 | 115 |
| Diafentiuron | 43/37 | 67/72 | 53 | 81,2 |
| Azoxystrobin | 101/100 | 93/94 | 162,5 | 160 |
| Pymetrozine | 30/28 | 81/75 | 30 | 120 |
| Acibenzolar-S-Methyl | 138/131 | 36/38 | 162 | 47,5 |
| Mandipropamide | 108/109 | 110/102 | 180 | 162 |
| Ciromazina | 60/61 | 81/80 | 95 | 125 |
| Metomile | 108/116 | 107/105 | 177 | 225 |
| Pymetrozine | 30/28 | 81/75 | 45 | 120 |
| Acetamiprido | 103/104 | 99/103 | 167 | 155 |
| Buprofezina | 98/97 | 96/96 | 167 | 166 |
| Lucifenuron | 68/67 | 64/63 | – | – |
| Thiamethoxam | 104/98 | 70/69 | 165 | 112 |
Fonte: elaborazione degli autori
Il trattamento con una soluzione di idrossido di calcio (pH = 12,3) ha mostrato migliori fattori di recupero per la maggior parte degli analiti, ad eccezione di Acibenzolar-S-metile, che non si è ripreso bene in nessuno dei trattamenti. Ciò è probabilmente dovuto alla metilazione della struttura del composto dello zolfo, che rende difficile l’estrazione in acetonitrile. Pertanto, la convalida è continuata sulla base del trattamento 02.
PROVE DI FORTIFICAZIONE PER LA VALUTAZIONE DELLA PRECISIONE DEL METODO
Per lo studio dell’accuratezza di questo metodo analitico sono state effettuate prove di fortificazione con l’obiettivo di verificare il fattore di recupero dei composti in esame. Pertanto, sono state eseguite cinque fortificazioni dei campioni “bianchi di riferimento” a due diversi livelli di concentrazione, per un totale di 10 test.
Ciascun livello di fortificazione è stato iniettato due volte, per un totale di n = 10 (5 estrazioni x 2 iniezioni).
Per la procedura di estrazione del metodo QuEChERS modificato, sono stati pesati 15,00 g di terreno omogeneo in provette di polipropilene (tipo Falcon), con tappo a vite (capacità 50 mL). Quindi, ogni campione è stato inumidito con 5 ml di acqua Milli-Q e agitato vigorosamente per 30 secondi in Vortex. La fortificazione è stata aggiunta a entrambi i livelli, utilizzando pipette calibrate da 0,5 mL e 1,0 mL, in concentrazioni: 0,200 µg.mL-1 per tutti i pesticidi contenuti nella soluzione di fortificazione.
Dopo la fortificazione, i campioni sono stati omogeneizzati mediante vortex per 30 secondi e mantenuti a 20 ºC per 15 minuti. Ricerca di PINTO et al. (2010), indicano che è essenziale che ci sia tempo sufficiente affinché il campione con gli analiti evapori il solvente e, quindi, vi sia una maggiore interazione tra i composti e la matrice. Secondo l’autore, questo passaggio avvicina il test alla realtà dell’interazione che si verifica con i campioni sul campo.
Quindi, con l’ausilio di una pipetta volumetrica, 5 mL di soluzione satura di idrossido di calcio pH 12,3, in ciascuna provetta, e dopo averle chiuse, è stato eseguito il vortex per 30 secondi. Lasciar reagire per 10 minuti, a riposo. Quindi, 15 ml di acetonitrile di grado Lichrosolv (per l’analisi dei residui) sono stati aggiunti a ciascuna provetta e agitati di nuovo per 30 secondi.
1,5 cloruro di sodio (NaCl) e 6,0 g di MgSO4 (solfato di magnesio anidro) sono stati aggiunti a ciascuna provetta e agitati su vortex per altri 30 secondi, al fine di ottenere la massima interazione possibile tra il liquido estratto e i reagenti solidi. Infine, le provette sono state portate in centrifugazione per 7 minuti a 3000 rpm.
In una fiala con una capacità di 2 mL, è stata eseguita una diluizione 1: 1 (v / v), in cui sono stati aggiunti 1.0 mL dell’estratto ottenuto dopo l’estrazione e 1.0 mL della fase mobile, seguita dall’analisi mediante LC-MS / SM.
Infine, diluizioni degli estratti finali sono state effettuate nella proporzione 1: 1 (v / v) in fase mobile (acqua ultrapura). Il recupero del composto è stato valutato a concentrazioni di 1 e 2 µg.kg-1 di terreno per tutti i pesticidi nella soluzione di fortificazione.
I risultati del recupero sono stati interessanti in entrambi i trattamenti. Tuttavia, il trattamento 02 si è dimostrato più efficace nell’estrazione di un maggior numero di pesticidi, con recuperi nel range dal 64 al 110%, ad eccezione di Acibenzolar-S-Methyl, i cui recuperi sono stati più espressivi nel trattamento 1.
I risultati degli esperimenti per valutare il miglior metodo di estrazione e pulizia sono riportati nella Tabella 1 – Test effettuati per ottimizzare la fase di estrazione.
La fase di clean-up non ha mostrato alcun miglioramento significativo nei risultati. Pertanto, si è deciso di procedere alla fase di convalida utilizzando il trattamento 02 senza la fase di pulizia.
OTTIMIZZAZIONE DEL METODO
Il metodo di estrazione è stato ottimizzato secondo la Analytical Quality Assurance Guide. I valori stabiliti in questo manuale soddisfano i requisiti della Decisione 2018/657 (European Comission/SANTE, 2018).
Sono stati valutati i seguenti parametri: selettività; effetto matrice; linearità; recupero; limite di rilevamento (LOD); limite di quantificazione (LOQ) e ripetibilità. I calcoli sono stati eseguiti utilizzando MassLynx® e il software Microsoft Excel®. Nel metodo proposto, la selettività è stata valutata attraverso l’analisi di cinque repliche degli estratti di campionamento dei terreni di pomodoro. La valutazione della linearità ha comportato il tracciamento di una curva analitica del solvente dalla soluzione di lavoro MIX 1 contenente i 295 analiti, con cinque punti corrispondenti a 0, 0,5, 1,0, 1,5 e 2,0 volte l’LMR stabilito per ciascun analita. Il test di Cochran è stato utilizzato per valutare l’omogeneità delle variazioni ottenute per ogni livello di concentrazione. I dati di calibrazione sono stati valutati mediante regressione lineare comune in caso di omoschedasticità o regressione lineare pesata in caso di eteroschedasticità.
Per l’estrazione dei campioni è stato utilizzato lo stesso terreno di riferimento delle prove iniziali. Nel metodo proposto, la selettività è stata valutata analizzando cinque repliche degli estratti di campionamento dal suolo della piantagione di pomodori. In 10 provette da centrifuga, tipo Falcon, sono stati pesati 15 g ed è stato aggiunto 1 ml della soluzione di lavoro. Nelle provette numerate 1 e 5, 1 ml della soluzione di fortificazione è stato aggiunto con soluzioni di lavoro di livello 1 in ciascuna provetta e nelle provette numerate da 6 a 10, 1 ml della soluzione di fortificazione è stato aggiunto con soluzioni di lavoro di livello 2. in ciascuna provetta, inoltre in una provetta in bianco, senza fortificazione, con controllo di qualità del propoxur. Le 11 provette hanno ricevuto tutti i passaggi utilizzati nel trattamento 2 e successivamente 1 ml dell’estratto è stato trasferito in un pallone e 1 ml di MeOH (componente della fase mobile) è stato applicato. Quindi, 5 µl sono stati iniettati nel cromatografo liquido Ultra Performance accoppiato allo spettrometro di massa sequenziale, nelle stesse condizioni adottate per i test 3 e 4 del trattamento 2. Ogni campione è stato iniettato in quintuplicato, come raccomandato in Guia Sante (2018) per la convalida di metodi cromatografici.
L’effetto matrice è stato valutato confrontando la pendenza della curva analitica nell’estratto della matrice con la pendenza della curva analitica nel solvente, utilizzando il test F (Fisher Snedecor). Quindi, è stato applicato il test t di Student per determinare l’equivalenza statistica tra le pendenze delle curve analitiche nel solvente e nella matrice.
Il LOD e LOQ sono stati calcolati utilizzando il rapporto segnale / rumore dell’apparecchiatura. LOD era la concentrazione equivalente a tre volte il rumore e LOQ era la concentrazione equivalente a sei volte il rumore. Il recupero e la ripetibilità del metodo sono stati eseguiti con campioni di terreno con picchi di due livelli: da 0,5 a 1,0 equivalenti a 5 volte l’MRL di ciascun analita, con cinque ripetizioni per ogni livello. Per ogni livello sono stati calcolati il recupero medio e la deviazione standard relativa (RSD). Analisi del campione. I campioni sul campo sono stati gentilmente forniti dai produttori nello stato di Rio de Janeiro, Brasile, e sono stati analizzati utilizzando il metodo convalidato.
Il metodo QuEChERS modificato con idrossido di calcio ha mostrato risultati di recupero migliori rispetto al metodo QuEChERS originale per la maggior parte degli analiti, principalmente per Abamectina, Acetamipride, Azoxystrobin, Buprofezina, Diafentiuron, Mandipropamide, Pymetrozine, Cyromazine, Metomil, Pimetrozine, Luciamenuron e. Con il metodo modificato (metodo QuEChERS con Ca (OH)2), i valori di recupero ottenuti erano compresi nell’intervallo accettabile del 70-120% (ANVISA, 2018). Il trattamento 2 ha avuto un solo risultato di recupero al di fuori dell’intervallo accettabile dell’80-110%, Acibenzolar-S-Methyl (37%). La fase di clean up con SPE dispersivo non ha promosso miglioramenti significativi nei recuperi. La fase di pulizia SPE non è stata necessaria perché il primo estratto ottenuto era limpido e presentava recuperi accettabili per i composti di interesse, come mostrato nella Tabella 2.
Pertanto, il metodo di estrazione scelto per seguire il processo di validazione è stato il metodo basato sul trattamento 2 (QuEChERS con idrossido di calcio) senza la fase di pulizia SPE, utilizzando MgSO4, PSA e C18.
La precisione è stata calcolata utilizzando la seguente equazione ed è stata espressa come percentuale di recupero (INMETRO, 2007):
C1 = Concentrazione determinata nel campione fortificato;
C2 = Concentrazione determinata nel campione non fortificato;
C3 = Concentrazione usata per fortificare.
Non c’era interferenza nello stesso m / ze tempo di ritenzione degli analiti nelle cinque ripetizioni eseguite con l’estratto di matrice. In questo modo è stato possibile ottenere la selettività del metodo. Il foglio di lavoro per la valutazione della curva analitica – Validazione del metodo multi-rifiuto da parte di CLUE-EM / EM è mostrato in Figura 1.
Figura 3 – Dati sulla valutazione della curva analitica – Validazione del metodo multiresiduo da parte di CLUE-EM / EM

Le caratteristiche prestazionali del metodo ottimizzato, il working range, i valori dei Coefficienti di correlazione (r) e determinazione (R2) per le curve analitiche ottenute per ogni analita sono riportati nella Tabella 3.
Tabella 3 – Riepilogo dei risultati della valutazione – Coefficienti di correlazione (r) e determinazione (R2)
| Sostanza | VALIDAZIONE DELLA CURVA ANALITICA | |
| r | R2 | |
| Azoxystrobin | 0,9995 | 0,9989 |
| Boscalida | 0,9982 | 0,9964 |
| Carbendazim | 0,9996 | 0,9993 |
| Clorantraniliprolo | 0,9996 | 0,9991 |
| Clothianidin | 0,9963 | 0,9925 |
| Diafentiuron | 0,9993 | 0,9986 |
| Difenoconazolo | 0,9988 | 0,9975 |
| Dimetomorfe | 0,9991 | 0,9982 |
| Espinetoram | 0,9973 | 0,9947 |
| Spinosad | 0,9987 | 0,9974 |
| Fenuron | 0,9986 | 0,9973 |
| Imidacloprid | 0,9995 | 0,9990 |
| Indoxacarb | 0,9981 | 0,9961 |
| Metalaxyl M | 0,9998 | 0,9997 |
| Metossifenozide | 0,9969 | 0,9939 |
Fonte: elaborazione degli autori
L’effetto matrice non è stato valutato per la convalida del suolo, essendo considerato significativo per tutti i pesticidi studiati.
Tutte le sostanze analizzate presentavano un comportamento omoscedastico nell’intervallo di lavoro compreso tra 0,0032 e 0,0500 µg / mL.
Si osserva che per la maggior parte degli analiti, i coefficienti di determinazione (r2) erano vicini a uno, mostrando una buona linearità, indicando un profilo di dispersione omoschedastico (variazione costante degli errori sperimentali per diverse osservazioni) per la maggior parte degli analiti, consentendo che le curve standard fossero valutate da regressione lineare utilizzando il metodo dei minimi quadrati ordinari. Le regolazioni lineari ponderate (1 / x) sono state effettuate utilizzando il software MassLynx®. I valori Student-t calcolati per l’effetto matrice rientravano nei valori richiesti dalla Guida SANTE per la maggior parte degli analiti. Pertanto, la curva nell’estratto della matrice è stata utilizzata per quantificare i campioni, inclusi gli analiti in cui non è stato osservato l’effetto della matrice. I valori ottenuti per LOD e LOQ, nonché il rapporto segnale / rumore (Tabella 4), hanno soddisfatto i criteri stabiliti dall’Agenzia nazionale di sorveglianza sanitaria (ANVISA, 2018) per questi analiti, confermando che il metodo ottimizzato è adeguato a rispettare la legislazione vigente in Brasile. Tuttavia, per essere conformi alla legislazione europea, il LOD e il LOQ ottenuti devono essere rivisti, in quanto sono molto vicini al livello massimo stabilito (EUROPEAN COMISSION, 2018).
Tabella 4 – Sostanze validate nella matrice del suolo, con i rispettivi limiti di quantificazione e il corrispondente rapporto segnale / rumore
| Sostanza | VALIDAZIONE DELLA CURVA ANALITICA | |
| LOQ (mg/kg) | Rapporto del segnale/Rumore | |
| Azoxystrobin | 0,0066 | 538,39 |
| Boscalida | 0,0076 | 30,11 |
| Carbendazim | 0,0055 | 166,53 |
| Clorantraniliprolo | 0,0075 | 276,84 |
| Clothianidin | 0,0064 | 496.4 |
| Diafentiuron | 0,0038 | 72,37 |
| Difenoconazolo | 0,0077 | 38,83 |
| Dimetomorfe | 0,0072 | 27,62 |
| Espinetoram | 0,0074 | 10729,08 |
| Spinosad | 0,0078 | 1757,72 |
| Fenuron | 0,0080 | 1630,64 |
| Imidacloprid | 0,0132 | 207,19 |
| Indoxacarb | 0,0062 | 171,61 |
| Metalaxyl M | 0,0072 | 1104,23 |
| Metossifenozide | 0,0074 | 327,56 |
Fonte: elaborazione degli autori
È stato possibile stabilire il LOQ per le sostanze al livello di fortificazione convalidato, poiché avevano un rapporto segnale / rumore maggiore di 10.
PRECISIONE (TASSO DI RECUPERO) E PRECISIONE (RIPETIBILITÀ)
Per lo studio della velocità di recupero e ripetibilità, il campione di terreno A1BR05 è stato fortificato con diversi volumi della soluzione madre di fortificazione, componendo una miscela dei pesticidi di interesse, in cinque repliche, dopo l’estrazione è stato rimosso il volume di 1 mL e diluito 1: 1 con metanolo (MeOH) per ulteriori analisi cromatografiche mediante UHPLC-MS / MS. Questa concentrazione di fortificazione corrisponde alla concentrazione teorica di LQ. Ciascun replicato è stato iniettato due volte.
Concentrazioni di iniezione:
– Livello 1: 0,00323 µg / mL, che corrisponde a 0,0067 mg / kg,
– Livello 2: 0,00625 µg / mL, che corrisponde a 0,0133 mg / kg,
I risultati ottenuti dall’accuratezza – recupero sono descritti nella Tabella 5.
Tabella 5 – Risultati ottenuti dall’accuratezza – Recupero
| Sostanza | VALIDAZIONE DELLA CURVA ANALITICA | ||||
| Livello 1 | Livello 2 | ||||
| conclusione. (mg kg-1) | Rec. (%) | conclusione. mg kg-1) | Rec. (%) | ||
| Azoxystrobin | 0,0066 | 95,4 | 0,0142 | 106,3 | |
| Boscalida | 0,0076 | 111,5 | 0,0149 | 110,5 | |
| Carbendazim | 0,0055 | 80,4 | 0,0125 | 94,2 | |
| Clorantraniliprolo | 0,0075 | 109 | 0,0153 | 114 | |
| Clothianidin | 0,0062 | 92,1 | 0,0146 | 109,9 | |
| Diafentiuron | 0,0038 | 53,7 | 0,0042 | 32,5 | |
| Difenoconazolo | 0,0077 | 112,2 | 0,0148 | 111 | |
| Dimetomorfe | 0,0072 | 105,4 | 0,015 | 111,5 | |
| Espinetoram | 0,0074 | 103,5 | 0,0149 | 111,5 | |
| Spinosad | 0,0078 | 114,4 | 0,0159 | 118,9 | |
| Fenuron | 0,008 | 115,9 | 0,016 | 119,4 | |
| Imidacloprid | 0,0063 | 92,1 | 0,0143 | 106,4 | |
| Indoxacarb | 0,0062 | 90,3 | 0,0135 | 101 | |
| Metalaxyl M | 0,0072 | 105,1 | 0,0155 | 116,6 | |
| Metossifenozide | 0,006 | 88,1 | 0,0146 | 109,6 | |
Fonte: elaborazione degli autori
I risultati del recupero rientrano nell’intervallo accettabile (70-120%). Il metodo ha mostrato una buona ripetibilità per la maggior parte dei composti studiati, con valori RSD inferiori al 20%.
Tutti i composti studiati hanno soddisfatto i criteri raccomandati dalla European Comission (2018), ad eccezione del pesticida Diafentiuron, perché non ha fornito un recupero nell’intervallo accettabile (dal 70% al 120%) a nessuno dei due livelli, rendendo impossibile la sua convalida.
Dopo la convalida, il metodo è stato utilizzato per la determinazione quantitativa del contenuto di pesticidi nei campioni di terreno raccolti nelle regioni in cui sono piantati i pomodori. I risultati ottenuti sono riportati nella Tabella 6 di seguito:
Tabella 6 – Riepilogo dei risultati dei campioni di suolo effettivi raccolti nelle aree di piantagione di pomodori (mg / kg di terreno)
| Pesticida | P1 | P2 | P3 | P4 | P5 | P6 | P7 |
| 1. Azoxystrobin | 0,003 | 0,0025 | 0,009 | 0,06 | |||
| 3. Boscalida | Tracce | ||||||
| 4. Carbendazim | 0,0065 | 0,0085 | |||||
| 5. Clomazone* | |||||||
| 6. Clorantraniliprolo | 0,036 | X | 0,071 | 0,223 | |||
| 7. Clothianidin | 0,027 | X | 0,0185 | ||||
| 8. Diafentiuron | 0,0255 | X | |||||
| 9. Difenoconazolo | 0,003 | 0,038 | 0,0285 | ||||
| 10. Dimetomorfe | 0,0105 | 0,48 | 0,096 | 0,0275 | |||
| 11. Espinetoram | X | X | |||||
| 12. Spinosad A | 0,002 | ||||||
| 13. Spinosad D | X | X | |||||
| 14. Fenuron | X | Tracce | X | Tracce | X | X | |
| 15. Imidacloprid | X | Tracce | 0,008 | 0,006 | |||
| 16. Indoxacarb | 0,0235 | 0,0015 | |||||
| 17. Metalaxil M | Tracce | Tracce | 0,0085 | 0,024 | 0,001 | ||
| 18. Metossifenozide | 0,1415 | 0,0105 | |||||
| 19. Thiamethoxam | 0,0315 | 0,0225 | 0,0255 |
Nota: da P1 a P6 (aree di piantagione di pomodori) Fonte: preparato dagli autori.
I residui di pesticidi sono stati trovati nella Tabella 6. Il fenuron di pesticida è stato trovato in tutti i campioni di suolo, tranne nelle aree P1 e P2. Questo pesticida è uno di quelli esclusi o non registrati in Brasile, come mostrato nella tabella 7. Tuttavia, le concentrazioni di questo composto trovate nei campioni sono state classificate come tratti, cioè al di sotto del limite di rilevamento con il metodo analitico.
Per quanto riguarda i pesticidi azoxitrobina e carbendazim, la situazione nelle zone 6 e 7 è preoccupante, soprattutto perché questi pesticidi non sono autorizzati dall’ANVISA per l’applicazione nella piantagione di pomodori, come mostrato nella Tabella 7.
Tabella 7 – Concentrazioni di pesticidi NON AUTORIZZATI da applicare ai pomodori presenti nei terreni analizzati
| Pesticida | P6 | P7 | ||||
| 5-10 | 10-20 | 10-20 | 0-5 | 5-10 | 10-20 | |
| 1. Azoxystrobin | 0,0090 | 0,0035 | 0,006 | 0,060 | 0,012 | 0,003 |
| 2. Carbendazim | 0,0065 | 0,0065 | 0,0045 | 0,0085 | 0,003 | 0,002 |
Fonte: elaborazione degli autori
Il metodo multiresiduo ottimizzato si è dimostrato selettivo e preciso nel range studiato, consentendo l’analisi simultanea delle sostanze: Azoxystrobin, Boscalide, Carbendazim, Chloranthraniliprole, Clothianidin, Diphenoconazole, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenuron, Imidacloprido , Indalaxide M, Methoxyfenozide, Tiametoxan, con i rispettivi limiti di quantificazione (LOQ), inclusi nel programma ufficiale di monitoraggio del pomodoro brasiliano, come mostrato nella Tabella 8
Tabella 8 – LOQS per pesticidi-focus: µg kg-1
| Pesticida | LOQ (µg kg-1) |
| Azoxystrobin | 7,0 |
| Boscalida | 7,0 |
| Carbendazim | 5,0 |
| Clorantraniliprolo | 7,0 |
| Clothianidin | 7,0 |
| Diafentiuron | 7,0 |
| Difenoconazolo | 7,0 |
| Dimetomorfe | 7,0 |
| Espinetoram | 7,0 |
| Spinosad | 7,0 |
| Fenuron | 7,0 |
| Imidacloprid | 13,0 |
| Indoxacarb | 7,0 |
| Metalaxyl M | 7,0 |
| Metossifenozide | 7,0 |
Fonte: elaborazione degli autori
CONSIDERAZIONI FINALI
Il metodo QuEChERS, con lievi alterazioni, è risultato idoneo per l’estrazione multiresiduale degli analiti in terreni di impianto di, con estratti limpidi e privi di interferenze. La cromatografia liquida ad altissima risoluzione accoppiata alla spettrometria di massa sequenziale (UPLC-MS / MS) era adeguata per il rilevamento e la quantificazione di questi analiti nella matrice, con valori di recupero tra il 70 e il 120% di deviazione standard inferiore al 20%, limiti di quantificazione tra 7 e 13 µg.L-1 e limiti di quantificazione tra 2 e 4 µg.L-1, adeguati per ottemperare alla normativa vigente. I risultati della prova sul campo hanno dimostrato che il metodo è adatto per l’analisi quantitativa di pesticidi valutati in suoli derivati da piantagioni di pomodoro all’interno del range di lavoro.
Il metodo validato è conforme ai valori suggeriti in letteratura per l’analisi dei residui di pesticidi mediante metodi cromatografici (COMMISSIONE EUROPEA, 2018). La determinazione dei pesticidi in esame da parte di UHPLC-MS / MS è stata soddisfacente, consentendo l’esecuzione di un’analisi qualitativa, ottenuta da frammenti di massa caratteristici di ogni analita, e quantitativa, attraverso la modalità di acquisizione MRM. Le condizioni cromatografiche ottimizzate per la determinazione mediante UHPLC-MS / MS hanno permesso l’identificazione e la quantificazione dei composti in studio, in un tempo di analisi inferiore a 15 min, che contribuisce con un grande guadagno come strumento analitico e per la società nel suo insieme.
In generale, tutti i campioni hanno mostrato concentrazioni di pesticidi consentite dalle monografie ANVISA. Tuttavia, i risultati ottenuti per le piantagioni convenzionali, pur rientrando nelle conformità richieste, sono superiori ai valori ottenuti per le piantagioni del sistema sostenibile e biologico. Tuttavia, funge da allarme per la presenza di pesticidi sulla tavola della società.
L’uso di pesticidi Azoxystrobin e Carbendazim (pesticidi non autorizzati) per l’applicazione nei pomodori porta concreta preoccupazione per qualcosa che era normalmente previsto, l’uso deliberato di pesticidi per aumentare la produzione, indipendentemente da ciò che le leggi raccomandano.
Se da un lato è preoccupante trovare pesticidi non autorizzati nei campioni, dall’altro questo dimostra che il metodo validato da questo lavoro è altamente efficace, grazie alla capacità di quantificare anche pesticidi non autorizzati all’uso.
Oltre a ottenere risultati abbastanza soddisfacenti per il focus pesticidi, questo lavoro si è rivelato in grado di determinare residui per 240 pesticidi, tra autorizzati e non autorizzati da ANVISA in Brasile, con valori di coefficiente di determinazione maggiori di 0,99; Valori di LOQ di 13 µg kg-1 per Spinosad e 7,0 µg kg-1 per gli altri pesticidi. Il metodo ha mostrato una buona precisione, con valori RSD <20%, e accuratezza, con recuperi tra il 70 e il 120% per la stragrande maggioranza dei composti analizzati.
RIFERIMENTI
AZEVEDO, E. de – Alimentos Orgânicos: ampliando conceitos de saúde humana, ambiental e social, Livros G.Play, 2018.
ANASTASSIADES M, Lehothay S.J, Stajnbaher D, Schenck F.J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residue in produce. J. AOAC Int. 86: 412-431, 2003.
ANVISA – Agência Nacional de Vigilância Sanitária. Disponível em: <http://portal.anvisa.gov.br> 2014. Acesso em: 11 de outubro de 2018.
ANVISA – NOTA TÉCNICA 02/2017 – Posicionamento da Anvisa referente à Recomendação 028/2016 aprovada em Reunião Plenária do Conselho, 2017
CARDOSO, Maria Helena Wohlers Morelli; GOUVÊA, Adherlene Vieira; NÓBREGA, Armi Wanderley da; ABRANTES, Shirley de Mello Pereira – Validação de método para determinação de resíduos de agrotóxicos em tomate: uma experiência laboratorial – Ciência e Tecnologia de Alimentos, Campinas, 30 (Supl.1): 63-72, maio 2010.
CARVALHO, C.R.F., PONCIANO N.J.; SOUZA P.M. de. – Viabilidade econômica e de risco da produção de tomate no município de Cambuci/RJ, – Ciência Rural, Brasil, 2014.
CETESB (Companhia Ambiental do Estado de São Paulo) – Qualidade do solo, 2020. Disponível em: https://cetesb.sp.gov.br/solo/poluicao/ – Acessado em 09/2020.
COMMISSION DECISION No. 657/2002. Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. Off. J. Eur. Commun. L 221: 8-36.
COMMISSION REGULATION (E.C). No. 1881/2006. Setting maximum levels for certain contaminants in foodstuffs. Off. J. Eur. Commun. L364: 5-24.
CONAMA – Resolução nº 420/2009 – Disposição sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e suas providências. Disponível em: < http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=620> Acesso em: 02 jan. 2019.
CURRENCE, T.M. Tomato breeding. I. Species, origin and botanical characters. Handbuch der Pflanzenzuchtung, p. 351-369, 2013.
DIEZ, C.; TRAAG, W. A.; ZOMMER, P.; MARINERO, P.; ATIENZA, J.; J. – Extraction and chromatographic analysis of the cadusafós nematicide, chromatography, 1131, 1135 – 2006.
DONG, H.; XIAO, K. – Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce – Food Chemistry, Volume 229, Pages 502-508 – Elsevier, 2017.
DROŻDŻYŃSKI, D.; KOWALSKA, J. – Rapid analysis of organic farming insecticides in soil and produce using ultra-performance liquid chromatography/tandem mass spectrometry, Springer, Talanta, 2009.
DROŻDŻYŃSKI , D.; WALORCZYK, S.; GNUSOWSKI , B – Multiresidue determination of 160 pesticides in wines employing mixed-mode dispersive-solid phase extraction and gas chromatography–tandem mass spectrometry, Volume 85, Issue 4, Talanta – Elsevier, Pages 1856-1870, 2011.
ESALQ – Simpósio de defensivos agrícolas: tópicos relevantes e principais desafios, ESALQ / 2017
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2017.
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2018.
EMBRAPA – Manual de Procedimentos de Coleta de Amostras em Áreas Agrícolas para Análise da Qualidade Ambiental: Solo, Água e Sedimentos, 2016.
EPA (Environmental Protection Agency) – Pesticide safety for farmworkers, 2017.
FAOSTAT – Food and Agriculture Organization of the United Nations – Produtividade Mundial, 2018. Disponível em: <http://faostat.fao.org/site/340/default.aspx>. Acesso em. 28 de novembro de 2019.
FERNANDES V.C, LEHOTAY S.J, GEIS-ASTEGGIANTE L, KWON H, Mol H.G.J, van der Kamp H, MATEUS N, DOMINGUES V.F, DELERUE-Matos, C. Analysis of pesticides residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two dimensional GC-time-of-flight MS comparing organic and integrated pest management farming. Food Addit Contam. 31: 262-270, 2014.
IARC. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. WHO. World Health Organization. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 82: 183-193, 2002.
IBAMA-Ministério do Meio Ambiente: Avaliação do Potencial de Periculosidade Ambiental (PPA) de Agrotóxicos e Afins. Disponível em: Acesso em: abr. 2020.
IBGE – Indicadores / Estatística da Produção Agrícola Levantamento Sistemático da Produção Agrícola 2017-2018, 2019.
IGLESIAS, Hoshi A. – Introdução ao Acoplamento Cromatografia Líquida – Espectrometria de Massas Waters Technologies do Brasil, Barueri, SP, 2016.
INMETRO. Instituto Nacional de Metrologia, Qualidade e Tecnologia. Orientação sobre Validação de Métodos Analíticos – DOQ-CGCRE-008. Rev. 07, 28 f, jul 2018.
JUNIOR, J.C.L, – Manejo integrado de pragas na cultura do tomate: uma estratégia para a redução do uso de agrotóxicos – Extensão em Foco (ISSN: 2317-9791), 2019.
LESUEUR, A. B; KNITTL P. A ; GARTNER, M. A; MENTLER A. C, FUERHACKER M.B.- Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuECheRS method – Science Direct, 2008.
MALDANER L, JARDIM ICSF. O estado da arte da cromatografia líquida de ultraeficiência [The art state of ultra performance liquid chromatography]. Quim Nova. 32: 214-222. Portuguese, 2009.
OGIHARA, Camila Honda – Desenvolvimento e validação de método para a determinação de multirresíduos de agrotóxicos em solo empregando o método quechers e a cromatografia líquida de ultra alta eficiência acoplada à espectrometria de massas sequencial – UNICAMP, 2018.
ORTELLI, D; COGNARD, E; JAN, P; EDDER, P. Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry and Chromatography. 877: 2363–2374, 2009.
PINTO, C.G., Martín, S.H., PAVÓN, J.L.P., CORDERO, B.M., A simplified Quick, Easy, Cheap, Effective, Rugged and Safe approach for the determination of trihalomethanes and benzene, toluene, ethylbenzene and xylenes in soil matrices by fast gas chromatography with mass spectrometry detection. Anal. Chim. Acta, 689, 129-136, 2011.
PRESTES, O.D. ; Friggi, C.A.; ADAIME M.B, ZANELLA, R. QuECheRS – QuEChERS-a modern method of sample preparation for multiresidue determination of pesticides in food by chromatographic methods coupled to mass spectrometry]. Quim Nova. 32: 1620-1634. Portuguese, 2009.
RAMOS, A. M. et al. Evaluation of a modified QuEChERS method for the extraction of pesticides from agricultural, ornamental and forestal soils. Analytical and Bioanalytical Chemistry, v. 396, p. 2307-2319, 2016.
RASHID A., NAWAZ S., BARKER H., AHMAD I., AND ASHRAF M., Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry. J. Chromatogr. A, 2010, 1217, 2933-2939
RIBAS, P. P.; MATSUMURA, A. T. S. A química dos agrotóxicos: impacto sobre a saúde e meio ambiente. Revista Liberato, 2009, 10, 14, 149-158.
RUBENSAM G, Barreto F, HOFF RB, KIST TL, PIZZOLATTO, TM. A liquid–liquid extraction procedure followed by a low temperature purification step for the analysis of macrocyclic lactones in milk by liquid chromatography–tandem mass spectrometry and fluorescence detection. Anal Chim Acta. 705:24-29, 2011.
SOBER – Revista de Economia e Sociologia Rural (RESR) – Relatório – 1º Trimestre 2019, MAPA, Brasil, 2019
TSIPI, D.; BOTITSI, H.; ECONOMOU, A. Mass Spectrometry for the Analysis of Pesticide Residues and their Metabolites. New Jersey: John Wiley & Sons, 2015.
VEIGA, Denise Piccirillo – O impacto do uso do solo na contaminação por agrotóxicos das águas superficiais de abastecimento público – USP, São Paulo, 2017
APPENDICE – RIFERIMENTI A PIEDI
8. La peronospora, causata da Phytophthora infestans, è una malattia molto aggressiva nella coltura del pomodoro, in grado di decimare intere colture in un breve periodo di tempo.
9. Parametro agronomico stabilito da ANVISA in merito alla Raccomandazione 028/2016 approvata dal Consiglio Nazionale per la Sicurezza Alimentare e Nutrizionale (CONSEA) – costituisce una delle componenti per il calcolo dell’esposizione e la valutazione del rischio, che è un prerequisito per la registrazione o autorizzazione di un pesticida in nuove colture.
[1] Dottorato di ricerca in Scienze e Ingegneria Ambientale presso l’Università Federale di Rio de Janeiro/ Scuola Politecnica di Chimica/Programma di Ingegneria Ambientale (UFRJ/POLI/PEA); Master in Scienze e Ingegneria Ambientale presso l’Università Federale di Rio de Janeiro/ Scuola Politecnica di Chimica/Programma di Ingegneria Ambientale (UFRJ/POLI/PEA); Specializzazione in Didattica della Chimica (FIJ); Laurea in Licenza in Chimica presso l’Università Statale di Rio de Janeiro (UERJ).
[2] Consigliere. Dottorato di ricerca in ingegneria presso il programma di ingegneria mineraria, metallurgica e dei materiali presso l’Università federale di Rio Grande do Sul.
[3] Consigliere. PhD in Ocean Engineering presso Coppe / UFRJ; Professore associato presso la Scuola politecnica dell’Università federale di Rio de Janeiro e Pro-Rettore degli studi universitari presso UFRJ.
[4] Consigliere. Dottorato di ricerca in Scienze presso il Centro per l’energia nucleare in agricoltura / CENA – dell’Università di San Paolo.
[5] Master in sorveglianza sanitaria nella salute (FIOCRUZ / INCQS).
[6] Dottorato di ricerca in sorveglianza sanitaria nella salute (FIOCRUZ / INCQS).
[7] Dottore in sorveglianza sanitaria nella salute (FIOCRUZ / INCQS).
Inserito: dicembre 2020.
Approvato: gennaio 2021.