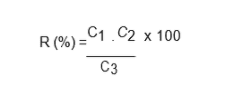ОРИГИНАЛЬНАЯ СТАТЬЯ
MAZZEI, João Roberto Fortes [1], FREIRE, Estevão [2], SERRA, Eduardo Gonçalves [3], MACEDO, José Ronaldo de [4], OLIVEIRA, Angélica Castanheira de [5], BASTOS, Lucia Helena Pinto [6], CARDOSO, Maria Helena Wohlers Morelli [7]
MAZZEI, João Roberto Fortes. Et al. Метод множественных остатков для анализа 240 пестицидов в почвах посадки томатов с помощью сверхэффективной жидкостной хроматографии в сочетании с масс-спектрометрией. Revista Científica Multidisciplinar Núcleo do Conhecimento. Год 06, изд.01, том 08, стр. 34-67. Январь 2021 г. ISSN: 2448-0959, Ссылка для доступа: https://www.nucleodoconhecimento.com.br/инженерной-экологии-ru/метод-множественных, DOI: 10.32749/nucleodoconhecimento.com.br/ru/77605
АБСТРАКТНЫЕ
В этой работе был оптимизирован аналитический метод определения остаточных количеств пестицидов в фокусе: Азоксистробин, Боскалид, Карбендазим, Хлорантранилпрол, Клотианидин, Диафентиурон, Дифеноконазол, Диметоморф, Эспинеторам, Эспинозад А, Металлэспинозад М, Факсилозад M , Тиаметоксан в почве, полученной при выращивании томатов, с целью сравнения уровней загрязнения этими соединениями в образцах почвы. Использовали модифицированный метод экстракции QuEChERS и ультраэффективную жидкостную хроматографию в сочетании с последовательной масс-спектрометрией с источником ионизации путем электронебулизации в режиме ESI (+/-). Метод заключался в экстрагировании 15,0 г почвы 15 мл насыщенного раствора гидроксида кальция pH 12,3 и 15 мл ацетонитрила с последующим разделением в эффекте «высаливания» на 6,0 г сульфата безводного магния и 1,5 г хлорида натрия. . Фазы разделяли центрифугированием при 3700 об / мин в течение 7 мин. Экстракты разбавляли MeOH марки licrossolv® и вводили в хроматограф. Метод был проверен на основе параметров линейности, LOD, LOQ, точности и точности. Линейность между 0,2 и 20,0 µg L-1, коэффициенты определения больше 0,99. Значения LOQ для этого метода составляли 13 µg kg-1 для Спинозада и 7,0 µg kg-1 для других пестицидов. Метод показал хорошую точность со значениями RSD < 20% и точность с извлечением от 70 до 120% для подавляющего большинства проанализированных соединений. Аналитические кривые были подготовлены с эталонными экстрактами белой почвы, чтобы минимизировать матричный эффект. Метод был признан подходящим для анализа остатков пестицидов в почве, поскольку он удовлетворяет параметрам валидации хроматографических методов (European Commission, 2018). После валидации метод был использован для анализа остатков этих пестицидов в образцах почвы с традиционных, органических и устойчивых плантаций томатов. Позволяет сравнивать уровни воздействия на окружающую среду. Помимо проверки аналитического метода исследования, посвященного пестицидам, также можно было проверить еще 240 соединений, как разрешенных, так и неразрешенных для использования при посадке томатов.
Ключевые слова: Загрязняющие вещества в почвах, остатки пестицидов, QuEChERS, UPLC-MS / MS.
ВСТУПЛЕНИЕ
Выращивание томатов подвержено появлению насекомых-вредителей и болезней. Данные исследования Carvalho (2017) указывают на то, что выращивание томатов уязвимо к атаке болезней, вызываемых насекомыми-вредителями, в том числе белокрылкой (Bemisia), одним из основных вредителей, поражающих помидоры. Bemisia argentifolii и Bemisia tabaci – два основных вида белокрылки, ответственные за нанесение ущерба выращиванию плодов. В работе автора были опрошены фермеры, выращивающие помидоры в муниципалитете Cambuci (Рио-де-Жанейро), в ходе которых было замечено, что около 60% плантаторов выполняют до двух применений пестицидов в неделю. В 2% случаев сеялки описали, что в зависимости от ситуации, например: при возникновении болезней или дождливой погоде необходимо большее количество обработок, которое может достигать трех раз в неделю.
Морфологически между двумя видами нет никакой разницы. Однако первый более агрессивен, поскольку, помимо того, что он более устойчив к неблагоприятным условиям окружающей среды и к некоторым традиционным пестицидам, он имеет более высокую скорость размножения, поражает большее количество растений-хозяев и успевает завершить весь свой жизненный цикл в помидор. По этой причине необходимо использовать различные пестициды для борьбы с этими и другими вредителями, поражающими плантации томатов (ESALQ, 2017).
В этой работе было решено использовать терминологию, руководствуясь бразильским законодательством – пестициды – с учетом того, что этот термин, несмотря на то, что он не охватывает по существу все используемые продукты, охватывает наибольшее количество атрибутов, необходимых для описания веществ, составляющих эту вселенную, и добавляет больше прозрачности и этичности для читателя, пользователя и потребителя продуктов, в которых используются такие соединения (SOBER, 2018).
Согласно обзору бразильского законодательства о пестицидах, опубликованному 28.06.2018 (MAPA, 2018):
Термин пестицид не используется в других странах или международных организациях, занимающихся этой темой. Комиссия Codex Alimentarius, международная справочная организация по пищевым продуктам в Соглашении Всемирной торговой организации (ВТО) о применении санитарных и фитосанитарных мер, использует английский и французский термин «агротоксичный» и испанский «plaguicida». Таким образом, необходимо изменить термин «пестицид» на «пестицид», чтобы привести законодательство Бразилии в соответствие с международной практикой.
Помидор был выбран в качестве объекта этого исследования из-за его специфических характеристик, то есть такие плантации, как томат (Solanum lycopersicum L. = Lycopersicon esculentum Mill), требуют частого внимания в отношении заражения вредителями и сорняками, что предполагает необходимость применения пестициды с большой частотой.
При контакте с почвой пестициды подвергаются физико-химическим процессам, которые ухудшают их действие в окружающей среде. В связи с необходимостью рационального использования сельскохозяйственных ресурсов для минимизации воздействия сельского хозяйства на окружающую среду, было проведено множество исследований с целью понимания поведения этих продуктов в почве. Однако о поведении этих пестицидов в тропических почвах известно немного.
ЗАГРЯЗНЕНИЕ ПОЧВ АГРОТОКСИКОМ
Согласно исследованиям Azevedo (2018), даже при более строгом контроле за применением пестицидов почва является конечным местом назначения химических веществ, используемых в сельском хозяйстве, независимо от того, вносятся ли они непосредственно в почву, на надземную часть растений или даже с фруктами в мешках. При контакте с почвой пестициды и гербициды подвергаются физико-химическим процессам, которые усиливают их действие в окружающей среде. По словам автора, из-за необходимости рационального использования сельскохозяйственных ресурсов для минимизации воздействия сельского хозяйства на окружающую среду, было проведено множество исследований с целью понимания поведения этих продуктов в почве.
Почва действует как фильтр, задерживая многие из внесенных в нее примесей. Таким образом, его качество может быть изменено за счет накопления атмосферных загрязнителей, использования пестицидов / удобрений, твердых отходов, токсичных и даже радиоактивных материалов. Когда загрязнитель достигает поверхности почвы, он может адсорбироваться; уносится ветром или сточными водами, или даже вымывается инфильтрационными водами, достигая нижних горизонтов и достигая уровня грунтовых вод. По достижении грунтовых вод эти загрязнители могут быть доставлены в другие регионы (CETESB, 2020).
Положение CONAMA (2009 г.) сообщает, что химические свойства почвы, такие как pH, содержание питательных веществ, ионообменная способность, электропроводность и органическое вещество, вместе с биологической активностью, отвечают за адсорбцию, химическую фиксацию, окисление и нейтрализацию этих веществ. загрязняющие вещества.
ПЕСТИЦИДЫ И КУЛЬТУРА ТОМАТОВ
Помидор произрастает в Южной Америке.Исторические данные показывают, что более 100 лет помидор выращивали инки и ацтеки в высокогорных районах Перу и Мексики. Согласно (CURRENCE, 2013), первыми странами, которые начали выращивать этот продукт, были Перу, Мексика, Боливия, Эквадор и Чили. Согласно отчету FAOSTAT (2018), крупнейшими производителями томатов в мире на сегодняшний день являются: Китай, Бразилия, США, Индия, Турция, Египет, Италия, Иран, Испания и Мексика.
Данные IBGE (EPAG, 2019) показывают, что в 2018 году Бразилия произвела 4084910 тонн фруктов, а в январе 2019 года – 4333609 тонн фруктов. Регионами с наибольшим объемом производства в 2018 году были: юго-восток – 1 689 558 тонн (Сан-Паулу произвел 811 100 тонн) и центрально-западный – 1 369 014 тонн (Гояс произвел 1334 500 тонн).
Для Junior (2019) не существует томата, устойчивого к большинству вредителей и болезней. По этой причине наиболее распространенным способом борьбы с этими заражениями по-прежнему является применение фунгицидов и инсектицидов, что вызывает риск заражения рабочих, остатков пестицидов в плодах, воздействия на окружающую среду и более высоких затрат.
В Бразилии в справочниках ANVISA (2018) разрешено около 500 активных ингредиентов для сельского хозяйства, бытовой химии, несельскохозяйственных целей, водных сред и консервантов для древесины. Из этого количества 119 пестицидов разрешены к применению на плантациях томатов. Один и тот же активный ингредиент может продаваться под маркировкой многих составов и торговых наименований, и обычно используется смесь, содержащая более одного ингредиента в одном и том же продукте.
Carvalho (2017) в своем исследовании упоминает, что пестициды используются при посадке томатов с целью борьбы, в первую очередь, с белокрылкой, фитофторозом [8], полым стеблем, бактериальным увяданием, минером, крупным плодоносом, черной пятнистостью. , бактериальная пятнистость и мелкий плодонос. Согласно этому исследованию, для борьбы с такими вредителями и болезнями необходимо несколько применений пестицидов. Автор отмечает, что производители ссылались на 53 различных торговых марки и в среднем 12 видов пестицидов на одну культуру. Согласно этому исследованию, фермеры чаще всего используют инсектициды и фунгициды при посадке томатов из-за болезни, называемой фитофтороз.
НАЗНАЧЕНИЕ ПЕСТИЦИДОВ В ОКРУЖАЮЩЕЙ СРЕДЕ
Использование пестицидов при традиционном выращивании томатов вызывает постоянную озабоченность из-за ущерба, наносимого окружающей среде, особенно в биотической и абиотической среде. Кроме того, среди полевых работников наблюдается ряд эффектов: слабость, тошнота, головокружение, рак, поражение печени, аллергия и другие. Таким образом, очень важно проанализировать фрукты, почву и воду с целью количественной оценки, чтобы убедиться, что они находятся в пределах максимальных пределов остатков (MПО[9]), разрешенных Anvisa, согласно (RIBAS и MATSUMURA, 2009).
РАЗРАБОТКА
МЕТОДОЛОГИЯ – ПОМЕЩЕНИЯ, ГИПОТЕЗЫ И ЭТАПЫ РАБОТЫ
ПРЕДПОСЫЛКИ
Эта работа началась со следующих предпосылок:
- Нет томатов, устойчивых к большинству вредителей и болезней;
- Почва является конечным местом назначения значительной части остатков от применения пестицидов в тех методах посадки, в которых они применяются;
- Вероятно загрязнение почвы в результате применения пестицидов на сельскохозяйственных плантациях, что может оказать воздействие на окружающую среду в биотической и абиотической среде;
ГИПОТЕЗЫ
- Пестициды, используемые в сельском хозяйстве Бразилии, не являются экологически безопасными в отношении загрязнения фруктов и почвы;
- Обычные посадки с интенсивным использованием пестицидов могут быть экологически опасными;
- В сельском хозяйстве наблюдается пробел, заключающийся в отсутствии проверенного и надежного метода определения и количественной оценки пестицидов в почве в соответствии с максимальными пределами остатков (MПО), установленными Anvisa;
- Можно использовать пестициды для посадки и хранить плоды в концентрациях, соответствующих требованиям действующего законодательства страны;
Знание остатков и загрязняющих веществ в почве важно для разработки действий по улучшению обработки и контроля в сельскохозяйственном производстве с целью сокращения таких загрязняющих веществ.
ЭТАПЫ РАБОТЫ
а) Проведение исследования: применение анкеты, состоящей из открытых ответов и множественного выбора. Это исследование было применено к плантаторам в районах, где будут собираться образцы, и позволило изучить основные продукты, используемые на их плантациях. Эти пестициды были определены как «Пестициды в центре внимания» работы.
б) Сбор образцов почвы на участках трех типов возделывания: условных; органический и устойчивый;
c) Сбор холостых контрольных образцов для испытаний – образцы почв, которые не подвергались какой-либо обработке пестицидами, представляющими интерес в данной работе;
г) Характеристика почвы с точки зрения текстуры, плодородия и химического состава – Этап проводится в сотрудничестве с лабораториями EMBRAPA SOLOS-RJ;
д) Подготовка образцов для экстракции – образцы должны иметь гранулометрию 30 меш (мелкозем), подходящую для химической экстракции – этап, выполняемый в лабораториях EMBRAPA SOLOS-RJ;
е) Анализ реальных образцов почвы, собранных в полевых условиях.
ж) Расчеты, статистическая оценка и нанесение полученных результатов на график.
Этот этап был разделен на:
- Характеристика почвы – выполняется в лабораториях EMBRAPA SOLOS;
- Определение органического вещества – Этап проводится в лабораториях EMBRAPA SOLOS;
- Химический анализ для определения питательных микроэлементов почвы – Этап выполняется в лаборатории FERTIMOVEL (EMBRAPA SOLOS);
- Экстракция, Clean-up, адекватность и оптимизация метода QuEChERS для определения остатков пестицидов в образцах почвы с помощью жидкостной хроматографии сверхвысокого разрешения в сочетании с последовательной масс-спектрометрией – этап, выполняемый в лабораториях INCQS – FIOCRUZ.
ПЕСТИЦИДЫ, ОТБРАННЫЕ ДЛЯ ИССЛЕДОВАНИЯ
В исследовании, проведенном с сеялками, было замечено, что основными продуктами, используемыми на их плантациях, были: абамектин, ацибензолар-S-метил, азоксистробин, циромазин, диафентиурон, мандипропамида, пиметрозина, тиаметоксан. Таким образом, было решено сначала адаптировать аналитический метод для определения остатков этих «пестицидов-фокусов» в почве от выращивания томатов. Исследование проводилось с использованием плантаторов из северного региона Рио-де-Жанейро (Рио-де-Жанейро), крупного производителя томатов, распределенного по трем системам выращивания, изученным в этой работе (традиционным, органическим и устойчивым).
МЕТОД ДОБЫЧИ (QUECHERS)
Метод извлечения QuEChERS (с английского Quick, Easy, Cheap, Effective, Rugged and Safe) был исследован и представлен научному сообществу ANASTASSIADES et al. (2003), направлена на устранение практических ограничений методов извлечения множества отходов, существовавших до того времени. Основное отличие этого метода заключается в том, что он быстрый, простой, экономичный, эффективный, надежный и безопасный, как следует из названия QuEChERS. Diéz et al. (2006) отмечают, что этот метод был разработан для проб, содержащих более 75% воды.
БИБЛИОГРАФИЧЕСКИЙ ИССЛЕДОВАНИЕ МЕТОДА КУЧЕРА, СООТВЕТСТВУЮЩЕГО ХРОМАТОГРАФИИ ДЛЯ ОПРЕДЕЛЕНИЯ ПЕСТИЦИДОВ – ХРОНОЛОГИЧЕСКАЯ ЭВОЛЮЦИЯ
Lesueur et al. (2008) исследовали изменения в QuEChERS при анализе 105 пестицидов с помощью газовой хроматографии в сочетании с масс-спектрометром (CG-EM) и 46 пестицидов с помощью сверхэффективной жидкостной хроматографии в сочетании с последовательной масс-спектрометрией (CLUE-EM / EM) после экстракции методом QuECheRS в четыре матрицы (виноградная, лимонная, луковая и томатная).
Drożdżyński et al. (2009) исследовали 3 экологических инсектицида (азадиратин, спиносад и ротенон) в образцах почвы, капусты и томатов, используя модифицированный метод QuEChERS, с последующим определением уровней с помощью CLUE-EM / EM.
Chen et al. (2010) выполнили модификацию метода QuEChERS для определения процимидона в образцах почвы и лука-порея, дополнив работу количественной оценкой с помощью GC-MS.
Rashid et al. (2010) проанализировали 19 пестицидов из группы хлорорганических соединений в почвах, применив модифицированный метод QuEChERS и метод clean-up, состоящий из разделения жидкость-жидкость с помощью н-гексана. Процедура была утверждена для определения 19 хлорорганических пестицидов, гексахлорбензола (HCB), α-HCH, β-HCH, γ-HCH, гептахлора, эпоксида гептахлора (транс), альдрина, дильдрина, хлордана (транс), хлордана (цис). , оксихлордан, α-эндосульфан, β-эндосульфан, сульфат эндосульфана, эндрин, p, p’-DDT, o, p’-DDT, p, p’-DDD и p, p’-DDE.
Shi et al. (2010) предложили модифицированный метод QuEChERS для анализа остатков оксадиагила в образцах почвы, воды, риса и рисовой соломы с количественной оценкой методом GC-ECD.
Pinto et al. (2010) исследовали еще более упрощенную версию метода QuEChERS, чтобы проанализировать три хлорорганических соединения (гексахлорбензол; 1,2-дихлорбензол и хлороформ) в образцах почвы с последующим количественным определением с помощью GC-µECD. В работе авторы использовали три различных типа почв: садовую, с высоким содержанием органического вещества; вертизол с высоким содержанием глины; и сертифицированный эталонный осадочный материал (глинистая почва).
Martins (2010) использовал метод QuEChERS – определение остатков пестицидов в орошаемой почве рисовых культур с использованием квечеров, модифицированных насыщенным раствором гидроксида кальция, и LC-MS/MS для определения остатков кломазона, фипронила, имазапика, имазетапира, пропиконазола, Тиаметоксам и трифлоксистробин.
Ramos et al. (2010) разработали модифицированный метод QuEChERS для определения 11 пестицидов в трех типах почв (лесных, декоративных и сельскохозяйственных). Модифицированная версия метода QuEChERS была разработана для определения уровней фосфорорганических пестицидов (этопрофос, диметоат, диазинон, малаоксон, хлорпирифосметил, фенитрион, малатион, хлорпирифос, фенамифос и фосмет) и пестицидов тиадиазинового класса (бупрофезин). пользователя GC-NPD.
Drożdżyński et al. (2011) определили 160 пестицидов в винах, используя дисперсную твердофазную экстракцию в смешанном режиме и CG-EM.
Costa (2012) провел исследование метода QuEChERS для определения нескольких остатков пестицидов в персиках в сиропе. LOQs пестицидов в этом исследовании варьировались от 1,0 до 10,0 μg.kg-1 и основывались на кривой для мониторинга эффективности метода и линейности. По словам автора, аналитические кривые показали значения r больше 0,99; со значениями извлечения для осушенных персиков от 83,4 до 120,4% с RSD менее 14,9% для большинства аналитов и от 68,6 до 124,6% с RSD менее 19,8%.
Исследования Tsipi et al., (2015) направлены на количественное определение остатков метаболитов 2,4-D с помощью жидкостной и газовой хроматографии в сочетании с масс-спектрометром.
Ramos et al. (2016) указывают, что метод QuEChERS использовался только 8 раз при экстракции пестицидов в почве, и что в большинстве случаев применялась газовая хроматография с обнаружением масс-спектрометрии (CG-EM), за исключением трех случаев, когда газовая хроматография с Применялись детекторы электронного захвата (CG-DCE); Азот и фосфор (CG-DNF) и обнаружение микроэлектронного захвата (CG-DμCE).
Dong et al. (2017) определили остатки метафлумизона в образцах почвы и капусты, используя метод QuEChERS. Авторы сообщают, что значения извлечения между 77,6 и 87,9% были получены для метафлумизона в почвах и капусте с относительным стандартным отклонением (RSD) 3,5 и 7,9%. Значения LOD и LOQ метода для тех же образцов составляли 0,001 mg.kg-1 и 0,004 mg.kg-1 соответственно.
Согласно Iglesias (2016), процесс сочетания жидкостной хроматографии с масс-спектрометрией происходил очень медленно из-за несовместимости между высокими скоростями потока, используемыми в части HPLC, что затрудняло перенос элюента хроматографической колонки непосредственно в источник спектрометр, работающий в высоком вакууме. Решив эти трудности, жидкостная хроматография с сопряженным интерфейсом масс-спектрометрии (LC-MS) все чаще используется в качестве превосходного метода для определения различных остатков аналитов.
Ogihara (2018) применил метод QuEChERS и ультраэффективную жидкостную хроматографию в сочетании с последовательной масс-спектрометрией для определения многоостаточных пестицидов в почве. В своей работе три версии метода QuEChERS: «Исходный», «Ацетатный» буфер и «Цитратный» буфер были оценены в отсутствие и при наличии этапа очистки при экстракции пестицидов из почвы и UHPLC-MS/MS с добавлением внутреннего стандарта трифенилфосфата при их количественном определении и подтверждении. Разработанный метод был направлен на корреляцию определенных физических и химических свойств 20 пестицидов, выбранных автором, с их соответствующим временем для рассеивания их в окружающей среде в присутствии и отсутствии света.
Все эти исследования привели к выводу, что классические методы определения пестицидов в почвах не рентабельны, так как это процедуры, требующие многих этапов, обычно основанных на исчерпывающем извлечении матрицы, с последующими этапами очистки. План удаления соэкстрагированных материалов перед инструментальным анализом.
ВЫБОР ОБРАЗЦОВ ДЛЯ ЭТАПА ВАЛИДАЦИИ
На этапе проверки использовались образцы белой почвы, которые не подвергались никакой обработке пестицидами до и во время посадки. После хроматографического определения эти образцы не содержали пестицидов и не демонстрировали хроматографического сигнала при временах удерживания, аналогичных таковым для соединений, представляющих аналитический интерес.
Почва, использованная в исследованиях, была классифицирована как эвтрофная ареническая гидроморфная планоссоло, принадлежащая картографической единице в муниципалитете Тангуа в муниципалитете Рио-де-Жанейро. Рельеф района равнинный или полого волнистый, с субстратом из современных аллювиальных отложений.
Физические и химические свойства этой почвы: pH воды (1: 1) = 4,8; P = 6,0 mg L-1; К = 120 мг L-1; глина = 26%; М.О. = 2,3%; Ca = 5,0 смоль / L-1; Mg = 2,0 смоль L-1; Al = 1,7 смольц L-1 и индекс SMP 5,1
РЕАГЕНТЫ, РАСТВОРИТЕЛИ И ГАЗЫ
Ацетон П.А.; Ацетонитрил – УВЭЖХ; Безводный сульфат магния; Натрия хлорид П.А.; PSA – УВЭЖХ; Дистиллированная вода; Сверхчистая вода, очищенная в системе Milli-Q-Plus; Синтетический воздух чистотой 99,9%; C18 – Картриджи для SPE; Натрия хлорид; Дихлорметан – Ultra Resi-Analyzed; Etanol; Этанол-УФ-ИК-ВЭЖХ; Экстран нейтральный; ац аргон, аналитический, используемый в качестве газа столкновений в системе CLUE-MS / MS; Газообразный азот, используемый в качестве газа для десольватации в источнике electrospray; Метанол – УФ-ИК-ВЭЖХ; Сорбент Bondesil PSA с размером частиц 50 мкм;
ОБОРУДОВАНИЕ
Шейкер Marconi Модель M227; Fanem Greenhouse Model F 330; Вихревой шейкер IKA, модель MS 3 Digital; Точные аналитические весы; Метлер Толедо; Модель XP205; серийный номер B018030980; Точные аналитические весы; SARTORIUS Модель SARTORIUS – серийный номер 71205517; Центрифуга; Eppendorf, модель 5810R; Автоматические микропипетизаторы Eppendorf с регулируемой производительностью; pH-метр Metler Toledo S 220; Система очистки воды Milli-Q производства MilliPore; Жидкостный хроматограф Waters Acquity Ultraperformance LC; Последовательный масс-спектрометр Four Premier Model XE.
ОПТИМИЗАЦИЯ МЕТОДА – УСЛОВИЯ ХРОМАТОГРАФИИ И МАСС-СПЕКТРОМЕТРА
Анализ выполняли с использованием системы Acquity UPLC®, соединенной с Quattro Premier XE® (Waters Corp., Ma, USA).
Система Acquity UPLC®, состоящая из бинарного насоса, автоматического пробоотборника и термостата для колонок.
Хроматографическое разделение выполняли на колонке Waters Acquity BEH UPLC® C18 (100 x 2,1 мм ID, 1,7 мкм). Составы подвижной фазы A (5 мМ аммонийный формат + 0,01% муравьиной кислоты, pH 4,00) и подвижной фазы B (ацетонитрил: подвижная фаза A, 95: 5), градиент: 0-1 мин (10% B); От 1 до 5,5 мин (55% B); От 5,5 до 10,5 мин (100% B); 12 мин (10% В). Используемая скорость потока составляла 0,3 мл мин-1, температура термостата колонки составляла 30 ° C, температура автосэмплера составляла 25 ° C.Инжектор был настроен на ввод полного контура 10 µL, а общее время выполнения составляло 12 мин.
Масс-спектрометр Quattro Premier XE® работал с источником ионизации электрораспылением в положительном режиме (ESI+). Рабочие параметры были скорректированы для следующих условий: капиллярное напряжение: 3,5 kV; температура источника ионов: 120 ° C, температура десольватации: 450 ° C; конусный газовый поток (N2): 20 L.h-1; расход газа десольватации (N2): 500 L.h-1; поток газа для столкновения (Ar): 0,15 мл.мин-1. Конические напряжения, энергии столкновения и переходы количественной оценки и подтверждения для каждого аналита были установлены путем прямого вливания раствора 1 мкг · мл-1. Инфузия аналитов выполнялась с подвижными фазами A и B (1: 1) со скоростью потока 0,1 мл / мин в режиме полного сканирования. После настройки этих параметров был использован метод мониторинга множественных реакций (MMP), используемый для идентификации и количественного определения аналитов.
Выбор подвижной фазы, режима ионизации (положительный ESI), количественных и подтверждающих переходов был сделан в соответствии с литературой (Aguilera-Luiz et al., 2011; Rubensam et al., 2011) и химическими характеристиками аналитов. Некоторые параметры, используемые в системе Quattro Premier XE®, такие как капиллярное натяжение; температура источника ионов; Температура десольватации, среди прочего, была установлена во время калибровки прибора производителем. Ионы-предшественники каждого аналита наблюдали путем прямой инфузии. В большинстве случаев наблюдался протонированный ион [M+ H]+.
АНАЛИТИЧЕСКИЕ СТАНДАРТЫ
Аналитические стандарты исследуемых пестицидов и приготовления рабочих растворов (исходных растворов обогащения).
Аналитические стандарты для используемых пестицидов были приобретены у компании AccuStandart. Таблица 1 показывает степень чистоты (%) и класс твердых аналитических стандартов, использованных для разработки этой работы.
Таблица 1 – Твердые аналитические стандарты, используемые в работе
| АГРОТОКСИЧНЫЙ | ЧИСТОТА (%) |
| Азоксистробин | 99,4 |
| Boscalida | 95,5 |
| Карбендазим | 98,7 |
| Хлорантранилипрол | 98,4 |
| Клотианидин | 96,5 |
| Диафентиурон | 99,9 |
| Дифеноконазол | 100 |
| Диметоморфе | 98 |
| Эспинеторам | 96,8 |
| Спиносад | 96,6 |
| Фенурон | 98 |
| Имидаклоприд | 99,5 |
| Индоксакарб | 97,3 |
| Металаксил М | 98 |
| Метоксифенозид | 99,5 |
| Тиаметоксам | 100 |
Источник: AccuStandart in New Haven, Connecticut, USA – 2018
С этими стандартами был приготовлен основной раствор для обогащения, содержащий аналиты. Этот раствор действителен только в течение одного месяца и должен храниться в янтарной колбе с пробкой и тефлоновой крышкой при -18ºC в очень холодных условиях.
Вся стеклянная посуда, используемая для приготовления растворов и анализов, такая как пипетки, мерные колбы, химические стаканы и т. Д., Была должным образом откалибрована и идентифицирована, чтобы избежать ошибок определения объема.
Первоначально готовили 10 мл исходного аналитического раствора 1000 мг.L-1 каждого пестицида. Стандарты растворяли в 0,02% метаноле в ледяной уксусной кислоте, которые являются теми же компонентами подвижной фазы, которые используются в жидкостной хроматографии, которая будет анализировать соединения, и исходные растворы хранили в янтарных колбах при температуре -18 ºC.
Методом последовательных разведений были приготовлены индивидуальные аналитические растворы для каждого исследуемого пестицида в концентрации 100 мг.L-1 с теми же растворителями. Из этих растворов была приготовлена смесь с концентрацией 10 мг.L-1, содержащая все пестициды. Наконец, из стандартного раствора 10 мг.L-1 была приготовлена смесь с концентрацией 0,200 мг.L-1, содержащая все пестициды.
Исходя из промежуточной смеси 1,0 мг L-1, готовили аналитические рабочие растворы с концентрацией 0,4; 2.0; 4.0; 10,0; 20,0 и 40,0 µg.L-1, содержащего все пестициды в каждой концентрации, для построения калибровочной кривой жидкостного хроматографа. Для инъекции в системе UHPLC-MS / MS разбавления производили в соотношении 1: 1 (об. / Об.) Этих растворов в подвижной фазе метанол / вода, так что конечные концентрации оцениваемых рабочих растворов составляли 0,2; 1.0; 2.0; 5.0; 10,0 и 20,0 µg.L-1 для всех пестицидов, входящих в состав основного раствора обогащения. Разбавления аналитических растворов в подкисленной подвижной фазе направлены на повышение эффективности ионизации аналитов, улучшение хроматографического сигнала, формы и симметрии пиков. Эти рабочие растворы были использованы для исследования линейности метода. Все растворы хранили в янтарных бутылях при -18 ºC.
ПРОВЕРКА МЕТОДА
Параметризация, принятая для валидации аналитического метода, заключалась в проверке характеристик. Таким образом, такие параметры, как аналитическая кривая и линейность, предел обнаружения, предел количественной оценки, точность (восстановление) и прецизионность (повторяемость и промежуточная точность), стали эталоном для получения надежных результатов.
ОПРЕДЕЛЕНИЕ ПОЧВЫ БЕЛАЯ REFERENCE
Из-за сложности матрицы и низких уровней концентрации пестицидов в почве (порядка от частей на миллион до частей на миллиард) подготовка образца была важна для получения надежных результатов.
Самым сложным шагом было получить образец белой почвы, свободной от пестицидов, который мог бы служить нулевым эталоном для исследований. Эта почва предназначалась для заражения пестицидами для последующей оптимизации с помощью метода QuEChERS.
Для проверки белой почвы образец почвы с кодом A1BR05 использовался в двух вариантах:
ЛЕЧЕНИЕ 01
В 5 пробирках центрифуги Falcon на 50 мл взвешивали 15 г почвы и проводили обработку 01 на основе оригинального метода QuEChERS original: 15 г почвы + 5 мл H2O; вортекс 30 сек, 1 мл Суррогат (пропоксур 1,0 µg / мл); вихрь 30 сек; 15 минут ожидания; 15 мл ACN для UHPLC; Вортекс 30 сек; 6 г MgSO4 + 1,5 г NaCl; Центрифугирование (7 мин); экстракция супернатанта и разбавление метанолом RP 1: 1 для инъекции в жидкостной хроматограф.
В качестве маркера использовали раствор пропоксура 1,0 µg.мл-1 (Surrogate). Если на белой хроматограмме отсутствуют пики, необходимо убедиться, что система проявляет чувствительность к соединениям, и пропоксур является соединением, которое дает эту уверенность.
ЛЕЧЕНИЕ 02
Также была протестирована обработка модифицированным методом раствором гидроксида кальция с pH = 12,6, чтобы получить лучший задний слой образцов по отношению к почвенной матрице следующим образом:
В 5 пробирках центрифуги Falcon на 50 мл взвешивали 15 г почвы и проводили обработку 02 – 15 г почвы + 5 мл H2O; вихрь 30 сек; 1 мл суррогатной матери; вихрь 30 сек; 5 мл раствора Ca(OH)2 pH 12,6; 5 минут ожидания; 15 мл ACN для UHPLC; вихрь 30 сек; 6 г MgSO4 + 1,5 г NaCl; центрифугирование (7 мин); экстракция супернатанта и разбавление метанолом RP 1; 1 для инъекции в жидкостной хроматограф.
Было показано, что образцы почвы A1BR05 не содержат пестицидов в обоих вариантах обработки. С этого этапа образец A1BR05 стал эталонным белым грунтом данной работы.
Две предыдущие обработки были использованы для образцов почвы, названных с помощью раствора для обогащения, содержащего интересующие аналиты.
Первоначально метод был оптимизирован для извлечения основных пестицидов: азоксистробина, боскалида, карбендазима, хлорантранилпрола, клотианидина, диафентиурона, дифеноконазола, диметоморфа, эспинеторама, эспинозада A, эспинозада D, культуризона, образцов из почвы, фенаклоридона путем определения с помощью UHPLC-MS/MS (Ультраэффективная жидкостная хроматография), который требует, чтобы матрица была чистой, минимизируя фоновые помехи (эффект матрицы – backgroud). Таким образом, обработки 1 и 2 были отправными точками для извлечения этих пестицидов из почвенной матрицы.
В обоих случаях экстракты были очень прозрачными. Даже в этом случае фракции из каждого из вышеупомянутых тестов были протестированы на стадии дисперсионной очистки. На этом этапе была протестирована дисперсионная экстракция в твердой фазе очистки PSA, в результате чего было произведено еще 4 обработки, всего 8 различных тестов.
Экстракт фильтровали через мембрану из PTFE, а затем 1 мл экстракта переносили в мерную колбу, растворяли в 1 мл метанола и этот конечный раствор переносили в хроматографическую колбу. С этого момента по 5 микролитров каждого образца дважды вводили в жидкостной хроматограф сверхвысокой производительности, соединенный с масс-спектрометром. Испытания проводились в двух экземплярах, результаты представлены в таблице 2.
Таблица 2 – Результаты обработок 1 и 2 анализа пестицидов-фокус с помощью ультраэффективной жидкостной хроматографии
| Активный принцип | Коэффициент извлечения без clean-up (%) | Фактор восстановления Пост clean-up (%) | ||
| Уход 01 | Уход 02 | Уход 01 | Уход 02 | |
| Абамектин | 88/115 | 65/70 | 97,5 | 115 |
| Диафентиурон | 43/37 | 67/72 | 53 | 81,2 |
| Азоксистробин | 101/100 | 93/94 | 162,5 | 160 |
| Пиметрозин | 30/28 | 81/75 | 30 | 120 |
| Ацибензолар-S-метил | 138/131 | 36/38 | 162 | 47,5 |
| Мандипропамид | 108/109 | 110/102 | 180 | 162 |
| Циромазин | 60/61 | 81/80 | 95 | 125 |
| Метомил | 108/116 | 107/105 | 177 | 225 |
| Пиметрозин | 30/28 | 81/75 | 45 | 120 |
| Ацетамипридо | 103/104 | 99/103 | 167 | 155 |
| Бупрофезина | 98/97 | 96/96 | 167 | 166 |
| Люцифенурон | 68/67 | 64/63 | – | – |
| Тиаметоксам | 104/98 | 70/69 | 165 | 112 |
Источник: разработка авторов.
Обработка раствором гидроксида кальция (pH = 12,3) показала лучшие коэффициенты восстановления для большинства аналитов, за исключением ацибензолар-S-метил, который не восстановился ни при одной из обработок. Возможно, это связано с метилированием структуры соединения серы, что затрудняет его извлечение в ацетонитриле. Таким образом, проверка продолжилась на основе лечения 02.
КОНТРОЛЬНЫЕ ИСПЫТАНИЯ ДЛЯ ОЦЕНКИ ТОЧНОСТИ МЕТОДА
Для изучения точности этого аналитического метода были проведены испытания обогащения с целью проверки коэффициента извлечения исследуемых соединений. Таким образом, было проведено пять усилений эталонных белых образцов при двух различных уровнях концентрации, всего было проведено 10 тестов.
Каждый уровень обогащения вводился дважды, всего n = 10 (5 экстракций x 2 инъекции).
Для процедуры экстракции модифицированным методом QuEChERS 15,00 г гомогенной почвы взвешивали в полипропиленовых пробирках (типа Falcon) с завинчивающейся крышкой (вместимостью 50 мл). Затем каждый образец увлажняли 5 мл воды Milli-Q и интенсивно перемешивали в течение 30 секунд в Vortex. Обогащение добавляли на обоих уровнях с помощью калиброванных пипеток на 0,5 мл и 1,0 мл в концентрациях: 0,200 µg.мл-1 для всех пестицидов, содержащихся в растворе для обогащения.
После обогащения образцы гомогенизировали путем встряхивания в течение 30 секунд и выдерживали при 20 °C в течение 15 минут. Исследования PINTO et al. (2010), указывают на то, что важно, чтобы у образца с аналитами было достаточно времени, чтобы растворитель испарился и, таким образом, было более тесное взаимодействие между соединениями и матрицей. По словам автора, этот шаг приближает тест к реальности взаимодействия, которое происходит с образцами в полевых условиях.
Затем с помощью мерной пипетки вводили 5 мл насыщенного раствора гидроксида кальция с pH 12,3 в каждую пробирку, и после их закрытия проводили встряхивание в течение 30 секунд. Дать ему прореагировать в течение 10 минут в состоянии покоя. Затем 15 мл ацетонитрила марки Lichrosolv (для анализа остатка) добавляли в каждую пробирку и снова перемешивали в течение 30 секунд.
1,5 хлорида натрия (NaCl) и 6,0 г MgSO4 (безводный сульфат магния) добавляли в каждую пробирку и встряхивали в течение дополнительных 30 секунд, чтобы получить максимально возможное взаимодействие между жидким экстрактом и твердыми реагентами. Наконец, пробирки центрифугировали в течение 7 минут при 3000 об / мин.
Во флаконе вместимостью 2 мл проводили разбавление 1: 1 (об. / Об.), В которое добавляли 1,0 мл экстракта, полученного после экстракции, и 1,0 мл подвижной фазы с последующим анализом с помощью LC-MS/MS.
Наконец, разведения конечных экстрактов были выполнены в соотношении 1: 1 (об. / Об.) В подвижной фазе (сверхчистая вода). Извлечение соединения оценивалось при концентрациях 1 и 2 мкг / кг почвы для всех пестицидов в растворе для обогащения.
Результаты выздоровления были интересными в обоих случаях. Однако обработка 02 оказалась более эффективной при извлечении большего количества пестицидов с извлечением в диапазоне от 64 до 110%, за исключением ацибензолар-S-метил, восстановление которого было более выраженным при обработке 1.
Результаты экспериментов по оценке наилучшего метода экстракции и очистки показаны в Таблице 1 – Тесты, проведенные для оптимизации этапа экстракции.
Этап очистки не показал значительного улучшения результатов. Таким образом, было решено перейти к этапу валидации с использованием обработки 02 без этапа очистки.
ОПТИМИЗАЦИЯ МЕТОДА.
Метод экстракции был оптимизирован в соответствии с Аналитическим руководством по обеспечению качества. Значения, установленные в этом руководстве, соответствуют требованиям Решения 2018/657 (European Comission/SANTE, 2018).
Оценивались следующие параметры: селективность; матричный эффект; линейность; восстановление; предел обнаружения (LOD); предел количественного определения (LOQ) и повторяемость. Расчеты проводились с использованием программ MassLynx® и Microsoft Excel®. В предлагаемом способе селективность оценивали путем анализа пяти повторностей отбора проб экстрактов почв томатов. Оценка линейности включала построение аналитической кривой для растворителя из рабочего раствора MIX 1, содержащего 295 аналитов, с пятью точками, соответствующими 0, 0,5, 1,0, 1,5 и 2,0 раза выше MRL, установленного для каждого аналита. Тест Кохрана использовался для оценки однородности вариаций, полученных для каждого уровня концентрации. Калибровочные данные оценивали с помощью обычной линейной регрессии в случае гомоскедастичности или взвешенной линейной регрессии в случае гетероскедастичности.
Для извлечения образцов использовалась та же эталонная почва из первоначальных испытаний. В предлагаемом методе селективность оценивали путем анализа пяти повторностей проб экстрактов из почвы плантации томатов. В 10 центрифужных пробирках типа Falcon взвешивали 15 г и добавляли 1 мл рабочего раствора. В пробирки с номерами 1 и 5 добавляли 1 мл раствора для обогащения с рабочими растворами уровня 1 в каждую пробирку, а в пробирки с номерами от 6 до 10 добавляли 1 мл раствора для обогащения с рабочими растворами уровня 2 в каждую пробирку, кроме того в пустую пробирку, без обогащения, с контролем качества пропоксура. В 11 пробирок прошли все этапы, которые использовались для обработки 2, после чего 1 мл экстракта переносили в колбу и наносили 1 мл MeOH (компонент подвижной фазы). Затем 5 5µL вводили в жидкостной хроматограф Ultra Performance, соединенный с последовательным масс-спектрометром, в тех же условиях, что и для тестов 3 и 4 обработки 2. Каждый образец вводили в пяти повторностях, как рекомендовано в Guia Sante (2018) для проверки достоверности хроматографические методы.
Эффект матрицы оценивали путем сравнения наклона аналитической кривой в экстракте матрицы с наклоном аналитической кривой в растворителе, используя F-тест (Fisher Snedecor). Затем был применен t-критерий Стьюдента для определения статистической эквивалентности наклона аналитических кривых в растворителе и в матрице.
LOD и LOQ были рассчитаны с использованием отношения сигнал / шум оборудования. LOD был концентрацией, эквивалентной трехкратному шуму, а LOQ был концентрацией, эквивалентной шестикратному шуму. Восстановление и воспроизводимость метода были выполнены с образцами почвы с пиками двух уровней: от 0,5 до 1,0, что эквивалентно 5-кратному MRL каждого аналита, с пятью повторениями для каждого уровня. Среднее восстановление и относительное стандартное отклонение (RSD) были рассчитаны для каждого уровня. Анализ образцов. Полевые образцы были любезно предоставлены производителями в штате Рио-де-Жанейро, Бразилия, и были проанализированы с использованием утвержденного метода.
Метод QuEChERS, модифицированный гидроксидом кальция, показал лучшие результаты восстановления, чем исходный метод QuEChERS для большинства аналитов, в основном для абамектина, ацетамиприда, азоксистробина, бупрофезина, диафентурона, мандипропамида, пиметрозина, циромазина, метомила, пиметрозина и люциаменурона. При использовании модифицированного метода (метод QuEChERS с Ca (OH)2) полученные значения извлечения находились в приемлемом диапазоне 70-120% (ANVISA, 2018). Лечение 2 дало только один результат восстановления за пределами допустимого диапазона 80-110%, ацибензолар-S-метил (37%). Стадия clean up ,с дисперсионным SPE не способствовала значительному увеличению извлечения. Стадия очистки SPE оказалась ненужной, поскольку первый полученный экстракт был прозрачным и показал приемлемую степень извлечения интересующих соединений, как показано в таблице 2.
Таким образом, метод экстракции, выбранный в соответствии с процессом проверки, был методом, основанным на обработке 2 (QuEChERS с гидроксидом кальция) без этапа очистки SPE с использованием MgSO4, PSA и C18.
Точность рассчитывалась с использованием следующего уравнения и выражалась в процентах извлечения (INMETRO, 2007):
C1 = Концентрация, определенная в обогащенном образце;
C2 = Концентрация, определенная в не обогащенном образце;
C3 = Концентрация, используемая для обогащения.
Не было никакого вмешательства в те же m/z и время удерживания аналитов в пяти повторениях, выполненных с матричным экстрактом. Таким образом, удалось добиться селективности метода. Рабочий лист для оценки аналитической кривой – Подтверждение метода множественных отходов с помощью CLUE-EM / EM показан на рисунке 1.
Рисунок 3 – Данные по оценке аналитической кривой – Проверка метода множественных остатков с помощью CLUE-EM / EM
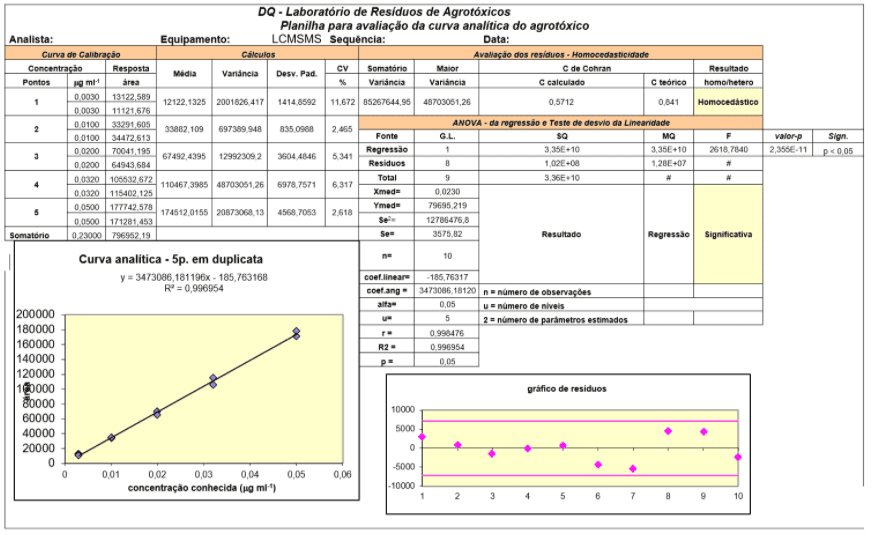
Рабочие характеристики оптимизированного метода, рабочий диапазон, значения коэффициентов корреляции (r) и детерминации (R2) для аналитических кривых, полученных для каждого аналита, показаны в таблице 3.
Таблица 3 – Сводка результатов оценки – Коэффициенты корреляции (r) и детерминации (R2)
| Вещество | ПРОВЕРКА АНАЛИТИЧЕСКОЙ КРИВОЙ | |
| r | R2 | |
| Вещество | 0,9995 | 0,9989 |
| Boscalida | 0,9982 | 0,9964 |
| Карбендазим | 0,9996 | 0,9993 |
| Хлорантранилипрол | 0,9996 | 0,9991 |
| Клотианидин | 0,9963 | 0,9925 |
| Диафентиурон | 0,9993 | 0,9986 |
| Дифеноконазол | 0,9988 | 0,9975 |
| Диметоморфе | 0,9991 | 0,9982 |
| Эспинеторам | 0,9973 | 0,9947 |
| Спиносад | 0,9987 | 0,9974 |
| Фенурон | 0,9986 | 0,9973 |
| Имидаклоприд | 0,9995 | 0,9990 |
| Индоксакарб | 0,9981 | 0,9961 |
| Металаксил М | 0,9998 | 0,9997 |
| Метоксифенозид | 0,9969 | 0,9939 |
Источник: разработка авторов.
Эффект матрицы не оценивался для проверки почвы, так как он считается значимым для всех изученных пестицидов.
Все анализируемые вещества демонстрировали гомоскедастическое поведение в рабочем диапазоне от 0,0032 до 0,0500 µg/мл.
Замечено, что для большинства аналитов коэффициенты определения (r2) были близки к единице, показывая хорошую линейность, указывая на профиль гомоскедастической дисперсии (постоянное изменение экспериментальных ошибок для разных наблюдений) для большинства аналитов, что позволяет оценивать стандартные кривые с помощью линейная регрессия с использованием метода обычных наименьших квадратов. Взвешенные линейные корректировки (1 / x) были сделаны с использованием программного обеспечения MassLynx®. Значения Стьюдента, рассчитанные для матричного эффекта, находились в пределах значений, требуемых Руководством SANTE для большинства аналитов. Таким образом, кривая в матричном экстракте использовалась для количественной оценки образцов, включая аналиты, в которых матричный эффект не наблюдался. Значения, полученные для LOD и LOQ, а также отношения сигнал / шум (Таблица 4), соответствовали критериям, установленным Национальным агентством по надзору за здоровьем (ANVISA, 2018) для этих аналитов, подтверждая, что оптимизированный метод адекватен соблюдать действующее законодательство Бразилии. Однако для соответствия европейскому законодательству полученные LOD и LOQ необходимо пересмотреть, так как они очень близки к установленному максимальному уровню (EUROPEAN COMMISSION, 2018).
Таблица 4 – Вещества, проверенные в матрице почвы, с соответствующими пределами количественного определения и соответствующим соотношением сигнал / шум
| Вещество | ПРОВЕРКА АНАЛИТИЧЕСКОЙ КРИВОЙ | |
| LOQ (мг / кг) | Коэффициент сигнала/Шум | |
| Азоксистробин | 0,0066 | 538,39 |
| Boscalida | 0,0076 | 30,11 |
| Карбендазим | 0,0055 | 166,53 |
| Хлорантранилипрол | 0,0075 | 276,84 |
| Клотианидин | 0,0064 | 496.4 |
| Диафентиурон | 0,0038 | 72,37 |
| Дифеноконазол | 0,0077 | 38,83 |
| Диметоморфе | 0,0072 | 27,62 |
| Эспинеторам | 0,0074 | 10729,08 |
| Спиносад | 0,0078 | 1757,72 |
| Фенурон | 0,0080 | 1630,64 |
| Имидаклоприд | 0,0132 | 207,19 |
| Индоксакарб | 0,0062 | 171,61 |
| Металаксил М | 0,0072 | 1104,23 |
| Метоксифенозид | 0,0074 | 327,56 |
Источник: разработка авторов.
Было возможно установить LOQ для веществ на утвержденном уровне обогащения, поскольку они имели отношение сигнал / шум более 10.
ТОЧНОСТЬ (СКОРОСТЬ ВОССТАНОВЛЕНИЯ) И ТОЧНОСТЬ (ВОЗМОЖНОСТЬ)
Для изучения скорости восстановления и воспроизводимости образец почвы A1BR05 был обогащен различными объемами основного раствора обогащения, составляющего смесь представляющих интерес пестицидов, в пяти повторностях, после экстракции объем 1 мл был удален. и разбавляли 1: 1 метанолом (MeOH) для дальнейшего хроматографического анализа с помощью UHPLC-MS / MS. Эта концентрация обогащения соответствует теоретической концентрации LQ. Каждую повторную инъекцию вводили дважды.
Концентрации впрыска:
– Уровень 1: 0,00323 µg/мл, что соответствует 0,0067 мг / кг,
– Уровень 2: 0,00625 µg/мл, что соответствует 0,0133 мг / кг,
Результаты, полученные по точности – восстановлению, представлены в таблице 5.
Таблица 5 – Результаты, полученные по точности – Восстановление
| Вещество | ПРОВЕРКА АНАЛИТИЧЕСКОЙ КРИВОЙ | ||||
| Уровень 1 | Уровень 2 | ||||
| Вывод. (mg kg-1) | Rec. (%) | Вывод. mg kg-1) | Rec. (%) | ||
| Азоксистробин | 0,0066 | 95,4 | 0,0142 | 106,3 | |
| Boscalida | 0,0076 | 111,5 | 0,0149 | 110,5 | |
| Карбендазим | 0,0055 | 80,4 | 0,0125 | 94,2 | |
| Хлорантранилипрол | 0,0075 | 109 | 0,0153 | 114 | |
| Клотианидин | 0,0062 | 92,1 | 0,0146 | 109,9 | |
| Диафентиурон | 0,0038 | 53,7 | 0,0042 | 32,5 | |
| Дифеноконазол | 0,0077 | 112,2 | 0,0148 | 111 | |
| Диметоморфе | 0,0072 | 105,4 | 0,015 | 111,5 | |
| Эспинеторам | 0,0074 | 103,5 | 0,0149 | 111,5 | |
| Спиносад | 0,0078 | 114,4 | 0,0159 | 118,9 | |
| Фенурон | 0,008 | 115,9 | 0,016 | 119,4 | |
| Имидаклоприд | 0,0063 | 92,1 | 0,0143 | 106,4 | |
| Индоксакарб | 0,0062 | 90,3 | 0,0135 | 101 | |
| Металаксил М | 0,0072 | 105,1 | 0,0155 | 116,6 | |
| Метоксифенозид | 0,006 | 88,1 | 0,0146 | 109,6 | |
Источник: разработка авторов.
Результаты восстановления находятся в приемлемом диапазоне (70-120%). Метод показал хорошую повторяемость для большинства изученных соединений со значениями RSD ниже 20%.
Все изученные соединения соответствовали критериям, рекомендованным European Comission (2018), за исключением пестицида Диафентиурон, поскольку он не обеспечивал извлечение в приемлемом диапазоне (от 70% до 120%) ни на одном уровне, что делало его валидацию невозможной.
После валидации метод был использован для количественного определения содержания пестицидов в образцах почвы, собранных в регионах посадки томатов. Полученные результаты представлены в таблице 6 ниже:
Таблица 6 – Краткое изложение результатов фактических проб почвы, собранных на площадях посадки томатов (мг / кг почвы)
| Пестицид | П1 | П2 | П3 | П4 | П5 | П6 | П7 |
| 1. Азоксистробин | 0,003 | 0,0025 | 0,009 | 0,06 | |||
| 3. Boscalida | Следы | ||||||
| 4. Карбендазим | 0,0065 | 0,0085 | |||||
| 5. Кломазон* | |||||||
| 6. Хлорантранилипрол | 0,036 | X | 0,071 | 0,223 | |||
| 7. Клотианидин | 0,027 | X | 0,0185 | ||||
| 8. Диафентиурон | 0,0255 | X | |||||
| 9. Дифеноконазол | 0,003 | 0,038 | 0,0285 | ||||
| 10. Диметоморфе | 0,0105 | 0,48 | 0,096 | 0,0275 | |||
| 11. Эспинеторам | X | X | |||||
| 12. Спиносад А | 0,002 | ||||||
| 13. Спиносад Д | X | X | |||||
| 14. Фенурон | X | Следы | X | Следы | X | X | |
| 15. Имидаклоприд | X | Следы | 0,008 | 0,006 | |||
| 16. Индоксакарб | 0,0235 | 0,0015 | |||||
| 17. Металаксил М | Следы | Следы | 0,0085 | 0,024 | 0,001 | ||
| 18. Метоксифенозид. | 0,1415 | 0,0105 | |||||
| 19. Тиаметоксам | 0,0315 | 0,0225 | 0,0255 |
Примечание: от П1 до П6 (посадки томатов) Источник: Подготовлено авторами.
Остатки пестицидов были обнаружены в таблице 6. Пестицид фенурон был обнаружен во всех образцах почвы, за исключением участков П1 и П2. Этот пестицид является одним из тех, которые исключены или не зарегистрированы в Бразилии, как показано в таблице 7. Однако концентрации этого соединения, обнаруженные в образцах, были классифицированы как признаки, то есть ниже предела обнаружения аналитическим методом.
Что касается пестицидов азокситробина и карбендазима, ситуация в областях 6 и 7 вызывает беспокойство, особенно потому, что эти пестициды не разрешены ANVISA для применения при посадке томатов, как показано в таблице 7.
Таблица 7 – Концентрации НЕСАНКЦИОНИРОВАННЫХ пестицидов для обработки томатов, обнаруженные в проанализированных почвах
| Пестицид | П6 | П7 | ||||
| 5-10 | 10-20 | 10-20 | 0-5 | 5-10 | 10-20 | |
| 1. Азоксистробин | 0,0090 | 0,0035 | 0,006 | 0,060 | 0,012 | 0,003 |
| 2. Карбендазим | 0,0065 | 0,0065 | 0,0045 | 0,0085 | 0,003 | 0,002 |
Источник: разработка авторов.
Оптимизированный метод множественного остатка оказался селективным и точным в изученном диапазоне, позволяя одновременно анализировать вещества: азоксистробин, боскалид, карбендазим, хлорантранилипрол, клотианидин, дифеноконазол, диметоморф, эспинеторам, эспинозад A, эспинозадоид D, фенилосадоид. , Индалаксид M, метоксифенозид, тиаметоксан с соответствующими пределами количественного определения (LOQ), включенные в официальную бразильскую программу мониторинга томатов, как показано в таблице 8
Таблица 8 – LOQS для основных пестицидов: µg / кг-1
| Аготоксичный | LOQ (µg kg-1) |
| Азоксистробин | 7,0 |
| Boscalida | 7,0 |
| Карбендазим | 5,0 |
| Хлорантранилипрол | 7,0 |
| Клотианидин | 7,0 |
| Диафентиурон | 7,0 |
| Дифеноконазол | 7,0 |
| Диметоморфе | 7,0 |
| Эспинеторам | 7,0 |
| Спиносад | 7,0 |
| Фенурон | 7,0 |
| Имидаклоприд | 13,0 |
| Индоксакарб | 7,0 |
| Металаксил М | 7,0 |
| Метоксифенозид | 7,0 |
Источник: разработка авторов.
ЗАКЛЮЧИТЕЛЬНЫЕ СООБРАЖЕНИЯ
Метод QuEChERS, с небольшими изменениями, подходил для многократной экстракции аналитов в почвах от насаждений, с прозрачными экстрактами и без помех. Жидкостная хроматография сверхвысокого разрешения в сочетании с последовательной масс-спектрометрией (UPLC-MS / MS) была достаточной для обнаружения и количественного определения этих аналитов в матрице со значениями извлечения от 70 до 120%, стандартное отклонение менее 20%, пределы количественное определение от 7 до 13 µg.L и пределы количественного определения от 2 до 4 µg.L в соответствии с действующим законодательством. Результаты полевых испытаний показали, что метод подходит для количественного анализа пестицидов, оцениваемых в почвах, полученных от посадки томатов в пределах рабочего диапазона.
Утвержденный метод соответствует значениям, предлагаемым в литературе для анализа остатков пестицидов хроматографическими методами (EUROPEAN COMISSION, 2018). Определение исследуемых пестицидов с помощью UHPLC-MS / MS было удовлетворительным, что позволило провести качественный анализ, полученный из фрагментов с массовыми характеристиками каждого аналита, и количественный в режиме сбора данных MRM. Хроматографические условия, оптимизированные для определения с помощью UHPLC-MS / MS, позволили идентифицировать и количественно оценить исследуемые соединения при времени анализа менее 15 минут, что дает большой выигрыш в качестве аналитического инструмента и для общества в целом.
В целом, все образцы показали концентрации пестицидов, разрешенные монографиями ANVISA. Однако результаты, полученные для обычных посадок, несмотря на то, что они находятся в пределах требуемых соответствий, выше, чем значения, полученные для плантаций устойчивой и органической системы. Однако он служит предупреждением о наличии пестицидов на столе общества.
Использование пестицидов азоксистробина и карбендазима (неразрешенных пестицидов) для обработки томатов вызывает конкретную озабоченность в связи с тем, что обычно ожидалось, – с преднамеренным использованием пестицидов для увеличения производства, независимо от того, что рекомендуют законы.
Если, с одной стороны, вызывает беспокойство обнаружение неразрешенных пестицидов в образцах, с другой стороны, это демонстрирует, что метод, утвержденный в этой работе, очень эффективен благодаря способности количественно определять даже пестициды, не разрешенные к использованию.
В дополнение к достижению вполне удовлетворительных результатов в отношении пестицидов, эта работа оказалась способной определять остаточные количества для 240 пестицидов, между разрешенными и неразрешенными ANVISA в Бразилии, со значениями коэффициента детерминации более 0,99; Значения LOQ 13 µg.кг-1 для Спиносада и 7,0 µg.кг-1 для других пестицидов. Метод показал хорошую точность со значениями RSD <20% и точность с извлечением от 70 до 120% для подавляющего большинства проанализированных соединений.
РЕКОМЕНДАЦИИ
AZEVEDO, E. de – Alimentos Orgânicos: ampliando conceitos de saúde humana, ambiental e social, Livros G.Play, 2018.
ANASTASSIADES M, Lehothay S.J, Stajnbaher D, Schenck F.J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residue in produce. J. AOAC Int. 86: 412-431, 2003.
ANVISA – Agência Nacional de Vigilância Sanitária. Disponível em: <http://portal.anvisa.gov.br> 2014. Acesso em: 11 de outubro de 2018.
ANVISA – NOTA TÉCNICA 02/2017 – Posicionamento da Anvisa referente à Recomendação 028/2016 aprovada em Reunião Plenária do Conselho, 2017
CARDOSO, Maria Helena Wohlers Morelli; GOUVÊA, Adherlene Vieira; NÓBREGA, Armi Wanderley da; ABRANTES, Shirley de Mello Pereira – Validação de método para determinação de resíduos de agrotóxicos em tomate: uma experiência laboratorial – Ciência e Tecnologia de Alimentos, Campinas, 30 (Supl.1): 63-72, maio 2010.
CARVALHO, C.R.F., PONCIANO N.J.; SOUZA P.M. de. – Viabilidade econômica e de risco da produção de tomate no município de Cambuci/RJ, – Ciência Rural, Brasil, 2014.
CETESB (Companhia Ambiental do Estado de São Paulo) – Qualidade do solo, 2020. Disponível em: https://cetesb.sp.gov.br/solo/poluicao/ – Acessado em 09/2020.
COMMISSION DECISION No. 657/2002. Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. Off. J. Eur. Commun. L 221: 8-36.
COMMISSION REGULATION (E.C). No. 1881/2006. Setting maximum levels for certain contaminants in foodstuffs. Off. J. Eur. Commun. L364: 5-24.
CONAMA – Resolução nº 420/2009 – Disposição sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e suas providências. Disponível em: < http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=620> Acesso em: 02 jan. 2019.
CURRENCE, T.M. Tomato breeding. I. Species, origin and botanical characters. Handbuch der Pflanzenzuchtung, p. 351-369, 2013.
DIEZ, C.; TRAAG, W. A.; ZOMMER, P.; MARINERO, P.; ATIENZA, J.; J. – Extraction and chromatographic analysis of the cadusafós nematicide, chromatography, 1131, 1135 – 2006.
DONG, H.; XIAO, K. – Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce – Food Chemistry, Volume 229, Pages 502-508 – Elsevier, 2017.
DROŻDŻYŃSKI, D.; KOWALSKA, J. – Rapid analysis of organic farming insecticides in soil and produce using ultra-performance liquid chromatography/tandem mass spectrometry, Springer, Talanta, 2009.
DROŻDŻYŃSKI , D.; WALORCZYK, S.; GNUSOWSKI , B – Multiresidue determination of 160 pesticides in wines employing mixed-mode dispersive-solid phase extraction and gas chromatography–tandem mass spectrometry, Volume 85, Issue 4, Talanta – Elsevier, Pages 1856-1870, 2011.
ESALQ – Simpósio de defensivos agrícolas: tópicos relevantes e principais desafios, ESALQ / 2017
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2017.
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2018.
EMBRAPA – Manual de Procedimentos de Coleta de Amostras em Áreas Agrícolas para Análise da Qualidade Ambiental: Solo, Água e Sedimentos, 2016.
EPA (Environmental Protection Agency) – Pesticide safety for farmworkers, 2017.
FAOSTAT – Food and Agriculture Organization of the United Nations – Produtividade Mundial, 2018. Disponível em: <http://faostat.fao.org/site/340/default.aspx>. Acesso em. 28 de novembro de 2019.
FERNANDES V.C, LEHOTAY S.J, GEIS-ASTEGGIANTE L, KWON H, Mol H.G.J, van der Kamp H, MATEUS N, DOMINGUES V.F, DELERUE-Matos, C. Analysis of pesticides residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two dimensional GC-time-of-flight MS comparing organic and integrated pest management farming. Food Addit Contam. 31: 262-270, 2014.
IARC. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. WHO. World Health Organization. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 82: 183-193, 2002.
IBAMA-Ministério do Meio Ambiente: Avaliação do Potencial de Periculosidade Ambiental (PPA) de Agrotóxicos e Afins. Disponível em: Acesso em: abr. 2020.
IBGE – Indicadores / Estatística da Produção Agrícola Levantamento Sistemático da Produção Agrícola 2017-2018, 2019.
IGLESIAS, Hoshi A. – Introdução ao Acoplamento Cromatografia Líquida – Espectrometria de Massas Waters Technologies do Brasil, Barueri, SP, 2016.
INMETRO. Instituto Nacional de Metrologia, Qualidade e Tecnologia. Orientação sobre Validação de Métodos Analíticos – DOQ-CGCRE-008. Rev. 07, 28 f, jul 2018.
JUNIOR, J.C.L, – Manejo integrado de pragas na cultura do tomate: uma estratégia para a redução do uso de agrotóxicos – Extensão em Foco (ISSN: 2317-9791), 2019.
LESUEUR, A. B; KNITTL P. A ; GARTNER, M. A; MENTLER A. C, FUERHACKER M.B.- Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuECheRS method – Science Direct, 2008.
MALDANER L, JARDIM ICSF. O estado da arte da cromatografia líquida de ultraeficiência [The art state of ultra performance liquid chromatography]. Quim Nova. 32: 214-222. Portuguese, 2009.
OGIHARA, Camila Honda – Desenvolvimento e validação de método para a determinação de multirresíduos de agrotóxicos em solo empregando o método quechers e a cromatografia líquida de ultra alta eficiência acoplada à espectrometria de massas sequencial – UNICAMP, 2018.
ORTELLI, D; COGNARD, E; JAN, P; EDDER, P. Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry and Chromatography. 877: 2363–2374, 2009.
PINTO, C.G., Martín, S.H., PAVÓN, J.L.P., CORDERO, B.M., A simplified Quick, Easy, Cheap, Effective, Rugged and Safe approach for the determination of trihalomethanes and benzene, toluene, ethylbenzene and xylenes in soil matrices by fast gas chromatography with mass spectrometry detection. Anal. Chim. Acta, 689, 129-136, 2011.
PRESTES, O.D. ; Friggi, C.A.; ADAIME M.B, ZANELLA, R. QuECheRS – QuEChERS-a modern method of sample preparation for multiresidue determination of pesticides in food by chromatographic methods coupled to mass spectrometry]. Quim Nova. 32: 1620-1634. Portuguese, 2009.
RAMOS, A. M. et al. Evaluation of a modified QuEChERS method for the extraction of pesticides from agricultural, ornamental and forestal soils. Analytical and Bioanalytical Chemistry, v. 396, p. 2307-2319, 2016.
RASHID A., NAWAZ S., BARKER H., AHMAD I., AND ASHRAF M., Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry. J. Chromatogr. A, 2010, 1217, 2933-2939
RIBAS, P. P.; MATSUMURA, A. T. S. A química dos agrotóxicos: impacto sobre a saúde e meio ambiente. Revista Liberato, 2009, 10, 14, 149-158.
RUBENSAM G, Barreto F, HOFF RB, KIST TL, PIZZOLATTO, TM. A liquid–liquid extraction procedure followed by a low temperature purification step for the analysis of macrocyclic lactones in milk by liquid chromatography–tandem mass spectrometry and fluorescence detection. Anal Chim Acta. 705:24-29, 2011.
SOBER – Revista de Economia e Sociologia Rural (RESR) – Relatório – 1º Trimestre 2019, MAPA, Brasil, 2019
TSIPI, D.; BOTITSI, H.; ECONOMOU, A. Mass Spectrometry for the Analysis of Pesticide Residues and their Metabolites. New Jersey: John Wiley & Sons, 2015.
VEIGA, Denise Piccirillo – O impacto do uso do solo na contaminação por agrotóxicos das águas superficiais de abastecimento público – USP, São Paulo, 2017
ПРИЛОЖЕНИЕ – ССЫЛКИ С СНОСАМИ
8. Requeima, вызываемый Phytophthora infestans, является очень агрессивным заболеванием в культуре томатов, способным уничтожить целые посевы за короткий период времени.
9. Агрономический параметр, установленный ANVISA в отношении рекомендации 028/2016, одобренной Национальным советом по продовольственной и пищевой безопасности (CONSEA), – представляет собой один из компонентов для расчета воздействия и оценки риска, что является предварительным условием для регистрации или разрешения пестицида в новые культуры.
[1] Доктор наук в области наук об окружающей среде и инженерии Федерального университета Рио-де-Жанейро / Политехнической школы химии / Программы инженерии окружающей среды (UFRJ / POLI / PEA); Магистр наук об окружающей среде и инженерии Федерального университета Рио-де-Жанейро / Политехнической школы химии / Программы инженерии окружающей среды (UFRJ / POLI / PEA); Специализация в области преподавания химии (FIJ); Степень лиценциата химии Государственного университета Рио-де-Жанейро (UERJ).
[2] Советник. Кандидат технических наук по программе горного дела, металлургии и материаловедения Федерального университета Риу-Гранди-ду-Сул.
[3] Советник. Доктор философии в области океанотехники из Коппе / UFRJ; Доцент Политехнической школы Федерального университета Рио-де-Жанейро и проректор бакалавриата UFRJ.
[4] Советник. Доктор наук Центра ядерной энергии в сельском хозяйстве / CENA – Университета Сан-Паулу.
[5] Мастер по надзору за здоровьем в области здравоохранения (FIOCRUZ / INCQS).
[6] Кандидат медицинских наук в области здравоохранения (FIOCRUZ / INCQS).
[7] Кандидат медицинских наук в области здравоохранения (FIOCRUZ / INCQS).
Поступило: декабрь 2020 г.
Утверждено: январь 2021 г.