ORIGINALER ARTIKEL
MAZZEI, João Roberto Fortes [1], FREIRE, Estevão [2], SERRA, Eduardo Gonçalves [3], MACEDO, José Ronaldo de [4], OLIVEIRA, Angélica Castanheira de [5], BASTOS, Lucia Helena Pinto [6], CARDOSO, Maria Helena Wohlers Morelli [7]
MAZZEI, João Roberto Fortes. Et al. Multiresidue-Methods zur Analyse von 240 Pestiziden in Böden von Tomatenpflanzen durch Ultra-Performance-Flüssigkeitschromatographie gekoppelt an Massenspektrometrie. Revista Científica Multidisciplinar Núcleo do Conhecimento. Jahr 06, Ed. 01, Vol. 08, pp. 34-67. Januar 2021. ISSN: 2448-0959, Zugangslink: https://www.nucleodoconhecimento.com.br/umwelttechnik-de/multiresidue-methods, DOI: 10.32749/nucleodoconhecimento.com.br/umwelttechnik-de/multiresidue-methods
ABSTRAKT
In dieser Arbeit wurde eine Analysemethode zur Bestimmung von Rückständen für den Pestizidfokus optimiert: Azoxystrobin, Boscalide, Carbendazim, Chloranthranilprol, Clothianidin, Diafentiuron, Difenoconazol, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenurox Methax , Thiametoxan in Böden, die aus Tomatenpflanzen stammen, um den Grad der Kontamination dieser Verbindungen in Bodenproben zu vergleichen. Das modifizierte QuEChERS-Extraktionsverfahren und die Ultra-Performance-Flüssigkeitschromatographie in Verbindung mit der sequentiellen Massenspektrometrie wurden mit einer Ionisationsquelle durch Elektronebulisation im ESI-Modus (+/-) verwendet. Das Verfahren bestand aus der Extraktion von 15,0 g Erde mit 15 ml gesättigter Calciumhydroxidlösung, pH 12,3 und 15 ml Acetonitril, mit einer sich daraus ergebenden Verteilung des “Aussalzeffekts” durch 6,0 g wasserfreies Magnesiumsulfat und 1,5 g Natriumchlorid . Die Phasen wurden durch 7-minütige Zentrifugation bei 3700 U / min getrennt. Die Extrakte wurden mit MeOH licrossolv®-Qualität verdünnt und in einen Chromatographen injiziert. Die Methode wurde anhand der Parameter Linearität, LOD, LOQ, Präzision und Genauigkeit validiert. Linearität zwischen 0,2 und 20,0 µg L-1, Bestimmungskoeffizienten größer als 0,99. Die LOQ-Werte für das Verfahren betrugen 13 µg kg-1 für Spinosad und 7,0 µg kg-1 für die anderen Pestizide. Die Methode zeigte eine gute Präzision mit RSD-Werten <20% und eine Genauigkeit mit Wiederfindungsraten zwischen 70 und 120% für die überwiegende Mehrheit der analysierten Verbindungen. Die analytischen Kurven wurden mit Referenz-Extrakten aus weißem Boden erstellt, um den Matrixeffekt zu minimieren. Die Methode wurde als geeignet für die Analyse von Pestizidrückständen im Boden angesehen, da sie die Validierungsparameter chromatographischer Methoden erfüllt (European Comission, 2018). Nach der Validierung wurde die Methode verwendet, um die Rückstände dieser Pestizide in Bodenproben von konventionellen, biologischen und nachhaltigen Tomatenplantagen zu analysieren. Dies ermöglicht es, die Höhe der erzeugten Umweltauswirkungen zu vergleichen. Neben der Validierung der Analysemethode für den Pestizid-Schwerpunkt der Studie konnten 240 weitere Verbindungen zwischen zugelassenen und nicht zugelassenen Verbindungen für die Verwendung beim Anpflanzen von Tomaten validiert werden.
Schlüsselwörter: Kontaminanten in Böden, Pestizidrückstände, QuEChERS, UPLC-MS / MS.
EINFÜHRUNG
Der Tomatenanbau ist anfällig für das Auftreten von Insektenschädlingen und -krankheiten. Daten aus Carvalhos Forschungen (2017) zitieren, dass der Tomatenanbau anfällig für den Befall von Krankheiten ist, die durch Insektenschädlinge verursacht werden, wobei die Weiße Fliege (Bemisia) einer der Hauptschädlinge ist, die Tomaten befallen. Bemisia argentifolii und Bemisia tabaci sind die beiden Hauptarten der Weißen Fliege, die den Anbau der Früchte schädigen. In der Arbeit des Autors wurden Tomatenbauern in der Gemeinde Cambuci (Rio de Janeiro) befragt, bei denen beobachtet wurde, dass etwa 60% der Pflanzer wöchentlich bis zu zwei Pestizidanwendungen durchführen. In 2% der Fälle beschrieben die Pflanzer, dass je nach Situation, z. B.: Wenn Krankheiten auftreten oder das Wetter regnerisch ist, eine größere Anzahl von Anwendungen erforderlich ist, die dreimal pro Woche erfolgen können.
Morphologisch gibt es keinen Unterschied zwischen den beiden Arten. Ersteres ist jedoch aggressiver, da es nicht nur widerstandsfähiger gegen widrige Umweltbedingungen und einige konventionelle Pestizide ist, sondern auch eine höhere Reproduktionsrate aufweist, eine größere Anzahl von Wirtspflanzen betrifft und es schafft, seinen gesamten Lebenszyklus in der abzuschließen Tomate. Aus diesem Grund müssen verschiedene Pestizide eingesetzt werden, um diese und andere Schädlinge, die Tomatenplantagen befallen, zu bekämpfen (ESALQ, 2017).
In dieser Arbeit wurde beschlossen, die von der brasilianischen Gesetzgebung geleitete Terminologie – Pestizide – zu verwenden, da dieser Begriff, obwohl er nicht im Wesentlichen alle verwendeten Produkte abdeckt, die größte Anzahl von Attributen umfasst, die zur Beschreibung der Substanzen erforderlich sind, aus denen dieses Universum besteht, und erhöht die Transparenz und Ethik für den Leser, den Benutzer und den Verbraucher der Produkte, in denen solche Verbindungen verwendet werden (SOBER, 2018).
Laut der am 28.06.2008 veröffentlichten Überprüfung der brasilianischen Pestizidgesetzgebung (MAPA, 2018):
Der Begriff Pestizid wird von keinem anderen Land oder keiner anderen internationalen Organisation verwendet, die sich mit dem Thema befasst. Die Codex Alimentarius-Kommission, die internationale Referenzorganisation für Lebensmittel im Übereinkommen der Welthandelsorganisation (WTO) über die Anwendung gesundheitspolizeilicher und pflanzenschutzrechtlicher Maßnahmen, verwendet den englischen und französischen Begriff „agrotoxisch“ und den spanischen Begriff „plaguicida“. Daher ist es notwendig, den Begriff Pestizid in Pestizid zu ändern, um die brasilianische Gesetzgebung an die internationalen Praktiken anzupassen.
Tomaten wurden aufgrund ihrer spezifischen Eigenschaften als Gegenstand dieser Studie ausgewählt, dh Plantagen wie Tomaten (Solanum lycopersicum L. = Lycopersicon esculentum Mill) erfordern häufige Aufmerksamkeit hinsichtlich des Befalls von Schädlingen und Unkräutern, was die Notwendigkeit einer Anwendung impliziert Pestizide mit großer Häufigkeit.
Bei Kontakt mit dem Boden sind Pestizide physikalisch-chemischen Prozessen ausgesetzt, die zu einer Verschlechterung ihrer Wirkung in der Umwelt führen. Aufgrund der Notwendigkeit einer rationellen Verwendung landwirtschaftlicher Betriebsmittel zur Minimierung der Umweltauswirkungen der Landwirtschaft wurden viele Studien durchgeführt, um das Verhalten dieser Produkte im Boden zu verstehen. Über das Verhalten dieser Pestizide in tropischen Böden ist jedoch wenig bekannt.
BESCHÄDIGUNG DER BÖDEN DURCH AGROTOXIC
Nach den Studien von Azevedo (2018) ist der Boden trotz einer besseren Kontrolle des Einsatzes von Pestiziden der endgültige Bestimmungsort der in der Landwirtschaft verwendeten Chemikalien, unabhängig davon, ob sie direkt auf den Boden, auf den oberirdischen Teil der Pflanzen oder auf die Luft aufgebracht werden sogar zu den eingepackten Früchten. Pestizide und Herbizide unterliegen im Kontakt mit dem Boden physikalisch-chemischen Prozessen, die ihre Wirkung auf die Umwelt erhöhen. Laut dem Autor wurden aufgrund der Notwendigkeit einer rationellen Verwendung landwirtschaftlicher Betriebsmittel zur Minimierung der Umweltauswirkungen der Landwirtschaft viele Studien durchgeführt, um das Verhalten dieser Produkte im Boden zu verstehen.
Der Boden wirkt als Filter und hält viele der darin eingegossenen Verunreinigungen zurück. Auf diese Weise kann seine Qualität durch die Anreicherung von Luftschadstoffen, die Verwendung von Pestiziden / Düngemitteln, festen Abfällen, giftigen und sogar radioaktiven Stoffen verändert werden. Wenn der Schadstoff die Oberfläche des Bodens erreicht, kann er adsorbiert werden. getragen vom Wind oder Abflusswasser oder sogar ausgelaugt durch Infiltrationswasser, erreicht den unteren Horizont und erreicht den Grundwasserspiegel. Sobald das Grundwasser erreicht ist, können diese Schadstoffe in andere Regionen transportiert werden (CETESB, 2020).
Die CONAMA-Bestimmung (2009) informiert, dass die chemischen Eigenschaften des Bodens wie pH-Wert, Nährstoffgehalt, Ionenaustauschkapazität, elektrische Leitfähigkeit und organische Substanz zusammen mit biologischen Aktivitäten für deren Adsorption, chemische Fixierung, Oxidation und Neutralisation verantwortlich sind Schadstoffe.
PESTIZIDE UND TOMATENKULTUR
Die Tomate ist eine in Südamerika beheimatete Frucht. Historische Daten zeigen, dass die Tomate bereits seit mehr als 100 Jahren von den Inkas und Azteken in Hochregionen Perus und Mexikos angebaut wurde. Die ersten Länder, in denen das Produkt angebaut wurde, waren laut (CURRENCE, 2013) Peru, Mexiko, Bolivien, Ecuador und Chile. Die weltweit größten Tomatenproduzenten sind laut FAOSTAT-Bericht (2018): China, Brasilien, USA, Indien, Türkei, Ägypten, Italien, Iran, Spanien und Mexiko.
IBGE-Daten (EPAG, 2019) zeigen, dass Brasilien im Jahr 2018 4.084.910 Tonnen produzierte und dass im Januar 2019 4.333.609 Tonnen Obst produziert wurden. Die Regionen mit der größten Produktion im Jahr 2018 waren: Südosten mit 1.689.558 Tonnen (São Paulo produzierte 811.100 Tonnen) und Zentralwesten mit 1.369.014 Tonnen (Goiás produzierte 1.334.500 Tonnen).
Für Junior (2019) gibt es keine Tomate, die gegen die meisten Schädlinge und Krankheiten resistent ist. Aus diesem Grund besteht die häufigste Methode zur Bekämpfung dieses Befalls weiterhin in der Anwendung von Fungiziden und Insektiziden, die ein Kontaminationsrisiko für die beteiligten Arbeitnehmer, Pestizidrückstände in den Früchten, Auswirkungen auf die Umwelt und höhere Kosten verursachen.
In Brasilien genehmigen ANVISA-Referenzen (2018) etwa 500 Wirkstoffe für landwirtschaftliche Zwecke, Haushaltsreinigung, nichtlandwirtschaftliche Zwecke, Gewässer und Holzschutzmittel. Von dieser Menge sind 119 Pestizide zur Anwendung in der Tomatenplantage zugelassen. Der gleiche Wirkstoff kann unter der Kennzeichnung vieler Formulierungen und Handelsnamen vermarktet werden, und eine Mischung, die mehr als einen Bestandteil in demselben Produkt enthält, ist üblich.
Carvalho (2017) erwähnt in seiner Forschung, dass Pestizide beim Pflanzen von Tomaten verwendet werden, um vor allem die Weiße Fliege, Spätbrandpilze[8], Hohlstiel, Bakterienwelke, Leaf Miner, großen Fruchtbohrer und schwarzen Fleck zu bekämpfen , Bakterienfleck und kleiner Fruchtbohrer. Nach diesen Untersuchungen sind zur Bekämpfung solcher Schädlinge und Krankheiten mehrere Anwendungen von Pestiziden erforderlich. Der Autor erwähnt, dass die Hersteller auf 53 verschiedene Handelsmarken und durchschnittlich 12 Arten von Pestiziden pro Ernte Bezug nahmen. Insektizide und Fungizide sind die Produkte, die der Landwirt aufgrund einer Krankheit, die als Spätfäule bezeichnet wird, nach dieser Untersuchung am häufigsten zum Anpflanzen von Tomaten verwendet.
ZIEL VON PESTIZIDEN IN DER UMWELT
Die Verwendung von Pestiziden im konventionellen Tomatenanbau wirft aufgrund der Umweltschäden, insbesondere in biotischen und abiotischen Umgebungen, ständige Bedenken auf. Darüber hinaus wird bei Feldarbeitern eine Reihe von Effekten beobachtet: Schwäche, Übelkeit, Schwindel, Krebs, Leberschäden, Allergien ua Daher ist es sehr wichtig, die Früchte, den Boden und das Wasser zum Zwecke der Quantifizierung zu analysieren, um zu überprüfen, ob sie innerhalb der von Anvisa gemäß (RIBAS und MATSUMURA, 2009) genehmigten Rückstandshöchstmengen (LMR[9]) liegen.
ENTWICKLUNG
METHODIK – VORAUSSETZUNGEN, HYPOTHESEN UND ARBEITSSTUFEN
LOKAL
Diese Arbeiten begannen in folgenden Räumlichkeiten:
- Es gibt keine Tomate, die gegen die meisten Schädlinge und Krankheiten resistent ist.
- Der Boden ist der endgültige Bestimmungsort eines großen Teils der Rückstände aus der Anwendung von Pestiziden in den Pflanzmethoden, in denen sie angewendet werden.
- Es ist wahrscheinlich, dass der Boden durch die Anwendung von Pestiziden in landwirtschaftlichen Plantagen kontaminiert wird, die in biotischen und abiotischen Umgebungen Umweltauswirkungen verursachen können.
HYPOTHESEN
- Die in der brasilianischen Landwirtschaft verwendeten Pestizide sind hinsichtlich der Kontamination von Obst und Boden nicht umweltfreundlich.
- Herkömmliche Pflanzungen mit intensivem Einsatz von Pestiziden sind möglicherweise nicht umweltfreundlich.
- In der Landwirtschaft besteht eine Lücke, dh das Fehlen einer validierten und zuverlässigen Methode zur Bestimmung und Quantifizierung von Pestiziden im Boden gemäß den von Anvisa festgelegten Rückstandshöchstmengen (LMR).
- Es ist möglich, Pestizide zum Anpflanzen zu verwenden und die Früchte in einer Konzentration zu halten, die den Anforderungen der im Land geltenden Rechtsvorschriften entspricht.
Die Kenntnis der Rückstände und Kontaminanten im Boden ist wichtig für die Entwicklung von Maßnahmen zur Verbesserung der Handhabung und Kontrolle in der landwirtschaftlichen Produktion zur Reduzierung solcher Kontaminanten.
ARBEITSSTUFEN
a) Durchführung von Forschungsarbeiten: Anwendung eines Fragebogenmixes aus offenen Antworten und Mehrfachauswahlmöglichkeiten. Diese Forschung wurde auf die Pflanzgefäße in den Gebieten angewendet, in denen die Proben gesammelt werden sollten, und ermöglichte es, die Hauptprodukte zu untersuchen, die in ihren Plantagen verwendet wurden. Diese Pestizide wurden als “Pestizid-Schwerpunkt” der Arbeit identifiziert.
b) Entnahme von Bodenproben in Gebieten mit drei Anbauarten: konventionell; biologisch und nachhaltig;
c) Entnahme von Blindreferenztestproben – Proben von Böden, die keiner Behandlung mit den für diese Arbeit interessierenden Pestiziden unterzogen wurden;
d) Charakterisierung des Bodens hinsichtlich Textur, Fruchtbarkeit und chemischer Zusammensetzung – Phase in Partnerschaft in EMBRAPA SOLOS-RJ-Labors durchgeführt;
e) Vorbereitung der Proben für die Extraktion – Die Proben müssen eine 30-Mesh-Granulometrie (Feinerde) aufweisen, die für die chemische Extraktion geeignet ist. Dieser Schritt wird in den EMBRAPA SOLOS-RJ-Labors durchgeführt.
f) Analyse der auf dem Feld gesammelten realen Bodenproben.
Diese Phase war unterteilt in:
- Bodencharakterisierung – durchgeführt in EMBRAPA SOLOS Laboratories;
- Bestimmung der organischen Substanz – Phase durchgeführt in EMBRAPA SOLOS Laboratories;
- Chemische Analyse zur Bestimmung von Bodenmikronährstoffen – Durchführung im FERTIMOVEL-Labor (EMBRAPA SOLOS);
- Extraktion, Clean-up, Angemessenheit und Optimierung der QuEChERS-Methode zur Bestimmung von Pestizidrückständen in Bodenproben durch hochauflösende Flüssigkeitschromatographie in Verbindung mit sequentieller Massenspektrometrie – Schritt durchgeführt in INCQS-Labors – FIOCRUZ.
g) Berechnungen, statistische Auswertung und Aufzeichnung der erhaltenen Ergebnisse.
FÜR DIE STUDIE AUSGEWÄHLTE PESTIZIDE
Bei den mit den Pflanzgefäßen durchgeführten Untersuchungen wurde beobachtet, dass die Hauptprodukte, die in ihren Plantagen verwendet wurden, waren: Abamectin, Acibenzolar-S-Methyl, Azoxystrobin, Ciromazin, Diafentiuron, Mandipropamida, Pimetrozina, Tiametoxan. Daher wurde beschlossen, die Analysemethode zunächst für die Bestimmung von Rückständen dieses “Pestizid-Fokus” im Boden aus dem Anbau von Tomaten anzupassen. Die Forschung wurde mit Pflanzgefäßen aus der nördlichen Region von nördliche Fluminense (Rio de Janeiro) durchgeführt, einem großen Tomatenproduzenten, der von den drei in dieser Arbeit untersuchten Anbausystemen (konventionell, biologisch und nachhaltig) vertrieben wird.
DIE EXTRAKTIONSMETHODE (QUECHERS)
Die QuEChERS-Extraktionsmethode (aus dem Englischen, Quick, Easy, Cheap, Effective, Rugged and Safe) wurde von ANASTASSIADES et al. (2003) zielt darauf ab, die praktischen Einschränkungen der bis dahin bestehenden Extraktionsmethoden für mehrere Abfälle zu beseitigen. Die Hauptunterschiede der Methode sind die Tatsache, dass sie schnell, einfach, wirtschaftlich, effektiv, robust und sicher ist, wie der Name QuEChERS abkürzt. Diéz et al. (2006) weisen darauf hin, dass diese Methode für Proben entwickelt wurde, die mehr als 75% Wasser enthalten.
BIBLIOGRAPHISCHE UMFRAGE ÜBER DIE MIT DER CHROMATOGRAPHIE VERBUNDENE QUECHERS-METHODE ZUR BESTIMMUNG VON PESTIZIDEN – CHRONOLOGISCHE ENTWICKLUNG
Lesueur et al. (2008) untersuchten Änderungen an QuEChERS bei der Analyse von 105 Pestiziden durch Gaschromatographie in Verbindung mit einem Massenspektrometer (CG-EM) und 46 Pestiziden durch Ultra Performance-Flüssigkeitschromatographie in Verbindung mit sequentieller Massenspektrometrie (CLUE-EM / EM) nach Extraktion mit der QuECheRS-Methode in vier Matrizen (Traube, Zitrone, Zwiebel und Tomate).
Drożdżyński et al. (2009) untersuchten 3 ökologische Insektizide (Azadiractin, Spinosad und Rotenon) in Boden-, Kohl- und Tomatenproben unter Verwendung der modifizierten QuEChERS-Methode und ermittelten anschließend die Konzentrationen durch CLUE-EM / EM.
Chen et al. (2010) führten eine Modifikation der QuEChERS-Methode durch, um Procymidon in Boden- und Lauchproben zu bestimmen, und ergänzten die Arbeit durch Quantifizierung durch GC-MS.
Rashid et al. (2010) analysierten 19 Pestizide aus der Gruppe der Organochloride in Böden unter Anwendung einer modifizierten und reinigenden QuEChERS-Methode, die aus einer Flüssig-Flüssig-Verteilung mit n-Hexan besteht. Das Verfahren wurde für die Bestimmung von 19 Organochlor-Pestiziden, Hexachlorbenzol (HCB), α-HCH, β-HCH, γ-HCH, Heptachlor, Heptachlorepoxid (trans), Aldrin, Dieldrin, Chlordan (trans), Chlordan (cis) validiert Oxychlordan, α-Endosulfan, β-Endosulfan, Endosulfansulfat, Endrin, p, p’-DDT, o, p’-DDT, p, p’-DDD ep, p’-DDE.
Shi et al. (2010) schlugen eine modifizierte QuEChERS-Methode zur Analyse von Oxadiargylresten in Boden-, Wasser-, Reis- und Reisstrohproben mit Quantifizierung durch GC-ECD vor.
Pinto et al. (2010) untersuchten eine noch vereinfachte Version der QuEChERS-Methode, um drei organochlorierte Verbindungen (Hexachlorbenzol; 1,2-Dichlorbenzol und Chloroform) in Bodenproben zu analysieren und anschließend durch GC-µECD zu quantifizieren. In der Arbeit verwendeten die Autoren drei verschiedene Bodentypen: Gartenerde mit einem hohen Anteil an organischer Substanz; ein Vertisol mit einem hohen Tongehalt; und ein zertifiziertes Referenzsedimentmaterial (Lehmboden).
Martins (2010) verwendete die QuEChERS-Methode – Bestimmung von Pestizidrückständen in bewässertem Reisboden unter Verwendung von mit gesättigter Lösung von Calciumhydroxid und LC-MS / MS modifizierten Quechern zur Bestimmung von Rückständen von Clomazona, Fipronil, Imazapique, Imazetapyr, Propiconazol, Thiametoxam und Trifloxystrobin.
Ramos et al. (2010) entwickelten eine modifizierte QuEChERS-Methode zur Bestimmung von 11 Pestiziden in drei Bodentypen (Wald, Zierpflanzen und Landwirtschaft). Eine modifizierte Version der QuEChERS-Methode wurde zur Bestimmung von Organophosphat-Pestiziden (Etoprofos, Dimetoat, Diazinon, Malaoxon, Chlorpyrifos-methyl, Fenitrion, Malation, Chlorpyrifos, Fenamiphos und Fosmet) und eines Pestizids der Thiadiazin-Klasse (Buprofezin) entwickelt durch GC-NPD.
Drożdżyński et al. (2011) ermittelten 160 Pestizide in Weinen mittels dispergierter Festphasenextraktion im Mischmodus und CG-EM.
Costa (2012) führte eine Studie zur QuEChERS-Methode zur Bestimmung von Pestiziden in Pfirsichen in Sirup mit mehreren Rückständen durch. Die LOQs der Pestizide in dieser Studie variierten zwischen 1,0 und 10,0 μg.kg-1 und basierten auf der Kurve, um die Leistung der Methode und die Linearität zu überwachen. Nach Angaben des Autors zeigten die analytischen Kurven Werte von r größer als 0,99; mit Wiederfindungswerten für abgelassene Pfirsiche zwischen 83,4 und 120,4% mit einem RSD von weniger als 14,9% für die meisten Analyten und 68,6 bis 124,6% mit einem RSD von weniger als 19,8%.
Studien von Tsipi et al. (2015) befassen sich mit der Quantifizierung von Rückständen der 2,4-D-Metaboliten durch Flüssigkeits- und Gaschromatographie, die an das Massenspektrometer gekoppelt ist.
Ramos et al. (2016) zitieren, dass die QuEChERS-Methode bei der Extraktion von Pestiziden in Böden nur achtmal angewendet wurde und dass in den meisten Fällen Gaschromatographie mit Massenspektrometrie (CG-EM) -Detektion angewendet wurde, außer in drei Fällen, in denen Gaschromatographie mit Elektroneneinfangdetektoren (CG-DCE) wurden angewendet; Stickstoff- und Phosphor- (CG-DNF) und Mikroelektroneneinfangdetektion (CG-DμCE).
Dong et al. (2017) ermittelten Rückstände von Metaflumizon in Boden- und Kohlproben unter Anwendung der QuEChERS-Methode. Die Autoren berichten, dass für Metaflumizon in Böden und Kohl Wiederfindungswerte zwischen 77,6 und 87,9% mit einer relativen Standardabweichung (RSD) von 3,5 und 7,9% erhalten wurden. Die LOD- und LOQ-Werte des Verfahrens für die gleichen Proben betrugen 0,001 mg.kg-1 bzw. 0,004 mg.kg-1.
Nach Iglesias (2016) verlief der Prozess der Kopplung der Flüssigkeitschromatographie an die Massenspektrometrie aufgrund der Inkompatibilität zwischen den im HPLC-Teil verwendeten hohen Flussraten sehr langsam, was es schwierig machte, das Elutionsmittel der Chromatographiesäule direkt in die Quelle von zu transportieren das Spektrometer, das im Hochvakuum arbeitet. Nachdem diese Schwierigkeiten gelöst wurden, wurde die Flüssigkeitschromatographie mit einer Massenspektrometrie-Kopplungsschnittstelle (LC-MS) zunehmend als hervorragende Technik zur Bestimmung verschiedener Analytreste eingesetzt.
Ogihara (2018) verwendete die QuEChERS-Methode und eine hocheffiziente Flüssigkeitschromatographie in Verbindung mit sequentieller Massenspektrometrie zur Bestimmung von Pestiziden mit mehreren Rückständen im Boden. In ihrer Arbeit wurden die drei Versionen der QuEChERS-Methode, “Original” -, “Acetat” -Puffer und “Citrat” -Puffer, in Abwesenheit und Gegenwart des Reinigungsschritts bei der Extraktion von Pestiziden aus dem Boden und der UHPLC- bewertet. MS / MS mit zusätzlichem internen Standard von Triphenylphosphat in ihrer Quantifizierung und Bestätigung. Die entwickelte Methode zielte darauf ab, bestimmte physikalische und chemische Eigenschaften von 20 vom Autor ausgewählten Pestiziden mit ihrer jeweiligen Zeit zu korrelieren, um sie in Gegenwart und Abwesenheit von Licht in der Umwelt abzuleiten.
Alle diese Untersuchungen kamen zu dem Schluss, dass die klassischen Methoden zur Bestimmung von Pestiziden in Böden nicht kosteneffektiv sind, da es sich um Verfahren handelt, die viele Schritte erfordern, die normalerweise auf der erschöpfenden Extraktion der Matrix mit anschließenden Reinigungsstufen beruhen -up für die Entfernung von coextrahierten Materialien vor der instrumentellen Analyse.
AUSWAHL DER PROBEN FÜR DEN VALIDIERUNGSSCHRITT
Die für die Validierungsphase verwendeten Proben stammten aus weißem Boden, der vor und während des Pflanzens keiner Behandlung mit Pestiziden unterzogen wurde. Nach der chromatographischen Bestimmung waren diese Proben frei von Pestiziden und zeigten bei Retentionszeiten, die denen von Verbindungen von analytischem Interesse ähnlich waren, kein chromatographisches Signal.
Der in den Studien verwendete Boden wurde als Eutrophic Arenic Hydromorphic Planossolo klassifiziert, das zur Kartierungseinheit in der Gemeinde Tanguá in der Gemeinde Rio de Janeiro gehört. Die Region weist ein flaches bis leicht welliges Relief mit einem Substrat aus neueren alluvialen Sedimenten auf.
Die physikalischen und chemischen Eigenschaften dieses Bodens sind: pH-Wert Wasser (1: 1) = 4,8; P = 6,0 mg L-1; K = 120 mg L-1; Ton = 26%; M.O. = 2,3%; Ca = 5,0 cmolc L-1 ; Mg = 2,0 cmol L-1 ; Al = 1,7 cmolc L-1 und SMP-Index 5.1
REAGENZIEN, LÖSUNGSMITTEL UND GASE
Aceton P. A.; Acetonitril – UHPLC; Wasserfreies Magnesiumsulfat; Natriumchlorid P.A.; PSA – UHPLC; Destilliertes Wasser; Reinstwasser, gereinigt im Milli-Q-Plus-System; Synthetische Luft 99,9% rein; C18 – Patronen für SPE; Natriumchlorid; Dichlormethan – Ultra Resi-analysiert; Ethanol-UV-IR-HPLC; Extran neutral; Ace Argon, analytisch, als Kollisionsgas im CLUE-MS / MS-System verwendet; Stickstoffgas, das als Desolvatisierungsgas in der Elektrosprayquelle verwendet wird; Methanol-UV-IR-HPLC; Bondesil-PSA-Sorptionsmittel mit einer Partikelgröße von 50 μm;
AUSSTATTUNG
Marconi Shaker Modell M227; Fanem Gewächshaus Modell F 330; Vortex Shaker IKA Modell MS 3 Digital; Präzisions-Analysenwaage; Metler Toledo; Modell XP205; Seriennummer B018030980; Präzisions-Analysenwaage; SARTORIUS Modell SARTORIUS – Seriennummer 71205517; Zentrifuge; Eppendorf, Modell 5810R; Eppendorf automatische Mikropipetizer mit variabler Kapazität; pH-Meter Metler Toledo S 220; Milli-Q Wasserreinigungssystem, hergestellt von MilliPore; Flüssigchromatograph Waters Acquity Ultraperformance LC; Vier sequentielle Massenspektrometer des Modells XE Premier.
OPTIMIERUNG DER METHODE – CHROMATOGRAPHISCHE UND MASSENSPEKTROMETERBEDINGUNGEN
Die Analyse wurde unter Verwendung eines Acquity UPLC®-Systems durchgeführt, das an Quattro Premier XE® (Waters Corp., Ma, USA) gekoppelt war.
Acquity UPLC®-System bestehend aus einer Binärpumpe, einem automatischen Probenehmer und einem Säulenofen.
Die chromatographische Trennung wurde an der Waters Acquity BEH UPLC® C18-Säule (100 × 2,1 mm ID, 1,7 µm) durchgeführt. Zusammensetzungen der mobilen Phase A (5 mM Ammoniumformat + 0,01% Ameisensäure, pH 4,00) und der mobilen Phase B (Acetonitril: mobile Phase A, 95: 5), Gradient: 0-1 min (10% B); 1 bis 5,5 min (55% B); 5,5 bis 10,5 min (100% B); 12 min (10% B). Die verwendete Flussrate betrug 0,3 ml min-1 , die Ofentemperatur der Säule betrug 30ºC, die Temperatur des Autosamplers betrug 25ºC. Der Injektor wurde auf eine Vollschleifeninjektion von 10 µL eingestellt und die Gesamtausführungszeit betrug 12 min.
Das Quattro Premier XE® Massenspektrometer wurde mit einer Elektrospray-Ionisationsquelle im positiven Modus (ESI+) betrieben. Die Betriebsparameter wurden für die folgenden Bedingungen eingestellt: Kapillarspannung: 3,5 kV; Ionenquellentemperatur: 120 ° C, Desolvatisierungstemperatur: 450 ° C; Kegelgasstrom (N2): L.h-1; Desolvatisierungsgasstrom (N2): 500 L.h-1; Kollisionsgasstrom (Ar): 0,15 mL.min-1. Die Kegelspannungen, die Kollisionsenergien und die Quantifizierungs- und Bestätigungsübergänge für jeden Analyten wurden aus der direkten Infusion einer Lösung von 1 µg.mL-1 ermittelt. Die Infusion von Analyten wurde mit den mobilen Phasen A und B (1: 1) mit einer Flussrate von 0,1 mL.min-1 im Vollabtastmodus durchgeführt. Nach dem Einstellen dieser Parameter wurde die Methode zur Überwachung mehrerer Reaktionen (MRM) verwendet, um Analyten zu identifizieren und zu quantifizieren.
Die Wahl der mobilen Phase, des Ionisationsmodus (positiver ESI), der Quantifizierungs- und Bestätigungsübergänge wurde gemäß der Literatur (Aguilera-Luiz et al., 2011; Rubensam et al., 2011) und den chemischen Eigenschaften der Analyten getroffen. Einige der im Quattro Premier XE®-System verwendeten Parameter, wie z. B. die Kapillarspannung; Ionenquellentemperatur; Die Desolvatisierungstemperatur wurde unter anderem während der Kalibrierung des Instruments durch den Hersteller festgelegt. Die Vorläuferionen jedes Analyten wurden durch direkte Infusion beobachtet. In den meisten Fällen wurde das protonierte Ion [M+ H]+ beobachtet.
ANALYTISCHE STANDARDS
Die analytischen Standards der untersuchten Pestizide und die Herstellung von Arbeitslösungen (Anreicherungsvorratslösungen)
Die Analysestandards für die verwendeten Pestizide wurden von der AccuStandart Company erworben. Tabelle 1 zeigt den Reinheitsgrad (%) und die Klasse fester analytischer Standards, die für die Entwicklung dieser Arbeit verwendet wurden.
Tabelle 1 – Feste analytische Standards, die bei der Arbeit verwendet werden
| AGROTOXISCH | REINHEIT (%) |
| Azoxystrobin | 99,4 |
| Boscalida | 95,5 |
| Carbendazim | 98,7 |
| Chlorantraniliprol | 98,4 |
| Clothianidin | 96,5 |
| Diafentiuron | 99,9 |
| Diphenoconazol | 100 |
| Dimetomorfe | 98 |
| Espinetoram | 96,8 |
| Spinosad | 96,6 |
| Fenuron | 98 |
| Imidacloprid | 99,5 |
| Indoxacarb | 97,3 |
| Metalaxyl M. | 98 |
| Methoxyfenozid | 99,5 |
| Thiamethoxam | 100 |
Quelle: AccuStandart in New Haven, Connecticut, USA – 2018
Mit diesen Standards wurde die Stammanreicherungslösung hergestellt, die die Analyten enthielt. Diese Lösung ist nur einen Monat gültig und muss sorgfältig in einem Bernsteinkolben mit einem Spund und einer Teflonkappe bei -18 ° C bei ultrakalter Temperatur gelagert worden sein.
Alle zur Herstellung von Lösungen und Analysen verwendeten Glaswaren wie Pipetten, Messkolben, Becher usw. wurden ordnungsgemäß kalibriert und identifiziert, um Volumenfehler bei den Bestimmungen zu vermeiden.
Anfänglich wurden 10 ml einer 1000 mg.L-1 Stammanalyselösung jedes Pestizids hergestellt. Die Standards wurden in 0,02% Methanol in Eisessig gelöst, die die gleichen Bestandteile der mobilen Phase sind, die in der Flüssigkeitschromatographie verwendet wurden, um die Verbindungen zu analysieren, und die Stammlösungen wurden in Bernsteinkolben bei einer Temperatur von -18ºC gelagert.
Unter Verwendung der Methode aufeinanderfolgender Verdünnungen wurden für jedes untersuchte Pestizid individuelle analytische Lösungen in einer Konzentration von 100 mg.L-1 mit den gleichen Lösungsmitteln hergestellt. Aus diesen Lösungen wurde eine Mischung in einer Konzentration von 10 mg.L-1 hergestellt, die alle Pestizide enthielt. Schließlich wurde aus der Standardlösung 10 mg.L-1 eine Mischung mit einer Konzentration von 0,200 mg.L-1 hergestellt, die alle Pestizide enthielt.
Ausgehend von der 1,0 mg L-1 Zwischenmischung wurden analytische Arbeitslösungen in Konzentrationen von 0,4 hergestellt; 2,0; 4,0; 10,0; 20,0 und 40,0 µg.L-1, die alle Pestizide in jeder Konzentration enthalten, zur Erstellung der Eichkurve des Flüssigkeitschromatographen. Zur Injektion in das UHPLC-MS / MS-System wurden Verdünnungen im Verhältnis 1: 1 (v / v) dieser Lösungen in mobiler Phase Methanol / Wasser vorgenommen, so dass die Endkonzentrationen der bewerteten Arbeitslösungen 0,2 betrugen; 0,2; 1,0; 2,0; 5,0; 10,0 und 20,0 µg L-1 für alle Pestizide, aus denen die Anreicherungsvorratslösung besteht. Die Verdünnungen der analytischen Lösungen in der angesäuerten mobilen Phase zielen darauf ab, die Ionisierungseffizienz der Analyten zu verbessern, das chromatographische Signal, die Form und Symmetrie der Peaks zu verbessern. Diese Arbeitslösungen wurden verwendet, um die Linearität der Methode zu untersuchen. Alle Lösungen wurden in Bernsteinflaschen gelagert und bei -18 ºC gelagert.
VALIDIERUNG DER METHODE
Die zur Validierung der Analysemethode verwendete Parametrisierung bestand aus einer Leistungsüberprüfung. Daher sind Parameter wie: analytische Kurve und Linearität, Nachweisgrenze, Quantifizierungsgrenze, Genauigkeit (Wiederfindung) und Präzision (Wiederholbarkeit und Zwischengenauigkeit) zu einer Referenz geworden, um zuverlässige Ergebnisse zu erhalten.
BESTIMMUNG DES WEISSEN REFERENZBODENS
Aufgrund der Komplexität der Matrix und der geringen Konzentration, in der sich die Pestizide im Boden befinden (Größenordnung von ppm bis ppb), war die Vorbereitung der Probe für zuverlässige Ergebnisse unerlässlich.
Der schwierigste Schritt bestand darin, eine Probe weißen Bodens zu erhalten, der frei von Pestiziden ist und als Nullreferenz für die Studien dienen kann. Dieser Boden sollte mit Pestiziden kontaminiert werden, um der Optimierung durch die QuEChERS-Methode zu folgen.
Zur Überprüfung des weißen Bodens wurde die als A1BR05 codierte Bodenprobe in zwei Behandlungen verwendet:
BEHANDLUNG 01
In 5 Röhrchen einer 50-ml-Falcon-Zentrifuge wurden 15 g Boden gewogen und die Behandlung 01 wurde basierend auf der ursprünglichen QuEChERS-Methode durchgeführt: 15 g Boden + 5 ml H2O; 30 Sekunden vortexen, 1 ml Ersatz (Propoxur 1,0 µg/ml); Wirbel 30 Sek.; 15 min warten; 15 ml ACN von UHPLC-Qualität; Vortex 30 Sek.; 6 g MgSO4 + 1,5 g NaCl; Zentrifugation (7 min); Extraktion des Überstands und Verdünnung mit Methanol RP 1: 1 zur Injektion in den Flüssigkeitschromatographen.
Die Propoxur 1,0 µg.mL-1 Lösung (Surrogat) wurde als Marker verwendet. Wenn das weiße Chromatogramm ohne Peaks erschien, musste sichergestellt werden, dass das System eine Empfindlichkeit gegenüber den Verbindungen zeigte, und Propoxur war die Verbindung, die diese Sicherheit brachte.
BEHANDLUNG 02
Es wurde auch eine Behandlung mit der modifizierten Methode mit Calciumhydroxidlösung mit pH = 12,6 getestet, um ein besseres Hintergrundbild der Proben in Bezug auf die Bodenmatrix wie folgt zu erhalten:
In 5 Röhrchen einer 50 ml Falcon-Zentrifuge wurden 15 g Erde gewogen und die Behandlung mit 02 – 15 g Erde + 5 ml H2O durchgeführt; Wirbel 30 Sek.; 1 ml Ersatz; Wirbel 30 Sek.; 5 ml Ca(OH)2 -Lösung mit einem pH-Wert von 12,6; 5 min warten; 15 ml ACN von UHPLC-Qualität; Wirbel 30 Sek.; 6 g MgSO4 + 1,5 g NaCl; Zentrifugation (7 min); Extraktion des Überstands und Verdünnung mit Methanol RP 1; 1 zur Injektion in den Flüssigkeitschromatographen.
Es wurde gezeigt, dass die Bodenproben A1BR05 bei beiden Behandlungen frei von Pestiziden waren. Ab diesem Stadium wurde die Probe A1BR05 zum Referenzweißboden dieser Arbeit.
Die zwei vorherigen Behandlungen wurden für Bodenproben verwendet, die mit der Anreicherungslösung benannt wurden, die die interessierenden Analyten enthielt.
Die Methode wurde zunächst für die Extraktion des Pestizid-Fokus optimiert: Azoxystrobin, Boscalide, Carbendazim, Chloranthranilprol, Clothianidin, Diafentiuron, Diphenoconazol, Dimetomorfe, Espinetoram, Espinosade A, Espinosade D, Fenuron, Imidacloprido, Espinosade D, Fenuron, Imidacloprido durch Bestimmung mittels UHPLC-MS / MS (Ultra Performance Flüssigkeitschromatographie), bei der die Matrix sauber sein muss, um Hintergrundstörungen zu minimieren (Matrixeffekt – backgroud). Daher waren die Behandlungen 1 und 2 die Ausgangspunkte für die Extraktion dieser Pestizide aus der Bodenmatrix.
Bei beiden Behandlungen waren die Extrakte sehr klar. Trotzdem wurden Fraktionen von jedem der vorgenannten Tests in einer dispersiven Reinigungsstufe getestet. In dieser Stufe wurde eine dispersive Extraktion in der festen Phase der Reinigung des Haftklebemassen getestet, wobei 4 weitere Behandlungen erzeugt wurden, was insgesamt 8 verschiedene Tests ergab.
Der Extrakt wurde durch eine PTFE-Membran filtriert und dann wurde 1 ml Extrakt in einen Messkolben überführt, mit 1 ml Methanol gelöst und diese endgültige Lösung in einen Chromatographiekolben überführt. Ab diesem Zeitpunkt wurden 5 Mikroliter jeder Probe doppelt in den mit dem Massenspektrometer gekoppelten Ultra-Performance Flüssigkeitschromatographen injiziert. Die Tests wurden doppelt durchgeführt und die Ergebnisse sind in Tabelle 2 aufgetragen
Tabelle 2 – Ergebnisse der Behandlungen 1 und 2 der Analyse des Pestizidfokus durch Ultra-Performance-Flüssigkeitschromatographie
| Wiederherstellungsfaktor ohne clean-up (%) | Wiederherstellungsfaktor ohne clean-up (%) | Wiederherstellungsfaktor nach der clean-up (%) | ||
| Behandlung 01 | Behandlung 02 | Behandlung 01 | Behandlung 02 | |
| Abamectin | 88/115 | 65/70 | 97,5 | 115 |
| Diafentiuron | 43/37 | 67/72 | 53 | 81,2 |
| Azoxystrobin | 101/100 | 93/94 | 162,5 | 160 |
| Pymetrozin | 30/28 | 81/75 | 30 | 120 |
| Acibenzolar-S-Methyl | 138/131 | 36/38 | 162 | 47,5 |
| Mandipropamid | 108/109 | 110/102 | 180 | 162 |
| Ciromazine | 60/61 | 81/80 | 95 | 125 |
| Methomyl | 108/116 | 107/105 | 177 | 225 |
| Pymetrozin | 30/28 | 81/75 | 45 | 120 |
| Acetamiprido | 103/104 | 99/103 | 167 | 155 |
| Buprofezina | 98/97 | 96/96 | 167 | 166 |
| Lucifenuron | 68/67 | 64/63 | – | – |
| Thiamethoxam | 104/98 | 70/69 | 165 | 112 |
Quelle: Ausarbeitung der Autoren
Die Behandlung mit Calciumhydroxidlösung (pH = 12,3) zeigte für die meisten Analyten bessere Wiederfindungsfaktoren, mit Ausnahme von Acibenzolar-S-Methyl, das sich bei keiner der Behandlungen gut erholte. Dies ist möglicherweise auf die Methylierung der Schwefelverbindungsstruktur zurückzuführen, die es schwierig macht, sie in Acetonitril zu extrahieren. Somit wurde die Validierung basierend auf Behandlung 02 fortgesetzt.
FORTIFIKATIONSTESTS ZUR BEURTEILUNG DER GENAUIGKEIT DER METHODE
Zur Untersuchung der Genauigkeit dieser Analysemethode wurden Anreicherungstests durchgeführt, um den Wiederfindungsfaktor der untersuchten Verbindungen zu überprüfen. Somit wurden fünf Anreicherungen der “Referenzweiß” -Proben bei zwei verschiedenen Konzentrationsniveaus durchgeführt, was insgesamt 10 Tests ergab.
Jede Anreicherungsstufe wurde zweimal injiziert, was insgesamt n = 10 (5 Extraktionen × 2 Injektionen) ergab.
Für das Extraktionsverfahren der modifizierten QuEChERS-Methode wurden 15,00 g homogener Boden in Polypropylenröhrchen (Typ Falcon) mit einem Schraubverschluss (50 ml Fassungsvermögen) gewogen. Dann wurde jede Probe mit 5 ml Milli-Q-Wasser angefeuchtet und 30 Sekunden in Vortex kräftig gerührt. Die Anreicherung wurde in beiden Mengen unter Verwendung von kalibrierten Pipetten von 0,5 ml und 1,0 ml in Konzentrationen von 0,200 µg.mL-1 für alle in der Anreicherungslösung enthaltenen Pestizide zugegeben.
Nach der Anreicherung wurden die Proben durch 30 Sekunden Vortexen homogenisiert und 15 Minuten bei 20 ° C gehalten. Forschungen von PINTO et al. (2010) weisen darauf hin, dass es wichtig ist, dass die Probe mit den Analyten genügend Zeit hat, damit das Lösungsmittel verdampft, und dass daher eine stärkere Wechselwirkung zwischen den Verbindungen und der Matrix besteht. Laut dem Autor bringt dieser Schritt den Test näher an die Realität der Interaktion, die mit Proben im Feld auftritt.
Dann wurden mit Hilfe einer volumetrischen Pipette 5 ml gesättigte Calciumhydroxidlösung, pH 12,3, in jedes Röhrchen gegeben, und nach dem Schließen wurde 30 Sekunden lang verwirbelt. Lassen Sie es 10 Minuten lang in Ruhe reagieren. Dann wurden 15 ml Acetonitril von Lichrosolv-Qualität (zur Rückstandsanalyse) in jedes Röhrchen gegeben und erneut 30 Sekunden gerührt.
In jedes Röhrchen wurden 1,5 Natriumchlorid (NaCl) und 6,0 g MgSO4 (wasserfreies Magnesiumsulfat) gegeben und weitere 30 Sekunden verwirbelt, um die größtmögliche Wechselwirkung zwischen der Extraktflüssigkeit und den festen Reagenzien zu erzielen. Schließlich wurden die Röhrchen 7 Minuten bei 3000 U / min zentrifugiert.
In einem Fläschchen mit einer Kapazität von 2 ml wurde eine 1: 1 (v / v) -Verdünnung durchgeführt, in die 1,0 ml des nach der Extraktion erhaltenen Extrakts und 1,0 ml der mobilen Phase gegeben wurden, gefolgt von einer Analyse durch LC-MS/MS.
Schließlich wurden Verdünnungen der Endextrakte im Verhältnis 1: 1 (v / v) in der mobilen Phase (Reinstwasser) durchgeführt. Die Rückgewinnung der Verbindung wurde bei Konzentrationen von 1 und 2 ug / kg Boden für alle Pestizide in der Anreicherungslösung bewertet.
Die Erholungsergebnisse waren bei beiden Behandlungen interessant. Die Behandlung 02 erwies sich jedoch als wirksamer bei der Extraktion einer größeren Anzahl von Pestiziden mit Wiederfindungsraten im Bereich von 64 bis 110%, mit Ausnahme von Acibenzolar-S-Methyl, dessen Wiederfindungsraten bei Behandlung 1 ausdrucksstärker waren.
Die Ergebnisse der Experimente zur Bewertung der besten Extraktions- und Reinigungsmethode sind in Tabelle 1 – Tests zur Optimierung des Extraktionsschritts aufgeführt.
Die Reinigungsphase zeigte keine signifikante Verbesserung der Ergebnisse. Daher wurde beschlossen, die Validierungsphase unter Verwendung der Behandlung 02 ohne die Reinigungsphase fortzusetzen.
OPTIMIERUNG DER METHODE
Die Extraktionsmethode wurde gemäß dem Analytical Quality Assurance Guide optimiert. Die in diesem Handbuch festgelegten Werte entsprechen den Anforderungen des Beschlusses 2018/657 (European Comission/SANTE, 2018).
Die folgenden Parameter wurden bewertet: Selektivität; Matrixeffekt; Linearität; Wiederherstellung; Nachweisgrenze (LOD); Bestimmungsgrenze (LOQ) und Wiederholbarkeit. Die Berechnungen wurden mit MassLynx® und Microsoft Excel® durchgeführt. Bei dem vorgeschlagenen Verfahren wurde die Selektivität durch Analyse von fünf Wiederholungen der Probenahmeextrakte von Tomatenböden bewertet. Die Linearitätsbewertung umfasste das Auftragen einer analytischen Lösungsmittelkurve aus der MIX 1-Arbeitslösung, die die 295 Analyten enthielt, mit fünf Punkten, die dem 0-, 0,5-, 1,0-, 1,5- und 2,0-fachen des für jeden Analyten festgelegten Rückstandshöchstgehalts entsprachen. Der Cochran-Test wurde verwendet, um die Homogenität der Variationen zu bewerten, die für jedes Konzentrationsniveau erhalten wurden. Die Kalibrierungsdaten wurden durch gemeinsame lineare Regression bei Homoskedastizität oder gewichtete lineare Regression bei Heteroskedastizität ausgewertet.
Für die Extraktion der Proben wurde der gleiche Referenzboden aus den ersten Tests verwendet. Bei dem vorgeschlagenen Verfahren wurde die Selektivität durch Analyse von fünf Wiederholungen der Probenahmeextrakte aus dem Boden der Tomatenplantage bewertet. In 10 Zentrifugenröhrchen vom Typ Falcon wurden 15 g gewogen und 1 ml der Arbeitslösung wurde zugegeben. In Röhrchen mit den Nummern 1 und 5 wurde 1 ml der Anreicherungslösung mit Arbeitslösungen der Stufe 1 in jedes Röhrchen gegeben, und in Röhrchen mit den Nummern 6 bis 10 wurde zusätzlich 1 ml der Anreicherungslösung mit Arbeitslösungen der Stufe 2 in jedes Röhrchen gegeben in ein leeres Reagenzglas ohne Anreicherung mit Propoxur-Qualitätskontrolle. Die 11 Röhrchen erhielten alle Schritte, die in Behandlung 2 verwendet wurden, und danach wurde 1 ml des Extrakts in einen Kolben überführt und 1 ml MeOH (Bestandteil der mobilen Phase) wurde aufgetragen. Dann wurden 5 & 5µL ; l in den an das sequentielle Massenspektrometer gekoppelten Ultra Performance Liquid Chromatograph unter den gleichen Bedingungen injiziert, die für die Tests 3 und 4 der Behandlung 2 angenommen wurden. Jede Probe wurde in fünffacher Ausfertigung injiziert, wie in Guia Sante (2018) zur Validierung von empfohlen chromatographische Methoden.
Der Matrixeffekt wurde bewertet, indem die Steigung der Analysekurve im Matrixextrakt mit der Steigung der Analysekurve im Lösungsmittel unter Verwendung des F-Tests (Fisher Snedecor) verglichen wurde. Dann wurde der Student-t-Test angewendet, um die statistische Äquivalenz zwischen den Steigungen der analytischen Kurven im Lösungsmittel und in der Matrix zu bestimmen.
Die LOD und LOQ wurden unter Verwendung des Signal / Rausch-Verhältnisses der Ausrüstung berechnet. LOD war die Konzentration, die dem Dreifachen des Rauschens entspricht, und LOQ war die Konzentration, die dem Sechsfachen des Rauschens entspricht. Die Gewinnung und Wiederholbarkeit des Verfahrens wurde mit Bodenproben mit Peaks von zwei Niveaus durchgeführt: 0,5 bis 1,0, was dem 5-fachen MRL jedes Analyten entspricht, mit fünf Wiederholungen für jedes Niveau. Die mittlere Wiederfindung und die relative Standardabweichung (RSD) wurden für jede Stufe berechnet. Probenanalyse. Die Feldproben wurden freundlicherweise von Herstellern im brasilianischen Bundesstaat Rio de Janeiro zur Verfügung gestellt und mit der validierten Methode analysiert.
Die mit Calciumhydroxid modifizierte QuEChERS-Methode zeigte für die meisten Analyten bessere Wiederfindungsergebnisse als die ursprüngliche QuEChERS-Methode, hauptsächlich für Abamectin, Acetamiprid, Azoxystrobin, Buprofezina, Diafentiuron, Mandipropamid, Pymetrozin, Cyromazin, Metomil, Pimetrozin, Luciamenuron und. Mit der modifizierten Methode (QuEChERS-Methode mit Ca (OH) 2) lagen die erhaltenen Wiederfindungswerte im akzeptablen Bereich von 70-120% (ANVISA, 2018). Behandlung 2 hatte nur ein Wiederfindungsergebnis außerhalb des akzeptablen Bereichs von 80-110%, Acibenzolar-S-Methyl (37%). Der Reinigungsschritt mit dispersiver SPE führte zu keinen signifikanten Verbesserungen der Wiederfindungsraten. Der SPE-Reinigungsschritt war letztendlich nicht notwendig, da der erste erhaltene Extrakt klar war und akzeptable Wiederfindungsraten für die interessierenden Verbindungen zeigte, wie in Tabelle 2 gezeigt.
Daher war die Extraktionsmethode, die gewählt wurde, um dem Validierungsprozess zu folgen, die Methode, die auf Behandlung 2 (QuEChERS mit Calciumhydroxid) ohne den SPE-Reinigungsschritt unter Verwendung von MgSO4, PSA und C18 basierte.
Die Genauigkeit wurde unter Verwendung der folgenden Gleichung berechnet und als Prozentsatz der Wiederfindung ausgedrückt (INMETRO, 2007):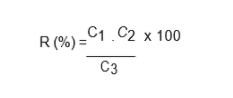 Wo:
Wo:
C1 = Konzentration bestimmt in der angereicherten Probe;
C2 = Konzentration bestimmt in der nicht angereicherten Probe;
C3 = Konzentration zur Anreicherung.
Bei den fünf Wiederholungen, die mit dem Matrixextrakt durchgeführt wurden, gab es keine Interferenz mit dem gleichen m / z und der gleichen Retentionszeit der Analyten. Somit war es möglich, die Selektivität des Verfahrens zu erhalten. Das Arbeitsblatt zur Auswertung der Analysekurve – Validierung der Multi-Waste-Methode durch CLUE-EM / EM ist in Abbildung 1 dargestellt.
Abbildung 3 – Daten zur Auswertung der Analysekurve – Validierung der Multiresidue-Methode durch CLUE-EM / EM
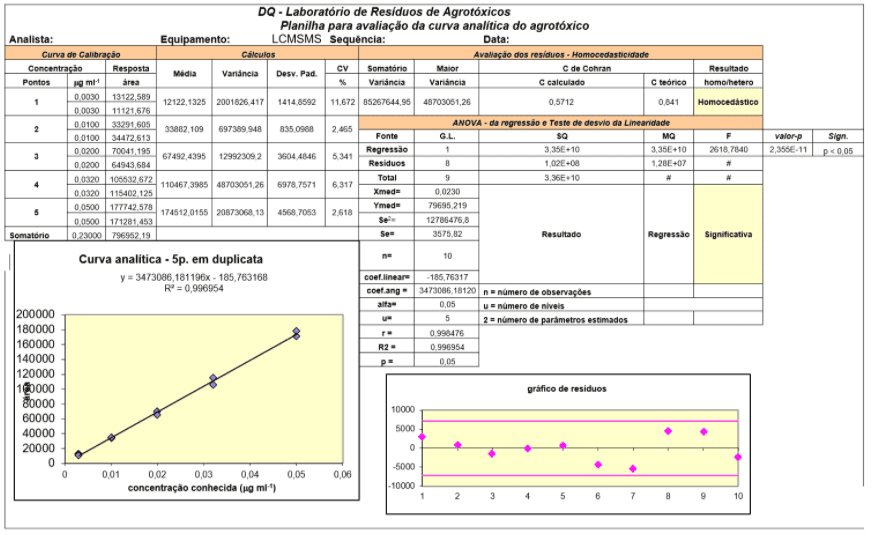
Die Leistungsmerkmale der optimierten Methode, der Arbeitsbereich, die Werte der Korrelations- (r) und Bestimmungskoeffizienten (R2) für die für jeden Analyten erhaltenen Analysekurven sind in Tabelle 3 gezeigt.
Tabelle 3 – Zusammenfassung der Bewertungsergebnisse – Korrelations- (r) und Bestimmungskoeffizienten (R2)
| Substanz | Validierung der analytischen Kurve | |
| r | R2 | |
| Azoxystrobin | 0,9995 | 0,9989 |
| Boscalida | 0,9982 | 0,9964 |
| Carbendazim | 0,9996 | 0,9993 |
| Chlorantraniliprol | 0,9996 | 0,9991 |
| Clothianidin | 0,9963 | 0,9925 |
| Diafentiuron | 0,9993 | 0,9986 |
| Diphenoconazol | 0,9988 | 0,9975 |
| Dimetomorfe | 0,9991 | 0,9982 |
| Espinetoram | 0,9973 | 0,9947 |
| Spinosad | 0,9987 | 0,9974 |
| Fenuron | 0,9986 | 0,9973 |
| Imidacloprid | 0,9995 | 0,9990 |
| Indoxacarb | 0,9981 | 0,9961 |
| Metalaxyl M. | 0,9998 | 0,9997 |
| Methoxyfenozid | 0,9969 | 0,9939 |
Quelle: Ausarbeitung der Autoren
Der Matrixeffekt wurde für die Bodenvalidierung nicht bewertet, da er für alle untersuchten Pestizide als signifikant angesehen wurde.
Alle analysierten Substanzen zeigten ein homoskedastisches Verhalten im Arbeitsbereich von 0,0032 bis 0,0500 µg / ml.
Es wird beobachtet, dass für die meisten Analyten die Bestimmungskoeffizienten (r2) nahe eins waren, was eine gute Linearität zeigt, was ein homoskedastisches Dispersionsprofil (konstante Variation der experimentellen Fehler für verschiedene Beobachtungen) für die meisten Analyten anzeigt, was ermöglicht, dass die Standardkurven durch bewertet wurden lineare Regression nach der Methode der gewöhnlichen kleinsten Quadrate. Die gewichteten linearen Anpassungen (1 / x) wurden mit der MassLynx®-Software vorgenommen. Die für den Matrixeffekt berechneten Student-t-Werte lagen innerhalb der im SANTE-Leitfaden für die meisten Analyten geforderten Werte. Somit wurde die Kurve im Matrixextrakt verwendet, um die Proben einschließlich der Analyten zu quantifizieren, bei denen der Matrixeffekt nicht beobachtet wurde. Die für LOD und LOQ erhaltenen Werte sowie das Signal / Rausch-Verhältnis (Tabelle 4) erfüllten die von der National Health Surveillance Agency (ANVISA, 2018) für diese Analyten festgelegten Kriterien und bestätigten, dass die optimierte Methode für geeignet ist Einhaltung der geltenden Gesetzgebung in Brasilien. Um jedoch den europäischen Rechtsvorschriften zu entsprechen, müssen die erhaltenen LOD und LOQ überarbeitet werden, da sie dem festgelegten Höchstniveau sehr nahe kommen (EUROPEAN COMISSION, 2018).
Tabelle 4 – In der Bodenmatrix validierte Substanzen mit den jeweiligen Bestimmungsgrenzen und dem entsprechenden Signal / Rausch-Verhältnis
| Substanz | Validierung der analytischen Kurve | |
| LOQ (mg/kg) | Signalverhältnis/Lärm | |
| Azoxystrobin | 0,0066 | 538,39 |
| Boscalida | 0,0076 | 30,11 |
| Carbendazim | 0,0055 | 166,53 |
| Chlorantraniliprol | 0,0075 | 276,84 |
| Clothianidin | 0,0064 | 496.4 |
| Diafentiuron | 0,0038 | 72,37 |
| Diphenoconazol | 0,0077 | 38,83 |
| Dimetomorfe | 0,0072 | 27,62 |
| Espinetoram | 0,0074 | 10729,08 |
| Spinosad | 0,0078 | 1757,72 |
| Fenuron | 0,0080 | 1630,64 |
| Imidacloprid | 0,0132 | 207,19 |
| Indoxacarb | 0,0062 | 171,61 |
| Metalaxyl M. | 0,0072 | 1104,23 |
| Methoxyfenozid | 0,0074 | 327,56 |
Quelle: Ausarbeitung der Autoren
Es war möglich, den LOQ für Substanzen auf dem validierten Anreicherungsniveau festzulegen, da sie ein Signal / Rausch-Verhältnis von mehr als 10 hatten.
GENAUIGKEIT (WIEDERHERSTELLUNGSRATE) UND GENAUIGKEIT (WIEDERHOLBARKEIT)
Zur Untersuchung der Wiederfindungsrate und Wiederholbarkeit wurde die Bodenprobe A1BR05 mit verschiedenen Volumina der Anreicherungslösung angereichert, wobei in fünf Wiederholungen eine Mischung der interessierenden Pestizide zusammengesetzt wurde, nachdem nach der Extraktion das Volumen von 1 ml entfernt worden war und 1: 1 mit Methanol (MeOH) zur weiteren chromatographischen Analyse durch UHPLC-MS / MS verdünnt. Diese Anreicherungskonzentration entspricht der theoretischen Konzentration von LQ. Jedes Replikat wurde zweimal injiziert.
Injektionskonzentrationen:
– Stufe 1: 0,00323 µg/mL, was 0,0067 mg / kg entspricht,
– Stufe 2: 0,00625 µg/mL, was 0,0133 mg / kg entspricht,
Die Ergebnisse der Genauigkeitswiederherstellung sind in Tabelle 5 beschrieben.
Tabelle 5 – Ergebnisse der Genauigkeit – Wiederherstellung
| Substanz | VALIDIERUNG DER ANALYTISCHEN KURVE | ||||
| Niveau 1 | Niveau 2 | ||||
| Fazit. (mg kg-1) | Rec. (%) | Fazit. mg kg-1) | Rec. (%) | ||
| Azoxystrobin | 0,0066 | 95,4 | 0,0142 | 106,3 | |
| Boscalida | 0,0076 | 111,5 | 0,0149 | 110,5 | |
| Carbendazim | 0,0055 | 80,4 | 0,0125 | 94,2 | |
| Chlorantraniliprol | 0,0075 | 109 | 0,0153 | 114 | |
| Clothianidin | 0,0062 | 92,1 | 0,0146 | 109,9 | |
| Diafentiuron | 0,0038 | 53,7 | 0,0042 | 32,5 | |
| Diphenoconazol | 0,0077 | 112,2 | 0,0148 | 111 | |
| Dimetomorfe | 0,0072 | 105,4 | 0,015 | 111,5 | |
| Espinetoram | 0,0074 | 103,5 | 0,0149 | 111,5 | |
| Spinosad | 0,0078 | 114,4 | 0,0159 | 118,9 | |
| Fenuron | 0,008 | 115,9 | 0,016 | 119,4 | |
| Imidacloprid | 0,0063 | 92,1 | 0,0143 | 106,4 | |
| Indoxacarb | 0,0062 | 90,3 | 0,0135 | 101 | |
| Metalaxyl M. | 0,0072 | 105,1 | 0,0155 | 116,6 | |
| Methoxyfenozid | 0,006 | 88,1 | 0,0146 | 109,6 | |
Quelle: Ausarbeitung der Autoren
Die Wiederfindungsergebnisse liegen im akzeptablen Bereich (70-120%). Die Methode zeigte für die meisten untersuchten Verbindungen eine gute Wiederholbarkeit mit RSD-Werten unter 20%.
Alle untersuchten Verbindungen erfüllten die von der European Comission (2018) empfohlenen Kriterien mit Ausnahme des Pestizids Diafentiuron, da es auf beiden Ebenen keine Rückgewinnung im akzeptablen Bereich (70% bis 120%) ergab, was eine Validierung unmöglich machte.
Nach der Validierung wurde die Methode zur quantitativen Bestimmung des Pestizidgehalts in Bodenproben verwendet, die in den Regionen gesammelt wurden, in denen die Tomaten gepflanzt wurden. Die erhaltenen Ergebnisse sind in der folgenden Tabelle 6 dargestellt:
Tabelle 6 – Zusammenfassung der Ergebnisse der tatsächlichen Bodenproben, die in den Tomatenpflanzgebieten gesammelt wurden (mg / kg Boden)
| Pestizid | P1 | P2 | P3 | P4 | P5 | P6 | P7 |
| 1. Azoxystrobin | 0,003 | 0,0025 | 0,009 | 0,06 | |||
| 3. Boscalida | Spuren | ||||||
| 4. Carbendazim | 0,0065 | 0,0085 | |||||
| 5. Clomazon* | |||||||
| 6. Chlorantraniliprol | 0,036 | X | 0,071 | 0,223 | |||
| 7. Clothianidin | 0,027 | X | 0,0185 | ||||
| 8. Diafentiuron | 0,0255 | X | |||||
| 9. Diphenoconazol | 0,003 | 0,038 | 0,0285 | ||||
| 10. Dimetomorfe | 0,0105 | 0,48 | 0,096 | 0,0275 | |||
| 11. Espinetoram | X | X | |||||
| 12. Spinosad A | 0,002 | ||||||
| 13. Spinosad D | X | X | |||||
| 14. Fenuron | X | Spuren | X | Spuren | X | X | |
| 15. Imidacloprid | X | Spuren | 0,008 | 0,006 | |||
| 16. Indoxacarb | 0,0235 | 0,0015 | |||||
| 17. Metalaxyl M. | Spuren | Spuren | 0,0085 | 0,024 | 0,001 | ||
| 18. Methoxyfenozid | 0,1415 | 0,0105 | |||||
| 19. Thiametoxan | 0,0315 | 0,0225 | 0,0255 |
Hinweis: P1 bis P6 (Tomatenpflanzgebiete) Quelle: Von den Autoren erstellt.
Pestizidrückstände wurden in Tabelle 6 gefunden. Das Pestizid Fenuron wurde in allen Bodenproben gefunden, außer in den Gebieten P1 und P2. Dieses Pestizid ist eines der in Brasilien ausgeschlossenen oder nicht registrierten Pestizide, wie in Tabelle 7 gezeigt. Die in den Proben gefundenen Konzentrationen dieser Verbindung wurden jedoch als Merkmale klassifiziert, dh unter der Nachweisgrenze durch die Analysemethode.
In Bezug auf die Pestizide Azoxitrobin und Carbendazim ist die Situation in den Gebieten 6 und 7 besorgniserregend, zumal diese Pestizide von ANVISA nicht für die Anwendung beim Anpflanzen von Tomaten zugelassen sind, wie in Tabelle 7 gezeigt.
Tabelle 7 – Konzentrationen von UNAUTHORIZED Pestiziden zur Anwendung auf Tomaten in den untersuchten Böden
| Pestizid | P6 | P7 | ||||
| 5-10 | 10-20 | 10-20 | 0-5 | 5-10 | 10-20 | |
| 1. Azoxystrobin | 0,0090 | 0,0035 | 0,006 | 0,060 | 0,012 | 0,003 |
| 2. Carbendazim | 0,0065 | 0,0065 | 0,0045 | 0,0085 | 0,003 | 0,002 |
| Agotoxisch | LOQ (µg kg-1) |
| Azoxystrobin | 7,0 |
| Boscalida | 7,0 |
| Carbendazim | 5,0 |
| Chlorantraniliprol | 7,0 |
| Clothianidin | 7,0 |
| Diafentiuron | 7,0 |
| Diphenoconazol | 7,0 |
| Dimetomorfe | 7,0 |
| Espinetoram | 7,0 |
| Spinosad | 7,0 |
| Fenuron | 7,0 |
| Imidacloprid | 13,0 |
| Indoxacarb | 7,0 |
| Metalaxyl M. | 7,0 |
| Methoxyfenozid | 7,0 |
Quelle: Ausarbeitung der Autoren
SCHLUSSBETRACHTUNGEN
Die QuEChERS-Methode war mit geringfügigen Änderungen für die Mehrfachrückstands-Extraktion der Analyten in Böden aus dem Pflanzen von, mit klaren Extrakten und störungsfrei geeignet. Die hochauflösende Flüssigkeitschromatographie in Verbindung mit der sequentiellen Massenspektrometrie (UPLC-MS / MS) war für den Nachweis und die Quantifizierung dieser Analyten in der Matrix ausreichend, wobei die Wiederfindungswerte zwischen 70 und 120% Standardabweichung unter 20% lagen Quantifizierung zwischen 7 und 13 µg.L-1 und Quantifizierungsgrenzen zwischen 2 und 4 µg.L-1, entsprechend der geltenden Gesetzgebung. Die Ergebnisse des Feldtests zeigten, dass die Methode zur quantitativen Analyse von Pestiziden geeignet ist, die in Böden ausgewertet wurden, die aus dem Anbau von Tomaten im Arbeitsbereich stammen.
Die validierte Methode entspricht den in der Literatur vorgeschlagenen Werten für die Analyse von Pestizidrückständen mit chromatographischen Methoden (EUROPEAN COMMISSION, 2018). Die Bestimmung der untersuchten Pestizide durch UHPLC-MS / MS war zufriedenstellend und ermöglichte die Durchführung einer qualitativen Analyse, die aus für jeden Analyten charakteristischen und quantitativen Massenfragmenten durch den MRM-Erfassungsmodus erhalten wurde. Die für die Bestimmung durch UHPLC-MS / MS optimierten chromatographischen Bedingungen ermöglichten die Identifizierung und Quantifizierung der untersuchten Verbindungen in einer Analysezeit von weniger als 15 Minuten, was als Analysewerkzeug und für die Gesellschaft insgesamt einen großen Gewinn bringt.
Im Allgemeinen zeigten alle Proben Pestizidkonzentrationen, die durch ANVISA-Monographien zugelassen wurden. Die Ergebnisse für konventionelles Pflanzen sind jedoch höher als die Werte für Plantagen des nachhaltigen und ökologischen Systems, obwohl sie innerhalb der erforderlichen Konformitäten liegen. Es dient jedoch als Warnung für das Vorhandensein von Pestiziden auf dem Tisch der Gesellschaft.
Die Verwendung von Pestiziden Azoxystrobin und Carbendazim (nicht zugelassene Pestizide) zur Anwendung in Tomaten bringt konkrete Bedenken in Bezug auf etwas mit sich, das normalerweise erwartet wurde: die gezielte Verwendung von Pestiziden zur Steigerung der Produktion, unabhängig davon, was die Gesetze empfehlen.
Wenn es einerseits besorgniserregend ist, nicht zugelassene Pestizide in den Proben zu finden, zeigt dies andererseits, dass die durch diese Arbeit validierte Methode aufgrund der Fähigkeit, selbst nicht zur Verwendung zugelassene Pestizide zu quantifizieren, sehr effektiv ist.
Diese Arbeit erzielte nicht nur zufriedenstellende Ergebnisse für den Pestizidfokus, sondern erwies sich auch als geeignet, Rückstände für 240 Pestizide zwischen von ANVISA in Brasilien zugelassenen und nicht zugelassenen Pestiziden mit Bestimmungskoeffizientenwerten von mehr als 0,99 zu bestimmen. LOQ-Werte von 13 µg kg-1 für Spinosad und 7,0 µg kg-1 für die anderen Pestizide. Die Methode zeigte eine gute Präzision mit RSD-Werten <20% und eine Genauigkeit mit Wiederfindungsraten zwischen 70 und 120% für die überwiegende Mehrheit der analysierten Verbindungen.
VERWEISE
AZEVEDO, E. de – Alimentos Orgânicos: ampliando conceitos de saúde humana, ambiental e social, Livros G.Play, 2018.
ANASTASSIADES M, Lehothay S.J, Stajnbaher D, Schenck F.J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residue in produce. J. AOAC Int. 86: 412-431, 2003.
ANVISA – Agência Nacional de Vigilância Sanitária. Disponível em: <http://portal.anvisa.gov.br> 2014. Acesso em: 11 de outubro de 2018.
ANVISA – NOTA TÉCNICA 02/2017 – Posicionamento da Anvisa referente à Recomendação 028/2016 aprovada em Reunião Plenária do Conselho, 2017
CARDOSO, Maria Helena Wohlers Morelli; GOUVÊA, Adherlene Vieira; NÓBREGA, Armi Wanderley da; ABRANTES, Shirley de Mello Pereira – Validação de método para determinação de resíduos de agrotóxicos em tomate: uma experiência laboratorial – Ciência e Tecnologia de Alimentos, Campinas, 30 (Supl.1): 63-72, maio 2010.
CARVALHO, C.R.F., PONCIANO N.J.; SOUZA P.M. de. – Viabilidade econômica e de risco da produção de tomate no município de Cambuci/RJ, – Ciência Rural, Brasil, 2014.
CETESB (Companhia Ambiental do Estado de São Paulo) – Qualidade do solo, 2020. Disponível em: https://cetesb.sp.gov.br/solo/poluicao/ – Acessado em 09/2020.
COMMISSION DECISION No. 657/2002. Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. Off. J. Eur. Commun. L 221: 8-36.
COMMISSION REGULATION (E.C). No. 1881/2006. Setting maximum levels for certain contaminants in foodstuffs. Off. J. Eur. Commun. L364: 5-24.
CONAMA – Resolução nº 420/2009 – Disposição sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e suas providências. Disponível em: < http://www.mma.gov.br/port/conama/legiabre.cfm?codlegi=620> Acesso em: 02 jan. 2019.
CURRENCE, T.M. Tomato breeding. I. Species, origin and botanical characters. Handbuch der Pflanzenzuchtung, p. 351-369, 2013.
DIEZ, C.; TRAAG, W. A.; ZOMMER, P.; MARINERO, P.; ATIENZA, J.; J. – Extraction and chromatographic analysis of the cadusafós nematicide, chromatography, 1131, 1135 – 2006.
DONG, H.; XIAO, K. – Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce – Food Chemistry, Volume 229, Pages 502-508 – Elsevier, 2017.
DROŻDŻYŃSKI, D.; KOWALSKA, J. – Rapid analysis of organic farming insecticides in soil and produce using ultra-performance liquid chromatography/tandem mass spectrometry, Springer, Talanta, 2009.
DROŻDŻYŃSKI , D.; WALORCZYK, S.; GNUSOWSKI , B – Multiresidue determination of 160 pesticides in wines employing mixed-mode dispersive-solid phase extraction and gas chromatography–tandem mass spectrometry, Volume 85, Issue 4, Talanta – Elsevier, Pages 1856-1870, 2011.
ESALQ – Simpósio de defensivos agrícolas: tópicos relevantes e principais desafios, ESALQ / 2017
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2017.
EUROPEAN COMMISSION – Directorate General for Healph and Food Safety, 2018.
EMBRAPA – Manual de Procedimentos de Coleta de Amostras em Áreas Agrícolas para Análise da Qualidade Ambiental: Solo, Água e Sedimentos, 2016.
EPA (Environmental Protection Agency) – Pesticide safety for farmworkers, 2017.
FAOSTAT – Food and Agriculture Organization of the United Nations – Produtividade Mundial, 2018. Disponível em: <http://faostat.fao.org/site/340/default.aspx>. Acesso em. 28 de novembro de 2019.
FERNANDES V.C, LEHOTAY S.J, GEIS-ASTEGGIANTE L, KWON H, Mol H.G.J, van der Kamp H, MATEUS N, DOMINGUES V.F, DELERUE-Matos, C. Analysis of pesticides residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two dimensional GC-time-of-flight MS comparing organic and integrated pest management farming. Food Addit Contam. 31: 262-270, 2014.
IARC. INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. WHO. World Health Organization. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 82: 183-193, 2002.
IBAMA-Ministério do Meio Ambiente: Avaliação do Potencial de Periculosidade Ambiental (PPA) de Agrotóxicos e Afins. Disponível em: Acesso em: abr. 2020.
IBGE – Indicadores / Estatística da Produção Agrícola Levantamento Sistemático da Produção Agrícola 2017-2018, 2019.
IGLESIAS, Hoshi A. – Introdução ao Acoplamento Cromatografia Líquida – Espectrometria de Massas Waters Technologies do Brasil, Barueri, SP, 2016.
INMETRO. Instituto Nacional de Metrologia, Qualidade e Tecnologia. Orientação sobre Validação de Métodos Analíticos – DOQ-CGCRE-008. Rev. 07, 28 f, jul 2018.
JUNIOR, J.C.L, – Manejo integrado de pragas na cultura do tomate: uma estratégia para a redução do uso de agrotóxicos – Extensão em Foco (ISSN: 2317-9791), 2019.
LESUEUR, A. B; KNITTL P. A ; GARTNER, M. A; MENTLER A. C, FUERHACKER M.B.- Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuECheRS method – Science Direct, 2008.
MALDANER L, JARDIM ICSF. O estado da arte da cromatografia líquida de ultraeficiência [The art state of ultra performance liquid chromatography]. Quim Nova. 32: 214-222. Portuguese, 2009.
OGIHARA, Camila Honda – Desenvolvimento e validação de método para a determinação de multirresíduos de agrotóxicos em solo empregando o método quechers e a cromatografia líquida de ultra alta eficiência acoplada à espectrometria de massas sequencial – UNICAMP, 2018.
ORTELLI, D; COGNARD, E; JAN, P; EDDER, P. Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry and Chromatography. 877: 2363–2374, 2009.
PINTO, C.G., Martín, S.H., PAVÓN, J.L.P., CORDERO, B.M., A simplified Quick, Easy, Cheap, Effective, Rugged and Safe approach for the determination of trihalomethanes and benzene, toluene, ethylbenzene and xylenes in soil matrices by fast gas chromatography with mass spectrometry detection. Anal. Chim. Acta, 689, 129-136, 2011.
PRESTES, O.D. ; Friggi, C.A.; ADAIME M.B, ZANELLA, R. QuECheRS – QuEChERS-a modern method of sample preparation for multiresidue determination of pesticides in food by chromatographic methods coupled to mass spectrometry]. Quim Nova. 32: 1620-1634. Portuguese, 2009.
RAMOS, A. M. et al. Evaluation of a modified QuEChERS method for the extraction of pesticides from agricultural, ornamental and forestal soils. Analytical and Bioanalytical Chemistry, v. 396, p. 2307-2319, 2016.
RASHID A., NAWAZ S., BARKER H., AHMAD I., AND ASHRAF M., Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry. J. Chromatogr. A, 2010, 1217, 2933-2939
RIBAS, P. P.; MATSUMURA, A. T. S. A química dos agrotóxicos: impacto sobre a saúde e meio ambiente. Revista Liberato, 2009, 10, 14, 149-158.
RUBENSAM G, Barreto F, HOFF RB, KIST TL, PIZZOLATTO, TM. A liquid–liquid extraction procedure followed by a low temperature purification step for the analysis of macrocyclic lactones in milk by liquid chromatography–tandem mass spectrometry and fluorescence detection. Anal Chim Acta. 705:24-29, 2011.
SOBER – Revista de Economia e Sociologia Rural (RESR) – Relatório – 1º Trimestre 2019, MAPA, Brasil, 2019
TSIPI, D.; BOTITSI, H.; ECONOMOU, A. Mass Spectrometry for the Analysis of Pesticide Residues and their Metabolites. New Jersey: John Wiley & Sons, 2015.
VEIGA, Denise Piccirillo – O impacto do uso do solo na contaminação por agrotóxicos das águas superficiais de abastecimento público – USP, São Paulo, 2017
ANHANG – FUßNOTENREFERENZEN
8. Die durch Phytophthora infestans verursachte Spätfäule ist eine hochaggressive Krankheit in der Tomatenkultur, die in kurzer Zeit ganze Pflanzen dezimieren kann.
9. Von ANVISA festgelegte agronomische Parameter in Bezug auf die vom Nationalen Rat für Lebensmittel- und Ernährungssicherheit (CONSEA) genehmigte Empfehlung 028/2016 – bilden eine der Komponenten für die Berechnung der Exposition und die Risikobewertung, die eine Voraussetzung für die Registrierung oder Zulassung eines Pestizids in ist neue Ernten.
[1] PhD in Umweltwissenschaften und -ingenieurwesen von der Bundesuniversität Rio de Janeiro/Polytechnische Schule für Chemie/Programm für Umweltingenieurwesen (UFRJ/POLI/PEA); Master in Umweltwissenschaften und -ingenieurwesen von der Bundesuniversität von Rio de Janeiro/Polytechnische Schule für Chemie/Programm Umwelttechnik (UFRJ/POLI/PEA); Fachrichtung Chemiedidaktik (FIJ); Lizentiat in Chemie an der Universität des Staates Rio de Janeiro (UERJ).
[2] Berater. Promotion in Ingenieurwissenschaften am Programm für Bergbau, Metallurgie und Werkstofftechnik an der Bundesuniversität von Rio Grande do Sul.
[3] Berater. Promotion in Meerestechnik bei Coppe / UFRJ; Assoziierter Professor an der Polytechnischen Schule der Bundesuniversität von Rio de Janeiro und Pro-Rektor des Grundstudiums an der UFRJ.
[4] Berater. Promotion in Naturwissenschaften am Zentrum für Kernenergie in der Landwirtschaft / CENA – an der Universität von São Paulo.
[5] Master in Gesundheitsüberwachung im Gesundheitswesen (FIOCRUZ / INCQS).
[6] Promotion in Gesundheitsüberwachung im Gesundheitswesen (FIOCRUZ / INCQS).
[7] Promotion in Gesundheitsüberwachung im Gesundheitswesen (FIOCRUZ / INCQS).
Eingereicht: Dezember 2020.
Genehmigt: Januar 2021.


