ОРИГИНАЛЬНАЯ СТАТЬЯ
FERREIRA, Fernanda Amorim [1], PARAÍBA, Isabella Maria Rios [2], ELIAS, Laíse de Souza [3]
FERREIRA, Fernanda Amorim. PARAÍBA, Isabella Maria Rios. ELIAS, Laíse de Souza. Влияние мелатонина на морфофизиологию сердца крыс, вызванную гиперлипидемией. Revista Científica Multidisciplinar Núcleo do Conhecimento. 05-й год, Эд. 10, Вол. 13, стр. 130-143. Октябрь 2020 года. ISSN: 2448-0959, Ссылка доступа: https://www.nucleodoconhecimento.com.br/питание/влияние-мелатонина
РЕЗЮМЕ
Гиперлипидемии классифицируются как метаболические изменения и связаны с сердечно-сосудистыми заболеваниями, которые подчеркивают ишемическую атертотические заболевания. Сердечно-сосудистые заболевания имеют значительное участие в показателях смертности во всем мире, и, как следствие, он был объектом исследований, которые стремятся терапевтических инноваций. Мелатонин является гормоном, вырабатываемым в экологической фазе темноты шишковидной железы, которая играет антиоксидант, липидоснижающая, противовоспалительная функция, среди прочего, таким образом демонстрируя, чтобы быть мощной молекулой в лечении сердечно-сосудистых заболеваний. Таким образом, цель этой работы заключается в оценке влияния мелатонина на окислительный стресс и биохимических параметров у крыс, вызванных гиперлипидемией. Для этого, 15 самцов крыс-альбиносов (Rattus norvegicus albinus) были использованы, с 150 дней, исходя из биотерия кафедры морфологии и физиологии животных Федерального сельского университета Pernambuco. Эти животные содержались в клетках, с кормлением и водой ad libitum, температурой 22 градусов по Цельсию и искусственным освещением, которое установит фотопериод 12 часов света и 12 часов темноты (перевернутый цикл). В заключение, исследования показали, что мелатонин влияет на снижение перекисного окисления липидов, креатин киназы (CK) уровнях, а также снижение глутатиона. Как дешевый и хорошо переносится препарат, мелатонин может быть новым терапевтическим вариантом для сердечно-сосудистых заболеваний и лиц с гиперлипидемией.
Ключевые слова: атеросклероз, мелатонин, сердце, гиперлипидемия, окислительный стресс.
ВВЕДЕНИЕ
Гиперлипидемии метаболические изменения, которые происходят, когда циркулирующие уровни липидов превышают пределы нормальности в крови (BEVILACQUA et al., 2007). Это нерегулируемое производство может вызвать серьезные проблемы, в том числе сердечно-сосудистых заболеваний (ССЗ), таких как гипертония, атеросклероз, в дополнение к повреждению различных органов и тканей, тем самым характеризуя серьезную проблему общественного здравоохранения (EMET et al., 2016).
ССЗ имеют замечательное участие в показателях смертности во всем мире и, как следствие, были объектом исследований, которые направлены на терапевтические инновации. (SIMKO et al., 2016). Таким образом, в последние десятилетия поиск новых препаратов для лечения гиперлипидемии оценил роль веществ, которые действуют в борьбе с увеличением липидного профиля и воспаления, в дополнение к защите сосудистого эндотелия от окислительного стресса (JOCKERS et al., 2016). Среди этих веществ, мелатонин получил много последствий для лечения поражений в различных органах, в том числе сердца (YANG et al., 2014).
Мелатонин (N-ацетил-5-methoxytryptaline) (MEL) является нейроэндокринный гормон, вырабатываемый шишковидной железы (HARDELAND et al., 2006). Его секреция регулируется циклом экологического света/тьмы через супрахиазматическое ядро (SKENE et al., 2006). Так как его биосинтез начался ночью, от фоторецепторов сетчатки, которые посылают сигнал шишковидной железе, стимулируя выработку и высвобождение мелатонина (GOOLEY et al., 2003). Механизм действия MEL зависит от мембранных рецепторов, называемых MT1, MT2 и MT3, которые выражаются как индивидуально, так и вместе в различных тканях и органах, первые два выражаются как в сердце, так и в крысиной артерии (CAHILL; GRACE; BESHARSE, 1991) (LI; ZHANG; TANG, 2013).
Представляя рецепторы, широко распространенные организмом, MEL может быть ответственным за ряд физиологических событий (FARÍAS; ZEPEDA; CALAF, 2012). Первоначально его функция была ограничена регулированием цикла сна/бодрствования (SUN; HUANG, QU, Зу, 2015) однако, на протяжении многих лет другие функции были также зарегистрированы, такие как его антиоксидантная и противовоспалительная роль, в регуляции метаболизма липидов и глюкозы,(AGIL et al., 2011) (ESPINO; PARIENTE; RODRIGUEZ, 2011), а также его кардиопротекторное действие, имеющие важную роль на болезни сердца (TAN et al., 1998), такие как ишемия-реперфузия миокарда, атеросклероз, гипертония и сердечная недостаточность. (FAVERO et al., 2012) (BENOVA et al., 2013) (DOMINGUEZ; ABREU-GONZALEZ; REITER, 2014).
Исследования на крысах показали, что MEL производится кардиопротекторное действие против кардиотоксичности, вызванной химиотерапевтическими агентами и в последнее время амплитуда сердечного защитного эффекта осуществляется MEL (SUN; GUSDON, QU, 2016 г.). Кроме того, мелатонин оказался эффективным в снижении воздействия индуцированной ишемии на сердца крыс (YU и др., 2014), снижение сердечного ритма, снижение уровня белка креатинкиназы, (FAVERO et al., 2016), сохранение микроструктуры кардиомиоцитов (LIN et al., 2018), уменьшение сердечной аритмии и окисления липидов в результате сердечных ишемических процессов (TARE et al., 2014), в дополнение к улучшению сердечной функции и кровотока (ZHANG et al., 2017).
В связи с увеличением гиперлипидемии (KANG; KOH; LEE, 2011) и, следовательно, сердечно-сосудистых заболеваний (HARDELAND, 2015) и что мелатонин играет антиоксидантную функцию, (PANDI-PERUMAL et al., 2013) (COMMENTZ; HELMKE, 1995), (REITER et al., 2013) противовоспалительное и липидоснижание (ALLEGRA et al., 2003), необходимо изучить эффективность влияния мелатонина на сердечную морфофизиологию у крыс, вызванных гиперлипидемией. Таким образом, это исследование может способствовать развитию дополнительных терапевтических методов в лечении гиперлипидемии, а также сердечно-сосудистых заболеваний. Настоящее исследование направлено на оценку влияния мелатонина на сердечную морфофизиологию крыс, индуцированных к гиперлипидемии.
1. МАТЕРИАЛЫ И МЕТОДЫ
1.1 ЭКСПЕРИМЕНТАЛЬНЫЕ ГРУППЫ
Мы использовали 15 самцов крыс-альбиносов (Rattus norvegicus albinus), 150 дней назад, из биотериума кафедры морфологии и физиологии животных Федерального сельского университета Pernambuco. Эти животные содержались в клетках, с кормлением и водой ad libitum, температурой 22 градусов по Цельсию и искусственным освещением, которое установило фотопериод 12 часов света и 12 часов темноты (перевернутый цикл). Зверей взвешивали и случайным образом делили на три экспериментальные группы: GC: крысы без индукции гиперлипидемии; GI: крысы, вызванные гиперлипидемией и обработанные плацебо; GM: крысы, вызванные гиперлипидемией и обработанные мелатонином.
1.2 ИНДУКЦИЯ ГИПЕРЛИПИДЕМИИ
Чтобы вызвать гиперлипидемию, Triton WR 1339, также известный как тилоксапол, неанионный детергент с полимерной структурой, вводили внутрибрюшинно в дозе 400 мг / кг массы тела, растворенной в 0,9% NaCl. Это вещество использовалось в экспериментальной работе, поскольку оно способно вызывать гиперлипидемию у животных. Для контроля гиперлипидемии после третьего дня индукции проводили биохимические анализы. Для этого использовали наборы Labtest® в соответствии с указанными каталогами: LDL, HDL, триглицериды и общий холестерин. Животные, не вызванные гиперлипидемией (GC), получали аналогичные дозы физиологического раствора таким же образом.
1.3 АДМИНИСТРАЦИЯ МЕЛАТОНИНА
Мелатонин вводили в устной форме (VO), поэтому 10 мг/кг мелатонина было растворено в 200 микролитров алкоголя. Затем, в 7:00.m., этот раствор был разбавлен в питьевой воде животных, стоит отметить, что бутылки были покрыты алюминиевой фольгой для защиты от содержания светимости.
1.4 БИОХИМИЧЕСКИЙ АНАЛИЗ
Образцы крови собирали до индукции и после лечения. Для анализа перед индукционным периодом крыс мобилизовали с помощью механического соперника и собирали кровь путем боковой каудальной пункции с использованием катетера (24G). Для анализа после индукции и соответствующей обработки кровь собирали сердечной пункцией. Материал центрифугировали, супернатант хранили в Eppendorf и хранили в морозильной камере при -20 °c до момента дозирования. Для этого использовался набор Labtest®, соответствующий конкретному каталогу: белок СК (133-1 / 500).
1.5 АНАЛИЗ ОКИСЛИТЕЛЬНОГО СТРЕССА: ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ И СНИЖЕНИЕ ГЛУТАТИОНА
Перекисное окисление липидов оценивали путем измерения уровней веществ, реагирующих с тиобарбитуровой кислотой (TBARS), в то время как восстановленный глутатион (GSH) определяли путем измерения небелковых сульфгидрильных групп. Для этого фрагменты сердца мацерировали в 1,15% KCl в соотношении 10 мл / 1 г до полной гомогенизации собранного материала. Гомогенат переносили в пробирку, в которую добавляли 2 мл регента (0,375% тиобарбитуровой кислоты и 75% трихлоруксусной кислоты) на каждый мл смеси. Дублирующие пробирки герметично закрывали и нагревали на водяной бане (100 °C) в течение 15 минут. Супернатант отделяли и измеряли оптическую плотность при 535 нм.
1.6 ЭТИЧЕСКИЕ ПРОЦЕДУРЫ
Эксперимент был разработан в соответствии с этическими принципами в экспериментах на животных, в соответствии с законом No 11,794 от 8 октября 2008 года, и проект был одобрен Комиссией по этике по использованию животных (CEUA) Федерального сельского университета Pernambuco (UFRPE – процесс No 23082.015842/2014) (ANNEX A).
1.7 СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистические анализы проводились с использованием непараметрического метода Kruskal-Wallis, где средства сравнивались тестом Wilcoxon-Mann Whitney, что составляет 95% значимости.
2. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Окислительный ущерб, индуцированный в клетках и тканях, был связан с физиологическими процессами и этиологией различных заболеваний, таких как старение, и хронических заболеваний, таких как диабет, рак и атеросклероз, где часто наблюдается увеличение содержания наиболее важных реактивных видов кислорода (EROs) в биологическом контексте (ROSEN et al., 2001) (HIGASSHI et al., 2014).
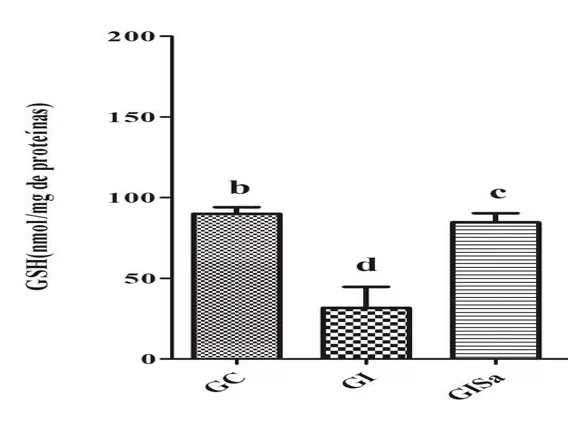
Анализ уровней TBARS в сердечной ткани после индукции к гиперлипидемии выявил высокие значения по сравнению с контрольной группой. Тем не менее, мелатонин лечения затухающих уровней TBARs, представляя значения, аналогичные GC (рисунок 1). Анализ тканей уровней GSH в группе, индуцированных и обработанных мелатонином были выше животных группы GI, также демонстрируя значения, аналогичные значениям контрольной группы (рисунок 2). При этом мы поняли, что мелатонин был в состоянии уменьшить окислительный ущерб.
Этот гормон имеет возможность похищать реактивный кислород (EROs) и азот (ERN) видов, действуя для предотвращения окислительного повреждения (ALVES et al., 2014) в дополнение к стимулированию экспрессии антиоксидантных ферментов (PANDI-PERUMAL et al., 2013) за счет роста экспрессии Keap1-Nrf2 (MANCHESTER et al., 2015).
ONK (2016) обнаружил, что использование 20 мг/кг мелатонина привело к снижению уровня TBARS. Аналогичным образом, Debosree Ghosh (2015) показал, что минимальная доза 10 мг/кг мелатонина была необходима для защиты от повышенного перекисного окисления липидов в красных кровяных телец крыс.
Многочисленные исследования были зарегистрированы демонстрации изолированного влияния мелатонина на продвижение уровней GSH, например, повышенные уровни GSH были продемонстрированы у животных с тиоацетамид-индуцированной повреждения печени (TAA) и лечение мелатонином (10 мг/кг) Чеховска (2015) и Goc (2017), наблюдается высокий уровень GSH в тканях печени животных, обработанных 10 мг/кг MEL в одиночку или в сочетании с нитропроприза натрия (SNP), антигипертного препарата с токсическими эффектами по сравнению с изолированной администрацией SNP.
В нашем исследовании, группа индуцированных к гиперлипидемии и лечение мелатонином, продемонстрировали снижение уровня белка CK по сравнению с гиперлипидемической группы (ГИ), однако, по отношению к контрольной группе, никаких существенных изменений не наблюдалось (таблица 1).
Креатинкиназы (CK) является фермент, который играет важную роль в генерации энергии для мышечного метаболизма. Он присутствует преимущественно в мышечной ткани, но также находится в тканях мозга (BRANCACCIO et al., 2008). Среди молекул, используемых в качестве маркера повреждения сердца, креатинкиназы (CK) часто описывается как лучший косвенный маркер повреждения мышечной ткани (FOSCHINI et al., 2017). Это снижение уровня CK может быть связано с мембраной стабилизации эффекты, данные MEL. Исследования in vitro показывают, что MEL способен ингибировать интернализации фосфатидилсерина, экспрессии Бакса и ксантина оксидазы, вызывая тем самым стабилизацию липидного билейера (KOCIC et al., 2017).
Ghaeli (2015), сообщает, что у пациентов с инфарктом миокарда с переуровень ST-сегмента, представленных на первичное перкутанное коронарное вмешательство, введения мелатонина плюс стандартное лечение значительно снизился уровень креатина киназы-MB. Кроме того, MEL по-прежнему имеет противовоспалительные и противоапоптотические эффекты, таким образом, будучи в состоянии действовать в борьбе с сердечно-сосудистыми заболеваниями (CHEN и др., 2016).
3. ЗАКЛЮЧЕНИЕ
В заключение, исследования показали, что мелатонин влияет на снижение перекисного окисления липидов, креатин киназы (CK) уровнях, а также увеличение снижения глутатиона у гиперлипидемии индуцированных крыс.
ССЫЛКИ
AGIL, A, Navarro-Alarcon M, Ruiz R, et al. Beneficial effects of melatonin on obesity and lipid profile in young Zucker diabetic fatty rats. J Pineal Res 2011; 50:207–212.
ALLEGRA, M.; REITER, R. J.; TAN, D. X.; et al. The chemistry of melatonin’s interaction with species. J. Pineal Res., v.34, n.1, p. 1–10, 2003.
ALVES, R.S.C. et al. A melatonina e o sono em crianças. Pediatria. v. 1, p. 587-594,2004.
BRANCACCIO, P.; Maffulli, N.; Buonauro, R. Serum enzyme monitoring in sports medicine. Clin Sports Med 2008. 27:1-1.
BENOVA, T, Viczenczova C, Radosinska J, et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias. Can J Physiol Pharmacol 2013; 91:633–639.
BEVILACQUA, MR, GIMENO SGA, BEVILACQUA MR, Matsumura LK, et al. Hiperlipidemias e Fatores Dietéticos: Estudo Transversal Entre Nipo-Brasileiros. Arq Bras Endocrinol Metab. 2007 mar/out; 51/4: 547-558.
CAHILL, GM, Grace MS, Besharse JC. Rhythmic regulation of retinal melatonin: metabolic pathways, neurochemical mechanisms, and the ocular circadian clock. Cell Mol Neurobiol 1991; 11:529–560.
CHEN, S,J. et al. Melatonin enhances interleukin-10 expression and suppresses chemotaxis to inhibit inflammation in situ and reduce the severity of experimental autoimmune encephalomyelitis. Int Immunopharmacol. v.31, p.169-77, 2016.
COMMENTZ, J. C.; HELMKE, K. Precocious puberty and decreased melatonin1583 secretion due to a hypothalamic hamartoma. Horm.Res. v.44, n. 6, p. 271-275,1584 1995.
CZECHOWSKA, G. et al. Protective effects of melatonin against thioacetamide induced liver fibrosis in rats. J Physiol Pharmacol. v.66, p.567-79, 2015.
DEBOSREE Ghosh; Sudeshna Paul, Aindrila Chattopadhyay, Debasish Bandyopadhy. Melatonin and aqueous curry leaf extract in combination protects against lead induced oxidative stress mediated injury to rat heart: a new approach. Journal of Pharmacy Research 2015,9(12),618-634.
DOMINGUEZ -Rodriguez A, Abreu-Gonzalez P, Reiter RJ. The potential usefulness of serum melatonin level to predict heart failure in patients with hypertensive cardiomyopathy. Int J Cardiol 2014; 174:415–417.
EMET M, Ozcan H, Ozel L, Yayla M, Halici Z, Hacimuftuoglu A. A review of melatonin, its receptors and drugs. Eur J Med. 2016; 48(2):135-41.
ESPINO J, Pariente JA, Rodriguez AB. Role of melatonin on diabetes-related metabolic disorders. World J Diabetes 2011; 2:82–91.
FARIAS JG, Zepeda AB, Calaf GM. Melatonin protects the heart, lungs and kidneys from oxidative stress under intermittent hypobaric hypoxia in rats. Biol Res. 2012; 45(1):81-5.
FAVERO G, Rodella LF, Reiter RJ, et al. Melatonin and its atheroprotective effects: a review. Mol Cell Endocrinol 2014; 382:926–937.
FAVERO G, Franceschetti L, Buffoli B, Moghadasian MH, Reiter RJ, Rodella LF, et al. Melatonin: Protection against age-related cardiac pathology. Ag Res Rev. 2016; 22: S1568-1637. 16.
FOSCHINI D, Prestes J, Charro MA. Relação entre exercício físico, dano muscular e dor muscular de início tardio. Rev Bras Cineantropom Desempenho Hum 2007;9(1):101-6.
GHAELI P, Vejdani S, Ariamanesh A, et al. Effect of melatonin on cardiac injury after primary percutaneous coronary intervention: a randomized controlled trial. Iran J Pharm Res 2015; 14:851–855.
GOC, Z. et al. Protective effects of melatonin on the activity of SOD, CAT, GSH-Px and GSH content in organs of mice after administration of SNP. Chin J Physiol. v.1, p. 28-34 2017.
GOOLEY, JJ, Lu J, Fischer D, Saper CB. A broad role for melanopsin in nonvisual photoreception. J Neurosci 2003; 23:7093–7106.
HARDELAND, R, Pandi-Perumal SR, Cardinali DP. Melatonin. Int J Biochem Cell Biol. 2006; 38:313–316.
HARDELAND, R. Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance. Endocrine. v. 27, p. 111-118, 2015.
HIGASSHI; T Maruhashi, K Noma, Y Kihara Oxidative stress and endothelial dysfunction: Clinical evidence and therapeutic implications, Trends in Cardiovascular Medicine Volume 24, Issue 4, May 2014, Pages 165-169.
JOCKERS, R, Delagrange P, Dubocovich ML, Markus RP, Renault N, Tosini G, et al. Update on melatonin receptors: IUPHAR Review. Br J Pharmacology. 2016; 173:2702-25.
KANG, J. W.; KOH, E. J.; LEE, S. M. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. v.50, p. 403-411, 2011.
KOCIC, G., Tomovic, K., Kocic, H., et al., 2017. Antioxidative, membrane protective and antiapoptotic effects of melatonin, in silico study of physico-chemical profile and efficiency of nanoliposome delivery compared to betaine. RSC Adv. 7, 1271–1281.
LI, X.; ZHANG, M.; TANG, W. Effects of melatonin on streptozotocin-induced retina neuronal apoptosis in high blood glucose rat. Neurochem Res. v.38, p.669- 76, 2013.
LIN, X, Zhao T, Lin CH et al. Melatonin provides protection against heat strokeinduced myocardial injury in male rats. J Pharm Pharmacol. 2018 Jun;70(6):760-767.
MANCHESTER LC, et al. Melatonin: an ancient molecule that makes oxygen metabolically tolerable. J Pineal Res. v.59, p. 403-19, 2015
ONK D, et al. Melatonin Attenuates Contrast-Induced Nephropathy in Diabetic Rats: The Role of Interleukin-33 and Oxidative Stress. Mediators Inflamm. v.2016, p. 508-28, 2016.
PANDI-PERUMAL, S. R. et al. Melatonin antioxidative defense: therapeutical implications for aging and neurodegenerative processes. Neurotox Res. v.23, p.267-300, 2013.
REITER, R. J. et al. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans – Acta Biochim. Pol.v. 50, p. 1129-1146, 2003.
RODRIGUEZ C, et al. Regulation of antioxidant enzymes: a significant role for melatonin. J Pineal Res. 2004;36(1):1–9.
ROSEN, P P Nawroth, G King, W Möller, H J Tritschler, L Packer. The role of oxidative stress in the onset and progression of diabetes and its complications: a summary of a Congress Series sponsored by UNESCO-MCBN, the American Diabetes Association and the German Diabetes Society – May-Jun 2001;17(3):189-212.
SIMKO F, Baka T, Paulis L, Reiter RJ. Elevated heart rate and non dripping heart rate as potential targets for melatonin: a review. J Pineal Res. 2016; 61:127-37.
SKENE, DJ, Arendt J. Human circadian rhythms: physiological and therapeutic relevance of light and melatonin. Ann Clin Biochem. 2006; 43:344–353.
SUN H, Huang FF, Qu S. Melatonin: a potential intervention for hepatic steatosis. Lipids Health Dis. 2015; 14:75.
SUN H, Gusdon AM, Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr Opin Lipidol. 2016; 27(4):408-13.
TAN DX, Manchester LC, Reiter RJ, et al. Ischemia/reperfusion-induced arrhythmias in the isolated rat heart: prevention by melatonin. J Pineal Res. 1998; 25:184–191.
TARE M, Parkington HC, Wallace EM et al. Maternal melatonin administration mitigates coronary stiffness and endothelial dysfunction, and improves heart resiliência to insult in growth restricted lambs. 2014
YANG Y, Sun Y, Yi W, Li Y, Fan C, Xin Z, et al. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases. J Pineal Res. 2014;57(4):357-66. doi: 10.1111/jpi.12175.
YU L, Sun Y, Cheng L, Jin Z, Yang Y, Zhai M, et al. Melatonin receptor mediated protection against myocardial ischemia/reperfusion injury: role of SIRT1. J Pineal Res. 2014; 57(2):228-38.
ZHANG, Y. et al. Melatonin protects against arsenic trioxide-induced liver injury by the upregulation of Nrf2 expression through the activation of PI3K/AKT pathway. Oncotarget. 2017.
ПРИЛОЖЕНИЕ
Рисунок 1: Оценка уровней TBARS (нмоль / мг белка) в сердечной ткани животных в разных экспериментальных группах) * Средние значения, за которыми следует одна и та же буква, существенно не отличаются по тесту Kruskal-Wallis и апостериорному тесту Данна (p < 0,05). GC: контроль; GI: индуцированная гиперлипидемия; GIM: индуцировали гиперлипидемию и лечили мелатонином.
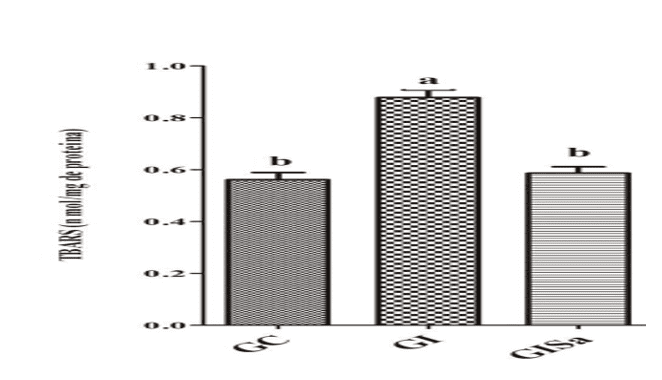
Рисунок 2. Оценка уровней GSH (нмоль / мг белка) в сердечной ткани животных в разных экспериментальных группах) * Средние значения, за которыми следует одна и та же буква, существенно не различаются по тесту Kruskal-Wallis и апостериорному тесту Данна (p < 0,05). CG: контроль; GI: индуцированная гиперлипидемия; GIM: индуцировали гиперлипидемию и лечили мелатонином.
Таблица 1: Биохимический анализ экспериментальных групп
[1] Окончил центр питания Университета Унинассау.
[2] Студент магистратуры по вопросам общественного питания и общественного здравоохранения FCNAUP окончил университетский центр Унинассау.
[3] Консультантом. Кандидат биологических наук о животных. Степень магистра в области бионауки животных. Специализация в Морфологии. Степень в области биологических наук.
Представлено: Август 2020.
Утверждено: октябрь 2020 года.