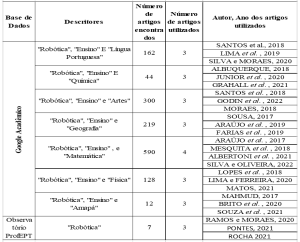
ОБЗОРНАЯ СТАТЬЯ
FRANCO, Guilherme Sousa Leal [1]
FRANCO, Guilherme Sousa Leal. Острая почечная недостаточность в отделении интенсивной терапии: диагностика у тяжелобольных пациентов. Revista Científica Multidisciplinar Núcleo do Conhecimento. 05-й год, Эд. 11, Vol. 01, стр. 42-53. Ноябрь 2020 года. ISSN: 2448-0959, Ссылка доступа: https://www.nucleodoconhecimento.com.br/здравоохранение/тяжелобольных-пациентов
РЕЗЮМЕ
Острая травма почек (OПП) является распространенным клиническим синдромом у тяжелобольных пациентов и связана с более длительным пребыванием в больнице, более широкое использование больничных ресурсов, а также более высокая заболеваемость и смертность. Общая цель состоит в том, чтобы представить текущие определения острой травмы почек, профиль пациента с этим диагнозом в отделениях интенсивной терапии и диагностические методы с акцентом на новые методы, основанные на дозировке биомаркеров. Для подготовки обзорной статьи в базах данных ScienceDirect, UptoDate, Medline/PubMed, Lilacs и SciELO были проведены консультации с различными научными публикациями с использованием терминов Acute Kidney Injury (AKI), факторов риска, биомаркеров мочевыводящих путей, нефропатии, UTI (Отделение интенсивной терапии), почечной недостаточности и интенсивной терапии. Результаты показывают, что объективно-управляемая терапия в периоперационный период связана со снижением осложнений и времени госпитализации. Таким образом, TGO может обеспечить благотворное воздействие, предотвращая трудности с поступлением в отделения интенсивной терапии
Ключевые слова: Acute Kidney Injury, биомаркеры, нефропатия, почечная недостаточность, интенсивная помощь.
1. ВВЕДЕНИЕ
Острая травма почек (OПП) является распространенным клиническим синдромом, связанным с длительной госпитализацией и более быстрым использованием больничных ресурсов, а также более высокой заболеваемостью и смертностью (RONCO et al., 2013). Это сложное расстройство, которое происходит в различных средах с клиническими проявлениями, начиная от минимального подъема креатинина сыворотки до анурикальной почечной недостаточности (MEHTA et al., 2007)
В последние годы, хотя значительные исследования были посвящены диагностике, профилактике и лечению OПП, заболеваемость и смертность вторичной острой дисфункции почек остаются высокими (BELLOMO et al., 2004). Это клиническое состояние может произойти в любой больничной среде с частотой заболеваемости от 1% до 25% у тяжело раненых пациентов. Отчет о других исследованиях (CHERTOW et al., 1998; BY MENDONÇA et al., 2000 г.) от 5% до 7% всех госпитализированных пациентов и две трети тяжелобольных пациентов (NIGWEKAR; WAIKAR, 2011), в зависимости от численности населения исследования и критериев, используемых для определения его присутствия.
Кроме того, в последнее десятилетие старый термин “острая почечная недостаточность” был заменен стандартизированными критериями острой травмы почек, включающими небольшие изменения в производстве креатинина и мочи, такие как Сеть острых травм почек (AKIN) (SAWHNEY; FRASER, 2017). Острая травма почек (OПП) встречается у до 50% пациентов в послеоперационном отделении интенсивной терапии, при этом показатели смертности, по данным, составляют от 15% до 80%, при этом более 50% случаев являются вторичными по сравнению с сепсисом (COCA et al 2009; MAXWELL; BELL, 2017).
Общая цель статьи заключается в проведении систематического обзора литературы с целью рассмотрения текущих определений острой травмы почек, профиля пациента с этим диагнозом в отделениях интенсивной терапии и диагностических методов с акцентом на новые модели, основанные на дозировке биомаркеров.
2. МАТЕРИАЛ И МЕТОДИС
Это исследование состоит из обзора литературы, проведенного в период с февраля по октябрь 2018 года, на основе анализа научных публикаций, присутствующих в Интернете, на данных ScienceDirect, UptoDate, Medline/PubMed, Lilacs, SciELO, особенно с терминами Acute Kidney Injury (AKI), Факторы риска, Биомаркеры, Нефропатия, UTI, острая почечная недостаточность и интенсивная помощь.
Согласно критериям, в исследование были включены научные статьи, описывающие профиль тяжелобольных пациентов с острой почечной недостаточностью в контексте отделений интенсивной терапии. Было рассмотрено несколько методов исследований в период с 1980 по 2018 год, включая крупные рандомизированные и многоцентровые перспективные исследования, мета-анализы, ретроспективные наблюдательные исследования и литературные обзоры.
3. Отзыв
3.1 ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ОПРЕДЕЛЕНИЕ.
Острая почечная недостаточность (ОПН), которая в настоящее время называется Острая травма почек (ОПП), отличается от АКИ, главным образом потому, что это клинический синдром, характеризующийся снижением функции почек, которое происходит в течение короткого периода времени (таблица 1). Это относительно распространенное осложнение у тяжелобольных пациентов и связано с высокой заболеваемостью и смертностью (NOGUEIRA; OLIVEIRA, 2007).
TABLE 01: Основные различия между острой почечной недостаточностью и хронической почечной недостаточностью
| Дисфункция/ Параметр | ОПН | ОПП |
| Строй | Дни/недели | Месяцы/годы |
| Гемоглобина | Нормальной | Снижение |
| Почечная “Масса” | Нормальной | Снижение |
| Остеоартрит | Выход | Настоящее время |
| Периферическая невропатия | Выход | Настоящее время |
| Сыворотка Креатинин | Реверсивно увеличено | Необратимо увеличено |
Источник: NOGUEIRA, OLIVEIRA (2007)
До недавнего времени не было достигнуто согласия в определении острой травмы почек или четкого консенсуса в отношении того, как предотвратить или справиться с этим заболеванием. Многие модели не смогли точно определить выбор соответствующих физиологических и клинических параметров для испытаний новых методов лечения. Время, интенсивность и модальность заместительной почечной терапии, возможное использование экстракорпорального лечения очистки крови при дополнительных заболеваниях почек и взаимодействие между дисфункцией почек и аномалиями в других органах являются факторами, которые должны быть включены в число инициатив по стандартизации управления этим синдромом (RONCO et al., 2013).
3.2 ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ДИАГНОСТИКА И ПОСТАНОВКА
Трудно обеспечить раннюю диагностику острой почечной сосудосуживаемой еще до возникновения трубчатых дисфункций. В прошлом диагноз основывался на реакции уровня мочевины плазмы у пациента с подозрением на АКИ – если уровни снижались при внутривенной гидратации, то это было бы признаком обратимой сосудосуживаемой (MILLER et al., 1978).
Проблема такого подхода заключается в том, что многие пациенты вошли в картину легочных заторов, гипоксии и использования ранней механической вентиляции легких (SCHRIER et al., 2004). С этого момента в центре внимания в диагностическом исследовании стал подробный анализ мочевых отложений (DE MENDONÇA et al., 2000).
Независимо от исследований, подробная и точная история имеет решающее значение для диагностики острой травмы почек (ОПН) и определить лечение. Различие Острые травмы почек от хронических заболеваний почек имеет важное значение, но сделать различие может быть трудно. В случаях непроверенной ОПН или при наличии гематических цилиндров почечной биопсии (MADAIO et al., 1990) — за исключением некоторых ситуаций, среди которых наиболее распространенной является активная инфекция мочевыводящих путей (MOTA, 2005).
Биопсия не заменяет хорошее клиническое обследование и анамнезис, но предлагает возможность гистопатологического исследования и описания с деталями почечной микроструктуры. Другим соображением является дифференциация между ОПН и ОПП (YANG et al., 2014)
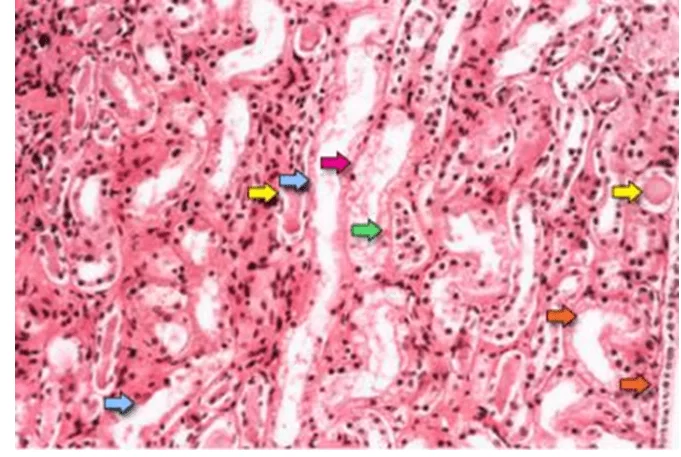
На рисунке 01 показаны характеристики острого трубчатого некроза, которые являются диффузной денудацией почечных трубчатых клеток с потерей края кисти (голубые стрелки); уплощение трубчатых клеток из-за трубчатого расширения (оранжевые стрелки); формирование внутрикубного скопления (желтые стрелки); и desoking клеток, который отвечает за формирование гранулированных форм (красная стрелка). Наконец, интратубубная обструкция из-за голого эпителия и клеточного мусора очевидна (зеленая стрелка). Обратите внимание, что задержки трубчатых эпителиальных клеток сливаются из-за перестановки молекул межклеточной реакции (TAN et al., 2009).
FIGURE 01: Фотомикрограф образца почечной биопсии показывает почечную медуллярную область, которая состоит в основном из почечных трубок.
Проспективное когортное исследование с использованием медицинских карт 190 пациентов, поступивших в отделение интенсивной терапии, показало, что и шкала RIFLE, и AKIN и KDIGO, аналогично, являются хорошими предикторами смертности у пациентов, находящихся в тяжелом состоянии. (LEVI et al., 2013).
Перспективное когортное исследование с использованием медицинских записей 190 пациентов, госпитализированных в отделение интенсивной терапии, показало, что и ОЦЕНКА RIFLE, и AKIN и kdigo, аналогичным образом, являются хорошими предикторами смертности у пациентов, которые находятся в тяжелом состоянии. (LEVI et al., 2013).
ГРАФИКА 01: Кривая ROC (Функция работы приемника) и дискриминационная способность к смерти у тяжелобольных пациентов в соответствии с критериями RIFLE, AKIN и KDIGO
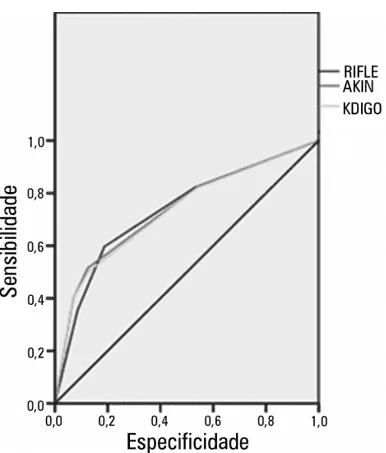
Источник:LEVI и др. (2010)
Как показано в графике 01, авторы обнаружили, что площадь на кривой ROC (AUROC) рассчитывается составил 0,735 для критерия RIFLE, 0,74 для AKIN и 0,733 для KDIGO, показывая значение p<0.0001 для дискриминации смерти трех критериев (LEVI et al., 2010).
3.3 НОВЫЕ МАРКЕРЫ ПРИ ДИАГНОСТИКЕ ОСТРОЙ ТРАВМЫ ПОЧЕК
Креатинин сыворотки, который является наиболее широко используемым лабораторным тестом для диагностики ОПН, является несовершенным маркером, так как его уровни отражают поздние функциональные последствия поражения, а не прямые травмы клеток, и не чувствительны и специфичны в ранней диагностике ОПП (NADKARNI et al., 2017).
Разработка новых биомаркеров для ранней диагностики, стратификации риска и прогноза острой травмы почек (ОПН) является одним из главных приоритетов в мировых исследованиях почек (PARIKH et al., 2014). Некоторые из наиболее перспективных веществ включают липокалин, связанный с плазменной нейтрофил желатазы (NGAL) (MISHRA et al., 2005), молекула почечной травмы-1 (КИМ-1), (HAN et al., 2002; ICHIMURA et al., 1998), Ил-18 (MELNIKOV et al., 2001; PARIKH et al., 2004), цистотин C (HERGET-ROSENTHAL et al., 2004), белок связывания жирных кислот печени (L-FABP) (KANG et al., 2002; YOSHINO et al., 2003), ИЛ-6 (D’AMICO; BAZZI, 2003), α / π Глутатион S-transferase (GST) (HARRISON и др., 1989; SUNDBERG et al., 1994), и N-ацетил-β-d-гликозаминидазы (NAG).
Несколько исследований показали эффективность мочевых биомаркеров, интерлейкина-18 (IL-18); липокалин коррелирует с плазменной нейтрофиловой желатазой (NGAL); молекула почечной травмы-1 (КИМ-1) и белок связывания жирных кислот печеночной железы (L-FABP) для обнаружения АКИ до изменения креатинина сыворотки (HO et al., 2015; LIN et al., 2015; NADKARNI et al., 2017). Некоторые из наиболее перспективных включают липокалин, связанный с плазменной нейтрофиловой желатазы (NGAL), молекулы почечной травмы-1 (КИМ-1), IL-18,23,24 цистотин C, белка связывания жирных кислот печени (L-FABP), IL-6.28 α/π S-трансферазы глутатиона (GST) и N-ацетил-β-d-гликозаминидазы (NAG).
В целом, кажущаяся диагностическая производительность биомаркера зависит не только от его способности обнаруживать поражения, но и от распространенности заболевания, чувствительности и специфичности несовершенства золотого стандарта (LASSNIGG et al., 2004).
Некоторые результаты подчеркивают важность перспективных и систематических испытаний условий хранения образцов на уровнях биомаркеров до принятия этих тестов в клинической практике или исследованиях (PARIKH et al., 2014), так как условия хранения мочи могут помешать чтению полученных результатов.
Nadkarni et al., (2017) пришел к выводу, что несколько факторов, доступных с помощью анализа реагентов мочи ленты связаны с повышенной концентрацией мочевых биомаркеров, которые не зависит от клинической травмы почек. Дальнейшие исследования, как представляется, необходимы для оценки вмешательства общих элементов мочи в уровни биомаркеров, представляющих интерес для изучения влияния учета этих элементов на их прогностические/диагностические показатели.
Ho et al., (2015), завершенный путем мета-анализа 28 исследований, в ходе которого сообщалось о внутриоперационных и/или ранних послеоперационных измерениях биомаркеров в моче (n No 23 исследования) или плазмы или сыворотки (n No 12 исследований). Был сделан вывод, что у взрослых, известных биомаркеров мочи, плазмы и сыворотки ОПН имеют скромную дискриминацию в лучшем случае при измерении в течение 24 часов после сердечных операций, те же исследования указывают на то, что эти биомаркеры по-прежнему доступны только для исследований, не доступных в клинической практике крупных центров.
3.4 ВЫЯВЛЕНИЕ ПРИЧИНЫ ОПП
В нашем исследовании не было выявлено никаких тестов, которые сравнивали бы точность анализа мочи с другими диагностическими методами, такими как биопсия и визуализирующие тесты. Но, согласно Беллу и Максвеллу (2017), в метаанализе, проведенном National Clinical Guideline Centre в 2013 году, в котором было собрано 126 публикаций по профилактике, диагностике и лечению острого повреждения почек у тяжелобольных пациентов, настоятельно рекомендовалось проводить анализ мочи. проводится с исследованием образцов крови, белка, лейкоцитов, нитритов и глюкозы у всех пациентов, как только появляется подозрение или обнаружение острого поражения почек. Предполагается, что обнаружение гематурии и протеинурии с помощью тест-полоски мочи у пациента с ОПН может указывать на острое гломерулярное заболевание или гломерулонефрит (UCHINO et al., 2004).
В перспективном, многоцентровом и многонациональном эпидемиологическом исследовании, проведенном Uchino et al., (2004), тяжелый сепсис / септический шок (43,8%), основные операции (39,1%), низкий сердечный выброс (29,7) и гиповолемия (28,2%) были наиболее распространенными состояниями, связанными с развитием острой почечной недостаточности у тяжело раненых пациентов.
Такие препараты были показаны, по крайней мере в животных моделях ОПН, снижение потребления кислорода и метаболических потребностей травмированных почечных трубчатых клеток, тем самым ограничивая ишемическое повреждение внешних медуллярных трубчатых сегментов (HEYMAN et al., 1994).
3.5. ТЕРАПЕВТИЧЕСКИЕ ПОДХОДЫ В УПРАВЛЕНИИ АКИ
В острой обстановке лечения, мочегонные средства часто назначают для поддержания или увеличения производства мочи у пациентов с острой травмой почек (ОПН). Причина предоставления мочегонных средств является то, что они могут защитить почки от ишемической травмы при сохранении неолигурического состояния (KARAJALA et al., 2009).
Ряд мочегонных средств с мочегонными переменными фармакологическими свойствами (фуросемид, буметанида, торсемид), мочегонные мочегонные средства тиазида (метолазон, гидрохлоротиазид, часто вводятся в сочетании с мочегонными средствами и мочегонными средствами, такими как манитол) были изучены и вводятся в аки настройки (KARAJALA et al. 2009). Петле мочегонные средства являются наиболее мощными мочегонными средствами и остаются наиболее указанными для управления AKI пациентов (NIGWEKAR; WAIKAR, 2011). Управление ОПН направлено на предотвращение и предотвращение постоянных повреждений, таких как нефротоксические препараты и гипотония, что уменьшит TFG (скорость клубочковой фильтрации) и местную оксигенацию.
4. ЗАКЛЮЧИТЕЛЬНЫЕ СООБРАЖЕНИЯ
Короче говоря, известно, что ОПН является синдромом, вызванным широким спектром сопутствующих и риск-ситуаций. Тяжело госпитализированный пациент в отделение интенсивной терапии по-прежнему, как представляется, наиболее выгоду от возможности ранней диагностики и правильного управления острой травмы почек.
Несмотря на успехи в клинических и лабораторных исследованиях, до сих пор считается, что его диагноз связан с креатинином, мочевиной и диурезом пациента. Эти меры, как представляется, являются эффективными на основе предположения, что они помогают в повышении выживаемости тяжелого пациента.
Необходимо провести дополнительные клинические исследования, а также мета-аналитические исследования, которые имеют первостепенное значение для выявления и организации большого числа лабораторных исследований, связанных со сбором и дозировкой биомаркеров мочевыводящих путей и плазмы, измененных при наличии острой почечной недостаточности. Необходимо разработать новые протоколы о том, как сохранить образцы мочи для этих тестов. Подчеркивается, что Risk, Injury, Failure, Loss, End-Stage (RIFLE) и острой травмы почек сети (AKIN), хотя широко используется с хорошей степенью точности не являются эффективными в ранней диагностике гломерулярных процессов травмы.
Как правило, применение жидкостей должно осуществляться как и любой другой вид препарата, учитывая их показания и индивидуальные ограничения. В этом контексте периоперационная замена объема изо-онкотическими растворами понимается как выгодный аспект, даже если необходимы дополнительные рандомизированные контролируемые исследования, чтобы связаться с его актуальностью для результата. Таким образом, таким образом, разработка рациональной стратегии введения жидкости может помочь в лечении пациентов, перенесших операцию с низким риском, которые имеют незначительную потерю внутрисосудистого объема с кристаллоидным вливанием, через сочетание кристаллоидного и коллоидного введения, тщательно титрованные на основе гемодинамических измерений.
Наконец, вывод заключается в том, что объективно-управляемая терапия в периоперационный период связана с уменьшением осложнений и продолжительности госпитализации. Таким образом, можно добиться благотворного эффекта TGO (глутаминовая щавелевоуксусная трансаминаза), при котором он препятствует госпитализации в реанимацию.
5. ССЫЛКИ
BELLOMO, R. et al. Open Access Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care, v. 4 n, 8, p. 204–212, 2004.
CHERTOW, G. et al. Independent association between acute renal failure and mortality following cardiac surgery. American Journal of Medicine, v. 104, n. 4, p. 343–348, 1998.
COCA, S. et al. Long-term Risk of Mortality and Other Adverse Outcomes After Acute Kidney Injury: A Systematic Review and Meta-analysis. American Journal of Kidney Diseases, v. 53, n. 6, p. 961–973, 2009.
D’AMICO, G.; BAZZI, C. Urinary protein and enzyme excretion as markers of tubular damage. Current opinion in nephrology and hypertension, v. 12, n. 6, p. 639–43, 2003.
DE MENDONÇA, A. et al. Acute renal failure in the ICU: risk factors and outcome evaluated by the SOFA score. Intensive Care Medicine, v. 26, n. 7, p. 915–921, 2000.
HAN, W. et al. Kidney Injury Molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International, v. 62, n. 1, p. 237–244, 2002.
HARRISON, D. et al. Distribution of glutathione S-transferase isoenzymes in human kidney: basis for possible markers of renal injury. Journal of clinical pathology, v. 42, n. 6, p. 624–8, 1989.
HERGET-ROSENTHAL, S. et al. Early detection of acute renal failure by serum cystatin C. Kidney International, v. 66, n. 3, p. 1115–1122, 2004.
HEYMAN, S. N. et al. Loop diuretics reduce hypoxic damage to proximal tubules of the isolated perfused rat kidney. Kidney International, v. 45, n. 4, p. 981–985, 1994.
HO, J. et al. Urinary, Plasma, and Serum Biomarkers’ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. American Journal of Kidney Diseases, v. 66, n. 6, p. 993–1005, 2015.
ICHIMURA, T. et al. Kidney injury molecule-1 (KIM-1), a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain, is up-regulated in renal cells after injury. The Journal of biological chemistry, v. 273, n. 7, p. 4135–42, 1998.
KANG, D.-H. et al. Role of the microvascular endothelium in progressive renal disease. Journal of the American Society of Nephrology: JASN, v. 13, n. 3, p. 806–16, 2002.
KARAJALA, V. et al. Diuretics in acute kidney injury. Minerva anestesiologica, v. 75, n. 5, p. 251–7, 2009.
LASSNIGG, A. et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study. Journal of the American Society of Nephrology: JASN, v. 15, n. 6, p. 1597–605, 2004.
LEVI, T. M. et al. Comparação dos critérios RIFLE, AKIN e KDIGO quanto à capacidade de predição de mortalidade em pacientes graves. Revista Brasileira de Terapia Intensiva, v. 25, n. 4, p. 290–296, 2013.
LIN, X. et al. Urine interleukin-18 in prediction of acute kidney injury: a systematic review and meta-analysis. Journal of Nephrology, v. 28, n. 1, p. 7–16, 2015.
MADAIO, M. P. et al. Renal Biopsy. Nephrology Forum. Kidney International, v. 38, p. 529-543, 1990.
MAXWELL, R.; BELL, C. M. Acute Kidney Injury in the Critically Ill. The Surgical clinics of North America, v. 97, n. 6, p. 1399–1418, 2017.
MEHTA, R. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Critical Care, v. 11, n. 2, p. R31, 2007.
MELNIKOV, V. et al. Impaired IL-18 processing protects caspase-1-deficient mice from ischemic acute renal failure. The Journal of clinical investigation, v. 107, n. 9, p. 1145–52, 2001.
MILLER, T. et al. Urinary diagnostic indices in acute renal failure: a prospective study. Annals of internal medicine, v. 89, n. 1, p. 47–50, 1978.
MISHRA, J. et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet, London, England, v. 365, n. 9466, p. 1231–8, 2005.
MOTA, P. C. Indications for renal biopsy. Acta Médica Portuguesa, v. 18, n. 2, p. 147–51, 2005.
NADKARNI, G. et al. Urinalysis findings and urinary kidney injury biomarker concentrations. BMC Nephrology, v. 18, n. 1, p. 218, 2017.
NIGWEKAR, S.; WAIKAR, S. Diuretics in Acute Kidney Injury. Seminars in Nephrology, v. 31, n. 6, p. 523–534, 2011.
NOGUEIRA, C. S.; OLIVEIRA, C. R. Degrandi. Disfunção renal: definição e diagnóstico. Medicina perioperatória, Rio de Janeiro, cap. 64, p. 571-577, 2007.
PARIKH, C. et al. Urinary interleukin-18 is a marker of human acute tubular necrosis. American journal of kidney diseases : the official journal of the National Kidney Foundation, v. 43, n. 3, p. 405–14, 2004.
PARIKH, C. et al. Urine Stability Studies for Novel Biomarkers of Acute Kidney Injury. American Journal of Kidney Diseases, v. 63, n. 4, p. 567–572, 2014.
RONCO, C. et al. Acute Dialysis Quality Initiative (ADQI). Contributions to nephrology. v. 182, p.1–4, 2013.
SAWHNEY, S.; FRASER, S. D. Epidemiology of AKI: Utilizing Large Databases to Determine the Burden of AKI. Advances in chronic kidney disease, v. 24, n. 4, p. 194–204, 2017.
SCHRIER, R. et al. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. The Journal of clinical investigation, v. 114, n. 1, p. 5–14, 2004.
SUNDBERG, A. et al. Urinary π-Class Glutathione Transferase as an Indicator of Tubular Damage in the Human Kidney. Nephron, v. 67, n. 3, p. 308–316, 1994.
TAN, J. et al. Glomerular function, structure, and number in renal allografts from older deceased donors. Journal of the American Society of Nephrology : JASN, v. 20, n. 1, p. 181–8, 2009.
UCHINO, S. et al. Diuretics and mortality in acute renal failure. Critical Care Medicine, v. 32, n. 8, p. 1669–1677, 2004.
YANG, B. et al. Intravascular Administration of Mannitol for Acute Kidney Injury Prevention: A Systematic Review and Meta-Analysis. (B. Bussolati, Org.)PLoS ONE, v. 9, n. 1, p. e85029, 2014.
YOSHINO, J. et al. Leukemia inhibitory factor is involved in tubular regeneration after experimental acute renal failure. Journal of the American Society of Nephrology : JASN, v. 14, n. 12, p. 3090–101, 2003.
[1] Доктор. Пост окончил в интенсивной медицине медицины для взрослых.
Представлено: октябрь 2020 года.
Утверждено: Ноябрь 2020 года.