ARTIGO DE REVISÃO
COUTINHO, Pamela Cris de Souza [1], LUIZ, Endhel Nayara Souza [2], BATISTA, Maely Oliveira [3], OLIVEIRA, César Augusto Batasini de [4]
COUTINHO, Pamela Cris de Souza. Et al. Farmacocinética dos medicamentos de primeira escolha no tratamento da tuberculose geniturinária. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 06, Ed. 04, Vol. 01, pp. 50-65. Abril de 2021. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/tuberculose-geniturinaria, DOI: 10.32749/nucleodoconhecimento.com.br/saude/tuberculose-geniturinaria
RESUMO
Após a descoberta do agente causador da tuberculose foi possível identificar as diferentes formas da doença que acometem outros órgãos, sendo chamadas de Tuberculose Extrapulmonares. O esquema terapêutico inclui a associação dos fármacos rifampicina, isoniazida, pirazinamida e etambutol como primeira escolha, devido a capacidade de apresentar maior eficácia terapêutica. Nesse sentido, este trabalho teve como objetivo descrever os aspectos farmacocinéticos dos medicamentos de primeira escolha no tratamento da tuberculose geniturinária em adultos. O presente artigo foi desenvolvido através dos preceitos da revisão sistemática descritiva nas bases de dados Biblioteca Virtual em Saúde (BVS), Scielo, PubMed, Google Acadêmico e o Portal de Periódicos CAPES/MEC, através da combinação de descritores e busca isolada de cada um deles, cujo recorte temporal escolhido foi de 2010 a 2020. A rifampicina apresenta rápida absorção pelo trato gastrintestinal, sendo de aproximadamente 100% se ingerido isoladamente em jejum, é parcialmente metabolizada pelo complexo citocromo P450 e eliminada cerca de 30% de rifampicina através da urina, ao passo que 60 a 65% é expelida pelas fezes. A isoniazida é bem absorvida por vira oral, podendo sofrer interferência na presença de alimentos e na ingestão conjunta com antiácidos orais. É amplamente distribuída por todos os tecidos e líquidos corporais, sofrendo biotransformação a nível hepático e excreção por via renal na maior parte dos casos. Semelhante à isoniazida, a pirazinamida é bem absorvida pelo trato gastrintestinal, porém, por se tratar de um pró fármaco, tem sua forma metabólica ativa após penetrar no bacilo por difusão passiva e é eliminada por via renal. O etambutol é o único que não sofre alteração da absorção quando ingerida concomitantemente com alimentos ou outros fármacos. Apesar de possuir poucos estudos à cerca da sua farmacocinética, sabe-se que o etambutol sofre oxidação que origina os derivados aldeídico (intermediário) e ácido carboxílico, o que facilita sua excreção por via renal. Diante do exposto, os medicamentos de primeira linha utilizados no combate à tuberculose geniturinária possuem eficácia relativamente boa quando administrados isoladamente, porém, quando se trata da associação dos fármacos há uma influência considerável nos parâmetros farmacocinéticos que resultam em maior sucesso terapêutico.
Palavras-chave: Farmacocinética, Tuberculose, Geniturinária, Tuberculostáticos.
1. INTRODUÇÃO
Robert Koch, em 1982, isolou a Mycobacterium tuberculosis sendo posteriormente atribuído o nome como bacilo de Koch como agente patógeno causador da Tuberculose (TB). Esta doença manifesta-se mais comumente na forma pulmonar podendo apresentar-se de outras formas como a ganglionar periférica, urinária, óssea, oftálmica, intestinal, cutânea e pode acometer, inclusive, o sistema nervoso central (BETHLEM, 2012).
Estima-se que, em 2018, a nível mundial houveram cerca de 10 milhões de novos casos e 1,5 milhão de óbitos devido a patologia em questão. Já no Brasil, no mesmo ano a ocorrência dos casos de tuberculose chegou a ser 45 casos/100.000 habitantes e a mortalidade apresentou a taxa de 2,3 óbitos/100.000 habitantes (SILVA; MELLO; MIGLIORI, 2020). Com relação ao ano de 2016, 10,4 milhões de pessoas foram diagnosticadas com tuberculose no país e, destas, 1,7 milhão faleceram (BARREIRA, 2018; ORGANIZAÇÃO MUNDIAL DA SAÚDE, 2018). Com o intuito de controlar esta doença junto a população, o Ministério da Saúde brasileiro criou o Plano Nacional de Controle da Tuberculose (PNCT) em 1999, visando reduzir a morbidade, mortalidade e transmissão da TB (BRASIL, 1999).
A redução na ocorrência de TB apresenta variação de acordo com alguns parâmetros apresentados pelos países como Índice de Desenvolvimento Humano (IDH), critérios socioculturais, distribuição dos serviços de saúde e execução de PNCTs. (OLIVEIRA, 2021; CAZABON et al., 2017). Mesmo com adoção de políticas públicas para o controle da doença, a TB ainda é considerada uma questão de saúde pública, e um fato alarmante é que cerca de 20% das pessoas acometidas pela tuberculose na forma pulmonar, desenvolvem a forma extrapulmonar geniturinária, que consiste, segundo Campos (2007), na presença do bacilo no sistema urinário através de disseminação linfo-hematogênica, implantando-se no córtex renal, onde se multiplica. Os sintomas mais frequentes são disúria e a hematúria.
A TB geniturinária ocorre comumente em adultos na faixa etária de 20 a 40 anos, possivelmente por reativação endógena. Lopes et al. (2006) afirmam que essa reativação no córtex renal resulta em necrose caseosa dando origem a uma cavidade em comunicação com o sistema pielocalicial. Os bacilos liberados na urina poderão causar outros focos da doença ao longo do sistema urinário.
Para o tratamento desta patologia, a partir de 2010, o PNCT definiu o esquema terapêutico utilizando de forma associada, e na mesma dose, a rifampicina, isoniazida, pirazinamida e etambutol nos dois primeiros meses (2RHZE) de tratamento e posteriormente a isoniazida e rifampicina por quatro meses (4RH) para todas as formas de tuberculose em adultos e adolescentes (FERREIRA et al., 2012). Quando se trata de crianças, o esquema terapêutico inicial constitui-se na utilização de uma associação entre rifampicina, isoniazida e pirazinamida por um período de 2 meses (2RHZ) seguidos de administração de isoniazida e rifampicina pelos 4 meses subsequentes (4RH) (BRASIL, 2010).
A rifampicina desenvolve ação tanto bactericida quanto bacteriostática ao atuar sob o crescimento da bactéria bem como na fase estacionária (SOUZA, 2005). Devido a esse feito farmacológico, uma vez associada à pirazinamida (cuja síntese se deu em meados de 1936), propiciam a redução no tratamento medicamentoso da TB para seis meses (ARBEX et al., 2010). O etambutol, por sua vez, é específico para o M. tuberculosis resistentes à isoniazida (INH) ao danificar a síntese de polissacarídeos e o transporte de ácidos micólicos para a parede celular (LAVOR, 2010).
A isoniazida teve seu uso inicial no tratamento da TB nos anos 1952. É usado como primeira escolha por ter algumas vantagens como, menor toxicidade, ser mais eficaz e mais barato que seus similares (VEIGA, 2011).
Diante do exposto, este trabalho teve como objetivo descrever os aspectos farmacocinéticos dos medicamentos de primeira escolha no tratamento da tuberculose geniturinária em adultos.
2. METODOLOGIA
2.1 TIPO DE PESQUISA
A presente pesquisa se caracteriza como uma revisão sistemática descritiva, sem metanálise, seguindo a metodologia descrita por Silva et al. (2018) e Nóbrega et al. (2015) com adaptações. A revisão sistemática consiste em um delineamento de um estudo secundário através de outros estudos primários as quais são analisados de forma criteriosa e avaliados quanto à sua qualidade científica (CAMACHO; COELHO, 2010).
2.2 LOCAL DA PESQUISA
As buscas dos artigos foram realizadas nos seguintes bancos de dados: Biblioteca Virtual em Saúde (BVS), Scielo, PubMed, Google Acadêmico e o Portal de Periódicos CAPES/MEC, através da combinação de descritores e busca isolada de cada um deles. Os termos de busca, em inglês, espanhol e português, foram combinados com operadores booleanos, sendo eles: “Tuberculose” OR “Tuberculose geniturinária”, “Tuberculose geniturinária” AND “Tratamento”, “Tuberculose geniturinária” AND “Farmcocinética”, “Genitourinary tuberculosis” AND “pharmacokinetics”, “Genitourinary tuberculosis” OR “Treatment”.
A coleta dos artigos, monografias, trabalhos de conclusão de curso, dissertações e teses foram realizadas de forma independente pelas autoras, seguindo critérios e inclusão e exclusão, cujo objetivo foi a redução de possíveis tendências. A seleção dos estudos, bem como a avaliação da qualidade dos dados de cada documento e exclusão de estudos duplicados, aconteceu em reunião de consenso.
2.3 CRITÉRIOS DE INCLUSÃO E EXCLUSÃO
A partir da definição do problema, participaram da revisão, relatos de caso, outras revisões de literatura, artigos originais completos, monografias, dissertações e teses, escritos nos idiomas inglês, espanhol ou português, publicados no período de 2010 a 2020 que abordem o tema “farmacocinética dos tuberculostáticos”, tendo como população-alvo indivíduos diagnosticados com tuberculose extrapulmonar, em especial a geniturinária, independente de gênero ou condição de saúde associada à doença em questão.
Foram excluídos da revisão sistemática estudos desenvolvidos em pessoas que não possuíam diagnóstico de tuberculose extrapulmonar; artigos publicados antes de 2016; estudos relacionados a outras doenças particulares, bem como validação de instrumentos; trabalhos que não forneceram detalhes suficientes em suas metodologias e resultados; e artigos que não estiveram escritos nas línguas selecionadas (inglês, português ou espanhol). Em casos de estudos que obtiveram resultados de diferentes populações patologias, foram consideradas apenas resultados pertinentes à tuberculose.
2.4 PROCEDIMENTOS E INSTRUMENTOS
As amostras foram selecionadas a partir da leitura prévia do resumo e, caso se enquadrasse na temática do presente trabalho, foi realizada a leitura na íntegra do trabalho, obedecendo aos critérios de inclusão. Os estudos foram avaliados quanto às variáveis relativas ao artigo, como ano de publicação e tipo de estudo; relativas aos fármacos utilizados no tratamento, analisando classe farmacológica, posologias e janela terapêutica; e relativas ao tipo de tuberculose, avaliando a prevalência, presença de outras patologias além da tuberculose e possíveis alterações fisiológicas ocasionadas pelos medicamentos.
3. RESULTADOS E DISCUSSÕES
3.1 RIFAMPICINA
A rifampicina, derivada inicialmente de outro antibiótico denominado rifamicina, é desenvolvida através do processo de fermentação da Streptomyces mediterranei (TROUSIL, 2020), sendo conhecida por inibir o crescimento da maioria das bactérias gram-positivas em fase de crescimento ou não replicante (MARTINS; MIRANDA, 2020). É empregada no tratamento da tuberculose e hanseníase e pertencente à classe dos fenilpropanoides (GUMBO et al., 2012). Sua estrutura é mostrada na Figura 1:
Figura 1: Fórmula estrutural da rifampicina
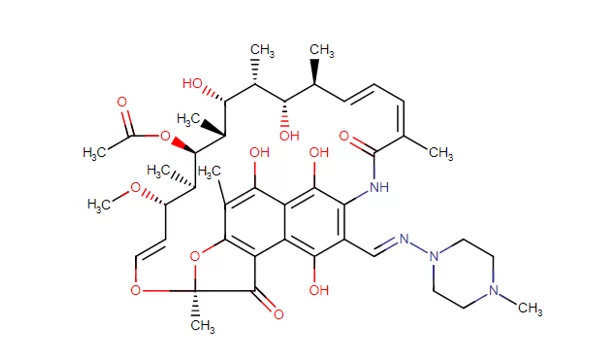
Sua absorção é rápida pelo trato gastrintestinal, sendo de aproximadamente 100% se ingerido isoladamente em jejum, entretanto a presença de alimentos e sua associação com demais fármacos preconizados no tratamento de TB implica numa redução de sua concentração plasmática em um terço (GUMBO et al., 2012). Embora haja variações relacionadas a concentração do fármaco no organismo, em geral o pico de concentração é atingido de 2 a 4 horas após ingestão por via oral. Essas variações são devido à taxa de dissolução do fármaco, motilidade gástrica e/ou secreção biliar (FERREIRA, 2012; ARBEX et al., 2010).
A rifampicina tem sua biodisponibilidade reduzida em 20 a 30% quando associada à isoniazida, uma vez que ocorre degradação da rifampicina para produzir a 3(formil isonicotinil)rifampicina, que posteriormente irá reagir com a isoniazida afim de formar a hidrazona. Essa interação resulta em perca de 20 a 30% da biodisponibilidade da rifampicina (NETO, 2016).
É amplamente distribuída pelo organismo, atingindo altas concentrações no pulmão, fígado, rins, tubo digestório, ossos, pele, músculos, saliva, lágrimas, suor e no baço, podendo, inclusive, atravessar a barreira hematoencefálica e placentária. Ao atravessar a barreira placentária, pode atingir concentrações terapêuticas no feto correspondentes a 30% da concentração no sangue materno (TAVARES, 2014; FERREIRA, 2012; CAZABON et al, 2017). Segundo Gumbo et al. (2012), o volume de distribuição, em litros, da rifampicina é cerca de 53 em pacientes adultos.
A rifampicina é biotransformada parcialmente, sob ação do complexo citocromo P450, formando os metabólitos desacetilrifampicina, formilrifampicina e quinona-rifampicina. A desacetilrifampicina mantém sua atividade antibacteriana mesmo sendo mais hidrossolúvel que a droga original (TAVARES, 2014). Além disso, a rifampicina desencadeia interações com diversos tipos de enzimas responsáveis pela biotransformação de fármacos, possibilitando processos de oxidação, glucuronidação e conjugação de glutationa (GSTA1), sendo, portanto, necessária atenção redobrada ao uso concomitante da rifampicina com outros medicamentos que tem a etapa de metabolização realizada por enzimas, tendo seu efeito possivelmente retardados (PEREIRA, 2020).
Por ser um autoindutor, após 14 dias de tratamento a rifampicina induz a formação de enzimas metabolizadoras responsáveis por causar sua própria eliminação, diminuindo sua meia-vida em 40% (de 3 – 5 horas para 2 – 3 horas) (ARBEX et al, 2010). Além disso, pode sofrer recirculação entero-hepática, e após cerca de 6 horas, quase todo o fármaco encontra-se na forma desacetilada, facilitando sua excreção pela bile (CAZABON et al., 2017). Em torno de 30% de rifampicina é eliminada através da urina, ao passo que 60 a 65% é expelida pelas fezes. Dessa maneira, faz-se necessário ressaltar a relevância de um acompanhamento especial em paciente com disfunção renal (BELEZA, 2017).
3.2 ISONIAZIDA
Utilizada desde 1952, é um dos fármacos com maior importância no tratamento da tuberculose geniturinária devido à sua função bactericida tanto sobre os bacilos de multiplicação rápida quanto aos bacilos de multiplicação lenta ou intermitente (ARBEX et al., 2010). Pertencente à classe das piridinas, é um pró–fármaco que possui em sua estrutura um anel piridina e um grupo hidrazida, sendo exemplificada na imagem a seguir:
Figura 2: Fórmula estrutural da isoniazida
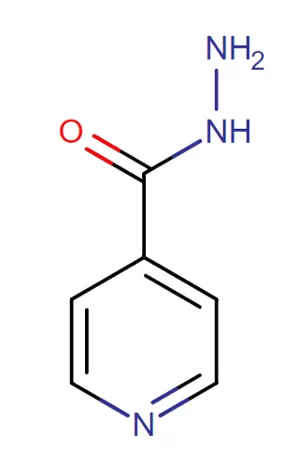
A isoniazida é bem absorvida por vira oral, podendo sofrer diminuição da absorção tanto na presença de alimentos quanto na ingestão conjunta com antiácidos orais que contenham alumínio em sua formulação (TAVARES, 2014). Penetra facilmente em lesões caseosas, cruza a barreira placentária com níveis terapêuticos ótimos, onde é excretada pelo leite (RANG et al., 2012), e atinge seu pico máximo de concentração entre 1 e 2 horas após ingestão, nas concentrações de 3 a 5 Pg/mL, podendo ser afetada pela presença de alimentos ou antiácidos (PIRES, 2011).
É amplamente distribuída por todos os tecidos e líquidos corporais (cefalorraquidiano, pleural e escarro) (TAVARES, 2014; SPRINZ et al., 2013; RANG et al., 2012) e a sua concentração no líquido cerebrospinal é similar à do soro (WHALEN et al., 2016). Segundo Olson (2014), o volume de distribuição é 0,6 a 0,7 L/kg, sendo não significativa sua ligação á proteínas.
A biotransformação é a nível hepático onde ocorrem reações de acetilação pela enzima N-acetiltransferase, formando como metabólitos inativos a acetilidrazida e o ácido isonicotínico (TAVARES, 2014). Entretanto, essa acetilação pode variar de indivíduo para indivíduo de acordo com a predisposição genética para se tornarem acetiladores lentos ou rápidos.
Indivíduos que se adequam ao perfil de acetiladores lentos são prejudicados quanto à metabolização e, consequentemente, quanto à eliminação deste fármaco, causando um acúmulo de isoniazida no organismo (TAVARES, 2014; RANG et al., 2012). Segundo Pires (2011), o uso de métodos colorimétricos aplicados à urina é comum para determinar a velocidade e capacidade de cada indivíduo de acetilar a isoniazida.
Esses testes colorimétricos apresentam melhores resultados se aplicados à indivíduos que fizeram ingestão do fármaco a mais de 4 horas, podendo variar de acordo com a etnia mas independe da presença de TB, seja pulmonar ou extrapulmonar. De acordo com Rang et al. (2012), a meia-vida da isoniazida em acetiladores lentos varia de 1 a 3 horas, enquanto que em acetiladores rápidos é de cerca de 1 hora.
A isoniazida é eliminada, na maioria das vezes pela urina, tanto na forma inalterada quanto na forma de metabólito inativo e apenas uma pequena porção é eliminada pelas fezes (TAVARES, 2014; RANG et al., 2012; ARBEX et al., 2010). Já a excreção pelo leite materno é cerca de 0,75 – 2,3% da dose em 24 horas (PIRES, 2011).
3.3 PIRAZINAMIDA
A pirazinamida é um análogo da nicotinamida e possui estrutura semelhante à isoniazida (Fig. 3). Pertencente à classe dos compostos organoheterocíclicos, é usada como tuberculostático desde 1952 com concentração inibitória mínima (CIM) que varia de 6,25 – 50,0 µg/mL em pH=5,5 (TAVARES 2014; ARBEX et al., 2010). É captada por macrófagos e exerce sua atividade contra as micobactérias que residem no ambiente ácido dos lisossomos (DECK, 2013) e não há restrição à ingestão concomitante com alimentos ou medicamentos antiácidos (ARBEX et al., 2010). É altamente seletiva para Mycobacterium tuberculosis, sendo ineficaz para o complexo Mycobacterium avium-intracellulare, todavida, a sua farmacodinâmica não é totalmente elucidada (TAVARES, 2014).
Figura 3: Fórmula estrutural da pirazinamida
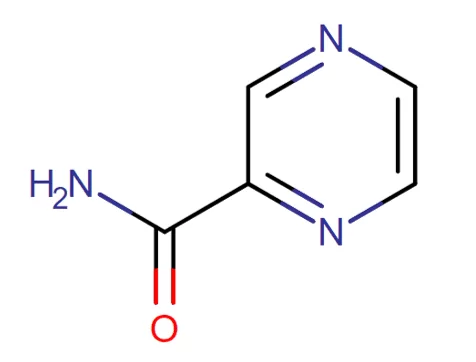
Sua absorção é rápida pelo trato gastrintestinal de maneira quase completa e distribui-se facilmente pelo organismo, inclusive nas meninges inflamadas, e atinge elevada concentração nas células alveolares e no fluido epitelial do pulmão (DECK et al., 2014). Tavares (2014) discorre que há uma escassez de dados que abordem a presença da droga no leite materno. Cerca de 10-20% do fármaco é atribuído a ligação com proteínas e o volume de distribuição da pirazinamida é de, aproximadamente, 0,7 L/kg (PIRES, 2011).
Após penetrar no BK por difusão passiva, sofre hidrólise, onde é convertida em ácido pirazinóico pela enzima pirazinamidase/nicotinamidase produzida pelo bacilo, dando origem à sua forma metabolicamente ativa (CAZANON et al., 2017; KASPER et al., 2016). Possui meia-vida de aproximadamente 9 – 10 horas (OLSON, 2014). A ausência da enzima pirazinamidase/nicotinamidade se dá por uma alteração no gene pncA da micobactéria, sendo este o causador de cepas resistentes à pirazinamida (PIRES, 2011). A biotransformação da pirazinamida também dá origem a um segundo e inativo metabólito: 5-hidroxipirazinóico. A maior parte do fármaco é excretado por via renal, sofrendo filtração glomerular, entretanto somente 4% a 14% é excretado na forma íntegra (TAVARES, 2014).
3.4 ETAMBUTOL
Introduzido no tratamento da TB na década de 1960, o etambutol é um isômero D sintético, hidrossolúvel e termoestável, cuja estrutura está explícita na figura 4. Também possui ação contra M. kansaii, M. sulgai e M. xenopi (TAVARES, 2014) e não tem efeitos sobre microrganismos que não sejam micobactérias (RANG et al., 2012), entretanto, se administrado isoladamente, possui facilidade em desencadear resistência (BROOKS et al., 2014).
Figura 4: Fórmula estrutural do etambutol
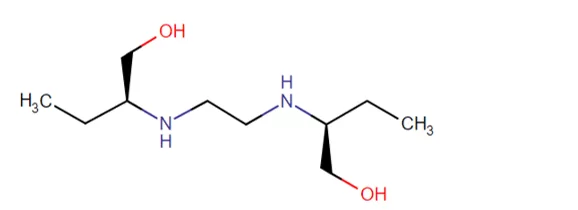
A CIM é de 1-5µg/mL para M. tuberculosis. Após administração de 25mg/kg por via oral, o etambutol da origem à concetrações plasmáticas de 2-5µg/mL, possuindo meia-vida de 2 a 4 horas com boa absorção pelo trato gastrointestinal e não há restrição quanto sua ingestão na presença de alimentos (DECK et al., 2014; PINTO, 2010). Sua biodisponibilidade é de 75 a 80% (ARBEX et al., 2010). Em indivíduos sadios, não atravessa a barreira hematoencefálica, mas cerca de 10% a 50% do fármaco chega ao cérebro em pacientes com meningite tuberculosa (TAVARES, 2014).
Pinto (2010) aponta que a principal via de biotransformação do etambutol parece ser a oxidação que origina os derivados aldeídico (intermediário) e ácido carboxílico, o que facilita sua excreção por via renal. Em contrapartida, estima-se que 20% é eliminado na condição de metabólitos inativos, onde a maior parcela do fármaco (80%) é excretado inalterado, porém farmacologicamente ativo (TAVARES, 2014; OLSON 2014; DECK et al., 2014).
4. CONSIDERAÇÕES FINAIS
Os medicamentos de primeira linha utilizados no combate à tuberculose geniturinária possuem eficácia relativamente boa quando administrados isoladamente, porém, quando se trata da associação dos fármacos há uma influência considerável nos parâmetros farmacocinéticos devido a capacidade de desenvolver a potencialização entre os ativos farmacológicos. Todavia, a farmacocinética de cada medicamento, seja administrado de forma individual ou combinada, está diretamente correlacionada com as características intrínsecas do paciente, incluindo metabolização.
O desenvolvimento de cepa resistentes, além da não seletividade e afinidade das drogas contra a Micobacteria tuberculosis também são fatores que contribuem para o insucesso dos fármacos de primeira linha. Estudos mais aprofundados acerca do bacilo de Koch é de suma importância no desenvolvimento de fármacos seletivos que possuam maior eficácia numa dose ainda menor do que as utilizadas atualmente.
REFERÊNCIAS
ARBEX, Marcos Abdo; VARELLA, Marília de Castro; SIQUEIRA, Hélio Ribeiro de; Mello, Fernando Augusto Fiúza de. Drogas antituberculose: Interações medicamentosas, efeitos adversos e utilização em situações especiais. Parte 1: Fármacos de primeira linha. Jornal Brasileiro de Pneumologia. v. 36, n. 5, p. 626-640, 2010.
SPRINZ, Eduardo; ALVES, Marcelle Duarte. Antituberculosos. In: BARROS, Elvino; MACHADO, Adão; SPRINZ, Eduardo. Antimicrobianos: Consulta Rápida. 5. ed, p. 320-333, Porto Alegre: Artmed Editora, 2013.
BARREIRA, Draurio. Os desafios para a eliminação da tuberculose no Brasil. Epidemiologia e Serviços de Saúde, v. 27, p. e00100009, 2018.
BEIGUELMAN, Bernardo. A interpretação genética da variabilidade humana. Ribeirão Preto: SBG Editora, 2008. 152 p.
BELEZA, Breno Kristoffer Uchôa. Concentrações plasmáticas de rifampicina em pacientes com tuberculose pulmonar. Universidade Federal do Pará, 2017. Dissertação de mestrado.
BETHLEM, Eduardo P. Manifestações clínicas da tuberculose pleural, ganglionar, geniturinária e do sistema nervoso central. v. 21, n. 1, p. 19-22. Pulmão RJ: 2012.
BRASIL. Ministério da saúde. Manual de recomendações para o controle da tuberculose no Brasil. Brasília, 2011.
BRASIL. Ministério da saúde. Plano Nacional de Controle da Tuberculose, 1999.
BROOKS, Geo F.; CARROL, Karen C.; BUTEL, Janet S.; MORSE, Stephen A.; MIETZNET, Timothy A. Quimioterapia antimicrobiana. In: ______. Microbiologia Médica de Jawetz, Melnick & Adelberg. 6. ed, p. 371-406. Porto Alegre: AMGH Editora, 2014.
CAZABON, Danielle; ALSDURG, Hannah; SATYANARAYANA, Srinath; NATHAVITHARANA, Ruvandhi; SUBBARAMAN, Ramnath; DAFTARY, Amrita; PAI, Madhukar. Quality of tuberculosis care in high burden countries: the urgent need to address gaps in the care cascade. Int J Infect Dis. v.56, p. 111-116. 2017.
GUMBO, Tawanda. Quimioterapia da tuberculose. In: BRUNTON, Laurence L.; CHABNER, Bruce A.; KNOLLMANN, Björn C. As Bases Farmacológicas da Terapêutica de Goodman & Gilman. 12 ed, p. 1549-1570. Porto Alegre: AMGH Editora, 2012.
CAMPOS, Hisbello S. Tratamento da tuberculose. v. 16, n. 1, p. 21-31, Pulmão RJ: 2007.
CAVALCANTI, Aline C; ALBUQUERQUE, Miracy M.; MEDEIROS, Flávia P. M.; LAVRA, Zênia M. M.; SANTANA, Aíla K. M. Novas formas farmacêuticas como alternativa para o tratamento da tuberculose visando a diminuição de Casos de Multi-Droga Resistência. Lat. Am. J. Pharm. v. 28. n. 6, p. 945-948, 2009.
CONCEIÇÃO, Gustavo Reis e. Tuberculose, novos desafios. Porto Alegre: 2013.
DRUGBANK. Fórmula estrutural do etambutol. <https://go.drugbank.com/structures/DB00330/image.svg> Acesso em: 05 fev 2021.
DRUGBANK. Fórmula estrutural da isoniazida. <https://go.drugbank.com/structures/DB00951/image.svg> Acesso em: 05 fev 2021.
DRUGBANK. Fórmula estrutural da pirazinamida. <https://go.drugbank.com/structures/DB00339/image.svg> Acesso em: 05 fev 2021.
DRUGBANK. Fórmula estrutural da rifampicina. <https://go.drugbank.com/structures/DB01045/image.svg> Acesso em: 05 fev 2021.
FERREIRA, Anna Carolina Galvão; JUNIOR, José Laerte Rodrigues da Silva; CONDE, Marcus Barreto; RABAHI, Marcelo Fouad. Desfechos clínicos do tratamento de tuberculose utilizando o esquema básico recomendado pelo Ministério da Saúde do Brasil com comprimidos em dose fixa combinada na região metropolitana de Goiânia. Jornal Brasileiro de Pneumologia. v. 39, n. 1, p. 76-83, 2013.
HIJAR, Miguel Aiub; PROCÓPIO, Maria José; FREITAS, Lísia Maria Raymundo de; GUEDES, Regina; BETHLEM, Eduardo P. Epidemiologia da tuberculose: importância no mundo, no Brasil e no Rio de Janeiro. v. 14, n. 3, p. 310-314, Pulmão RJ: 2005.
KASPER, Dennis L.; HAUSER, Stephen L.; JAMESON, J. Larry; FAUCI, Anthony S.; LONGO, Dan L.; LOSCALZO, Joseph. Medicina Interna de Harrison – 2 Volumes. 19 ed. ARTMED, p. 402-403, 2016.
DECK, Daniel H.; PHARM, D.; WINSTON, Lisa G. Fármacos antibacterianos. In: KATZUNG, Bertram G.; MASTERS, Susan B.; TREVOR, Anthony J. Farmacologia Básica e Clínica. 12 ed. AMGH Editora, 2013. cap. 47, p. 839-848.
LAVOR, Edilene Pereira. Estudo de pré-formulação para dose fixa combinada dos tuberculostáticos – Rifampicina, Isoniazida, Pirazinamida e Etambutol (4 em 1). Natal, 2010. Dissertação de mestrado.
LOPES, Agnaldo José; CAPONE, Domenico; MOGAMI, Roberto; TESSAROLLO, Bernardo; CUNHA, Daniel Leme da; CAPONE, Rafael Barcelos; SIQUEIRA, Hélio Ribeiro de; JANSEN, José Manoel. Tuberculose extrapulmonar: aspectos clínicos e de imagem. Rev. Pulmão. v. 15, n.4, p. 253-26, Rio de Janeiro: 2006.
MARTINS, Vanessa de Oliveira; MIRANDA, Camila Vicente de. Diagnóstico e tratamento medicamentoso em casos de tuberculose pulmonar: revisão de literatura. Revista Saúde Multidisciplinar, v. 7, n. 1, 2020.
NETO, Antonio Marcelino de Freitas; HOLANDA, Simone Ferreira; SOUSA, Francisco de Assis Paulino; VANDESMET, Lilian Cortez Sombra. O impacto global da tuberculose e seu tratamento com o complexo isoniazida-rifampicina. Mostra Científica em Biomedicina. v.1, n.1, 2016.
NOGUEIRA, Antônio Francisco; FACCHINETTI, Victor; SOUZA, Marcus Vinicius Nora de; VASCONCELOS, Thatyana Rocha Alves. Tuberculose: uma abordagem geral dos principais aspectos. Rev Bras Farm. v. 93, n.1, p. 3-9, 2012.
NÓBREGA, Hayanne Oliveira da Silva; COSTA, Aleska Maria Pereira da; MARIZ, Saulo Rios; Fook, Sayonara Maria Lia. Intoxicações por Medicamentos: Uma Revisão Sistemática com Abordagem nas Síndromes Tóxicas. Revista Saúde & Ciência Online, v. 4, n. 2, p. 109-119, 2015.
OLIVEIRA, Andreza Oliveira; MELO, Angelita Cristine de; NEVESA, Leonardo de Oliveira; RESENDEA, Karina Aparecida; CAMARGOSA, Paulo. Tuberculose no Brasil: um país, múltiplas realidades. J Bras Pneumol, v. 47, n. 2, p. e20200119, 2021.
OLSON, Kent R. Venenos e fármacos específicos: diagnóstico e tratamento. In:______. Manual de toxicologia clínica. 6. ed. Porto Alegre: AMGH Editora, 2014. seção II, p. 301.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. Global tuberculosis report 2018. Geneva: World Health Organization; 2018
PEREIRA, Maria Nunes. Desenvolvimento e caracterização de carreadores lipídicos nanoestruturados para o tratamento tópico da hidradenite supurativa. Universidade de Brasília, 2020. Tese de doutorado.
PINTO, Leonardo Santos Ribeiro. Síntese, atividade antibacteriana e farmacocinética pré-clínica de pró-fármaco do etambutol com potencial terapêutico para meningite tuberculosa. Araraquara, 2010. Dissertação de Mestrado.
PIRES, Rodrigo Vieira. Tratamento da tuberculose: estudo de interações farmacocinéticas da pirazinamida. Araraquara, 2011. Trabalho de Conclusão de Curso.
RANG, H.P.; RITTER, J. M.; FLOWER, R. J.; HENDERSON, G. Fármacos antibacterianos. In:______. Rang & Dale – Farmacologia. Rio de Janeiro: Elsevier Brasil, 2015. cap. 50, p. 633-637.
SILVA, André Santos da; MACIEL, Gabriella de Alcantara; WANDERLEY, Luciane Soares de Lima; WANDERLEY, Almir Gonçalves. Indicadores do uso de medicamentos na atenção primária de saúde: uma revisão sistemática. Revista Panamericana de Salud Pública, v. 41, p. 132, 2018.
SILVA, Denise Rossato; MELLO, Fernanda Carvalho de Queiroz; MIGLIORI, Giovanni Battista. Série tuberculose 2020. Jornal Brasileiro de Pneumologia, v. 46, n. 2, 2020.
SOUZA, Marília Vieira Nogueira. Rifampicina, um importante fármaco no combate à tuberculose. Rev. Bras. Farm. v. 86, n. 3, p. 92-94, 2005.
TAVARES, Walter. Rifamicinas. In:______. Antibióticos e quimioterápicos para o clínico. 3. ed. São Paulo: ATHENEU, 2014. cap. 16, p. 281-295.
TROUSIL, Jiri; PAVLIS, Oto; KUBICKOVA, Pavla; SKORIC, Misa; MARESOVA, Vera; PAVLOVA, Ewa; KNUDSEN, Kenneth D.; DAI, You-Shan; ZIMMERMAN, Matthew; DARTOIS, Veronique; FANG, Jia-YOU; HRUBY, Martin. Antitubercular nanocarrier monotherapy: Study of In vivo efficacy and pharmacokinetics for rifampicin. Journal of Controlled Release, v. 321, p. 312-323, 2020.
VEIGA, Marco Aurélio Gomes. Estudo da eficiência de degradação da isoniazida pelo processo H2O2 (UV) e identificação dos intermediários. Rio de Janeiro, 2011. Dissertação de Mestrado.
WHALEN, Karen; FINKEL, Richard; PANAVELIL, Thomas A. Antimicobacterianos. In:______. Farmacologia ilustrada. 6 ed. São Paulo: ARTMED, 2016. cap 41, p. 525-534.
[1] Graduação em Farmácia Generalista.
[2] Acadêmica do curso de Farmácia.
[3] Pós-graduação Latu Sentu em Docência do Ensino Superior, Graduação em Farmácia Generalista e Acadêmica do curso de Licenciatura em Química.
[4] Orientador. Pós-graduação em Atenção Farmacêutica e Farmácia Clínica, Graduação em Farmácia Generalista.
Enviado: Janeiro, 2021.
Aprovado: Abril, 2021.
