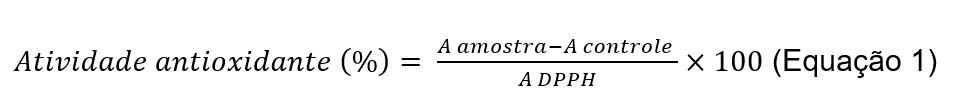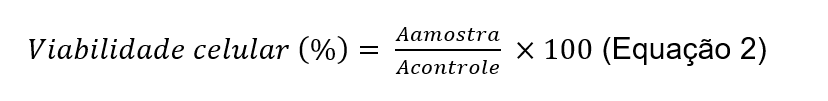ARTIGO ORIGINAL
BRAGA, Glower [1], VAZ, Urias Pardócimo [2], CARPANEZ, Arthur Girardi [3], GRAZUL, Richard Michael [4], ASSIS, Pollyana Mendonça de [5], GARCIA, Adriana [6], BRANDÃO, Marcos Antônio Fernandes [7], RAPOSO, Nádia Rezende Barbosa [8]
BRAGA, Glower. et al. Composição química, atividades biológicas e toxicidade in vitro do óleo de licuri. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 10, Vol. 02, pp. 05-27. Outubro de 2023. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/oleo-de-licuri, DOI: 10.32749/nucleodoconhecimento.com.br/saude/oleo-de-licuri
RESUMO
Syagrus coronata (Mart.) Beccari é uma palmeira presente em alguns biomas nacionais e possui grande importância cultural, socioeconômica e ecológica. As amêndoas comestíveis são ricas em óleo fixo que pode ser aproveitado tecnologicamente, dada a hipótese de que a sua composição química possua compostos ativos úteis para os setores farmacêutico, cosmético, alimentício, ornamental e forrageiro. O objetivo deste trabalho foi caracterizar o perfil químico de ácidos graxos por cromatografia gasosa acoplada à espectrometria de massas, as atividades antioxidante com o reagente DPPH (2,2-difenil-1-picril-hidrazil), de inibição da acetilcolinesterase (método colorimétrico de Ellman) e antifúngica [(Candida albicans ATCC 10231; Candida glabrata (Taniwaki, M.H.) CCT 0728; Candida krusei (FTI) CCT 1517; e Candida guilliermondii (CCT) 1890], bem como a toxicidade aguda in vitro (Artemia salina, Daphnia magna e citotoxicidade empregando fibrosblastos murinos – L929) do óleo fixo extraído da amêndoa de Syagrus coronata adquirido de uma cooperativa nacional. A análise cromatográfica revelou o ácido láurico como composto majoritário (44,61%). A ação antioxidante não foi dose-dependente e na maior concentração testada (250 µg mL-1), a inibição foi de 12,4%. O óleo de licuri promoveu inibição da acetilcolinesterase de 29,4% e CI50 = 3,5 ± 0,2 mg mL-1 e exibiu efeito fungicida para três das quatro espécies analisadas (concentração fungicida mínima = 1.250 µg mL-1 para C. albicans e C. glabrata e 2.500 µg mL-1 para C. krusei). O óleo não demonstrou ser tóxico para os organismos-modelo (dose letal 50% =1.082,12 ± 1,36 µg mL-1 e 101,32 mg mL-1 para Artemia salina e Daphnia magna, respectivamente) e nem alterou a viabilidade dos fibroblastos murinos (L929) nas condições analíticas. Os dados revelam a segurança e a eficácia deste óleo e demonstram a possibilidade de maior e melhor aproveitamento sustentável desta espécie vegetal.
Palavras-chave: Syagrus coronata, Composição química, Atividades biológicas, Toxicidade aguda, Óleo fixo.
1. INTRODUÇÃO
O licuri – Syagrus coronata (Mart.) Beccari – é uma palmeira nativa do bioma Cerrado e da costa leste do Brasil, ocorrendo também no Nordeste e bem adaptada às regiões secas e áridas da Caatinga e da Mata Atlântica e possui grande importância cultural, socioeconômica e ecológica (Silva et al., 2019; Silva e Migues, 2019). A extração de palmeiras é proibida pela lei brasileira e, portanto, indivíduos isolados são uma visão comum em pastagens manejadas no semiárido brasileiro (Silva et al., 2019).
A nomenclatura vernacular inclui licuri, ouricuri (português), uricuripalme (alemão), licuri (espanhol), ouricuri e licuri (inglês). O tamanho da árvore varia entre 1,5 m a 13 m de altura. Possui grande potencial alimentício, ornamental e forrageiro, sendo o seu manejo de grande importância. Seus frutos são elipsóides ou ovóides, 2,5–3×1,7–2 cm, com epicarpo verde-amarelado ou alaranjado, apresentando polpa adocicada e amêndoas comestíveis ricas em óleo que pode ser aproveitado tecnologicamente (Arcano; Sá, Messias, 2021; Teixeira; Ibañez; Block, 2022; Freires, 2023). De acordo com Ticktin (2004), o licuri exerce papel vital para a subsistência e geração de renda das comunidades do semiárido baiano brasileiro.
Johnson (1997) e Rufino e colaboradores (2008) destacaram que tanto os frutos quanto as sementes do licuri são amplamente utilizados na produção de doces, ração animal, óleo comestível e biodiesel, enquanto as folhas são utilizadas no artesanato e na produção de utilidades domésticas. Na medicina popular, o óleo de S. coronata possui diferentes relatos de suas aplicações, como por exemplo: picadas de cobra, inflamações oculares, micoses, cicatrização de feridas e tratamento da dor espinhal, além de outras atividades biológicas que já foram descritas, incluindo atividades antibacteriana, antiparasitária, inseticida, bem como hidratante (Coradin; Camillo; Pareyn, 2018; Razera, 2021, Rodrigues et al., 2011). O extrato obtido das sementes também tem demonstrado potencialidades biológicas, conforme demonstrado por Silva e Migues (2019). As frações aquosas e metanólicas obtidas das inflorescências foram avaliadas por Hughes e colaboradores (2013) e demonstraram atividade contra Bacillus cereus e Staphylococcus aureus resistente a múltiplos fármacos. Adicionalmente, Bessa e colaboradores (2016), e Santos e colaboradores (2019), também demonstraram a eficácia antimicrobiana e a atribuíram ao perfil de ácidos graxos presentes no óleo, rico em ácido láurico. Santos (2019) demonstrou a segurança do óleo fixo por meio de estudos de citotoxicidade, toxicidade aguda oral in vivo e genotoxicidade, bem como a atividade antioxidante. Em 2023, Penha e colaboradores, destacaram o uso da espécie vegetal como fonte de compostos bioativos e suas potencialidades tanto para a saúde humana (agentes terapêuticos, cosméticos e alimentícios) quanto para uso veterinário.
Diante do exposto e da escassez de dados na literatura sobre as atividades biológicas e de toxicidade sobre do óleo fixo extraído da amêndoa de Syagrus coronata (Mart.) Beccari, neste trabalho foram avaliados o perfil de ácidos graxos, as atividades antioxidante, de inibição da acetilcolinesterase e antifúngica, bem como a toxicidade aguda in vitro (Artemia salina, Daphnia magna e citotoxicidade em fibrosblastos murinos – L929) deste óleo.
2 MATERIAL E MÉTODOS
2.1 AMOSTRA VEGETAL
O óleo fixo extraído da amêndoa de licuri por prensagem a frio e filtrado foi adquirido comercialmente da empresa Licuri do Brasil localizada em Caldeirão Grande – Bahia – Brasil. O óleo possui coloração amarelada e aroma suave de coco.
2.2 PERFIL DE ÁCIDOS GRAXOS DO ÓLEO FIXO DE SYAGRUS CORONATA
Os ácidos graxos utilizados na síntese dos padrões de ésteres metílicos foram submetidos ao protocolo de esterificação em meio alcoólico. A uma alíquota da mistura de ácidos graxos (80 mg), adicionou-se 8 mL de solução previamente preparada com 2 g de cloreto de amônio, 60 mL de metanol para análise e 3mL de ácido sulfúrico. Após homogeneização em vórtex e aquecimento em água fervente por 10 minutos, foram adicionados 4 mL de uma solução saturada de cloreto de sódio. Por fim, realizou-se extração com 2 mL de n-hexano PA destilado, para a obtenção dos ésteres metílicos. Em outro tubo de ensaio, foram adicionados 80 mg do óleo extraído da amêndoa do licuri, e em seguida, adicionados 4 mL de solução de hidróxido de potássio 0,5 mol/litro de metanol PA e homogeneizados em vórtex. Em seguida, foram aquecidos em água fervente por 5 minutos. Após essa etapa, adicionou-se 4 mL de uma solução previamente preparada com 2 g de cloreto de amônio PA, 60 mL de metanol PA e 3 mL de ácido sulfúrico PA. A mistura foi novamente homogeneizada e depois aquecida em água fervente por 5 minutos. Finalmente, foram adicionados 4 mL de solução de cloreto de sódio saturada (36 g em 100 mL de água) e realizada a extração com 2 mL de n-hexano PA destilado, para a obtenção dos ésteres metílicos derivados dos ácidos graxos presentes no óleo. Adicionou-se a fase orgânica, obtida após a extração com n-hexano destilado, concentração aproximada de 40 mg/mL, em um tubo de ensaio com sulfato de sódio anidro PA. Depois, transferiu-se 100 µL desta solução para outro tubo contendo 900 µL de n-hexano destilado, realizando assim uma diluição de 10 vezes. Em seguida, transferiu-se essa solução para o vial do CG-EM em uma proporção de 1 + 2 volume/volume (v/v), chegando à concentração final de 1,33 mg/mL. As análises por cromatografia gasosa acoplada à espectrometria de massas (CG-EM) foram realizadas em equipamento GCMS-QP2010Plus (Shimadzu) acoplado ao auto-injetor AOC-5000, coluna capilar RTx®-5MS, 60 m x 0,25 mm, espessura do filme 0,25 ìm (Crosband 5% difenil, 95% polisiloxano). Utilizou-se gás hélio como gás de arraste. As análises foram realizadas empregando-se as seguintes condições foram empregadas: modo Split (taxa de split 1:10), volume de injeção de 1 µL, fluxo de 19,1 mL/minuto, temperatura do injetor de 245 °C. Para o forno, foi empregada a programação descrita na Tabela 1. Programou-se o aparelho de detecção de massa para captação de 40 a 700 unidades de massa atômica, no intervalo de 3 até 47 minutos, e a fonte de ionização foi o impacto de elétrons a 70 eV.
Tabela 1 – Programação linear da temperatura do forno da coluna usada na cromatografia gasosa acoplada à espectrometria de massas
| Taxa (°C/minuto) | Temperatura (°C) | Tempo de espera (minutos) |
| – | 80 | 3 |
| 5 | 150 | 6 |
| 5 | 215 | 3 |
| 5 | 250 | 1 |
Fonte: o Autor (2023).
2.3 ATIVIDADE BIOLÓGICA
2.3.1 ATIVIDADE ANTIOXIDANTE
Para analisar a atividade antioxidante, empregou-se método descrito por Sreejayan e Rao (1996), modificado. Esta técnica preconiza o sequestro de espécies reativas de oxigênio através da redução do DPPH. Utilizou-se uma solução de DDPH 0,05 M, obtida pela solubilização de 1 mg de DDPH em 50 mL de etanol. Uma alíquota do óleo de licuri foi preparada a partir de 10 μL de óleo e 10 μL de dimetilsulfóxido, solubilizados em 1980 μL de etanol obtendo uma solução inicial de 5.000 μg/mL. Dessa, foram alíquotados 200 μL aos quais se adicionou 800 μL de etanol PA, obtendo uma solução com concentração de 1.000 μg/mL. Foram realizadas diluições seriadas utilizando o etanol PA como diluente. Em microplaca de 96 poços, foram adicionados 50 μL da amostra, em diferentes concentrações, e 150 μL de DPPH. Ao término do processo, foram obtidas concentrações-teste na faixa de 0,122 a 250 μg/mL. Para cada concentração foi preparado o branco da amostra, para excluir possível interferência da coloração da amostra. Para homogeneização, as amostras foram submetidas à ação de um agitador de microplaca durante 3 minutos e, na sequência, as amostras foram colocadas em temperatura ambiente e mantidas em ambiente escuro por 30 minutos. Em seguida as placas foram lidas a 510 nm em espectrofotômetro adequado. O padrão utilizado no ensaio foi o ácido ascórbico (Sigma-Aldrich, EUA), o qual foi preparado igualmente à amostra e na mesma faixa de concentração. O ensaio foi conduzido em triplicata. A atividade antioxidante foi calculada por meio da Equação 1.
Para analisar a atividade antioxidante, empregou-se método descrito por Sreejayan e Rao (1996), modificado. Esta técnica preconiza o sequestro de espécies reativas de oxigênio através da redução do DPPH. Utilizou-se uma solução de DDPH 0,05 M, obtida pela solubilização de 1 mg de DDPH em 50 mL de etanol. Para cada concentração, calculou-se a porcentagem da atividade antioxidante em função das leituras das absorvâncias e com esses valores construiu-se o gráfico dose-resposta. A partir do gráfico obtido, foi determinada CI50, que é a concentração capaz de inibir 50% dos radicais livres presentes no DPPH. A probabilidade aceita como indicativa da existência de diferença significativa foi de p < 0,05.
2.3.2 INIBIÇÃO DA ACETILCOLINESTERASE (ACHE)
A inibição da AChE provocada pelo óleo de licuri foi avaliada pelo método colorimétrico descrito por Ellman e colaboradores (1961), com algumas modificações, adaptado para microplacas por Rhee e colaboradores (2001). Foram usados o iodeto de acetiltiocolina (ATCI) como substrato e o reagente de Ellman ácido 5,5’-ditiobis-(2-nitrobenzóico) (DTNB). Em uma placa de 96 poços, foram adicionados 80 µL de solução tampão Tris-HCl 50 mM (pH=8,0), 120 µL do óleo de licuri (2 – 2.000 µg mL-1), e 25 µL da solução de DTNB 3 mM + ATCI 75 mM. Em seguida, foram colocados 25 µL de solução de AChE 0,25 U mL-1. Posteriormente a absorvância foi lida espectrofotometricamente (λ = 415 nm), a cada 15 segundos por 41 ciclos, e à temperatura de 37oC. O fármaco de referência empregado foi a eserina. Também foram preparados o branco do óleo-teste, adicionando 120 µL do óleo (nas mesmas concentrações dos poços-teste) à 130 µL do tampão Tris-HCl, para excluir possível interferência da coloração do óleo; o branco da enzima, adicionando 225 µL de tampão Tris-HCl à 25 µL de substrato, para excluir possível interferência da enzima; e a enzima teste, adicionando 200 µL de tampão Tris-HCl, 25 µL de substrato e 25 µL de enzima, para obter 100% de atividade da enzima. O teste foi realizado em triplicata. A atividade enzimática foi calculada a partir da inclinação da região linear da curva cinética (ΔA/Δt) utilizando o programa Microsoft® Excel. Calculou-se a porcentagem de inibição comparando-se as taxas de reação da amostra (óleo) com a taxa de reação da eserina. A CI50, ou seja, concentração do óleo capaz de inibir a hidrólise da acetilcolina em 50%, foi determinada a partir da curva dose-resposta, empregando o software GraphPad Prism 5. O teste t de Student foi utilizado para avaliar diferenças significativas entre os valores de porcentagem de inibição e CI50 do óleo e o fármaco de referência. A probabilidade aceita como indicativa da existência de diferença significativa foi de p < 0,05.
2.3.3 ATIVIDADE ANTIFÚNGICA
As cepas padrão utilizadas neste estudo foram: Candida albicans American Type Culture Collection (ATCC) 10231; Candida glabrata (Taniwaki, M.H.), Coleção de culturas tropicais (CCT) 0728; Candida krusei (FTI) CCT 1517; e Candida guilliermondii (CCT) 1890 procedentes da Fundação André Tosello (São Paulo, Brasil). Os procedimentos realizados seguiram as técnicas preconizadas pelo protocolo M27-A2 do Clinical and Laboratory Standards Institute (CLSI). As linhagens de leveduras foram cultivadas a 35 ± 2 °C por 48 horas em ágar Sabouraud dextrose (SDA). Suspensões fúngicas de cada linhagem foram preparadas com transmitância de 90% no comprimento de onda de 530 nm, usando solução salina estéril 0,9%. Foram feitas diluições das soluções em meio Roswell Park Memorial Institute (RPMI) 1640 (Sigma Aldrich, EUA) tamponado com ácido 3(N-morfolino) propanosulfônico (MOPS) (JT Baker, Alemanha) para obtenção de 3 x 103 unidades formadoras de colônia (UFC)/mL. O pH foi ajustado para 7,0, com o auxílio de solução de hidróxido de sódio 0,5 M. O óleo foi diluído em meio RPMI 1640 tamponado com MOPS e 20 µL mL-1 de Tween-80/DMSO (1:1, v/v), em concentrações entre 9,7 e 2.500 µg mL-1. Adicionaram-se 100 µL do óleo de licuri à microplacas estéreis nas concentrações citadas. Na sequência, foram adicionados 100 µL das suspensões fúngicas padronizadas. O controle de crescimento consistiu em 200 µL do mesmo meio de cultura inoculado e o controle negativo compreendeu em 200 µL de meio de cultura não inoculado. A anfotericina B (0,125 – 64 µg/mL) e a nistatina (2 a 64 unidades internacionais – UI) foram utilizadas como fármacos de referência. Para a incubação, as microplacas foram mantidas em estufa bacteriológica a 35 ± 2°C por 48 horas. A concentração inibitória mínima (CIM) foi considerada como a menor concentração na qual não houve crescimento fúngico. A concentração fungicida mínima (CFM) foi determinada, retirando-se uma alíquota de 10 µL dos poços nos quais não foi verificado o crescimento das amostras da CIM que foram transferidas para tubos contendo 1 mL de caldo Sabouraud dextrose (SDB). Em seguida, incubaram-se os tubos a 35 ± 2°C por 48 horas em estufa bacteriológica. Após esse período, foi realizada a leitura da CFM. Nas concentrações em que se observaram crescimento fúngico, a diluição foi considerada como sendo fungistática. Naquelas onde não ocorreram crescimento, classificou-se como de ação fungicida. Os experimentos foram realizados em triplicata.
2.4 TOXICIDADE AGUDA
2.4.1 ARTEMIA SALINA LEACH
O método descrito por Meyer e colaboradores (1982), com modificações foi escolhido para o ensaio de letalidade para Artemia salina (adquiridos da Maramar Aquacultura, Cabo Frio, Rio de Janeiro, Brasil). Utilizando-se ovos encistados do microcrustáceo, foi realizada a incubação em água marinha artificial com pH variando entre 8 e 9 à temperatura ambiente. Coletaram-se 10 unidades do microcrustáceo, eclodidos após 48 horas de incubação sob iluminação artificial, que foram então adicionados em poços de placa branca leitosa. Os poços continham o óleo de licuri solubilizado inicialmente em 2,5% de DMSO. Na sequência, o volume foi completado a 5 mL usando água do mar artificial. O ensaio foi realizado em triplicada com concentrações variando entre de 10 e 1.000 μg mL−1. Os controles negativos foram a água do mar artificial e o DMSO (2,5%) e o controle positivo empregado foi o timol, nas mesmas concentrações do óleo. Os microcrustáceos sobreviventes foram contados após 24 horas de tratamento para calcular a porcentagem de morte ocorrida. Utilizou-se a análise Probit para o cálculo d concentração letal de 50% (CL50) (Finney, 1971). A análise estatística foi realizada através do teste T de Student considerando valores de p < 0,05 para diferença estatística significante.
2.4.2 DAPHNIA MAGNA
O Kit Daphtoxkit F magna (Microbio Tests Inc., Bélgica) foi escolhido para a avaliação da toxicidade aguda, com o emprego da Daphnia magna como bioindicador. As orientações do fabricante foram seguidas, ou seja, os organismos foram selecionados após 2 a 26 horas após a eclosão dos ovos. As concentrações avaliadas em concentrações entre 0,10 e 40,00 mg/mL numa mistura de Tween 80 e DMSO (1:1; v/v) e água. Para cada concentração foram acrescentados 25 microcrustáceos, com os experimentos protegidos da luz, incubados por 48 horas à temperatura de 22°C e os resultados expressos em Concentração Efetiva Média (CE50), ou seja, aquela capaz de provocar a morte ou imobilidade a 50% dos organismos, após determinado tempo de exposição (ABNT, 2002; 2011). O óleo avaliado foi categorizado conforme o estabelecido por Zucker (1985) apud Manrique (2009).
2.4.3 CITOTOXICIDADE
A linhagem celular imortalizada empregada na elaboração deste estudo foi a de fibroblasto murino (L929) fornecida pela Universidade Federal de Santa Catarina. O meio Dubelcco’s Modified Eagle’s Medium (DMEM, Vitrocell) suplementado com 10% de soro fetal bovino, 1% de penicilina e estreptomicina (100 µg mL-1) e 1% de ácido [4-(2-hidroxietil)]-1-piperazinaetanolsulfônico (HEPES, 10 mM) foi utilizado para o cultivo das células, que foram mantidas em incubadora sob atmosfera umidificada à temperatura 37ºC e com 5% de dióxido de carbono (CO2). Este ensaio foi realizado de acordo com o método MTT descrito por Mosmann (1983). Brevemente, após atingirem 80% de confluência, as células foram tripsinizadas e plaqueadas com densidade celular de 5 x 103 células/poço, estimada por meio de contagem em câmara de Neubauer empregando o corante azul de trypan. Após 24 horas, o meio foi substituído pelos tratamentos. Foram aplicadas 100 µL do óleo de licuri solubilizado em dimetilsulfóxido (DMSO) em meio de cultura DMEM, em quintuplicada, em concentrações variando entre 7,81 e 1.000 µg mL-1. Como experimento controle, aplicou-se o meio de cultura sem o óleo. Preparou-se um controle do solvente (DMSO), adicionando-se esse solvente ao meio DMEM. Incubou-se a placa por 48 horas a 37ºC e 5% CO2. Removeram-se então os tratamentos, lavaram-se os poços com 100 µL de tampão fosfato salina (PBS) e aplicou-se a solução de MTT a 10% [(10 µL de MTT (5 mg mL−1) e 90 µL de DMEM]. Incubou-se a placa por 3 horas. Solubilizaram-se os cristais de formazana obtidos em 100 µL de DMSO. Foi obtida a absorvância dessa solução em 540 nm, em espectrofotômetro adequado. Com as absorvâncias alcançadas, foram calculadas as porcentagens de viabilidade celular através da Equação 2, comparando os controles com o tratamento com óleo de licuri. Através do software Graphpad Prism versão 5, executou-se a análise de variância (ANOVA) seguida de teste post hoc de Bonferronni. Valores de p < 0,05 foram considerados estatisticamente diferentes.
onde o valor da absorvância obtida após reação com MTT referente às células tratadas com diferentes concentrações do óleo é representado por Aamostra; o valor da absorbância após reação com MTT de células não tratadas é representado por Acontrole.
3. RESULTADOS E DISCUSSÃO
3.1 PERFIL DE ÁCIDOS GRAXOS DO ÓLEO FIXO DE SYAGRUS CORONATA
O perfil cromatográfico do óleo fixo de Syagrus coronata (Figura 1) revelou a presença do ácido láurico como composto majoritário (44,61%). A diversidade de ácidos graxos pode ser observada pelo número de picos cromatográficos identificados no óleo (n = 6), perfazendo um total de 100% do material analisado.
Figura 1. Perfil cromatográfico do óleo fixo de Syagrus coronata
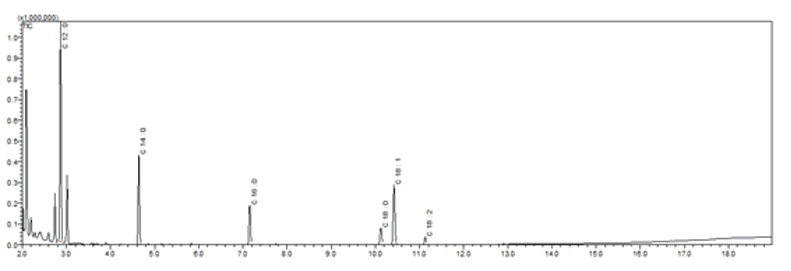
A partir do mesmo, foi possível também descrever a composição quali-quantitativa do óleo fixo de licuri (Tabela 2).
Tabela 2 – Diversidade de ácidos graxos encontrados no óleo fixo de Syagrus coronata
| Composição | Abreviação | Ácido | % Área |
| Dodecanoato de metila | C12:0 | Láurico | 44,61 |
| Tetradecanoato de metila | C14:0 | Mirístico | 20,33 |
| Hexadecanoato de metila | C16:0 | Palmítico | 10,22
|
| Octadecanoato de metila | C18 0 | Esteárico | 5,07
|
| (E)-octadec-9-enoato de metila | C18:1 ω9trans | Elaídico | 17,68 |
| (9Z, 12Z)-octadeca-9-12-dienoato de metila | C18:2 ω6 | Linoléico | 2,09 |
tR-Tempo de Retenção em minutos; IKCAL– Índice de Kovats calculado (com base na série homóloga de n-alcanos C7-C30); IKLIT– Índice de Kovats da literatura. Fonte: Adams, 2007.
De acordo com Santos (2019), as análises do óleo da amêndoa de licuri realizada por cromatografia gasosa acoplado com detector por ionização de chama (CG-FID) revelaram oito constituintes na amostra de S. coronata, dos quais o ácido láurico (43,64%) e o ácido mirístico (14,32%) também foram os mais abundantes.
O uso tópico de óleos vegetais ricos em ácidos graxos funciona com uma barreira protetora para a pele por meio do efeito oclusivo que permite que a mesma se mantenha hidratada e saudável. O óleo de coco, rico em ácidos graxos saturados como ácido láurico (49%), mirístico (18%) e palmítico (8%) – à semelhança dos principais ácidos graxos saturados presentes no óleo extraído da amêndoa do licuri, já demonstrou ser efetivo e seguro quando aplicado como hidratante ( Lin; Zhong; Santiago, 2017). Devido essa similaridade, é possível que o óleo extraído da amêndoa do licuri tem sua aplicabilidade ampliada para os mesmos fins que o óleo de coco.
O percentual de ácido láurico na amêndoa do licuri (36% a 48%) também foi descrito por Teixeira, Ibañez e Block (2022) e é concordante o valor encontrado por este trabalho. Segundo Coradin, Camillo e Pareun (2018), o óleo de licuri apresenta diversos benefícios à saúde humana em razão da presença de ácidos graxos de cadeia média, que são gorduras saturadas de fácil digestão. Estes ácidos graxos também podem ser utilizados na formulação de suplementos alimentares, ajudando na redução do peso, promovendo a saciedade, liberando energia e auxiliando no funcionamento do metabolismo e da glândula tireoide.
3.2 ATIVIDADES BIOLÓGICAS
3.2.1 ATIVIDADE ANTIOXIDANTE
O óleo de licuri não apresentou ação antioxidante dose-dependente, não sendo, portanto, possível o cálculo da concentração efetiva de 50% (CE50), ou seja, a concentração necessária para consumir 50% dos radicais livres presentes no DPPH. Na maior concentração testada, a inibição foi de 12,4%. Este resultado não demonstra uma atividade relevante por este método para esta amostra. No entanto, vale ressaltar que esse não é o único mecanismo de ação antioxidante e que outros protocolos devem ser conduzidos na tentativa de averiguar a potencialidade biológica deste óleo. Os dados encontrados estão de acordo com aqueles obtidos por Souza et al. (2021), que encontraram atividade de 10% para o óleo fixo de licuri oriundo do município de Capim Grosso – Bahia –Brasil. O fármaco de referência empregado – o ácido ascórbico – demonstrou efeito dose-dependente e CE50= 1,74 µg/mL. De acordo com Gulçin e colaboradores (2010), durante os processos bioquímicos que ocorrem no organismo, são produzidas de modo contínuo as chamadas Espécies Reativas de Oxigênio (EROs), as quais em concentrações fisiológicas participam da homeostase celular. Em desacordo com o nosso achado, Bauer (2013) relataram elevado potencial antioxidante para o óleo de licuri usando o mesmo protocolo de análise (DPPH); no entanto, o método de extração a quente relatado por eles era diferente daquele usado pela empresa fornecedora do óleo empregado neste estudo. Tal diferença pode ser a responsável pela discordância. Seneviratne, Hapuarachchi e Ekanayake (2009), demonstraram que o óleo de coco extraído a quente tem uma atividade antioxidante muito maior do que o óleo extraído a frio; essa diferença pode estar relacionada à maior quantidade de substâncias fenólicas resistentes à temperatura no óleo extraído a quente.
3.2.2 INIBIÇÃO DA ACETILCOLINESTERASE
O óleo de licuri promoveu inibição enzimática de 29,4% e apresentou uma CI50 = 3,5 ± 0,2 mg mL-1, enquanto a eserina inibiu totalmente a enzima com CI50 = 2,0 ± 0,2 µg mL-1. Os resultados para o óleo e a eserina diferiram significativamente (p < 0,05). O óleo de licuri pode ser considerado um inibidor fraco da acetilcolinesterase, uma vez que os inibidores potentes inibem mais de 50% da enzima, os moderados inibem entre 30% e 50% e os inibidores fracos inibem menos de 30% da acetilcolinesterase (Vinutha et al., 2007).
El-Hawary e colaboradores (2021) demonstraram a inibição da AChE provocada pelos extratos hidroalcoólicos tanto das folhas quanto dos frutos de Syagrus romanzoffiana (Cham.) Glassman e demonstraram in vivo o efeito neuroprotetor dos mesmos.
A literatura científica traz muitos estudos sobre a doença de Alzheimer (DA) e muitos deles propõem terapias com o objetivo de diminuir o número de casos e reduzir o progresso dos sintomas da doença. Fatores demográficos, genéticos e estilos de vida são características que influenciam o metabolismo lipídico e são os principais fatores de risco da doença de Alzheimer. No sistema nervoso central, a elevação de citocinas pró-inflamatórias propicia a ativação da micróglia e gera focos de inflamação que prejudicam a homeostase local, resultando em morte neuronal e danos cognitivos (Ellulu et al., 2017; Verdile et al., 2015). Tendo-se em vista que a capacidade anti-inflamatória do ácido láurico, é plausível supor que ele possa minimizar os efeitos pró-inflamatórios do ácido araquidônico e melhorar sintomas de DA, por se tratar de uma doença com características inflamatórias (XU et al., 2013). Foi sugerido por alguns autores (Matsuzaki et al., 2011; Guttmann et al., 2020; Sandupama, Munasinghe e Jayasinghe; 2022) que os componentes do óleo de coco, dentre eles o (ácido láurico e os triglicerídeos de cadeia média) exibem características potenciais para o tratamento da Doença de Alzheimer.
A diversidade de atividades biológicas atribuídas aos ácidos graxos saturados se deve parcialmente ao comprimento da cadeia carbônica com mais de 10 átomos de carbono. Tais moléculas estariam diretamente associadas ao desencadeamento de vias anti-inflamatórias e antioxidantes, potenciais interessantes na prevenção da doença de Alzheimer (Neves, 2018). De fato, para o ácido láurico, composto majoritário encontrado no óleo fixo obtido das amêndoas de licuri, são descritas as atividades anti-inflamatória e antimicrobiana (Nakatsuji et al., 2009). Santos (2019) reforça a atividade anti-inflamatória, relacionando-a à presença de ácido láurico.
3.2.3 ATIVIDADE ANTIFÚNGICA
O óleo fixo extraído da amêndoa do licuri demonstrou efeito fungicida para três das quatro espécies analisadas (CFM = 1.250 µg mL-1 para C. albicans e C. glabrata e CFM = 2.500 µg mL-1 para C. krusei) (Tabela 3).
Tabela 3 – Avaliação da atividade antifúngica das substâncias de interesse
| Micro-organismos | Anfotericina B (µg/mL) | Nistatina
(UI) |
Óleo de licuri
(μg/mL) |
|||
| CIM | CFM | CIM | CFM | CIM | CFM | |
| Candida albicans ATCC 10231 | 0,125 | 0,5 | 8 | 16 | 625 | 1.250 |
| Candida glabrata CCT 0728 | 0,125 | ˃16 | 16 | ˃64 | 625 | 1.250 |
| Candida krusei
CCT 1517 |
2 | 4 | 16 | 32 | 1.250 | 2.500 |
| Candida guilliermondii
CCT 1890 |
0,25 | ˃16 | 16 | ˃64 | 1.250 | ˃2.500 |
CIM (Concentração Inibitória Mínima); CFM (Concentração Fungicida Mínima); UI (Unidades internacionais). Fonte: o Autor (2023).
Considerando que a resistência fúngica é um grave problema de saúde pública e que o desenvolvimento de novos fármacos não é tão rápido quanto a evolução da resistência nos microrganismos, é imperiosa a busca por novos compostos para o tratamento de doenças causadas por fungos, cujo arsenal terapêutico é escasso (Zhou et al., 2018; Robbins, Wright e Cowen, 2016). Nesse cenário, de acordo com Sampaio e colaboradores (2023), os óleos provenientes de frutos da família Arecaceae, da qual o também licuri é pertencente, surgem como candidatos, dada a hipótese de que a composição química desses óleos possua compostos ativos que podem ser utilizados contra microrganismos patogênicos e parasitas. Tais autores demonstraram que a combinação do óleo fixo de Syagrus cearenses Noblick e fluconazol, foi eficaz contra as cepas de C. albicans, C. krusei e C. tropicalis.
O potencial antibacteriano dos produtos naturais extraídos de plantas deste gênero é bem descrito literatura, destacando-se o efeito do óleo de S. coronata contra o Staphylococcus aureus resistente a múltiplos fármacos, rico em compostos com essa propriedade, como os ácidos láurico, oleico e linoleico. O mecanismo de ação tanto de S. coronata quanto de S. oleracea não foi completamente elucidado, mas é atribuída ao ácido láurico a destruição da membrana celular e a interferência em processos celulares, como transdução de sinal e transcrição (Dayrit, 2014; Kim e Rhee, 2016). De acordo com Kim e Rhee (2016) e Kim, Seok e Rhee (2019), o ácido cáprico também pode danificar a membrana microbiana e, facilitar a entrada de íons hidrogênio do ambiente extracelular e promover a inativação celular.
3.3 TOXICIDADE AGUDA
3.3.1 ARTEMIA SALINA LEACH
O óleo fixo de licuri não apresentou toxicidade aguda empregando A. salina como organismo-modelo, visto que a dose letal 50% (DL50) foi de 1.082,12 ± 1,36 µg mL-1. De acordo com Meyer e colaboradores (1982), amostras com valores de DL50 acima 1.000 µg mL-1 não são consideradas tóxicas.
Silva e Migues (2019) também não observaram atividade contra o microcrustáceo para o extrato obtido das sementes de Syagrus coronata oriundo do município de Senhor do Bonfim – Bahia – Brasil.
Os controles negativos (água do mar artificial e o DMSO 2,5%) não apresentaram influência sobre os resultados, pois nenhuma larva morreu na presença dos mesmos, mas o timol (controle positivo) apresentou DL50 = 22,00 ± 1,15 µg mL-1. Os valores de DL50 do timol e do óleo de licuri diferiram significativamente (p < 0,05).
Este ensaio tem sido amplamente utilizado para triagem toxicológica e isolamento bioguiado de muitos compostos ativos, incluindo produtos naturais, devido à simplicidade e rapidez na execução, além do baixo custo (Olmedo et al., 2023).
3.2.2 DAPHNIA MAGNA
Os resultados obtidos com o teste de toxicidade empregando Daphnia magna como bioindicador, após 48 horas de tratamento, revelaram CE50 = 101,32 mg/L. De acordo com a classificação da toxicidade aguda proposta por Zucker (1985), o óleo pode ser considerado praticamente não tóxico.
A presença de compostos tóxicos em corpos de água representa um risco aos organismos aquáticos e para o meio ambiente como um todo, e a realização de ensaios ecotoxicológicos exibem potencialidades para auxiliar preditivamente na compreensão da interação dos efeitos tóxicos, com a resposta biológica dos organismos. Para avaliar os impactos desta amostra em ecossistemas aquáticos de maneira mais profunda, outros testes ecotoxicológicos (agudos e crônicos) empregando peixes, algas, macrófitas, macroinvertebrados bentônicos e perifiton são indicados (Li, Zhong e Santiago, 20107; Sousa et al., 2021).
3.2.3 CITOTOXICIDADE
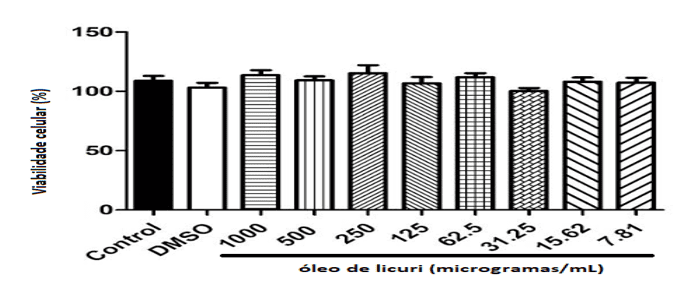
Os resultados da viabilidade celular de fibroblastos murinos (L929) para o óleo fixo das amêndoas de Syagrus coronata, bem como para os controles, estão expressos na Figura 2. De acordo com a ISO 10993-5 (2009), as substâncias são classificadas como citotóxicas quando a viabilidade celular é inferior a 70% da amostra. Não foram evidenciadas perda da viabilidade celular nas condições analíticas testadas, bem como não foram encontradas diferenças estatisticamente significativas entre os grupos controles e tratamento (p ˃ 0,05).
Figura 2. Viabilidade celular de fibroblastos murinos (L929) em função dos tratamentos
4. CONCLUSÃO
O perfil lipídico e de segurança in vitro, aliado ao conjunto das atividades biológicas atribuídas ao óleo extraído da amêndoa de Syagrus coronate (Mart.) Beccari demonstraram a potencialidade do mesmo como insumo ativo para os segmentos farmacêutico e cosmético, também a sua aplicação em seres humanos e animais. Ainda, representa a possibilidade de maior e melhor aproveitamento do óleo vegetal, e com isso a promoção de impactos social e econômico benéficos, visto que a produção sustentável e o uso diversificado deste óleo podem aumentar tanto a renda de agricultores familiares no Brasil quanto para a indústria.
No entanto, estudos mais aprofundados devem ser conduzidos para cada uso pretendido desse óleo; o uso de estratégias tecnológicas convergentes como a nanotecnologia podem ser consideradas no âmbito de uma economia sustentável, bem como o desenvolvimento de formulações farmacêuticas e/ou cosméticas diferenciadas à base deste óleo fixo de licuri. Tais estratégias visam não só a valorização da biodiversidade brasileira, mas também a ampliação das oportunidades de mercado para este óleo.
REFERÊNCIA
ADAMS, R. P. Identification of essential components by gas chromatography/mass spectroscopy. 4.ed. Illinois: Allured Publishing Corporation, 2007.
ARCANO, A. F. D; SÁ, A. A. MESSIAS, C. M. B. O. Licuri milk (Syagrus coronata) supplemented with the calcium present in the egg shell of laying hens. Brazilian Journal of Development, [S.L.], v. 7, n. 3, p. 30303-30313, 2021.
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS (ABNT). 2002. Água – Ensaio de toxicidade aguda com Daphnia sp. (Crustacea, Cladocera). ABNT NBR 12713: 2002.
______. 2011. Ecotoxicidade aquática – Toxicidade aguda – Método de ensaio com peixes. ABNT NBR 15088: 2011.
BAUER, L. C. Chemical characterization of pressed and refined licuri (Syagrus coronata) oils. Acta Scientiarum. Technology. Maringá, v. 35, n. 4, p. 771-776, Oct.-Dec., 2013.
BESSA, C. M. A. S. et al. Syagrus coronata seed oils have antimicrobial action against multidrug-resistant Staphylococcus aureus. Journal of Medicinal Plants Research, v. 10, n. 23, p. 310–317, 2016.
CORADIN, L.; CAMILLO, J ; PAREYN, F. G. C. Espécies nativas da flora brasileira de valor econômico atual ou potencial. Plantas para o futuro: região Nordeste. Brasília, DF: Ministério do Meio Ambiente, 2018. Disponível em http://www.mma.gov.br/publicacoes/biodiversidade/category/142-serie-biodiversidade.html. 03 de Mar.2023.
DAYRIT, F. M. The properties of lauric acid and their significance in coconut oil. Journal of The American Oil Chemists’ Society, v. 92, n. 1, p. 1-15, 15 nov. 2014.
EL-HAWARY, S. S. et al. Anticholinesterase activity and metabolite profiling of Syagrus romanzoffiana (Cham.) Glassman leaves and fruits via UPLC–QTOF–PDA–MS. Natural Product Research, v. 35, n. 10, p. 1671-1675, 31 maio 2019.
ELLULU, M. S.et al. Obesity and inflammation: the linking mechanism and the complications. Archives of Medical Science, v. 4, p. 851-863, 2017.
FINNEY D. J. Probit Analysis. 3 ed. Cambridge, UK: Cambridge University Press. 1971.
FREIRES, J. D. Monitoramento tecnológico do processamento do óleo de licuri (Syagrus coronata) para fins alimentícios. Journal of Biotechnology and Biodiversity, v. 11, n. 1, p. 10-17, 30 mar. 2023.
GÜLÇIN, I. et al. Polyphenol contents and antioxidant activity of lyophilized aqueous extract of propolis from Erzurum, Turkey. Food And Chemical Toxicology, v. 48, n. 8-9, p. 2227-2238, ago. 2010.
GUTTMANN, R.et al. Coconut Oil and its Constituents as a Treatment for Alzheimer’s Dementia. Journal of Student Research, v. 9, n. 1, p. 1-6, 3 nov. 2020.
HUGHES, A. F. S. et al. Antimicrobial activity of Syagrus coronata (Martius) Beccari. Brazilian Archives of Biology and Technology, v. 56, n. 2, p. 269-274, abr. 2013.
International Organization for Standardization. ISO 10993-5 – Biological Evaluation of medical devices. Part 5: Tests for in vitro cytotoxicity, 3ª ed., ISO, 2009.
JOHNSON, D.V. et al. Non-wood forest products: tropical palms. Bangkok, Thailand: Food and Agriculture Organization of the United Nations, 1997.
KIM, H. W.; SEOK, Y. S.; RHEE, M. S. Synergistic staphylocidal interaction of benzoic acid derivatives (benzoic acid, 4-hydroxybenzoic acid and β-resorcylic acid) and capric acid: mechanism and verification study using artificial skin. Journal of Antimicrobial Chemotherapy, v. 75, n. 3, p. 571-575, 28 nov. 2019.
KIM, S. A.; RHEE, M. S. Highly enhanced bactericidal effects of medium chain fatty acids (caprylic, capric, and lauric acid) combined with edible plant essential oils (carvacrol, eugenol, β-resorcylic acid, trans -cinnamaldehyde, thymol, and vanillin) against Escherichia coli O157: h7. Food Control, v. 60, p. 447-454, fev. 2016.
LI, Z.-H.; LI, P.; RANDAK, T. Ecotoxocological effects of short-term exposure to a human pharmaceutical Verapamil in juvenile rainbow trout (Oncorhynchus mykiss). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, v. 152, n. 3, p. 385-391, set. 2010.
LIN, T.-K.; ZHONG, L.; SANTIAGO, J. Anti-Inflammatory and Skin Barrier Repair Effects of Topical Application of Some Plant Oils. International Journal of Molecular Sciences, v. 19, n. 1, p. 70, 27 dez. 2017.
MANRIQUE, W. G. 2009. Toxicidade aguda, risco ambiental do fipronil para o guarú (Poecilia reticulata) e dissipação no ambiente aquático. Dissertação (Mestrado), Pós-Graduação em Aquicultura, Centro de Aquicultura da UNESP – Campus de Jaboticabal, Universidade Estadual Paulista, Jaboticabal – SP, 2009. Disponível em https://repositorio.unesp.br/handle/11449/86756?show=full. Acesso em 04 ago. 2023.
MATSUZAKI, T. et al. Association of Alzheimer disease pathology with abnormal lipid metabolism: the hisayama study. Neurology, v. 77, n. 11, p. 1068-1075, 12 set. 2011.
MEYER, B. et al. Brine shrimp: a conveniente general bioassay for active plant constituents. Planta Medica, v. 45, n. 5, p. 31-34, 1982.
MOSMANN T. Rapid Colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods, v. 65, p. 55-62, 1983.
NAKATSUJI, T. et al. Antimicrobial Property of Lauric Acid Against Propionibacterium Acnes: its therapeutic potential for inflammatory acne vulgaris. Journal of Investigative Dermatology, v. 129, n. 10, p. 2480-2488, out. 2009.
NEVES, D.A. Caracterização química, determinação da presença de hidrocarbonetos policíclicos aromáticos, e avaliação do efeito do cozimento na composição química, capacidade antioxidante e atividade antimicrobiana do jambu (Acmella oleracea(L.) R.K. Jansen). 2018. 134 f. Tese (Doutorado) – Curso de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Campinas – Sp, 2018. Disponível em: https://repositorio.unicamp.br/acervo/detalhe/1082253. Acesso em: 01 set. 2023.
OLMEDO, D.A. et al. Understanding the Artemia Salina (Brine Shrimp) Test: pharmacological significance and global impact. Combinatorial Chemistry & High Throughput Screening, v. 26, p. 1-10, 3 jul. 2023.
PENHA, E; et al. Syagrus coronata como fonte de compostos bioativos: aspectos fitoquímicos e potenciais biológicos e industriais na saúde humana e veterinária. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 08, Ed. 04, Vol. 06, pp. 29-50. Abr de 2023.
RAZERA, M. L. Palmeira do sertão: caracterização da cadeia produtiva do licuri (Syagrus coronata Martius Beccari) em regiões da Bahia. 2021. 108 f. TCC (Graduação) – Curso de Engenharia Florestal, Universidade Tecnológica Federal do Paraná, Dois Vizinhos – PR, 2021. Disponível em: http://repositorio.utfpr.edu.br/jspui/handle/1/29314. Acesso em: 25 ago. 2022.
ROBBINS, N.; WRIGHT, G. D.; COWEN, L. E. Antifungal Drugs: the current armamentarium and development of new agents. Microbiology Spectrum, v. 4, n. 5, p. 1-19, 14 out. 2016.
RODRIGUES, I. A. et al. In vitro anti-Leishmania amazonensis activity of the polymeric procyanidin-rich aqueous extract from Syagrus coronate. Journal of Medicinal Plants Research, v. 5, n. 16, p. 3781-3790, 18 August, 2011.
RUFINO, M. U. D. L. et al. Conhecimento e uso do ouricuri (Syagrus coronata) e do babaçu. Acta Botanica Brasilica, Buíque, v. 22, p. 1141-1149, julho 2008.
SAMPAIO, R. S. L. et al. Chemical composition and antimicrobial potential of Acrocomia aculeata (Jacq.) Lodd. ex Mart. and Syagrus cearensis Noblick (Arecaceae). Microbial Pathogenesis, v. 180, p. 106147-106148, jul. 2023.
SANDUPAMA, P; MUNASINGHE, D; JAYASINGHE, M. Coconut oil as a therapeutic treatment for alzheimer’s disease: a review. Journal of Future Foods, v. 2, n. 1, p. 41-52, mar. 2022.
SANTOS, B. S. et al. Anti-staphylococcal activity of Syagrus coronata essential oil: biofilm eradication and in vivo action on galleria mellonela infection model. Microbial Pathogenesis, v. 131, p. 150-157, jun. 2019.
SANTOS, M. S. Atividade anti-inflamatória tópica dos óleos de babaçu e licuri. 2019. 91 F. Tese (Doutorado) – Pós-Graduação em Ciências Farmacêuticas, Centro de Ciências da Saúde, Universidade Federal de Pernambuco, Recife – PE, 2019. Disponível em: https://repositorio.ufpe.br/bitstream/123456789/39567/1/TESE%20Simone%20Maria%20dos%20Santos.pdf. Acesso em 04 ago. 2023.
SENEVIRATNE, K. N.; HAPUARACHCHI, C. D.; EKANAYAKE, S. Comparison of the phenolic-dependent antioxidant properties of coconut oil extracted under cold and hot conditions. Food Chemistry, v. 114, n. 4, p. 1444-1449, jun. 2009.
SILVA, J. O. et al. Natural Vs Managed Habitat: effect over the seed-predator pachymerus nucleorum and its natural enemies. Neotropical Entomology, v. 49, n. 1, p. 131-138, 14 nov. 2019.
SILVA, J. O.; MIGUES, V. H. Prospecção fitoquímica e atividade biológica de Syagrus Coronata e Vanilla Palmarum. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano 04, Ed. 07, Vol. 09, pp. 20-42. Julho de 2019.
SOUSA, M. L. et al. Caffeine as a contaminant of periphyton: ecological changes and impacts on primary producers. Ecotoxicology, v. 30, n. 4, p. 599-609, 17 mar. 2021.
SOUZA, T. G. S. et al. Biological safety of Syagrus coronata (Mart.) Becc. Fixed oil: cytotoxicity, acute oral toxicity, and genotoxicity studies. Journal of Ethnopharmacology, v. 272, p. 113941, maio 2021.
SREEJAYAN, N.; RAO, M. N. Free radical scavenging of curcuminoids. Arzneimittel Forschung – Drug Research, v. 46, v. 2, p. 169-172, 1996.
TEIXEIRA, G. L.; IBAÑEZ, E.; BLOCK, J. M. Emerging Lipids from Arecaceae Palm Fruits in Brazil. Molecules, v. 27, n. 13, p. 4188, 29 jun. 2022.
TICKTIN, T. The ecological implications of harvesting non-timber forest products. Journal of Applied Ecology, v. 41, n. 1, p. 11-21, 12 fev. 2004.
VERDILE, G. et al. Inflammation and Oxidative Stress: the molecular connectivity between insulin resistance, obesity, and Alzheimer’s disease. Mediators of Inflammation, v. 2015, p. 1-17, 2015.
VINUTHA, B. et al. Screening of selected Indian medicinal plants for acetylcholinesterase inhibitory activity. Journal of Ethnopharmacology, v. 109, p. 359-363, 2007.
XU, S. et al. CD36 Enhances Fatty Acid Uptake by Increasing the Rate of Intracellular Esterification but Not Transport across the Plasma Membrane. Biochemistry, v. 52, n. 41, p. 7254-7261, 3 out. 2013..
ZHOU, Y. et al. Lovastatin synergizes with itraconazole against planktonic cells and biofilms of Candida albicans through the regulation on ergosterol biosynthesis pathway. Applied Microbiology and Biotechnology, v. 102, n. 12, p. 5255-5264, 25 abr. 2018.
ZUCKER, E. 1985. Hazard Evaluation Division – Standard Evaluation Procedure – Acute toxicity test for freshwater fish. USEPA Publication 540/9-85-006.
[1] Graduado em medicina pela UNI-FOA (Universidade de Volta Redonda) no ano de 2000. Título de Especialista em Cirurgia Geral (Residência Médica Hospital Geral de Ipanema) término em 2003, Título de Especialista em Cirurgia Plástica (Residência no Hospital Universitário Clementino Fraga Filho- UFRJ) término em 2006, Título de Especialisata em Dermatologia pela Sociedade Brasileira de Dermatologia. Atualmente Mestrando do Programa de Pós Graduação em Saúde (PPGS-Stricto Sensu) da Universidade Federal de Juiz de Fora, Minas Gerais. ORCID: 0009-0001-8162-141X. Currículo Lattes: http://lattes.cnpq.br/6407206291074282.
[2] Mestrado em Saúde Coletiva. ORCID: 0000-0003-0512-307X. Currículo Lattes: http://lattes.cnpq.br/1112231712478363.
[3] Doutorado em Química. ORCID: 0000-0002-6231-8052. Currículo Lattes: http://lattes.cnpq.br/1112231712478363.
[4] Doutorado em Química. ORCID: 0000-0001-7492-9355. Currículo Lattes: http://lattes.cnpq.br/1583818296495609.
[5] Mestrado em Saúde. ORCID: 0000-0002-1905-2527. Currículo Lattes: http://lattes.cnpq.br/2470597442366263.
[6] Mestrado em Química. ORCID: 0000-0001-5348-3542. Currículo Lattes: http://lattes.cnpq.br/2145592109291763.
[7] Doutorado em Química. ORCID: 0000-0001-7186-2220. Currículo Lattes: http://lattes.cnpq.br/6247152116355527.
[8] Orientadora. Doutorado em Toxicologia. ORCID: 0000-0001-5271-1048 Currículo Lattes: http://lattes.cnpq.br/4958736937529401.
Enviado: 6 de setembro, 2023.
Aprovado: 18 de setembro, 2023.