ARTIGO ORIGINAL
PEIXOTO, Emanuel Henrique Coelho [1], JESUS, Lizandra Carolina de [2], CORREIA, Aline Roepke Loss [3]
PEIXOTO, Emanuel Henrique Coelho. JESUS, Lizandra Carolina de. CORREIA, Aline Roepke Loss. Situação epidemiológica da COVID-19 na macrorregião de saúde leste de Minas Gerais entre 2020 e 2021. Revista Científica Multidisciplinar Núcleo do Conhecimento. Ano. 07, Ed. 06, Vol. 07, pp. 120-138. Junho de 2022. ISSN: 2448-0959, Link de acesso: https://www.nucleodoconhecimento.com.br/saude/situacao-epidemiologica
RESUMO
A COVID-19, doença infecciosa causada pelo coronavírus da Síndrome Respiratória Aguda Grave tipo 2, teve um grande impacto nos sistemas de saúde em todo o mundo, levando a Organização Mundial de Saúde (OMS) a declarar situação de pandemia no primeiro trimestre de 2020. A complexidade da distribuição de casos no Brasil impele a um questionamento: qual a realidade epidemiológica dos casos de Síndrome Respiratória Aguda Grave (SARS) em uma macrorregião de Minas Gerais? No presente trabalho, o objetivo geral foi realizar um estudo de prevalência de casos de SARS na macrorregião de saúde Leste de Minas Gerais (região que compreende os municípios de Governador Valadares, Resplendor e Aimorés) entre os anos de 2020 e 2021. O estudo descritivo e quantitativo utilizou dados secundários do banco de dados oficial da Fundação Oswaldo Cruz (InfoGripe, Fiocruz/MS) contendo casos notificados de SARS em pessoas residentes na macrorregião de saúde do estado de Minas Gerais relativos ao período de março de 2020 a novembro de 2021. A distribuição de casos de SARS apresentou uma incidência levemente maior na macrorregião leste de Minas Gerais quando comparada com o estado de Minas Gerais, porém com um perfil semelhante. Esse indicador pode estar relacionado a alguma disparidade em saúde que necessita maior atenção dos gestores de saúde pública da região.
Palavras-chave: COVID-19, SARS-CoV-2, Coronavírus, SARS.
1. INTRODUÇÃO
A propagação global da Síndrome Respiratória Aguda Grave por Coronavírus tipo 2 (SARS-CoV-2, do inglês Severe Acute Respiratory Syndrome) e as milhares de mortes causadas pela doença do coronavírus (COVID-19, do inglês Coronavirus Disease 2019) levaram a Organização Mundial de Saúde (OMS) a declarar uma pandemia no primeiro trimestre de 2020. Depois que os primeiros casos dessa doença viral, predominantemente respiratória, foram relatados pela primeira vez em Wuhan, província de Hubei, China, no final de dezembro de 2019, o SARS-CoV-2 se disseminou rapidamente por todo o mundo em um curto espaço de tempo (WHO, 2021). A COVID-19 sobrecarregou os sistemas de saúde de praticamente todos os países do planeta. O mundo sofreu em termos de perda de vidas, repercussões econômicas e aumento da pobreza (CIOTTI et al., 2020). A pandemia também resultou na perda de meios de subsistência devido a paralisações prolongadas, que tiveram um efeito cascata na economia global (KAUFMAN e LEIGH, 2021).
Assim como outros vírus de Ácido Ribonucleico (RNA, do inglês Ribonucleic Acid), o SARS-CoV-2, enquanto se adapta a seus novos hospedeiros humanos, está sujeito à evolução genética com o desenvolvimento de mutações ao longo do tempo, resultando em variantes mutantes que podem ter características diferentes de suas linhagens ancestrais. Variantes do SARS-CoV-2 foram descritas durante o curso desta pandemia, entre as quais apenas algumas são consideradas Variantes de Interesse (VOIs, do inglês Variants Of Interest) pela OMS, devido ao seu impacto na saúde pública global. Com base na atualização epidemiológica recente da OMS, de 22 de junho de 2021, quatro VOIs de SARS-CoV-2 foram identificados desde o início da pandemia (WALENSKY et al., 2021):
(i) Alfa (B.1.1.7): primeira variante de preocupação descrita no Reino Unido no final de dezembro de 2020;
(ii) Beta (B.1.351): relatado pela primeira vez na África do Sul em dezembro de 2020;
(iii) Gama (P.1): relatado pela primeira vez no Brasil no início de janeiro de 2021;
(iv) Delta (B.1.617.2): relatado pela primeira vez na Índia em dezembro de 2020.
Apesar da velocidade sem precedentes do desenvolvimento da vacina para a prevenção do COVID-19 e dos esforços globais de vacinação em massa, o surgimento de novas variantes do SARS-CoV-2 ameaça reverter o progresso significativo feito até agora para limitar a propagação desta doença viral (WALENSKY et al., 2021).
Segundo a OMS foram reportados mais de 250 milhões de casos confirmados em todo o mundo, sendo que só no Brasil foram reportados mais de 22 milhões de casos, até novembro de 2021. Diante desse cenário, o país apresenta um conjunto de fatores que permitiram elevada prevalência da doença, ocupando o terceiro lugar na relação de países com maior número de casos no mundo, estando atrás apenas dos Estados Unidos e da Índia, e sendo o segundo maior em número de mortes pela COVID-19 (OMS, 2021).
No Brasil, as macrorregiões com maior prevalência de casos confirmados de COVID-19 foram Norte, Nordeste e Centro-Oeste; as regiões Sul e Sudeste, mais desenvolvidas economicamente, apresentaram o menor casuística (DONG et al., 2020).
O planejamento de ações de controle da disseminação da SARS-CoV-2 parte do (re)conhecimento da magnitude da doença em uma região, desenvolvendo um panorama com informações precisas e atualizadas de indicadores de saúde, como o número de pessoas diagnosticadas com SARS. A taxa de incidência é considerada um indicador útil para avaliar a transmissão de SARS em uma determinada área. Essa taxa depende principalmente das atividades de detecção de casos novos, refletindo a eficácia das estratégias dos programas de controle. A compreensão da complexidade da distribuição de casos e a heterogeneidade dentro de uma região impele a um questionamento: qual a realidade epidemiológica dos casos de SARS em uma macrorregião de Minas Gerais?
Neste sentido, no presente trabalho, o objetivo geral foi realizar um estudo de prevalência de casos de SARS na macrorregião de saúde Leste de Minas Gerais entre os anos de 2020 e 2021. Foram objetivos específicos deste estudo identificar a distribuição de casos notificados de SARS no Brasil e em Minas Gerais; a incidência de SARS no estado de Minas Gerias; e a distribuição de casos e óbitos confirmados por COVID-19 e o total de vacinas aplicadas segundo o local de residência na macrorregião Leste entre os anos de 2020 e 2021. Para isto, foi realizado um estudo descritivo de abordagem quantitativa utilizando dados secundários do banco de dados oficial da Fundação Oswaldo Cruz (InfoGripe, Fiocruz/MS) relativos ao período de março de 2020 a novembro de 2021 contendo casos notificados de SARS em pessoas residentes na macrorregião de saúde do estado de Minas Gerais.
2. DESENVOLVIMENTO
Coronavírus (CoVs) são vírus de RNA de fita positiva (+ssRNA) que se assemelham com uma coroa quando vistos em um microscópio eletrônico (coronam é o termo latino para coroa) devido à presença de glicoproteínas de pico no envelope. A subfamília Orthocoronavirinae da família Coronaviridae (ordem Nidovirales) é classificada em quatro gêneros de CoVs: alphacoronavirus (alphaCoV), betacoronavirus (betaCoV), deltacoronavirus (deltaCoV) e gammacoronavirus (gammaCoV), sendo o gênero BetaCoV dividido em cinco subgêneros ou linhagens (CHAN et al., 2013).
A caracterização genômica mostrou que morcegos e roedores são as prováveis fontes gênicas de alphaCoVs e betaCoVs. Por outro lado, as espécies aviárias parecem representar as fontes gênicas de deltaCoVs e gammaCoVs. Os CoVs se tornaram os principais patógenos de surtos de doenças respiratórias emergentes. Os membros desta grande família de vírus podem causar doenças respiratórias, entéricas, hepáticas e neurológicas em diferentes espécies animais, incluindo camelos, gado, gatos e morcegos. Por razões ainda não explicadas, esses vírus podem cruzar as barreiras das espécies e causar, em humanos, doenças que vão desde o resfriado comum até doenças mais graves, como a Síndrome Respiratória do Oriente Médio (MERS, do inglês Middle East Respiratory Syndrome) e SARS. Até o momento, foram identificados sete CoVs humanos (HCoVs), capazes de infectar humanos. Alguns dos HCoVs foram identificados em meados da década de 1960, enquanto outros foram detectados apenas no novo milênio. Em geral, as estimativas sugerem que 2% da população são portadores saudáveis de CoVs e que esses vírus são responsáveis por cerca de 5% a 10% das infecções respiratórias agudas (LEI et al., 2018).
HCoV-OC43 e HCoV-HKU1 (betaCoVs da linhagem A, HCoV-229E e HCoV-NL63 (alphaCoVs) são CoVs humanos comuns. Esses vírus podem causar resfriados comuns e infecções autolimitadas do trato respiratório superior em indivíduos imunocompetentes. No entanto, em indivíduos imunocomprometidos e idosos, podem ocorrer infecções do trato respiratório inferior devido a esses vírus. Já o SARS-CoV e o MERS-CoV (betaCoVs da linhagem B e C, respectivamente) são considerados mais virulentos e capazes de causar epidemias com manifestações respiratórias e extra-respiratórias de gravidade clínica variável (CHAN et al., 2020).
O SARS-CoV-2 é um novo betaCoV pertencente ao mesmo subgênero que a síndrome respiratória aguda grave coronavírus (SARS-CoV) e a Síndrome Respiratória do Oriente Médio Coronavírus (MERS-CoV), que foram previamente implicados nas epidemias de SARS-CoV e MERS -CoV, que tiveram taxas de mortalidade de até 10% e 35%, respectivamente (CHAN et al., 2020).
O SARS-CoV-2 tem uma forma redonda ou elíptica e frequentemente pleomórfica e um diâmetro de aproximadamente 60-140 nm. Como outros CoVs, é sensível aos raios ultravioleta e ao calor. Embora a alta temperatura diminua a replicação de qualquer espécie de vírus, a temperatura de inativação do SARS-CoV-2 está sendo pesquisada. Uma superfície de aço inoxidável mantida a uma temperatura do ar de 54,5 °C resulta na inativação de 90% do SARS-CoV-2 em aproximadamente 36 minutos. Por outro lado, pode resistir a temperaturas mais baixas, mesmo abaixo de 0 °C. Além disso, esses vírus podem ser efetivamente inativados por solventes lipídicos, incluindo éter (75%), etanol, desinfetante contendo cloro, ácido peroxiacético e clorofórmio, exceto clorexidina (BIRYUKOV et al., 2021).
Embora a origem do SARS-CoV-2 seja atualmente desconhecida, é amplamente postulado que se originou de um animal silvestre, implicando na transmissão zoonótica. Análises genômicas sugerem que o SARS-CoV-2 provavelmente evoluiu de uma cepa encontrada em morcegos. A comparação genômica entre a sequência SARS-CoV-2 humana e coronavírus animais conhecidos revelou de fato alta homologia (96%) entre o SARS-CoV-2 e o betaCoV RaTG13 de morcegos (Rhinolophus affinis) (ANDERSEN et al., 2020).
Semelhante ao SARS e ao MERS, foi levantada a hipótese de que o SARS-CoV-2 avançou de morcegos para hospedeiros intermediários, como pangolins e visons, e depois para humanos. Um relatório divulgado em 2020 pela OMS descrevendo as possíveis origens do SARS-CoV-2 não foi conclusivo, pois não especificou claramente a origem do vírus; no entanto, relatou que a circulação do SARS-CoV-2 ocorreu já em dezembro de 2019. Este relatório explorou várias hipóteses possíveis da origem do vírus, incluindo a origem do vírus em um animal, a transmissão do vírus a um hospedeiro intermediário e a passagem subsequente para humanos (ZHANG et al., 2020; ORESHKOVA et al., 2020).
Como mencionado anteriormente, o SARS-CoV-2 é propenso à evolução genética, resultando em múltiplas variantes que podem ter características diferentes em comparação com suas cepas ancestrais. O sequenciamento genômico periódico de amostras virais é de fundamental importância, especialmente em um cenário de pandemia global, pois ajuda a detectar quaisquer novas variantes genéticas do SARS-CoV-2. Notavelmente, a evolução genética foi mínima inicialmente com o surgimento da variante D614G globalmente dominante, que foi associada ao aumento da transmissibilidade, mas sem a capacidade de causar doenças graves (KORBER et al., 2020).
Outra variante foi identificada em humanos, atribuída à transmissão de visons de criação infectados na Dinamarca, que não foi associada ao aumento da transmissibilidade. Desde então, várias variantes do SARS-CoV-2 foram descritas, das quais apenas algumas são consideradas variantes de interesse (VOIs), devido ao seu potencial de causar maior transmissibilidade ou virulência, redução da neutralização por anticorpos obtidos por infecção natural ou vacinação, a capacidade de evitar a detecção, ou uma diminuição na eficácia terapêutica ou vacinação (ORESHKOVA et al., 2020).
Com o surgimento contínuo de múltiplas variantes, o CDC e a OMS estabeleceram independentemente um sistema de classificação para distinguir as variantes emergentes do SARS-CoV-2 em variantes de interesse (VOIs):
a) Alfa (linhagem B.1.1.7):
No final de dezembro de 2020, foi relatada no Reino Unido uma nova variante de interesse de SARS-CoV-2, a linhagem B.1.1.7, também conhecida como variante Alfa ou GRY (anteriormente GR/501Y.V1), com base no sequenciamento de genoma completo de amostras de pacientes com teste positivo para SARS-CoV-2 (GALLOWAY et al., 2021; VOLZ et al., 2021).
Essa variante de interesse estava circulando no Reino Unido já em setembro de 2020 e era baseada em vários modelos de projeções. Foi relatado que é 43% a 82% mais transmissível, ultrapassando as variantes preexistentes do SARS-CoV-2 e emergindo como a variante dominante do SARS-CoV-2 no Reino Unido. A variante B.1.1.7 foi relatada nos Estados Unidos (EUA) no final de dezembro de 2020 e foi uma das cepas mais dominantes em circulação (DAVIES et al., 2021a).
Um estudo inicial de caso-controle combinado não relatou nenhuma diferença significativa no risco de hospitalização ou mortalidade associada com a variante da linhagem B.1.1.7 em comparação com outras variantes existentes. No entanto, estudos subsequentes relataram que pessoas infectadas com a variante da linhagem B.1.1.7 aumentaram a gravidade da doença em comparação com pessoas infectadas com outras formas circulantes de variantes do vírus (DAVIES et al., 2021b; VOLZ et al., 2021).
Um estudo relatou que a variante B.1.1.7 estava associada a um aumento da mortalidade em comparação com outras variantes do SARS-CoV-2 (HR = 1,61, IC 95% 1,42-1,82) (DAVIES e JARVIS, 2021). O risco de morte foi supostamente maior (razão de risco ajustada 1,67, IC 95% 1,34-2,09) entre os indivíduos com variante de preocupação B.1.1.7 confirmada em comparação com os indivíduos com SARS-CoV-2 não 1.1.7 (GRINT et al., 2021).
b) Beta (linhagem B.1.351)
Outra variante do SARS-CoV-2, B.1.351, também conhecida como variante Beta ou GH501Y.V2 com múltiplas mutações de pico, resultou na segunda onda de infecções por COVID-19. Esta variante foi detectada pela primeira vez na África do Sul em outubro de 2020, e foi relatada como tendo um risco aumentado de transmissão e neutralização reduzida por terapia com anticorpos monoclonais, soros de convalescença e soros pós-vacinação (TEGALLY et al., 2021; WANG et al., 2021).
c) Gama (linhagem P.1)
A terceira variante de interesse, a variante P.1, também conhecida como variante Gama ou GR/501Y.V3, foi identificada em dezembro de 2020 no Brasil e foi detectada pela primeira vez nos EUA em janeiro de 2021. Uma característica desta variante é que ela pode ter neutralização reduzida por terapias de anticorpos monoclonais, soros de convalescença e soros pós-vacinação (FARIA et al., 2021).
d) Delta (linhagem B.1.617.2)
A quarta variante de interesse, B.1.617.2, também conhecida como variante Delta, foi inicialmente identificada em dezembro de 2020 na Índia e foi responsável pela segunda onda mortal de infecções por COVID-19 em abril de 2021 na Índia. Nos Estados Unidos, essa variante foi detectada pela primeira vez em março de 2021 (WALENSKY et al., 2021).
O principal modo de transmissão do SARS-CoV-2 é através da exposição a gotículas respiratórias que transportam o vírus infeccioso quando em contato próximo ou transmissão de gotículas de indivíduos pré-sintomáticos, assintomáticos ou sintomáticos que abrigam o vírus. A transmissão aérea a partir de procedimentos de geração de aerossol também foi implicada na disseminação do COVID-19. No entanto, os dados que implicam a transmissão aérea do SARS-CoV-2 na ausência de procedimentos geradores de aerossol estão surgindo e sendo avaliados, e este modo de transmissão não foi reconhecido universalmente (VAN DOREMALEN et al., 2020).
A transmissão a partir da contaminação de superfícies inanimadas com SARS-CoV-2 foi bem caracterizada com base em muitos estudos relatando a viabilidade do SARS-CoV-2 em várias superfícies porosas e não porosas. Em condições experimentais, o SARS-CoV-2 mostrou ser estável em superfícies de aço inoxidável e plástico em comparação com superfícies de cobre e papelão, com o vírus viável sendo detectado até 72 horas após a inoculação das superfícies com o vírus (VAN DOREMALEN et al., 2020).
Um estudo que avaliou a duração da viabilidade do vírus em objetos e superfícies mostrou que o SARS-CoV-2 pode ser encontrado em plástico e aço inoxidável por até 2-3 dias, papelão por até 1 dia e cobre por até 4 horas. Além disso, parece que a contaminação foi maior em unidades de terapia intensiva (UTI) do que em enfermarias gerais, e o SARS-CoV-2 pode ser encontrado em pisos, mouses de computador, latas de lixo e corrimãos de leito de enfermidades, bem como no ar até 4 metros de pacientes implicando em transmissão nosocomial em conjunto com a transmissão por fômites (GUO et al., 2020).
O Centro de Controle e Prevenção de Doenças (CDC), órgão americano de saúde, divulgou recentemente uma atualização informando que os indivíduos podem ser infectados com o SARS-CoV-2 por meio do contato com superfícies contaminadas pelo vírus, mas o risco é baixo e não é a principal via de transmissão deste vírus. Dados epidemiológicos de vários estudos de caso relataram que pacientes com infecção por SARS-CoV-2 têm o vírus vivo presente nas fezes, implicando em possível transmissão fecal-oral. Além disso, uma meta-análise que incluiu 936 recém-nascidos de mães com COVID-19 mostrou que a transmissão vertical é possível, mas ocorre em uma minoria dos casos (YEO et al., 2020; KOTLYAR et al., 2021).
Segundo a Organização Mundial da Saúde (OMS), o surgimento de doenças virais representa um sério risco à saúde pública. Nas últimas duas décadas, várias epidemias causadas por vírus, como a síndrome respiratória aguda grave coronavírus (SARS-CoV) de 2002 a 2003, a influenza H1N1 em 2009, e a síndrome respiratória coronavírus do Oriente Médio (MERS-CoV) em 2012, foram descritas, as quais tiveram um impacto significativo na saúde global (AHMAD et al., 2021).
Desde que foi declarada uma pandemia global pela OMS, o vírus responsável pela COVID-19 se espalhou por 223 países com mais de 250 milhões de casos confirmados e mais de 5 milhões de mortes relatadas globalmente. Os Estados Unidos da América (EUA) tiveram o maior número de infecções por SARS-CoV-2 e mortes relacionadas ao COVID-19, seguidos pelo Brasil e Índia. Para efeito de comparação, a COVID-19 foi a terceira principal causa de morte nos EUA em 2020 depois de doenças cardíacas e câncer, com aproximadamente 375.000 mortes relatadas, sendo que até o momento já acumula mais de 770 mil mortes (AHMAD et al., 2021).
Até a data de 22 de junho de 2021, a variante Alfa (B.1.1.7) se espalhou por 170 países, a variante Beta (B.1.351) foi relatada em 119 países, a variante Gama (P.1) foi detectada em 71 países e a variante Delta (B.1.617.2) se espalhou para 85 países ao redor do mundo com base na atualização epidemiológica semanal da OMS (2021). A estimativa atual da OMS da taxa global de letalidade para COVID-19 é de 2,2%. No entanto, a taxa de letalidade é afetada por fatores que incluem idade, condições preexistentes subjacentes e gravidade da doença e varia significativamente entre os países.
A COVID-19 pode ser considerada uma doença viral sistêmica com base em seu envolvimento em vários sistemas de órgãos principais. Pacientes com idade avançada e comorbidades como obesidade, diabetes mellitus, doença pulmonar crônica, doença cardiovascular, doença renal crônica, doença hepática crônica e condições neoplásicas possuem risco de desenvolver COVID-19 grave e suas complicações associadas. A complicação mais comum da COVID-19 grave é a deterioração clínica progressiva ou súbita que leva a insuficiência respiratória aguda e Síndrome do Desconforto Respiratório Agudo (SDRA) e/ou falência de múltiplos órgãos, levando à morte. Além disso, também há o risco aumentado de desenvolver complicações pró-trombóticas, como acidente vascular cerebral isquêmico e trombose arterial (COOPERSMITH et al., 2021).
O prognóstico de COVID-19 é amplamente dependente de vários fatores que incluem a idade do paciente, a gravidade da doença na apresentação, condições pré-existentes, a rapidez com que o tratamento pode ser implementado e a resposta ao tratamento. Conforme descrito anteriormente, a estimativa atual da OMS da taxa global de casos fatais para COVID-19 é de 2,2%. No entanto, a taxa de letalidade é afetada por fatores como idade, condições pré-existentes subjacentes e gravidade da doença. Os resultados de um estudo de coorte prospectivo multicêntrico europeu que incluiu 4.000 pacientes gravemente enfermos com COVID-19 relataram uma mortalidade de 90 dias de 31%, com mortalidade mais alta observada em pacientes idosos, diabéticos, obesos e com SDRA grave (COVID-ICU, 2021).
3. MATERIAL E MÉTODO
Foi realizado um estudo descritivo de abordagem quantitativa e temporalidade retrospectiva, utilizando-se dados secundários publicados em bancos de dados oficiais.
Segundo estado mais populoso do Brasil, Minas Gerais apresenta 853 municípios. O Índice de Desenvolvimento Humano (IDH) do estado foi 0,731 em 2010, com importante desigualdade entre as regiões do estado (SILVA et al., 2012). Foi selecionada a macrorregião de saúde leste de Minas Gerais (Figura 1), região que compreende, dentre outros, os municípios de Aimorés, Resplendor e Governador Valadares.
Figura 1: Mapa do estado de Minas Gerais, com destaque para a macrorregião leste de saúde, em vermelho
Foram utilizados dados do Info Gripe (Fiocruz/MS) relativos ao período de março de 2020 a novembro de 2021 contendo casos notificados de síndrome respiratória aguda grave (SARS) em pessoas residentes na macrorregião de saúde do estado de Minas Gerais. As informações fornecidas pelo Info Gripe (Fiocruz/MS) são anonimizadas.
4. RESULTADOS
De março de 2020 a novembro de 2021, foram registrados, no Brasil, mais de 22 milhões de casos de síndrome respiratória aguda grave (SARS), sendo que em Minas Gerais esse número foi de 2,2 milhões e na macrorregião leste foram registrados pouco mais de 68 mil casos confirmados. Das cidades da macrorregião leste, Governador Valadares foi a que apresentou o maior número de casos, 33.446, seguido por Mantena, com 3.375, Conselheiro Pena, com 2.336, Resplendor, com 2.186, e Aimorés, com 2.177 casos confirmados.
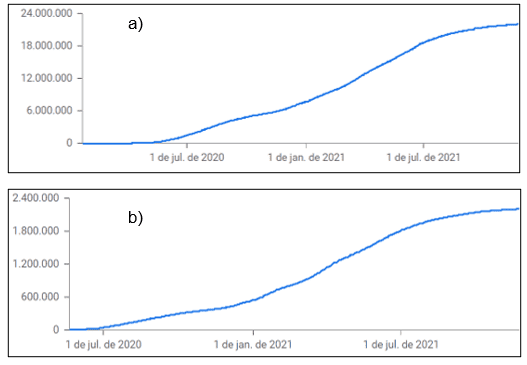
O perfil de distribuição dos casos notificados de SARS no Brasil e em Minas Gerais no período de março de 2020 a novembro de 2021 está demonstrado na Figura 2. Pode-se notar um perfil semelhante, demonstrando que o aumento de casos no estado de Minas Gerais seguiu o aumento de casos no Brasil.
Figura 2: Casos notificados de SARS no Brasil (a) e em Minas Gerais (b), de 2020 a 2021
A seguir, na Figura 3, é possível observar o perfil de distribuição de incidência de SARS por 100 mil habitantes no estado de Minas Gerais (a) e na macrorregião de saúde leste (b), no período de 2020 a 2021. As duas localidades apresentam um perfil semelhante, com um pico de incidência bem intenso no primeiro trimestre de 2021.
Figura 3: Incidência de SARS no estado de Minas Gerais (a) e na macrorregião de saúde leste (b), de 2020 a 2021
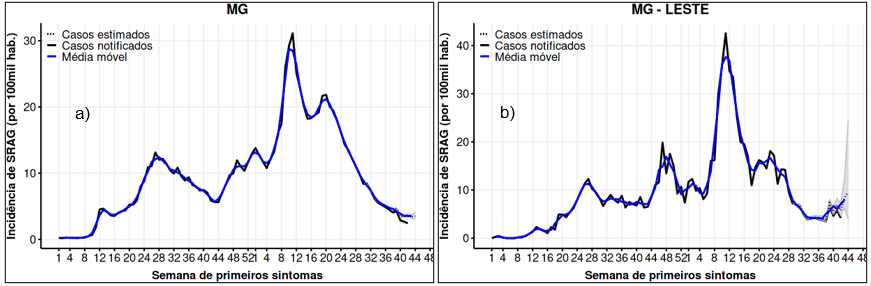
Por outro lado, a região leste apresentou uma taxa de incidência um pouco maior que o restante do estado, atingindo o valor de 20 casos por 100 mil habitantes ao final do ano de 2020, enquanto no estado de MG esse valor foi atingido apenas no segundo mês de 2021.
Dentre os principais municípios da macrorregião de saúde leste de Minas Gerias, Aimorés, Resplendor e Governador Valadares, são apresentados na Tabela 1 a distribuição de casos e óbitos confirmados de COVID-19, e o total de vacinas aplicadas na população nos anos de 2020 e 2021, segundo a Secretaria Estadual de Saúde de Minas Gerais. De acordo com os dados, é possível ver que apesar do número maior de casos totais ter sido maior em Aimorés, quando comparado com Resplendor, se for levado em consideração o número de casos por mil habitantes temos que em Aimorés esse número foi de 131,6 casos/1000 hab, com 3,5 mortes/1000 hab, e em Resplendor houve 175,2 casos/1000 hab, com 3,9 mortes/1000 hab. Portanto, o impacto da COVID-19 foi mais danoso no município de Resplendor, quando comparado com Aimorés.
Tabela 1: Distribuição de casos e óbitos confirmados da COVID-19 e total de vacinas aplicadas segundo local de residência, macrorregião Leste do Vale do Rio Doce, Minas Gerais, 2020-2021
| Localidade | Casos | Óbitos | Total vacinas aplicadas |
| Aimorés | 3.309 | 88 | 52.464 |
| Resplendor | 3.047 | 68 | 32.758 |
| Governador Valadares | 45.117 | 1.469 | 528.093 |
(Fonte: Secretaria Estadual de Saúde/SES-MG, 2022).
Já em Governador Valadares, esses números se apresentaram da seguinte forma: 160,5 casos/1000 hab e 5,2 mortes/1000 hab. Então, apesar de apresentar um número menor de casos por mil habitantes, quando comparado com Resplendor, Governador Valadares teve um número bem mais expressivo de mortes a cada mil habitantes. Isso pode ser devido ao deslocamento de casos mais graves de municípios vizinhos em direção a Governador Valares, o que culmina, mais provavelmente, em um maior número de mortes.
5. CONSIDERAÇÕES FINAIS
O presente artigo visou responder: qual a realidade epidemiológica dos casos de Síndrome Respiratória Aguda Grave (SARS) na macrorregião de saúde leste de Minas Gerais? Sendo possível constatar, através dos resultados, que as taxas de incidência de SARS foram mais elevadas na região de saúde leste do estado de Minas Gerais quando comparadas com o estado, no período entre 2020 e 2021. Essa distribuição espacial heterogênea pode estar associada a fatores socioeconômicos, históricos e culturais que necessitam de maior atenção dos gestores de saúde pública da região, e que devem ser levados em conta para o planejamento de ações de controle e erradicação da doença. Algumas ações são indicadas como prioritárias para diminuir efetivamente a incidência de uma infecção ou agravo em saúde: desenvolvimento de estratégias para detecção oportuna; comprometimento das equipes de saúde na busca ativa de casos; rastreio e exames de contatos e educação em saúde a nível de comunidade.
A COVID-19 teve um impacto sem precedentes nos sistemas de saúde em todo o mundo. Esta doença continuará a ser uma ameaça à saúde pública global com o surgimento de variantes potencialmente resistentes ao tratamento, até que a maior parte da população mundial esteja vacinada adequadamente contra a infecção. A prevenção e o gerenciamento dessa doença viral respiratória altamente transmissível exigem uma abordagem holística e interprofissional que inclui a experiência dos médicos em todas as especialidades, enfermeiras, farmacêuticos, especialistas em saúde pública e autoridades governamentais.
REFERÊNCIAS
AHMAD, Farida B.; CISEWSKI, Jodi A.; ANDERSON, Robert N. Provisional Mortality Data – United States, 2021. MMWR Morb Mortal Wkly Rep. 2022, Hyattsville, MD: US Department of Health and Human Services, CDC, National Center for Health Statistics, 71, n. 17, 597-600, 2022. Disponível em: https://www.cdc.gov/mmwr/
volumes/71/wr/pdfs/mm7117e1-H.pdf. Acesso em 30/03/2022.
ANDERSEN, Kristian G. Et al. The proximal origin of SARS-CoV-2, Nat Med., New York, NY: Nature, 26, 450-452, 2020. Disponível em: <https://www.nature.com/articles/s41591-020-0820-9.pdf>. Acesso em 10/03/2022.
BIRYUKOV, Jennifer. Et al. SARS-CoV-2 is rapidly inactivated at high temperature. Environ Chem Lett, 19, 2, 1773–1777, 2021. Disponível em: <https://doi.org/10.1007%2Fs10311-021-01187-x>. Acesso em 30/03/2022.
CHAN, Jasper Fuk-Woo. Et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerg Microbes Infect, 9, 1, 221-236, 2020. Disponível em: <https://doi.org/10.1080/22221751.2020.1719902>. Acesso em 11/03/2022.
CHAN, Jasper Fuk-Woo. Et al. Interspecies transmission and emergence of novel viruses: lessons from bats and birds. Trends Microbiol, 21, 10, 544-555, 2013. Disponível em: <https://doi.org/10.1016/j.tim.2013.05.005>. Acesso em 10/03/2022.
CIOTTI, Marco. Et al. The COVID-19 pandemic. Critical Reviews in Clinical Laboratory Sciences, 57, 6, 365-388, 2020. Disponível em: <https://doi.org/10.1080/10408363.2020.1783198>. Acesso em 13/02/2022.
COOPERSMITH, Craig M. Et al. The Surviving Sepsis Campaign: Research Priorities for Coronavirus Disease 2019 in Critical Illness. Crit Care Med, 49, 4, 598-622, 2021. Disponível em: <https://journals.lww.com/ccmjournal/Fulltext/2021/04000/The_Surviving_Sepsis_Campaign__Research_Priorities.5.aspx>. Acesso em 12/03/2022.
COVID-ICU Group on behalf of the REVA Network and the COVID-ICU Investigators. Clinical characteristics and day-90 outcomes of 4244 critically ill adults with COVID-19: a prospective cohort study. Intensive Care Med, 47, 1, 60-73, 2021. Disponível em: <https://link.springer.com/content/pdf/10.1007/s00134-020-06294-x.pdf>. Acesso em 10/03/2022.
DAVIES, Nicholas G. Et al. Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. Science, 372, eabg3055, 2021a. Disponível em: <https://doi.org/10.1126/science.abg3055>. Acesso em 30/03/2022.
DAVIES, Nicholas G. Et al. Association of tiered restrictions and a second lockdown with COVID-19 deaths and hospital admissions in England: a modelling study. Lancet Infect Dis, 21, 482-492, 2021b. Disponível em: <https://doi.org/10.1016%2FS1473-3099(20)30984-1>. Acesso em 30/03/2022.
DONG, Ensheng; DU, Hongru; GARDNER, Lauren. An interactive web-based dashboard to track COVID-19 in real time. Lancet Inf Dis, 20, 533-534, 2020. Disponível em: <https://doi.org/10.1016/s1473-3099(20)30120-1>. Acesso em 13/02/2022.
FARIA, Nuno R. Et al. Genomics and epidemiology of the P.1 SARS-CoV-2 lineage in Manaus, Brazil. Science, 372, 6544, 815-821, 2021. Disponível em: <https://doi.org/10.1126/science.abh2644>. Acesso em 10/03/2022.
FIOCRUZ. Monitoramento de casos de síndrome respiratória aguda grave (SRAG) notificados no SIVEP-Gripe. Disponível em: <http://info.gripe.fiocruz.br>, Acesso em: 20/09/2021.
GALLOWAY, Summer E. Et al. Emergence of SARS-CoV-2 B.1.1.7 Lineage – United States, December 29, 2020-January 12, 2021. MMWR Morb Mortal Wkly Rep,70, 3, 95-99, 2021. Disponível em: <http://dx.doi.org/10.15585/mmwr.mm7003e2>. Acesso em 13/03/2022.
GRINT, Daniel J. Et al. Case fatality risk of the SARS-CoV-2 variant of concern B.1.1.7 in England, 16 November to 5 February. Euro Surveill, 26, 11, 2100256 Euro Surveill. 2021. Disponível em: <https://doi.org/10.2807%2F1560-7917.ES.2021.26.11.2100256>. Acesso em 08/03/2022.
GUO, Zhen-Dong. Et al. Aerosol and Surface Distribution of Severe Acute Respiratory Syndrome Coronavirus 2 in Hospital Wards, Wuhan, China, 2020. Emerg Infect Dis, 26, 7, 1583-1591, 2020. Disponível em: <https://doi.org/10.3201/eid2607.200885>. Acesso em: 22/10/2021.
KAUFMAN, Martin; LEIGH, Daniel. Como a pandemia ampliou os saldos globais em conta corrente. International Monetary Fund, 2021. Disponível em: <https://www. imf.org/pt/News/Articles/2021/08/02/blog-how-the-pandemic-widened-global-current-accoun t-balances>. Acesso em: 20/03/2022.
KORBER, Bette. Et al. Tracking Changes in SARS-CoV-2 Spike: Evidence that D614G Increases Infectivity of the COVID-19 Virus. Cell, 182, 4, 812-827, 2020. Disponível em: <https://doi.org/10.1016/j.cell.2020.06.043>. Acesso em: 22/10/2021.
KOTLYAR, Alexander M. Et al. Vertical transmission of coronavirus disease 2019: a systematic review and meta-analysis. Am J Obstet Gynecol, 224, 1, 35-53, 2021. Disponível em: <https://doi.org/10.1016/j.ajog.2020.07.049>. Acesso em: 08/03/2022.
LEI, Jian; KUSOV, Yuri; HILGENFELD, Rolf. Nsp3 of coronaviruses: Structures and functions of a large multi-domain protein. Antiviral Res, 149, 58-74, 2018. Disponível em: <https://doi.org/10.1016/j.antiviral.2017.11.001>. Acesso em: 18/10/2021.
ORESHKOVA, Nadia. Et al. SARS-CoV-2 infection in farmed minks, the Netherlands, April and May 2020. Euro Surveill, 25, 23, 2001005, 2020. Disponível em: <https://doi.org/10.2807/1560-7917.ES.2020.25.23.2001005>. Acesso em: 18/02/2022.
SECRETARIA ESTADUAL DE SAÚDE DE MINAS GERAIS. Boletim epidemiológico. Painel COVID-19 MG/Sala de Situação/SubVS/SES/MG. Disponível em: <https://coronavirus.saude.mg.gov.br/boletim>. Acesso em 22/03/2022.
SILVA, Ambrozina de Abreu Pereira. Et al. Eficiência na alocação de recursos públicos destinados à educação, saúde e habitação em municípios mineiros. Contabilidade, Gestão e Governança, Brasília, 15, 1, 96-114, 2012. Disponível em: <http://www.revistacgg.org/index.php/contabil/article/viewFile/389/pdf>. Acesso em 22/03/2022.
TEGALLY, Houriiyah. Et al. Detection of a SARS-CoV-2 variant of concern in South Africa. Nature, 592, 7854, 438-443, 2021. Disponível em: <https://doi.org/10.1038/s41586-021-03402-9>. Acesso em 12/02/2022.
VAN DOREMALEN, Neeltje. Et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. N Engl J Med, 382, 16, 1564-1567, 2020. Disponível em: <https://www.nejm.org/doi/pdf/10.1056/nejmc2004973>. Acesso em 11/03/2022.
VOLZ, Erik. Et al. Assessing transmissibility of SARS-CoV-2 lineage B.1.1.7 in England. Nature, 593, 7858, 266-269, 2021. Disponível em: <https://doi.org/10.1038/s41586-021-03470-x>. Acesso em 27/03/2022.
WALENSKY, Rochelle P.; WALKE, Henry T.; FAUCI, Anthony S. SARS-CoV-2 Variants of Concern in the United States-Challenges and Opportunities. JAMA, 325, 11, 1037-1038, 2021. Disponível em: <http://jamanetwork.com/article.aspx?doi=10.1001/jama.2021.2294>. Acesso em 11/03/2022.
WANG, Pengfei. Et al. Increased Resistance of SARS-CoV-2 Variant P.1 to Antibody Neutralization. bioRxiv. 2021. Disponível em: <http://dx.doi.org/10.1016/j.chom.2021.04.007>. Acesso em 18/03/2022.
WORLD HEALTH ORGANIZATION. COVID-19 weekly epidemiological update. 2021. Disponível em: <https://apps.who.int/iris/handle/10665/339859>. Acesso em 22/03/2022.
YEO, Charleen; KAUSHAL, Sanghvi; YEO, Danson. Enteric involvement of coronaviruses: is faecal-oral transmission of SARS-CoV-2 possible? The Lancelot Gastroenterol Hepatol, 5, 4, 335-337, 2020. Disponível em: <https://doi.org/10.1016/s2468-1253(20)30048-0>. Acesso em 10/03/2022.
ZHANG, Tao; WU, Qunfu; ZHANG, Zhigang. Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak. Curr Biol. 30, 8, 1578, 2020. Disponível em: <https://doi.org/10.1016/j.cub.2020.03.022>. Acesso em: 18/10/2021.
[1] Graduando em enfermagem. ORCID: 0000-0001-9868-409X.
[2] Graduanda em enfermagem. ORCID: 0000-0002-2919-1002.
[3] Orientadora. ORCID: 0000-0002-6808-9756.
Enviado: Maio, 2022.
Aprovado: Junho, 2022.

