ARTÍCULO ORIGINAL
MELO, Fernando Henrique Boaventura de [1], TEIXEIRA, Valéria Wanderley [2], CAMARA, Claudio Augusto Gomes da [3], SOUZA, Catiane Oliveira [4], CRUZ, Glaucilane dos Santos [5], MONTEIRO, Vaneska Barbosa [6], MORAES, Marcilio Martins [7], VIEIRA FILHO, Leucio Duarte [8], MALERBO-SOUZA, Darclet Teresinha [9], SOARES, Anísio Francisco [10], TEIXEIRA, Álvaro Aguiar Coelho [11]
MELO, Fernando Henrique Boaventura de et al. Inmunotoxicidad comparativa de abejas, Apis mellifera (Hymenoptera: Apidae), expuestas a xenobióticos naturales y sintéticos. Revista Científica Multidisciplinar Núcleo do Conhecimento. Año 09, Ed. 02, Vol. 02, pp. 43-65. Febrero de 2024. ISSN: 2448-0959, Enlace de acceso: https://www.nucleodoconhecimento.com.br/biologia-es/inmunotoxicidad-comparativa, DOI: 10.32749/nucleodoconhecimento.com.br/biologia-es/inmunotoxicidad-comparativa
RESUMEN
El objetivo de este estudio fue comparar los efectos de los pesticidas químicos naturales y sintéticos, examinando la supuesta selectividad de estos compuestos naturales sobre las abejas Apis mellifera. Los valores de LC50 utilizados en los bioensayos se obtuvieron de la investigación de Souza et al. (2023) y son los siguientes: Karate® (13,4 µL/100 mL), compuesto de limoneno (1.440 µL/100 mL) y Roundup® (712.290 µL/100 mL). Sin embargo, según informaron estos autores, se utilizó una concentración de 250 µL/100 mL para Azamax®. Estos valores de LC50, junto con una concentración de 250 µL/100 mL de Azamax®, se emplearon en los análisis inmunohistoquímicos utilizando el método TUNEL y PCNA en el intestino medio de las abejas. También se realizaron evaluaciones inmunológicas (óxido nítrico, fenoloxidasa y marcadores de estrés oxidativo TBARS y GSH) en abejas adultas obreras. Los tratamientos con xenobióticos no revelaron apoptosis o proliferación celular. Sin embargo, observamos degeneración epitelial, marcada por la presencia de células vacuoladas, lo que sugiere un proceso necrótico. Excepto por el compuesto de limoneno, todas las sustancias indujeron estrés oxidativo, lo que llevó a niveles elevados de TBARS. Aunque no hubo diferencias en los niveles de GSH, observamos alteraciones en el sistema inmunológico de estos insectos, caracterizadas por un aumento de la actividad de la fenoloxidasa y los niveles de NO2. Basándonos en los resultados obtenidos, es posible concluir que se debe tener precaución al utilizar pesticidas químicos en la agricultura, ya sean de origen sintético o natural, ya que tienen el potencial de causar daños histopatológicos e inmunológicos irreversibles. Este estudio también subraya la importancia de realizar investigaciones más exhaustivas sobre el impacto de los productos naturales en la fisiología de los insectos polinizadores.
Palabras clave: Apis mellifera, Xenobióticos, Inmunohistoquímica, Estrés oxidativo, Fenoloxidasa.
1. INTRODUCCIÓN
Las abejas melíferas, Apis mellifera Linnaeus (Hymenoptera: Apidae), desempeñan un papel prominente en los ecosistemas debido a su participación en la polinización, un papel que desempeñan tanto de forma espontánea en entornos naturales como en entornos antropomorfizados. Facilitan la transferencia de partículas celulares reproductivas, contribuyendo así a la diversidad genética tanto de especies vegetales silvestres como cultivadas (Klein, et al. 2007; Michener, 2007; Potts, et al. 2016; Eardley, et al. 2016). Como artrópodos de gran importancia, las abejas melíferas contribuyen intrínsecamente a la supervivencia de numerosos organismos en la Tierra (Potts et al., 2016; Eardley et al., 2016). A pesar de su importancia ambiental y económica (Giannini et al., 2015), en los últimos años se ha producido un declive en las poblaciones de abejas y una reducción en la diversidad de especies en todos los continentes (Zattara & Aizen, 2021).
Los pesticidas agrícolas afectan a las poblaciones de abejas melíferas de varias maneras y se identifican como una de las causas multifactoriales que contribuyen al fenómeno conocido como Trastorno del Colapso de las Colonias (CCD), que afecta a las abejas sociales del género Apis y a las especies nativas (Graystock et al., 2013; Goulson et al., 2015). Los insecticidas neurotóxicos, como los neonicotinoides y piretroides, por ejemplo, no solo son letales, sino que también son capaces de inducir cambios en el comportamiento de las abejas obreras (Decourtye et al., 2005; Gill & Raine, 2014). Además, se ha descubierto que el herbicida ampliamente utilizado glifosato reduce las habilidades de aprendizaje de las abejas (Herbert et al., 2014).
Desde una perspectiva inmunológica, Gregorc & Ellis (2011) realizaron pruebas en larvas de A. mellifera utilizando pesticidas químicos: organofosfato, neonicotinoide y el herbicida glifosato. Observaron un aumento de la apoptosis en el intestino medio, con porcentajes respectivos del 61%, 65% y 69% de muerte celular en las larvas tratadas en comparación con el 10% en el grupo de control. Esto demuestra que los pesticidas ejercen un efecto a nivel celular. La apoptosis es el proceso de muerte celular programada que ocurre naturalmente en los organismos para mantener la homeostasis celular y servir como un mecanismo de defensa (Ashe & Berry, 2003). Sin embargo, dependiendo de la capacidad de un individuo, puede recuperarse a través del proceso de proliferación celular (Caccia et al., 2019).
El estrés oxidativo tiene el potencial de iniciar el proceso de muerte celular y ocurre debido al equilibrio entre las especies reactivas de oxígeno o nitrógeno (ROS y RNS) y los compuestos antioxidantes (Maulik et al., 1998; Barbosa et al., 2010). ROS y RNS son radicales libres que, cuando están en equilibrio, desempeñan funciones importantes en el sistema inmunológico de los insectos. Un ejemplo de esto es el óxido nítrico, que participa en procesos de señalización de la presencia de entomopatógenos y xenobióticos, y forma parte de los mecanismos de defensa humoral de estos artrópodos (Bartling et al., 2021). La fenoloxidasa es otro componente de esta defensa, ya que esta enzima participa en la formación de melanina, que está involucrada en la esclerotización de la cutícula, la cicatrización de heridas y el reconocimiento de agentes extraños (Negreiro et al., 2004).
En este contexto, en las últimas dos décadas, la investigación sobre biopesticidas botánicos ha aumentado significativamente debido a varias ventajas que ofrecen, incluida una mayor selectividad hacia los organismos no objetivo (Isman, 2006; Isman, 2020). Sin embargo, a pesar del extenso cuerpo de investigación, se ha prestado poca atención a los efectos de estos insecticidas naturales en la fisiología de los insectos (Isman, 2020; Giannini et al., 2015). Esto es motivo de preocupación, ya que los estudios han revelado que los aceites esenciales y sus compuestos aislados tienen el potencial de afectar la historia de vida de los insectos, afectando tanto a las plagas como a los enemigos naturales y provocando cambios histopatológicos (Almehmadi, 2011; Oliveira et al., 2021), nutricionales (Cruz et al., 2017; Oliveira et al., 2021) y inmunológicos (Silva et al., 2020).
Por lo tanto, son necesarias pruebas fisiológicas para garantizar la seguridad de estas sustancias en las abejas en los campos agrícolas. Las abejas obreras pueden contaminarse potencialmente, y en consecuencia toda la colonia, ya sea durante la recolección o a través de residuos en el agua en el caso de los pesticidas químicos sintéticos (Mullin et al., 2010; Potts et al., 2010; Ruiz-Toledo & Sánchez-Guillén, 2014).
Dado el contexto proporcionado, esta investigación tuvo como objetivo comparar las respuestas inmunológicas de las abejas A. mellifera cuando están expuestas a xenobióticos sintéticos (insecticida piretroide – Karate® y herbicida glifosato – Roundup®) y xenobióticos naturales (biopesticida – Azamax® y compuesto de limoneno) comúnmente utilizados en la agricultura.
2. MATERIAL Y MÉTODOS
2.1 OBTENCIÓN DE INSECTOS
Las abejas melíferas utilizadas en esta investigación fueron obtenidas del apiario experimental del Departamento de Ciencia Animal de la Universidad Rural Federal de Pernambuco (UFRPE). Las abejas obreras fueron recolectadas utilizando recipientes plásticos con tapas perforadas colocadas en las entradas de las colmenas. Posteriormente, los insectos fueron transportados al Laboratorio de Fisiología de Insectos (LAFI) y al Laboratorio de Estudios Morfológicos en Vertebrados e Invertebrados (LABEMOVI), ambos en la UFRPE, donde fueron utilizados en los bioensayos.
2.2 CONCENTRACIONES UTILIZADAS EN LOS BIOENSAYOS
Las Concentraciones Letales 50 (LC50) utilizadas para las evaluaciones inmunohistoquímicas e inmunológicas de la población de abejas A. mellifera del apiario de la UFRPE fueron obtenidas de Souza et al. (2023). Ellos reportaron los valores de LC50 de la siguiente manera: 13.4 µL/100 mL para el insecticida Karate® (pesticida + solución de miel 1:1 + 1% de dimetilsulfóxido (DMSO)), 1,440 µL/100 mL para el compuesto de Limoneno (solución de miel + DMSO), y 712,290 µL/100 mL para el herbicida Roundup® (miel + agua + DMSO). En cuanto al insecticida botánico Azamax®, se utilizó una concentración de 250 µL/100 mL de la solución (miel + DMSO). Según lo demostrado por Souza et al. (2023), esta concentración representó el nivel más alto del producto que resultó en mortalidad sin repeler a los insectos; concentraciones más altas repelieron al 100% de los individuos muestreados, lo que hizo imposible determinar la LC50 para Azamax®. El grupo de control fue tratado únicamente con la solución de miel (1:1) + 1% de DMSO. Después de 24 horas de exposición a los tratamientos, las abejas sobrevivientes fueron utilizadas en las pruebas posteriores.
2.3 APOPTOSIS EN EL INTESTINO MEDIO DE APIS MELLIFERA
Para el análisis inmunohistoquímico, incluida la apoptosis y la proliferación celular, los intestinos medios se incluyeron en parafina, y se obtuvieron secciones de 5 µm de grosor utilizando un microtomo Minot (Leica, 2035). Estas secciones se colocaron en un baño de agua y se recogieron en portaobjetos silanizados. Las imágenes se capturaron y digitalizaron utilizando el software Leica LAS Image (Junqueira y Junqueira, 1983; Solomon, 2009). Para detectar la apoptosis mediante la fragmentación del ADN, los portaobjetos silanizados que contenían secciones de intestino medio se sometieron a la prueba TUNEL (Transferasa Terminal de Desoxinucleótidos de Timidina) Costa (2022); Gavrieli (1992), siguiendo el protocolo del kit Apoptag Plus (Merck®). Los cortes se desparafinaron e hidrataron inicialmente, seguidos de una incubación de 5 minutos en PBS (Solución Salina Tamponada con Fosfato) a temperatura ambiente. Luego se aplicó proteína quinasa K a los portaobjetos durante 15 minutos. Después de lavar con agua destilada, los portaobjetos se incubaron en peróxido de hidrógeno durante 5 minutos a temperatura ambiente. Las secciones se lavaron en PBS e incubaron en un buffer de equilibración durante 60 minutos a 4°C. Posteriormente, las secciones se incubaron en TdT a 37°C durante 1 hora en una cámara húmeda. Se aplicó la solución de detención durante 10 minutos a temperatura ambiente, seguida de un lavado en PBS e incubación en anti-digoxigenina. Los portaobjetos se enjuagaron en PBS, y las secciones se desarrollaron con sustrato cromogénico de diaminobencidina (DAB, DakoCytomationTM) durante aproximadamente 20 minutos. Luego se tiñeron de nuevo con hematoxilina durante 20 a 30 segundos. Después de esto, los portaobjetos se lavaron con agua corriente, se deshidrataron en concentraciones crecientes de alcohol y se colocaron en xileno para montaje y observación bajo un microscopio óptico.
2.4 PROLIFERACIÓN CELULAR DEL INTESTINO MEDIO
Para evaluar la proliferación celular, se eliminó la parafina de las secciones, que luego se hidrataron y se sometieron a recuperación de antígenos utilizando un tampón de citrato (pH=6) en un baño de agua durante 20 minutos a 100°C. Después de permitirles reposar durante 20 minutos a temperatura ambiente, se aplicó una solución de peróxido de hidrógeno al 3% durante 30 minutos. A continuación, las secciones se enjuagaron en tampón Tris (Tris-(hidroximetil)-aminometano) y se expusieron al anticuerpo PCNA (antígeno nuclear de proliferación celular) (Spring) diluido 1:100 durante 1 hora a temperatura ambiente. Las secciones se enjuagaron nuevamente en tampón Tris y se incubaron con histofina durante 30 minutos. Posteriormente, se sometieron al cromógeno diaminobencidina (DAB, DakoCytomation™) y se contratiñeron con hematoxilina. El índice apoptótico y la proliferación celular se determinaron en función del porcentaje de células positivas, calculado a partir del recuento de al menos 500 núcleos por tratamiento, subdivididos en 10 campos seleccionados al azar utilizando el objetivo de 40x (Losa et al., 2000; Wu et al., 2013).
2.5 PREPARACIÓN DEL MACERADO
Se maceró una abeja adulta en 500 µL de buffer fosfato (0,1 mM, pH 7,4) dentro de un crisol utilizando un mortero de porcelana. El macerado resultante se transfirió a un tubo de centrífuga de 2 mL y se centrifugó durante 1 minuto a 1000 rpm para eliminar cualquier fragmento del exoesqueleto de los insectos. El sobrenadante se transfirió posteriormente a otro tubo de 2 mL y se mantuvo refrigerado a -20°C hasta el análisis. Cada abeja individual se trató como una repetición, y cada tratamiento consistió en 10 repeticiones realizadas dentro de las 24 horas posteriores a la aplicación.
2.6 MEDICIÓN DEL ÓXIDO NÍTRICO
Se empleó el reactivo de Griess Green et al. (1981) para evaluar la concentración del ion nitrito (NO2). En una alícuota de 50 μL del macerado, se añadieron 70 μL de sulfanilamida al 1% en ácido fosfórico al 5% (H3PO4). Tras la incubación, se agregaron 50 μL adicionales de NEED (naphthylethyleneamine dihydrochloride) al 0,1% a los 50 μL de la muestra (macerado/sulfanilamida) en una placa de microtitulación (Faraldo et al., 2005). La lectura de absorbancia se realizó a 562 nm utilizando el lector de microplacas Biochrom Anthos 2010 (São Paulo, Brasil), con el programa ADAP funcionando en modo de punto final. Los datos se sometieron a un ANOVA y las medias se compararon utilizando la prueba de Tukey HSD, con análisis realizado utilizando el software de SAS Institute.
2.7 ACTIVIDAD DE LA FENOLOXIDASA
El análisis para cada tratamiento se realizó utilizando 10 μL del macerado, con cada tratamiento consistiendo en diez réplicas. Duplicados de 50 µL de esta mezcla se transfirieron a la microplaca. Posteriormente, se añadieron 50 microlitros de L-DOPA (L-dihidroxifenilalanina) a una concentración de 4 g/L (Sigma-Aldrich, St. Louis, MO, EE. UU.) a cada pocillo para activar la enzima. Las lecturas de absorbancia se realizaron utilizando un lector de microplacas Biochrom Anthos 2010 (São Paulo, Brasil) a 492 nm, con el programa ADAP configurado en modo fotometría cinética. La actividad enzimática se midió durante la fase lineal de la reacción a intervalos de 60 segundos durante 20 minutos, siguiendo el método descrito por (Faraldo et al., 2006). Los datos fueron sometidos a la prueba no paramétrica de Kruskal-Wallis a un nivel de significancia del 5%, utilizando el software SAS Institute.
2.8 ESTRÉS OXIDATIVO
Para evaluar el estrés oxidativo, se evaluó la peroxidación lipídica mediante la medición de sustancias reactivas al ácido tiobarbitúrico (TBARS) siguiendo el método de Ohkawa et al. (1979). Diez insectos adultos de cada tratamiento fueron homogeneizados en un baño de hielo utilizando cloruro de potasio al 1.15% + 3 mM de EDTA. Posteriormente, se preparó el medio de reacción agregando ácido tiobarbitúrico al 0.3%, sulfato de dodecilo sódico al 0.4%, y ácido acético al 7.5% (pH 3.5). La mezcla se calentó a 95°C durante una hora. Después de la centrifugación, se midió la absorbancia del sobrenadante a una longitud de onda de 535 nm. Los datos obtenidos se normalizaron por la concentración de proteína del homogeneizado, medida según Lowry et al. (1951). Estos datos se analizaron utilizando la prueba no paramétrica de Kruskal-Wallis con un nivel de significancia del 5%, utilizando el software SAS Institute. Los niveles de glutatión reducido (GSH) se determinaron mediante la medición de grupos sulfhidrilo no proteicos, siguiendo la metodología de Sedlak y Lindsay (1968). Del homogeneizado obtenido para la evaluación de la peroxidación lipídica, se precipitaron de 80 a 160 mg de tejido en una solución de TCA al 5%. Luego, un volumen del sobrenadante se mezcló con un medio de reacción que contenía TRIS 4 mM, EDTA 4 mM y DTNB 4 mM a pH 8.9. La reacción se incubó a temperatura ambiente durante 5 minutos, y la absorbancia se midió a 412 nm. El resultado se ajustó por la concentración de proteína del homogeneizado. Los datos sobre los niveles de GSH asumieron normalidad y homogeneidad y se analizaron utilizando ANOVA, con medias comparadas utilizando la prueba de Tukey con un nivel de significancia del 5%, según lo determinado por el SAS Institute.
3. RESULTADOS
3.1 APÓPTOSIS EN EL INTESTINO MEDIO DE APIS MELLIFERA
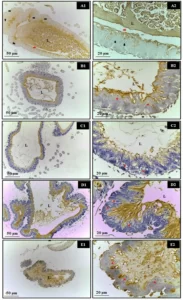
En cuanto a la evaluación inmunohistoquímica del intestino medio de las abejas, no se observaron núcleos apoptóticos después de la exposición a xenobióticos sintéticos (Roundup® y Karate®) y naturales (Azamax® y compuesto de Limoneno) después de 24 horas. Sin embargo, el tejido epitelial mostró degeneración celular caracterizada por la presencia de vacuolas citoplasmáticas, lo que sugiere un proceso necrótico. Se cree que este daño celular pudo haber sido un factor importante que impidió que estas células secretaran la matriz peritrófica, haciéndolas entrar en contacto con el contenido del lumen y, consecuentemente, con las enzimas digestivas (Figura 1).
Figura 1. Evaluación de la apoptosis en el intestino medio de adultos de Apis mellifera, utilizando la prueba Tunel. En la que, A1 y A2- Control, B1 y B2- Azamax®, C1 y C2- Limoneno, D1 y D2- Roundup®, E1 y E2- Karate®, L- Lumen, Flecha negra- núcleos apoptóticos, Flecha roja- matriz peritrófica, Asterisco- Células vacuoladas
3.2 PROLIFERACIÓN CELULAR DEL INTESTINO MEDIO
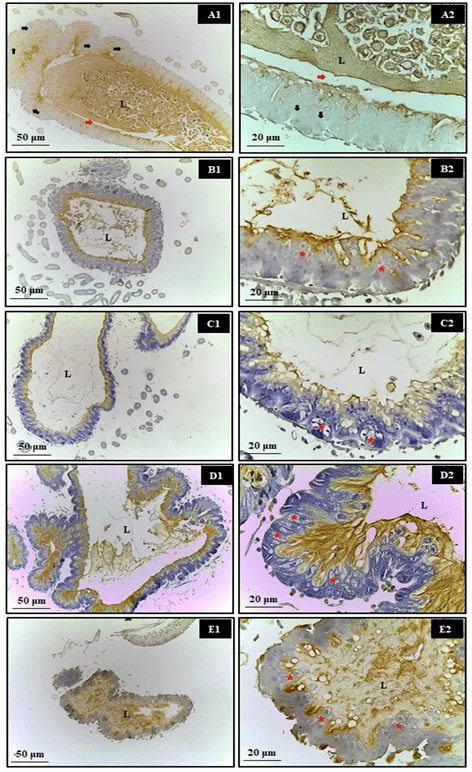
Las células epiteliales no demostraron activación de mecanismos de regeneración mediante el proceso de proliferación celular en abejas expuestas a xenobióticos (Figura 2), con PCNA positivo identificado solo en el grupo de control (Figura 2A). Las células epiteliales no mostraron signos de activación de mecanismos de regeneración a través del proceso de proliferación celular en abejas expuestas a xenobióticos (Figura 2). La tinción positiva de PCNA solo se observó en el grupo de control (Figura 2A).
Figura 2. Análisis de la proliferación celular (PCNA). Sección transversal del intestino medio de abejas adultas, Apis mellifera. A- Control, B- Azamax®, C- Limoneno, D- Roundup®, E- Karate®, L- Lumen, asterisco- células regenerativas

3.3 MEDICIÓN DE ÓXIDO NÍTRICO
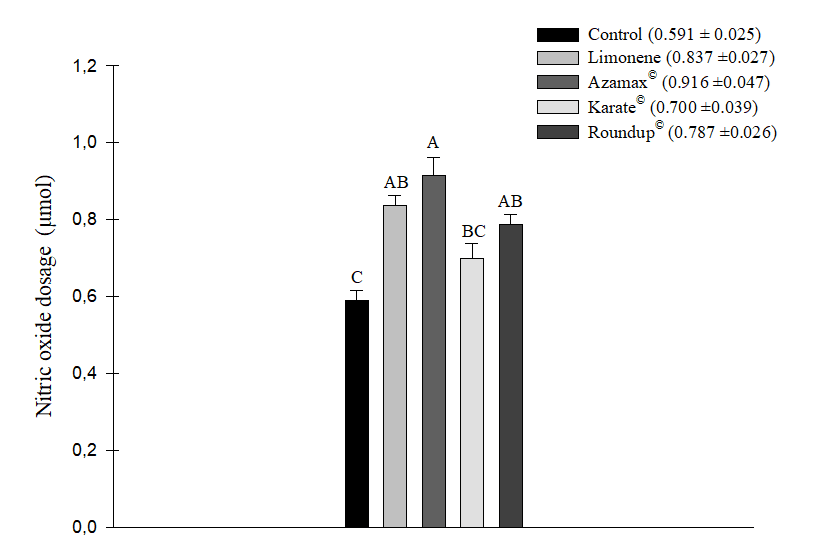
Después del análisis estadístico, se observó que todos los productos químicos utilizados, a saber, Karate® (0,700 ± 0,039 µM de NO2), Limoneno (0,837 ± 0,027 µM de NO2), Azamax® (0,916 ± 0,047 µM de NO2) y Roundup® (0,787 ± 0,026 µM de NO2), aumentaron los niveles de óxido nítrico en las abejas. Sin embargo, el aumento más significativo se observó en el tratamiento con Azamax®. El Limoneno no mostró una diferencia estadísticamente significativa en comparación con Azamax® y Roundup®. Aunque las abejas alimentadas con la solución de miel+Karate® mostraron una respuesta similar al control (0,591 ± 0,025 µM de NO2), no difirió significativamente de los tratamientos con Roundup® y Limoneno, lo que resultó en un aumento en los niveles de NO2 en las muestras (Figura 3).
Figura 3. Media (+SE) de la dosificación de los niveles de óxido nítrico (μM de NO2) en las abejas Apis mellifera sometidas a la CL50 del compuesto Limoneno, al insecticida Karate®, al herbicida Roundup®, y a una concentración de 250 µL/100 mL de Azamax®. Las columnas con la misma letra no difieren según la prueba de Tukey HSD al 5% de probabilidad
3.4 ACTIVIDAD DE FENOL OXIDASA
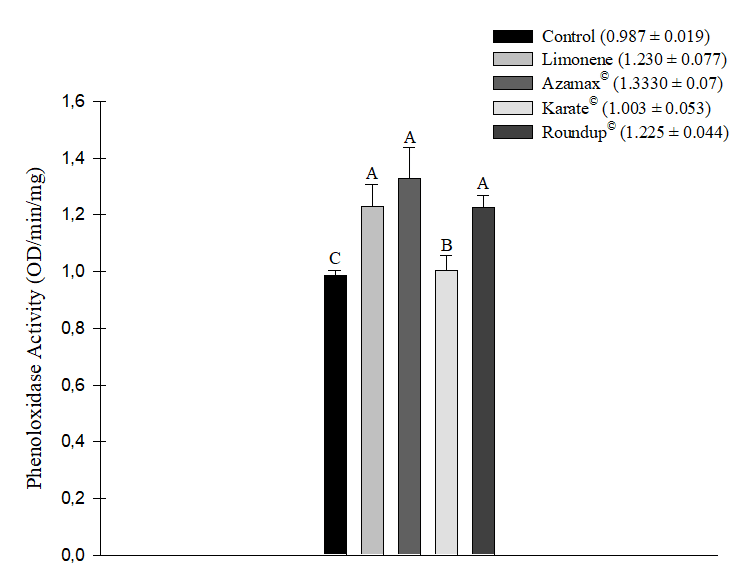
Todos los xenobióticos evaluados provocaron un aumento en la actividad enzimática de la fenoloxidasa después de 24 horas de exposición. Los aumentos más significativos se observaron en los tratamientos con el biopesticida Azamax® (1,333 ± 0,107 OD/min/mg), seguido del compuesto Limoneno (1,230 ± 0,077 OD/min/mg) y el herbicida Roundup® (1,225 ± 0,044 OD/min/mg), que no difirieron significativamente entre sí. Una vez más, el insecticida Karate® (1,003 ± 0,053 OD/min/mg) no mostró una diferencia estadísticamente significativa respecto al grupo de control (0,987 ± 0,019 OD/min/mg) (Figura 4).
Figura 4. Actividad enzimática de la fenoloxidasa (OD/min/mg) en abejas Apis mellifera sometidas a la CL50 del compuesto Limoneno, al insecticida Karate®, al herbicida Roundup®, y a una concentración de 250 µL/100 mL de Azamax®. Las columnas con la misma letra no difieren según la prueba no paramétrica de Kruskal-Wallis al 5% de probabilidad
3.5 ESTRÉS OXIDATIVO
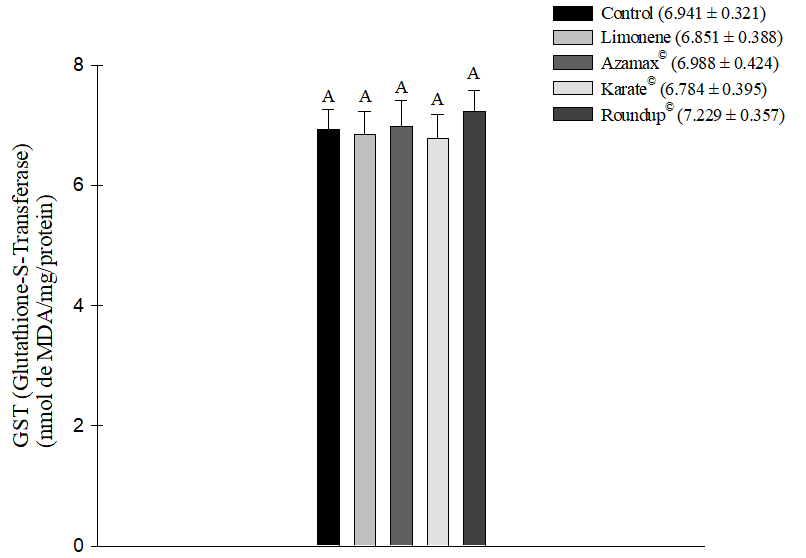
Todos los agentes químicos probados, excepto el Limoneno, demostraron la capacidad de inducir un aumento en el estrés oxidativo medido por TBARS, lo que indica peroxidación lipídica celular en las muestras de abejas evaluadas. El herbicida Roundup® (1,838 ± 0,205 nmol de MDA/mg/proteína) fue particularmente notable, siendo el producto que indujo el estrés oxidativo más significativo en las células, seguido por Azamax® (1,280 ± 0,070 nmol de MDA/mg/proteína) y Karate® (1,214 ± 0,055 nmol de MDA/mg/proteína). En contraste, el compuesto Limoneno (0,914 ± 0,096 nmol de MDA/mg/proteína) no mostró una diferencia estadísticamente significativa en comparación con el grupo de control (0,782 ± 0,109 nmol de MDA/mg/proteína). En consecuencia, esta sustancia no promovió este tipo de estrés después de 24 horas de exposición (Figura 5). Además, durante este mismo período de evaluación, no hubo diferencias en los niveles de medición de la Glutatión-S-Transferasa (GSH) (Figura 6).
Figura 5. Estrés oxidativo a partir de la medición del ácido tiobarbitúrico (TBARS) como indicador de peroxidación lipídica (nmol de MDA/mg/proteína) en Apis mellifera sometida a la CL50 del compuesto Limoneno, al insecticida Karate®, al herbicida Roundup®, y a una concentración de 250 µL/100 mL de Azamax®. Las columnas con la misma letra no difieren según la prueba no paramétrica de Kruskal-Wallis al 5% de probabilidad
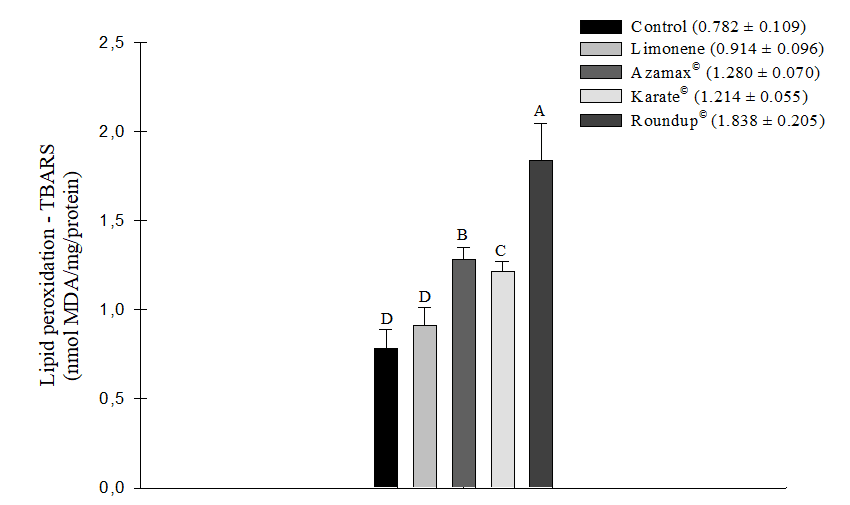
Figura 6. Estrés oxidativo a partir de la medición de la Glutatión-S-Transferasa (GSH) en Apis mellifera sometida a la CL50 del compuesto Limoneno, al insecticida Karate®, al herbicida Roundup®, y a una concentración de 250 µL/100 mL de Azamax®. Las columnas con la misma letra no difieren según la prueba de Tukey al 5% de probabilidad, para los datos de GSH
4. DISCUSIÓN
Los cambios histopatológicos e inmunológicos observados en las abejas tratadas sugieren que las sustancias probadas fueron altamente perjudiciales para estos organismos y no les permitieron tiempo suficiente para activar los mecanismos de regeneración (Illa-Bochaca & Montuenga, 2006; Caccia et al., 2019). Considerando que, en general, los productos naturales son considerados selectivos, este hallazgo es significativo. Los compuestos naturales son evaluados principalmente por su toxicidad aguda para los insectos benéficos (Sabahi et al., 2022; Cappa et al., 2022). Sin embargo, hay información limitada sobre cómo estos compuestos afectan a las abejas a nivel celular, lo que tiene graves implicaciones para su fisiología y salud.
Braga et al. (2020) también identificaron la ausencia de apoptosis en el intestino medio de ninfas de quinto instar del chinche depredador Podisus nigrispinus (Dallas), que habían sido alimentadas con larvas de Alabama argillacea (Hübner) tratadas con una Dosis Letal (LD50) de 2,50 y 2,82 mg/g de insecto, respectivamente, de los aceites de Mentha spicata L. y Melaleuca alternifolia Cheel. Sin embargo, en las ninfas tratadas con M. alternifolia, se observaron cambios histopatológicos como elongación de células columnares y lisis celular, similares a los síntomas de necrosis. La necrosis se caracteriza por la dilatación del citoplasma, mitocondrias y retículo endoplásmico, lo que conduce a la ruptura celular y, consecuentemente, a la extravasación del contenido celular (Sun et al., 2021). Ambos aceites consisten únicamente en terpenos, una clase química a la que pertenecen el Limoneno y la azadiractina. Por lo tanto, la necrosis del tejido epitelial puede ser un mecanismo de acción de estos compuestos sobre los insectos.
A diferencia de las otras sustancias analizadas, el Limoneno no tiene la molécula de oxígeno en su composición, que es capaz de desencadenar radicales libres dañinos para el cuerpo, lo que hace que el individuo sea susceptible al estrés oxidativo (Kumar et al., 2022). Además, ya hay un informe de que los monoterpenos pueden tener propiedades antioxidantes (Yu et al., 2017). Por lo tanto, no se esperaba que el estrés oxidativo fuera una de las formas en que el Limoneno actúa sobre la fisiología de las abejas.
El modo de acción del Limoneno está asociado con la inhibición neuromuscular de la acetilcolinesterasa (AChE), lo que lleva a la acumulación de AChE, lo que genera excitación neuronal y la muerte del insecto (García et al., 2005; Zarrad et al., 2017; Gadelhaq et al., 2023). Además, en A. mellifera, se observaron efectos en las células intestinales, resultantes de las lesiones necróticas observadas en el epitelio.
El estrés oxidativo observado en los otros tratamientos indica la ocurrencia de peroxidación lipídica en las abejas, que, como consecuencia, conduce a alteraciones en las funciones fundamentales de la membrana celular (Barbosa et al., 2010). Estudios han relacionado el proceso apoptótico como una de las respuestas celulares a este estrés (Li & Wogan, 2005; Kim & Lee, 2020). Sin embargo, también puede ser la causa de desencadenar necrosis epitelial en la población de A. mellifera evaluada, siendo este efecto más pronunciado en las muestras tratadas con glifosato.
De hecho, estudios sobre este herbicida han mostrado su impacto en la supervivencia y salud de varias especies de abejas, ya sea larvas o adultos, expuestos de forma aguda o crónica. Esta exposición conduce a cambios en sistemas moleculares, celulares, histológicos y biológicos (Battisti et al., 2023). Un aspecto importante reportado por Liao et al. (2017) es que se encontró que una solución que contiene agua, azúcar y glifosato (10 ppb) era más atractiva para las abejas en comparación con una solución sin el herbicida. Esto plantea preocupaciones sobre la contaminación potencial de estos organismos a través del néctar en su entorno natural.
El intestino medio constituye una de las primeras barreras de defensa de los insectos contra organismos patógenos y xenobióticos (Schmid-Hempel, 2005). El deterioro de esta función se confirma por la activación de la cascada de la fenoloxidasa y las alteraciones en los niveles de NO2, indicando la participación de mecanismos de defensa humoral en las células de las abejas cuando están expuestas a pesticidas sintéticos y naturales.
La baja actividad de la enzima fenoloxidasa y el nivel reducido de NO2 en los ensayos con Karate®, también fue observada por Silva et al. (2020) en chinches de la especie Podisus nigrispinus (Dallas), sometidas a otro piretroide, deltametrina, ambos bajo el tiempo de evaluación de 24 horas. Sin embargo, después de 72 horas de exposición, estos autores encontraron un aumento en la actividad de la fenoloxidasa, simultáneamente con un aumento en los niveles de proteínas totales en P. nigrispinus. Aun así, el análisis de la apoptosis mediante la prueba Tunel, en el caso de la población de abejas muestreada en esta investigación, muestra necrosis celular. Además, el insecticida Karate® y los otros compuestos estudiados aquí causaron daños irreversibles, ya que no pudieron ser acompañados por la reparación celular, lo que conlleva, consecuentemente, a la muerte del organismo (Miller & Zachary, 2017).
Estudios previos también han demostrado la repelencia de la azadiractina, el ingrediente activo en Azamax®, a otras especies de abejas (Zhao et al., 2022) y varios insectos (Ikeura et al., 2013; Andrade et al., 2013). En el caso de A. mellife’ra, se observó el efecto repelente de Azamax® a concentraciones superiores a 250 µL/100 mL. Por lo tanto, existe potencial para que este insecticida se utilice en programas de Manejo Integrado de Plagas (MIP) para preservar la abundancia de estos polinizadores en los agroecosistemas. Esto se debe a que el modo de acción de la azadiractina está asociado con un aumento de la contaminación a través de la ingestión (Martinez & Van Emden, 2001), y en el campo, la probabilidad de contacto con esta sustancia disminuye. Sin embargo, debido a los fuertes efectos deletéreos de Azamax® en los sistemas digestivo e inmunológico de las abejas, es crucial tener cuidado para garantizar que su pulverización no coincida con el tiempo de forrajeo de A. mellifera.
La exposición de esta población de A. mellifera al insecticida natural Azamax® y al Limoneno resultó en respuestas análogas a las inducidas por los pesticidas sintéticos Karate® y Roundup®. Estas respuestas incluyeron la necrosis del tejido epitelial y el deterioro de las funciones de la membrana. A pesar de la supuesta seguridad de Limoneno y Azamax® para los organismos no objetivo, fueron las sustancias que aumentaron más significativamente los niveles de óxido nítrico y la actividad enzimática de la fenoloxidasa en las abejas. Sin embargo, Roundup® fue el tratamiento que causó más estrés oxidativo, y al igual que Karate®, tiene el agravante de dejar residuos en los sustratos de la colmena. Como resultado, las abejas también se ven afectadas por la exposición crónica a productos químicos sintéticos.
5. CONCLUSIÓN
Aunque los insecticidas naturales probados aquí se consideran seguros para organismos no objetivo, esta investigación ha demostrado que se debe tener precaución respecto a su uso en agroecosistemas. Fueron capaces de causar efectos perjudiciales en el sistema inmunológico de las abejas comparables a los pesticidas sintéticos. Por lo tanto, se necesita más investigación para comprender cómo los productos naturales interfieren con la fisiología de las abejas, con el fin de garantizar que los insecticidas botánicos utilizados en la agricultura sean verdaderamente selectivos y una alternativa segura a los pesticidas sintéticos.
AGRADECIMIENTOS
Este trabajo fue apoyado en parte por la FACEPE (Fundação de Amparo à Ciência e Tecnologia do Estado de Pernambuco) bajo el subsidio: R$ 36.000.
CONFLICTO DE INTERESES
No hay conflicto de intereses por parte de los autores.
REFERENCIAS
ALMEHMADI, Roqaiah Mohammad. Larvicidal Histopathological and Ultra-structure Studies of Matrichiaria chamomella Extracts Against the Rift Valley Fever Mosquito Culex quinquefascia tus (Culicidaee: Diptera). Journal of Entomology-Academic Journals Inc., v. 8, n. 1, 2011.
ANDRADE, Lígia Helena de et al. Repellent effect of azadirachtin and essential oils on Aphis gossypii Glover (Hemiptera: Aphididae) in cotton plants. Revista Ciência Agronômica, v. 44, p. 628-634, 2013.
ASHE, Paula C.; BERRY, Mark D. Apoptotic signaling cascades. Progress in Neuro-Psychopharmacology and Biological Psychiatry, v. 27, n. 2, p. 199-214, 2003.
BARBOSA, Kiriaque Barra Ferreira et al. Oxidative stress: concept, implications and modulating factors. Rev Nutr, v. 23, n. 4, p. 629-43, 2010.
BARTLING, Merle T. et al. Exposure to low doses of pesticides induces an immune response and the production of nitric oxide in honeybees. Scientific Reports, v. 11, n. 1, p. 6819, 2021.
BATTISTI, Lucas et al. Review on the sublethal effects of pure and formulated glyphosate on bees: Emphasis on social bees. Journal of Applied Entomology, v. 147, n. 1, p. 1-18, 2023.
BRAGA, Valeska Andrea Ático et al. Effect of essential oils of Mentha spicata L. and Melaleuca alternifolia Cheel on the midgut of Podisus nigrispinus (Dallas)(Hemiptera: Pentatomidae). Acta Histochemica, v. 122, n. 3, p. 151529, 2020.
CACCIA, Silvia; CASARTELLI, Morena; TETTAMANTI, Gianluca. The amazing complexity of insect midgut cells: types, peculiarities, and functions. Cell and Tissue research, v. 377, p. 505-525, 2019.
CAPPA, Federico; BARACCHI, David; CERVO, Rita. Biopesticides and insect pollinators: Detrimental effects, outdated guidelines, and future directions. Science of the Total Environment, v. 837, p. 155714, 2022.
COSTA, Hilton Nobre et al. LAMBDA-CYHALOTHRIN PROMOTES OXIDATIVE STRESS AND PATHOLOGICAL CHANGES IN THE MIDGUT AND GONADS OF COTTON BOLL WEEVIL. International Journal of Biological and Natural Sciences, ISSN 2764-1813 v. 2, n. 2, 2022.
CRUZ, Glaucilane S. et al. Effect of trans-anethole, limonene and your combination in nutritional components and their reflection on reproductive parameters and testicular apoptosis in Spodoptera frugiperda (Lepidoptera: Noctuidae). Chemico-Biological Interactions, v. 263, p. 74-80, 2017.
DECOURTYE, A. et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of environmental contamination and toxicology, v. 48, p. 242-250, 2005.
EARDLEY, C. et al. Background to pollinators, pollination and food production. The Assessment Report on Pollinators, Pollination and Food Production; Ngo, HT, Eds, p. 1-25, 2016.
FARALDO, Ana Carolina et al. Nitric oxide production in blowfly hemolymph after yeast inoculation. Nitric Oxide, v. 13, n. 4, p. 240-246, 2005.
FARALDO, Ana Carolina et al. Prophenoloxidase activity in blowfly hemolymph after yeast inoculation. Resumos, 2006.
GADELHAQ, Sahar M. et al. D‐limonene nanoemulsion: lousicidal activity, stability, and effect on the cuticle of Columbicola columbae. Medical and Veterinary Entomology, v. 37, n. 1, p. 63-75, 2023.
GARCÍA, Matías et al. Toxic and repellent effects of Baccharis salicifolia essential oil on Tribolium castaneum. Pest Management Science: formerly Pesticide Science, v. 61, n. 6, p. 612-618, 2005.
GAVRIELI, Yael; SHERMAN, Yoav; BEN-SASSON, Shmuel A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. The Journal of cell biology, v. 119, n. 3, p. 493-501, 1992.
GIANNINI, Tereza C. et al. The dependence of crops for pollinators and the economic value of pollination in Brazil. Journal of economic entomology, v. 108, n. 3, p. 849-857, 2015.
GILL, Richard J.; RAINE, Nigel E. Chronic impairment of bumblebee natural foraging behaviour induced by sublethal pesticide exposure. Functional Ecology, v. 28, n. 6, p. 1459-1471, 2014.
GOULSON, Dave et al. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science, v. 347, n. 6229, p. 1255957, 2015.
GRAYSTOCK, Peter et al. The T rojan hives: pollinator pathogens, imported and distributed in bumblebee colonies. Journal of Applied Ecology, v. 50, n. 5, p. 1207-1215, 2013.
GREEN, Laura C. et al. Nitrate biosynthesis in man. Proceedings of the National Academy of Sciences, v. 78, n. 12, p. 7764-7768, 1981.
GREGORC, Ales; ELLIS, James D. Cell death localization in situ in laboratory reared honey bee (Apis mellifera L.) larvae treated with pesticides. Pesticide biochemistry and physiology, v. 99, n. 2, p. 200-207, 2011.
HERBERT, Lucila T. et al. Effects of field-realistic doses of glyphosate on honeybee appetitive behaviour. Journal of experimental biology, v. 217, n. 19, p. 3457-3464, 2014.
IKEURA, Hiromi; SAKURA, Akio; TAMAKI, Masahiko. Repellent effect of neem against the cabbage armyworm on leaf vegetables. Journal of Agriculture and Sustainability, v. 4, n. 1, 2013.
ILLA-BOCHACA, Irineu; MONTUENGA, Luis M. The regenerative nidi of the locust midgut as a model to study epithelial cell differentiation from stem cells. Journal of experimental biology, v. 209, n. 11, p. 2215-2223, 2006.
ISMAN, Murray B. Botanical insecticides, deterrents, and repellents in modern agriculture and an increasingly regulated world. Annu. Rev. Entomol., v. 51, p. 45-66, 2006.
ISMAN, Murray B. Botanical insecticides in the twenty-first century—fulfilling their promise?. Annual Review of Entomology, v. 65, p. 233-249, 2020.
JUNQUEIRA, Luiz Carlos Uchoa; JUNQUEIRA, L. M. M. S. Técnicas básicas de citologia e histologia. São Paulo: Santos, v. 8, p. 3, 1983.
KIM, Heesu; LEE, Dong Gun. Nitric oxide–inducing Genistein elicits apoptosis-like death via an intense SOS response in Escherichia coli. Applied Microbiology and Biotechnology, v. 104, p. 10711-10724, 2020.
KLEIN, Alexandra-Maria et al. Importance of pollinators in changing landscapes for world crops. Proceedings of the royal society B: biological sciences, v. 274, n. 1608, p. 303-313, 2007.
KUMAR, Debaditya et al. Oxidative stress and apoptosis in Asian honey bees (A. cerana) exposed to multiple pesticides in intensive agricultural landscape. Apidologie, v. 53, n. 2, p. 25, 2022.
LI, Chun-Qi; WOGAN, Gerald N. Nitric oxide as a modulator of apoptosis. Cancer letters, v. 226, n. 1, p. 1-15, 2005.
LIAO, Ling-Hsiu; WU, Wen-Yen; BERENBAUM, May R. Behavioral responses of honey bees (Apis mellifera) to natural and synthetic xenobiotics in food. Scientific Reports, v. 7, n. 1, p. 15924, 2017.
LOSA, Marco et al. Determination of the proliferation and apoptotic index in adrenocorticotropin-secreting pituitary tumors: comparison between micro-and macroadenomas. The American journal of pathology, v. 156, n. 1, p. 245-251, 2000.
LOWRY, OliverH et al. Protein measurement with the Folin phenol reagent. Journal of biological chemistry, v. 193, n. 1, p. 265-275, 1951.
MARTINEZ, Sueli S.; VAN EMDEN, Helmut F. Growth disruption, abnormalities and mortality of Spodoptera littoralis (Boisduval)(Lepidoptera: Noctuidae) caused by azadirachtin. Neotropical Entomology, v. 30, p. 113-125, 2001.
MAULIK, Nilanjana; YOSHIDA, Tetsuya; DAS, Dipak K. Oxidative stress developed during the reperfusion of ischemic myocardium induces apoptosis. Free Radical Biology and Medicine, v. 24, n. 5, p. 869-875, 1998.
MICHENER, C. D. The Bees of the World Johns Hopkins University Press. Baltimore, Md, USA, 2007.
MILLER, Margaret A.; ZACHARY, James F. Mechanisms and morphology of cellular injury, adaptation, and death. Pathologic basis of veterinary disease, p. 2, 2017.
MULLIN, Christopher A. et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one, v. 5, n. 3, p. e9754, 2010.
NEGREIRO, Maria Cláudia Cordeiro; DE ANDRADE, Fábio Goulart; FALLEIROS, Ângela Maria Ferreira. Sistema imunológico de defesa em insetos: uma abordagem em lagartas da soja, Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae), resistentes ao AgMNPV. Semina: Ciências Agrárias, v. 25, n. 4, p. 299-313, 2004.
OLIVEIRA, Fernanda M. et al. Histological, histochemical and energy disorders caused by R-limonene on Aedes aegypti L. larvae (Diptera: Culicidae). Acta Tropica, v. 221, p. 105987, 2021.
OHKAWA, Hiroshi; OHISHI, Nobuko; YAGI, Kunio. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Analytical biochemistry, v. 95, n. 2, p. 351-358, 1979.
POTTS, Simon G. et al. Global pollinator declines: trends, impacts and drivers. Trends in ecology & evolution, v. 25, n. 6, p. 345-353, 2010.
POTTS, Simon G. et al. The assessment report on pollinators, pollination and food production: summary for policymakers. Secretariat of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services, 2016.
RUIZ-TOLEDO, Jovani; SÁNCHEZ-GUILLÉN, Daniel. Effect of the concentration of glyphosate present in body waters near transgenic soybean fields on the honeybee Apis mellifera, and the stingless bee Tetragonisca angustula. Acta zoológica mexicana, v. 30, n. 2, p. 408-413, 2014.
SABAHI, Qodratollah; KELLY, Paul Gordon; GUZMAN‐NOVOA, Ernesto. Carvone and citral, two promising compounds for controlling the honey bee ectoparasitic mite, Varroa destructor. Journal of Applied Entomology, v. 146, n. 8, p. 1003-1010, 2022.
SEDLAK, Jozef; LINDSAY, Raymond H. Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman’s reagent. Analytical biochemistry, v. 25, p. 192-205, 1968.
SILVA, Cristiane TS et al. Immune and nutritional responses of Podisus nigrispinus (Hemiptera: Pentatomidae) nymphs sprayed with azadirachtin. Austral Entomology, v. 59, n. 1, p. 215-224, 2020.
SOLOMON, Robert W. Free and open source software for the manipulation of digital images. American Journal of Roentgenology, v. 192, n. 6, p. W330-W334, 2009.
SOUZA, Catiane Oliveira et al. Toxicology, histophysiological and nutritional changes in Apis mellifera (Hymenoptera: Apidae) submitted to limonene and natural pesticides in comparison to synthetic pesticides. Journal of Apicultural Research, p. 1-12, 2023.
SUN, Zhipeng et al. Rotenone-induced necrosis in insect cells via the cytoplasmic membrane damage and mitochondrial dysfunction. Pesticide Biochemistry and Physiology, v. 173, p. 104801, 2021.
SCHMID-HEMPEL, Paul. Evolutionary ecology of insect immune defenses. Annu. Rev. Entomol., v. 50, p. 529-551, 2005.
WU, Xing et al. Determination of the apoptotic index in osteosarcoma tissue and its relationship with patients prognosis. Cancer Cell International, v. 13, p. 1-4, 2013.
YU, Lihua; YAN, Jing; SUN, Zhiguang. D-limonene exhibits anti-inflammatory and antioxidant properties in an ulcerative colitis rat model via regulation of iNOS, COX-2, PGE2 and ERK signaling pathways. Molecular medicine reports, v. 15, n. 4, p. 2339-2346, 2017.
ZARRAD, Khaoula et al. Chemical composition and insecticidal effects of Citrus aurantium of essential oil and its powdery formulation against Tuta absoluta. Tunis. J. Plant Prot, v. 12, p. 83-94, 2017.
ZATTARA, Eduardo E.; AIZEN, Marcelo A. Worldwide occurrence records suggest a global decline in bee species richness. One Earth, v. 4, n. 1, p. 114-123, 2021.
ZHAO, Kunyu et al. Effects of sublethal azadirachtin on the immune response and midgut microbiome of Apis cerana cerana (Hymenoptera: Apidae). Ecotoxicology and Environmental Safety, v. 229, p. 113089, 2022.
[1] Máster en Entomología – UFRPE. ORCID: 0009-0009-3350-2334. Currículo Lattes: http://lattes.cnpq.br/3858015372572475.
[2] Doctorado en Tecnología Nuclear – USP. ORCID: 0000-0001-9533-5476. Currículo Lattes: http://lattes.cnpq.br/4292195468804301.
[3] Asesor. Doctor en Química – UFRPE. ORCID: 0000-0001-8508-1230. Currículo Lattes: http://lattes.cnpq.br/5615678215435460.
[4] Máster en Entomología – UFRPE. ORCID: 0000-0002-6223-7113. Currículo Lattes: http://lattes.cnpq.br/5156282820589894.
[5] Doctorado en el Programa de Posgrado en Entomología – UFRPE. ORCID: 0000-0001-6012-1945. Currículo Lattes: http://lattes.cnpq.br/3795270436231657.
[6] Doctorado en Entomología – UFRPE. ORCID: 0000-0002-4270-1476. Currículo Lattes: http://lattes.cnpq.br/8583960034442631.
[7] Doctorado en Química – USP. ORCID: 0000-0002-7597-6775. Currículo Lattes: http://lattes.cnpq.br/6957579091162269.
[8] Doctor en Bioquímica. ORCID: 0000-0002-6041-1720. Currículo Lattes: http://lattes.cnpq.br/4162837199448101.
[9] Doctorado en Producción Animal de la Facultad de Ciencias Agrícolas y Veterinarias, Jaboticabal, UNESP. ORCID: 0000-0002-3488-4778. Currículo Lattes: http://lattes.cnpq.br/3266223126925865.
[10] Doctorado en Bioquímica y Fisiología, Máster en Fisiología, Biólogo. ORCID: 0000-0003-1493-7964. Currículo Lattes: http://lattes.cnpq.br/9044747136928972.
[11] Doctorado en morfología – UNIFESP. ORCID: 0000-0001-5940-9220. Currículo Lattes: http://lattes.cnpq.br/1539131079574469.
Material recibido: 05 de diciembre de 2023.
Material aprobado por pares: 30 de enero de 2024.
Material editado aprobado por los autores: 16 de febrero de 2024.